表1 流化床干燥条件
Table1 Fluid bed drying conditions

不变因素变化因素进料量160 mL、悬浮介质添加量30 g进风温度:45、50、55、60、65 ℃进风温度65 ℃、悬浮介质添加量30 g进料量:140、160、180、200、220 mL进风温度65 ℃、进料量160 mL悬浮介质添加量:18、22、26、30、34 g
胡志和 1,2,赵 勇 1,夏 磊 1,李艳军 1,薛 璐 1,2,孙振刚 3,武文起 3,冯永强 3
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134;3.天津海河乳业有限公司,天津 300402)
摘 要:用不同的干燥方法干燥富含血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽的酪蛋白水解物,研究对ACE活性抑制的影响。在研究过程中,采用喷雾干燥法、流化床干燥法和真空冷冻干燥法干燥富含ACE抑制肽的酪蛋白水解产物,以干燥产物的水分含量低于5%为指标,确定干燥条件,以干燥产物的ACE活性半数抑制浓度(half inhibitory concentration,IC 50)值,优化干燥条件。并通过动物实验,评价不同干燥方法所得产物的降血压效果。结果显示,采用喷雾干燥法干燥水解产物优化条件为:进风温度190 ℃、出风温度75 ℃、进料量44 mL/min,其干燥产物的ACE活性抑制的IC 50值为0.442 mg/mL;流化床干燥水解物的条件为:进风温度65 ℃、进料量180 mL、悬浮介质添加量30 g,其干燥产物ACE活性抑制的IC 50值为0.294 mg/mL;真空冷冻干燥产物的ACE活性抑制的IC 50值为0.275 mg/mL。动物实验结果显示,采用真空冷冻干燥方法所得干燥产物,最有利于ACE抑制肽活性的保留,其次是流化床干燥,而喷雾干燥产物的活性损失最大。因此,在富含ACE抑制肽水解产物干燥时,采用冷冻干燥方法较好。
关键词:酪蛋白水解物;血管紧张素转化酶活性抑制肽;真空冷冻干燥;喷雾干燥;流化床干燥
高血压与心脑血管疾病关系密切 [1]。在全球范围内,高血压平均发病率呈逐年上升趋势,对人类的生命健康构成了巨大威胁 [2]。根据世界卫生组织预测,至2020年,非传染性疾病将占我国死亡原因的79%,其中高血压等心血管疾病将占首位 [3]。目前治疗高血压时以合成药物为主,长期服用可能引起肾脏损伤等毒副作用,还会产生药物依赖或抗药性 [4-5]。因此,在以天然、健康为主题的今天,人们越来越倾向于预防保健和食疗。
目前,研究人员已经从众多的食源性蛋白,如乳蛋白 [6-13]、水产类蛋白 [14-16]、植物蛋白 [17-19]等蛋白的酶解物中分离出具有抗高血压的蛋白肽——血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽,其中,从牛乳酪蛋白中分离的ACE抑制肽就有近30种 [20]。然而,对于采用何种干燥方法,才能够更好地保留水解产物中ACE抑制肽活性的研究相对较少。
水解产物干燥常采用的方法包括真空冷冻干燥法、喷雾干燥法和流化床干燥法。真空冷冻干燥法可以维持原有的生物活性状态 [21],便于研究产物的特性及相关功能产品的开发 [22],但缺点是耗能较大、生产成本较高 [23-25]。喷雾干燥特点是干燥速度迅速,可以在操作过程中更改条件参数,使产品符合质量要求,符合大规模生产的要求 [26-27],但是过高的进风温度可能会对一些热敏感的物质有影响 [28-29]。流化床干燥法是一种新兴的干燥方法,特点是容器内部温度呈均匀分布状态,比较适合对温度敏感的并具有活性功能的产品进行干燥,所得产物的水分含量较为稳定,可以进行连续干燥操作 [30],但干燥过程需要有固体悬浮物。
本研究以牛乳酪蛋白为原料,经胃蛋白酶和胰蛋白酶水解,制备富含ACE抑制肽的水解产物,分别采用真空冷冻干燥、喷雾干燥和流化床干燥,确定干燥条件,检测干燥产物ACE抑制肽活性,为ACE抑制肽水解物干燥方法的选择提供参考。
1.1 材料与试剂
SPF级原发性高血压大鼠(spontaneously hypertensive rat,SHR) 北京维通利华实验动物技术有限公司;SPF级Wistar大鼠 中国人民解放军军事医学科学院实验动物中心。
酪蛋白(含量≥80%) 新西兰Tatua公司;胃蛋白酶(10 000 U/g)、胰蛋白(10 000 U/g)、马尿酰-组氨酰-亮氨酸、兔肺ACE 美国Sigma公司;风味蛋白酶(15 000 U/g) 丹麦诺维信公司;001×7强酸性苯乙烯系阳离子交换树脂、201×7强碱性苯乙烯系阴离子交换树脂 南开大学化工厂;硼酸、硼砂、乙酸乙酯(均为分析纯) 天津市赢达稀贵化学试剂厂;氢氧化钠、盐酸(均为分析纯) 天津市化学试剂批发公司。
1.2 仪器与设备
FA1104N电子天平 上海精密科学仪器有限公司;FE20型实验室pH计 梅特勒-托利多仪器(上海)有限公司;L535-1低速离心机 长沙湘仪离心机仪器有限公司;3-18K型高速冷冻离心机 美国Sigma公司;FD8-4T冷冻干燥机 美国GOLD-SIM公司;NF膜试验机系统 海得科膜分离技术(北京)有限公司;6 000 u中空纤维膜组件 天津膜天膜工程技术有限公司;TU-1810DPC型紫外-可见分光光度计 北京普析通用仪器有限责任公司;BT01-100型兰格恒流泵 保定兰格恒流泵有限公司;BP-2006A型智能无创血压计 北京软隆科技有限责任公司;YC-015实验型喷雾干燥机 上海雅程仪器设备有限公司;WBF-1G多功能流化床 重庆英格造粒包衣技术有限公司。
1.3 方法
1.3.1 富含ACE抑制肽的酪蛋白水解液的制备 [31-33]
将7%的酪蛋白溶液依次用胃蛋白酶(pH 3.0、37 ℃)、胰蛋白酶(pH 7.7、48 ℃)、风味蛋白酶(pH 6.8、50 ℃)分别水解3 h,期间每次水解后煮沸灭酶10 min。将最终得到的水解液离心,取上清液脱盐和浓缩,获得含固形物为10%的水解液。
1.3.2 酪蛋白水解物对ACE活性的半数抑制浓度(half inhibitory concentration,IC 50)
采用分光光度法进行体外检测ACE抑制率。按照文献[34-35],将样品用硼酸盐缓冲溶液配制成不同质量浓度(0.1、0.2、0.4、0.8、1.0 mg/mL)的溶液,测定各个溶液对ACE的抑制率,并绘制ACE抑制率曲线,计算IC 50值。
1.3.3 喷雾干燥
选择雾化喷嘴口径1 mm,风机的转动频率设定为70 Hz,通针设定为5 s启动一次。水分含量检测参照GB 5009.3—2010《食品中水分的测定》 [36]。
1.3.3.1 出风温度选择
在进风温度190 ℃、进料量52 mL/min条件下,分别选取出风温度70、75、80、85、90 ℃进行喷雾干燥。
1.3.3.2 进风温度选择
在出风温度75 ℃、进料量52 mL/min条件下,分别选取进风温度160、170、180、190、200 ℃进行喷雾干燥。
1.3.3.3 进料量选择
在进风温度190 ℃、出风温度75 ℃条件下,分别选取进料量44、48、52、56、60 mL/min进行喷雾干燥。
1.3.4 流化床干燥
引风机工作风量控制方式为闭环控制,风量为90 m 3/h,脉冲喷吹时间为1 s,脉冲喷吹间隔时间为0.1 s,压缩空气压力为0.5 MPa,雾化压力为0.45 MPa,蠕动泵转速为3.5 r/min。水分含量检测参照GB 5009.3—2010。
实验中,第一次流化悬浮介质为乳清蛋白粉。在整个干燥过程中,由喷嘴喷入的酪蛋白水解物与乳清蛋白粉结合,形成第一次干燥产物;以第一次干燥产物作为第二次干燥的悬浮介质;以第二次干燥物作为第三次干燥的悬浮介质,依此类推,逐渐用水解物置换乳清粉,最终使得干燥产物中的酪蛋白水解物质量占干燥产物质量的95%以上。流化床干燥条件设计见表1。
表1 流化床干燥条件
Table1 Fluid bed drying conditions

不变因素变化因素进料量160 mL、悬浮介质添加量30 g进风温度:45、50、55、60、65 ℃进风温度65 ℃、悬浮介质添加量30 g进料量:140、160、180、200、220 mL进风温度65 ℃、进料量160 mL悬浮介质添加量:18、22、26、30、34 g
1.3.5 冷冻干燥
采用FD8-4T冷冻干燥机进行干燥,冷冻温度-80 ℃、真空泵抽速162 L/min、极限真空2.67×10 -2Pa、冻干效率3 L/24 h、水解液冻结厚度10 mm。
1.3.6 动物实验
取40 只10 周龄的雄性SHR,体质量(190±10) g,自由采食、饮水,维持环境温度(20±1)℃,相对湿度(45±5)%,预饲养1 周。将大鼠随机分为4 组,每组10 只,分别作为空白组(生理盐水,10 mL/kg)、低剂量组(10 mg/kg)、中剂量组(30 mg/kg)和高剂量组(90 mg/kg),灌胃不同干燥方式的水解产物。检测灌胃后1~8 h内血压的变化。
另取正常Wistar大鼠16 只,随机分为2 组,每组8 只,分别作为空白组和正常实验组,分别灌胃生理盐水10 mL/kg和高剂量组的水解产物,检测其血压的变化。
每只大鼠连续测定3 次,对测定的SHR及Wistar正常大鼠的收缩压进行读数,取平均值。
1.4 数据统计分析
运用SPSS 16.0软件进行结果分析,结果采用
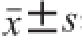 表示。当P<0.05时,表示有显著差异。
表示。当P<0.05时,表示有显著差异。
2.1 不同条件下喷雾干燥产物的水分含量及对ACE的IC 50值
2.1.1 干燥产物的水分含量
2.1.1.1 出风温度对水分含量的影响
在进风温度190 ℃、蠕动泵进料量52 mL/min条件下,选取出风温度分别为70、75、80、85、90 ℃进行喷雾干燥,产物水分含量见图1。在不同出风温度条件下,所得产物的水分含量在出风温度≥75 ℃,产物的水分含量分别为(4.26±0.07)%、(4.24±0.13)%、(4.2±0.16)%和(4.2±0.05)%,水分含量均小于5%,符合产物干燥工艺的结果要求。由此可知,当出风温度≥75℃时,干燥产物的水分含量无显著变化。因此,选取出风温度75 ℃进行后续实验。

图1 出风温度对喷雾干燥产物水分含量的影响
Fig.1 Effect of air outlet temperature on moisture content after spray drying
小写字母不同表示差异显著(P<0.05)。下同。
2.1.1.2 进风温度对水分含量的影响

图2 进风温度对喷雾干燥产物水分含量的影响
Fig.2 Effect of air inlet temperature on moisture content after spray drying
在出风温度75 ℃、蠕动泵转速52 mL/min条件下,选取进风温度分别为160、170、180、190、200 ℃进行喷雾干燥,产物水分含量见图2。在出风温度、进料流速相同时,喷雾干燥样品的水分含量随着进风温度的升高而降低,并且进风温度的变化对产物的水分含量有较大影响。在所选进风温度190、200 ℃条件下,水分含量分别为(4.26±0.07)%和(4.25±0.25)%。所得干燥产物的水分含量小于5%,符合产物干燥工艺的结果要求。因此,选取进风温度190 ℃进行后续实验。
2.1.1.3 进料量对水分含量的影响
在进风温度190℃、出风温度75℃条件下,选取蠕动泵流量分别为44、48、52、56、60 mL/min进行喷雾干燥。产物水分含量见图3。在进风温度、出风温度相同时,喷雾干燥样品的水分含量随着进料量的升高而升高,因此,进料量的变化对产物的水分含量有较大影响。进料量为44、48、52、56 mL/min时,干燥产物的水分含量分别为(3.851±0.037)%、(4.191±0.197)%、(4.257±0.068)%和(4.865±0.050)%,产物水分含量小于5%,符合产物干燥工艺的结果要求。

图3 进料量对喷雾干燥产物水分含量的影响
Fig.3 Effect of feeding rate on moisture content after spray drying
2.1.2 喷雾干燥产物ACE活性的IC 50值
用分光光度法检测水分含量在5%以下的喷雾干燥样品对ACE的IC 50值,在检测过程中,按照各条件下干燥产物的水分含量,计算绝干产物(在105~120 ℃条件下烘干至恒质量的产物)的含量,然后,按照不同质量浓度(0.1、0.2、0.4、0.8、1.0 mg/mL)检测对ACE的抑制率,计算对ACE的IC 50值,结果见表2。在喷雾干燥过程中,当进料量和出风温度相同时,随着进风温度的提高,水解干燥产物对ACE的IC 50值增大,其产物的活性降低。当进风温度和出风温度相同时,单位时间内进料量越大,且IC 50值也随之增大。由表2可知,采用喷雾干燥法干燥水解产物条件为:进风温度190 ℃、出风温度75 ℃、进料量44 mL/min。该条件下干燥产物的水分含量为(3.851±0.037)%,对ACE的IC 50值为0.442 mg/mL。
表2 喷雾干燥水解产物对ACE的IC
50值
Table2 IICC
5500for ACE inhibition of casein hydrolysate dried by spray drying
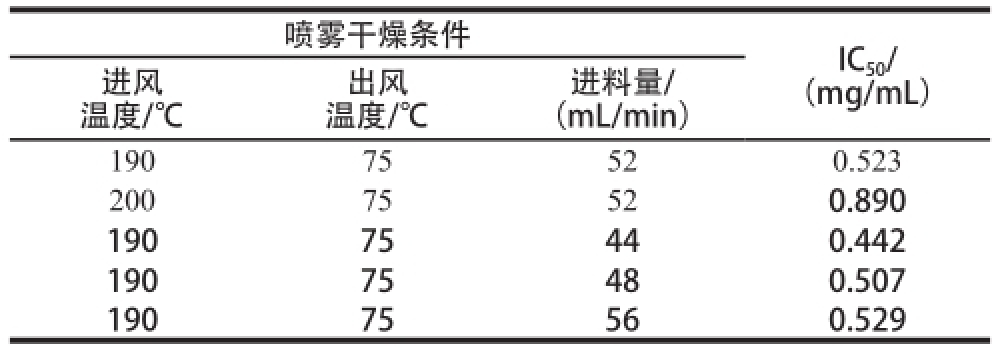
进风温度/℃进料量/(mL/min)19075520.523 20075520.890 19075440.442 19075480.507 19075560.529喷雾干燥条件IC 50/(mg/mL)出风温度/℃
2.2 不同条件下流化床干燥产物水分含量及对ACE的IC 50值
2.2.1 不同条件下流化床干燥产物水分含量变化
实验过程中,引风机工作风量控制方式为闭环控制,风量设定为90 m 3/h,脉冲喷吹时间为1 s,脉冲喷吹间隔时间为0.1 s,压缩空气压力为0.5 MPa,雾化压力为0.45 MPa,蠕动泵转速为3.5 r/min。
2.2.1.1 进风温度对水分含量的影响
在进料量160 mL、悬浮介质添加量30 g条件下,选取进风温度分别为45、50、55、60、65℃进行流化床干燥,产物水分含量结果如图4。在介质添加量、进料量等干燥条件相同时,流化床干燥样品的水分含量随着进风温度的升高而降低。在实验的进风温度为55、60、65 ℃条件下干燥后,水分含量分别为:(4.61±0.11)%、(4.53±0.09)%和(4.48±0.23)%,产物的水分含量均小于5%。3个温度条件下水分含量无显著差异,但在65 ℃条件下水分含量最低。因此,选取进风温度65 ℃进行后续实验。
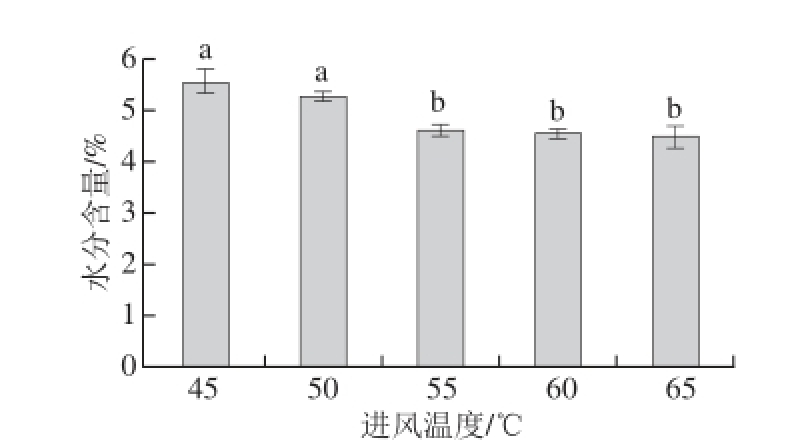
图4 进风温度对流化床干燥产物水分含量的影响
Fig.4 Effect of air inlet temperature on moisture content after fluid bed drying
2.2.1.2 进料量对水分含量的影响

图5 进料量对流化床干燥产物水分含量的影响
Fig.5 Effect of loading amount on moisture content after fluid bed drying
在进风温度65 ℃、介质添加量30 g条件下,选取进料量分别为140、160、180、200、220 mL进行流化床干燥,产物水分含量结果见图5。在进风温度、介质添加量等其他流化床干燥条件相同时,进料量160~220 mL所得样品的水分含量随着进料量的增加而升高。在实验的进料量条件下,所得产物的水分含量小于5%的条件为140、160、180和200 mL。当进料量增加到220 mL时,产物的水分含量增加较大,因此,选取进料量160 mL进行后续实验。
2.2.1.3 介质乳清蛋白粉的添加量对水分含量的影响
在进风温度65 ℃、进料量160 mL条件下,选取悬浮介质添加量分别为18、22、26、30、34 g进行流化床干燥,产物水分含量见图6。在进风温度、进料量等其他流化床干燥条件相同时,干燥样品的水分含量随着悬浮介质添加量的增加而降低,在添加量大于26 g时,产物水分含量没有显著变化。在实验的添加量范围内,所得干燥产物的水分含量在5%以下的条件为26、30、34 g。
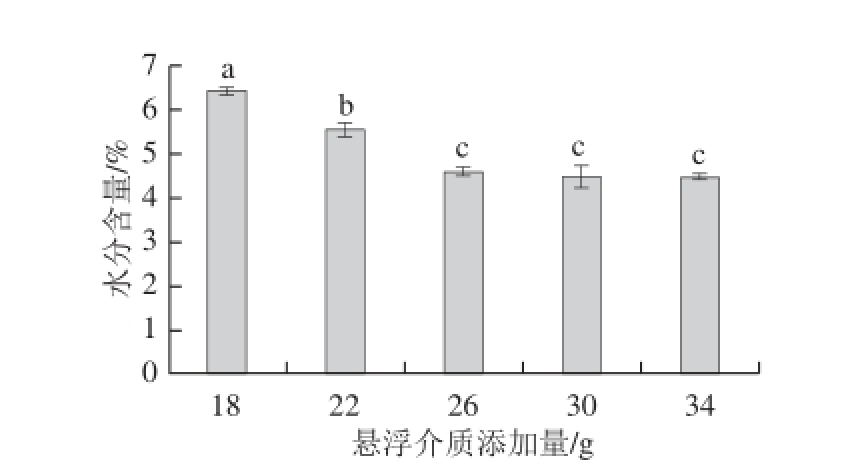
图6 悬浮介质的添加量对流化床干燥产物水分含量的影响
Fig.6 Effect of suspending medium amount on moisture content after fluid bed drying
2.2.2 不同干燥条件下乳清蛋白置换次数
根据2.2.1节的实验结果,共有8个干燥条件的干燥产物的水分含量小于5%,各条件下的置换次数见表3。通过乳清蛋白的置换,使酪蛋白水解物的含量大于95%,便于后期研究干燥产物对ACE抑制效果的比较。由于流化床干燥条件(进料量、悬浮介质添加量、进风温度)的不同,在干燥过程中,使干燥产物中酪蛋白水解物含量达到95%以上所需要的置换次数不同。当悬浮介质添加量(30 g)相同时,进料量(140、160、180和200 mL)越大,置换次数越小;当进料量(160 mL)相同时,悬浮介质添加量(26、30、34 g)越大,置换次数越多。因此,在流化床干燥过程中,选择合适的干燥条件能够减少置换次数,从而降低生产的成本。另外,对于活性产物的干燥,在条件选择时还要考虑产物的活性。
表3 不同干燥条件下乳清粉的置换次数
Table3 Number of casein hydrolysate replacement with whey powder under different conditions during fluid bed drying
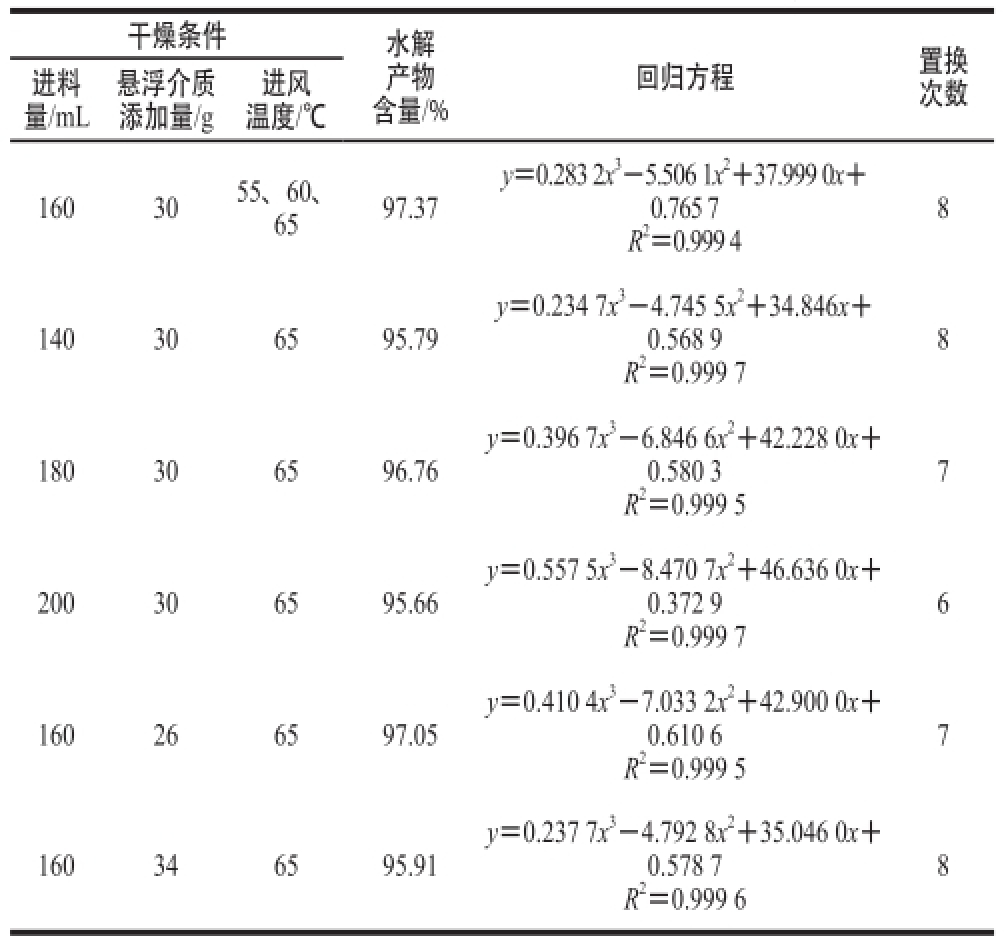
进料量/mL悬浮介质添加量/g干燥条件水解产物含量/%进风温度/℃回归方程置换次数1603055、60、6597.37 y=0.283 2x 3-5.506 1x 2+37.999 0x+ 0.765 7 R 2=0.999 4 8 140306595.79 y=0.234 7x 3-4.745 5x 2+34.846x+ 0.568 9 R 2=0.999 7 8 180306596.76 y=0.396 7x 3-6.846 6x 2+42.228 0x+ 0.580 3 R 2=0.999 5 7 200306595.66 y=0.557 5x 3-8.470 7x 2+46.636 0x+ 0.372 9 R 2=0.999 7 6 160266597.05 y=0.410 4x 3-7.033 2x 2+42.900 0x+ 0.610 6 R 2=0.999 5 7 160346595.91 y=0.237 7x 3-4.792 8x 2+35.046 0x+ 0.578 7 R 2=0.999 6 8
2.2.3 流化床干燥产物对ACE的IC 50值
将2.2.2节所制备的水解物干燥产物,按照水分含量,以绝干的水解物进行计算称量,按照水解产物质量浓度0.1、0.2、0.4、0.8、1.0 mg/mL的梯度,用分光光度法检测流化床干燥产物溶液对ACE的IC 50值,结果见表4。在流化床干燥过程中,当进料量和悬浮介质相同时,在所选的进风温度(55、60、65 ℃)范围内,随温度升高, IC 50值随之减小。当进风温度和悬浮介质量相同,在所选进料量(140、160、180、200 mL)范围内,进料量为180 mL时IC 50值最低,为0.294 mg/mL;其次为进料量160 mL时,IC 50值为0.303 mg/mL。因此,适当的进料量与悬浮介质的比例,更有利于活性的保留。另外,进风温度和进料量相同,悬浮介质用量(26、30、34 g)越多,导致干燥置换次数增大,干燥产物对ACE的 IC 50值越大。综合各种条件下干燥产物对ACE的IC 50值,选择干燥条件为:进风温度65 ℃、进料量180 mL、悬浮介质添加量30 g。该条件下,干燥产物的水分含量为(4.491±0.128)%,对ACE的IC 50值为0.294 mg/mL。
表4 流化床干燥水解产物的ACE活性抑制的IC
50值
Table4 IICC
5500for ACE inhibition of casein hydrolysate dried by fluid bed drying
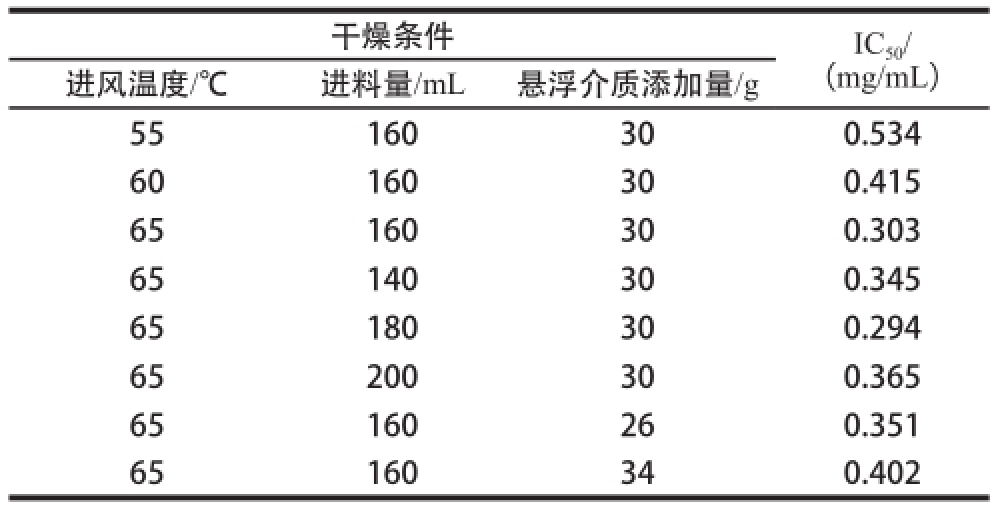
干燥条件IC 50/(mg/mL)进风温度/℃进料量/mL悬浮介质添加量/g 55160300.534 60160300.415 65160300.303 65140300.345 65180300.294 65200300.365 65160260.351 65160340.402
2.3 真空冷冻干燥产物的水分含量及对ACE的IC 50值
水解产物采用FD8-4T冷冻干燥机进行干燥。经过32 h的干燥,其水分为1.68%,对ACE的IC 50值为0.275 mg/mL。
2.4 不同水解物体内降血压实验
将喷雾干燥法(在进风温度190 ℃、出风温度75 ℃、进料量44 mL/min条件下)、流化床干燥法(在进风温度65 ℃、进料量180 mL、悬浮介质添加量30 g条件下)和真空冷冻干燥法的干燥产物,按照水解产物的绝干物质含量计算,分别以低剂量组(10 mg/kg)、中剂量组(30 mg/kg)和高剂量组(90 mg/kg)灌胃SHR,检测灌胃后1~8 h内血压的变化,结果见图7~8。同时,用各产物的高剂量组灌胃正常血压的Wistar大鼠,检测其血压变化。由图7可知,在相同剂量灌胃SHR时,冷冻干燥产物的低、中、高剂量组在灌胃4 h时达到较好降压效果,SHR血压分别下降16.83、27.54和35.33 mmHg;喷雾干燥产物在灌胃3 h时达到较好降压效果,低、中、高剂量组分别下降9.50、18.08和19.96 mmHg;流化床干燥产物在灌胃3 h达到较好降压效果,低、中、高剂量组分别下降11.79、25.67、29.21 mmHg。因此,降压效果最好的是冷冻干燥法的干燥产物,其次是流化床干燥产物。喷雾干燥产物对ACE活性的抑制作用有较大的影响。另外,3 种干燥产物对Wistar大鼠血压无影响。
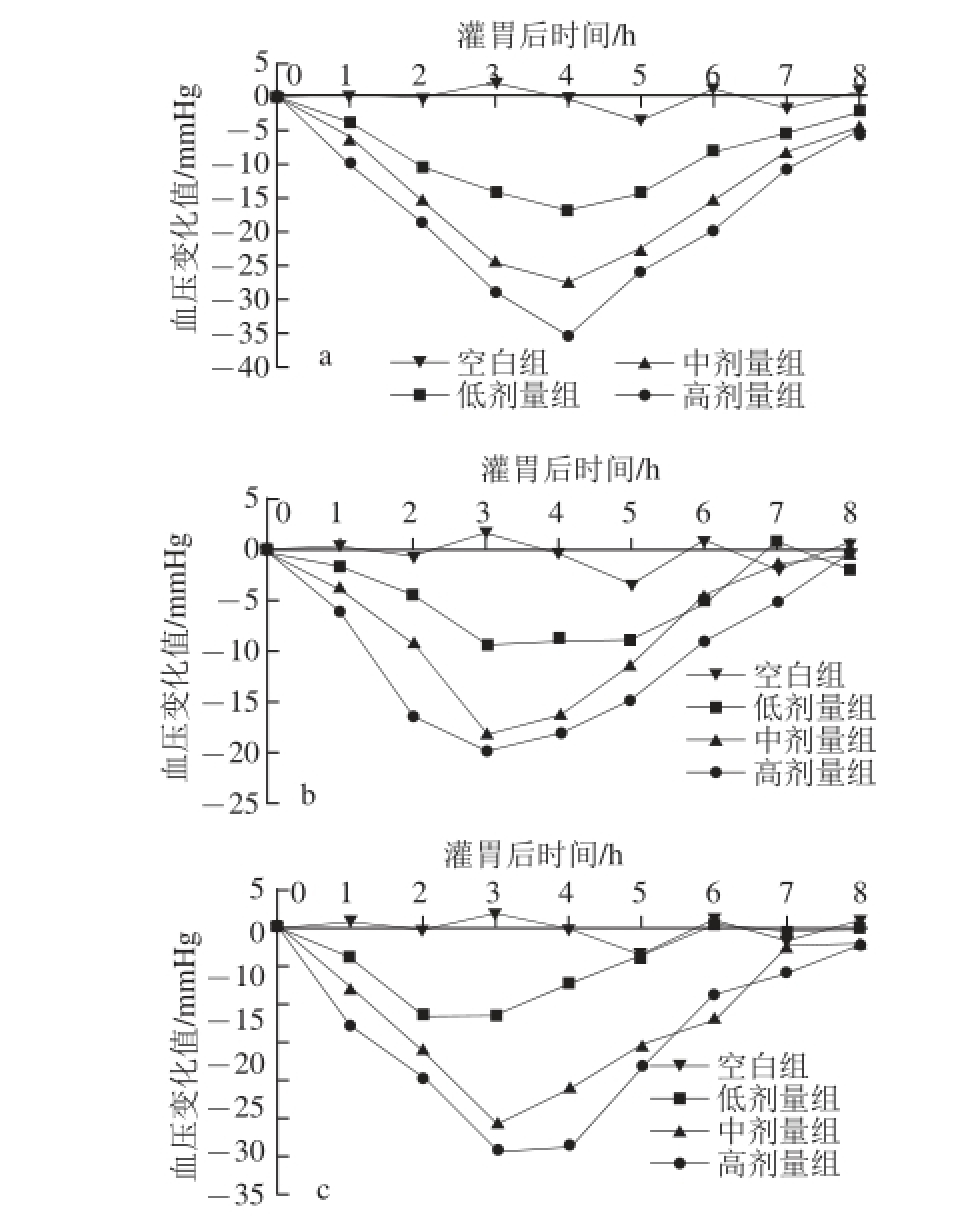
图7 不同干燥方法产物对SHR大鼠血压的影响
Fig.7 Effect of three different dried products on blood pressure of SHR
a~c分别为真空冷冻干燥法、喷雾干燥法和流化床干燥法。
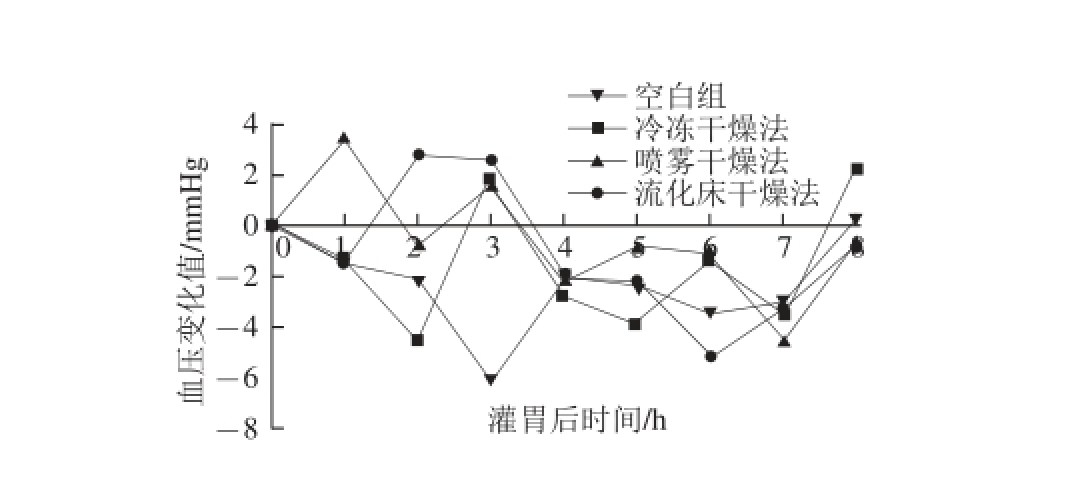
图8 不同干燥方法产物对Wistar大鼠血压的影响
Fig.8 Effect of three different dried products on blood pressure of Wistar rats
在喷雾干燥过程中,进风温度、出风温度和进料速度等因素都会影响干燥产物的水分含量。在本研究的实验条件范围内,当进料速度和出风温度一定时,随着进风温度的升高,干燥产物的水分随之降低;当进风和出风温度一定时,随着进料速度的降低,干燥产物的水分含量越低。其干燥过程的水分含量变化规律与刘贺 [37]和张煜 [38]等的研究结果一致,但在干燥产物的活性方面却有较大差异。张煜的结果显示,进风温度在160、170、180 ℃条件下,干燥的乳酸菌存活量并不受到进风温度的影响;而本研究的干燥产物在190、200℃条件下,其对ACE的IC 50值相差较大。其原因可能是干燥物料的不同或温度条件的不同。另外,本研究发现,当进风温度和出风温度一定,随着进料速率的提高,其干燥产物的活性降低,其原因可能是由于进料速率加快,使得干燥空间水蒸气的存量加大,热量增大,从而导致产物活性降低,但具体原因还需要进一步研究。
此外,对喷雾干燥产物与冷冻干燥产物的活性比较,本研究发现,干燥产物的活性,无论是体外检测还是体内检测,均有较大差异。而姜瞻梅等 [39]研究显示,喷雾干燥法与真空冷冻干燥法相比酪蛋白水解物对ACE抑制作用影响不显著。这可能与所用喷雾干燥设备及条件有关,但文献并没有说明喷雾干燥的设备型号及参数。因此,该差异的原因还需要研究。
本研究在流化床干燥的研究中显示,进风温度、悬浮介质和干燥物料的量等因素对干燥物料的水分含量均有影响。其中,干燥产物的水分含量随着进料量的增加而增加,随着进风温度升高和悬浮介质添加量的增加而降低。其水分变化规律与和进娜 [40]用流化床干燥酵母醪液基本相同。但在干燥产物的活性体外检测时发现,在进料量160 mL、悬浮介质添加量30 g条件下,随着进风温度的升高(55、60、65 ℃),其干燥产物对ACE的IC 50值是降低的,说明产物的活性增强,其原因还需要进一步研究。另外,当进风温度和悬浮介质添加量相同,在所选的进料量(140、160、180、200 mL)条件下,当进料量为180 mL时,其干燥产物活性的体外检测结果最高,这表明,在干燥过程中,干燥物料与悬浮介质的量的比例可能会影响干燥产物的活性,但具体原因还有待进一步研究。
另外,将3 种干燥方法所获得的干燥产物对ACE抑制作用进行体外和体内检测发现,真空冷冻干燥法的产物活性最好,其次是流化床干燥。这可能是真空冷冻干燥能够更好地保持活性成分的结构;而流化床干燥与喷雾干燥相比,其进风温度(65 ℃)较低,其活性保持相对较好。可见,在干燥富含ACE活性抑制肽的酪蛋白水解物时,采用真空冷冻干燥法,有利于产物活性的保留,其次时流化床干燥,而喷雾干燥法的产物,活性损失最大。
参考文献:
[1] 陈绍行, 沈卫峰. 高血压治疗现况[J]. 国际心血管病杂志, 2006,33(2): 67-69. DOI:10.3969/j.issn.1673-6583.2006.02.001.
[2] 揭红波. 浅谈心血管疾病的发病机理与预防[J]. 中外医疗, 2011,30(12): 184. DOI:10.3969/j.issn.1674-0742.2011.12.151.
[3] 蒋菁莉, 任发政. 食源性降血压肽的评价方法[J]. 中国乳品工业,2006, 34(6): 36-39. DOI:10.3969/j.issn.1001-2230.2006.06.009.
[4] SUH H J, WHANG J H, KIM Y S, et al. Preparation of angiotensin I converting enzyme inhibitor from corn gluten[J]. Process Biochemistry,2003, 38(3): 1239-1244. DOI:10.1016/S0032-9592(02)00316-3.
[5] 任锦, 曹刚, 张瑞洁, 等. ACE抑制肽的合成及其活性研究[J]. 药学学报, 2011, 46(1): 58-63. DOI:10.16438/j.0513-4870.2011.01.008.
[6] del MAR CONTRERAS M, CARRÓN R, MONTERO M J, et al. Novel casein-derived peptides with antihypertensive activity[J]. International Dairy Journal, 2009, 19(10): 566-573. DOI:10.1016/ j.idairyj.2009.05.004.
[7] NORRIS R, POYARKOV A, O’KEEFFE M B, et al. Characterisation of the hydrolytic specificity of Aspergillus niger derived prolyl endoproteinase on bovine β-casein and determination of ACE inhibitory activity[J]. Food Chemistry, 2014, 156(1): 29-36. DOI:10.1016/j.foodchem.2014.01.056.
[8] NORRIS R, O’KEEFFE M B, POYARKOV A, et al. Peptide identification and angiotensin converting enzyme (ACE) inhibitory activity in prolyl endoproteinase digests of bovine α s-casein[J]. Food Chemistry, 2015, 188(1): 210-217. DOI:10.1016/j.foodchem.2015.130.
[9] MARUYAMA S, SUZUKI H. A peptide inhibitor of angiotensin iconverting enzyme in the tryptic hydrolysate of casein[J]. Agricultural and Biological Chemistry, 1982, 46(5): 1393-1394.
[10] KOHMURA M, NIO N, ARIYOSHI Y. Inhibition of angiotensinconverting enzyme by synthetic peptides of human κ-casein[J]. Agricultural and Biological Chemistry, 1990, 54: 825-836.
[11] YAMAMOTO N. Antihypertensive peptides derived from food proteins[J]. Peptide Science, 1997, 43(2): 129-134. DOI:10.1002/(SICI)1097-0282(1997)43:2<129::AID-BIP5>3.0.CO;2-X.
[12] FERREIRA I M P L V O, PINHO O, MOTA M V, et al. Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates[J]. International Dairy Journal, 2007,17(5): 481-487. DOI:10.1016/j.idairyj.2006.06.023.
[13] da COSTA E L, da GONTIJO J A, NETTO F M. Effect of heat and enzymatic treatment on the antihypertensive activity of whey protein hydrolysates[J]. International Dairy Journal, 2007, 17(6): 632-640. DOI:10.1016/j.idairyj.2006.09.003.
[14] BALTI R, BOUGATEF A, SILA A, et al. Nine novel angiotensin I-converting enzyme (ACE) inhibitory peptides from cuttlefish(Sepia officinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chemistry, 2015, 170(1): 519-525. DOI:10.1016/ j.foodchem.2013.03.091.
[15] KLEEKAYAI T, HARNEDY P A, O’KEEFFE M B, et al. Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J]. Food Chemistry, 2015, 176(1): 441-447. DOI:10.1016/j.foodchem.2014.12.026.
[16] TOOPCHAM T, ROYTRAKUL S, YONGSAWATDIGUL J. Characterization and identifi cation of angiotensin I-converting enzyme(ACE) inhibitory peptides derived from tilapia using Virgibacillus halodenitrifi cans SK1-3-7 proteinases[J]. Journal of Functional Foods. 2015, 14(4): 435-444.
[17] 江利华, 王璋, 许时婴, 等. 花生ACE抑制肽的分离纯化、结构鉴定及体内降血压功能研究[J]. 食品工业科技, 2009, 30(10): 94-100. DOI:10.13386/j.issn1002-0306.2009.10.010.
[18] WU Jianping, DING Xiaolin. Hypotensive and physiological effect of angiotensin converting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensive rats[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1): 501-506. DOI:10.1021/jf000695n.
[19] WU Jianping, DING Xiaolin. Characterization of inhibition and stability of soy-protein-derived angiotension I-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35(4): 367-375. DOI:10.1016/S0963-9969(01)00131-4.
[20] 胡志和, 夏磊, 孙振刚, 等. 酪蛋白水解物中ACE抑制肽分离及氨基酸序列分析[J]. 食品科学, 2015, 36(24): 156-163. DOI:10.7506/ spkx1002-6630-201524028.
[21] 史伟勤. 食品真空冷冻干燥国内外最新进展[J]. 通用机械, 2004(12): 10-11. DOI:10.3969/j.issn.1671-7139.2004.12.003.
[22] 于亚云, 段姚尧, 崔颖. 蛋白类药物冷冻干燥技术的研究进展[J]. 武警医学院学报, 2010, 19(1): 78-80.
[23] EVANS J A. Frozen Food Science and Technology[M]. 北京: 中国轻工业出版社, 2010: 213-214.
[24] 任广跃, 李晖, 段续, 等. 常压冷冻干燥技术在食品中的应用研究[J]. 食品研究与开发, 2013, 34(18): 119-122. DOI:10.3969/j.issn.1005-6521.2013.18.030.
[25] 周礽, 李臻峰, 李静, 等. 真空冷冻干燥技术的研究进展[J]. 黑龙江科技信息, 2014(30): 76-77. DOI:10.3969/ j.issn.1673-1328.2014.30.074.
[26] 杨浩, 蔡源源, 唐敏, 等. 喷雾干燥技术及其应用[J]. 河南大学学报(医学版), 2013, 32(1): 71-74.
[27] 金国淼. 干燥设备[M]. 北京: 化学工业出版社, 2002: 155-164.
[28] 李静. 喷雾干燥技术在中药制药中使用研究进展[J]. 生物技术世界,2013(7): 113.
[29] 张裕中. 食品加工技术设备[M]. 北京: 化学工业出版社, 2007: 306-324.
[30] 郭良然, 孙佩男, 潘卫三. 流化床制粒特点及影响因素[J]. 中国药剂学杂志, 2005, 3(6): 347-351.
[31] 赵勇, 胡志和, 孙振刚, 等. RP-HPLC法测定酪蛋白水解物中ACE抑制肽的含量[J]. 食品工业科技, 2015, 36(10): 54-58. DOI:10.13386/ j.issn1002-0306.2015.10.002.
[32] 张艳. 乳酪蛋白组分分离及水解物ACE抑制活性的研究[D]. 天津:天津商业大学, 2010: 17-69.
[33] 王佳佳, 胡志和, 蒋毅. 富含ACE抑制肽的酪蛋白水解物及其功能性酸奶对SHR血压的影响[J]. 食品工业科技, 2013, 34(10): 345-356. DOI:10.13386/j.issn1002-0306.2013.10.075.
[34] MIGUEL M, CONTETAS M M, RECIO I, et al. ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry, 2009, 112(1): 211-214. DOI:10.1016/ j.foodchem.2008.05.041.
[35] 赵骏, 宫霞, 郭本恒. 乳酪蛋白源A C E抑制肽的分离纯化[J]. 中国乳品工业, 2006, 34(6): 8-11. DOI:10.3969/ j.issn.1001-2230.2006.06.002.
[36] 卫生部. GB 5009.3—2010 食品中水分的测定[S]. 北京: 中国标准出版社, 2010: 1-2.
[37] 刘贺, 王雪, 李君, 等. 扁杏仁水解蛋白的喷雾干燥及其抗氧化活性[J].食品科学, 2012, 33(16): 18-23.
[38] 张煜, 孙波, 接伟光. 活性乳酸菌豆粉喷雾干燥工艺的优化[J].食品工业科技, 2012, 33(10): 260-263. DOI:10.13386/ j.issn1002-0306.2012.10.082.
[39] 姜瞻梅, 迟涛, 吴刚, 等. 酪蛋白源ACE抑制肽干燥工艺的探讨[J]. 中国乳品工业, 2007, 35(7): 23-24. DOI:10.3969/ j.issn.1001-2230.2007.07.007.
[40] 和进娜. 利用酵母醪液生产饲料的研究[D]. 天津: 天津科技大学,2008: 12-46.
Effect of Different Drying Methods on Angiotensin Converting Enzyme Inhibitory Activity of Peptides from Bovine Casein Hydrolysate
HU Zhihe
1,2, ZHAO Yong
1, XIA Lei
1, LI Yanjun
1, XUE Lu
1,2, SUN Zhengang
3, WU Wenqi
3, FENG Yongqiang
3
(1. College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Tianjin Key Laboratory of Food and Biotechnology, Tianjin 300134, China; 3. Tianjin Haihe Dairy Co. Ltd., Tianjin 300402, China)
Abstract:The objective of this paper was to explore the effect of different drying methods i.e., spray drying, fluid bed drying and vacuum freeze drying on the angiotensin converting enzyme (ACE) inhibitory activity of peptides from bovine casein hydrolysate. The operating parameters were optimized to obtain both a moisture content lower than 5% and reduced half inhibitory concentration (IC 50) for ACE inhibition of dried product. The antihypertensive effi ciency of the dried products obtained by different drying methods was evaluated by animal tests. The results showed that the spray drying conditions were optimized as 190 ℃, 75 ℃ and 44 mL/min for air inlet and air outlet temperatures and feeding rate, respectively. The IC 50for ACE inhibition of the dried product obtained under these conditions was 0.442 mg/mL. The optimal fl uid bed drying conditions were established as 65 ℃, 180 mL and 30 g for air inlet temperature, loading amount and suspending medium amount, respectively, which gave a dried product with an IC 50of 0.294 mg/mL for ACE inhibition. The IC 50for ACE inhibition of the dried product obtained by vacuum freeze drying was 0.275 mg/mL. The results of animal tests showed that upon oral administration of the three different dried products at the same dose, the anti-hypertension activity of dried product was best maintained by by vacuum freeze drying, followed by fl uid bed drying, and spray drying caused the maximum loss of anti-hypertension activity. Therefore, vacuum freeze drying is a better drying method for casein hydrolysate rich in ACE inhibitory peptides.
Key words:casein hydrolysate; angiotensin converting enzyme (ACE) activity inhibitory peptides; vacuum freeze drying;spray drying; fl uid bed drying
DOI:10.7506/spkx1002-6630-201619034
中图分类号:TS252.42
文献标志码:A
文章编号:1002-6630(2016)19-0204-07
引文格式:
胡志和, 赵勇, 夏磊, 等. 不同干燥方法对乳源血管紧张素转化酶抑制肽活性的影响[J]. 食品科学, 2016, 37(19):204-210. DOI:10.7506/spkx1002-6630-201619034. http://www.spkx.net.cn
HU Zhihe, ZHAO Yong, XIA Lei, et al. Effect of different drying methods on angiotensin converting enzyme inhibitory activity of peptides from bovine casein hydrolysate[J]. Food Science, 2016, 37(19): 204-210. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619034. http://www.spkx.net.cn
收稿日期:2016-05-04
基金项目:天津市科技支撑项目(14ZCZDNC00017);天津市高等学校创新团队项目(TD12-5049);天津市自然科学基金重点项目(14JCZDJC34500);天津市北辰区科技计划补助项目(2014-CXYH-KF-001)
作者简介:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn