
图1 发酵液的Sephadex G-100洗脱曲线
Fig.1 Elution curve of fermentation broth on Sephadex G-100
赵希岳,宋厚煜,蔡志强,陈小花
(常州大学制药与生命科学学院,江苏 常州 213164)
摘 要:在5 L发酵罐中研究不同温度对枯草芽孢杆菌(Bacillus subtilis)ZJF-15菌体生长、底物消耗和产酶量的影响。分批发酵的工艺条件为:搅拌转速400 r/min、通气量1.0 L/(L·min)、pH 7.0、接种量5%、装液系数0.6、发酵温度35~37 ℃。结果表明:温度升高会导致反应速率加大、生长代谢加快、生产期提前、酶失活速率加快、发酵周期缩短、最终产酶量减少。实验建立了B. subtilis ZJF-15分批发酵的菌体生长、底物消耗和β-葡聚糖酶产酶的动力学方程。
关键词:枯草芽孢杆菌;β-葡聚糖酶;分批发酵;温度;动力学
β-葡聚糖是一类非淀粉多糖,是谷物类细胞壁的主要成分之一,约占其干质量的5.5% ,也广泛存在于褐藻、酵母、大型真菌、细菌等其他微生物的细胞壁中 [1-2]。美国饲料业首次在大麦饲料中添加β-葡聚糖酶,显著提高了饲料利用率,从而引起世界各国对β-葡聚糖酶的重视 [3-4]。吴鹏等 [5]对黑曲霉H-5产β-葡聚糖酶培养条件进行优化,把β-葡聚糖酶的酶活力由12.98 U/mL提高到20.03 U/mL。邵敏等 [6]利用聚合酶链式反应(polymerase chain reaction,PCR)技术对葡聚糖酶的基因进行改造,酶活力由84.2 U/mL提高至247.3 U/mL。黄发等 [7]对绿色木霉产β-葡聚糖酶的条件进行优化,最高酶活力可达998 U/mL。
产葡聚糖酶的微生物主要包括细菌和真菌,已报道的有:枯草芽孢杆菌(Bacillus subtlis) [8-9]、地衣芽孢杆菌(Bacillus licheniformis) [10-11]、碎囊毛霉(Mucor petrinsularis) [12]、盾壳霉(Coniothyrium minitans) [13]、康氏木霉(Trichoderma koningii) [14]、热纤梭菌(Clostridium thermocellum) [15]、黑曲霉(Aspergillus niger) [17]、局限曲霉 (Spergillus restrictus) [17]等。
Bano等 [18]以廉价甘蔗渣为主要碳源,确定枯草芽孢杆菌产β-葡聚糖酶的最优条件为:温度60 ℃、pH 7.0。Zhang Dianpeng [19]和Chu [20]等测得毕赤酵母属Guilliermondii M8的葡聚糖酶基因是糖苷水解酶家族的PgExg1,并嫁接此基因到大肠杆菌中。Jung等 [21]提取南极弹尾虫体内的β-葡聚糖酶基因,并导入大肠杆菌,获得重组蛋白工程菌,所产β-葡聚糖酶对海带多糖水解效果显著。尽管国内外研发的β-葡聚糖酶已经具有很强的工业潜力,但是关于β-葡聚糖酶发酵动力学模型的研究报道较少。
本课题组研究了Bacillus subtilis ZJF-15发酵生产β-葡聚糖酶的最适温度为35~37 ℃。在此基础上,本实验在5 L发酵罐中研究了不同温度对菌体生长、底物消耗和产酶量的影响。建立了B. subtilis ZJF-15分批发酵菌体生长、底物消耗和β-葡聚糖酶产酶的动力学方程,为β-葡聚糖酶生物技术发展及挖掘其在发酵工业中的应用潜力提供理论依据。
1.1 菌种与试剂
B. subtilis ZJF-15 浙江大学生物系统工程与食品科学学院。
地衣多糖 美国Sigma公司;大麦粉为市售;其他试剂均为分析纯。
1.2 仪器与设备
Biof-2005型5 L全自动控制发酵罐 上海理工大学高机实业总公司。
1.3 方法
1.3.1 发酵培养
在5 L发酵罐中进行分批发酵,装料系数0.6、接种量5%、发酵温度35~37 ℃、搅拌转速400 r/min,复膜氧电极和pH电极在线测定发酵过程中的溶解氧和pH值变化,每隔4 h取样,测定总糖质量浓度、还原糖质量浓度、β-葡聚糖酶活力、α-淀粉酶活力和中性蛋白酶活力及菌体生物量。
1.3.2 发酵液收集及组分测定
发酵液经硫酸铵进行盐析分级,收集35%~75%的组分,该组分保留了大部分的β-葡聚糖酶、α-淀粉酶和蛋白酶。含有β-葡聚糖酶的组分经脱色、脱盐、浓缩后上Sephadex G-100柱,获取纯品;β-葡聚糖酶活力、发酵液中总糖和还原糖含量的测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法 [22];中性蛋白酶活力的测定采用福林-酚法 [23];α-淀粉酶活力的测定采用BPNPG7法 [24];生物量的测定采用干质量法 [25]。
2.1 发酵代谢产物的确定
发酵液中高分子质量的蛋白质首先会被洗脱下来(峰Ⅰ),紧接为α-淀粉酶(峰Ⅱ),随后的第3峰主要为β-葡聚糖酶,其间混杂着少量的α-淀粉酶和中性蛋白酶(图1)。峰Ⅲ组分经浓缩后取一部分上DEAE-Cellulose 52离子交换层析柱,得到3 个峰,峰Ⅰ为蛋白酶,紧接着的峰Ⅱ为α-淀粉酶,最后出现的是β-葡聚糖酶蛋白峰(峰Ⅲ)(图2)。

图1 发酵液的Sephadex G-100洗脱曲线
Fig.1 Elution curve of fermentation broth on Sephadex G-100
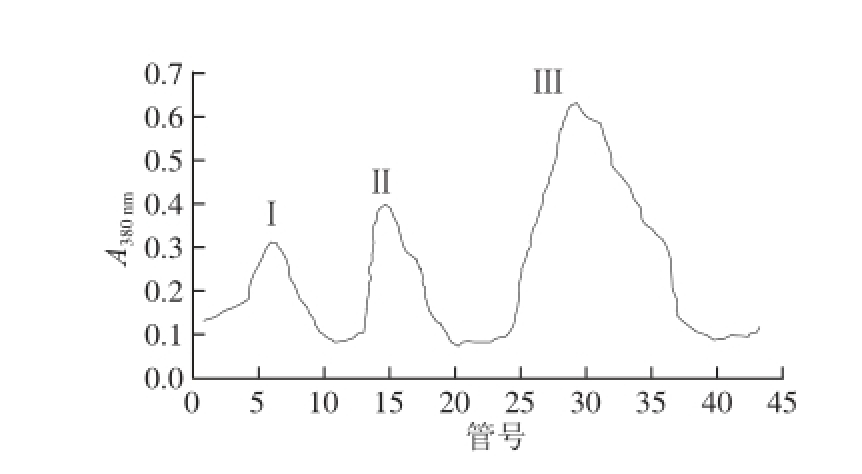
图2 2 β-葡聚糖酶的DEAE-Cellulose 52洗脱曲线
Fig.2 Elution curve of β-glueanase on DEAE-Cellulose 52
2.2 发酵温度对B. subtilis ZJF-15产酶的影响
2.2.1 发酵温度对菌体生长的影响

图3 发酵温度对菌体生长的影响
Fig.3 Effect of culture temperature on the growth of B. subtilis ZJF-15
升高温度可加快菌体生长,有利于菌体生物量的积累。由图3可知,在35 ℃时,菌体生长较为缓慢,细胞比生长速率(细菌生物量对时间求导即为比生长速率)μ=0.114 9 h -1,发酵至28 h时菌体生物量为13.22 g/L,达到最大;升高发酵温度,菌体比生长速率加快,当发酵温度为37 ℃时,菌体比生长速率为0.148 5 h -1,在发酵24 h时,菌体生物量最大,为12.88 g/L。
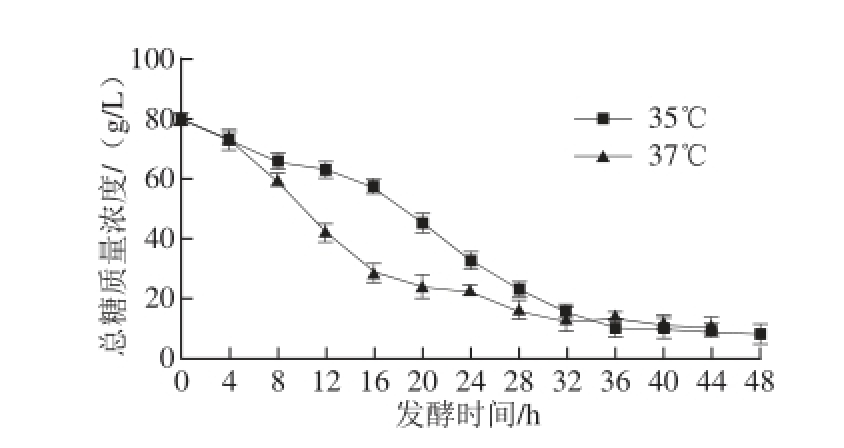
图4 发酵温度对底物消耗的影响
Fig.4 Effects of culture temperature on substrate consumption
2.2.2 发酵温度对底物消耗的影响由图4可知,发酵温度不同,发酵液中溶氧水平不同,底物消耗速率也不同,结果见图4。两种发酵温度条件下的糖耗曲线相似,菌体生长初始阶段的糖耗速率较快,当菌体生长进入对数生长后期至稳定期,糖耗速率下降;到发酵后期,发酵液中总糖质量浓度趋于稳定。
2.2.3 发酵温度对β-葡聚糖酶产生的影响

图5 发酵温度对产β-葡聚糖酶水平的影响
Fig.5 Effect of culture temperature on β-glucanase production
由图5可知,随着发酵温度的升高,发酵液中β-葡聚糖酶的水平明显提高,发酵产酶高峰也提前。β-葡聚糖酶水平在37 ℃条件下最高,在发酵36 h时,β-葡聚糖酶活力为207.18 U/mL。
2.2.4 发酵温度对产α-淀粉酶的影响

图6 发酵温度对产α-淀粉酶的影响
Fig.6 Effect of culture temperature on α-amylase production
由图6可知,产α-淀粉酶的水平受温度的影响与β-葡聚糖酶略有不同。随温度的升高,虽然有利于菌体的生长,但发酵液中还原糖水平明显提高,B. subtilis ZJF-15 α-淀粉酶受末端代谢产物的抑制,高质量浓度的还原糖抑制了α-淀粉酶编码基因的表达。
2.2.5 发酵温度对产中性蛋白酶的影响

图7 发酵温度对产中性蛋白酶的影响
Fig.7 Effect of culture temperature on protease production
如图7所示,产中性蛋白酶水平随温度的降低而急剧增大,在37 ℃和35 ℃条件下分别在44、40 h时的产酶水平最高,分别为206.7 U/mL和218.42 U/mL。
2.3 生长曲线及代谢规律的发酵动力学模型
在37 ℃条件下,从分批发酵的实验结果(图8、9)可以看出,B. subtilis ZJF-15的菌体生长曲线较典型,生长曲线与耗糖曲线在细胞生长期间呈影镜关系。β-葡聚糖酶的活力随菌体生物量的增加而逐渐增加,在菌体进入对数生长后期至稳定期,菌体发生自溶,β-葡聚糖酶开始大量产生。

图8 间歇培养中菌体生长和底物消耗
Fig.8 Cell growth and substrate consumption in batch culture
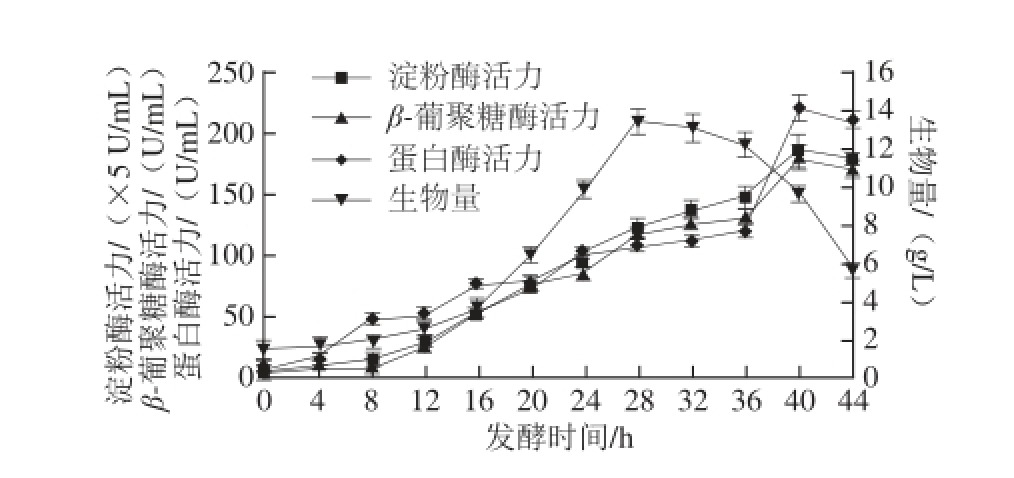
图9 间歇培养中菌体生长和产酶水平
Fig.9 Cell growth and enzyme production in batch culture
菌体生长的动力学方程为:

式中:c x为菌体生物量/(g/L);t为发酵时间/h;μ为比生长速率/h -1;μ max为最大比生长速率/h -1;c s为限制性底物质量浓度/(g/L);K s为饱和常数/(g/L)。
由公式(1)、(2)得:
底物消耗动力学方程为:
式中
![]() 依次表示菌体生长、维持及次级代谢所消耗底物的速率。
依次表示菌体生长、维持及次级代谢所消耗底物的速率。
 分别表示菌体生物量对底物、产物对底物的得率系数(此模型视为理想状态下);m
s为菌体的维持系数/(g/(g•h)),表示单位量菌体在单位时间所消耗的底物质量。
分别表示菌体生物量对底物、产物对底物的得率系数(此模型视为理想状态下);m
s为菌体的维持系数/(g/(g•h)),表示单位量菌体在单位时间所消耗的底物质量。
相关数据代入公式(4),得
产物形成动力学方程为:
式中:α为与菌体生长偶联的产物生成系数;β为经验常数;r p为产物的生成速率/(g/(L·h));r x为细胞的增殖速率/(g/(L·h));c x为菌体生物量/(g/L);c p为产物质量浓度/(g/L)。
相关数据代入公式(6),得
利用Matlab统计软件包对实验数据(图8、9)拟合,得各参数,见表1。
表1 模型参数计算结果
Table1 Determination of model parameters for B. subtiilliiss ZJF-15 growth, substrate consumption and enzyme production in batch culture
注: *.表示理想状态,即产生的细胞或产物及时转移出反应体系,不会对进一步的反应产生抑制作用。
参数μ max/h -1K s/(g/L)Y * x/s/(g/g)m s/(g/(g·h))Y * p/s/(g/g)αβ数值0.177 622.650.276 50.06913.882.864 30.387 6
利用模型公式(1)~(7)计算的c s、c x、c p与实验数据比较,结果见图10、11。可知上述方程能较好拟合实验所得数据,模型能很好地描述菌体生长、酶产生及底物消耗的规律。

图10 间歇培养中菌体生长和底物消耗模型拟合曲线
Fig.10 Fitting curves of the models for cell growth and substrate consumption in batch culture
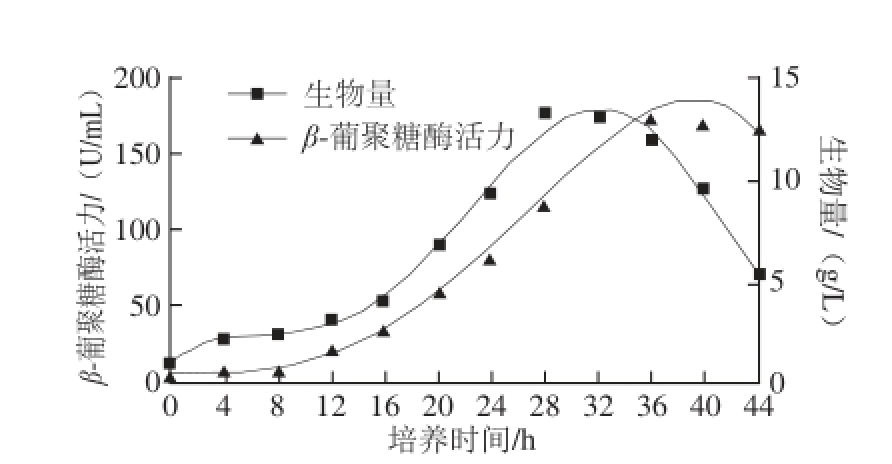
图11 间歇培养中菌体生长和产β-葡聚糖酶模型拟合曲线
Fig.11 Fitting curves of the model for cell growth and enzyme production in batch culture
发酵温度升高可加快菌体生长,但不利于菌体生物量的积累。温度升高,发酵液中产β-葡聚糖酶水平明显提高,发酵产酶高峰也提前。产β-葡聚糖酶水平在37 ℃条件下最大,且在36 h时,β-葡聚糖酶活力为207.18 U/mL。产α-淀粉酶的水平随温度的降低而急剧增大。B. subtilis ZJF-15分批发酵菌体生长,采用的是“部分生长偶联型”动力学模型进行拟合。底物消耗和β-葡聚糖酶产酶动力学模型能很好地描述菌体生长、酶生产及底物消耗规律。
参考文献:
[1] 华承建, 于江傲, 谢凤珍, 等. 拟青霉β-1,3(4)-葡聚糖酶同源建模及共价固定化[J]. 食品科学, 2013, 34(1): 252-256.
[2] SIBAKOV J, MYLLYMÄKI O, SUORTTI T, et al. Comparison of acid and enzymatic hydrolyses of oat bran β-glucan at low water content[J]. Food Research International, 2013, 52(1): 99-108. DOI:10.1016/j.foodres.2013.02.037.
[3] 张永勤, 曾凡伟. β-葡聚糖酶活力测定方法的研究进展[J]. 食品科学, 2011, 32(19): 316-320.
[4] 杨培龙, 姚斌, 范云六. 饲料用非淀粉多糖水解酶转基因植物的研究进展[J]. 中国生物工程杂志, 2005, 25(9): 29-34. DOI:10.3969/ j.issn.1671-8135.2005.09.007.
[5] 吴鹏, 王知龙, 吴秀. 黑曲霉HS-5高产β-葡聚糖酶发酵条件的优化[J]. 中国酿造, 2015, 34(3): 54-57. DOI:l0.11882/ j.issn.0254-5071.2015.03.012.
[6] 邵敏, 李长福, 葛正龙, 等. 基于易错PCR技术定向进化枯草芽孢杆菌β-葡聚糖酶[J]. 生物技术通报, 2013(12): 141-145.
[7] 黄发, 吴志娜. 绿色木霉生产β-葡聚糖酶的产酶条件的优化[J]. 中国实用医药, 2014, 9(34): 248-249.
[8] NIU Qinhong, ZHANG Guo, ZHANG Lin, et al. Purification and characterization of a thermophilic 1,3-1,4-β-glucanase from Bacillus methylotrophicus S2 isolated from booklice[J]. Journal of Bioscience and Bioengineering, 2016, 121(5): 503-508. DOI:10.1016/j.jbiosc. 2015.10.007.
[9] 王远, 高秋强, 辛秀娟, 等. β-葡萄糖苷酶基因和内切葡聚糖酶基因在枯草芽孢杆菌中的表达[J]. 应用与环境生物学报, 2013, 19(6): 990-996. DOI:10.3724/SP.J.1145.2013.00990.
[10] KARIM A, NAWAZ M A, AMAN A, et al. Hyper production of cellulose degrading endo (1,4)-β-D-glucanase from Bacillus licheniformis KIBGEIB2[J]. Journal of Radiation Research and Applied Sciences, 2015, 8(2): 160-165. DOI:10.1016/ j.jrras.2014. 06.004.
[11] NEERAJA C, MOERSCHBACHER B, PODILE A R. Fusion of cellulose binding domain to the catalytic domain improves the activity and conformational stability of chitinase in Bacillus licheniformis DSM13[J]. Bioresource Technology, 2010, 101(10): 3635-3641. DOI:10.1016/j.biortech.2009.12.118.
[12] 丁叶梅, 贠建民, 魏龙, 等. 碎囊毛霉产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质[J]. 食品科学, 2014, 35(11): 143-148. DOI:10.7506/ spkx1002-6630-201411029.
[13] 刘峄, 沈高峰, 刘慧芹, 等. 盾壳霉固态发酵基质筛选和发酵条件优化[J]. 中国农学通报, 2012, 28(30): 101-105. DOI:10.3969/ j.issn.1000-6850.2012.30.018.
[14] 王敏, 王颉. 响应面法优化秸秆发酵产β-葡萄糖苷酶的研究[J].河北农业科学, 2015, 19(1): 80-83. DOI:10.16318/j.cnki. hbnykx.2015.01.022.
[15] JIANG Daohua, FAN Junping, WANG Xianping, et al. Crystal structure of 1,3Gal43A, an exo-β-1,3-galactanase from Clostridium thermocellum[J]. Journal of Structural Biology, 2012, 180(3): 447-457. DOI:10.1016/j.jsb.2012.08.005.
[16] 郭春腾, 傅蓉, 邓文汉, 等. 黑曲霉内切β-葡聚糖酶的纯化和性质[J]. 中国食品学报, 2002, 2(1): 12-16. DOI:10.3969/ j.issn.1009-7848.2002.01.003.
[17] RABIE C J, LÜBBEN A, MARAIS G J, et al. Enumeration of fungi in barley[J]. International Journal of Food Microbiology, 1997, 35(2): 117-127. DOI:10.1016/S0168-1605(96)01210-X.
[18] BANO S, QADER S A U, AMAN A, et al. High production of cellulose degrading endo-1,4-β-D-glucanase using bagasse as a substrate from Bacillus subtilis KIBGE HAS[J]. Carbohydrate Polymers, 2013, 91: 300-304. DOI:10.1016/j.carbpol.2012. 08.022.
[19] ZHANG Dianpeng, SPADARO D, VALENTE S, et al. Cloning,characterization and expression of an exo-1,3-β-glucanase gene from the antagonistic yeast, Pichia guilliermondii strain M8 against grey mold on apples[J]. Biological Control, 2011, 59(2): 284-293. DOI:10.1016/j.biocontrol.2011.06.018.
[20] CHU C Y, TSENG C W, YUEH P Y, et al. Molecular cloning and characterization of a β-glucanase from Piromyces rhizinflatus[J]. Journal of Bioscience and Bioengineering, 2011, 111(5): 541-546. DOI:10.1016/j.jbiosc.2011.01.009.
[21] SONG J M, NAM K, SUN Y-U, et al. Molecular and biochemical characterizations of a novel arthropod endo-β-1,3-glucanase from the Antarctic springtail, Cryptopygus antarcticus, horizontally acquired from bacteria[J]. Comparative Biochemistry and Physiology, 2010,155(4): 403-412. DOI:10.1016/j.cbpb.2010.01.003.
[22] 薛茂云, 杨爱萍, 郑萍, 等. β-葡聚糖酶发酵培养基的优化研究[J].中国调味品, 2015, 40(8): 62-64. DOI:10.3969/j.issn.1000-9973. 2015.08.014.
[23] FUKAMIZO T, HAYASHI K, TAMOI M, et al. Enzymatic hydrolysis of 1,3-1,4-β-glucosyl oligosaccharides by 1,3-1,4-β-glucanase from Synechocystis PCC6803: a comparison with assays using polymer and chromophoric oligosaccharide substrates[J]. Archives of Biochemistry and Biophysics, 2008, 478(2): 187-194. DOI:10.1016/ j.abb.2008.07.019.
[24] 何艳克, 胡飞. 大麦芽中淀粉酶系活力的测定及其作用特性[J]. 食品科学, 2010, 31(15): 236-239.
[25] 孙磊, 程显好, 李维焕, 等. 菌落直径法和菌丝干重法在优化真姬菇菌种固体斜面培养条件的比较[J]. 中国食用菌, 2015, 34(3): 28-32. DOI:10.13629/j.cnki.53-1054.2015.03.008.
Kinetic Study of β-Glucanase Production by Batch Fermentation at Different Temperatures
ZHAO Xiyue, SONG Houyu, CAI Zhiqiang, CHEN Xiaohua
(School of Pharmaceutical and Life Science, Changzhou University, Changzhou 213164, China)
Abstract:The effect of different temperatures on the growth of Bacillus subtilis ZJF-15, substrate consumption and β-glucanase production was studied by conducting batch fermentation experiments in a 5-L fermentation tank. The fermentation conditions were determined as 400 r/min, 1.0 L/(L·min), 7.0, 5%, 0.6 and 35-37 ℃ for rotating speed,ventilation rate, initial fermentation pH, inoculum quantity, medium loading coeffi cient and culture temperature, respectively. The results showed that increased culture temperature led to a higher reaction rate, accelerated bacterial growth and metabolism, earlier production of β-glucanase, faster enzyme inactivation, shortened fermentation period and fi nally reduced production of β-glucanase. The kinetic equations for bacterial growth, substrate consumption and β-glucanase production of Bacillus subtilis ZJF-15 were established by batch fermentation.
Key words:Bacillus subtilis; β-glucanase; batch fermentation; temperature; kinetics
DOI:10.7506/spkx1002-6630-201619035
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2016)19-0211-05
引文格式:
赵希岳, 宋厚煜, 蔡志强, 等. 不同温度对β-葡聚糖酶分批发酵动力学的影响[J]. 食品科学, 2016, 37(19): 211-215.
DOI:10.7506/spkx1002-6630-201619035. http://www.spkx.net.cn
ZHAO Xiyue, SONG Houyu, CAI Zhiqiang, et al. Kinetic study of β-glucanase production by batch fermentation at different temperatures[J]. Food Science, 2016, 37(19): 211-215. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619035. http://www.spkx.net.cn
收稿日期:2015-12-29
基金项目:江苏省研究生培养创新工程项目(CX09S-010Z);江苏省企业研究生工作站项目(20130605)
作者简介:赵希岳(1965—),男,教授,博士,研究方向为生物化工。E-mail:Xyzhao@cczu.edu.cn