不同葡萄品种多酚氧化酶酶学特性比较
闫小宇,董 喆,王沙沙,周亚丽,苏鹏飞,袁春龙*
(西北农林科技大学葡萄酒学院,陕西 杨陵 712100)
摘 要:以欧美种葡萄 “关口”、“金手指”、“黄密”3 个品种和欧亚种葡萄 “泽香”、“无核白”2 个品种为实验材料,比较了5 个不同葡萄品种间多酚氧化酶(polyphenol oxidase,PPO)以邻苯二酚、4-甲基儿茶酚、儿茶素、咖啡酸为底物的动力学参数K
m、v
max/K
m值,并比较了酶的最适pH值、最适温度、热稳定性、以及抑制剂对酶活性的影响。结果表明:测定的5 个品种中,欧美种葡萄和欧亚种葡萄对邻苯二酚的亲和力存在显著性差异,对 4-甲基儿茶酚、儿茶素、咖啡酸的亲和力无显著性差异;欧美种葡萄和欧亚种葡萄对邻苯二酚的催化效率存在显著性差异,对4-甲基儿茶酚的催化效率无显著性差异,“关口”葡萄对儿茶素和咖啡酸的催化效率明显高于其他4 个葡萄品种。焦亚硫酸盐和抗坏血酸对5 种葡萄PPO活性都有强的抑制作用,焦亚硫酸盐对其他4 个品种葡萄的抑制作用强于对“关口”葡萄的抑制作用;在测定的pH值和温度中,5 种葡萄PPO的最适pH值和最适温度都无明显差异。
关键词:多酚氧化酶;动力学参数;催化效率;抑制作用
“关口”葡萄是湖北省建始县特产。利用简单重复序列和逆转座子间扩增多态性标记法对“关口”葡萄的亲缘关系进行了分析,结果显示“关口”葡萄与欧美杂交种“尼加拉”和“白香蕉”亲缘关系最近,与美洲种“康可”和“郑果6号”亲缘关系较近,而与其他欧亚种的遗传关系相对较远,属欧美杂交种
[1]。近几年“关口”葡萄受到关注,但是发现此种葡萄在酿造葡萄酒和制汁过程中存在迅速褐变的问题。褐变是白葡萄酒和葡萄汁生产过程中出现的主要的问题,一方面,褐变会影响产品的感官特性,如色泽、香气物质和风味的丢失。另一方面,褐变会导致营养物质的丢失
[2]。褐变反应依据反应机制分为酶促褐变与非酶促褐变
[3]。研究发现,葡萄汁中主要发生的是酶促褐变,葡萄酒在酿造过程中,首先发生酶促褐变,随着发酵进行,酶活性逐渐降低,在葡萄酒中主要发生非酶促褐变,而多酚氧化酶(polyphenol oxidase,PPO)的活性是影响酶促褐变强度的主要因素。
PPO是一种含有铜离子的酶,在氧存在的情况下,能催化单体酚氧化成为邻苯酚(单体酚酶活性),也能催化邻苯酚氧化成相应的醌类(儿茶酚酶活性)
[4-6]。这些物质再聚合成为不期望的褐色、红色、或者是黑色色素。目前,有关PPO与植物褐变方面的研究已见不少报道,关于部分品种葡萄的PPO和控制酒氧化的研究也有不少报道
[7-13],但关于不同品种葡萄间PPO的比较研究鲜见报道。关口葡萄破碎时氧化速率快,这可能与其PPO的特性有关。为此,选取欧美种葡萄“关口”、“金手指”、“黄密”和欧亚种葡萄“泽香”、“无核白”为实验材料,对其PPO进行提取,比较不同品种间PPO对几种不同底物的催化活性以及酶学性质,为葡萄酒和葡萄汁生产过程中出现的褐变问题提供一定的理论依据,从而找到控制酶促褐变的方法。
1 材料与方法
1.1 材料与试剂
“关口”葡萄样品采自湖北建始县花坪镇,采收时间为2014年9月20日,采样后-20 ℃低温冰箱冷冻保存。“金手指”(欧美种)、“黄密”(欧美种)、“泽香”(欧亚种)和“无核白”(欧亚种)均采自咸阳张裕瑞那酒庄,采收时间为2014年9月15日,采样后-20 ℃保存。
邻苯二酚、儿茶素、邻苯三酚、4-甲基儿茶酚、咖啡酸 美国Sigma公司;柠檬酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、环庚三烯酚酮、抗坏血酸、焦亚硫酸钠、氯化钠、L-酪氨酸、没食子酸均为国产分析纯。
1.2 仪器与设备
AuY220精密电子天平、UV-2450型紫外分光光度计日本岛津公司;RC5C Plus高速冷冻离心机 德国赛默飞公司。
1.3 方法
1.3.1 葡萄PPO粗酶液的制备
参考Fortea等
[14]的方法,略加改动。具体如下:称取葡萄果实50 g,去籽,加入50 mL的100 mmol/L磷酸盐缓冲溶液打浆(含10 mmol/L抗坏血酸,pH 7.3)1 min,用8 层纱布过滤,4 000 r/min离心15 min。弃上清液,残渣用20 mL的100 mmol/L磷酸盐缓冲溶液(含4 g/100 mL的Triton X-114和50 mmol/L CaCl
2,pH 7.3)提取,振荡均匀,然后在4 ℃条件下保存15 min,再于37 ℃保温15 min。这时溶液会由于去污剂中的胶体形成、聚合和沉淀而自发的混浊,这些胶体中包括疏水性的蛋白、花青素和酚类物质。然后将混合液在25 ℃、1 000 r/min离心10 min,将富含去污剂的相丢弃,上清液中不含去污剂的液体即为酶粗提取液,-20 ℃保存。实验做3 次重复。
1.3.2 葡萄PPO活性的测定
PPO活性的测定方法参考Marsellés-Fontanet等
[15]的方法,略加改动。具体步骤如下:将0.1 mL粗酶提取液加入到2.90 mL含有20 mmol/L邻苯二酚的麦基尔文缓冲溶液(柠檬酸-磷酸二氢钠缓冲溶液,pH 5.0)中,然后轻轻的摇匀,使其均质化,避免形成泡沫,25 ℃反应3 min后,测定在400 nm波长处的吸光度,每20 s测定一次,共测定3 min,以蒸馏水代替酶的提取液作为对照组,选取吸光度-时间曲线中线性部分表示酶的活性,将每分钟吸光度变化0.001记为一个活力单位U。做3 次重复。
1.3.3 不同底物酶促动力学参数(K
m与v
max/K
m)的测定
分别对7 个不同商业底物(邻苯二酚、邻苯三酚、4-甲基儿茶酚、咖啡酸、儿茶素、没食子酸、L-酪氨酸)的专一性进行研究。除L-酪氨酸的浓度为2.5 mmol/L、咖啡酸的浓度为1 mmol/L之外(其溶解度很低),其余底物浓度设置为10 mmol/L。酶活力的测定方法同上述酶活力测定方法,只改变波长为每种物质各自的最大吸收波长,邻苯二酚、邻苯三酚、4-甲基儿茶酚、没食子酸、L-酪氨酸的最大吸收波长均为400 nm,咖啡酸、儿茶素的最大吸收波长为387 nm,以10 mmol/L的邻苯二酚为底物时的最大酶活力表示为100%。
以邻苯二酚、4-甲基儿茶酚、儿茶素、咖啡酸为底物,测定不同底物在不同浓度下PPO的活性,做双倒数曲线,依据曲线计算酶的动力学参数K
m与v
max/K
m。实验重复3 次。
1.3.4 部分酶学性质的测定
1.3.4.1 最适pH值的测定
以邻苯二酚为底物,测定酶提取液在pH值范围为2.6~7.6之间的柠檬酸-磷酸缓冲液中的PPO活性。
1.3.4.2 最适温度的测定
将含邻苯二酚底物的缓冲液(pH值为实验所得的最适pH值)在不同温度的水浴中保持10 min,温度变化从20~80 ℃,增加幅度为5 ℃,取2.9 mL缓冲液加入0.1 mL酶提取液,相同水浴温度反应3 min后测定吸光度,计算PPO活性。
1.3.4.3 热稳定性的测定
将PPO粗酶提取液分别置于70、75、80 ℃水浴中保温2、4、6、8、10 min后,迅速放入冰中冷却,10 min后放入室温条件下,按上述酶活性测定的标准方法以邻苯二酚为底物测定相对酶活力,结果用所测定残余酶活力占最大酶活力(100%)的百分比表示。
1.3.5 抑制剂对PPO活性的影响
测定抑制剂柠檬酸、抗坏血酸、焦亚硫酸盐、EDTA、环庚三烯酚酮对酶活性的抑制作用。利用含20 mmol/L邻苯二酚的柠檬酸-磷酸缓冲溶液(pH 5.0)溶解抑制剂,配制成含不同浓度(0.05、0.5、5 mmol/L)抑制剂的反应体系。按上述酶活性的测定方法测定PPO残余酶活力。用最大酶活力与残余酶活力差值比最大酶活力表示抑制剂对PPO活性的抑制作用。
1.4 数据统计分析及制图
使用Excel 2007软件统计分析所有数据,计算标准差,利用Origin 9.0软件作图。
2 结果与分析
2.1 不同底物酶促动力学
表1 PPO专一性
Table1 Substrate specificity of PPO
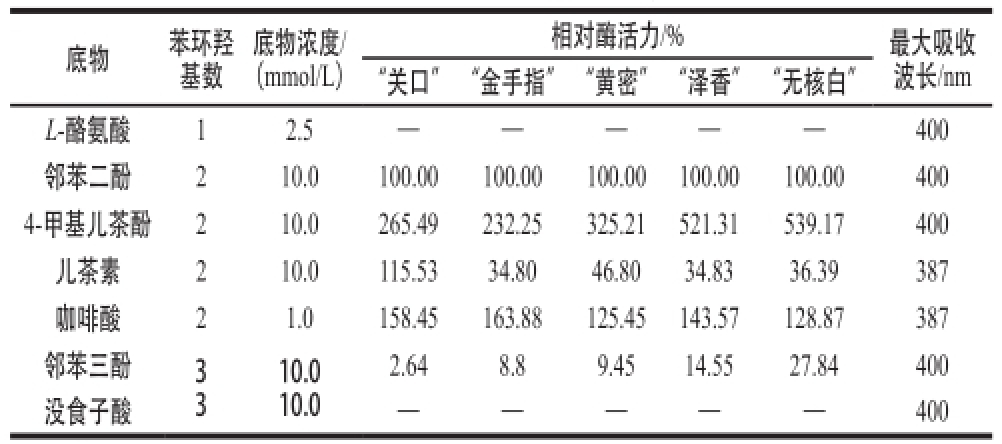
注:—. 未检出。
底物苯环羟基数底物浓度/(mmol/L)相对酶活力/%最大吸收波长/nm“关口”“金手指”“黄密”“泽香”“无核白”L-酪氨酸12.5——400邻苯二酚210.0100.00100.00100.00100.00100.00400 4-甲基儿茶酚210.0265.49232.25325.21521.31539.17400儿茶素210.0115.5334.8046.8034.8336.39387咖啡酸21.0158.45163.88125.45143.57128.87387邻苯三酚3 3 2.648.89.4514.5527.84400没食子酸——400 10.0 10.0
实验测定了5 个葡萄品种PPO对7 种不同底物的专一性,其中包括单羟基酚、二羟基酚、三羟基酚,结果见表1。5 种葡萄PPO对单羟基和三羟基酚基本无活性,而对二羟基酚的氧化活性相对较强。PPO是一种含铜离子,能催化酚类物质反应的酶,能够催化单羟基酚到二羟基酚,称作甲酚酶活性,也能够催化二羟基酚到相应的醌类物质,称作儿茶酚酶活性。显然,5 个品种葡萄都只具有儿茶酚酶活性,这个结果与Zheng Yongju等
[9]对于Thompson无籽葡萄,Cash等
[16]对Concord葡萄,Lee等
[17]对Chaumac葡萄PPO的研究结果均相同。然而,Rapeanu等
[18]研究得出Victoria葡萄既具有儿茶酚酶活性,也具有甲酚酶活性。5 个葡萄PPO都对邻苯三酚有催化活性,但是催化活性明显低于二羟基酚的活性。
表2 葡萄PPO不同底物的动力学参数
Table2 Kinetic parameters of grape PPO towards different substrates
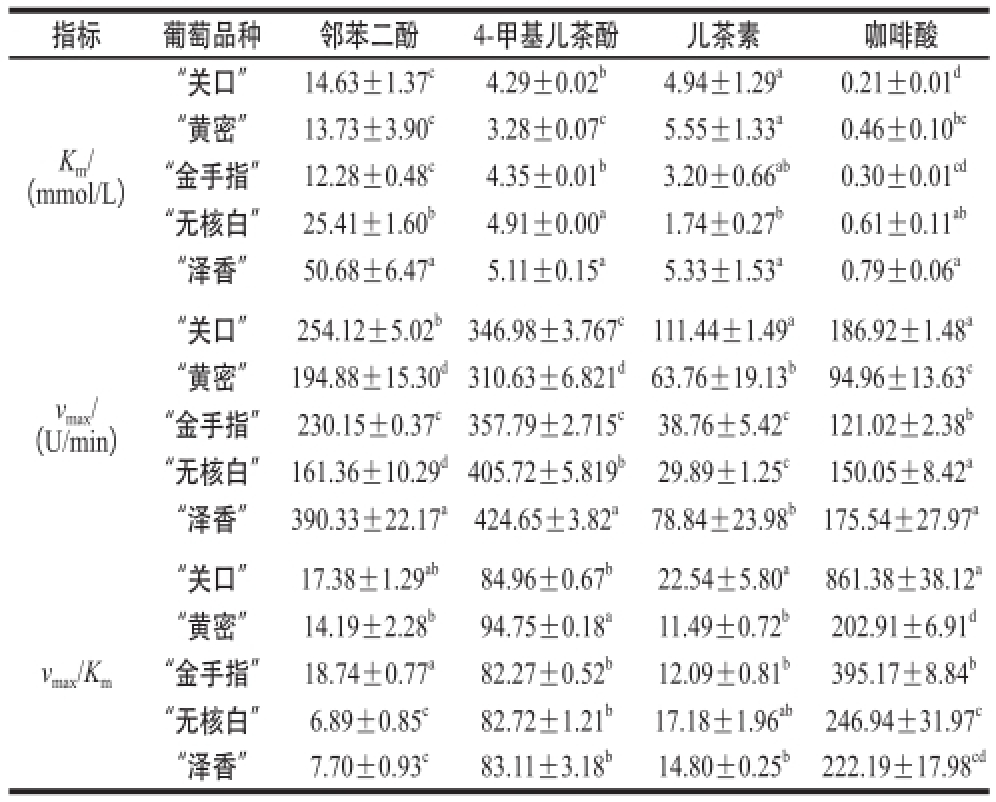
注:同列同指标肩标小写字母不同表示差异显著(P<0.05)。
指标葡萄品种邻苯二酚4-甲基儿茶酚儿茶素咖啡酸Km/(mmol/L)“关口”14.63±1.37
c4.29±0.02
b4.94±1.29
a0.21±0.01
d“黄密”13.73±3.90
c3.28±0.07
c5.55±1.33
a0.46±0.10
bc“金手指”12.28±0.48
c4.35±0.01
b3.20±0.66
ab0.30±0.01
cd“无核白”25.41±1.60
b4.91±0.00
a1.74±0.27
b0.61±0.11
ab“泽香”50.68±6.47
a5.11±0.15
a5.33±1.53
a0.79±0.06
avmax/(U/min)“关口”254.12±5.02
b346.98±3.767
c111.44±1.49
a186.92±1.48
a“黄密”194.88±15.30
d310.63±6.821
d63.76±19.13
b94.96±13.63
c“金手指”230.15±0.37
c357.79±2.715
c38.76±5.42
c121.02±2.38
b“无核白”161.36±10.29
d405.72±5.819
b29.89±1.25
c150.05±8.42
a“泽香”390.33±22.17
a424.65±3.82
a78.84±23.98
b175.54±27.97
av
max/K
m“关口”17.38±1.29
ab84.96±0.67
b22.54±5.80
a861.38±38.12
a“黄密”14.19±2.28
b94.75±0.18
a11.49±0.72
b202.91±6.91
d“金手指”18.74±0.77
a82.27±0.52
b12.09±0.81
b395.17±8.84
b“无核白”6.89±0.85
c82.72±1.21
b17.18±1.96
ab246.94±31.97
c“泽香”7.70±0.93
c83.11±3.18
b14.80±0.25
b222.19±17.98
cd
实验以4 种物质作为PPO底物时,其反应规律都符合米氏方程,依据双倒数曲线得到5 种葡萄的PPO 对4 种不同底物的动力学参数K
m和v
max见表2。用K
m值的大小评价底物与酶的亲和力,K
m值越小,说明底物与酶的亲和力越强
[19]。由表2可知,当以邻苯二酚为底物时,3 个欧美种葡萄的K
m与2 个欧亚种葡萄之间存在显著差异,且3 个欧美种葡萄的K
m值明显小于2 个欧亚种葡萄,表明在测定的5 个葡萄品种中,欧美种葡萄对邻苯二酚的亲和能力强于欧亚种,研究发现邻苯二酚似乎对大多数的水果和蔬菜的PPO的亲和力都比较低
[20];当以4-甲基儿茶酚为底物时,发现欧美种葡萄对4-甲基儿茶酚的亲和能力同样强于欧亚种,只是差异没有邻苯二酚的明显;当以咖啡酸和儿茶素为底物时,5 个品种葡萄的K
m值都很小,说明5 个葡萄PPO对于咖啡酸和儿茶素的亲和能力都很强,且欧美与欧亚之间的差异性不明显。Rapeanu等
[18]对Victoria葡萄的底物动力学研究发现以邻苯二酚、4-甲基儿茶酚、儿茶素为底物的K
m值分别为52.6、7.51、4.34 mmol/L,这与本实验得到的5 个葡萄PPO与底物的亲和力的结果相似。实验发现“关口”葡萄较其他葡萄品种与咖啡酸的亲和力相对较强。
然而,判断PPO最适底物的主要的标准是具有高的催化效率,以v
max/K
m表示,v
max/K
m越高,表明催化效率越高。实验发现,以邻苯二酚为底物时,3 个欧美种葡萄的v
max/K
m值明显大于2 个欧亚种葡萄,即欧美种葡萄PPO对邻苯二酚的催化效率高于欧亚种葡萄的催化效率;当以4-甲基儿茶酚为底物时,欧美种与欧亚种之间无明显差异,而当以咖啡酸或者是儿茶素为底物时,“关口”葡萄对于这两种底物的催化效率明显高于其他4 种葡萄PPO的催化效率,尤其以咖啡酸为底物时,“关口”葡萄PPO的v
max/K
m值是其他4 种葡萄的2~4 倍,“关口”葡萄对咖啡酸的催化效率明显高于其他葡萄的催化效率。研究表明,葡萄酒在氧化过程中,首先是酚酸、酒石酸脂类物质被氧化成对应的醌类物质,然后这个醌类物质作为氧化剂再将黄烷醇类物质氧化成对应的醌类物质,而自己则被还原。这表明,“关口”葡萄在酿造葡萄酒时氧化速率快,很可能是由于其PPO对于咖啡酸等酚酸类物质的催化效率高而使褐变的开始反应快速发生而引起的。
2.2 部分酶学性质测定
2.2.1 pH值对PPO活性的影响

图1 pH值对5 种葡萄PPO活性的影响
Fig.1 Effect of pH on the activity of PPO from five different varieties of grapes
由图1可知,pH值对5 个不同葡萄品种的PPO活性影响都很大,且对各品种影响趋势相同。在实验测定的pH值范围内,PPO的活性呈先增大后减小的趋势,实验测定的几个pH值中,5 个葡萄品种PPO活性都在pH值为5.0时表现为最强。这个实验结果与Rapeanu等
[18]报道的Victoria葡萄PPO的最适pH值为5.0相同,与西班牙无籽葡萄BRS Clara和BRS Morena测定的最适pH值为5.5的结果相似
[21]。“关口”葡萄汁的pH值为3.4左右,在此pH值处果实PPO的活性为最适pH值处活性的45.25%。其他的4 个葡萄品种在葡萄汁的pH值处表现出的活力与“关口”葡萄相似。
2.2.2 5 种葡萄果实PPO的最适温度比较
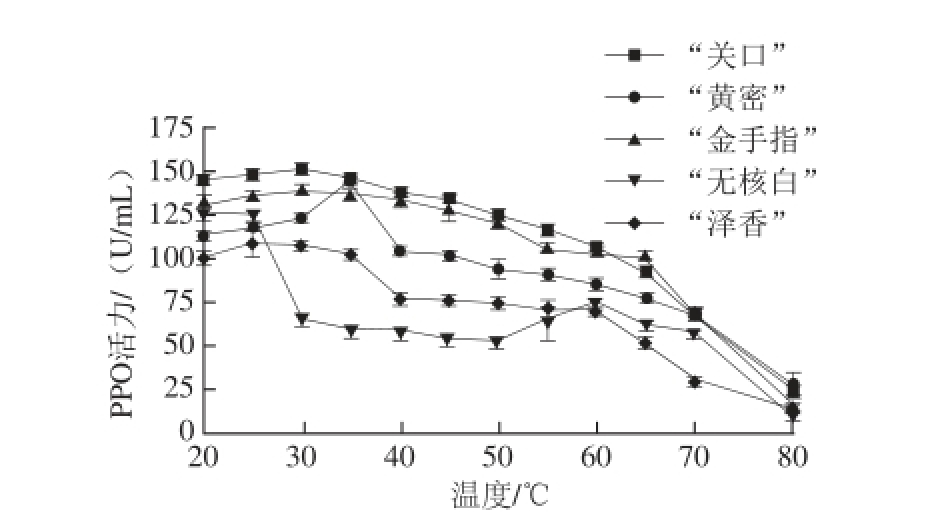
图2 温度对PPO活性的影响
Fig.2 Effect of temperature on the activity of grape PPO
实验测定了反应温度为20~80 ℃之间时5 种葡萄PPO的催化活性,结果见图2。“关口”、“黄密”、“金手指”、“泽香”和“无核白”5 种葡萄PPO的最适反应温度分别为30、35、30、25、20 ℃。实验发现,随着温度的升高,“关口”、“黄密”、“金手指”、“泽香”4 种葡萄的PPO的活性呈先升高后降低的趋势,只有“无核白”PPO活性先降低,在50 ℃以后,又出现上升的趋势,在60 ℃出现另一个高峰,然后再降低,这表明“无核白”葡萄PPO可能具有多种分子形式或同工酶,这与曹健等
[22]在《食品酶学》中叙述的有关结论相同。当温度超过65 ℃时,几个葡萄酶活性都出现快速下降。Muscadine葡萄和Emir葡萄的PPO最适反应温度与5 种葡萄最适反应温度相似
[23]。
2.2.3 5 种葡萄PPO的热稳定性
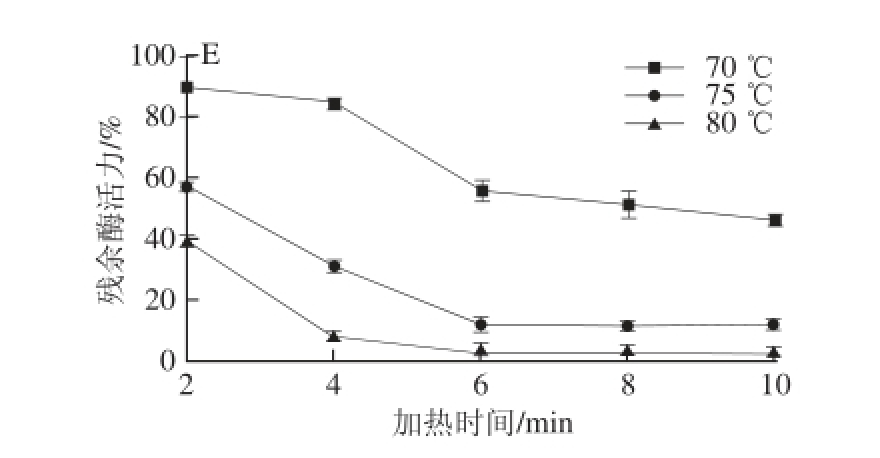
图3 5 种葡萄PPO热稳定性
Fig.3 Thermal inactivation of PPO from five different varieties of grapes
A~E. 葡萄品种分别为“关口”、“金手指”、“黄密”、“泽香”、“无核白”。
实验测定了不同加热温度、加热时间对5 种葡萄PPO活性的影响,结果见图3。5 种葡萄PPO热稳定性相似,当加热温度为80 ℃时,加热时间达到4 min后,酶的活性降低到10%以下,当温度为75 ℃时,将酶液加热4 min,酶的活性降低到最适活性的50%以下。欧亚种葡萄“泽香”和“无核白”PPO热稳定性比3 个欧美种葡萄差,在70 ℃条件下,“泽香”葡萄PPO在70 ℃加热2 min后活性就降到80%以下,在80 ℃加热2 min酶活性就降到20%以下,而“金手指”葡萄PPO在70 ℃加热达8 min时酶活性才降到80%以下。实验发现“关口”葡萄PPO对热处理稳定性介于几种葡萄的稳定性之间。
2.2.4 抑制剂对葡萄果实PPO的影响
表3 抑制剂对OPP活性的抑制作用
Table3 Effect of various inhibitors on the activity of grape PPO

抑制剂浓度/(mmol/L)抑制率/%“关口”“黄密”“金手指”“无核白”“泽香”焦亚硫酸盐0.0544.65±2.40 77.83±1.33 83.73±0.58 83.28±0.27 77.14±0.00 0.50100100100100100 5.00100100100100100抗坏血酸0.0517.15±0.95 18.42±1.29 16.6±0.14 16.17±1.92 16.95±1.06 0.50100100100100100 5.00100100100100100柠檬酸0.059.15±2.19 10.09±1.29 12.03±2.10 12.09±1.09 10.11±0.21 0.5014.96±1.64 12.01±1.12 13.11±0.22 13.32±2.19 12.24±2.15 5.0013.38±0.10 15.43±0.89 15.32±3.12 13.21±2.73 15.56±2.76 EDTA 0.057.08±0.25 2.38±0.85 4.65±0.94 5.75±0.48 3.95±0.15 0.507.50±3.14 12.95±0.89 14.50±1.02 6.40±0.23 9.97±0.43 5.0016.23±1.24 15.27±1.84 18.01±0.99 8.09±0.98 10.10±0.41
研究发现,不同抑制剂对于PPO的抑制作用机理不同:还原剂、螯合剂、络合剂、酸化剂、酶修饰剂,这些抑制作用都是通过阻止o-醌的积累或是形成稳定的无颜色的物质。抗坏血酸和焦亚硫酸盐是还原剂
[24-26],可以将o-醌还原为没有颜色的二羟基酚,也可以和o-醌反应形成稳定的没有颜色的产物。EDTA具有较强的螯合能力,能螯合PPO中Cu
2+,从而抑制PPO的活性。柠檬酸的抑制作用是通过降低反应体系的pH值来降低酶的活性。
实验以邻苯二酚为底物对不同浓度的5 种抑制剂对5 个葡萄果实PPO活性的影响做了研究。结果见表3。对葡萄果实PPO有强的抑制作用的物质是焦亚硫酸盐、抗坏血酸。焦亚硫酸盐的浓度达到0.5 mmol/L时抑制率达到100%。白葡萄酒酿造过程中,一般会在除梗破碎过程中加入0.1 mmol/L左右二氧化硫(以亚硫酸形式加入),由于二氧化硫的挥发性强,在压榨挤汁过程后,二氧化硫浓度一般会降低到0.05 mmol/L以下,实验发现,当亚硫酸盐浓度为0.05 mmol/L时,只有“关口”葡萄的抑制率为44.65%,其余4 个葡萄的抑制率都达到77%以上。这可能解释了为什么在用“关口”葡萄发酵葡萄酒时,即使加入二氧化硫,其氧化速率仍然很快的现象。抗坏血酸的浓度达到0.5 mmol/L时抑制率达到100%,可以得出焦亚硫酸盐和抗坏血酸可以抑制葡萄汁的酶促褐变反应。柠檬酸和EDTA对PPO也存在抑制作用,但是抑制强度相对较低。
3 结 论
实验测定了5 种葡萄PPO的酶学性质,结果发现,5 种葡萄PPO只具有儿茶酚酶催化活性。欧美种葡萄与欧亚种葡萄PPO对不同底物的亲和力与催化活性间存在显著性差异,“关口”葡萄PPO对咖啡酸和儿茶素的催化活性明显高于其他4 种葡萄PPO。“关口”葡萄在酿造葡萄酒时氧化速率快,很可能是由于其PPO对于咖啡酸等酚酸类物质的催化效率高而引起的。在测定的几个pH值处,5 个葡萄PPO的最适pH值为5.0。“关口”、“黄密”、“金手指”、“泽香”和“无核白”葡萄PPO的最适反应温度分别为30、35、30、25 ℃和20 ℃。欧亚种葡萄“泽香”和“无核白”PPO热稳定性比3 个欧美种葡萄稳定性差。焦亚硫酸盐和抗坏血酸对5 种PPO活性都有强的抑制作用,其中焦亚硫酸盐对其他4 个品种葡萄的抑制作用强于对“关口”葡萄的抑制作用。
参考文献:
[1] 李慧, 罗正荣, 张青林. 基于SSR和IRAP标记的‘关口葡萄’亲缘关系分析[J]. 果树学报, 2014, 31(6): 1040-1046. DOI:10.13925/j.cnki. gsxb.20140202.
[2] SIOUMIS N, KALLITHRAKA S, TSOUTSOURAS E, et al. Browning development in white wines: dependence on compositional parameters and impact on antioxidant characteristics[J]. European Food Research and Technology, 2005, 220(3/4): 326-330. DOI:10.1007/s00217-004-1032-0.
[3] ES-SAFI N E, CHEYNIER V, MOUTOUNET M. Effect of copper on oxidation of (+)-catechin in a model solution system[J]. International Journal of Food Science and Technology, 2003, 38(2): 153-163. DOI:10.1046/j.1365-2621.2003.00656.x.
[4] FRONK P, HARTMANN H, BAUER M, et al. Polyphenoloxidase from Riesling and Dornfelder wine grapes (Vitis vinifera) is a tyrosinase[J]. Food Chemistry, 2015, 183: 49-57. DOI:10.1016/ j.foodchem.2015.03.016.
[5] ROLFF M, SCHOTTENHEIM J, DECKER H, et al. Copper-O
2reactivity of tyrosinase models towards external monophenolic substrates: molecular mechanism and comparison with the enzyme[J]. Chemical Society Reviews, 2011, 40(7): 4077-4098. DOI:10.1039/ C0CS00202J.
[6] 刘芳, 赵金红, 朱明慧, 等. 多酚氧化酶结构及褐变机理研究进展[J]. 食品研究与开发, 2015, 36(6): 113-119. DOI:10.3969/ j.issn.1005-6521.2015.06.032.
[7] 王月晖, 徐洪宇, 张京芳, 等. 酿酒红葡萄多酚氧化酶活力及总酚含量[J]. 食品科学, 2013, 34(9): 47-51. DOI:10.7506/spkx1002-6630-201309011.
[8] OEENÑES-PINERO E, GARCÍA-CARMONA F, SÁNCHEZFERRER A. Latent polyphenol oxidase from quince fruit pulp (Cydonia oblonga): purification, activation and some properties[J]. Journal of the Science of Food and Agriculture, 2006, 86(13): 2172-2178. DOI:10.1002/jsfa.2593.
[9] ZHENG Yongju, SHI Junling, PAN Zhongli. Biochemical characteristics and thermal inhibition kinetics of polyphenol oxidase extracted from Thompson seedless grape[J]. European Food Research and Technology, 2012, 234: 607-616. DOI:10.1007/s00217-012-1664-4.
[10] ÜMIT ÜNAL M, ŞENER A. Effect of harvest year on biochemical properties of Narince grape (Vitis vinifera L. cv. Narince) polyphenol oxidase[J]. European Food Research and Technology, 2014, 238(4): 613-619. DOI:10.1007/s00217-013-2138-z.
[11] 田国政, 程超, 田莉, 等. 青蒿多酚氧化酶的酶学特性研究[J]. 食品科学, 2014, 35(19): 149-152. DOI:10.7506/spkx1002-6630-201419031.
[12] MISHRA B B, GAUTAM S, SHARMA A. Purification and characterisation of polyphenol oxidase (PPO) from eggplant(Solanum melongena)[J]. Food Chemistry, 2012, 134(4): 1855-1861. DOI:10.1016/j.foodchem.2012.03.098.
[13] COMUZZO P, ZIRONI R. Biotechnological strategies for controlling wine oxidation[J]. Food Engineering Reviews, 2013, 5(4): 217-229. DOI:10.1007/s12393-013-9071-6.
[14] FORTEA M I, LÓPEZ-MIRANDA S, SERRANO-MARTÍNEZ A,et al. Kinetic characterisation and thermal inactivation study of polyphenol oxidase and peroxidase from table grape (Crimson Seedless)[J]. Food Chemistry, 2009, 113(4): 1008-1014. DOI:10.1016/ j.foodchem.2008.08.053.
[15] ROBERT MARSELLÉS-FONTANET A, MARTÍN-BELLOSO O. Optimization and validation of PEF processing conditions to inactivate oxidative enzymes of grape juice[J]. Journal of Food Engineering,2007, 83(3): 452-462. DOI:10.1016/j.jfoodeng.2007.04.001.
[16] CASH J N, SISTRUNK W A, STUTTE C A. Characteristics of Concord grape polyphenoloxidase involved in juice color loss[J]. Food Science, 1976, 41: 1398-1402. DOI:10.1111/j.1365-2621.1976. tb01181.x.
[17] LEE C Y, SMITH N L, PENNESI A P. Polyphenoloxidase from DeChaunac grapes[J]. Journal of the Science of Food and Agriculture,1983, 34(9): 987-991.
[18] RAPEANU G, LOEY A V, SMOUT C, et al. Biochemical characterization and process stability of polyphenoloxidase extracted from Victoria grape (Vitis vinifera ssp. sativa)[J]. Food Chemistry,2006, 94(2): 253-261. DOI:10.1016/j.foodchem.2004.10.058.
[19] SIDDIQ M, SINHA N K, CASH J N. Characterization of polyphenoloxidase from Stanley plums[J]. Food Science, 1992, 57(5): 1177-1179. DOI:10.1111/j.1365-2621.1992.tb11292.x.
[20] PALMA-OROZCO G, MARRUFO-HERNÁNDEZ N A, SAMPEDRO J G, et al. Purification and partial biochemical characterization of polyphenol oxidase from mango (Mangifera indica cv. Manila)[J]. Journal of Agricultural and Food Chemistry, 2014, 62(40): 9832-9840. DOI:10.1021/jf5029784.
[21] ELLEN S L V, FABIANA C P, NATÁLIA M, et al. Isolation and characterization of latent and active polyphenoloxidase in BRS Clara (CNPUV 154-147×Centennial seedless) and BRS Morena(Marroo seedless×Centennial seedless) seedless table grapes[J]. Plant Physiology and Biochemistry, 2011, 49(11): 1251-1258. DOI:10.1016/ j.plaphy.2011.09.004.
[22] 曹健, 师俊玲. 食品酶学[M]. 郑州: 郑州大学出版社, 2011: 142-143.
[23] ÜNAL M Ü, ŞENER A. Determination of some biochemical properties of polyphenol oxidase from Emir grape (Vitis vinifera L. cv. Emir)[J]. Journal of the Science of Food and Agriculture, 2006, 86(14): 2374-2379. DOI:10.1002/jsfa.2627.
[24] BRADSHAW M P, BARRIL C, ANDREW C C, et al. Ascorbic acid: a review of its chemistry and reactivity in relation to a wine environment[J]. Critical Reviews in Food Science and Nutrition, 2011,51(6): 479-498. DOI:10.1080/10408391003690559.
[25] LIU Wei, ZOU Liqiang, LIU Junping, et al. The effect of citric acid on the activity, thermodynamics and conformation of mushroom polyphenoloxidase[J]. Food Chemistry, 2013, 140(1): 289-295. DOI:10.1016/j.foodchem.2013.02.028.
[26] 郭艳萍, 刘美林, 贺东亮, 等. 抑制剂对黑鸡心葡萄多酚氧化酶活性的影响[J]. 山西农业大学学报, 2014, 34(5): 476-480. DOI:10.3969/ j.issn.1671-8151.2014.05.019.
Comparative Enzymatic Kinetics of Polyphenol Oxidase from Different Grape Varieties
YAN Xiaoyu, DONG Zhe, WANG Shasha, ZHOU Yali, SU Pengfei, YUAN Chunlong*
(College of Enology, Northwest A&F University, Yangling 712100, China)
Abstract:The kinetic parameters K
mand v
max/K
mof polyphenol oxidase (PPO) from three Franco-American hybrid grape varieties namely “Guankou”, “Goldfinger”, “Huangmi” and two Vitis vinifera varieties i.e., Zexiang and seedless white were compared towards different substrates: catechol, 4-methylcatechol, catechin and caffeic acid as well as optimal pH and temperature, thermal stability, and the effect of inhibitors on PPO activity. Results showed that the affinity of PPO from five varieties grapes for catechol was significantly different, whereas no significant difference was observed when 4-methylcatechol, catechin and caffeic acid were used as substrates. The catalytic effi ciency of PPO from Franco-American hybrid grapes and Vitis vinifera for catechol was signifi cantly different while no signifi cant difference was observed when 4-methylcatechol, catechin and caffeic acid were used as substrates. The catalytic efficiency of PPO from “Guankou”grapes for catechin and caffeic acid was obviously higher than that of four other varieties of grapes. Among inhibitors tested, ascorbic acid and sodium metabisulfi te had stronger inhibition on PPO from all fi ve varieties. The inhibitory effect of sodium metabisulfi te on PPO from “Guankou” grapes was weaker than on PPO from four other varieties. Optimal pH and temperature of PPO from fi ve varieties of grapes had no signifi cant difference.
Key words:polyphenol oxidase; kinetic parameters; catalytic effi ciency; inhibition
DOI:10.7506/spkx1002-6630-201619036
中图分类号:Q554.1
文献标志码:A
文章编号:1002-6630(2016)19-0216-06
引文格式:
闫小宇, 董喆, 王沙沙, 等. 不同葡萄品种多酚氧化酶酶学特性比较[J]. 食品科学, 2016, 37(19): 216-221. DOI:10.7506/ spkx1002-6630-201619036. http://www.spkx.net.cn
YAN Xiaoyu, DONG Zhe, WANG Shasha, et al. Comparative enzymatic kinetics of polyphenol oxidase from different grape varieties[J]. Food Science, 2016, 37(19): 216-221. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619036. http://www.spkx.net.cn
收稿日期:2015-12-04
基金项目:西北农林科技大学校企合作项目(K403021407)
作者简介:闫小宇(1989—),女,硕士,主要从事葡萄酒氧化机制及其抑制氧化研究。E-mail:498332416@qq.com
*通信作者:袁春龙(1969—),男,副教授,博士,主要从事葡萄酒化学及葡萄酿酒副产物加工利用研究。
E-mail:yuanchl69@nwsuaf.edu.cn






