董毓玭,陈 责,宣 佳,贾 慧,赵大云*
(上海交通大学农业与生物学院,上海 200240)
摘 要:大豆蛋白肽具有显著的降血脂功效,但目前研究主要集中在小分子肽段,且对蛋白肽降血脂作用的分子机理探究较少。模拟豆腐蛋白的胃肠道消化,得到豆腐蛋白的体外消化物,按相对分子质量(M R)分为3 个级别:>10 000、3 000~10 000和<3 000,利用胆固醇胶束实验(采用两种实验基质及两种检测方法)检测其抑制膳食混合胶粒转运胆固醇的作用。结果表明,在分级的3 种豆腐消化物中,M R>10 000具有最强的抑制膳食混合胶粒转运胆固醇作用,其胆固醇胶束吸收率为62.40%,小于阳性对照(Val-Ala-Trp-Met-Tyr,其胆固醇胶束吸收率为68.41%),且M R>10 000豆腐消化物的抑制胶束转运胆固醇作用随着样品质量浓度增大呈先增强后减弱的趋势。此外,胆固醇胶束实验中采用的两种“膳食混合胶粒”的转运效果及两种检测方法的结果均具有一致性,说明豆腐蛋白消化物具有影响膳食混合胶粒转运和胆固醇吸收的作用。
关键词:豆腐;消化肽;膳食混合胶粒;胆固醇转运与吸收
人体内胆固醇等脂类组分的吸收是通过小肠肠液中的“膳食混合胶粒”(dietary mixed micelles,DMM)来转运吸收的。经过胃肠道蛋白酶等消化的豆腐蛋白在被进一步消化成小分子肽之前就已经接触到DMM从而影响胆固醇等脂类组分的转运和吸收。近年来研究发现大豆蛋白对于高脂蛋白血症的人群有明显降血脂的作用 [1-3]。González-Ortega等 [4]的研究指出,大豆来源的多肽LPYPR具有降胆固醇作用;Inoue等 [5]研究证明了3 种二肽的降甘油三酯作用;Nagaoka等 [6]报道相对分子质量(M R)<1 000的肽段Val-Ala-Trp-Met-Tyr具有降血脂作用。但目前对大豆蛋白消化物的研究主要集中在小分子肽,而对M R>3 000的大分子消化物的作用研究相对较少。且目前大豆蛋白及其酶解产物的降血脂作用研究主要通过细胞和动物实验来进行功能性判断 [7],鲜见对其分子机制进行深入的探讨。本研究探索豆腐蛋白在消化吸收过程中的消化肽对于DMM转运和吸收胆固醇等脂类组分的影响。
因此,本实验采用一种常见的豆制品——豆腐来进行体外消化模拟实验,得到豆腐蛋白体外消化物(tofu protein hydrolysates,TPH),进一步分为3 个不同M R级别的TPH:>10 000、3 000~10 000和<3 000。同时利用胆固醇胶束实验对其进行研究对比,来探讨TPH的抑制胶束转运胆固醇(disruption of the transportation of micellar cholesterols,DTMC)作用,从而基于胆固醇的小肠吸收机制来分析TPH的降胆固醇作用。在胆固醇胶束实验中,天然猪胆汁虽然成分复杂,但其具有更贴近人体胆汁状况和更易获取的优点;而人工胆固醇胶束溶液由于其成分简单,实验干扰小,亦是一种常用的实验基质 [8-9],所以本实验中采用了人工胶束和天然胆汁的对比实验,可增强实验的可靠性。此外,采用试剂盒法和高效液相色谱-蒸发光散射检测器(high performance liquid chromatography-evaporative light scattering detector,HPLC-ELSD)联用法对具有最强DTMC作用的TPH的量效关系进行探究,尝试建立更为精确的胆固醇检测方法,以期为胆固醇胶束溶解度的检测提供理论支持。
1.1 材料与试剂
老豆腐(蛋白质含量8.5%;脂肪含量5.1%) 上海清美绿色食品有限公司;猪胆 取自上海郊区一屠宰场。
胃蛋白酶、胰酶 美国Sigma公司;人工合成肽(Val-Ala-Trp-Met-Tyr,M R854.03) Synpeptide公司;胆固醇含量检测试剂盒 日本和光纯药工业株式会社;离心过滤器、0.22 μm滤膜 美国Millipore公司;96 孔板 美国Corning公司。
1.2 仪器与设备
旋转蒸发仪 步琦实验室设备(上海)贸易有限公司;台式离心机 德国艾本德(上海)贸易有限公司;高速台式冷冻离心机 上海卢湘仪器有限公司;超声波细胞粉碎机 上海比朗仪器有限公司;氮吹仪 上海安谱科学仪器有限公司;高效液相色谱系统(600 Controller 泵;717 Plus自动进样器;2996紫外检测器;Anpel LAG-5000G无油空气发生器) 美国Waters公司;ELSD 2000蒸发光散射检测仪 美国Alltech公司;冷冻干燥机 美国Labconco公司;酶标仪 瑞士帝肯公司。
1.3 方法
1.3.1 样品预处理
豆腐与70%乙醇等体积混匀。超声波萃取3~4 h,3 000 r/min离心15 min。弃去上清液,取下层沉淀于-18 ℃冷冻保藏。豆腐制品中除了蛋白质,还含有大豆异黄酮、植物甾醇等物质,它们在小肠被吸收并且也具有一定的生物活性 [10-11],所以需要预处理步骤去除干扰因素。
1.3.2 胃肠道消化模拟
加入1 mg/mL酶解底物——乙醇处理过的老豆腐,并用1 mol/L HCl溶液调节pH值至2.0。猪胃黏膜蛋白酶添加量为40 mg/g底物,于37 ℃酶解90 min。再用1 mol/L NaOH溶液调节pH值至8.0,猪胃黏膜蛋白酶添加量为40 mg/g底物,37 ℃酶解150 min。把模拟消化完成后的消化液沸水浴10 min灭酶活,再快速冷却至室温,并用1 mol/L HCl溶液调节pH值至4.6;待沉淀析出后,旋蒸去除多余的水溶液,6 000 r/min离心20 min。弃去下层沉淀,得到上清液,即胃肠道模拟酶解的消化液;取一半上清液冷冻干燥成粉末,为TPH;另一半上清液予以下面的超滤分级处理。
1.3.3 消化产物超滤分级
分别用3 000和10 000两种截留相对分子质量的离心过滤器,取胃肠道模拟酶解的消化上清液,分为3 个M R级别的TPH:>10 000、3 000~10 000、<3 000,分别冷冻干燥成粉末,备用。
1.3.4 分级产物的胆固醇胶束实验
1.3.4.1 天然猪胆汁预处理
屠宰场取新鲜猪胆4 只,刺破胆囊取胆汁于烧杯中。6 000 r/min离心20 min后,去沉淀(主要是组织残留细胞),取上清液用pH 7.4的缓冲溶液调节猪胆浓度至2 mmol/L,于-80 ℃冰箱冻藏备用。
1.3.4.2 胆固醇胶束实验
分别准确称量TPH以及3 个M R级别>10 000、3 000~10 000 TPH和<3 000的TPH,用去离子水溶解至300 mg/mL。取200 μL,加入1 800 μL稀释的胆汁胶束溶液,使得样品质量浓度为30 mg/mL,将得到的2 mL溶液常温振荡5 min混匀。37 ℃条件下,样品与胆汁胶束反应1 h。15 000 r/min离心20 min,取上清液1 mL用氯仿-甲醇溶液(2∶1,V/V)萃取。萃取物氮气吹干后,于高效液相进样检测其胆固醇含量。实验中取人工合成肽(Val-Ala-Trp-Met-Tyr)作为阳性对照;以不加任何样品的溶剂为空白组。
1.3.4.3 HPLC-ELSD法检测胆固醇含量
色谱条件:分析柱:Inertsil ODS-3(250 mm×4.6 mm,5 μm);柱温:50 ℃;流动相A:0.1%三氟乙酸水溶液;流动相 B:0.1%三氟乙酸-甲醇溶液;洗脱梯度:0~5 min,20% A,80% B;5~15 min,0% A,100% B;15~18 min,20% A,80% B;18~25 min,20% A,80% B;流速:1.0 mL/min;进样量:10 μL;在线脱气(氦气)速率:30 mL/min;HPLC-ELSD法检测条件:漂移管温度:52 ℃;氦气流速:1.6 mL/min;氦气压力:0.2 MPa;进样方式:不分流进样。实验条件参照文献[12-13]并结合实际检测进行了优化。
1.3.4.4 胆固醇吸收率计算
式中:S 1为空白组(不加任何样品的溶剂)胶束溶解度/(mg/mL);S 2为样品组胶束溶解度/(mg/mL)。
1.3.5 实验方法验证
1.3.5.1 人工胆固醇胶束溶液对比天然胆汁验证实验
按10 mmol/L牛磺胆酸钠、2 mmol/L胆固醇、5 mmol/L油酸、132 mmol/L氯化钠、15 mmol/L磷酸钠缓冲液(pH 7.4),超声波乳化20 min制备人工胆固醇胶束溶液,置于37 ℃、24 h过夜。称取M R>10 000 TPH用去离子水溶解至300 mg/mL。取200 μL,加入1 800 μL人工胆固醇胶束溶液中,使得样品质量浓度为30 mg/mL,将得到的2 mL溶液常温振荡5 min混匀。37 ℃条件下,样品与人工胆固醇胶束溶液反应1 h。15 000 r/min离心20 min,取上清液1 mL用氯仿-甲醇溶液(2∶1,V/V)萃取。萃取物氮气吹干后,于HPLC-ELSD进样检测其胆固醇含量。HPLC-ELSD条件和计算方法同1.3.4节。
1.3.5.2 试剂盒法验证HPLC-ELSD法检测胆固醇含量以及抑制胆固醇转运量-效关系实验
试剂盒法检测M R>10 000 TPH的量效关系。称取M R>10 000 TPH用去离子水分别溶解至100、300、600 mg/mL。分别取20 μL,加入180 μL人工胆固醇胶束溶液中,使得样品质量浓度为10、30、60 mg/mL,将得到的200 μL溶液常温振荡5 min混匀。37 ℃条件下,样品与人工胆固醇胶束溶液反应1 h。15 000 r/min离心20 min,取上清液2 μL,添加到每孔已有300 μL显色剂(试剂盒自带)的96 孔板上。37 ℃反应5 min,于酶标仪600 nm(700 nm辅波长)波长处检测其胆固醇含量。计算方法同1.3.4节。
HPLC-ELSD法检测M R>10 000 TPH的量效关系。称取M R>10 000 TPH用去离子水分别溶解至100、300、600 mg/mL。分别取200 μL,加入1 800 μL人工胆固醇胶束溶液中,使得样品质量浓度为10、30、60 mg/mL,将得到的2 mL溶液常温振荡5 min混匀。37 ℃条件下,样品与人工胆固醇胶束溶液反应1 h。15 000 r/min离心20 min,取上清液1 mL用氯仿-甲醇溶液萃取。萃取物氮气吹干后,于HPLC进样检测其胆固醇含量。HPLC-ELSD条件和计算方法同1.3.4节。
1.4 统计学分析
实验结果用
 表示,采用SPSS 17.0软件进行统计分析。用单因素方差分析(one-way analysis of variance,ANOVA)进行多重比较分析。
表示,采用SPSS 17.0软件进行统计分析。用单因素方差分析(one-way analysis of variance,ANOVA)进行多重比较分析。
2.1 HPLC-ELSD检测胆固醇含量
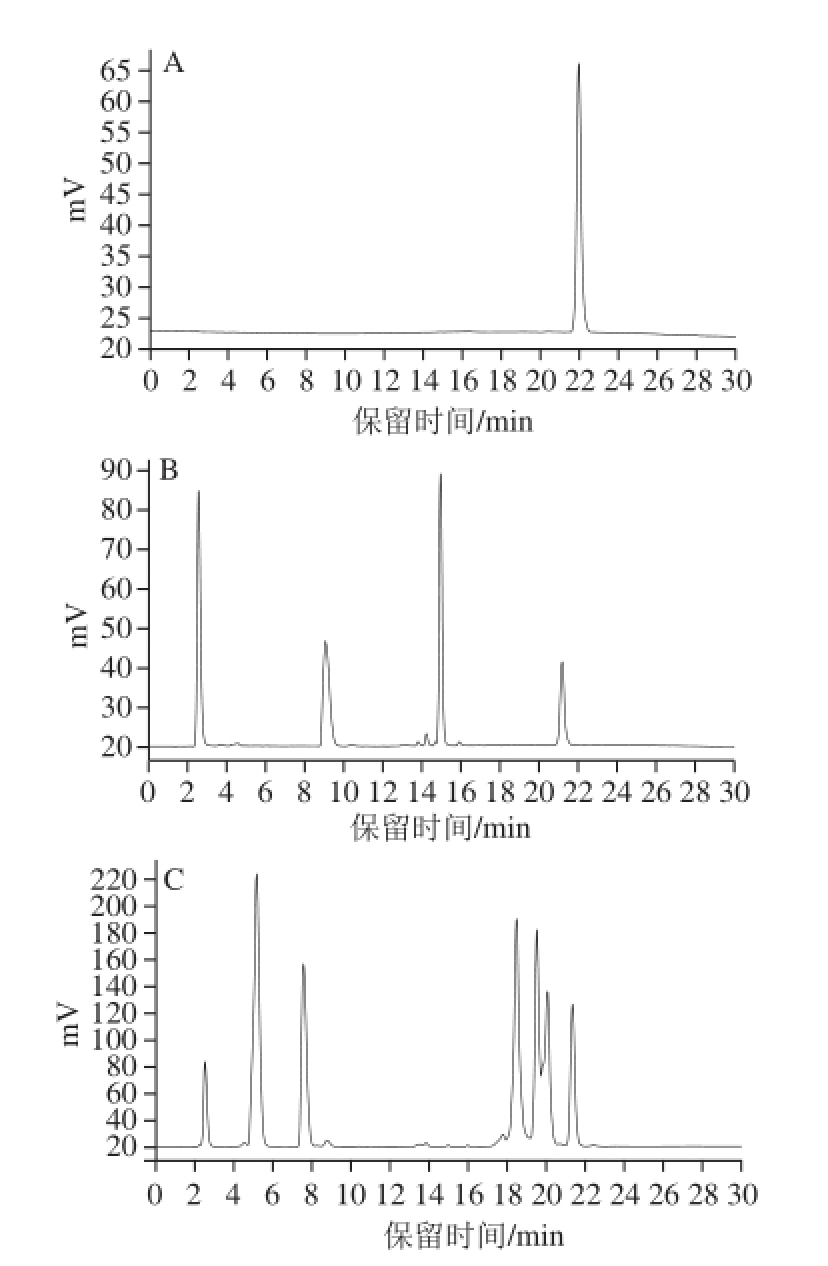
图1 HPLC-ELSD法检测标准品和样品中的胆固醇
Fig.1 Detection of cholesterol by HPLC with ELSD detector
A. 1.0 mg/mL胆固醇标准溶液;B. 人工胆固醇胶束溶液;C. 天然胆汁溶液。
从图1 HPLC-ELSD法的检测图谱中发现,1.0 mg/mL的胆固醇标准溶液在22 min时有电信号输出,可知胆固醇的保留时间为22 min。以光散射检测的电信号积分值作为纵坐标,以0.05、0.10、0.50、1.0、2.0、5.0 mg/mL这一系列胆固醇标准溶液的胆固醇含量对数值作为横坐标,得到标准曲线方程:y = 1.201 3x+5.835 1(R 2= 0.998 1)。同时图1B、C显示人工胆固醇胶束溶液和天然胆汁在22 min时也均有电信号输出,因此高效液相蒸发光散射检测联用法可用于胆固醇含量的检测,图谱基线稳定,峰形窄尖,检测结果直观可靠。
2.2 分级产物的抑制DTMC作用
大豆蛋白肽的降胆固醇作用可由抑制DTMC作用的增强而得到增强 [14-17],在人体小肠吸收时,只有形成胶束的胆固醇才可以被转运至肠细胞表面被人体吸收利用。胆固醇胶束溶解度即为溶液中形成胶束的胆固醇的含量。所以当添加样品后,胆固醇胶束被破坏,溶液中的胶束减少,可被人体吸收的胆固醇的量减少。胆固醇胶束溶解度越小,则样品的DTMC作用越强。胆固醇吸收率越低,则样品的DTMC作用越强。故实验中图表常以胆固醇胶束溶解度和胆固醇吸收率表征样品的DTMC作用。又因为血脂主要由人体血清中的胆固醇和甘油三酯构成,所以DTMC作用也起到一定的降血脂的作用。

图2 HPLC-ELSD法检测不同分子质量分级的TPH与人工合成肽的DTMC作用对比
Fig.2 Comparison of micellar cholesterol transportation-disrupting activity of TPH with different M
Rand a synthetic peptide by HPLC-ELSD
*. 与空白组相比差异显著(P<0.05);**. 与空白组相比差异极显著(P<0.01)。下同。
从图2的不同分子质量分级的酶解物(TPH)和TPH本身以及作为阳性对照的人工合成肽Val-Ala-Trp-Met-Tyr的检测结果来看,TPH均具有DTMC作用。TPH、M R>10 000 TPH、M R3 000~10 000 TPH和M R<3 000 TPH这4 种样品在添加量为30 mg/mL时其胆固醇胶束溶解度分别为(0.445±0.003)、(0.334±0.002)、(0.454±0.001)、(0.369±0.001) mg/mL(以空白胆固醇胶束溶解度(0.535±0.002) mg/mL计)。按DTMC作用由强到弱排序依次为M R>10 000 TPH、M R<3 000 TPH、TPH、M R3 000~10 000 TPH;其中M R<3 000 TPH与人工合成肽Val-Ala-Trp-Met-Tyr的DTMC作用相当,胆固醇胶束吸收率分别为(68.90±0.45)% 和(68.41±0.63)%。M R>10 000 TPH胆固醇胶束吸收率为(62.40±0.61)%,其DTMC作用最强。
在前人研究中也有类似发现,Lule等 [18]发现分子质量为5.5 kD的肽 Lunasin 具有潜在的抗氧化、抗炎症、抗癌变等多种生物活性,也在调节体内胆固醇生物合成方面有重要作用。Ishiguro等 [19]发现Kori-Tofu豆腐蛋白的高分子质量物质(high-molecular-weight fraction,HMF)的含量比大豆分离蛋白更大,从而可以表现出更好的降低胆固醇作用,并且物质的降胆固醇作用与其HMF含量这两者之间有着密切的联系。本实验结果(图2)与前述 [18-19]的实验发现具有一致性。这可能是由于随着胃肠道消化的进行,酶解大豆肽中具有破坏转运胆固醇胶束作用的氨基酸片段会被机体内胃或胰蛋白酶降解,而分子质量大的大豆肽较为完整地保留了这些特殊的片段。
2.3 实验方法验证
2.3.1 人工胆固醇胶束溶液对比天然胆汁验证实验
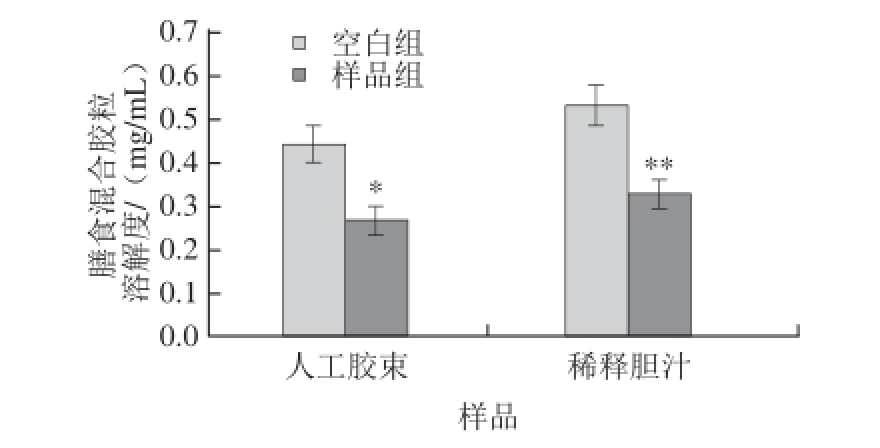
图3 人工胶束和稀释天然猪胆汁的HPLC-ELSD检测M
R>10 000 TPH的DTMC作用对比
Fig.3 Comparison of micellar cholesterol transportation-disrupting activity of M
R> 10 000 TPH with artificial micelles and swine bile by HPLC-ELSD
从图3人工胶束和稀释的天然胆汁的HPLC-ELSD检测对比来看,M R>10 000 TPH在添加量为30 mg/mL时,无论是人工胶束基质,还是稀释的天然猪胆汁均具有显著DTMC作用。所以,人工胶束和天然胆汁这两种基质具有较好的检测一致性,在方法上两者可相互验证。
2.3.2 试剂盒法验证HPLC-ELSD法检测胆固醇以及抑制胆固醇转运的量-效关系实验结果
试剂盒检测胆固醇含量是一种常见的检测方法,但当实验样本较大,试剂盒使用成本高;HPLC-ELSD检测虽然前期实验条件优化困难,但是对于大量样本较经济实惠。为了进一步保证HPLC检测的实验准确性,本实验采用的胆固醇含量试剂盒检测和HPLC-ELSD检测两种方法进行对比实验,也进而对M R>10 000 TPH的DTMC作用的量效关系进行了探究。
试剂盒中胆固醇含量和吸光度存在线性关系,以吸光度作为纵坐标,胆固醇含量为横坐标,得到标准曲线方程:y = 0.116 6x+0.011 6(R² = 0.998 2)。

图4 试剂盒法和HPLC-ELSD法检测不同质量浓度下M
R>10 000TPH的DTMC作用
Fig.4 Comparison of micellar cholesterol transportation-disrupting activity of M
R> 10 000 TPH with artificial micelles at different concentrations by kit and HPLC-ELSD
对比图4中试剂盒法和HPLC-ELSD法这两种检测方法的结果,可观察到一致性,相互验证了样品的DTMC作用。此外,可观察到当TPH添加量从10 mg/mL增加到30 mg/mL时,胆固醇吸收率有显著性下降。这可能是由于相同大小的空间内有了更多的TPH,增加了TPH与胆固醇胶束的接触机率,使得更多的胆固醇胶束被破坏 [20]。当以胆固醇吸收率表征时,胆固醇吸收率随着TPH质量浓度增大而下降,说明在实验中胆固醇胶束溶解度占空白组胆固醇胶束溶解度的比率越来越低,而空白组胆固醇胶束溶解度始终不变,所以溶液中胆固醇胶束减少,更少的胆固醇被人体小肠吸收利用,所以在一定范围内,TPH的DTMC作用随着TPH质量浓度的增大呈增强的趋势。然而,当TPH质量浓度从30 mg/mL增加到60 mg/mL时,胆固醇吸收率略微上升,表示TPH的DTMC作用减弱。这可能是由于当TPH质量浓度持续增大时,单位空间内的TPH过于饱和,反而会影响TPH与胆固醇胶束的相互作用,并不能使得更多的胆固醇胶束被破坏,没有增强DTMC的作用。
本实验发现豆腐消化产物TPH对DTMC具有抑制作用,表明豆腐经体外模拟消化后的产物仍具有较好的降胆固醇作用。实验还发现M R>10 000的大相对分子质量的TPH在各级TPH中具有最强的DTMC抑制作用,其胆固醇胶束吸收率为62.40%,优于阳性对照(其胆固醇胶束吸收率为68.41%),且M R>10 000 TPH的DTMC作用随着样品质量浓度增大呈先增强后减弱的趋势。人工胶束和天然胆汁的转运效果均较好,试剂盒法与HPLC-ELSD这两种检测方法的结果也是高度一致的,可相互验证样品的DTMC作用,也为胆固醇的精确定量检测提供了理论依据和技术支持,这对大豆制品降胆固醇的研究工作具有指导意义。
参考文献:
[1] WILCKE H L, HOPKINS D T, WAGGLE D H. Soy protein and human nutrition[M]. Amsterdam, Netherlands: Elsevier, 2012: 19-359.DOI:10.1016/B978-0-12-751450-5.50003-6.
[2] HARTMANN R, MEISEL H. Food-derived peptides with biological activity: from research to food applications[J]. Current Opinion in Biotechnology, 2007, 18(2): 163-169. DOI:10.1016/ j.copbio.2007.01.013.
[3] 刘恩岐, 巫永华, 张建萍, 等. 黑豆肽的分离纯化及其辅助降血脂作用[J]. 食品科学, 2011, 32(19): 248-252.
[4] GONZÁLEZ-ORTEGA O, LÓPEZ-LIMÓN A R, MORALESDOMÍNGUEZ J F, et al. Production and purifi cation of recombinant hypocholesterolemic peptides[J]. Biotechnology Letters, 2015, 37(1): 41-54. DOI:10.1007/s10529-014-1657-4.
[5] INOUE N, NAGAO K, SAKATA K, et al. Screening of soy proteinderived hypotriglyceridemic di-peptides in vitro and in vivo[J]. Lipids Health Disease, 2011, 10: 85. DOI:10.1186/1476-511X-10-85.
[6] NAGAOKA S, NAKAMURA A, SHIBATA H, et al. Soystatin(VAWWMY), a novel bile acid-binding peptide, decreased micellar solubility and inhibited cholesterol absorption in rats[J]. Bioscience,Biotechnology, and Biochemistry, 2010, 74(8): 1738-1741. DOI:10.1271/bbb.100338.
[7] ZHANG H, BARTLEY G E, ZHANG H, et al. Peptides identified in soybean protein increase plasma cholesterol in mice on hypercholesterolemic diets[J]. Journal of Agricultural and Food Chemistry, 2013, 61(35): 8389-8395. DOI:10.1021/jf4022288.
[8] KIRANA C, ROGERS P F, BENNETT L E, et al. Naturally derived micelles for rapid in vitro screening of potential cholesterol-lowering bioactives[J]. Journal of Agricultural and Food Chemistry, 2005,53(11): 4623-4627. DOI:10.1021/jf050447x.
[9] KIRANA C, ROGERS P F, BENNETT L E, et al. Rapid screening for potential cholesterol-lowering peptides using naturally derived micelle preparation[J]. Australian Journal of Dairy Technology, 2005, 60(2): 163-166.
[10] SMET E D, MENSINK R P, PLAT J. Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present[J]. Molecular Nutrition & Food Research, 2012,56(7): 1058-1072. DOI:10.1002/mnfr.201100722.
[11] CHÁVEZ-SANTOSCOY R A, TOVAR A R, SERNA-SALDIVAR S O,et al. Conjugated and free sterols from black bean (Phaseolus vulgaris L.) seed coats as cholesterol micelle disruptors and their effect on lipid metabolism and cholesterol transport in rat primary hepatocytes[J]. Genes & Nutrition, 2014, 9(1): 1-9. DOI:10.1007/s12263-013-0367-1.
[12] HSIEH Y, MERKLE K, WANG G, et al. High-performance liquid chromatography-atmospheric pressure photoionization/tandem mass spectrometric analysis for small molecules in plasma[J]. Analytical Chemistry, 2003, 75(13): 3122-3127. DOI:10.1021/ac0300082.
[13] OSADA K, RAVANDI A, KUKSIS A. Rapid analysis of oxidized cholesterol derivatives by high-performance liquid chromatography combined with diode-array ultraviolet and evaporative laser lightscattering detection[J]. Journal of the American Oil Chemists’ Society,1999, 76(7): 863-871. DOI:10.1007/s11746-999-0078-3.
[14] RUIZ J C R, ANCONA D A B, CAMPOS M R S. Bioactive vegetable proteins and peptides in lipid-lowering; nutraceutical potential[J]. Nutrición Hospitalaria, 2014, 4(29): 776-784. DOI:10.3305/ nh.2014.29.4.7208.
[15] UDENIGWE C C. Bioinformatics approaches, prospects and challenges of food bioactive peptide research[J]. Trends in Food Science & Technology, 2014, 36(2): 137-143. DOI:10.1016/ j.tifs.2014.02.004.
[16] IKEDA K, KITAGAWA S, TADA T, et al. Modification of yeast characteristics by soy peptides: cultivation with soy peptides represses the formation of lipid bodies[J]. Applied Microbiology and Biotechnology, 2011, 89(6): 1971-1977. DOI:10.1007/s00253-010-3001-9.
[17] ABETE I, GOYENECHEA E, ZULET M A, et al. Obesity and metabolic syndrome: potential benefit from specific nutritional components[J]. Nutrition, Metabolism and Cardiovascular Diseases,2011, 21: B1-B15. DOI:10.1016/j.numecd.2011.05.001.
[18] LULE V K, GARG S, POPHALY S D, et al. Potential health benefi ts of lunasin: a multifaceted soy-derived bioactive peptide[J]. Journal of Food Science, 2015, 80(3): R485-R494. DOI:10.1111/1750-3841.12786.
[19] ISHIGURO T, TATSUNOKUCHI S, MITSUI N, et al. Cholesterollowering effect of kori-tofu protein and its high-molecular-weight fraction content[J]. Bioscience, Biotechnology, and Biochemistry,2011, 75(3): 575-577. DOI:10.1271/bbb.100634.
[20] ZHANG H, YOKOYAMA W H, ZHANG H. Concentrationdependent displacement of cholesterol in micelles by hydrophobic rice bran protein hydrolysates[J]. Journal of the Science of Food and Agriculture, 2012, 92(7): 1395-1401. DOI:10.1002/jsfa.4713.
Disrupting Effect of Peptides Derived from in Vitro Digestion of Tofu Protein on the Transportation of Micellar Cholesterol
DONG Yupin, CHEN Ze, XUAN Jia, JIA Hui, ZHAO Dayun*
(School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China)
Abstract:Soy protein peptides have signifi cant hypocholesterolemic activity. But at present most studies are focused on small molecular peptides, and few explorations have been made on their hypolipidemic mechanism. In the present study, an in vitro gastrointestinal digestion model was applied to simulate the gastrointestinal digestion of tofu protein. The digested products were classifi ed into three levels: > 10 000, 3 000-10 000, and < 1 000, according to their molecular weights (M R). The effect of these digested products on disrupting the transportation of micellar cholesterol was explored based on dietary mixed micelles (DMM) experiments with two experimental matrixes and two test methods. The results indicated that the products with M R> 10 000 had the strongest suppressing effect on transportation of micellar cholesterol. The absorption rate of micellar cholesterol in their presence was 62.40%, which was superior to the positive control, VAWWMY (Val-Ala-Trp-Met-Tyr) with an absorption rate of micellar cholesterol of 68.41%. The effect of the products with M R> 10 000 was enhanced fi rst and then reduced with the increase in its concentration. In addition, the results of two cholesterol detection methods and the transportation effi ciencies of two cholesterol micelles were consistent. Peptides derived from in vitro digestion of tofu protein exerted a signifi cant inhibitory effect on the micellar solubility of cholesterol. The current work has provided the fi rst approach to exploring the potential effect of tofu protein hydrolysates (TPH) on reducing cholesterol absorption in the intestine.
Key words:tofu; digested peptides; dietary mixed micelles (DMM); cholesterol transport and absorption
DOI:10.7506/spkx1002-6630-201619039
中图分类号:TS214.2
文献标志码:A
文章编号:1002-6630(2016)19-0232-05
引文格式:
董毓玭, 陈责, 宣佳, 等. 豆腐蛋白体外消化物抑制胶束转运胆固醇作用分析[J]. 食品科学, 2016, 37(19): 232-236.
DOI:10.7506/spkx1002-6630-201619039. http://www.spkx.net.cn
DONG Yupin, CHEN Ze, XUAN Jia, et al. Disrupting effect of peptides derived from in vitro digestion of tofu protein on the transportation of micellar cholesterol[J]. Food Science, 2016, 37(19): 232-236. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201619039. http://www.spkx.net.cn
收稿日期:2015-12-06
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102207-6)
作者简介:董毓玭(1991—),女,硕士研究生,研究方向为功能性食品。E-mail:pennydong@qq.com
*通信作者:赵大云(1966—),男,副教授,博士,研究方向为功能性食品。E-mail:dyzhao@sjtu.edu.cn