李 赟 1,汪 芳 2,邹 伟 1,王雪松 1,蔡红燕 1,陈 轩 1,孙 威 1,沈汪洋 1,3,*
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉凯迪工程技术研究总院有限公司,湖北 武汉 430023;3.大宗粮油精深加工省部共建教育部重点实验室,湖北 武汉 430023)
摘 要:采用相溶解度法研究6-O-α-D-麦芽糖-β-环糊精(6-O-α-D-maltosyl-β-cyclodextrin,Mal-β-CD)和β-环糊精(β-cyclodextrin,β-CD)对槲皮素的包合效果,利用溶剂法制备Mal-β-CD与槲皮素的包合物,借助紫外光谱分析、红外光谱分析、扫描电子显微镜、X射线衍射、热重及差示扫描量热联用等分析手段研究该包合物的理化性质,并采用分子对接法建立了该包合物的超分子结构。结果表明:Mal-β-CD包合槲皮素的能力高于母体β-CD。分子对接结果表明,槲皮素是沿Mal-β-CD的大口端方向进入其疏水空腔形成包合物,二者间是通过氢键相连接的。较之母体β-CD,Mal-β-CD与槲皮素的包合效果更好,且包合后槲皮素的物相发生重大变化,热稳定性提高。
关键词:槲皮素;6-O-α-D-麦芽糖-β-环糊精;包合物;理化性质;分子对接
槲皮素是一种多功能性的天然膳食类黄酮 [1],广泛存在于苹果、葡萄、草莓、洋葱、花生、大豆、土豆、西兰花、茶及红酒中 [2-4]。研究表明,槲皮素具有抗花粉症、抗糖尿病、抗癌、抗病毒、抗炎、抗氧化、螯合金属离子、清除自由基、保护神经等多种特性 [5-11],对由腺苷二磷酸、胶原或凝血酶引起的血小板聚集及血栓有抑制作用 [12]。但槲皮素水溶性低(<7 μg/mL)、稳定性低,导致其生物利用率低,从而限制了其在食品行业中的应用 [13-14]。目前提高槲皮素水溶性的途径主要有形成微脂囊、胶团、环糊精包合等 [15-17],本研究采用与环糊精(cyclodextrin,CD)包合的途径来提高槲皮素的水溶性,从而提高其利用率。
CD是由数个葡萄糖残基以α-1,4糖苷键连接而成的环式低聚糖,由Villiers教授在1891年发现 [18]。CD具有疏水中腔和亲水外表面的特殊结构,这一特殊结构使其能够与多种无机或有机分子形成主客体复合物 [19],通过CD包合,客体分子的水溶性、化学稳定性可有效提高,且毒性有所降低。最常见的CD是分别由6、7、8 个葡萄糖残基组成的α-、β-和γ-CD。β-CD因具有价格低廉和可与客体分子完美契合的空腔尺寸(空腔深度为0.78 nm,直径为0.78 nm)的优点而在CD的包合中应用最为广泛 [20]。然而,有研究显示,β-CD能够与胆固醇、磷脂形成稳定的复合物,产生溶血作用,从而对细胞造成伤害,因此β-CD被禁止用于非肠道吸收方式给药 [21]。
6-O-α-D-麦芽糖-β-环糊精(6-O-α-D-maltosyl-βcyclodextrin,Mal-β-CD)是利用化学或生物酶法将麦芽糖基接枝到母体β-CD的6位羟基而得到的分支环糊精。该产物保留了母体β-CD的包合性能,且具有较母体β-CD更高的水溶性和安全性 [22]。
本实验采用相溶解度法研究β-CD和Mal-β-CD对槲皮素的包合效果,利用溶剂法制备槲皮素的包合物,借助紫外光谱分析、红外光谱分析、扫描电子显微镜、X射线衍射、热重法及差示扫描量热法、核磁共振等分析手段研究包合物的理化特征,以期扩大槲皮素在食品和医药领域中的应用。
1.1 材料与试剂
槲皮素(纯度98%)、β-CD(纯度≥97%,相对分子质量为1 134.98)、Mal-β-CD(纯度98%,相对分子质量为1 459.27) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
RET Basic 型恒温磁力搅拌器 广州仪科实验室技术有限公司;LGJ-10型冷冻干燥机 北京松源华兴科技发展有限公司;1260型高效液相色谱仪 美国Agilent公司;TU-1810PC型紫外-可见光光度计 北京普析通用仪器有限责任公司;NEXUS670型傅里叶红外光谱仪 美国尼高力仪器公司;S-3000N型扫描式电子显微镜 日本日立公司;7000型X射线衍射仪 日本岛津制作所;AscendTM 600MHZ型核磁共振波谱仪德国Bruker公司;STA449F3型热重/差热综合分析仪德国耐驰仪器制造有限公司。
1.3 方法
1.3.1 槲皮素/Mal-β-CD相溶解度的测定
槲皮素/Mal-β-CD相溶解度的测定参考文献[23]进行。称取5 mg槲皮素分别加入到不同浓度的β-CD和Malβ-CD溶液(0~10 mmol/L)中,制得混合溶液。将混合液在30 ℃条件下水浴振荡72 h,使反应达到动态平衡。取上清液,用孔径为0.45 μm的微孔滤膜过滤,上清液中槲皮素的浓度采用高效液相色谱法进行测定。用槲皮素浓度对CD浓度作图,得到包合物的相溶解度图。依据Higuchi-Connors方程计算得到表观稳定常数K s。
1.3.2 槲皮素/Mal-β-CD包合物的制备
称取1.824 1 g(1.25 mmol)Mal-β-CD,用40 mL 30%甲醇溶解,待其完全溶解后,加入0.075 6 g(0.25 mmol)槲皮素,30 ℃条件下水浴振荡72 h,之后4 000 r/s离心15 min,取上清液,除去甲醇,冷冻干燥,制得浅黄色固体,即为槲皮素/Mal-β-CD包合物。
1.3.3 槲皮素/Mal-β-CD物理混合物的制备
称取0.075 6 g槲皮素、1.824 1 g Mal-β-CD,室温条件下研磨搅拌均匀,制得槲皮素/Mal-β-CD物理混合物。
1.3.4 槲皮素/Mal-β-CD紫外光谱分析
称取适量的槲皮素、Mal-β-CD、槲皮素与Mal-β-CD物理混合物及包合物溶于甲醇中,在300~400 nm波长处测其紫外吸收光谱。
1.3.5 槲皮素/Mal-β-CD红外光谱分析
将适量槲皮素、Mal-β-CD、槲皮素与Mal-β-CD物理混合物及包合物用溴化钾压片,用傅里叶红外光谱仪记录其红外光谱。
1.3.6 槲皮素/Mal-β-CD扫描电子显微镜观察
将适量槲皮素、Mal-β-CD、槲皮素与Mal-β-CD物理混合物及包合物依照扫描电子显微镜操作要求制片后置于显微镜下观察。
1.3.7 X射线衍射分析
取适量槲皮素、Mal-β-CD、槲皮素与Mal-β-CD物理混合物及包合物在Cu靶/石墨单色器,管压40 kV,管流40 mA,在扫描范围为10~60 °条件下进行X射线衍射分析。
1.3.8 槲皮素/Mal-β-CD热重及差示扫描量热同步分析
取5 mg左右槲皮素、Mal-β-CD、槲皮素与Mal-β-CD包合物均匀平铺在坩埚中,用热重及差示扫描量热同步仪记录样品的热重及差示扫描量热曲线,测定条件为:氮气流速20 mL/min,扫描温度范围40~500 ℃,扫描速率10 ℃/min。
1.3.9 分子对接
在Hyperchem 8.0软件中构造槲皮素分子,结构运用分子力学方法MM +和半经验的量子化学方法AM1进行优化,Mal-β-CD的构建参考文献[24]进行,在β-CD小口端引入一个麦芽糖基。利用AUTODOCK4.2分子模拟软件对槲皮素和Mal-β-CD进行分子对接,设定autogrid box参数为60 Å×60 Å×60 Å,格间距参数为0.375 Å;采用拉马克遗传算法进行计算,其他参数均默认设置,对接20 次。
2.1 槲皮素/Mal-β-CD相溶解度实验分析

图1 槲皮素与CD的相溶解度
Fig. 1 Phase-solubility diagrams of inclusion complexes formed from quercetin and CDs
表1 槲皮素与CD间包合作用的表观稳定常数
Table 1 Apparent stability constants of the inclusion complex between quercetin and cyclodextrins
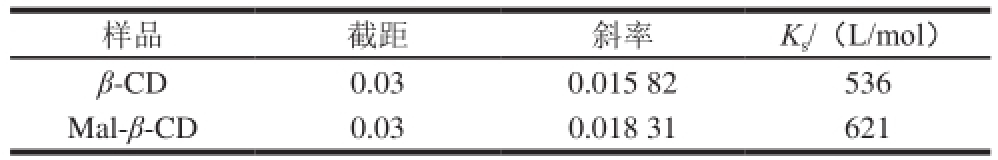
样品截距斜率K s/(L/mol)β-CD0.030.015 82536 Mal-β-CD0.030.018 31621
由图1可知,槲皮素溶解度与CD浓度呈线性关系,同浓度的Mal-β-CD对槲皮素的溶解性要大于β-CD。根据Higuchi-Connors原理,槲皮素与CD的结合比为1∶1,Mal-β-CD与槲皮素的K s(621 L/mol)高于β-CD与槲皮素的K s(536 L/mol),表明Mal-β-CD包合槲皮素的能力高于母体β-CD,这一现象可能是由于Mal-β-CD在水溶液中的稳定性高于β-CD引起。由于Mal-β-CD对槲皮素的溶解性和稳定性均优于β-CD,其对槲皮素的包合能力较好,又具有较高的安全性,所以选择Mal-β-CD与槲皮素进行包合。
2.2 槲皮素/Mal-β-CD紫外吸收光谱分析
由图2可知,槲皮素在370 nm波长处有紫外特征吸收峰,Mal-β-CD没有不饱和键,紫外吸收很弱,没有特征峰,槲皮素与Mal-β-CD的物理混合物的紫外吸收光谱与槲皮素相同,而二者包合物的紫外吸收特征峰与槲皮素紫外吸收特征峰相比,发生了蓝移,这可能是由于Mal-β-CD对槲皮素进入其空腔产生空间位阻使槲皮素分子结构的共轭效应减小导致的,由此表明槲皮素的共轭体系与Mal-β-CD之间发生了包合作用,两种物质间并不是简单的物理混合。

图2 槲皮素(a)、Mal-β-CD(b)、Mal-β-CD与槲皮素的物理混合物(c)及包合物(d)的紫外光谱
Fig. 2 Ultraviolet-visible spectroscopy quercetin(a), Mal-β-CD(b), and their mixture(c) and complex(d)
2.3 槲皮素/Mal-β-CD红外光谱分析

图3 槲皮素(a)、Mal-β-CD(b)、Mal-β-CD与槲皮素的物理混合物(c)及包合物(d)的红外光谱
Fig. 3 Infrared spectroscopy of quercetin (a), Mal-β-CD(b), and their mixture (c) and complex (d)
由图3可知,槲皮素具有羟基(3 409.25 cm -1)、羰基(1 662.49 cm -1)和C—H伸缩振动(1 262.74 cm -1)的特征吸收峰,Mal-β-CD具有羟基(3 409.37 cm -1)、亚甲基(2 928.04 cm -1)和糖苷键(1 026.77 cm -1)的特征吸收峰,槲皮素与Mal-β-CD的物理混合物的红外光谱为二者红外光谱的叠加,表明二者未发生相互作用,而槲皮素与Mal-β-CD的包合物在400~1 500 cm -1之间的红外光谱发生明显变化,其他扫描范围内未出现新的吸收峰,由此表明槲皮素与Mal-β-CD在形成包合物的过程中并未产生新的共价键。
2.4 槲皮素/Mal-β-CD扫描电子显微镜分析
扫描电子显微镜是利用电子与物质之间相互作用来测定样品的表面形态。槲皮素、Mal-β-CD、槲皮素与Mal-β-CD的物理混合物及包合物的表面形态如图4所示。

图4 槲皮素(a)、Mal-β-CD(b)、Mal-β-CD与槲皮素的物理混合物(c)及包合物(d)的电子显微镜图
Fig. 4 Scanning electron micrographs of quercetin(a), Mal-β-CD(b), and their mixture(c) and complex(d)
由图4可知,槲皮素的表面形态为针状结晶,Mal-β-CD则呈现出多孔的球状形态,在槲皮素与Mal-β-CD的物理混合物中,两种形态均能被观察到,而二者的包合物的表面形态则发生明显变化,呈无定形状态。
2.5 槲皮素/Mal-β-CD X射线衍射分析

图5 槲皮素(a)、Mal-β-CD(b)、Mal-β-CD与槲皮素的物理混合物(c)及包合物(d)的X射线衍射
Fig. 5 X-ray diffractometry patterns of quercetin (a), Mal-β-CD (b), and their mixture (c) and complex (d)
由图5可知,槲皮素的衍射峰较为尖锐,表明其形态为结晶状,而Mal-β-CD在13°和18°附近具有两个宽大的吸收峰,说明其结构中不含晶体结构,槲皮素与Mal-β-CD的物理混合物中,槲皮素的尖锐结晶衍射峰和Mal-β-CD的宽大衍射峰均有呈现,而二者的包合物中,槲皮素的尖锐结晶峰消失,其衍射图谱与Mal-β-CD类似,这说明包合物中槲皮素的物相发生重大变化,已完全分散于Mal-β-CD中。
2.6 槲皮素/Mal-β-CD热重及差示扫描量热同步分析
热重及差示扫描量热同步分析方法可同时测定样品在升温过程中的质量变化和吸放热 [25]。槲皮素的热重及差示扫描量热分析结果如图6a所示。由热重曲线可知,槲皮素在100 ℃之前质量有少量损失,温度继续升高时,质量仍然下降,对应的差示扫描量热曲线有两个很大的吸热峰,峰值温度分别为107.21 ℃和314.81 ℃,而槲皮素的熔点在314 ℃左右,由此说明槲皮素在其熔融之前已部分分解,熔融之后再进一步降解。Mal-β-CD的热重及差示扫描量热分析结果如图6b所示。由热重曲线可知,Mal-β-CD在300 ℃之前基本上没有质量损失,说明该吸热峰是由于样品水分挥发引起,在300~400 ℃之间质量损失严重,对应的差示扫描量热曲线在300~400 ℃之间有一个明显的吸热峰,峰值温度为314.02 ℃,由此可知该质量损失是由Mal-β-CD含碳分解物挥发引起,400 ℃之后样品质量基本稳定,说明Mal-β-CD降解完成。槲皮素与Mal-β-CD的包合物的热重及差示扫描量热分析结果如图6c所示,该包合物的热重和差示扫描量热曲线与Mal-β-CD的相同,槲皮素的差示扫描量热曲线的特征吸热峰消失,说明其不再以晶体形态存在,而是完全分散在Mal-β-CD中。在温度升至300 ℃时,包合物的质量开始发生严重损失,说明通过Mal-β-CD包合,槲皮素的热稳定性显著提高。

图6 槲皮素(a)、Mal-β-CD(b)、Mal-β-CD与槲皮素包合物(c)的热重及差示扫描量热图
Fig. 6 Thermogravimetric/differential scanning calorimetry curves of quercetin (a), Mal-β-CD (b) and their complex (c)
2.7 分子对接分析
本研究中,Mal-β-CD和槲皮素分别作为受体和配体,二者包合物的三维超分子结构利用分子模拟对接的方法获得(图7)。结果表明:槲皮素沿Mal-β-CD的大口端方向进入其疏水性空腔,其C环在空腔内,A环位于大口端处,B环位于小口端处,二者之间以分子间氢键来维持该超分子结构。
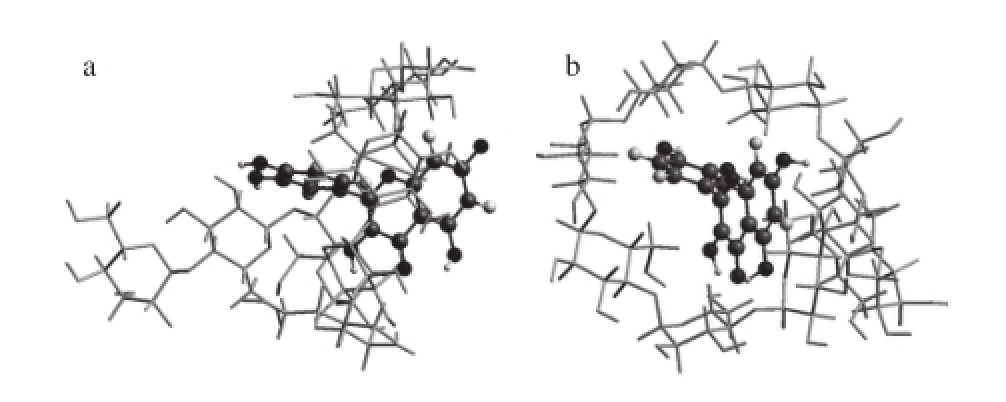
图7 槲皮素/Mal-β-CD复合物的三维超分子结构
Fig. 7 Three-dimensional supermolecular structure of quercetin/Mal-β-CD complex
研究结果表明Mal-β-CD对槲皮素的溶解性及稳定性均优于β-CD,对槲皮素具有较好的包合能力。通过溶剂法制得的槲皮素与Mal-β-CD的包合物不是简单的物理混合,而是槲皮素的共轭体系与Mal-β-CD之间发生了包合作用形成的,二者之间是以氢键来维持分子结构的。槲皮素与Mal-β-CD在形成包合物的过程中并未产生新的共价键,但包合物的表面形态及物相均发生了明显变化。经过包合,槲皮素的热稳定性也得到显著提高。
参考文献:
[1] HARISH S, VIKASH K, AMIT K S, et al. Isocitrate lyase of Mycobacterium tuberculosis is inhibited by quercetin through binding at N-terminus[J]. International Jounal of Biological Macromolecules, 2015, 78: 137-141. DOI:10.1016/j.ijbiomac.2015.04.005.
[2] GWI N C, JI H K, JI H K, et al. Effect of quercetin on learning and memory performance in ICR mice under neurotoxic trimethyltin exposure[J]. Food Chemistry, 2012, 132(2): 1019-1024. DOI:10.1016/ j.foodchem.2011.11.089.
[3] ESTHER P, ÁNGEL M, HAYLEY E, et al. Production of watersoluble quercetin formulations by antisolvent precipitation and supercritical drying[J]. The Journal of Supercritical Fluids, 2015, 104: 281-290. DOI:10.1016/j.supflu.2015.07.006.
[4] MOHAMED L T, SAMEHA M, BRUNO B, et al. Quercetin alleviates predator stress-induced anxiety-like and brain oxidative signs in pregnant rats and immune count disturbance in their offspring[J]. Pharmacology, Biochemistry and Behavior, 2013, 107(6): 1-10. DOI:10.1016/j.pbb.2013.03.009.
[5] BALABOLKIN I I, GORDEEVA G F, FUSEVA E D, et al. Use of vitamins in allergic illnesses in children (in Russian)[J]. Voprosy Meditsinskoi Khimii, 1992, 38(5): 36-40.
[6] COSKUN O, KANTER M, KORKMAZ A, et al. Quercetin, a flavonoid antioxidant, prevents and protects streptozotocin-induced oxidative stress and β-cell damage in rat pancreas[J]. Pharmacological Research, 2005, 51(2): 117-123. DOI:10.1016/j.phrs.2004.06.002.
[7] ZHANG X, XU Q, SAIKI I. Quercetin inhibits the invasion and mobility of murine melanoma B16-BL6 cells through inducing apoptosis via decreasing Bcl-2 expression[J]. Clinical & Experimental Metastasis, 2000, 18(5): 415-421. DOI:10.1023/A:1010960615370.
[8] SANYOG J, AMIT K J, MILIND P, et al. Novel self-emulsifying formulation of quercetin for improved in vivo antioxidant potential: implications for drug-induced cardiotoxicity and nephrotoxicity[J]. Free Radical Biology and Medicine, 2013, 65: 117-130. DOI:10.1016/ j.freeradbiomed.2013.05.041.
[9] JAFAR E N D, AHAD M, SEYED M G, et al. Synthesis, characterization and antioxidant property of quercetin-Tb(III) complex[J]. Advanced Pharmaceutical Bulletin, 2014, 4(2): 101-104. DOI:10.5681/apb.2014.016.
[10] YASUSHI N, HIROYUKI T. Quantitative analysis of quercetin using Raman spectroscopy[J]. Food Chemistry, 2011, 126(2): 751-755. DOI:10.1016/j.foodchem.2010.11.059.
[11] LU J, ZHENG Y L, LUO L, et al. Quercetin reverses D-galactose induced neurotoxicity in mouse brain[J]. Behavioural Brain Research, 2006, 171(2): 251-260. DOI:10.1016/j.bbr.2006.03.043.
[12] 邵伟, 王金山, 王春香, 等. 槲皮素-β-环糊精包合物的研究[J].高等学校化学学报, 1998, 19(7): 1101-1103. DOI:10.3321/ j.issn:0251-0790.1998.07.039.
[13] SURAYA J, OYAIS A C, GHULAM M R, et al. Investigation of antioxidant activity of quercetin (2-(3,4-dihydroxyphenyl)-3,5,7-trihydroxy-4H-chromen-4-one) in aqueous micellar media[J]. Food Research International, 2013, 51(1): 294-302. DOI:10.1016/ j.foodres.2012.12.022.
[14] 翟广玉, 马岩, 闫臻, 等. 槲皮素包合物的研究进展[J]. 化学与黏合, 2010, 32(4): 52-57. DOI:10.3969/j.issn.1001-0017.2010.04.015.
[15] PRALHAD T, RAJENDRAKUMAR K. Study of freeze-dried quercetin-cyclodextrin binary systems by DSC, FT-IR, X-ray diffraction and SEM analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 34(2): 333-339. DOI:10.1016/S0731-7085(03)00529-6.
[16] LIU W, GUO R. Interaction between flavonoid, quercetin and surfactant aggregates with different charges[J]. Journal of Colloid and Interface Science, 2006, 302(2): 625-632. DOI:10.1016/ j.jcis.2006.06.045.
[17] LANDI-LIBRANDI A P, CHRYSOSTOMO T N, MARZOCCHIMA CHADO C M, et al. Study of quercetin-loaded liposomes as potential drug carries: in vitro evaluation of human complement activation[J]. Journal of Liposome Research, 2012, 22(2): 89-99. DOI:10.3109/0898 2104.2011.615321.
[18] LORENZ R T, CYSEWSKI G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-166. DOI:10.1016/S0167-7799(00)01433-5.
[19] ARUMUGAM S P, JEYACHANDRAN S, BASKARALINGAM V, et al. Improvement on dissolution rate of inclusion complex of Rifabutin drug with β-cyclodextrin[J]. International Journal of Biological Macromolecules, 2013, 62: 472-480. DOI:10.1016/ j.ijbiomac.2013.09.006.
[20] PARAMASIVAGANESH K, SRINIVASAN K, MANIVEL A, at al. Studies on inclusion complexation between 4,4’-dihydroxybiphenyl and β-cyclodextrin by experimental and theoretical approach[J]. Journal of Molecular Structure, 2013, 1048: 399-409. DOI:10.1016/ j.molstruc.2013.04.072.
[21] BELLRINGER M E, SMITH T G, READ R, et al. β-Cyclodextrin: 52-week toxicity studies in the rat and dog[J]. Food and Chemical Toxicology, 1995, 33(5): 367-376. DOI:10.1016/0278-6915(94)00149-I.
[22] 崔波. 麦芽糖基-β-环糊精的酶法合成及其性质和应用研究[D]. 无锡: 江南大学, 2011: 7.
[23] LIU B, LI W, ZHAO J, et al. Physicochemical characterisation of the supramolecular structure of luteolin/cyclodextrin inclusion complex[J]. Food Chemistry, 2013, 141(2): 900-906. DOI:10.1016/ j.foodchem.2013.03.097.
[24] EID E E M, ABDUL A B, SULIMAN F E O, et al. Characterization of the inclusion complex of zerumbone with hydroxypropylβ-cyclodextrin[J]. Food Chemistry, 2011, 83(4): 1707-1714. DOI:10.1016/j.carbpol.2010.10.033.
[25] 刘本国, 张瑞婷, 吴晓楠, 等. 橙皮苷/羟丙基-β-环糊精包合物的理化性质研究[J]. 现代食品科技, 2013, 29(10): 2349-2352. DOI:10.13982/j.Mfst. 1673-9078. 2013.10.023.
Physicochemical Properties of Inclusion Complex of Quercetin with 6-O-α-D-Maltosyl-β-Cyclodextrin
LI Yun
1, WANG Fang
2, ZOU Wei
1, WANG Xuesong
1, CAI Hongyan
1, CHEN Xuan
1, SUN Wei
1, SHEN Wangyang
1,3,*
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Wuhan Kaidi General Research Institute Engineering&Technology Co. Ltd., Wuhan 430023, China; 3. Key Laboratory of the Deep Processing of Bulk Grain and Oil Authorized, Ministry of Education, Wuhan 430023, China)
Abstract:In this study, the inclusion efficiency of 6-O-α-D-maltosyl-β-cyclodextrin (Mal-β-CD) and β-cyclodextrin (β-CD) for quercetin was studied by the phase solubility method, and the inclusion complex of quercetin with Mal-β-CD was prepared by the solvent method. The physicochemical properties of the inclusion complex were studied by ultravioletvisible spectroscopy, infrared spectroscopy, scanning electron microscope, X-ray diffractometry, and thermogravimetric/ differential scanning calorimetry. The molecular docking method was also applied to study the three-dimensional supermolecular structure of the complex. The results showed that the inclusion efficiency of Mal-β-CD was superior to β-CD. The results of molecular docking showed that quercetin could enter the hydrophobic cavity from the wide rim of G2-β-CD to form a super-molecular structure. Quercetin and Mal-β-CD were connected by hydrogen bonds. Compared with β-CD, Mal-β-CD exhibited higher inclusion efficiency, resulting in significantly changed physicochemical properties and improved stability of quercetin.
Key words:quercetin; 6-O-α-D-maltosyl-β-cyclodextrin; inclusion complex; physicochemical property; molecular docking
DOI:10.7506/spkx1002-6630-201621007
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)21-0038-05
引文格式:
李赟, 汪芳, 邹伟, 等. 槲皮素与6-O-α-D-麦芽糖-β-环糊精包合物的理化表征[J]. 食品科学, 2016, 37(21): 38-42.
DOI:10.7506/spkx1002-6630-201621007. http://www.spkx.net.cn
LI Yun, WANG Fang, ZOU Wei, et al. Physicochemical properties of inclusion complex of quercetin with 6-O-α-D-maltosylβ-cyclodextrin[J]. Food Science, 2016, 37(21): 38-42. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621007. http://www.spkx.net.cn
收稿日期:2016-03-02
基金项目:国家自然科学基金青年科学基金项目(31301415)
作者简介:李赟(1990—),女,硕士研究生,研究方向为食品生物化学。E-mail:shuang7061234@163.com
*通信作者:沈汪洋(1978—),男,副教授,博士,研究方向为食品生物化学。E-mail:whwangyangshen@126.com