6 种食品防腐剂对金黄色葡萄球菌抑菌效果及肠毒素基因表达的影响
王 琼,唐俊妮
*,汤 承,陈 娟
(西南民族大学生命科学与技术学院,四川 成都 610041)
摘 要:目的:探索6 种食品防腐剂——亚硝酸盐、苯甲酸钠、ε-聚赖氨酸、壳聚糖、茶多酚、Nisin对1 株引起食物中毒的金黄色葡萄球菌SA003的抑菌作用,以及对该菌株所含不同肠毒素基因在mRNA水平表达的影响。方法:按照GB 2760—2014《食品添加剂使用标准》限量标准的质量浓度,分别添加6 种不同的防腐剂在金黄色葡萄球菌SA003初始接菌量约为10
5CFU/mL的TSB液体培养基中,37 ℃培养24 h后进行菌落计数;同时收集菌体用于RNA提取,将提取的RNA进行反转录后,采用荧光定量聚合酶链式反应方法检测各肠毒素基因在mRNA水平上的相对表达量。结果:在国标最大限量条件下,不同添加剂对金黄色葡萄球菌SA003的抑菌作用强弱顺序分别为:Nisin>茶多酚>壳聚糖>ε-聚赖氨酸>苯甲酸钠>亚硝酸盐。6 种防腐剂均能抑制肠毒素sea、sed、seg、sei、selj、selm、selr和selu基因在转录水平上的表达,但作用效果存在差异。结论:在TSB液体培养基中添加一定剂量的防腐剂不仅能抑制金黄色葡萄球菌的生长,还能够显著降低肠毒素基因的表达量。
关键词:食品防腐剂;金黄色葡萄球菌;肠毒素基因;表达?
葡萄球菌肠毒素是由金黄色葡萄球菌分泌的一类具有超抗原活性、耐高温、对胃蛋白酶以及胰蛋白酶均具有很好耐消化能力的胞外蛋白,误食由金黄色葡萄球菌污染的食物可能会引起食物中毒
[1]。欧盟发布的2013年食源性疾病的报告中,由金黄色葡萄球菌肠毒素引起的食物中毒占所有食源性疾病爆发的7.4%
[1]。目前,已经检测发现的葡萄球菌肠毒素基因有24 种,由它们编码的蛋白分别命名为传统肠毒素SEA~SEE,以及新型肠毒素SEG~SElY
[2-4]。
我国现行的GB 2760—2014《食品添加剂使用标准》中规定的常见食品防腐剂主要有硝酸盐、苯甲酸钠、山梨酸钾、多酚类、壳聚糖、细菌素、抗菌肽等
[5]。针对金黄色葡萄球菌抑菌方面现有的研究认为,在液体培养基环境中添加一定剂量的山梨酸钾、茶多酚、ε-聚赖氨酸、肉桂醛等能够有效抑制金黄色葡萄球菌的生长
[6-9];学者还发现防腐剂能影响葡萄球菌肠毒素的表达,如Braga等
[10]采用0.05%的石榴提取液处理金黄色葡萄球菌,发现石榴提取液的活性成分能够抑制肠毒素SEA的产生;Souza等
[11]发现亚致死剂量浓度的香芹酚和百里酚能够破坏金黄色葡萄球菌的细胞质膜,导致蛋白质分泌受阻,从而抑制肠毒素产生;Azizkhani等
[12]发现野蔷薇精油能够降低肠毒素sea、sec、see和agrA等基因的转录,从而降低肠毒素产生;Handayani等
[13]从木瓜叶中提取的生物碱对肠毒素sea的表达具有抑制作用。上述这些研究一方面证实了部分防腐剂能够抑制金黄色葡萄球菌的生长,另一方面还可抑制部分传统肠毒素的产生和基因表达。由于菌株的特异性和所含基因的种类差异,为了进一步了解常用防腐剂对金黄色葡萄球菌的抑菌效果以及对更多的新型肠毒素基因表达的影响,本实验拟采用一株引起食物中毒的金黄色葡萄球菌分离菌株SA003作为待测菌株,探究6 种常用防腐剂对SA003的抑菌效果,以及对SA003携带的传统肠毒素和新型肠毒素基因转录水平的影响,为防控由金黄色葡萄球菌引起的食物中毒提供更加丰富的基础数据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
金黄色葡萄球菌,分离自重庆市第三人民医院食物中毒患者的呕吐物。在实验室里进一步采用Baird-Parker平板、染色镜检、耐热核酸酶以及血浆凝固酶实验,针对16S rDNA和nuc基因采用聚合酶链式反应(polymerase chain reaction,PCR)扩增进行验证,菌株符合金黄色葡萄球菌所有典型特征,将其命名为SA003,采用常规PCR将该菌株的肠毒素基因进行检测,该菌株包含2 种传统肠毒素基因sea和sed以及6种新型肠毒素基因seg、sei、selj、selm、selr、selu。
1.1.2 试剂与培养基
亚硝酸盐 四川金山制药有限公司;苯甲酸钠、乳酸链球菌素(nisin) 河南千志商贸有限公司;ε-聚赖氨酸 郑州天峰食品科技有限公司;水溶性壳聚糖 郑州天和生物科技有限公司;茶多酚 河南绿邦生物技术有限公司;所有防腐剂均为食品级添加剂。
胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB)及其固体培养基(tryptic soy agar,TSA)、Baird-Parker(BP)琼脂培养基 青岛海博生物技术有限公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 美国Amresco公司;细菌总RNA提取试剂盒、溶菌酶 天根生化科技有限公司;RevertAid First Strand cDNA Synthesis Kit 美国Thermo Scientific公司;SsoAdvanced SYBR Green Supermix 美国Bio-Rad公司。
1.1.3 仪器与设备
5804R型冷冻离心机 德国Eppendorf公司;HZQ-F160全温振荡培养箱 上海齐欣科学仪器有限公司;Tsnenen031445 PCR仪、CFX96荧光定量PCR仪美国Bio-Rad公司;BioSpec-nano230V核酸测定仪 日本岛津公司。
1.2 方法
1.2.1 菌株纯化及菌悬液配制
将-70 ℃保存的金黄色葡萄球菌SA003菌株解冻后在BP培养基上划线,37 ℃条件下恒温培养24 h,挑选单菌落于TSB培养基中,在37 ℃、150 r/min条件下恒温振荡培养过夜,平板计数测定菌体浓度,将培养液稀释成菌体浓度约为10
5CFU/mL的菌悬液,4 ℃冰箱暂存备用。
1.2.2 抑菌活性测定
根据GB 2760—2014规定的亚硝酸钠、ε-聚赖氨酸、壳聚糖、苯甲酸钠、茶多酚以及Nisin 6种防腐剂最大使用量0.15、0.25、6.00、2.00、0.80 g/L以及0.50 g/L的要求,采用无菌水配制10倍上述最大使用量的添加剂溶液,无菌过滤,4 ℃冰箱暂存备用。在含有8.9 mL灭菌TSB的试管中,分别加入1.0 mL各配制质量浓度的防腐剂溶液以及0.1 mL SA003菌悬液;不加防腐剂的空白对照组用无菌水代替防腐剂,不含菌液的阴性对照组用无菌TSB代替菌液,共计8 组,每组设3 次平行。将上述体系充分混匀后,于37 ℃条件下,150 r/min恒温振荡培养24 h。取出培养后的试管,充分振荡混匀,平板计数确定金黄色葡萄球菌在6 种防腐剂最大使用量下的生长情况。若在最大使用量下培养液未见浑浊,则采用二倍稀释法对配制的添加剂进行稀释,再按照上述方法培养和计数。
1.2.3 菌体收集及RNA提取
通过预实验,确定24 h收集菌体。收集金黄色葡萄球菌SA003在添加6种防腐剂以及不添加任何防腐剂作用下的7 组实验样本的所有24 h培养液,4 ℃、12 000 r/min离心2 min,弃上清液,菌体于-70 ℃冰箱保存备用。在进行RNA提取时,先将试剂和耗材均用DEPC水处理,样本在冰上解冻后用500 μL的1×TE缓冲液重悬菌体,加入溶菌酶37 ℃作用过夜,然后根据细菌总RNA提取及纯化试剂盒操作要求提取细菌总RNA。
1.2.4 反转录以及荧光定量PCR
以上述提取的7 组样本的金黄色葡萄球菌SA003总RNA分别为模板,采用RevertAid First Strand cDNA合成试剂盒将RNA反转录为cDNA。具体操作按照试剂盒说明书,反应体系20 µL,反应条件为42℃、60 min,然后70℃、5 min。得到的cDNA产物采用BioSpec-nano230V核酸测定仪进行核酸浓度定量测定。
荧光定量PCR反应采用SYBR荧光定量试剂盒在CFX96 PCR仪上进行,每个样品各做3 次平行。荧光定量PCR的反应体系为10 µL,包括SYBR Green Supermix 5 µL,各肠毒素正、反向引物(10 µmol/L)各0.5 µL,cDNA模板1 µL,RNase free water 3 µL。用于荧光定量的各肠毒素引物详见表1,由上海生工生物工程有限公司合成。
表1 用于荧光定量PCR的各肠毒素引物序列
Table 1 Primer sequences of SE genes for real-time PCR analysis

引物名称引物序列(5’→3’)理论扩增长度/bp参考文献sea-FCCTTTGGAAACGGTTAAAAC128[14] sea-RCTCTGMACCTTYCCATCAAA sed-FTCAATTTGTGGATAAATGGTGTAC154[14] sed-RTTTCCTCCGAGAGTATCATTAT seg-FGGTTGTTGTATGTATGGTGGTC168本实验seg-RCCAGTGTCTTGCTTTGTAATCT sei-FTGCCTTTACCAGTGTTATT176本实验sei-RAGGACAATACTTAAATTCTGCT selj-FGGTTTTCAATGTTCTGGTGGTA167本实验selj-RTAGTTCTTGAATGGTTACTTTTT selm-FAATCACCTGCTAATGTAACTC159本实验selm-RATCATCTTTCGCATCAATTAG selr-FCAGTAAGTGCTAAACCAGATCC120本实验selr-RCTGCTATTACCGCTTTATCCT selu-FTGAAAAACATAACAGCACAAG100本实验selu-RCCAGACTCATAAGGCGAAC ftsz-FTGAAGATGCAATCCAAGGTG 116[15] ftsz-RGTTAATGCGCCCATTTCTTT
荧光定量PCR退火温度探索:将上述反应体系按照95℃ 2 min、95 ℃ 30 s、55~65℃(共设置8个温度梯度)30 s,39个循环进行荧光定量PCR。反应结束后,选择熔解曲线尖锐且Ct值较小的体系所对应的温度为各肠毒素的最佳退火温度(T*),然后将各肠毒素在T*对应的扩增产物作为模板(采用BioSpec-nano230V核酸测定仪测定核酸浓度),10倍稀释成8个梯度,反应条件为95℃ 2 min、95 ℃ 10 s、T* 30 s,39个循环,获得各不同肠毒素基因荧光定量PCR的标准曲线。针对金黄色葡萄球菌SA003所有反转录cDNA的扩增同样按照上述条件进行,从而得到各肠毒素在24 h取样点对应的Ct值。
1.2.5 荧光定量数据处理
以ftsZ作为内标基因
[14],各肠毒素基因作为目标基因,SA003添加6种防腐剂样本作为测试样本(sample),不添加防腐剂的对照样本作为校准样本(control),每个目标基因分别做3个重复。采用改良的2-Δ ΔCt法
[16],按下式计算8种肠毒素基因在6种不同防腐剂作用下的相对表达量(R
control/sample)。
式中:E
SEs、E
ftsz分别为各引物的扩增效率E值+1,E值是各目标基因荧光定量标准曲线的斜率(slope),由公式E=10
-1/slope-1计算得出
[16]。将各目标基因在防腐剂作用下的表达数值进行标准化,从而计算出SA003菌株8种肠毒素基因在6种不同防腐剂作用下的相对表达量。
1.3 统计分析
各组菌体培养24 h后的平板计数结果以
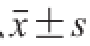 表示。SA003各肠毒素的表达分析根据荧光定量标准曲线和Ct值的对应情况,用Excel软件进行初步整理后,使用SPSS 18.0数据分析软件处理各肠毒素在不同时间段mRNA的相对表达量,以
表示。SA003各肠毒素的表达分析根据荧光定量标准曲线和Ct值的对应情况,用Excel软件进行初步整理后,使用SPSS 18.0数据分析软件处理各肠毒素在不同时间段mRNA的相对表达量,以
 表示,组内计量资料比较采用单因素方差分析(analysis of Variance,ANOVA),Duncan’s方法比较组内差异性,以P<0.05为差异具有统计意义。
表示,组内计量资料比较采用单因素方差分析(analysis of Variance,ANOVA),Duncan’s方法比较组内差异性,以P<0.05为差异具有统计意义。
2 结果与分析
2.1 6 种不同防腐剂对金黄色葡萄球菌SA003的抑菌活性比较
表2 添加6 种不同防腐剂对金黄色葡萄球菌SA003生长的影响
Table 2 Inhibitory effect of six food antiseptics on the growth of S. aureusSA003
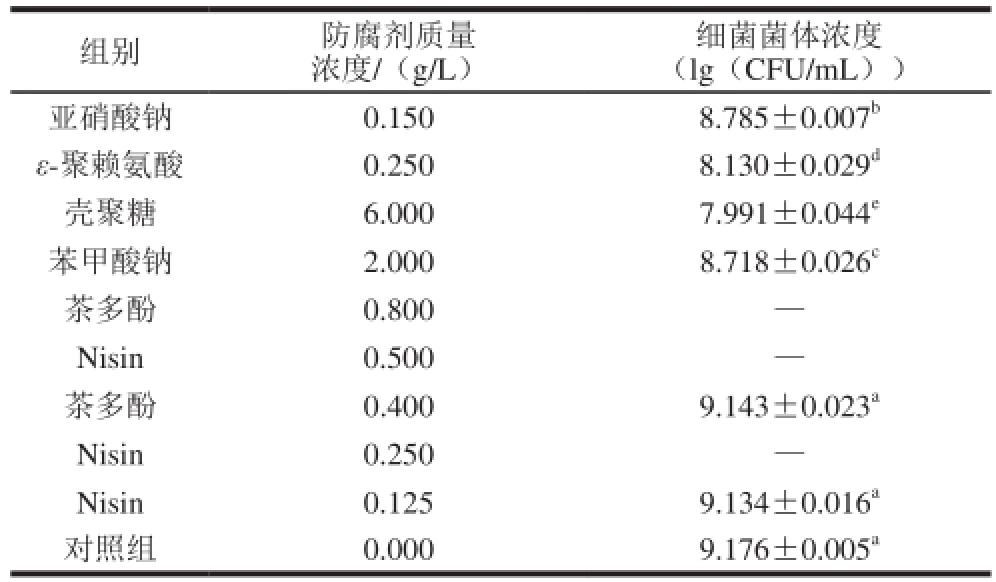
注:—.不生长;同列肩标不同字母代表差异显著(P<0.05)。
细菌菌体浓度(lg(CFU/mL))亚硝酸钠0.1508.785±0.007
bε-聚赖氨酸0.2508.130±0.029
d壳聚糖6.0007.991±0.044
e苯甲酸钠2.0008.718±0.026
c茶多酚0.800—Nisin0.500—茶多酚0.4009.143±0.023
aNisin0.250—Nisin0.1259.134±0.016
a对照组0.0009.176±0.005
a组别防腐剂质量浓度/(g/L)
当亚硝酸钠、ε-聚赖氨酸、壳聚糖、苯甲酸钠、茶多酚以及Nisin 6种食品添加剂采用国标最大限量作用于金黄色葡萄球菌SA003时,培养24 h进行平板计数,金黄色葡萄球菌SA003的生长情况详见表2。最大限量的亚硝酸钠、ε-聚赖氨酸、壳聚糖以及苯甲酸钠对金黄色葡萄球菌SA003的生长均有抑制作用,且相对于不添加任何防腐剂的对照组抑制效果显著(P<0.05)。同时发现,当在金黄色葡萄球菌SA003培养基中添加茶多酚和Nisin分别为0.8 g/L与0.5 g/L时,培养24 h试管中的培养液澄清未见浑浊,说明茶多酚和Nisin在国标最大限量时完全能够抑制金黄色葡萄球菌SA003的生长。进一步对茶多酚和Nisin进行2倍稀释,发现当Nisin质量浓度为0.25 g/L时,金黄色葡萄球菌SA003的生长依旧被完全抑制。茶多酚质量浓度为0.4 g/L时,对金黄色葡萄球菌SA003存在微弱抑菌效果,但抑菌作用不明显(P>0.05);进一步2倍稀释Nisin,使其质量浓度为0.125 g/L,发现Nisin对金黄色葡萄球菌SA003也存在微弱抑菌作用,但抑菌效果不明显(P>0.05)。比较6种防腐剂在国标最大限量作用下,对金黄色葡萄球菌SA003的抑菌作用强弱顺序为:Nisin(0.50 g/L)>茶多酚(0.80 g/L)>壳聚糖(6.00 g/L)>ε-聚赖氨酸(0.25 g/L)>苯甲酸钠(2.00 g/L)>亚硝酸盐(0.15 g/L)。可以看出,实验中生物防腐剂(Nisin、茶多酚、壳聚糖、ε-聚赖氨酸)较化学防腐剂(苯甲酸钠、亚硝酸盐)对金黄色葡萄球菌SA003生长抑制效果要好一些。
2.2 6种防腐剂对金黄色葡萄球菌SA003不同肠毒素在mRNA转录水平的影响
通过荧光定量PCR分析,得到金黄色葡萄球菌SA003携带8 种肠毒素基因以及内标基因的退火温度及标准曲线相关参数见表3。除了sei基因的最佳退火温度为63.3 ℃,其余各肠毒素基因以及内标基因的最佳退火温度均为61.4 ℃。
表3 各金黄色葡萄球菌SA003肠毒素基因荧光定量PCR的相关参数
Table 3 Reference values for real time-PCR of SE genes
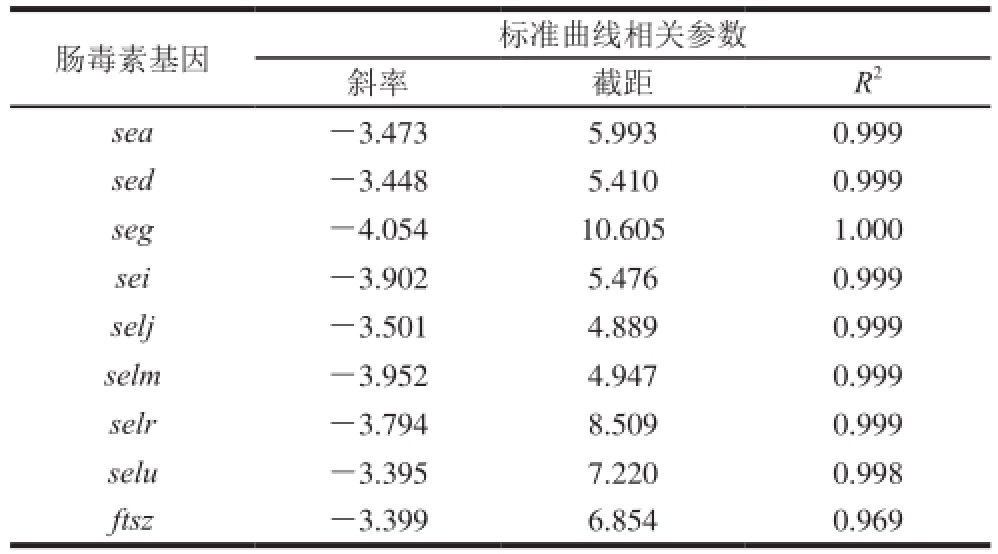
注:sei基因的退火温度为63.3 ℃,其他肠毒素基因退火温度均为61.4 ℃。
肠毒素基因标准曲线相关参数斜率截距R
2sea-3.4735.9930.999 sed-3.4485.4100.999 seg-4.05410.6051.000 sei-3.9025.4760.999 selj-3.5014.8890.999 selm-3.9524.9470.999 selr-3.7948.5090.999 selu-3.3957.2200.998 ftsz-3.3996.8540.969
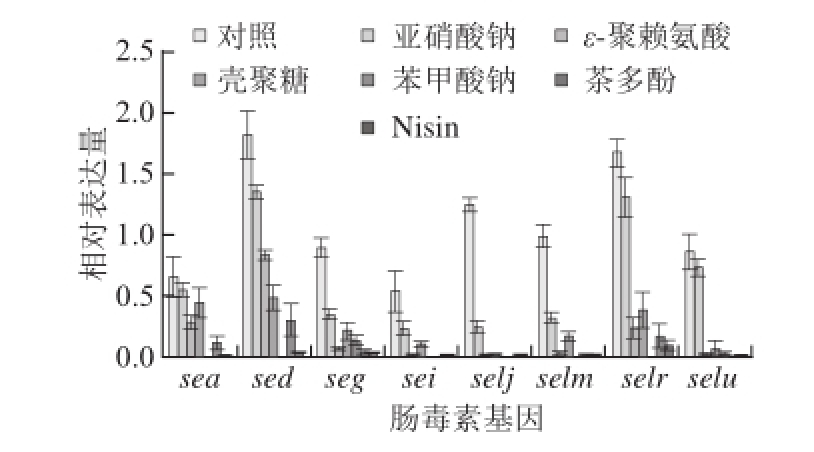
图16 种防腐剂对金黄色葡萄球菌SA003肠毒素基因转录水平的影响
Fig. 1 Effect of six food antiseptics on the expression levels of eight SE genes in S. aureus SA003
根据标准曲线斜率,得出金黄色葡萄球菌SA003携带的8 种肠毒素分别在不同防腐剂作用下以及对照组的相对表达量。由图1可以看出,在6种不同防腐剂剂量(亚硝酸钠0.150 g/L、ε-聚赖氨酸0.250 g/L、壳聚糖6.000 g/L、苯甲酸钠2.000 g/L、茶多酚0.400 g/L、Nisin 0.125 g/L)作用24 h后,检测发现6 种防腐剂对肠毒素sea、sed、seg、sei、selj、selm、selr和selu的转录起抑制作用,但不同防腐剂的作用效果存在差异。Duncan’s分析发现,尽管亚硝酸钠对肠毒素基因转录的抑制相对其他几种防腐剂来说作用效果最小,但对sea、sed、seg、sei、selj和selm仍存在较显著的抑制作用(P<0.05);其次是ε-聚赖氨酸和壳聚糖,二者对8种不同肠毒素转录表达的抑制作用效果相当(P>0.05);茶多酚、苯甲酸钠和Nisin对肠毒素基因的转录水平抑制效果较强(P>0.05)。此外,在相同培养条件下,无论添加防腐剂与否,由质粒编码的肠毒素sed与selr基因转录水平均显著高于其他肠毒素基因。
3 讨 论
本实验探索了6 种常见食品防腐剂对金黄色葡萄球菌SA003生长以及该菌株携带毒素基因表达的影响,发现在国标限量最大范围时,生物防腐剂Nisin、茶多酚、壳聚糖、ε-聚赖氨酸的抑菌效果较化学防腐剂苯甲酸钠和亚硝酸盐好,同时还发现6 种防腐剂可以使8 种肠毒素基因表达量呈明显下降趋势。
廖春丽等
[6]研究了茶多酚对金黄色葡萄球菌及其他细菌的抑制效果,表明茶多酚对供试菌有较强的抑菌活性,而常用的防腐剂山梨酸钾对金黄色葡萄球菌抑制效果不显著,茶多酚的质量浓度越高,抑菌活性越强。胡春红等
[7]研究了苯甲酸钠和山梨酸钾两种防腐剂对大肠杆菌和金黄色葡萄球菌的抑菌效果,他们认为苯甲酸钠和山梨酸钾对两种菌的生长都呈显著抑制作用,相同浓度下苯甲酸钠的抑菌效果要好于山梨酸钾。莫树平等
[8]以ε-聚赖氨酸为主要防腐剂,与Nisin和纳他霉素进行复配,认为复合生物防腐剂对革兰氏阳性菌、革兰氏阴性菌和真菌均表现出抑制作用。这些研究结果与本实验结果一致,6 种防腐剂对金黄色葡萄球菌都具有很好的抑菌效果。
目前,食品防腐剂的抑菌机理可以归纳为3 种:作用于细菌细胞壁和细胞膜系统、作用于细胞内的酶系统或功能蛋白质、作用于遗传物质
[17]。本研究所选的6 种防腐剂的抑菌机制不尽相同。如亚硝酸盐的抑菌机制是在细菌代谢作用下生成NO发挥活性,NO能够与铁硫化合物反应形成铁-亚硝酰化物,导致铁氧化还原蛋白等的破坏
[18];另外,NO还可与RNA还原酶相关位点结合,攻击锌指类型的DNA连接蛋白,从而影响基因的调节作用
[19]。但从本实验的研究结果来看,亚硝酸钠对金黄色葡萄球菌SA003的作用效果相对其他几种防腐剂稍微表现弱一些,可能是金黄色葡萄球菌对亚硝酸钠具有一定抵抗能力。苯甲酸钠是通过未离解的苯甲酸分子发生作用,未离解的苯甲酸亲脂性强,易通过细胞膜,抑制细胞内呼吸酶的活力,阻止乙酰辅酶A的缩合反应,从而起到抑菌作用
[20]。Karabay等
[21]发现苯甲酸钠对临床分离的耐甲氧西林金黄色葡萄球菌和甲氧西林敏感金黄色葡萄球菌菌株具均有很好的体外抑菌活性,本研究也证实了这一结论。茶多酚是从茶叶中提取的酚类物质及衍生物的总称,本实验结果表明茶多酚的抑菌活性很强,在最大限量时可完全抑制SA003的生长。壳聚糖能与细菌生存所必需的蛋白质等结合,或选择性地螯合对微生物生长起关键作用的金属离子,尤其是酶的辅助因子,从而抑制微生物的生长和繁殖;同时还可与DNA相互作用,扰乱DNA的复制与转录
[22]。本研究发现壳聚糖抑菌效果较强,在相同的条件下培养24 h,壳聚糖实验组金黄色葡萄球菌SA003菌落总数与对照组相比降低了3 个数量级,且抑菌活性高于ε-聚赖氨酸、苯甲酸钠和亚硝酸钠。ε-聚赖氨酸是一种从放线菌培养过滤液中提取出来的天然微生物代谢产物
[23],ε-聚赖氨酸能够与细胞膜上带负电荷的基团结合,取代膜上的二价阳离子,逐渐破坏细胞结构,最终导致细胞死亡,从而起到抑菌作用
[24]。在最大限量下,ε-聚赖氨酸的抑菌效果强于苯甲酸钠。Nisin可以使金黄色葡萄球菌培养液中蛋白质含量明显增加,带电荷细胞内容物大量外泄,造成菌体不可恢复性损伤,从而失去代谢和增殖活性
[25]。本研究认为Nisin对SA003的抑菌活性最强,通过两次2倍稀释之后金黄色葡萄球菌SA003才能生长。基于以上探讨,上述6种不同防腐剂的作用效果存在差异可能与各自的抑菌机制有关。另外,0.4 g/L茶多酚和0.125 g/L Nisin对金黄色葡萄球菌生长只存在微弱抑菌效果,但在相同的质量浓度条件下,二者对于肠毒素基因转录却有着显著的抑制效果,并且在另一株食物中毒的菌株中也获得同样结果。Mori等
[26]的研究也表明儿茶素没食子酸酯能抑制金黄色葡萄球菌RNA的合成,这可以部分解释茶多酚对肠毒素基因表达的抑制效果。至于Nisin抑制肠毒素基因转录的具体原因,还有待于进一步探索。值得一提的是,本课题组前期研究发现肠毒素基因的表达高峰时期是在细菌对数生长后期和稳定期阶段,因此,本研究只探索了6 种防腐剂与金黄色葡萄球菌共同作用24 h的情形,如果能针对整个生长过程进行监测,获得的数据将更有帮助。
实时荧光定量PCR是一种精确、灵敏的检测方法,常用于金黄色葡萄球菌肠毒素基因检测以及基因转录水平研究
[14,27-31]。本研究通过荧光定量方法探索6种常见防腐剂对金黄色葡萄球菌SA003携带肠毒素基因转录的影响,发现6 种防腐剂对8 种肠毒素基因转录的影响存在差异。探其原因,一方面可能与上述6 种防腐剂的抑菌机制有关;另一方面,也可能与SA003携带的8 种肠毒素基因由不同基因元件编码有关。肠毒素基因sea是由温和型噬菌体编码
[32];seg、sei、selm、selu基因由毒力基因簇(enterotoxin gene cluster,egc)编码
[33-34];肠毒素sed、selj和selr基因由质粒编码
[35-36],研究发现由质粒编码的sed、selj和selr基因的表达较其他几种肠毒素要高,这一点可以部分解释金黄色葡萄球菌肠毒素SED引起食物中毒的发生率比较高的原因
[32]。由于6 种防腐剂的作用机制不同,苯甲酸钠和Nisin以及茶多酚对肠毒素基因转录水平抑制效果强;其次是ε-聚赖氨酸与壳聚糖;亚硝酸钠对基因转录抑制效果最小。从本研究可以看出,在食品加工过程中选择合适的防腐剂不仅能改良食品的品质、延长食品的保质期,还可以抑制肠毒素的产生、降低食品安全风险。在未来的研究中,进一步探索不同防腐剂复配使用,以及结合不同环境条件共同作用,也许能够更好地对金黄色葡萄球菌的生长和肠毒素表达进行控制。
参考文献:
[1] European Food Safety Authority, European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2013[J]. EFSA Journal, 2015, 13(1): 3991.
[2] ARGUDÍN M Á, MENDOZA M C, RODICIO M R. Food poisoning and Staphylococcus aureus enterotoxins[J]. Toxins, 2010, 2(7): 1751-1773. DOI:10.3390/toxins2071751.
[3] WILSON G J, SEO K S, CARTWRIGHT R A, et al. A novel core genome-encoded superantigen contributes to lethality of communityassociated MRSA necrotizing pneumonia[J]. PLoS Pathogens, 2011, 7(10): e1002271. DOI:10.1371/journal.ppat.1002271.
[4] ONO H K, SATO’O Y, NARITA K, et al. Identification and characterization of a novel staphylococcal emetic toxin[J]. Applied and Environmental Microbiology, 2015, 81(20): 7034-7040. DOI:10.1128/ AEM.01873-15.
[5] 周志江. 生物防腐剂及其在食品防腐中的应用[J]. 保鲜与加工, 2015, 15(1): 1-8.
[6] 廖春丽, 周亚巍, 周凯, 等. 茶多酚及其金属离子对肉源腐败菌和致病菌抑制效果的研究[J]. 食品科技, 2015, 40(1): 292-296.
[7] 胡春红, 乔琳, 古红梅, 等. 常用食品防腐剂的抑菌效果[J]. 吉林农业科学, 2013, 38(1): 83-86.
[8] 莫树平, 王惠惠, 柏建玲, 等. ε-聚赖氨酸复合防腐剂对常见致病菌和污染菌的抑制作用[J]. 食品与机械, 2012, 28(6): 109-111; 124. DOI:10.3969/j.issn.1003-5788.2012.06.027.
[9] 张赟彬, 刘笑宇, 姜萍萍, 等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技, 2015, 31(5): 31-36. DOI:10.13982/j.mfst.1673-9078.2015.5.006.
[10] BRAGA L C, SHUPP J W, CUMMINGS C, et al. Pomegranate extract inhibits Staphylococcus aureus growth and subsequent enterotoxin production[J]. Journal of Ethnopharmacology, 2005, 96 (1/2): 335-339. DOI:10.1016/j.jep.2004.08.034.
[11] SOUZA E L, OLIVEIRA C E, STAMFORD T L, et al. Influence of carvacrol and thymol on the physiological attributes, enterotoxin production and surface characteristics of Staphylococcus aureus strains isolated from foods[J]. Brazilian Journal of Microbiology, 2013, 44(1): 29-35. DOI:10.1590/S1517-83822013005000001.
[12] AZIZKHANI M, MISAGHI A, BASTI A A, et al. Effects of Zataria multiflora Boiss. essential oil on growth and gene expression of enterotoxins A, C and E in Staphylococcus aureus ATCC 29213[J]. International Journal of Food Microbiology, 2013, 163(2/3): 159-165. DOI:10.1016/j.ijfoodmicro.2013.02.020.
[13] HANDAYANI L, FARIDAH D N, KUSUMANINGRUM H D. Staphylococcal enterotoxin A gene-carrying Staphylococcus aureus isolated from foods and its control by crude alkaloid from papaya leaves[J]. Journal of Food Protection, 2014, 77(11): 1992-1997. DOI:10.4315/0362-028X.JFP-13-483.
[14] DERZELLE S, DILASSER F, DUQUENNE M, et al. Differential temporal expression of the staphylococcal enterotoxins genes during cell growth[J]. Food Microbiology, 2009, 26(8): 896-904. DOI:10.1016/j.fm.2009.06.007.
[15] 杨静, 杨军, 黄继超, 等. 食源性金黄色葡萄球菌肠毒素基因的分布与时序性表达[J]. 中国农业科学, 2012, 45(19): 4057-4066. DOI:10.3864/j.issn.0578-1752.2012.19.018.
[16] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45.
[17] 李兴峰, 黄云坡, 王志新, 等. DNA:天然防腐剂抑菌作用的新靶位[J]. 中国食品学报, 2015, 15(4): 130-135.
[18] 董庆利, 屠康. 腌制肉中亚硝酸盐抑菌机理的研究进展[J]. 现代生物医学进展, 2006, 6(3): 48-52.
[19] LI Huihua, CAO Rong, WASSERLOOS K J, et al. Nitric oxide and zinc homeostasis in pulmonary endothelium[J]. Annals of the New York Academy of Sciences, 2010, 1203: 73-78. DOI:10.1111/j.1749-6632.2010.05558.x.
[20] 候振建. 食品添加剂及其应用技术[M]. 北京: 化学工业出版社, 2004: 64-65.
[21] KARABAY O, SAHIN I. In vitro activity of sodium-benzoate against isolates of methicillin-resistant Staphylococcus aureus[J]. The West Indian Medical Journal, 2005, 54(2): 107-109. DOI:10.1590/S0043-31442005000200004.
[22] 韩永萍, 李可意, 杨宏伟, 等. 壳聚糖的抗菌机理及其化学改性研究[J]. 化学世界, 2012(4): 248-252. DOI:10.3969/ j.issn.0367-6358.2012.04.016.
[23] SHIMA S, SAKAI H. Poly-l-lysine produced by Streptomyces. part II. taxonomy and fermentation studies[J]. Agricultural and Biological Chemistry, 1981, 45(11): 2497-2502. DOI:10.1080/00021369.1981.10 864929.
[24] 刘蔚, 周涛. ε-聚赖氨酸抑菌机理研究[J]. 食品科学, 2009, 30(9): 15-20. DOI:10.3321/j.issn:1002-6630.2009.09.002.
[25] 吕淑霞, 白泽朴, 代义, 等. 乳酸链球菌素(Nisin)抑菌作用及其抑菌机理的研究[J]. 中国酿造, 2008, 27(9): 87-91. DOI:10.3969/ j.issn.0254-5071.2008.05.025.
[26] MORI A, NISHINO C, ENOKI N, et al. Antibacterial activity and mode of action of plant flavonoids against Proteus vulgaris and Staphylococcus aureus[J]. Phytochemistry, 1987, 26(8): 2231-2234. DOI:10.1016/S0031-9422(00)84689-0.
[27] NOUAILLE S, RAULT L, JEANSON S, et al. Contribution of Lactococcus lactis reducing properties to the downregulation of a major virulence regulator in Staphylococcus aureus, the agr system[J]. Applied and Environmental Microbiology, 2014, 80(22): 7028-7035. DOI:10.1128/AEM.02287-14.
[28] AGUILAR J L, VARSHNEY A K, WANG Xiaobo, et al. Detection and measurement of staphylococcal enterotoxin-like K (SEl-K) secretion by Staphylococcus aureus clinical isolates[J]. Journal of Clinical Microbiology, 2014, 52(7): 2536-2543. DOI:10.1128/ JCM.00387-14.
[29] TSUTSUURA S, SHIMAMURA Y, MURATA M. Temperature dependence of the production of staphylococcal enterotoxin A by Staphylococcus aureus[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(1): 30-37. DOI:10.1271/bbb.120391.
[30] CAO Rong, ZEAKI N, WALLIN-CARLQUIST N, et al. Elevated enterotoxin A expression and formation in Staphylococcus aureus and its association with prophage induction[J]. Applied and Environmental Microbiology, 2012, 78(14): 4942-4948. DOI:10.1128/AEM.00803-12.
[31] MÁRTA D, WALLIN-CARLQUIST N, SCHELIN J, et al. Extended staphylococcal enterotoxin D expression in ham products[J]. Food Microbiology, 2011, 28(3): 617-620. DOI:10.1016/j.fm.2010.11.013.
[32] GOERKE C, PANTUCEK R, HOLTFRETER S, et al. Diversity of prophages in dominant Staphylococcus aureus clonal lineages[J]. Journal of Bacteriology, 2009, 191(11): 3462-3468. DOI:10.1128/ JB.01804-08.
[33] JARRAUD S, PEYRAT M A, LIM A, et al. egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens in Staphylococcus aureus[J]. The Journal of Immunology, 2001, 166(1): 669-677. DOI:10.4049/ jimmunol.166.1.669.
[34] LETERTRE C, PERELLE S, DILASSER F, et al. Identification of a new putative enterotoxin SEU encoded by the egc cluster of Staphylococcus aureus[J]. Journal of Applied Microbiology, 2003, 95(1): 38-43. DOI:10.1046/j.1365-2672.2003.01957.x.
[35] ZHANG Shuping, IANDOLO J J, STEWART G C. The enterotoxin D plasmid of Staphylococcus aureus encodes a second enterotoxin determinant(sej)[J]. FEMS Microbiology Letters, 1998, 168(2): 227-233. DOI:10.1016/S0378-1097(98)00423-6.
[36] OMOE K, HU Dongliang, TAKAHASHI-OMOE H T, et al. Identification and characterization of a new staphylococcal enterotoxin-related putative toxin encoded by two kinds of plasmids[J]. Infection and Immunity, 2003, 71(10): 6088-6094. DOI:10.1128/ IAI.71.10.6088-6094.2003.
Inhibitory Effect of Six Food Antiseptics on the Growth and Staphylococcal Enterotoxin (SE) Gene Expression of Staphylococcus aureus
WANG Qiong, TANG Junni*, TANG Cheng, CHEN Juan
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Abstract:Objective: To explore the inhibitory effect of six food antiseptics (nitrite, sodium benzoate, ε-polylysine, chitosan, polyphenols, and nisin) on the growth of Staphylococcus aureus SA003, a strain capable of causing food poisoning, as well as on the expression of enterotoxin genes by this strain at the mRNA level. Methods: According to the national standard (GB 2760—2014) concentration limits, aqueous solutions of six different preservatives were prepared and added into TSB medium inoculated with about 10
5CFU/mL of S. aureus SA003. All cultures were shaken at 150 r/min at 37 ℃. After 24 h, the colonies of the cultures treated by different preservatives were counted, respectively. At the same time, the cells were collected for RNA extraction and reverse transcription. The fluorescence quantitative PCR was used to detect the relative expression level of each enterotoxin gene at the mRNA level. Results: At the GB maximum concentration limits, the inhibitory effects of different additives on the growth of S. aureus SA003 were nisin > polyphenols > chitosan > ε-polylysine > sodium benzoate > nitrite. All six preservatives could inhibit the expression of sea, sed, seg, sei, selj, selm, selr and selu genes at the transcriptional level and their effects were significantly different. Conclusion: Adding preservatives in liquid medium not only inhibited the growth of S. aureus, but also significantly reduced the expression of staphylococcal enterotoxin genes.
Key words:food antiseptics; Staphylococcus aureus; enterotoxin genes; expression
DOI:10.7506/spkx1002-6630-201621026
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2016)21-0151-06
引文格式:
王琼, 唐俊妮, 汤承, 等. 6 种食品防腐剂对金黄色葡萄球菌抑菌效果及肠毒素基因表达的影响[J]. 食品科学, 2016, 37(21): 151-156. DOI:10.7506/spkx1002-6630-201621026. http://www.spkx.net.cn
WANG Qiong, TANG Junni, TANG Cheng, et al. Inhibitory effect of six food antiseptics on the growth and staphylococcal enterotoxin (SE) gene expression of Staphylococcus aureus[J]. Food Science, 2016, 37(21): 151-156. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621026. http://www.spkx.net.cn
收稿日期:2016-01-04
基金项目:国家自然科学基金面上项目(31371781);四川省应用基础项目(2014JY0253);教育部“新世纪人才支持计划”项目(NCET-11-0847)
作者简介:王琼(1990—),女,硕士研究生,研究方向为畜产品加工与安全。E-mail:wangqiong528@163.com
*通信作者:唐俊妮(1971—),女,教授,博士,研究方向为食品安全与食品微生物。E-mail:junneytang@aliyun.com

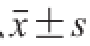 表示。SA003各肠毒素的表达分析根据荧光定量标准曲线和Ct值的对应情况,用Excel软件进行初步整理后,使用SPSS 18.0数据分析软件处理各肠毒素在不同时间段mRNA的相对表达量,以
表示。SA003各肠毒素的表达分析根据荧光定量标准曲线和Ct值的对应情况,用Excel软件进行初步整理后,使用SPSS 18.0数据分析软件处理各肠毒素在不同时间段mRNA的相对表达量,以
 表示,组内计量资料比较采用单因素方差分析(analysis of Variance,ANOVA),Duncan’s方法比较组内差异性,以P<0.05为差异具有统计意义。
表示,组内计量资料比较采用单因素方差分析(analysis of Variance,ANOVA),Duncan’s方法比较组内差异性,以P<0.05为差异具有统计意义。


