表1 Box-Behnken试验因素水平编码
Table 1 Factors and levels used in Box-Behnken experimental design

因素水平—101 A料水比(m/V)1∶21∶31∶4 B碳氮比(m/m)10∶120∶130∶1 C初始pH3.04.05.0
梁宝东 1,魏海香 1,姜淑喆 2,杨永涛 1
(1.济宁学院生命科学与工程系,山东 曲阜 273155;2.山东大学生命科学学院,山东 济南 250013)
摘 要:利用响应面法对芽孢杆菌属细菌J-5菌株产羧甲基纤维素酶(carboxymethyl cellulase,CMCase)的发酵条件进行优化。通过单因素试验,研究了氮源、碳氮比、初始pH值、料水比、发酵温度、发酵时间、辅助碳源等对产CMCase酶活性的影响,再此基础上选择料水比、碳氮比、初始pH值三因素进行响应面设计,考察各因素对CMCase酶活性的影响及相互作用。确定最佳产酶条件为碳氮比25∶1(m/m)、初始pH 3.2、料水比
关键词:大蒜皮;羧甲基纤维素酶;响应面分析
在自然界中,纤维素是最广泛存在的可再生资源 [1]。在大蒜加工过程中,其秸秆及大蒜皮只有少数作为牛、羊的食料,多数作为废弃物随意丢弃。大蒜秸秆、蒜皮等废弃物含有丰富的有机物质,经检测大蒜的普通干秸秆中(以总质量计)各组分含量为粗纤维24.63%、粗蛋白8.68%、粗脂肪0.96%、粗灰分14.51%、水分12.62%、钙2.29%、磷0.25%、无氮浸出物38.59%、总糖没有检出 [2]。但是,大蒜秸秆及皮中含有的抗菌物质,如大蒜素等,不利于微生物的生长,是限制其被利用的关键 [3]。现在利用秸秆的方法主要有一些物理、化学和生物的方法,其都存在不能充分利用、处理成本高等问题,只有生物降解法是利用秸秆的最佳途径 [4]。众多国内外专家学者一直致力于寻找并改造能高效降解纤维素的菌种。因此,产纤维素酶菌种的分离、筛选及优化其产酶条件一直是相关研究领域的热点之一 [5-7]。据报道,里氏木霉(Trichlderma ressiei)、绿色木霉(Trichoderma viride)、康氏木霉(Trichoderma koniggii)等微生物具有较高的纤维素降解能力 [8-11]。但受制于这些菌株较高的产酶条件,同时由于秸秆中天然纤维素结构的复杂性、高惰性,处理大蒜废弃物时依然存在转化率低、时间长、成本偏高等诸多问题,难以利用纤维素酶进行大规模生产 [12-13]。研究菌种产酶条件是提高纤维素酶活性、增加产酶量的重要途径之一 [14-15]。本实验拟研究大蒜皮降解菌株的产酶条件,以期将大蒜皮高效降解为糖和蛋白质,为蒜皮降解提供理论依据及技术支持。
1.1 菌株、材料与试剂
J-5菌株(野生)筛选自大蒜皮自然降解物,革兰氏阳性,杆状,有芽孢,初步鉴定为芽孢杆菌属(Bacillus Cohn),济宁学院生命科学实验中心保存。
液体发酵产酶培养基:蛋白胨3 g、硫酸铵2 g、酵母膏0.5 g、KH 2PO 44 g、CaCl 20.3 g、MgSO 4·7H 2O 0.3 g、吐温-80 0.2 g、羧甲基纤维素钠10 g、蒸馏水1 000 mL,初始pH 5.0。
固体发酵产酶培养基:粉碎的无霉变大蒜皮粉(取自加工厂的新鲜大蒜皮,烘干后粉碎10目)20.0 g、(NH 4) 2SO 42.0 g、MgSO 4·7H 2O 0.05 g、K 2HPO 40.1 g、蒸馏水70 mL,初始pH 5.0,121 ℃、0.1 MPa灭菌20 min。
蛋白胨、牛肉膏、酵母粉 北京澳博星生物技术有限责任公司;羧甲基纤维素钠、(NH 4) 2SO 4、MgSO 4·7H 2O、K 2HPO 4、柠檬酸、柠檬酸三钠(均为分析纯) 天津市英博生化试剂有限公司;刚果红 天津市津北精细化工有限公司。
1.2 仪器与设备
超净工作台 苏州净化设备有限公司;XB120A电子天平 上海精密科学仪器有限公司;HZQ-X160恒温振荡培养箱 太仓市实验设备厂;723PC可见光分光光度计 上海菁华科技仪器有限公司;TD6离心机 常州市华普达教学仪器有限公司;YXQ-SL-50SLL立式压力灭菌锅 上海博讯实业有限公司医疗设备厂;雷磁PHS-3C型pH计 南京互川电子有限公司。
1.3 方法
1.3.1 固体发酵产酶的单因素试验
1.3.1.1 氮源对羧甲基纤维素酶(carboxymethyl cellulase,CMCase)产量的影响
分别取2 mL菌株J-5的菌悬液,加入到以2 g/100 g蛋白胨、1 g/100 g蛋白胨加1 g/100 g硫酸铵、2 g/100 g硫酸铵分别作为氮源的不同固体产酶培养基中,其他成分不变,每组3 个平行,料水比1∶4(m/V)、35 ℃培养5 d,测其酶活力。
1.3.1.2 料水比对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到料水比为1∶2、1∶3、1∶4、1∶5、1∶6(m/V)的不同固体产酶培养基中,振动混合均匀,每组3 个平行,35 ℃培养5 d,测其酶活力。
1.3.1.3 碳氮比对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到碳氮比为5∶1、10∶1、20∶1、30∶1、40∶1(m/m)的不同固体产酶培养基中。每组3 个平行,料水比1∶4(m/V),35 ℃培养5 d,测其酶活力。
1.3.1.4 初始pH值对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到初始pH值为3.0、4.0、5.0、6.0、7.0的不同固体产酶培养基中,每组3 个平行,料水比1∶4(m/V)、35 ℃培养5 d,测其酶活力。
1.3.1.5 发酵温度对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到15 个相同条件的固体产酶培养基中,每组3 个平行,料水比1∶4(m/V),分别于29、32、35、38、41 ℃条件下培养5 d,测其酶活力。
1.3.1.6 发酵时间对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到15 个相同条件的固体产酶培养基中,每组3 个平行,料水比1∶4(m/V)、35 ℃分别培养72、96、120、144、168 h,测其酶活力。
1.3.1.7 辅助碳源(葡萄糖)对CMCase产量的影响
分别取2 mL菌株J-5的菌悬液加入到葡萄糖含量为0.0、0.5、1.0、1.5、2.0 g/100 g的不同固体产酶培养基中。每组3 个平行,料水比1∶4(m/V)、35 ℃培养6 d,测其酶活力。
1.3.2 固体发酵产酶条件的响应面优化
根据Box-Behnken中心设计原理 [16],结合单因素试验结果,以料水比、碳氮比、初始pH值3 个关键因素作为自变量 [17-18],以-1、0、+1分别代表自变量的低、中、高水平,以CMCase酶活力为响应值设计三因素三水平试验,各因素水平见表1。
表1 Box-Behnken试验因素水平编码
Table 1 Factors and levels used in Box-Behnken experimental design

因素水平—101 A料水比(m/V)1∶21∶31∶4 B碳氮比(m/m)10∶120∶130∶1 C初始pH3.04.05.0
1.3.3 验证实验
用响应面试验结果的最优化组合,降解大蒜皮,测定其CMCase酶活力。
1.3.4 指标测定
1.3.4.1 葡萄糖标准曲线
参照文献[19]方法。取9 支洗净烘干的25 mL具塞刻度试管,分别加入1.0 mg/mL的标准葡萄糖溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,再分别向各试管中加入蒸馏水至溶液总体积为2.0 mL,配制成一系列不同质量浓度的葡萄糖溶液。充分摇匀后,向各试管中加入1.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液,摇匀后沸水浴5 min。取出立即流水冷却后用蒸馏水定容至25 mL,充分混匀。用723分光光度计在波长520 nm处,以1号试管溶液作为空白对照,调零点,测定其他各管溶液的光密度值并记录结果。以葡萄糖质量为横坐标,以对应的光密度值为纵坐标,绘制曲线即为葡萄糖的标准曲线。得光密度值(y)与葡萄糖质量(x)的线性关系为:y=0.618 6x-0.000 8。
1.3.4.2 CMCase酶活力测定
参照文献[21-22]方法。取4 支洗净烘干的25 mL具塞刻度试管,编号后各加入1.0 mL酶液和1.5 mL pH 4.4、5 g/L羧甲基纤维素钠的柠檬酸缓冲液,1号试管加入1.5 mL的DNS溶液钝化酶活性,作为参比溶液。50 ℃水浴保温30 min。取出后立即向2、3、4号试管各加入1.5 mL DNS溶液终止酶反应,充分摇匀,沸水浴5 min,取出立即流水冷却,用蒸馏水定容至25 mL,充分摇匀,参比溶液调零,波长520 nm处测2、3、4号试管的光密度值,求平均值,通过标准曲线查出对应的葡萄糖含量,酶活力计算见下式:
式中:m 1为葡萄糖质量/mg;V 1为酶液定容体积/mL;V 2为反应液中酶液的加入量/mL;m 2为样品质量/g;t为时间/h;5.56为l mg葡萄糖微摩尔数(1 000/180=5.56)。
1.3.4.3 残余还原糖含量的测定
取4 支洗净烘干的25 mL具塞刻度试管,编号后向2、3、4号试管中各加入1.0 mL酶液和1.5 mL DNS溶液,1号中只加DNS作为参比溶液,充分摇匀沸水浴5 min,取出立即流水冷却,用蒸馏水定容至25 mL,充分摇匀,参比溶液调零,波长520 nm处测2、3、4号试管的光密度值,求平均值,通过标准曲线查出对应的葡萄糖含量 [23]。
2.1 产酶条件单因素试验结果
2.1.1 氮源对CMCase产量的影响
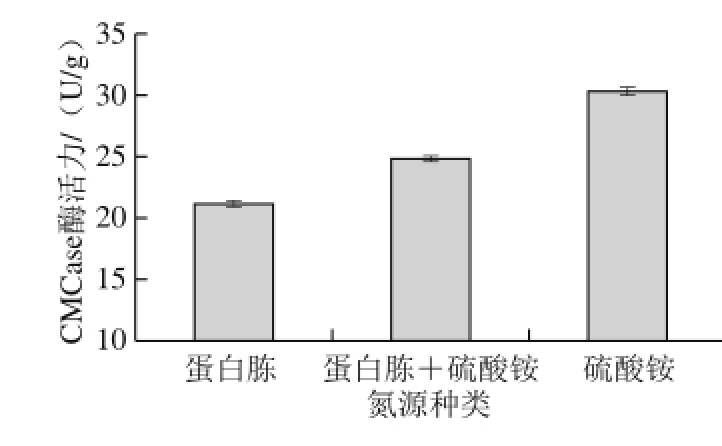
图1 氮源种类对CMCase产量的影响
Fig. 1 Effect of nitrogen source on CMCase production
由图1可知,在上述3 个组合中,蛋白胨为唯一氮源时,产CMCase量最少,CMCase酶活力只有21.145 U/g;蛋白胨和硫酸铵同时做氮源时,CMCase酶活力略有提高;无机氮源硫酸铵为唯一氮源时,CMCase酶活力最高为30.309 U/g。结果表明,菌株J-5受氮源影响不大,均能有效的利用,且无机氮源更有利于CMCase酶的合成。硫酸铵价格低,更适合工业化生产,因此选用硫酸铵为唯一氮源。
2.1.2 料水比对CMCase产量的影响
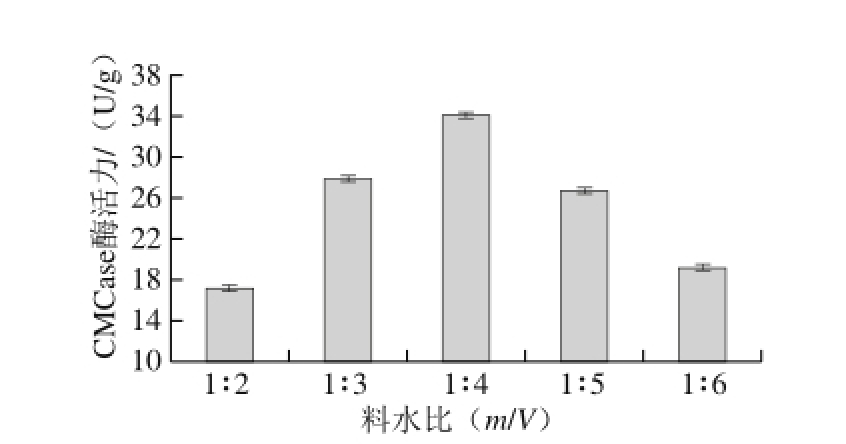
图2 料水比对CMCase产量的影响
Fig. 2 Effect of solid-to-liquid ratio on CMCase production
由图2可知,随着水含量的增大CMCase酶活力逐渐提高,在料水比为1∶4(m/V)时,达到最大值。当料水比超过1∶4(m/V)时CMCase酶活力出现下降趋势,由34.080 U/g下降到19.157 U/g。这是因为水是微生物生长的必要条件之一,大蒜皮吸水膨胀软化,有利于降解纤维素菌株J-5的生长和代谢。但当水含量过大时导致一些营养物质(某些纤维素和无机离子)的浓度下降,从而使CMCase酶活力产生下降趋势。因此在固体发酵培养中,确定一个最佳的料水比对产酶尤为重要。
2.1.3 碳氮比对CMCase产量的影响
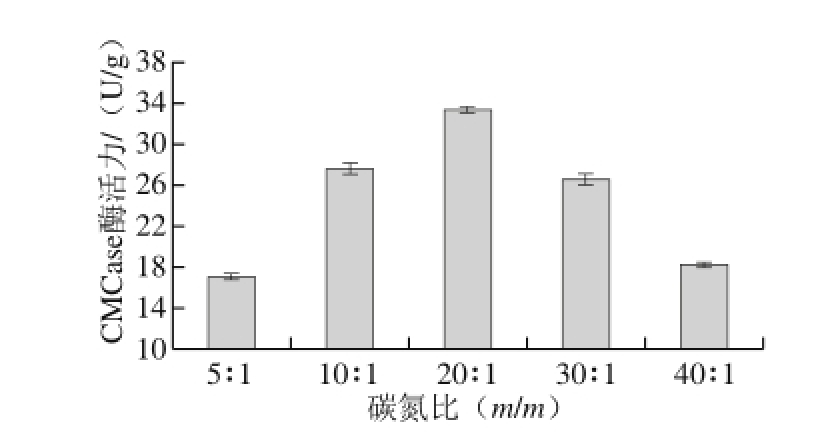
图3 碳氮比对CMCase产量的影响
Fig. 3 Effect of carbon/nitrogen ratio on CMCase production
由图3可知,随着碳氮比的逐渐增大CMCase酶活力逐渐提高,在碳氮比约为20∶1(m/m)时达到最大值,当碳氮比大于20∶1(m/m)时,其CMCase酶活力开始降低,由20∶1(m/m)时的33.367 U/g降为40∶1(m/m)时的18.245 U/g。这是由于碳氮比直接影响菌株生长和代谢,一般降解纤维素的菌株对氮源的需求量有一个很低的最佳值。
2.1.4 初始pH值对CMCase产量的影响

图4 初始pH值对CMCase产量的影响
Fig. 4 Effect of initial medium pH on CMCase production
由图4可知,随着初始pH值的增大CMCase酶活力逐渐提高。CMCase酶活力在初始pH值为4.0时达到最大值,在pH 3.0~4.0时变化较显著,由30.032 U/g增加到37.099 U/g。当初始pH值大于4.0时CMCase酶活力降低比较明显,其后随pH值增大一直缓慢的降低。说明了CMCase酶为一种酸性酶,偏向于较酸的环境,更有利于该菌株CMCase酶的生产代谢和积累,最适发酵pH值为4.0。
2.1.5 发酵温度对CMCase产量的影响
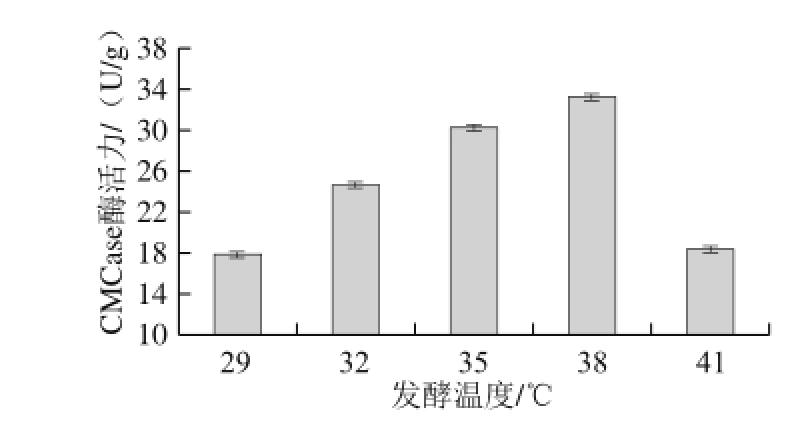
图5 发酵温度对CMCase产量的影响
Fig. 5 Effect of fermentation temperature on CMCase production
由图5可知,随着发酵温度的升高CMCase酶活力逐渐提高。CMCase酶活力在发酵温度为38 ℃时达到最大值,约33.25 U/g。当发酵温度为41 ℃时,CMCase酶活力较38 ℃时的显著降低,降至18.35 U/g。每个菌种都有最适产酶的发酵温度,在此温度条件下该菌株能更好地进行胞外酶的生产和积累。该菌种最适宜发酵温度为38 ℃,明显高于常见产CMCase霉菌适宜的发酵温度。
2.1.6 发酵时间对CMCase产量的影响

图6 发酵时间对CMCase产量的影响
Fig. 6 Effect of fermentation duration on CMCase production
由图6可以看出,在144 h以前,随着发酵时间的延长CMCase酶活力逐渐提高。在72 h,CMCase酶活力处于较低的水平,合成和代谢比较缓慢。发酵至72~96 h,CMCase酶活力变化较为明显,由12.759 U/g增长到20.192 U/g。发酵时间至120 h时,CMCase酶活力为32.27 U/g,酶的合成处于加速时期。在144 h时,酶活力达到最大值,约37.818 U/g。当发酵时间大于144 h时CMCase酶活力开始降低。因此控制发酵时间尤为重要,这是因为每个菌种都有生长周期,要先测定好菌株的生长周期才能更好地找到CMCase积累最多的时间。
2.1.7 葡萄糖含量对CMCase产量的影响
由图7可知,在加入少量辅助碳源时,CMCase酶活力比大蒜皮做唯一碳源时低,如在含有0.5 g/100 g的葡萄糖时,CMCase酶活力比不加时低。在辅助碳源质量分数到达1 g/100 g时,CMCase酶活力最高达到31.706 U/g。当辅助碳源超过1 g/100 g时CMCase酶活力出现下降趋势。这由葡萄糖效应引起,即初始的少量葡萄糖被菌体生长利用,一段时间后,菌体分泌CMCase,此酶分解纤维素生成葡萄糖,从而导致培养基内积累的葡萄糖抑制菌株J-5对CMCase的分泌。也就是说葡萄糖等速效碳源能引起CMCase的阻遏效应。因此应控制葡萄糖的加入量,使加入的葡萄糖刚好被利用促进前期菌种的生长,而又不影响CMCase的合成。

图7 葡萄糖含量对CMCase产量的影响
Fig. 7 Effect of glucose concentration on CMCase production
由因素与指标的关系图判断该因素的影响程度:点的分散程度越大,点的高低相差越大,任意两点的斜率越大,则影响越显著 [24]。采用以上原则,根据关系图上点的散布情况来分析这些因素的影响程度。可以得出:碳氮比影响最显著,初始pH值次之,料水比第三,其他在有效因素区间影响不显著。由此采用响应面分析料水比、碳氮比和初始pH值3 个因素对产酶的影响。
2.2 产酶条件的响应面设计与方差分析
选用A(料水比)、B(碳氮比)、C(初始pH值)3 个因素为自变量,CMCase酶活力为因变量,采用Box-Behnken设计原理进行发酵条件的优化,试验设计及CMCase酶活力结果见表2。
表2 Box-Behnken试验设计及结果
Table 2 Experimental design and responses of Box-Behnken design
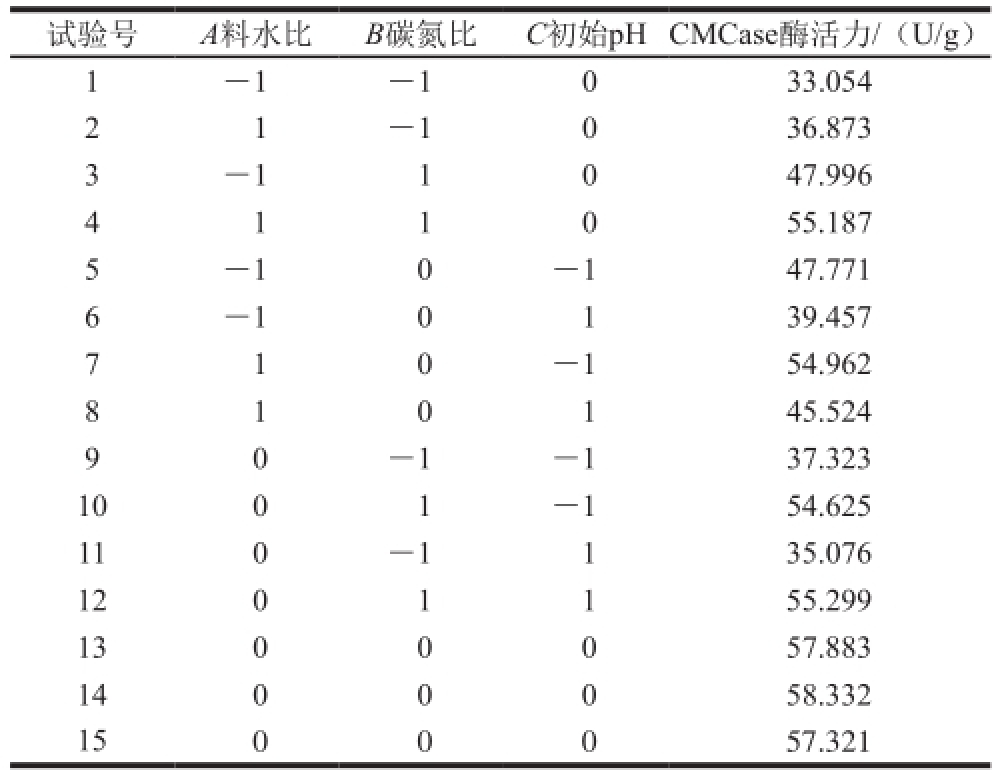
试验号A料水比B碳氮比C初始pH CMCase酶活力/(U/g)1-1-1033.054 2 1-1036.873 3-11047.996 4 1 1 0 55.187 5-10-147.771 6-10139.457 7 1 0-154.962 8 1 0 1 45.524 0-1-137.323 1001-154.625 110-1135.076 1201155.299 1300057.883 1400058.332 1500057.321 9
2.2.1 响应面方差分析
用Design-Expert程序对实验数据进行分析,方差分析见表3,并得出回归模型(1):

由方差分析可知:模型的校正决定系数R 2Adj为0.942 2,变异系数为4.58%,说明该模型只有0.597 1的变异不能由该模型解释,因此,该模型的拟合性良好。模型的F值为30.00,P值小于0.000 1,表明该模型受外界干扰的几率只有0.01%,是极其显著的,模型拟合程度良好,自变量与响应值之间的线性关系显著,可用于CMCase产量的预测和分析。
A、B、A 2、B 2和C 2的P值均小于0.01说明其对CMCase产量影响极其显著;而交互项AB、BC和AC对CMCase产量的影响都不显著。
由表3的P值可以得知,在所选的各因素范围内,对CMCase产量的影响排序为:B(碳氮比)>A(料水比)>C(初始pH值)。对回归模型的回归方程进行优化得式(2):
表3 回归方程的方差分析
Table 3 Analysis of variance (ANOVA) for regression equation
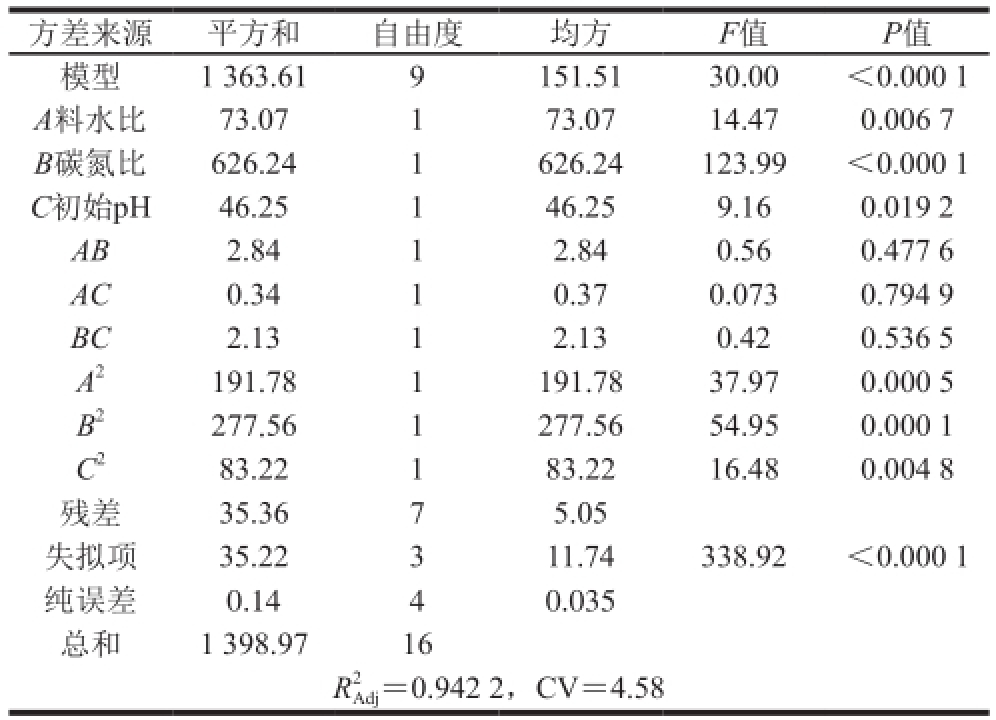
方差来源平方和自由度均方F值P值模型1 363.619151.5130.00<0.000 1 A料水比73.07173.0714.470.006 7 B碳氮比626.241626.24123.99<0.000 1 C初始pH46.25146.259.160.019 2 AB2.8412.840.560.477 6 AC0.3410.370.0730.794 9 BC2.1312.130.420.536 5 A 2191.781191.7837.970.000 5 B 2277.561277.5654.950.000 1 C 283.22183.2216.480.004 8残差35.3675.05失拟项35.22311.74338.92<0.000 1纯误差0.1440.035总和1 398.9716 R2 Adj=0.942 2,CV=4.58
2.2.2 响应面交互作用分析
通过Design-Expert软件绘制响应面曲线图与等高线图进行分析可进一步研究相关变量之间的交互作用以及确定最优点,结果见图8~10。
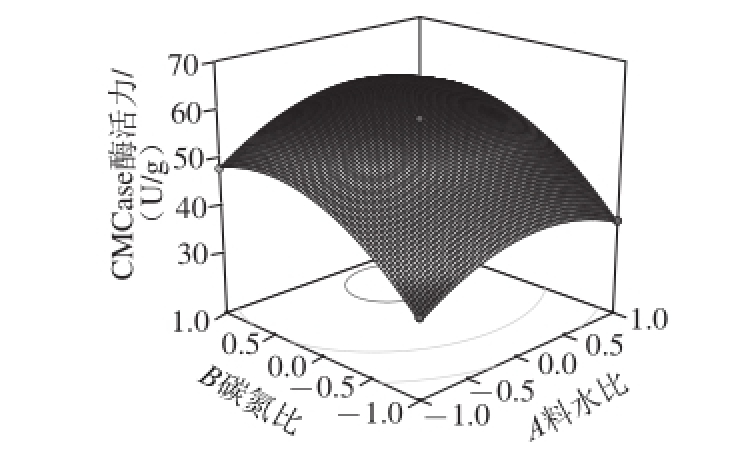
图8 碳氮比和料水比对CMCase酶活力的影响
Fig. 8 Effects of carbon/nitrogen ratio and solid-to-liquid ratio on CMCase production
由图8可知,碳氮比对产CMCase量的影响较为显著,CMCase酶活力随碳氮比的升高先升高再降低。在试验水平范围内,料水比和碳氮比分别在1∶3~1∶4(m/V)和20∶1~30∶1(m/m)范围内时,CMCase酶活力可以达到试验中的最大值。
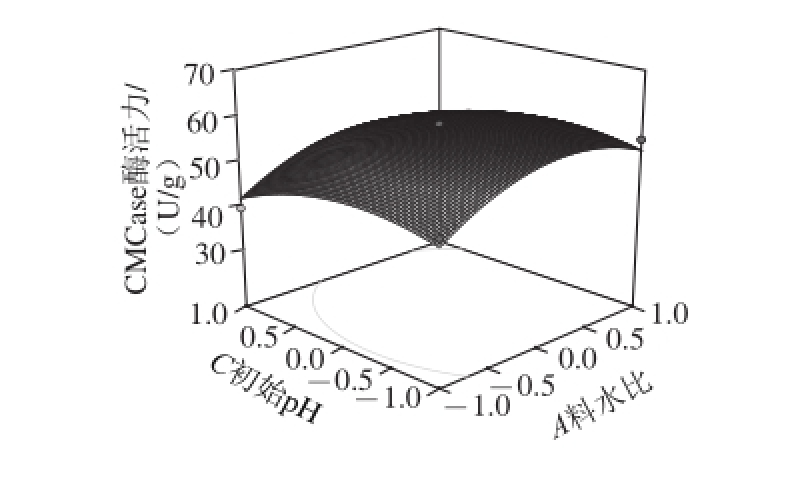
图9 初始pH值和料水比对CMCase酶活力的影响
Fig. 9 Effects of initial medium pH and solid-to-liquid ratio on CMCase production
由图9可知,初始pH值对CMCase产量的影响较为显著,CMCase酶活力随初始pH值的升高先升高再降低。在试验水平范围内,料水比和初始pH值分别在1∶3~1∶3.5(m/V)和3.5~4.0范围内时,CMCase酶活力可以达到试验中的最大值。
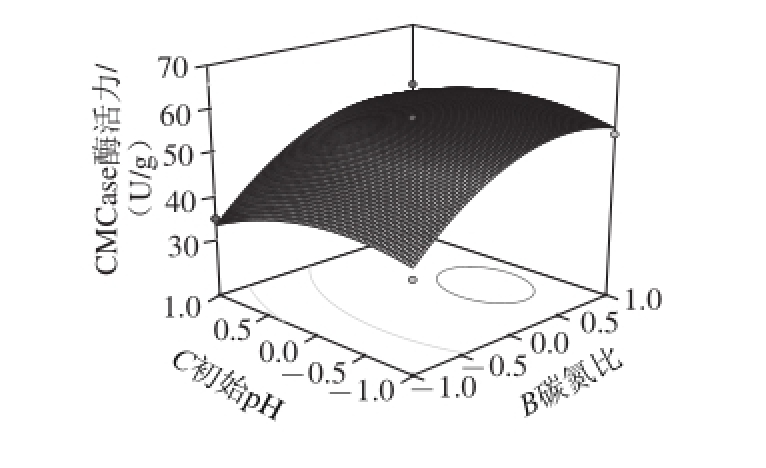
图10 碳氮比和初始pH值比对CMCase酶活力的影响
Fig. 10 Effects of carbon/nitrogen ratio and initial medium pH on CMCase production
由图10可知,CMCase酶活力随碳氮比和初始pH值的升高先升高再降低,碳氮比对CMCase酶活力的影响较初始pH值大。在试验水平范围内,碳氮比和初始pH值分别在20∶1~30∶1(m/m)和3.0~3.5范围内时,CMCase酶活力可以达到试验中的最大值。
2.2.3 验证实验结果
根据Design-Expert软件分析得出3 个影响因素的最佳组合为:碳氮比25∶1(m/m)、初始pH值3.2、料水比1∶3.25(m/V),该条件下CMCase酶活力预测值为58.15 U/g。为检验其可靠性,在该条件下重复实验3 次,得到CMCase酶活力为57.996 U/g,实测值与理论值基本吻合,说明响应面分析法得到的固体产酶的工艺条件真实可靠,具有一定使用价值。
本研究以菌株J-5为研究对象,接种于以大蒜皮为唯一碳源的产酶固体培养基,单因素试验最佳降解条件为:氮源为硫酸铵、碳氮比20∶1(m/m)、初始pH值4.0、料水比1∶3(m/V)、发酵温度38 ℃、发酵时间144 h、辅助碳源1 g/100 g。影响菌种产酶的因素较多,响应面法可同时对影响生物产量的因子水平及相互作用进行优化和评价,可快速确定多因子系统的最佳条件 [25]。响应面试验表明各因素的主效应关系为:B(碳氮比)>A(料水比)>C(初始pH值),最终最佳优化条件为:碳氮比25∶1(m/m),初始pH值3.2,料水比1∶3.25(m/V)。此条件下,CMCase酶活力预测值为58.15 U/g,验证实验酶活力为57.996 U/g。研究证实该菌株J-5对大蒜素等有抵抗作用,可正常生长并高效降解大蒜皮。
参考文献:
[1] 殷实, 先世碧. 腐败稻草中产纤维素菌种的筛选及产酶条件研究[J]. 江苏农业科学, 2010, 38(3): 417-419. DOI:10.3969/ j.issn.1002-1302.2010.03.170.
[2] 孔雪旺, 韩站强, 周敏, 等. 大蒜秸秆在肉羊育肥中的应用试验[J].畜牧科学, 2013, 36(6): 76-77.
[3] 魏玲, 程智慧, 张亮. 不同品种大蒜秸秆水浸液对番茄的化感效应[J].西北农林科技大学学报, 2008, 36(10): 139-145. DOI:10.3321/ i.issn:1671-9387.2008.10.024.
[4] 赵小蓉, 林启美. 纤维素分解菌对不同纤维素类物质的分解作用[J].微生物学杂志, 2000, 20(3): 12-14.
[5] AHAMED A, VERMETTE P. Effect of mechanical agitation on the production of cellulases by Trichoderma reesei RUT-C30 in a drafttube airlift bioreactor[J]. Biochemical Engineering Journal, 2010, 49(3): 379-387. DOI:01.1016/j.Bej.2010.01.014.
[6] GUO X Z, SUI Z R. Rhizobium borbori sp. nov. aniline degrading bacteria isolated from activated sludge[J]. International Jounal of Systematic and Evolutionary Microbiology, 2011, 61: 816-822. DOI:10.1099/ijs.0.022228-0.
[7] 张晓月, 孜力汗, 李勇昊. 里氏木霉Rut-C30产纤维素酶培养基优化及酶解特性[J]. 过程工程学报, 2014, 14(2): 312-317.
[8] 张洪斌, 陈贤东, 胡雪芹, 等. 一株里氏木霉产纤维素酶发酵条件的研究[J]. 食品科学, 2008, 29(11): 375-378. DOI:10.3321/ j.issn.1002-6630.2008.11.085.
[9] 林志伟, 孙冬梅, 张红梅, 等. 黄绿木霉菌产纤维素酶条件的优化[J].微生物学通报, 2008, 35(1): 59-62. DOI:10.13344/j.Microbiol. China,2008.01.020.
[10] 刘颖, 张玮玮, 王馥. 绿色木霉产纤维素酶发酵条件的研究[J]. 食品工业科技, 2008, 29(3): 128-130. DOI:10.13386/ j.issn1002-0306.2008.03.009.
[11] 王芳, 陈介南, 张林, 等. 产纤维素酶里氏木霉的研究进展[J]. 中国酿造, 2014, 33(6): 1-5. DOI:10.11882/j. issn.0254-5071.2014.06.001.
[12] 王海滨, 韩立荣. 高效纤维素降解菌的筛选及复合菌系的构建[J].农业生物技术学报, 2015, 23(4): 421-431. DOI:10.3969/j.issn. 1674-7968.2015.04.001.
[13] 刘凯, 戴莉. 纤维素酶生产技术的研究进展[J]. 生物产业技术, 2014, 10(3): 59-65. DOI:10.3969/j.issn.1674-0319.2014.03.008.
[14] 王晓芳, 徐旭士, 吴敏, 等. 不同碳源对两株真菌纤维素酶合成的诱变与调控[J]. 应用与环境生物学报, 2002, 8(6): 653-657. DOI:10.3321/j. issn.1006-687x.2002.05.019.
[15] EMSLEY A M. Cellulosic ethanol reignitse the fire of cellulose degradation[J]. Cellulose, 2008, 15: 187-192. DOI:10.1007/s10570-007-9191-3.
[16] NEAGU D A, DESTAIN J. Trichoderma reesei cellulase produced by submerged versus solid state fermentations[J]. Bulletin of University of Agriculture Sciences and Verinary Medicine, 2012, 69(2): 320-326. DOI:10.4061/2011/658493.
[17] 刘林明, 王燕. 响应面法优化纤维素酶发酵工艺[J]. 山东食品发酵, 2014, 43(14): 35-40.
[18] 李悦, 薛桥丽. 响应面法优化小刺青霉16-7产纤维素酶液体发酵工艺[J]. 食品科学, 2014, 35(17): 137-145. DOI:10.7506/spkx1002-6630-201417028.
[19] 柴秀娟, 李曹龙. 产纤维素酶菌株的筛选、鉴定及产酶条件的优化[J].生物技术通报, 2014, 12(9): 164-170.
[20] KAWAI T, NAKAZAWA H. A comprehensive analysis of the effects of the main component enzymes of cellulase derived from Trichoderma reeseion biomass saccharification[J]. Industrial Microbiology and Biotechnology, 2013, 40(8): 805-810. DOI:10.1007/s10295-013-1290-6.
[21] FANG Hao, XIA Liming. High activity cellulase production by recombinant Trichoderma reesei ZU-02 with the enhanced cellobiohydrolase production[J]. Bioresource Technology, 2013, 144: 693-697. DOI:10.1016/j. Biortch.2013.06.120.
[22] 冯培勇, 赵彦宏, 张丽. 响应面法优化黑曲霉产纤维素酶发酵条件[J]. 食品科学, 2009, 30(23): 335-339. DOI:10.3321/ j.issn:1002-6630.2009.23.076.
[23] 唐蕊, 张雪辉. 纤维素分解菌ZJW-4产酶条件研究[J]. 北方园艺, 2010, 32(20): 148-149. DOI:10.11937/bfyy.201020054.
[24] 蒋志刚, 李春旺, 曾岩, 等. 生物实验设计与数据分析[M]. 北京: 高等教育出版社, 2003: 185-186.
[25] TRUPKIN S, LEVIN L, FORCHIASSIN F. Optimizationg of a culture medium for ligninolytic enzyme production and synthetic dye decolorization using response surface methodology[J]. Industrial Microbiology and Biotechnology, 2003, 30(12): 682-690. DOI:10.1007/s10295-003-0099-0.
Optimization of Study on Fermentation Conditions of Bacillus J-5 for Degrading Garlic Peel
LIANG Baodong 1, WEI Haixiang 1, JIANG Shuzhe 2, YANG Yongtao 1
(1. Department of Life Science and Engineering, Jining University, Qufu 273155, China; 2. College of Life Sciences, Shandong University, Jinan 250013, China)
Abstract:Response surface methodology was applied to optimize the fermentation conditions of Bacillus J-5 for the production of carboxymethyl cellulase (CMCase). Firstly, the effect of medium components and culture conditions such as nitrogen source, carbon/nitrogen ratio, solid-to-liquid ratio, fermentation temperature, fermentation duration and supplementary carbon source on CMCase activity was examined by the one-factor-at-a-time method. Secondly, carbon/ nitrogen ratio, solid-to-liquid ratio and initial medium pH were selected for the investigation of their effects on CMCase activity as well as the interaction among them by response surface analysis (RSA). The optimal conditions for CMCase production were established as follows: carbon/nitrogen ratio, 25:1 (m/m); initial medium pH, 3.2; solid-to-liquid ratio, 1:3.25 (m/V), fermentation temperature, 38 ℃; fermentation duration, 144 h; and supplementary carbon source concentration, 1 g/100 g. Under these conditions, the predicted value of CMCase activity was 58.15 U/g, agreeing with the experimental value of 57.996 U/g. The high CMCase activity from Bacillus J-5 could effectively degrade garlic peel.
Key words:garlic peel; carboxymethyl cellulase; response surface analysis
DOI:10.7506/spkx1002-6630-201621034
中图分类号:Q939.97
文献标志码:A
文章编号:1002-6630(2016)21-0202-07
引文格式:
梁宝东, 魏海香, 姜淑喆, 等. 大蒜皮降解芽孢杆菌属细菌J-5发酵条件优化[J]. 食品科学, 2016, 37(21): 202-208.
DOI:10.7506/spkx1002-6630-201621034. http://www.spkx.net.cn
LIANG Baodong, WEI Haixiang, JIANG Shuzhe, et al. Optimization of study on fermentation conditions of Bacillus J-5 for degrading garlic peel[J]. Food Science, 2016, 37(21): 202-208. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621034. http://www.spkx.net.cn
收稿日期:2016-01-24
基金项目:济宁市产学研合作发展计划项目(2014JNKJ02)
作者简介:梁宝东(1979—),男,讲师,硕士,研究方向为微生物发酵。E-mail:liangbaodong@126.com
1∶3.25(m/V)、发酵温度38 ℃、发酵时间144 h、辅助碳源1 g/100 g,此条件下,CMCase酶活力预测值为58.15 U/g,
实测值为57.996 U/g。该菌株可产生较高酶活力的CMCase,可有效地降解大蒜皮。