
图1 4 种异黄酮类化合物结构图
Fig. 1 Structures of four different isoflavonoids
刘科梅 1,聂 挺 1,潘栋梁 1,胡 川 1,陆 豫 2,余 勃 2,*
(1.南昌大学资源环境与化工学院,鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330031;2.南昌大学中德联合研究院,江西 南昌 330047)
摘 要:为探究异黄酮类化合物抗氧化活性的构效关系,以染料木素、大豆苷元、橙桑黄酮、奥沙京4 种异黄酮类分子为代表展开研究。测定了4 种分子的体外抗氧化活性,并与文献报道进行分析比对。对4 种分子进行分子模拟,得到稳定的优势构象并对其进行相关量子化学计算。结果分析表明,4 种异黄酮分子清除自由基能力与其酚羟基位置电子转移和脱氢能力有关,前线分子轨道能直观地展现抗氧化物的分子活性部位,而能隙和自由基生成热能准确表征4 种异黄酮分子抗氧化活性顺序,对于4 种分子的多羟基位自由基生成热分析可知,4’-OH是染料木素和大豆苷元最主要的羟基活性部位,3’-OH是橙桑黄酮和奥沙京最主要的羟基活性部位,4’-OH和3’-OH可分别作为表征这4 种分子清除自由基活性的位点。
关键词:异黄酮;量子化学计算;清除自由基;前线分子轨道;自由基生成热
异黄酮类化合物在自然界的植被中广泛存在,因其具有诸多生物活性而被人们普遍关注 [1]。特别是许多异黄酮化合物具有显著的抗氧化活性,能够有效阻断自由基链式反应。大量研究表明,异黄酮化合物的调节免疫、改善心脑血管疾病、抗肿瘤和抗病毒等生理作用与其抗氧化活性相关 [2-4]。直接和间接清除氧自由基是异黄酮化合物发挥抗氧化作用的主要方式。目前普遍较为认同的异黄酮化合物抗氧化作用机制主要分为单电子转移和氢原子转移2 种 [5-7]。单电子转移指的是异黄酮类分子把其单电子转到临近的氧上从而产生阳离子基团,然后与其他自由基结合阻断或抑制自由基链式反应;氢原子转移则指的是异黄酮抗氧化物将其酚羟基结构上的氢原子脱去,生成异黄酮酚氧自由基,从而产生抗氧化作用。所以异黄酮化合物的抗氧化活性强弱取决于生成自由基的稳定性,生成的自由基越稳定,其抗氧化活性就越强。因此量子化学中分子结构上的羟基位氢自由基生成热将与其分子抗氧化活性具有良好的相关性 [8]。
本研究拟用植食性食物中广泛分布的4 种异黄酮类化合物为研究对象(图1),其中染料木素相比大豆苷元多一个5’-OH,橙桑黄酮相比奥沙京多一个3’-OH。

图1 4 种异黄酮类化合物结构图
Fig. 1 Structures of four different isoflavonoids
首先对这4 种异黄酮的抗氧化活性进行测定,包括1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除能力和氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)。然后利用量子化学计算得出4 种异黄酮的前线分子轨道中的最高占据分子轨道(highest occupied molecular orbital,HOMO)和最低占据分子轨道(lowest occupied molecular orbital,LUMO)能隙、原子净电荷分布以及各羟基位发生抽氢反应的自由基生成热(heat of formation,HOF)等相关量化理论参数。通过分析实测值和理论计算值的相关性,从理论和实际两方面揭示4 种异黄酮的构效关系。研究对于进一步探讨天然抗氧化物活性与结构的关系,揭示其清除自由基的具体作用机制,具有理论和现实的参考意义。
1.1 材料与试剂
染料木素、大豆苷元、橙桑黄酮、奥沙京标品(98%) 北京瑞尼克生物技术有限公司;Tris-HCl缓冲液、邻苯三酚、FeSO 4、水杨酸、DPPH试剂盒、ORAC试剂盒 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
752C可见光分光光度计 上海第三分析仪器厂;Finnpipette微量移液器 美国热电公司;台式冷冻离心机 美国Sigma公司;T型恒温水浴锅 德国LAUDA公司;ER-180A型电子分析天平 日本AND公司;高性能计算集群浪潮天梭TS10000、Gaussian09软件 南昌大学高等研究院。
1.3 方法
1.3.1 DPPH自由基清除活性的测定
参照文献[9]的方法,DPPH的甲醇溶液呈深紫色,可见光区最大吸收峰为517 nm。当自由基清除剂加入到DPPH溶液中时,DPPH的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度减少,溶液颜色变浅的程度与配电子数成化学计量关系。因此,可通过吸光度减弱的程度来评价自由基被消除的情况。测定时将样品溶于去离子水中配成相同浓度溶液,分别取5 mL样品与5 mL 1×10 -4mol/L DPPH无水乙醇溶液并充分混合,然后恒温5 ℃避光反应30 min,取样在517 nm波长处测定吸光度。同时使用等体积的无水乙醇溶液替代DPPH溶液作空白对照,等体积的蒸馏水替代样品溶液作为对照组。清除率按式(1)计算。
式中:A i为样品组吸光度;A j为空白组吸光度;A 0为对照组吸光度。
以水溶性VE为标准品(以Trolox当量计),绘制Trolox浓度与DPPH自由基清除率的标准曲线;再将待测物质与DPPH反应,得到清除率值,计算得到与该清除率相当的Trolox浓度,进而得到Trolox当量抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)值,单位为μmol TE/g [10]。
1.3.2 ORAC的测定
具体操作步骤 [11-12]:在96 孔板各微孔中分别加入待测样品20 μL后添加磷酸钾缓冲溶液20 μL及荧光素FL 20μL,在37 ℃条件下预置5 min后,用多道移液器迅速在各孔中加入自由基产生剂2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)140 μL启动反应,并将微孔板置于荧光分析仪中,在37 ℃条件下以激发波长485 nm,发射波长538 nm进行连续测定,每2 min测定一次各孔荧光强度,测定时间一般设定在荧光衰减至基线后为止。样品的氧自由基清除能力ORAC值是通过荧光衰退曲线的保护面积与标准抗氧化物质的保护面积相比得出。ORAC值以抗氧化标准物质Trolox当量(μmol TE/μmol、μmol TE/mL及μmol TE/mg)表示 [13],按式(2)计算。
式中:AUC Sample、AUC Trolox及AUC +AAPH分别为样品、标品及空白组与自由基作用下荧光衰退曲线下面积(area under the curve,AUC); c t为Trolox浓度/(μmol/L); c为样品浓度/(μmol/L)。
1.4 数据分析与统计
清除自由基活性数据用± s(每组实验设3 次重复,2 次平行)表示,采用方差分析和新复极差法对各组数据进行显著性检验。
1.5 计算模型与方法
首先使用Chem3D程序构建染料木素、大豆苷元、橙桑黄酮、奥沙京分子及其脱氢后的自由基的几何构型,然后使用半经验法PM6和分子力学法MM2对构建的初步分子模型进行初步优化 [14],最后将优化结果输入Gaussian09程序中,运用密度泛函(density functional theory,DFT)法B3LYP/6-311G(dd,pp)基组对初步优化的构型进行全几何构型优化并进行频率分析,优化直至无虚频产生,证明已得到能量最低的优势构象 [15](图2)。
得到需要的优势构象后,最后通过密度泛函法DFT计算前线分子轨道HOMO和LUMO能隙、原子净电荷分布以及298 K时不同羟基位发生抽氢反应的自由基生成热差(∆HOF)等相关量化理论参数。
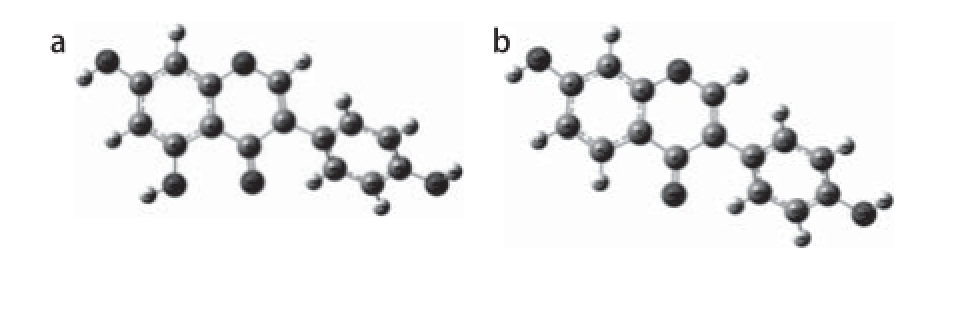

图2 4 种异黄酮类化合物的优势构象
Fig. 2 Energy-minimized conformations of four different isoflavonoids
2.1 4 种异黄酮抗氧化活性
表1 4 种异黄酮的DPPH自由基清除的TEAC值
Table 1 TEAC of DPPH radical scavenging activity of four isoflavones μmol TE/g

注:-. 无抗氧化活性;同行肩标字母不同表示差异显著( P<0.05)。后同。
抗氧化剂浓度/(μmol/L)染料木素大豆苷元橙桑黄酮奥沙京0.005----0.01--38.670±1.8 c-0.0539.252±2.4 a-143.532±12.1 c-0.175.448±5.3 a-330.224±27.4 c-146.968±4.2 a40.923±3.4 b--5177.276±13.7 a136.269±11.6 b--
由表1可知,在抗氧化剂浓度为0.1 μmol/L及以下时,大豆苷元无抗氧化活性,橙桑黄酮在浓度为0.005 μmol/L及以下时也无抗氧化能力,奥沙京在0.005~5 μmol/L浓度范围均无抗氧化活性表现。橙桑黄酮在浓度为0.05 μmol/L和0.10 μmol/L时TE值相比染料木素相同浓度条件下的TE值要高许多,所以此方法得知4 种异黄酮抗氧化活性顺序为橙桑黄酮>染料木素>大豆苷元、奥沙京。其中大豆苷元和奥沙京两者活性顺序无法判断。
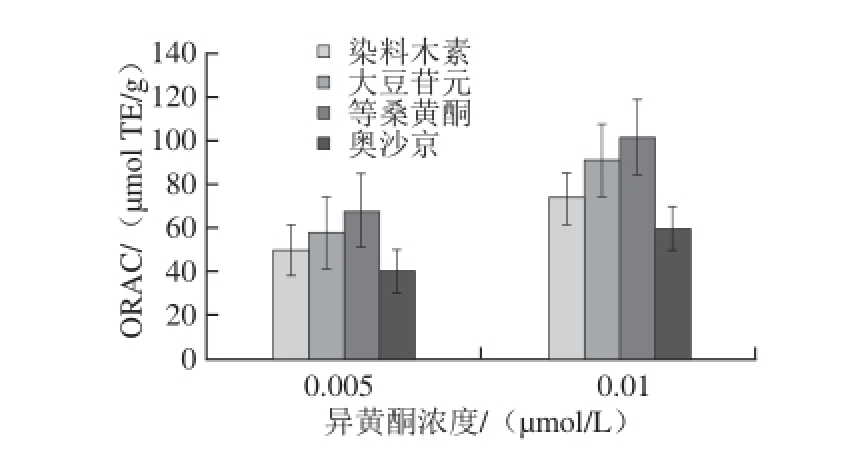
图3 4 种异黄酮类化合物的ORAC值
Fig. 3 ORAC values of four different isoflavones
由于大豆苷元和奥沙京2 种异黄酮抗氧化活性还不明确,于是使用ORAC的测定来表征4 种分子的抗氧化活性。由图3可知,橙桑黄酮的抗氧化活性最高,与DPPH法测得橙桑黄酮的抗氧化活性结果一致;奥沙京活性则最低,染料木素和大豆苷元的平行数据差异性较大,暂无法判断两者抗氧化活性顺序;综合DPPH法和ORAC法两种化学评价方法,得到的4 种异黄酮抗氧化活性的顺序为橙桑黄酮>染料木素>大豆苷元>奥沙京。
2.2 前线分子轨道分布与抗氧化活性关系

图4 染料木素(a)、大豆苷元(b)、橙桑黄酮(c)和奥沙京(d)的前线分子轨道分布
Fig. 4 HOMO and LUMO frontier molecular orbitals of four isoflavones
量子化学理论认为,前线分子轨道分布图可以直观反映抗氧化物清除自由基的主要活性部位 [16]。其中最主要的分子轨道主要有两条:HOMO和LUMO。通过计算相关数据再通过GView程序显示4 种异黄酮的前线分子轨道分布图(图4)。从图4a、b可以看出,染料木素和大豆苷元的2 种异黄酮分子最高占据轨道HOMO轨道都主要分布在B环,而最低占据轨道LUMO则主要分布于C环。所以当2 种异黄酮分子发生电子转移时,发挥清除自由基作用的关键基团主要集中在B环以及B环上与C环共轭的部分,所以证明这些部位就是参与自由基清除反应作用较强的活性部位。同理从图4c、d可以看出,橙桑黄酮和奥沙京的最高占据轨道HOMO主要分布在B环,最低占据轨道LUMO则主要分布在A环。当2 种异黄酮分子发生电子转移时,二者反应活性部位主要集中在B环上。
2.3 能隙与抗氧化活性关系
分子轨道理论认为,能隙是表征抗氧化剂清除自由基能力的一个重要量化参数,若抗氧化剂的能隙越小,则形成反应活化态所需的能量越小,分子中的电子越容易发生跃迁,化合物越容易发生化学反应,则抗氧化活性越高 [17]。
表2 染料木素、大豆苷元、橙桑黄酮、奥沙京的前线分子轨道(HOMO和LUMO)的轨道能和能隙
Table 2 The frontier orbital energy and energy gap of genistein, daidzein, pomiferin and osajin
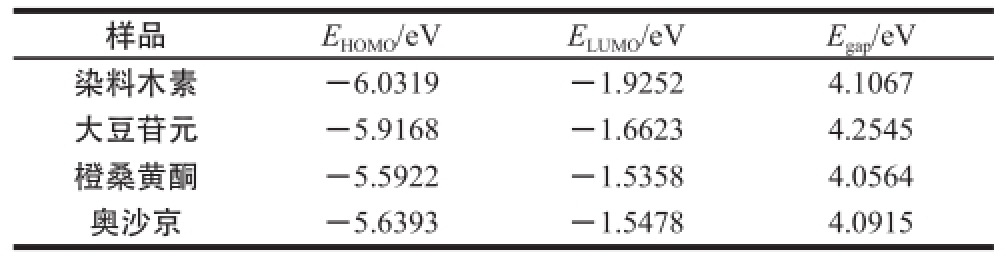
注:E HOMO和E LUMO为前线分子轨道(HOMO和LUMO)的轨道能;E gap为能隙。
样品E HOMO/eVE LUMO/eVE gap/eV染料木素-6.0319-1.92524.1067大豆苷元-5.9168-1.66234.2545橙桑黄酮-5.5922-1.53584.0564奥沙京-5.6393-1.54784.0915
由表2分析可知,染料木素能隙为4.106 7 eV ,大豆苷元能隙为4.254 5 eV,即表征的抗氧化活性顺序为:染料木素>大豆苷元。同理,橙桑黄酮为4.056 4 eV,奥沙京为4.091 5 eV,即表征的抗氧化活性顺序为:橙桑黄酮>奥沙京,分析结果与表1实验测定的活性顺序相符。
2.4 ∆HOF与抗氧化活性关系
在抗氧化剂众多的抗氧化作用机理中,氢原子转移也是其中一种。氢原子转移机制中,抗氧化剂分子失去酚羟基氢原子生成酚氧自由基。因此,分子热力学理论认为,在此过程中,如果羟基位∆HOF越小,抽氢反应就越容易进行 [18]。
对异黄酮化合物而言,多羟基活性部位发生抽氢反应生成的自由基越稳定,从而抑制自由基链式反应能力越强,表明其抗氧化活性越强。表3列出了4 种异黄酮分子在不同羟基取代部位发生抽氢反应的∆HOF。
表2 染料木素、大豆苷元、橙桑黄酮、奥沙京的前线分子轨道(HOMO和LUMO)的轨道能和能隙
Table 2 The frontier orbital energy and energy gap of genistein, daidzein, pomiferin and osajin

取代基位置∆HOF /(kcal/mol)染料木素大豆苷元橙桑黄酮奥沙京3’-OH--81.00-4’-OH91.7993.73100.2290.28 5-OH104.30-101.40101.64 7-OH107.62106.40--
从计算结果可知,对染料木素和大豆苷元而言,4’-OH位置与5-OH、7-OH位置相比较,其最容易发生抽氢反应生成酚氧自由基,从而阻止或抑制自由基链式反应的发生。因此,4’-OH是这2 种异黄酮的主要活性部位,可以被作为表征这染料木素和大豆苷元2 种异黄酮抗氧化活性的一个重要量化参数。4’-OH位置羟基基团的∆HOF值分别为:染料木素91.79 kcal/mol,大豆苷元93.73 kcal/mol (表3),即抗氧化活性顺序为染料木素>大豆苷元。此推测结果与前线分子轨道能级差预测得到的抗氧化活性顺序一致。
对于橙桑黄酮而言,3’-OH位点的∆HOF显著低于4’-OH和5-OH位点的,说明3’-OH位点为橙桑黄酮的主要活性羟基位点。对奥沙京而言,4’-OH和5-OH位置相比较,4’-OH位置较容易发生抽氢反应,说明其清除自由基的活性基团为4’-OH位置的酚羟基。对比两者活性基团的∆HOF可知,橙桑黄酮的3’-OH为81 kcal/mol,小于奥沙京4’-OH的90.28 kcal/mol(表3),故预测橙桑黄酮抗氧化活性大于奥沙京。此结果也与前面通过前线分子轨道能级差讨论得到的抗氧化活性顺序一致。
由此可知4’-OH可以被认为是染料木素和大豆苷元最主要的羟基活性部位,即可用其4’-OH的∆HOF来表征其分子抗氧化能力;3’-OH的可以被认为是橙桑黄酮和奥沙京最主要的羟基活性部位,即可用具有3’-OH的HOF来表征其分子抗氧化能力;比对4 种异黄酮分子具有3’-OH和4’-OH的∆HOF,推测其抗氧化活性顺序为:橙桑黄酮>染料木素>大豆苷元>奥沙京,此分析结果与实验测定的活性顺序相符。
众多对天然抗氧化剂的研究结果已表明,与清除自由基相关的作用机制有以下3 种:1)供氢:通过活性基团与自由基进行抽氢反应(R’OO•+RXH→R’OOH+RX•)生成一个更稳定的自由基,从而中断自由基链式反应(反应式中R代表C、N、O、S等);2)供电子:通过抗氧化剂的还原作用(R’OO•+RXH→R’OO -+RXH+→R’OOH+RX )直接给出电子而清除自由基(反应式中R代表C、N、O、S等);3)螯合金属:通过抗氧化剂对金属离子的络合,降低需金属离子催化的产自由基的Ferton反应(O 2 -+H 2O 2→O 2+OH+OH -)的速率,从而间接实现抗氧化作用。
量子化学计算是根据量子化学的理论,采用不同算法获得相应的量化参数,并以此来解释或预测原子、分子和晶体的各种性质。近年来,随着计算服务器和大型工作站的出现以及有关量子化学计算软件的大量推出,量子化学计算已被广泛应用于生物大分子体系的研究中。
Pasha等 [19]研究发现,黄酮类抗氧化剂清除自由基活性与酚羟基O—H键强度成反比,O—H键强度越低,则活性越高。而可用来表征O—H键强度的量子化学参数有ΔHOF和键解离焓(bond dissociation enthalpy,BDE)等。Mikulski等 [20]认为生育酚类清除自由基的作用机制中包含电子转移成分,因此近来也有采用自由基清除剂的给电子能力作为理论指标的。这一类参数包括最高占据分子轨道HOMO能级差,即ΔHOMO;电离势(ionization potential,IP)等。Zhang Hongyu等 [21]以ΔHOF、ΔHOMO、BDE、IP为理论指标,采用密度泛函理论DFT结合半经验算法对包括茶多酚、五味子素、芦丁、黄芩苷等多种天然抗氧化剂的构效关系和清除自由基机理进行了研究,不仅确定了体现活性的关键基团,还从理论上解释了各化合物清除自由基的反应机制。周敏娜等 [22]利用量子化学计算研究了VA、VC和类胡萝卜素清除自由基的活性位点和还原性特征。
如今,利用量子化学计算对天然活性成分的活性位点进行确定及研究其构效关系已成为十分活跃的研究手段。目前国内外相关研究中,绝大多数都是利用量子化学计算方法计算出抗氧化剂的各种参数,然后结合具体实验结果并借助回归分析确定理论参数与清除自由基速率常数的对数(lgk s)相关程度,因此要选择能较好反映抗氧化剂活性的参数。能用来表征抗氧化活性的主要参数有ΔHOF、BDE、HOMO、IP等。
研究通过B3LYP的密度泛函理论DFT方法和6-311G(dd,pp)基组,使用Gaussian09程序对染料木素、大豆苷元、橙桑黄酮、奥沙京4 种异黄酮类分子进行相关量子化学计算。首先通过优化和频率分析,直至无虚频出现,得到4 种分子的优势构象,然后使用同样方法和机组对4 种分子计算出前线分子轨道能E HOMO和E LUMO、能隙、多羟基位的ΔHOF等相关量子化学理论参数。通过这些理论参数研究4 种异黄酮分子清除自由基机理发现,分子清除自由基能力与其各羟基位电子转移能力和脱氢能力有关,即羟基位电子越活跃,越容易发生抽氢反应;前线分子轨道图能直观的展示4 种异黄酮化合物的活性部位,能隙能准确表征4 种异黄酮分子抗氧化活性顺序,能隙较小的抗氧化物前线轨道电子容易被激发,从而发生电子跃迁,反应越容易进行,即抗氧化活性较强。对4 种异黄酮分子的多羟基位HOF分析可知,4’-OH是染料木素和大豆苷元最主要的羟基活性部位,3’-OH是橙桑黄酮和奥沙京最主要的羟基活性部位,这2 个羟基位的量化参数可以分别作为预测4 种异黄酮分子的抗氧化活性顺序的主要指标。且由以上相关理论参数预测4 种异黄酮分子的抗氧化活性顺序与实验测得结果是一致的。
通过量子化学计算,进一步探讨天然抗氧化物活性与结构的关系,揭示其清除自由基的具体作用机制,对于异黄酮乃至多酚类化合物的基础研究和指导开发抗氧化食品或辅助药物,都具有理论和现实参考意义。
参考文献:
[1] 邢军, 李友广, 谢丽琼. 黄酮类化合物: 植物异黄酮的研究进展与展望[J]. 新疆大学学报(自然科学版), 2006, 23(2): 207-210. DOI:10.3969/j.issn.1000-2839.2006.02.019.
[2] WANG F, WANG H, WANG D, et al. Isoflavone, γ-aminobutyric acid contents and antioxidant activities are significantly increased during germination of three Chinese soybean cultivars[J]. Journal of Functional Foods, 2015, 14: 596-604. DOI:10.1016/j.jff.2015.02.016.
[3] AI-QUDAH M A, SALEH A M, AI-JABER H I, et al. New isoflavones from Gynandriris sisyrinchium and their antioxidant and cytotoxic activities[J]. Fitoterapia, 2015, 107: 15-21. DOI:10.1016/ j.fitote.2015.09.020.
[4] CHO D Y, LEE M K, KIM E A, et al. Analysis of the isoflavone content, antioxidant activity, and SDS-PAGE of cheese analogs produced with different proteolysis and soymilk residue contents[J]. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(4): 501-509. DOI:10.1007/s13765-015-0064-4.
[5] ALCARO S, CHIODO S G, LEOPOLDINI M, et al. Antioxidant efficiency of oxovitisin, a new class of red wine pyranoanthocyanins, revealed through quantum mechanical investigations[J]. Journal of Chemical Information and Modeling, 2013, 53(1): 66-75. DOI:10.1021/ci300354s.
[6] SZELAG M, MIKULSKI D, MOLSKI M. Quantum-chemical investigation of the structure and the antioxidant properties of alphalipoic acid and its metabolites[J]. Journal of Molecular Modeling, 2012, 18(7): 2907-2916. DOI:10.1007/s00894-011-1306-y.
[7] SARKAR A, MIDDYA T R, JANA A D. A QSAR study of radical scavenging antioxidant activity of a series of flavonoids using DFT based quantum chemical descriptors-the importance of group frontier electron density[J]. Journal of Molecular Modeling, 2012, 18(6): 2621-2631. DOI:10.1007/s00894-011-1274-2.
[8] 荣玉芝, 王正武. 两种异黄酮化合物抗氧化活性的理论研究[J].食品与药品, 2012, 22(9): 317-319. DOI:10.3969/j.issn.1672-979X.2012.09.005.
[9] 聂挺, 单艳, 胡川, 等. 量子化学计算对4种抗氧化肽清除自由基活性机理判别分析[J]. 南昌大学学报(理科版), 2015, 39(1): 70-75. DOI:10.3969/j.issn.1006-0464.2015.01.013.
[10] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[11] 续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报, 2006, 22(8): 1015-1021. DOI:10.3321/ j.issn:1001-1978.2006.08.029.
[12] 韩飞, 周孟良, 钱健亚, 等. 抗氧化剂抗氧化活性测定方法及其评价[J]. 粮油食品科技, 2009, 17(6): 54-57. DOI:10.3969/ j.issn.1007-7561.2009.06.021.
[13] D VALOS A, G MEZ-CORDOV S C, BARTOLOM B. Extending applicability of the oxygen radical absorbance capacity (ORAC-fluorescein) assay[J]. Journal of Agricultural and Food Chemistry, 2004, 52(1): 48-54. DOI:10.1021/jf0305231.
[14] MITRA I, SAHA A, ROY K. Quantitative structureactivity relationship modeling of antioxidant activities of hydroxybenzalacetones using quantum chemical, physicochemical and spatial descriptors[J]. Chemical BIology and Drug Design, 2009, 73(5): 526-536. DOI:10.1111/j.1747-0285.2009.00801.x.
[15] PATTERSON J. Density functional theory of atoms and molecules[M]. Oxford: Oxford University Press, 1991: 277-284. DOI:10.1073/ pnas.76.6.2522.
[16] AGNIHOTRI N, MISHRA P C. Mechanism of scavenging action of N-acetylcysteine for the OH radical: a quantum computational study[J]. The Journal of Physical Cemistry B, 2009, 113(35): 12096-12104. DOI:10.1021/jp903604s.
[17] ALASALVAR C, SOYLU M S, GUDER A. Molecular structure, quantum mechanical calculation and radical scavenging activities of (E)-4,6-dibromo-2-[(3,5-dimethylphenylimino)methyl]-3-methoxyphenol and (E)-4,6-dibromo-2-[(2,6-dimethylphenylimino) methyl]-3-methoxyphenol compounds[J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2014, 130: 357-366. DOI:10.1016/j.saa.2014.03.069.
[18] van ACKER S A B E, KOYMANS L M H, BAST A. Molecular pharmacology of vitamin E: structural aspects of antioxidant activity[J]. Free Radical Biology and Medicine, 1993, 15(3): 311-328. DOI:10.1016/0891-5849(93)90078-9.
[19] PASHA F A, CHO S J, BEG Y, et al. Quantum chemical QSAR study of flavones and their radical-scavenging activity[J]. Medicinal Chemistry Research, 2007, 16(7/8/9): 408-417. DOI:10.1007/s00044-007-9060-5.
[20] MIKULSKI D, MOLSKI M. A quantum chemical study on the antioxidant activity of bioactive polyphenols from peanut (Arachis hypogaea) and the major metabolites of trans-resveratrol[J]. Computational and Theoretical Chemistry, 2012, 981: 38-46. DOI:10.1016/j.comptc.2011.11.042.
[21] ZHANG H Y, CHEN D Z. Theoretical elucidation on activity differences of ten flavonoid antioxidants[J]. Acta Biochimica et Biophysica Sinica, 2000, 32(4): 317-321. DOI:10.3969/ j.issn.1674-7224.1999.01.013.
[22] 周敏娜, 杨英杰, 吕庆章. 4种类胡萝卜素抗氧化性质的量化计算[J].计算机与应用化学, 2011, 28(10): 1305-1308. DOI:10.3969/ j.issn.1001-4160.2011.10.018.
Structure-Activity Relationship of Four Isoflavones for Scavenging Free Radicals Evaluated by Quantum Chemistry Calculation
LIU Kemei
1, NIE Ting
1, PAN Dongliang
1, HU Chuan
1, LU Yu
2, YU Bo
2,*
(1. Key Laboratory of Poyang Lake Environment and Resource Utilization, Ministry of Education, School of Environment and Chemical Engineering, Nanchang University, Nanchang 330031, China; 2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Abstract:Isoflavones are a large class of polyphenols with biological activity. They are currently the subject of extensive research for their significant antioxidant activity. This investigation determined and compared the in vitro antioxidant activity of genistein, daidzein, pomiferin and osajin isoflavones as representative isoflavones with reported data in the literature and further explored their structure-activity relationships for 1,1-diphenyl-2-picrylhydrazyl (DPPH) scavenging capacity and oxygen radical absorbance capacity (ORAC). Molecular simulation of the four molecules was carried out. As a result, stable dominant conformation was obtained and studied by quantum chemistry calculation. It was found that the four isoflavones indicated an association between free radical scavenging ability and electron transfer at the phenolic hydroxyl position as well as dehydrogenation capacity. Frontier molecular orbital could intuitively show the active sites of the molecules and based on energy gap and the enthalpy of formation of free radicals the antioxidant activity of the four isof avones could be accurately ranked. Based on the enthalpy of formation of polyhydroxyl free radicals, 4’-OH was the main hydroxyl active site of genistein and daidzein, and 3’-OH was the main hydroxyl active site of pomiferin and osajin. Therefore, 4’-OH and 3’-OH can be considered as the representative active sites of the four isof avonemolecules for scavenging free radicals.
Key words:isoflavone; quantum chemistry calculation; free radical scavenging; frontier molecular orbital; heat of formation of free radical
DOI:10.7506/spkx1002-6630-201623001
中图分类号:TS272;O641
文献标志码:A
文章编号:1002-6630(2016)23-0001-06
引文格式:
刘科梅, 聂挺, 潘栋梁, 等. 4 种异黄酮抗氧化活性的构效关系[J]. 食品科学, 2016, 37(23): 1-6. DOI:10.7506/spkx1002-6630-201623001. http://www.spkx.net.cn
LIU Kemei, NIE Ting, PAN Dongliang, et al. Structure-activity relationship of four isoflavones for scavenging free radicals evaluated by quantum chemistry calculation[J]. Food Science, 2016, 37(23): 1-6. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623001. http://www.spkx.net.cn
收稿日期:2016-05-26
基金项目:国家自然科学基金青年科学基金项目(31301435)
作者简介:刘科梅(1994—),女,硕士研究生,研究方向为生物化工。E-mail:1445573999@qq.com
*通信作者:余勃(1978—),男,副教授,博士,研究方向为食品微生物、天然产物。E-mail:yubo@ncu.edu.cn