
图1 柠檬醛对指状青霉菌丝体形态的影响
Fig. 1 Effect of citral on morphology of P. digitatum
欧阳秋丽,贾 雷,陶能国 *
(湘潭大学化工学院生物与食品工程系,湖南 湘潭 411105)
摘 要:探讨柠檬醛对指状青霉菌丝体膜脂过氧化的影响。研究发现,经最小抑菌浓度(minimal inhibitory concentration,MIC,2.0 μL/mL)和最小杀菌浓度(minimal fungicidal concentration,MFC,4.0 μL/mL)柠檬醛处理后,指状青霉菌丝体发生扭曲变形且表面出现明显褶皱,表明细胞完整性遭到破坏。不同质量浓度柠檬醛处理指状青霉后,其胞外电导率及K +泄漏量均显著增加,而总脂质含量降低,说明柠檬醛处理能增加指状青霉细胞膜通透性,导致细胞膜结构遭受破坏。进一步研究发现,MIC、MFC柠檬醛处理促使指状青霉总丙二醛含量、过氧化氢含量和脂氧合酶、过氧化物酶活性升高。本研究结果表明:柠檬醛处理可诱导指状青霉菌丝体发生严重的膜脂过氧化损伤,损伤细胞膜结构,从而抑制指状青霉菌丝体生长。
关键词:柠檬醛;指状青霉;细胞膜;膜脂过氧化
柑橘果实主产地位于较为偏僻的山区,远离消费市场,因此出售前需要贮藏一定时间。贮藏期间,柑橘果实极易感染真菌引起的青霉病、绿霉病及酸腐病等。其中,指状青霉(Penicillium digitatum)引起的绿霉病可导致柑橘采后损失率高达40% [1-2]。目前,人们多采用抑霉唑、咯菌腈等化学杀菌剂控制绿霉病害。近几十年来,植物精油及其萜类组分因具有高效、安全无毒、可降解、不易诱导致病菌产生抗性等优点,逐渐成为控制采后柑橘病害的替代方案。
柠檬醛广泛存在于植物精油中,是典型的萜类化合物,由同分异构体香叶醛和橙花醛组成 [2-7]。前期研究表明,柠檬醛对柑橘采后病害的致病菌酸腐病菌、意大利青霉和指状青霉均有较强抑菌效果 [5-6]。此外,柠檬醛对黄曲霉、黑曲霉、白色念珠菌等病原真菌也有较强的抑制作用 [7-10]。Wuryatmo等 [11]研究发现,5 ℃或室温条件下熏蒸体积分数为6%和15%的柠檬醛可有效延迟接种酸腐病菌的脐橙果实发病时间。柠檬草精油和其主要成分柠檬醛与果蜡复合应用可使柑橘果实酸腐病的发病率减少至10% [12]。前期研究表明,柠檬醛加辛醛组合能显著抑制指状青霉生长,果蜡加柠檬醛处理可显著抑制柑橘采后绿霉病的发生,且对果实品质基本无影响 [3-4]。
尽管柠檬醛的抑菌性能及其在果蔬采后病害的应用已多有描述,但关于其抑菌的作用机理目前尚不明确。通常认为,柠檬醛能通过改变真菌菌丝体表面特征以及破坏真菌细胞膜通透性和完整性,从而表现出较强的抗真菌活性 [2,5-6]。有研究指出,萜烯类物质具有的亲脂特性是造成病原菌细胞膜通透性和完整性发生改变的重要原因 [13-14]。真菌体内某些特异性的蛋白质或酶也会受到萜烯类物质的影响 [14]。事实上,萜类物质能显著诱导真核细胞发生膜脂过氧化,并引起活性氧爆发,从而扰乱真菌细胞膜组件,引起细胞膜流动性和通透性的变化,改变离子运输方式并抑制代谢过程 [15-17]。王春梅等 [17]发现丁香酚诱导灰葡萄孢菌丝产生的过量过氧化氢(H 2O 2)能攻击细胞膜形成脂质过氧化物,使膜受到损伤,透性改变,造成膜离子转运紊乱、丙二醛(malondialdehyde,MDA)外流,释放后的MDA还可与蛋白质、核酸反应,使其丧失功能,并抑制蛋白质的合成。
前期研究表明,柠檬醛能有效抑制指状青霉菌丝体生长,最小抑菌浓度(minimal inhibitory concentration,M I C)和最小杀菌浓度(m i n i m a l f u n g i c i d a l concentration,MFC)分别为2.0 μL/mL和4.0 μL/mL [3-4]。本研究拟探讨柠檬醛对指状青霉菌丝体膜损伤和膜脂过氧化的影响,为柑橘采后绿霉病防治提供理论依据。
1.1 材料与试剂
柠檬醛(95%) 西格玛奥德里奇(上海)贸易有限公司;胆固醇(95%)、香草醛(98%) 梯希爱(上海)贸易有限公司; MDA试剂盒、脂氧合酶(lipoxygenase,LOX)试剂盒、过氧化物酶(peroxidase,POD)试剂盒 北京索宝贸易有限公司。
指状青霉(P. digitatum)分离自腐烂的柑橘果实 [1],现保存于湘潭大学生物与食品工程专业实验室。
1.2 仪器与设备
SPX-250B-D生化培养箱 上海博迅实业有限公司;UV2450紫外分光光度计、AA6300C原子吸收分光光度计日本岛津公司;JSM-6360LV高低真空扫描电子显微镜计 日本JEOL有限公司;DDS-W系列微机型电导率仪上海般特仪器有限公司;CoolSafe 110-4L真空冷冻干燥机 丹麦LaboGene公司。
1.3 方法
1.3.1 柠檬醛对指状青霉菌丝体表面形态的影响
用扫描电子显微镜观察柠檬醛对指状青霉表面形态的影响 [3]。在培养6~7 d的指状青霉平板边缘打取菌苔(6 mm×6 mm)接种于含有不同含量柠檬醛(MIC和MFC)的PDA培养基中央,以不添加柠檬醛的菌苔作为对照。培养4 d后,将菌苔切割下来固定在3%的戊二醛磷酸盐缓冲液(pH 6.8)中,4 ℃保存1 d。样品用无菌水水洗3 次,每次20 min。之后用乙醇系列梯度(30%、50%、70%、95%)进行脱水,每次20 min,最后用纯乙醇脱水45 min。然后真空冷冻干燥,喷金,用扫描电子显微镜观察。
1.3.2 柠檬醛对指状青霉胞外电导率的影响
采用微型电导率仪测定柠檬醛对指状青霉胞外电导率的影响 [3]。将指状青霉孢子洗脱于马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基,(25±2) ℃、160 r/min振荡培养48 h后,4 000 r/min离心15 min,水洗3 次,收集菌丝体,重新悬浮于磷酸盐缓冲液(pH 7.0)。加入柠檬醛含量分别为0 μL/mL、MIC(2.0 μL/mL)和MFC(4.0 μL/mL)时处理0、30、60、120 min后,测定胞外电导率,每一浓度3 组重复,无菌水作对照。
1.3.3 柠檬醛对指状青霉菌丝体K +泄漏量的影响
采用原子吸收分光光度计测定柠檬醛对指状青霉菌丝体K +泄漏量的影响 [5]。指状青霉在PDB培养基中培养2 d,过滤,用无菌水水洗3 次。然后样品悬浮在磷酸盐缓冲液中,迅速加入柠檬醛0 μL/mL、MIC和MFC,以200 r/min的转速振荡培养,在0、30、60、120 min时,分别取2 mL加入2.5 mL的离心管中, 12 000 r/min离心2 min,收集上清液。通过原子吸收分光光度计测定K +含量,用K +标准溶液做标准曲线。
1.3.4 柠檬醛对指状青霉菌丝体总脂质含量的影响
采用香草醛硫酸比色法测定处理后菌丝体总脂质含量 [6]。培养及处理方法如1.3.2节,收集处理后的菌丝体真空冷冻干燥2 h,称取一定质量干燥菌丝体,利用液氮充分研磨,加入V(甲醇)∶V(氯仿)∶V(水)=1∶1∶1溶液剧烈振荡,充分萃取脂质,将混合液与浓硫酸沸水浴加热10 min,室温条件下冷却后加入磷光体香草醛素充分混匀,在520 nm波长处测定其吸光度,最后用胆固醇标准曲线计算其总脂质含量/(mg/g)(以干质量计,下同),每组实验重复3 次,结果取平均值。
1.3.5 指状青霉MDA和H 2O 2含量测定
培养及处理方法如1.3.2节,收集处理后的上清液,使用MDA试剂盒测定胞外MDA含量;收集处理后的菌丝体,使用MDA试剂盒测定胞内MDA含量,每组实验重复3 次,结果取平均值。采用Sagisaka [18]的方法测定总H 2O 2含量。培养及处理方法如1.3.2节,收集处理后的菌丝体0.5 g,加入4 mL磷酸盐缓冲液(50 mmol/L,pH 7.5)冰浴研磨后,加入2.8 mL质量分数为5%的三氯乙酸,于10 000 r/min离心10 min。取上清液1.6 mL与0.4 mL 50%的三氯乙酸、0.4 mL 10 mmol/L的硫酸亚铁铵和0.2 mL 2.5 mol/L的硫氰酸钾混合,于480 nm波长处测定上清液的吸光度,每组实验重复3 次,并将对照组吸光度设为100%。
1.3.6 指状青霉LOX和POD活力测定
菌丝体LOX和POD活力的测定参照相应试剂盒标注方法进行,每组实验重复3次,结果取平均值。
1.3.7 数据分析
每组3 次重复,采用常规的分析方法标注标准偏差,数据分析采用SPSS 16.0统计分析软件,单因素方差(one-way analysis of variance,one way ANOVA)分析差异显著性。
2.1 柠檬醛对指状青霉菌丝体表面形态的影响

图1 柠檬醛对指状青霉菌丝体形态的影响
Fig. 1 Effect of citral on morphology of P. digitatum
由图1可知,柠檬醛对指状青霉菌丝体形态存在明显影响。对照组菌丝体表面光滑,形状规则,结构完整(图1a)。而经MIC (2.0 μL/mL)和MFC(4.0 μL/mL)处理的指状青霉菌丝体发生多种形态变化。MIC处理组的菌丝体表面粗糙、出现褶皱、整体不规则扭曲(图1b)。相比之下,MFC处理组的菌丝体表面形态变化更为剧烈,菌丝体严重塌陷,扭曲变形,孢子囊萎缩(图1c)。这些变化通常意味着细胞通透性增加,小分子物质、离子等泄漏和细胞代谢出现差异 [5,19-21]。
2.2 柠檬醛对指状青霉胞外电导率的影响
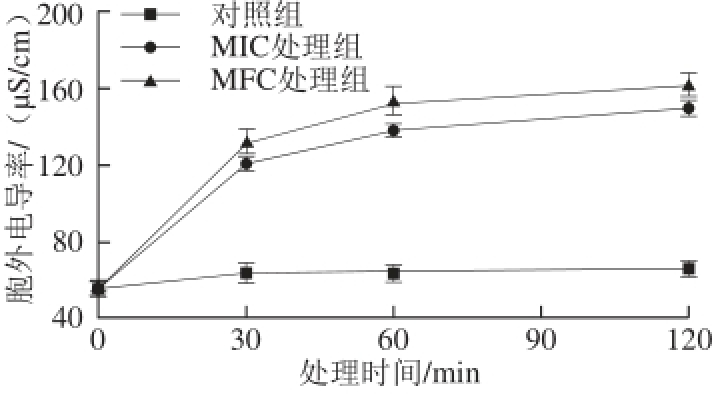
图2 柠檬醛对指状青霉胞外电导率的影响Fig. 2 Effect of citral on extracellular conductivity from P. digitatum cells
经柠檬醛处理后,指状青霉胞外电导率随处理时间延长和处理浓度增加不断上升,且前30 min变化趋势最明显(图2)。处理30 min时,MIC和MFC处理组的电导率分别为121.57、131.60 μS/cm,显著高于对照组(63.37 μS/cm,P<0.05)。处理120 min后,MIC和MFC处理组胞外电导率显著升高且达到最大值,分别为149.90、161.17 μS/cm,表明细胞膜通透性增加。
2.3 柠檬醛对指状青霉K +泄漏量的影响
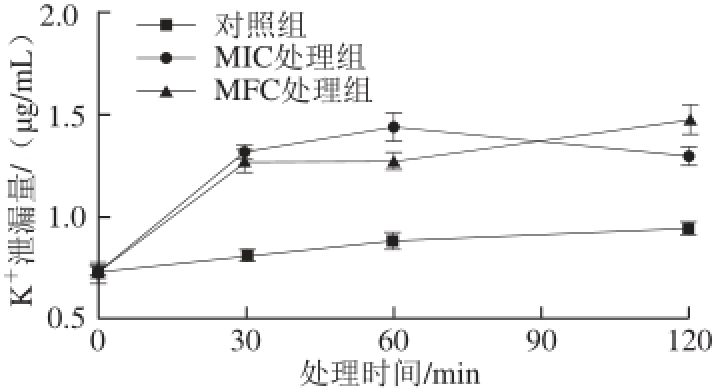
图3 柠檬醛对指状青霉KK
+泄漏量的影响
Fig. 3 Effect of citral on the leakage of K
+from P. digitatum cells
由图3可知,处理30 min时,MFC处理组K +泄漏量为1.28 μg/mL,显著高于对照组(0.81 μg/mL,P<0.05)。处理30~120 min时,MIC与MFC处理组的K +泄漏量稍有起伏,但始终高于对照组。说明柠檬醛处理可促使K +大量泄漏,进一步证实指状青霉细胞膜通透性发生了改变。
2.4 柠檬醛对指状青霉菌丝体总脂质含量的影响
脂质是生物膜中重要的结构物质,在调节膜流动性和提高膜稳定性方面具有重要作用 [6]。柠檬醛处理能显著降低总脂质含量,且在处理30 min时就发生显著变化(图4)。处理30 min后,MIC和MFC处理组的总脂质含量分别为388.32、350.05 mg/g,显著低于对照组的总脂质含量423.57 mg/g(P<0.05)。此外,柠檬醛处理组总脂质含量持续下降,且显著低于对照组(P<0.05),表明细胞膜完整性被破坏,细胞活性受到影响。
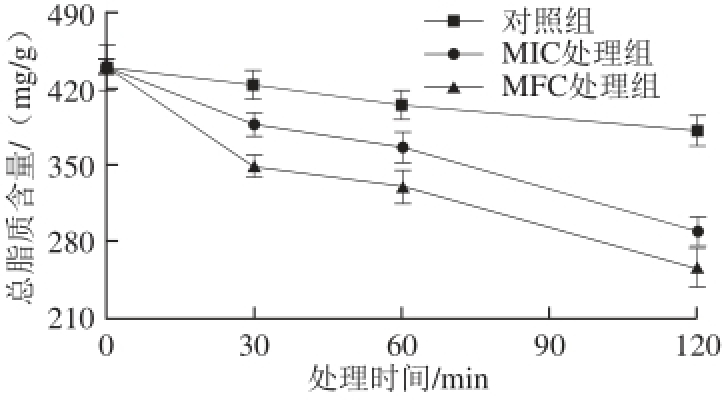
图4 柠檬醛对指状青霉总脂质含量的影响
Fig. 4 Effect of citral on the total lipid content of P. digitatum cells
2.5 柠檬醛对指状青霉MDA和H 2O 2含量的影响

图5 柠檬醛对指状青霉胞内MDA(a)、胞外MDA(b)和总MDA(c)含量的影响
Fig. 5 Effect of citral on intracellular MDA (a), extracellular MDA (b), and total MDA (c) contents of P. digitatum cells
柠檬醛处理后,指状青霉菌丝体胞内、胞外和总MDA含量发生显著升高,而对照组中含量始终保持相对恒定(图5)。柠檬醛处理120 min后,胞外MDA(图5b)和总MDA(图5c)含量达到最高水平,且显著高于对照组的0.27 nmol/g和0.93 nmol/g(P<0.05);而经MIC和MFC柠檬醛处理60 min后胞内MDA含量分别达到峰值1.56、2.06 nmol/g,随着时间延长至120 min,两者含量逐渐降低,但依然显著高于对照组的0.66 nmol/g(P<0.05)。胞外MDA含量增加表明细胞膜结构受到损伤,膜透性改变;总MDA含量增加暗示着膜脂过氧化现象已经产生。
与MDA含量变化类似,柠檬醛处理可显著诱导指状青霉细胞内H 2O 2积累(图6)。相比对照组,处理30~120 min时MIC和MFC处理组H 2O 2含量分别增加了30.65%~116.13%和64.19%~185.16%,说明细胞发生了氧化胁迫,进一步证实细胞内发生了膜脂过氧化伤害。
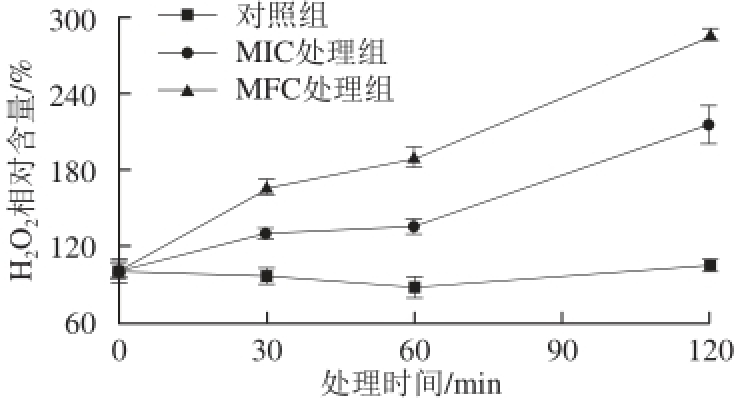
图6 柠檬醛对指状青霉胞内HH
2O
2含量的影响
Fig. 6 Effect of citral on H
2O
2content of P. digitatum cells
2.6 柠檬醛对指状青霉LOX和POD活力的影响

图7 柠檬醛对指状青霉LOX活力(a)和POD活力(b)的影响
Fig. 7 Effect of citral on LOX (a) and POD (b) activities of P. digitatum cells
柠檬醛处理30 min时,LOX活力从667.63 U/mg增加到759.96 U/mg (MIC处理组)和1 250.03 U/mg(MFC处理组),显著高于对照组(P<0.05)(图7a)。MIC处理组POD活力持续升高,显著高于对照组(P<0.05);MFC处理组POD活力在30 min时为1 004.29 U/mg,显著高于对照组的644.19 U/mg(P<0.05),随着时间延长活力逐渐下降,至120 min时与对照组基本无差别(图7b)。MFC柠檬醛处理指状青霉菌丝体LOX活力和POD活力分别在处理30 min和60 min后迅速下降,且LOX活力在处理120 min后显著低于对照组(P<0.05),可能是由于高浓度柠檬醛长期处理引起了指状青霉凋亡。LOX活力变化趋势表明膜脂过氧化发生和活性氧积累,而POD活力增加幅度不能完全缓解该过程,与MDA含量和H 2O 2水平变化趋势相符 [16]。
细胞膜是将细胞与周围分割的屏障,也是细胞与周围环境进行物质和能量交换的通道,它的通透性和完整性在维持细胞活力方面具有重要作用 [17]。细胞膜通透性的增加通常伴随小分子物质泄漏、离子泄漏、膜损伤等现象 [5-6]。大量研究表明,柠檬醛能通过改变细胞膜的结构,从而影响细胞膜通透性 [5-6,19]。前期研究发现,柠檬醛能破坏意大利青霉和酸腐病菌细胞膜流动性和完整性,导致胞内物质如K +、Mg 2+等泄露,脂质和麦角固醇等细胞膜结构物质含量减少,从而抑制菌丝体生长 [5-6]。本研究结果也表明:柠檬醛处理后指状青霉菌丝形态发生显著变化,胞外电导率和K +泄漏量增加,总脂质含量急剧降低。说明细胞膜通透性和膜结构已被严重损害,这些现象与前期研究报道的结果类似 [5-6,19-21]。
有报道指出,β-蒎烯和丁香酚等精油能诱导真核细胞活性氧积累,从而导致膜脂过氧化伤害的产生 [15-16]。MDA是膜脂过氧化作用的主要产物,是衡量膜脂过氧化损伤的重要指标。作为水溶性小分子,细胞膜被破坏后MDA将泄漏到培养基中 [16-17]。H 2O 2是活性氧的一种,低浓度可作为分子信号提高细胞防御能力和增强细胞耐受力,但高浓度时却会引发脂质、蛋白质、核酸分子的氧化性损伤 [17]。柠檬醛处理后,指状青霉MDA和H 2O 2的含量急剧增加,表明指状青霉菌丝体可能发生严重的膜脂过氧化伤害;这一结果与脂质含量的降低,以及LOX和POD活力的增加保持一致。LOX、POD是参与膜脂过氧化进程的重要酶。在真核细胞中,LOX参与了自由基产生、膜脂过氧化、膜透性增加以及加剧细胞膜退化的过程,在维持细胞膜脂质含量和细胞膜完整性上发挥关键作用;POD是重要的抗氧化酶,它保护细胞免受氧自由基毒害并调控膜脂过氧化过程 [16]。当离子泄漏量与LOX活力增加时,脂质含量降低并伴随严重的膜脂过氧化现象发生 [22]。综合以上结果可以看出,柠檬醛的确能诱导指状青霉菌丝体产生严重的膜脂过氧化伤害。
真菌细胞内活性氧的产生对线粒体的形态和功能也能产生显著的影响。线粒体是细胞能量代谢最重要的细胞器,也是真菌细胞产生活性氧的主要场所。当活性氧的产生与抗氧化防御系统二者失去平衡时,线粒体会因脂质过氧化作用而受到损伤 [23]。前期研究已证实,柠檬醛能改变指状青霉线粒体形态,降低ATP含量并抑制三羧酸循环 [24],暗示氧化磷酸化途径与抗氧化防御系统出现异常,从侧面验证了本实验结果。
虽然利用植物精油控制果蔬采后病害已有诸多报道,但由于精油存在高挥发性和抑菌效果不稳定等缺点,加之采后致病菌种类繁多,对植物精油表现出不同耐受性,限制了其在食品工业的应用 [25]。通过在涂膜液(如果蜡)中添加精油、将精油微胶囊化、混配多种精油组分等方式可有效减轻以上问题 [12,25]。鉴于柠檬醛对多种果蔬采后致病真菌的广谱抗性,结合微胶囊化和多组分混配等措施,将使之成为一种极具潜力的可应用于果蔬采后贮藏保鲜的生物杀菌剂。
参考文献:
[1] 陶能国, 王华, 王长锋, 等. 两株柑橘采后致病真菌的分离及生物学特性研究[J]. 湘潭大学自然科学学报, 2013, 35(3): 75-78. DOI:10.3969/j.issn.1000-5900.2013.03.014.
[2] LU L, LU H, WU C, et al. Rhodosporidium paludigenum induces resistance and defense-related responses against Penicillium digitatum in citrus fruit[J]. Postharvest Biology and Technology, 2013, 85(4): 196-202. DOI:10.1016/j.postharvbio.2013.06.014.
[3] 陶能国, 段小芳, 凡凤, 等. 柠檬醛和辛醛混合物对指状青霉的抑制作用[J]. 现代食品科技, 2015, 31(6): 73-77. DOI:10.13982/ j.mfst.1673-9078.2015.6.012.
[4] FAN F, TAO N G, JIA L, et al. Use of citral incorporated in postharvest wax of citrus fruit as a botanical fungicide against Penicillium digitatum[J]. Postharvest Biology and Technology, 2014, 90(3): 52-55. DOI:10.1016/j.postharvbio.2013.12.005.
[5] TAO N G, OUYANG Q L, JIA L. Citral inhibits mycelial growth of Penicillium italicum by a membrane damage mechanism[J]. Food Control, 2014, 41(2): 116-121. DOI:10.1016/j.foodcont.2014.01.010.
[6] ZHOU H E, TAO N G, JIA L. Antifungal activity of citral, octanal and α-terpineol against Geotrichum citri-aurantii[J]. Food Control, 2014, 37(1): 277-283. DOI:10.1016/j.foodcont.2013.09.057.
[7] KLIEBER A, SCOTT E, WURYATMO E. Effect of method of application on antifungal eff cacy of citral against postharvest spoilage fungi of citrus in culture[J]. Australasian Plant Pathology, 2002, 31(4): 329-332. DOI:10.1071/ap02034.
[8] ABE S, SATO Y, INOUE S, et al. Anti-Candida albicans activity of essential oils including lemongrass (Cymbopogon citratus) oil and its component, citral[J]. Japanese Journal of Medical Mycology, 2002, 44(4): 285-291. DOI:10.3314/jjmm.44.285.
[9] 谢小梅, 方建茹, 许杨. 肉桂醛、柠檬醛抗黄曲霉作用的研究[J]. 食品科学, 2004, 25(9): 32-34. DOI:10.3321/j.issn:1002-6630.2004.09.002.
[10] 钟业俊, 徐欣源, 刘成梅, 等. 茶树油、丁香酚和柠檬醛对荔枝黑曲霉的抑制作用[J]. 食品科学, 2012, 33(11): 21-24. DOI:10.3969/ j.issn.1674-2435.2011.04.014.
[11] WURYATMO E, ABLE A J, FORD C M, et al. Effect of volatile citral on the development of blue mould, green mould and sour rot on navel orange[J]. Australasian Plant Pathology, 2014, 43(4): 403-411. DOI:10.1007/s13313-014-0281-z.
[12] REGNIER T, COMBRINCK S, VELDMAN W, et al. Application of essential oils as multi-target fungicides for the control of Geotrichum citri-aurantii and other postharvest pathogens of citrus[J]. Industrial Crops and Products, 2014, 61: 151-159. DOI:10.1016/ j.indcrop.2014.05.052.
[13] BARD M, ALBRECHT M R, GUPTA N, et al. Geraniol interferes with membrane functions in strains of Candida and Saccharomyces[J]. Lipids, 1988, 23(6): 534-538. DOI:10.1007/bf02535593.
[14] WOLKEN W A M, TRAMPER J, van der WERF M J. Toxicity of terpenes to spores and mycelium of Penicillium digitatum[J]. Biotechnology and Bioengineering, 2002, 80(6): 685-690. DOI:10.1002/bit.10435.
[15] NIGAM S, SCHEWE T. Phospholipase A 2s and lipid peroxidation[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2000, 1488(1/2): 167-181. DOI:10.1016/S1388-1981(00)00119-0.
[16] CHOWHAN N, SINGH H P, BATISH D R, et al. β-Pinene inhibited germination and early growth involves membrane peroxidation[J]. Protoplasma, 2013, 250(3): 691-700. DOI:10.1007/s00709-012-0446-y.
[17] 王春梅, 张杰, 陈浩, 等. 天然化合物丁香酚对灰葡萄孢菌丝脂质过氧化和膜损伤的影响[J]. 农药学学报, 2009, 11(1): 104-108. DOI:10.3969/j.issn.1008-7303.2009.01.018.
[18] SAGISAKA S. The occurrence of peroxide in a perennial plant, Populus gelrica[J]. Plant Physiology, 1976, 7(2): 308-309. DOI:10.1104/pp.57.2.308.
[19] PARK M J, GWAK K S, YANG I, et al. Effect of citral, eugenol, nerolidol and α-terpineol on the ultrastructural changes of Trichophyton mentagrophytes[J]. Fitoterapia, 2009, 80(5): 290-296. DOI:10.1016/ j.fitote.2009.03.007.
[20] YU D, WANG J, SHAO X, et al. Antifungal modes of action of tea tree oil and its two characteristic components against Botrytis cinerea[J]. Journal of Applied Microbiology, 2015, 119(5): 1253-1262. DOI:10.1111/jam.12939.
[21] SHAO X F, CHENG S, WANG H, et al. The possible mechanism of antifungal action of tea tree oil on Botrytis cinerea[J]. Journal of Applied Microbiology, 2013, 114(6): 1642-1649. DOI:10.1111/ jam.12193.
[22] 宋凤鸣, 葛秀春. 活性氧及膜脂过氧化与棉花对枯萎病抗性的关系[J]. 植物病理学报, 2001, 31(2): 110-116. DOI:10.13926/j.cnki. apps.2001.02.003.
[23] 刘井波, 彭双清. 脂质过氧化作用与线粒体损伤[J]. 中国预防医学杂志, 2005, 6(2): 167-170. DOI:10.3969/j.issn.1009-6639.2005.02.061.
[24] ZHENG S, JING G, WANG X, et al. Citral exerts its antifungal activity against Penicillium digitatum by affecting the mitochondrial morphology and function[J]. Food Chemistry, 2015, 178: 76-81. DOI:10.1016/j.foodchem.2015.01.077.
[25] KOUASSI K H S, BAJJI M, JIJAKLI H. The control of postharvest blue and green molds of citrus in relation with essential oil-wax formulations, adherence and viscosity[J]. Postharvest Biology and Technology, 2012, 73: 122-128. DOI:10.1016/j.postharvbio.2012.06.008.
Citral Inhibits Mycelial Growth of Penicillium digitatum Involving Membrane Peroxidation
OUYANG Qiuli, JIA Lei, TAO Nengguo
*
(Department of Biotechnology and Food Engineering, College of Chemical Engineering, Xiangtan University, Xiangtan 411105, China)
Abstract:The effects of citral on membrane lipid peroxidation of Penicillium digitatum were investigated in this study. After treated with citral at minimal inhibitory concentration (MIC, 2.0 μL/mL) and minimal fungicidal concentration (MFC, 4.0 μL/mL), the morphology of P. digitatum hyphae was evidently altered, as indicated by a wrinkled and rough surface, by causing loss of cytoplasm and distortion of mycelia. Extracellular conductivity and the leakage of potassium ions were significantly higher after citral treatment compared with the control, which indicated the increase of membrane permeability. Moreover, citral could decrease the total lipid content of P. digitatum cells, indicating the disruption of membrane integrity. Furthermore, the addition of citral (at both MIC and MFC) significantly increased the contents of total malondialdehyde and hydrogen peroxide, and the activities of lipoxygenase and peroxidase. These results indicate that citral inhibits mycelial growth of P. digitatum by a membrane damage mechanism involving membrane peroxidation.
Key words:citral; Penicillum digitatum; cell membrane; membrane peroxidation
DOI:10.7506/spkx1002-6630-201623006
中图分类号:S436.66
文献标志码:A
文章编号:1002-6630(2016)23-0032-06
引文格式:
欧阳秋丽, 贾雷, 陶能国. 柠檬醛对指状青霉菌丝体膜脂过氧化的影响[J]. 食品科学, 2016, 37(23): 32-37 . DOI:10.7506/ spkx1002-6630-201623006. http://www.spkx.net.cn
OUYANG Qiuli, JIA Lei, TAO Nengguo. Citral inhibits mycelial growth of Penicillium digitatum involving membrane peroxidation[J]. Food Science, 2016, 37(23): 32-37. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623006. http://www.spkx.net.cn
收稿日期:2016-02-24
基金项目:国家自然科学基金面上项目(31271964);湖南省研究生科研创新项目(CX2016B266)
作者简介:欧阳秋丽(1990—),女,博士研究生,研究方向为农产品贮藏与保鲜。E-mail:ouyang199006@126.com
*通信作者:陶能国(1979—),男,教授,博士,研究方向为农产品贮藏与保鲜。E-mail:nengguotao@126.com