李秋慧,隋晓楠,徐 靓,王中江,张雨霏,江连洲,李 杨 *
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:为探究磷脂酶解物-大豆分离蛋白复合乳化体系稳定性及氧化稳定性的机理,研究了不同酶解时间对乳液乳化性质、贮存稳定性和氧化稳定性等特性的影响,通过核磁共振法对酶解后的磷脂产物组分进行分析,并对乳状液的乳化活性、乳化稳定性、粒径分布、Zeta电位、乳层析指数、氢过氧化物值和硫代巴比妥酸反应物值进行测定。结果发现:随着酶解时间的延长,磷脂经4 h酶解后主要产物为溶血磷脂,其与大豆蛋白共建乳化体系后,乳化稳定性、贮存稳定性及氧化稳定性均优于对照组,酶解6 h左右酰基转移现象加剧,产生的溶血磷脂会继续被酶解生成甘油磷脂酰胆碱,导致稳定性略有下降;添加一定酶解时间的磷脂酶解产物,会促进乳化体系通过相互作用在水油界面上形成较稳定的界面膜,可以提高乳液的稳定性及氧化稳定性。
关键词:大豆分离蛋白;磷脂酶解产物;乳化稳定性;氧化稳定性
大豆分离蛋白(soybean protein isolate,SPI)是一种具有较高营养价值的植物蛋白,其高蛋白质含量及特殊结构使SPI具有多种可以在食品工业中广泛应用的功能特性,其中较为重要的功能特性就是乳化性。食品加工过程中添加大豆分离蛋白可以提高产品乳化稳定性、延长货架期等,然而单一的天然大豆分离蛋白由于其结构限制及易变性等缺点不能很好地满足食品工业对乳化剂的多重需求。大豆卵磷脂是一种广泛存在的具有乳化功能的天然表面活性剂,由于其结构中同时具有亲水、亲油基团而常常被添加到蛋白质中增强食品的乳化活性及乳化稳定性。谷克仁等 [1]研究发现由于磷脂分子结构的关系,亲水亲油平衡值较低,仅适用作水包油型乳化剂,使磷脂的作用不能充分发挥,限制了其与蛋白质的交互作用。Kasinos等 [2]研究发现经过酶解后的葵花磷脂由于非极性基团减少,使其与乳中蛋白质更容易发生相互作用,其二者形成的复合体系更有利于维持乳状液的乳化稳定性。van der Meeren等 [3]研究发现将经过磷脂酶A1酶解后的卵磷脂加入到咖啡乳中可以改善咖啡乳的热稳定性,并推测磷脂酶解物可以替代乳化界面上的部分蛋白质。目前生活中许多产品,如牛奶、冰淇淋等乳化制品及微胶囊、药制品等微乳液制品,常常会因为乳状液中乳化剂包裹的不理想而发生被包裹物的氧化变质等。因此,对于稳定的乳液来说,乳化稳定及氧化稳定性同样重要,但目前在此方向的研究仍较少。本研究利用磷脂酶A1对磷脂进行不同时间的酶解,并将酶解产物与大豆分离蛋白进行复合,共建乳化体系,通过对复合体系的酶解物组成、乳化活性、乳化稳定性、乳层析指数、粒径分布、Zeta电位、氢过氧化物值和硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值等指标的测定,探究不同酶解时间对磷脂酶解产物与大豆蛋白复合体系乳化稳定性及氧化稳定性的影响,为乳液工业生产应用提供理论依据。
1.1 材料与试剂
脱脂豆粕 哈尔滨高科技股份有限公司;大豆卵磷脂 深圳康之源生物有限公司。
磷脂酶A1(酶活力8 900 U/mL) 丹麦诺维信生物技术有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tris-HCl 美国Sigma公司;磷酸二氢钠、磷酸氢二钠、盐酸、氢氧化钠等化学试剂均为分析纯。
1.2 仪器与设备
磁力搅拌器 广州仪科实验仪器有限公司;T18 basic高速乳化均质机 英国IKA公司;ULTRASHIELD-500核磁共振光谱仪 德国布鲁克仪器公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;Zeta电位仪 美国布鲁克海文仪器公司;Mastersize 2000激光粒度分析仪 英国马尔文公司;Allegra64R台式高速冷冻离心机 美国贝克曼公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
根据Molina等 [4]的提取方法并稍加修改。将脱脂豆粕按照1∶15的质量比与水混合,加入1 mol/L NaOH溶液调节pH值至8.0,室温条件下搅拌1 h后6 000×g离心30 min。取上清液溶液加入1 mol/L的HCl溶液调节pH值至4.5,搅拌15 min后在室温条件下静置15 min。6 000×g离心30 min,取沉淀水洗3 次,最后将沉淀溶于水中加入1 mol/L NaOH溶液调节pH值至7,6 000×g离心30 min滤去不溶物得蛋白质溶液,将蛋白质溶液进行冷冻干燥得大豆分离蛋白粉末,经凯式定氮仪测得蛋白质质量分数为90.13%(氮溶解指数为6.25)。
1.3.2 磷脂酶解产物的制备
以Tris-HCl缓冲液为溶剂,配制磷脂溶液,添加150 mmol/L CaCl 2。在50 ℃条件下分别加入一定量磷脂酶A1,分别酶解0、2、4、6、8 h,然在90 ℃条件下进行灭酶处理30 min,再用丙酮萃取3~4 次,挥干丙酮后得磷脂酶解产物。
1.3.3 核磁共振 31P谱测定磷脂酶解产物组成
参考Sui Xiaonan等 [5]的方法,取10 mg左右的样品,用0.5 mL的氘代甲醇溶解样品后转移到直径为3 mm的玻璃核磁管中,测定条件为:频率202.46 MHz,测定温度为(40.00±0.01)℃,采集时间3.22 s,延迟时间12.25 s,扫描光谱256 次得核磁共振 31P谱图。
1.3.4 大豆分离蛋白-磷脂酶解产物乳化体系的制备
精确称取30 mg蛋白质和3 mg磷脂酶解产物样品,溶解于30 mL pH 7.2的0.1 mol/L磷酸盐缓冲溶液中,室温条件下磁力搅拌溶液1 h。取9 mL搅拌均匀的蛋白质-磷脂酶解产物溶液与3 mL葵花籽油混合搅拌,预乳化后倒入25 mL烧杯中,用高速乳化均质机20 000 r/min乳化1 min,制备乳液,1~5号分别是0、2、4、6、8 h磷脂酶解产物-大豆分离蛋白乳化体系样品。
1.3.5 新鲜乳液乳化特性的测定
1.3.5.1 乳化性及乳化稳定性
乳化性的测定参考Comas等 [6]的方法。将均质的乳状液用0.1% SDS溶液稀释到确定倍数,在500 nm波长处用紫外分光光度计测定吸光度,按公式(1)计算乳化活性指数(emulsion activity index,EAI)。静置30 min后测定吸光度,按公式(2)计算乳化稳定性指数(emulsion stability index,ESI)。
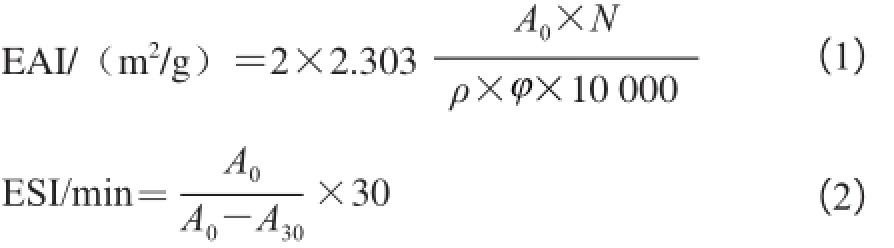
式中:N为稀释倍数(250);ρ为乳化液形成前蛋白质水溶液中蛋白质质量浓度/(g/mL);φ为乳化液中油相体积分数/%;A 0、A 30分别为0 min和30 min时的吸光度。
1.3.5.2 乳液Zeta电位
参考Crudden等 [7]的方法,采用Zeta电位分析仪在pH 7、乳液质量浓度为0.1 mg/mL的条件下进行测定,上样体积1 mL,测定温度25 ℃。重复测量3 次,计算平均值为测定值。
1.3.5.3 流体动力学半径及其分布
参考王金梅 [8]的测定方法。采用动态光散射技术,利用Mastersize 2000激光粒度分析仪测定乳状液的粒度分布,测定温度25 ℃。参数设置为:颗粒折射率1.520,颗粒吸收率0.001,分散剂为水,分散剂折射率1.330。实验采用D 4,3,即乳液油滴体积平均直径表征液滴粒径的大小,样品均质后立即测定,每个样品重复3 次。
1.3.6 新鲜乳液贮存稳定性的测定
取新鲜乳液至10 mL玻璃试管中,封口密闭,置于室温,避光贮存10 d后观察,上层为乳析层,下层为清液层。按公式(3)计算乳层析指数(creaming index,CI)。
式中:H s为下层清液高度/cm;H t为整个乳化液的高度/cm。
1.3.7 新鲜乳液氧化稳定性的测定
1.3.7.1 氢过氧化物浓度测定
乳液中油脂初级氧化产物——氢过氧化物浓度的测定参考Shao Yun等 [9]的方法并稍加修改。将新鲜制备出的乳状液分装到离心管中,并于50 ℃电热恒温培养箱中培养以促进氧化反应,并定期拿出样品进行过氧化值的测定。取6 mL乳状液于试管中,加入30 mL异辛烷,充分振荡(15 s,3 次),1 000×g离心2 min,取上层清液4 mL,加入到56 mL甲醇-丁醇混合液(2∶1,V/V)中,再分别加入300 μL 3 mol/L硫氰酸铵和300 μL二价铁离子溶液,反应20 min后,在510 nm波长处测定吸光度,通过异丙苯氢过氧化物标准曲线计算样品中氢过氧化物浓度。
1.3.7.2 TBARS值测定
乳液中油脂二级氧化产物——TBARS的测定参考Hu Min等 [10]的方法。取6 mL乳液加入到试管中,之后加入12 mL TBARS测试液(15%三氯乙酸和0.375% TBARS溶于0.25 mol/L HCl溶液),沸水浴15 min后在流动水中冷却至室温,然后用1.2 μm微孔滤膜进行过滤,滤液于532 nm波长处测定吸光度。乳液中TBARS反应物的浓度通过1,1,3,3-四乙氧基丙烷标准曲线进行计算。
1.3.8 数据统计分析
所有数据均为3 次重复实验的±s。数据用Origin 8.5软件绘制趋势曲线图,采用一维方差分析(analysis of variance,ANOVA)比较样品平均值之间的差异显著性。
2.1 磷脂酶解产物组成确定
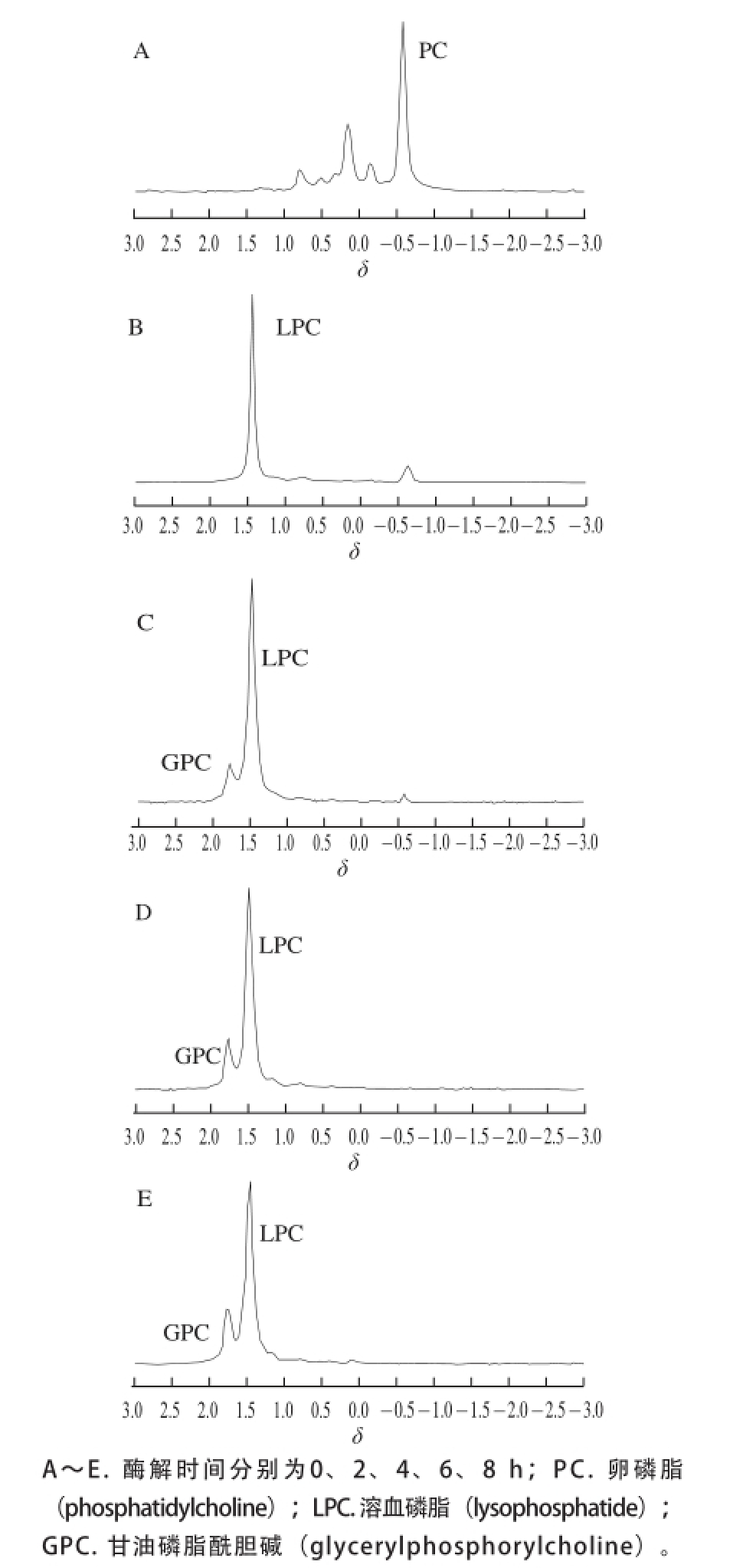
图1 不同酶解时间磷脂酶解产物核磁共振磷谱图
Fig. 1 Nuclear magnetic resonance spectra of hydrolysis products from phospholipids at different hydrolysis times
由图1可知,1号原样中主要成分为PC(δ=-0.5~-0.75),PC经磷脂酶A1催化酶解2 h后样品中PC特征峰明显变小,这说明PC被酶解导致含量明显减少并且出现了乳化性较好的LPC特征峰(δ=1.25~1.5),酶解4 h后的样品中PC不断被酶解变为LPC,并且开始出现GPC(δ=1.6~1.8) [3],但含量较少,这与杜章斌等 [12]采用核磁共振氢谱方法研究所发现的PC酶解4 h后被水解成LPC和GPC的结果相一致。并且张康逸等 [13]研究同样发现磷脂在磷脂酶酶解3.5 h时会发生重要的酰基转移现象,未被酶解的Sn-2位基团会被转移至Sn-1位继续被磷脂酶A1酶解,有部分LPC会被酶解成GPC。随着酶解时间的增长,酶解6 h的样品中LPC不断发生酰基转移现象,GPC含量不断增多,当酶解时间达到8 h时LPC和GPC的含量基本保持不变。
2.2 不同酶解时间酶解产物对EAI及ESI的影响
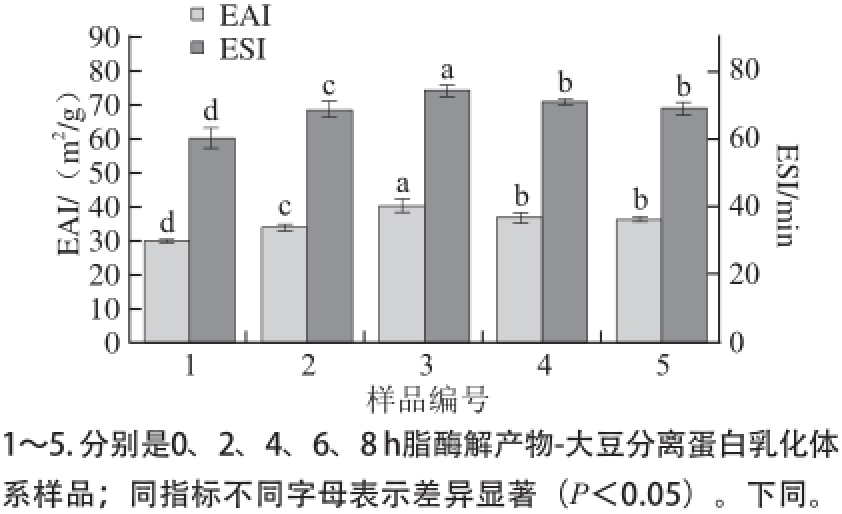
图2 不同酶解时间酶解产物对复合体EAI及ESI的影响
Fig. 2 Effect of hydrolysis time on emulsion activity and stability of multiple emulsion system
由图2可知,磷脂经磷脂酶A1酶解后与大豆分离蛋白的共建体系随着酶解时间的增加,EAI及ESI呈现先增强后减弱的趋势。其中,3号样品酶解4 h具有最好EAI及ESI,分别为40.5 m 2/g和74.3 min,与未酶解体系相比分别提高35.1%和20.3%。4号与5号样品的EAI及ESI均有所下降。由此可知,磷脂酶酶解时间的不同对乳状液的EAI及ESI有一定的影响。这是由于磷脂经磷脂酶A1酶解后产生LPC,LPC由于疏水基团的减少,亲水性增强,会使其EAI有所提高 [14]。在酶解4 h时LPC达到最大含量,并且LPC可以与大豆分离蛋白之间通过疏水作用力相结合,形成大豆分离蛋白-磷脂酶解产物的复合体系,构成双亲性结构,使疏水性蛋白区域更好的包裹油滴,亲水性的磷脂头部更好的伸入水相当中去,降低水油间的界面张力,从而提高了复合体系的乳化特性。当酶解6 h后GPC含量逐渐积累使得乳状液EAI及ESI有所下降,这是由于GPC几乎失去全部疏水性结构,与大豆分离蛋白之间相互作用力减弱,且无法形成较好的双亲结构,导致界面膜无法完全包裹油滴,从而稳定性下降。
2.3 不同酶解时间酶解产物对乳液流体动力学半径及分布的影响
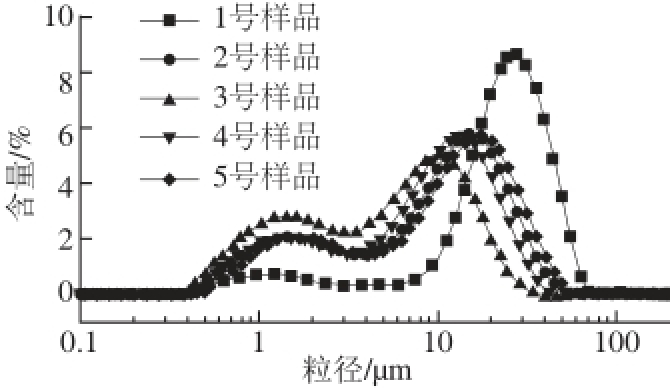
图3 不同酶解时间酶解产物对复合体系流体动力学半径分布的影响
Fig. 3 Effect of hydrolysis time on particle size distribution of multiple emulsion system

图4 不同酶解时间酶解产物对复合体系D
44,,33的影响
Fig. 4 Effect of hydrolysis time on D
4,3of multiple emulsion system
本实验中采用动态光散射技术探究5 种新鲜制备的乳液样品的液滴分布情况及平均粒径的大小。由图3可知,1号样品几乎呈现单峰分布,主要出现在10~40 μm处,其他4 种样品均呈现明显的双峰现象,分别出现在1~5 μm和10~20 μm处,与1号样品相比有较为明显的差异,且均有向较小粒径方向移动的趋势,这说明磷脂酶解产物的加入可明显的改善复合体系的粒径分布情况。相应地,乳液油滴的体积平均直径D 4,3(图4)也在一定浓度条件下随不同磷脂酶解产物的加入呈现先减小后增大的趋势,其中3号样品具有最小的D 4,3,为12.5 μm。Liu Fu等 [15]研究指出:一般地,乳液体系当中乳滴分散的体积平均粒径越小,表示乳液的乳化能力越好,稳定性越强。同时,Pan等 [16]研究发现向大分子蛋白质中添加适量的小分子物质可以改善蛋白质乳滴的大小。这可能是由于在一定浓度范围内,更多的小分子磷脂酶解产物会与蛋白质相结合,形成更有利于深入水相中的双亲性结构,很好地降低了界面张力,酶解后所生成的LPC也可以替代界面上部分大分子蛋白质,最终形成更小的油滴粒径,起到维持乳液稳定的作用。然而,对于4号与5号乳液,乳液油滴的体积平均粒径虽小于1号样品,但却大于3号样品,这一事实证明GPC的产生并没有进一步降低乳液粒径的大小,反而使粒径出现变大的趋势。由此可推断出,过多的GPC的积累会阻碍LPC与蛋白质的结合,进而使乳液液滴粒径略微增大。
2.4 不同酶解时间酶解产物对乳液Zeta电位的影响
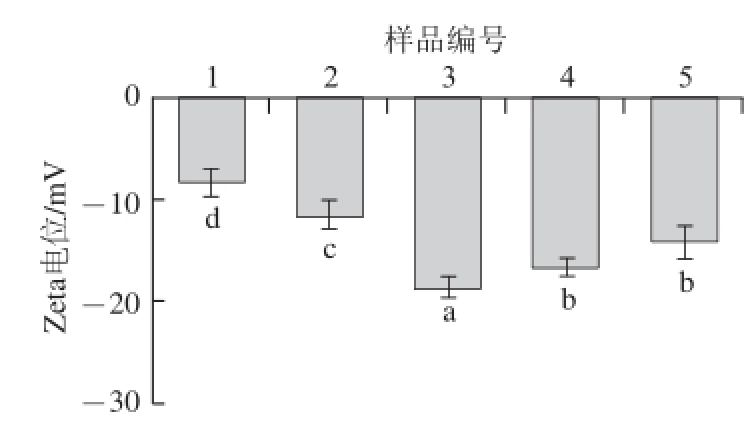
图5 不同酶解时间酶解产物对复合体系Zeta电位的影响
Fig. 5 Effect of hydrolysis time on Zeta potential of multiple emulsion system
采用Zeta电位仪对新鲜制备的不同样品乳液的电位值进行测定,结果见图5。一般来说,蛋白质表面带正电荷的氨基酸多于带负电荷氨基酸,使其蛋白质溶液Zeta电位为正值 [17],由图5可知,磷脂及磷脂酶解产物的加入可以使乳液液滴的Zeta电位值呈现负电位,且添加酶解产物均能增加乳状液的负Zeta电位,其中3号样品具有最大的负Zeta电位值。Malhotra等 [18]研究表明乳液发生聚集、絮凝和分层现象的原因主要是受到界面层上发生的相互吸引和排斥作用的影响,通过增强乳滴之间的相互斥力,抵抗乳滴因重力产生的分层作用力可以提高乳液抗聚集、延缓分层的能力。侯俊杰等 [19]同样发现液滴的
Zeta电位负电位绝对值越大乳液稳定性越好,越能保持油水两相的平衡。这可能是由于磷脂酶解产物通过疏水相互作用以及静电作用与蛋白相结合,使蛋白结构发生舒展,更多负电荷暴露出来,从而引起乳液Zeta电位的改变,使复合乳化体系带有更多的负电位,使液滴与液滴之间的斥力增大,从而提高乳液的稳定性,其结果趋势与D 4,3的结构相一致 [20],由此可以推断,乳液油滴界面的表面电荷与乳液中非絮凝状态油滴的粒径大小有一定关系。
2.5 不同酶解时间酶解产物对乳液贮存稳定性的影响
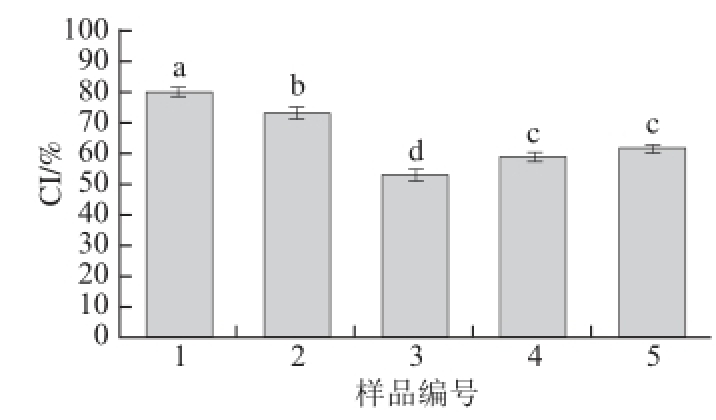
图6 不同酶解时间酶解产物对复合体系CI的影响
Fig. 6 Effect of hydrolysis time on creaming index of multiple emulsion system
由图6可知,5 种复合体系乳液在室温贮存10 d后出现明显分层现象,其中1号样品CI最大,乳液分层现象最为明显,其他4 种样品CI均有所下降,且3号样品与1号样品相比分层现象有明显的改善,CI降低至53%,这个趋势与新鲜制备的乳液物理稳定性相一致。CI是反映乳液中油相和水相之间所达到的平衡稳定性的重要指标之一,可以客观地反映乳液正在贮存过程中的稳定性 [21]。这表明磷脂经磷脂酶A1改性后与大豆分离蛋白共建的乳化体系可有效地抑制油滴与水相的分离,阻碍乳液的油脂上浮现象,提高乳液的贮存稳定性,并且由此可以推断出乳液的物理稳定性对乳液的贮存稳定性有一定的影响。
2.6 不同酶解时间酶解产物对乳液氧化稳定性的影响
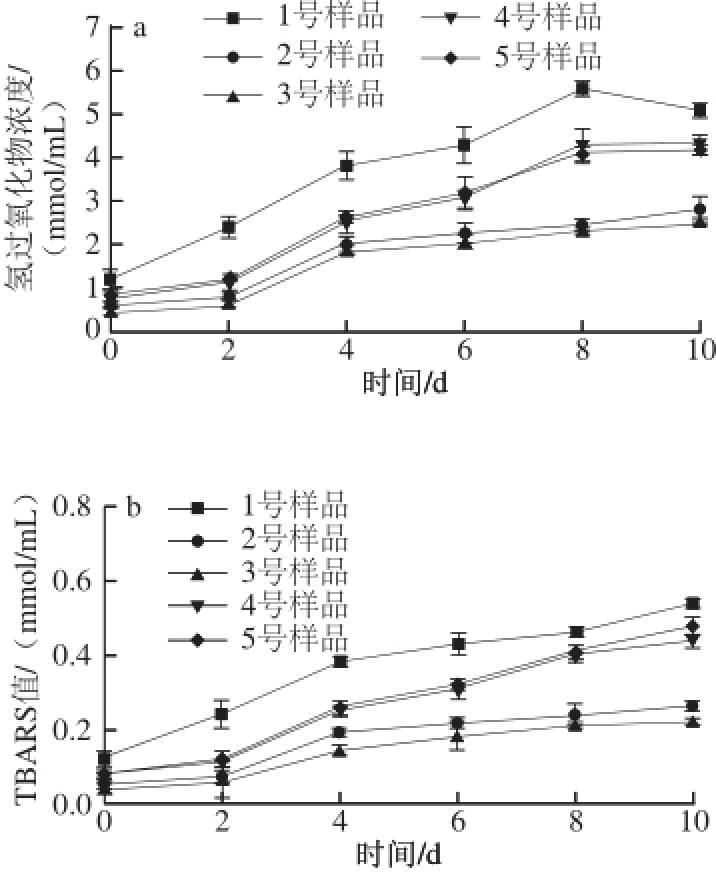
图7 不同酶解时间酶解产物的氢过氧化物浓度(a)及TBARS值(bb)变化
Fig. 7 Hydrogen peroxide value (a) and TBARS value (b) of multiple emulsion systems with phospholipid hydrolysates at different hydrolysis times
本实验中采用氢过氧化物值及TBARS值在贮存10 d内的变化来评价乳液中的初级氧化产物及次级氧化产物的形成、油脂氧化的程度和乳液的氧化稳定性。由图7可知,随着贮存时间的延长,1号样品的氢过氧化物浓度呈现出先增大后减小的趋势,4号及5号样品表现出先增加后趋于平缓略微有所下降的趋势,2号及3号样品表现为先增大后趋于不变。TBARS值的形成趋势与氢过氧化物浓度的趋势略为相似,随着贮存时间的延长,5 种样品的TBARS值均不断升高,且其他4 种样品TBARS值均要低于1号样品,这是由于磷脂酶解产物与大豆分离蛋白复合体系可以形成较好的稳定界面膜。油脂氧化可显著地降低食品乳液的品质,了解乳液体系中油脂氧化与乳液稳定性的相关机理对研发出高质量、高稳定性的乳化食品起到重要作用。吕兵等 [22]研究提出油滴特性(如大小、浓度和物理状态)不仅对乳液的物理稳定性有一定影响,同样对乳液的氧化稳定性有一定影响。Silvestre等 [23]同样指出覆盖在油滴表面所形成一层具有一定厚度的界面膜,这种界面膜具有清除自由基以及螯合金属离子的作用,从而可以起到抑制油脂氧化的发生。
另外,该乳液稳定性的趋势与新鲜乳液的物理稳定性及贮存稳定性相一致。这说明虽然乳化稳定性与氧化稳定性的稳定机制有所不同,但ESI在很大程度上影响了乳液的氧化稳定性 [24],较好的乳液物理稳定性可以延缓油相的聚集,阻碍油滴与氧气接触。Boon等 [25]研究表明,乳液的物理及氧化不稳定机理之间通常是相互关联的,且阴离子表面活性剂可与金属离子产生静电排斥反应,使之远离乳液中的油脂,减缓了氧化作用。综上可知,磷脂酶解产物的添加可以通过减小液滴的粒径大小,增加乳滴之间的负Zeta电位值从而增强乳液的物理稳定性及贮存稳定性,乳液所具有较好的物理稳定性及贮存稳定性,有利于减缓乳液中油脂的氧化进程,从而改善乳液的氧化稳定性。
在大豆分离蛋白中加入磷脂酶解产物形成复合体系,其乳状液的ESI、贮存稳定性及氧化稳定性随酶解时间的增加呈现先增强后下降的趋势。
在酶解时间为4 h条件下制备的相关乳液具有最好的物理稳定性、贮存稳定性及油脂氧化稳定性,但酶解6 h及8 h条件下制备的相关乳液稳定性略微有所下降。这是由于在一定酶解时间范围内会发生酰基转移现象,因此添加适度酶解时间的磷脂酶解产物会明显改善大豆分离蛋白乳状液的稳定性。
参考文献:
[1] 谷克仁, 金华丽. 酶改性大豆磷脂乳化稳定性比较[J]. 粮油加工, 2006, 37(5): 53-55.
[2] KASINOS M, LE T T, van der MEEREN P. Improved heat stability of recombined evaporated milk emulsions upon addition of phospholipid enriched dairy by-products[J]. Food Hydrocolloids, 2014, 34: 112-118. DOI:10.1016/j.foodhyd.2012.11.030.
[3] van der MEEREN P, EL-BAKRY M, NEIRYNCK N, et al. Inf uence of hydrolysed lecithin addition on protein adsorption and heat stability of a sterilised coffee cream simulant[J]. International Dairy Journal, 2005, 15(12): 1235-1243. DOI:10.1016/j.idairyj.2004.12.007.
[4] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269. DOI:10.1016/ S0268-005X(01)00023-6.
[5] SUI Xiaonan, LI Qiuhui, WANG Zhongjiang, et al. Does the hydrophobic group on sn-2 position of phosphatidylcholine decide its emulsifying ability?[J]. LWT-Food Science and Technology, 2016, 74: 255-262. DOI:10.1016/j.lwt.2016.07.056.
[6] COMAS D I, WAGNER J R, TOMÁS M C. Creaming stability of oil in water (O/W) emulsions: influence of pH on soybean proteinlecithin interaction[J]. Food Hydrocolloids, 2006, 20(7): 990-996. DOI:10.1016/j.foodhyd.2005.11.006.
[7] CRUDDEN C M, ALLEN D P. Stability and reactivity of N-heterocyclic carbene complexes[J]. Coordination Chemistry Reviews, 2004, 248(21): 2247-2273. DOI:10.1016/j.idairyj.2004.11.001.
[8] 王金梅. 大豆蛋白热聚集行为及界面、乳化性质研究[D]. 广州: 华南理工大学, 2012: 30-55.
[9] SHAO Yun, TANG Chuanhe. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions: inf uence of ionic strength and heat pretreatment[J]. Food Hydrocolloids, 2014, 37: 149-158. DOI:10.1016/j.foodhyd.2013.10.030.
[10] HU Min, MCCLEMENTS D J, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 1696-1700. DOI:10.1021/jf020952j.
[11] ADLERCREUTZ D, WEHTJE E. An enzymatic method for the synthesis of mixed-acid phosphatidylcholine[J]. Journal of the American Oil Chemists’ Society, 2004, 81(6): 553-557. DOI:10.1007/ s11746-006-0940-5.
[12] 杜章斌, 滕英来, 汪勇, 等. 核磁共振氢谱法测定卵磷脂、溶血磷脂和甘油磷脂酰胆碱含量[J]. 中国油脂, 2015, 40(3): 83-86.
[13] 张康逸, 张丽霞, 屈凌波, 等. 溶血磷脂酰基转移机理及有效影响因子研究[J]. 有机化学, 2014, 34(12): 2529-2536. DOI:10.6023/ cjoc201404019.
[14] 王大海. 磷脂酶A1催化水解大豆浓缩磷脂的研究[D]. 大连: 大连理工大学, 2008: 33-63.
[15] LIU Fu, TANG Chuanhe. Emulsifying properties of soy protein nanoparticles: influence of the protein concentration and/or emulsif cation process[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2644-2654. DOI:10.1021/jf405348k.
[16] PAN L G, TOMAS M C, ANON M C, et al. Effect of sunflower lecithins on the stability of water-in-oil and oil-in-water emulsions[J]. Journal of Surfactants and Detergents, 2002, 5(2): 135-143. DOI:10.1007/s11743-002-0213-1.
[17] 陈振家, 郝利平. pH值和离子强度对大豆分离蛋白功能特性的影响[J].农产品加工(学刊), 2008, 133(4): 8-12.
[18] MALHOTRA A, COUPLAND J N. The effect of surfactants on the solubility, Zeta potential, and viscosity of soy protein isolates[J]. Food Hydrocolloids, 2004, 18(1): 101-108. DOI:10.1016/S0268-005X(03)00047-X.
[19] 侯俊杰, 严江殷, 杨晓泉. 谷氨酰胺内肽酶限制性水解对大豆伴球蛋白乳化性的影响[J]. 现代食品科技, 2015, 31(4): 51-57. DOI:10.13982/j.mfst.1673-9078.2015.4.009.
[20] 吴金鋆, 刘通讯. 微细化处理对全豆蛋白饮料稳定性的影响[J].现代食品科技, 2009, 25(11): 1246-1249. DOI:10.3969/ j.issn.1673-9078.2009.11.003.
[21] ZARENA A S, BHATTACHARYA S, KADIMI U S, et al. Mangosteen oil-in-water emulsions: rheology, creaming, and microstructural characteristics during storage[J]. Food and Bioprocess Technology, 2012, 5(8): 3007-3013. DOI:10.1007/s11947-011-0695-3.
[22] 吕兵, 陈洁, 夏文水. 乳化剂、油浓度及油滴粒径对乳状液中油脂氧化稳定性的影响[J]. 粮油加工, 2007, 38(3): 53-55.
[23] SILVESTRE M, CHAIYASIT W, BRANNAN R, et al. Ability of surfactant head group size to alter lipid and antioxidant oxidation in oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2000, 48(6): 2057-2061. DOI:10.1021/jf991162l.
[24] 易建华, 孙艺飞, 朱振宝, 等. 桃仁分离蛋白质对油包水乳液物理与氧化稳定性影响[J]. 现代食品科技, 2016, 32(1): 1-8. DOI:10.13982/ j.mfst.1673-9078.2016.1.022.
[25] BOON C, XU Z, YUE X, MCCLEMENTS D, et al. Factors affecting lycopene oxidation in oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1408-1414. DOI:10.1021/jf072929+.
Effect of Enzymatic Modification of Phospholipids on Emulsion Stability and Oxidative Stability of Soybean Protein Isolate-Phospholipids System
LI Qiuhui, SUI Xiaonan, XU Liang, WANG Zhongjiang, ZHANG Yufei, JIANG Lianzhou, LI Yang
*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:The aim of this study was to understand the mechanism of the emulsion stability and oxidative stability of enzymatic phospholipid hydrolysate-soybean protein isolate (SPI) emulsions by evaluating the effect of different hydrolysis times of phospholipid with phospholipase on emulsifying properties, storage stability, oxidation stability and other characteristics. The phospholipid hydrolysate was analyzed by nuclear magnetic resonance. Meanwhile, the emulsifying activity, emulsifying stability, particle size distribution, Zeta potential, creaming index, hydrogen peroxide value and thiobarbituric acid reactive substances (TBARS) value of emulsions were determined. The results showed that lysophospholipid was the major product after 4 h enzymatic hydrolysis of phospholipid, and the lysophospholipid-SPI emulsion was superior to the control sample with respect to emulsion stability, storage stability and oxidation stability. The stability of the lysophospholipid was slightly decreased after 6 h hydrolysis due to the transfer of acyl groups. Therefore, the addition of hydrolysis products from phospholipids can promote the system to form a stable interfacial film, improving emulsion stability and oxidative stability.
Key words:soybean protein isolate; enzymatic hydrolysate; emulsion stability; oxidative stability
DOI:10.7506/spkx1002-6630-201623011
中图分类号:TS214. 2
文献标志码:A
文章编号:1002-6630(2016)23-0064-06
引文格式:
李秋慧, 隋晓楠, 徐靓, 等. 酶法改性磷脂对大豆蛋白共建体系乳化稳定性及氧化稳定性的影响[J]. 食品科学, 2016, 37(23): 64-69. DOI:10.7506/spkx1002-6630-201623011. http://www.spkx.net.cn
LI Qiuhui, SUI Xiaonan, XU Liang, et al. Effect of enzymatic modification of phospholipids on emulsion stability and oxidative stability of soybean protein isolate-phospholipids system[J]. Food Science, 2016, 37(23): 64-69. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623011. http://www.spkx.net.cn
收稿日期:2016-02-19
基金项目:“十二五”国家科技支撑计划项目(2014BAD22B01);国家高技术研究发展计划(863计划)项目(2013AA102104);国家自然科学基金青年科学基金项目(31301501);国家自然科学基金面上项目(31571876)
作者简介:李秋慧(1991—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:cherish_lqh620@163.com *
通信作者: