王大为,赵 鑫,董 欣,宋云禹,董彦夫,任华华
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:为研究发芽对绿豆皮膳食纤维结构及功能性质的影响,采用X射线衍射分析、红外光谱分析和电子显微镜扫描等方法测定其结构,并对其持水力、持油力、膨胀力、阳离子交换能力、吸附葡萄糖能力、吸附胆固醇能力和吸附NO 2 -能力等功能性质进行对比研究。结果表明:发芽处理后绿豆皮中总膳食纤维含量增加3.40%,可溶性膳食纤维增加13.62%。发芽绿豆皮膳食纤维的持水力、持油力、膨胀力明显提高,分别达到(6.97±0.32)、(4.93±0.10) g/g、(4.79±0.11) mL/g,阳离子交换能力略有降低,为(0.47±0.02) mmol/g,吸附葡萄糖能力增加,为(8.37±0.18) mmol/g,吸附胆固醇能力增加,为(2.23±0.11) mg/(mL·g),吸附NO 2 -能力有所降低,为(3.92±0.09) mg/g。扫描电子显微镜结果表明,发芽可使绿豆皮膳食纤维表面出现更多孔隙和褶皱,有利于膳食纤维吸附能力的提高;X射线衍射结果表明,发芽没有改变绿豆皮膳食纤维的结晶度,较好地保留了膳食纤维的结晶区和非结晶区;傅里叶红外光谱分析表明,发芽没有破坏绿豆皮膳食纤维的官能团结构。绿豆经发芽处理后改善了绿豆皮膳食纤维的大部分功能性质,较好地保留了其结构,有利于绿豆副产物的开发利用。
关键词:发芽;绿豆;膳食纤维;结构;性质
绿豆又名植豆、吉豆,属于豆科、蝶形花亚科、菜豆族、豇豆属,为一年生草本植物。绿豆种植最早起源于中国,已有2 000多年的栽培历史,主产区集中在东北三省及内蒙古自治区,除上海、西藏、青海、宁夏外,在我国大陆的30多个省、市、自治区均有种植 [1]。绿豆的营养成分十分丰富,其籽粒中蛋白质和淀粉含量高达80%左右 [2],还含少量维生素、矿物质和脂肪等物质;其种皮中主要成分是纤维 [3],还含有黄酮类化合物及酚类化合物等生物活性物质 [4]。
绿豆芽是绿豆经过浸泡、发芽后得到的一种菜用产品,适宜世界各地的广大人群食用,目前其年产量呈逐年增长趋势 [5]。绿豆发芽后可有效增加其维生素 [6]、总酚类化合物 [7]等生物活性成分的含量,抗氧化活性也有所增加 [8-9]。绿豆芽在生产过程中会产生大量的绿豆皮副产物,绿豆皮中膳食纤维的含量高达75%,因此,绿豆皮是一种良好的膳食纤维资源,但目前对绿豆皮的开发尚不完全,通常只能用作饲料或者直接废弃,造成这一良好资源的极大浪费。膳食纤维作为一种重要的功能性营养素,对预防心血管疾病 [10]、降低胆固醇水平 [11]、调节血糖 [12]、预防肥胖症和肠道疾病及清除内源有害物质等均有一定的功效 [13]。迄今为止,已有关于玉米皮膳食纤维、米糠膳食纤维和小麦麸皮膳食纤维等的研究报道 [14-16],但对绿豆皮膳食纤维的研究报道相对较少,张洪微等 [17]采用加碱蒸煮法从绿豆皮中提取膳食纤维,最佳提取率为64.2%;李积华等 [18]对全绿豆和绿豆皮膳食纤维各级多糖进行了比较分析;杜冰等 [19]将绿豆皮和绿豆粉按照10∶2的比例混合后进行双螺杆挤压改性处理,可溶性膳食纤维(soluble dietary fiber,SDF)含量由3.8%增加到8.5%,结晶度降低了8.7%;邬海雄等 [20]将绿豆纤维超细粉碎后应用到焙烤食品杏仁饼中。而发芽对绿豆皮膳食纤维的结构及性质的影响鲜见报道,如能将绿豆芽生产过程中产生的绿豆皮充分合理利用,将会大幅度提升绿豆附加值,提高绿豆精深加工行业经济效益。
本研究拟收集发芽前与发芽后的绿豆皮,对未发芽绿豆皮膳食纤维(non-sprouted mung bean skin dietary fiber,N-DF)和发芽后绿豆皮膳食纤维(after sprouted mung bean skin dietary f ber,A-DF)的持水力、持油力、膨胀力、阳离子交换能力、葡萄糖吸附能力以及在生理条件下对胆固醇吸附能力和NO 2 -吸附能力等功能性质进行对比研究,通过X射线衍射分析、红外光谱分析和电子显微镜扫描测定其结构,为绿豆皮膳食纤维的进一步开发利用提供一定的理论依据。
1.1 材料与试剂
绿豆产于吉林省白城地区。
耐高温α-淀粉酶(酶活力≥4×10 4U/g)、碱性蛋白酶(酶活力≥3×10 3U/mL)、糖化酶(酶活力≥1.6×10 5U/g)诺维信中国生物技术有限责任公司;2-(N-吗啉代)乙烷磺酸 北京鼎国昌盛生物技术有限公司;三羟甲基氨基甲烷 中国惠世生化试剂有限公司;葡萄糖 天津市北方天医化学试剂厂;亚硝酸钠天津市福晨化学试剂厂;胆固醇 上海新兴化工试剂研究所;所用其他试剂均为国产分析纯。
1.2 仪器与设备
DY801(B型)家用智能豆芽机 中山市迪尼仕电器制造有限公司;EX-224电子天平(万分之一)奥豪斯仪器(上海)有限公司;TU-1901型紫外-可见分光光度计 北京普析通用仪器有限公司;PRESTIGE-21傅里叶变换红外光谱仪、SSX-550型扫描电子显微镜日本岛津公司;D8-ADVANCE型广角X射线衍射仪德国Bruker公司。
1.3 方法
1.3.1 绿豆皮的准备
选用籽粒饱满、无破损和病害绿豆,去离子水清洗3 次后,用温水浸泡30 min,取一部分绿豆剥皮得未发芽绿豆皮,将其余浸泡后的绿豆置于豆芽机中25 ℃恒温培养3 d,每天换水2 次,发芽结束后收集绿豆皮,常温干燥后粉碎至80 目,保存备用。
1.3.2 绿豆皮基础成分测定
水分含量测定:参照GB 5009.3—2010《食品中水分的测定》直接干燥法;脂肪含量测定:参照GB/T 5009.6—2003《食品中脂肪的测定》索氏提取法;灰分含量测定:参照GB 5009.4—2010《食品中灰分的测定》灼烧称量法;蛋白质含量测定:参照GB 5009.5—2010《食品中蛋白质的测定》分光光度法;淀粉含量测定:参照GB/T 5009.9—2008《食品中淀粉的测定》酶水解法;总膳食纤维(total dietary f ber,TDF)、SDF、不溶性膳食纤维含量测定:参照GB 5009.88—2014《食品中膳食纤维的测定》;多酚含量测定:参照隋银强等 [21]方法测定。
1.3.3 绿豆皮膳食纤维的提取
参照AOAC 991.43《食物中总的、可溶性和不溶性膳食纤维》酶-质量法提取膳食纤维。
1.3.4 绿豆皮膳食纤维结构的测定
1.3.4.1 X射线衍射扫描
衍射条件:电流:40 mA;电压:40 kV;靶型:Cu;步长:0.1°;起始角:2°;终止角:50°;扫描方式:连续。
1.3.4.2 扫描电子显微镜观察
参照Zhang Min等 [22]方法,将干燥粉碎至20 目(0.850 mm)的样品喷金后放入扫描电子显微镜中,20 kV加速电压条件下,对样品100、500、2 000、4 000 倍的微观结构进行拍照观察。
1.3.4.3 傅里叶红外光谱扫描
参照张艳荣等 [23]方法,准确称取干燥绿豆皮膳食纤维2 mg,加入干燥KBr粉末200 mg,混合均匀且充分研磨后压片进行检测,扫描范围4 000~400 cm -1。
1.3.5 绿豆皮膳食纤维功能性质的测定
1.3.5.1 持水力(持油力)的测定
参照Rupérez等 [24]方法准确称取干燥样品0.20 g于离心管中,加入10 mL蒸馏水(植物油),搅拌均匀,保鲜膜密封,室温放置12 h,然后在室温条件下3 800 r/min离心20 min,弃去上清液,用滤纸吸干多余水分(油)后,称量样品湿质量,持水力和持油力按公式(1)计算。
式中:m 0为恒质量样品质量/g;m 1为离心管质量/g;m 2为吸水(油)后离心管与样品质量之和/g。
1.3.5.2 膨胀力的测定
参照Sowbhagya等 [25]方法,准确称取干燥样品0.20 g于10 mL量筒中,记录样品自然堆积时体积,加蒸馏水至5 mL刻度,保鲜膜密封,室温条件下放置18 h后,记录样品膨胀后的体积。膨胀力按公式(2)计算。
式中:m为恒质量样品质量/g;V 1为吸水膨胀后样品的体积/mL;V 0为样品自然堆积的体积/mL。
1.3.5.3 阳离子交换能力的测定
参照Chau等 [26]方法稍加修改。准确称取干燥样品1.00 g于250 mL三角烧瓶中,加入1 mol/L HCl溶液50 mL,搅拌均匀后保鲜膜密封,室温条件下静置24 h,使样品完全酸化,用蒸馏水洗涤至不含Cl -,然后置于烘箱中干燥至恒质量。准确称取干燥样品0.20 g于250 mL三角烧瓶中,加入5 g/100 mL的NaCl溶液50 mL,搅拌均匀,加入2 滴酚酞指示剂,用0.01 mol/L NaOH溶液滴定至终点,记录滴定体积V 1/mL。同时用蒸馏水做空白,记录空白体积V 0/mL,阳离子交换能力按公式(3)计算。
式中:c为滴定所用NaOH溶液浓度/(mol/L);m为干燥样品质量(0.20 g)。
1.3.5.4 吸附葡萄糖能力的测定
参照Chau等 [27]方法稍作修改。称取干燥样品2.00 g于250 mL烧杯内,加入100 mL 85%乙醇溶液,80 ℃条件下水浴15 min,过滤,反复洗涤3 次后,将残渣于60 ℃条件下烘干至恒质量。称取处理后的样品0.50 g放入250 mL的三角瓶中,加入浓度为100 mmol/L的葡萄糖溶液100 mL,搅拌均匀后于37 ℃恒温水浴中振荡2、4、6、8、10、12、24 h后,取出在室温条件下12 000 r/min离心20 min,收集上清液定容至100 mL。吸取2 mL上清液,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法,以葡萄糖标品制备葡萄糖标准曲线y=0.515 7x-0.010 4(R 2=0.995 9),测定540 nm波长处上清液中葡萄糖浓度。吸附葡萄糖能力按公式(4)计算。
式中:m为恒质量样品质量/g;ρ 1为吸附前葡萄糖溶液中葡萄糖的浓度/(mmol/L);ρ 2为吸附后上清液中葡萄糖的浓度/(mmol/L);V葡萄糖溶液体积/L,本实验为0.1 L。
1.3.5.5 吸附胆固醇能力的测定
参照Zhang Ning等 [28]方法稍作修改。取市售鲜鸡蛋蛋黄,加9 倍水搅打成乳液,准确称取干燥样品0.50 g于250 mL三角烧瓶中,加入30 mL乳液搅拌均匀,分别配制pH 2(模拟胃环境)和pH 7(模拟小肠环境)的磷酸盐缓冲溶液,37 ℃水浴振荡2、4、6、8、10、12、24 h后,在室温条件下3 800 r/min离心15 min,分别取上清液1 mL,采用邻苯二甲醛法,以胆固醇标品制备标准曲线y=0.008 7x-0.004 9(R 2=0.990 2),测定550 nm波长处上清液中胆固醇质量浓度ρ 1,同时测定吸附前蛋黄乳液中的胆固醇质量浓度ρ 2。胆固醇吸附能力按公式(5)计算。
式中:m为恒质量样品质量/g;ρ 1为吸附后上清液中胆固醇质量浓度/(mg/mL);ρ 2为吸附前蛋黄乳液胆固醇质量浓度/(mg/mL)。
1.3.5.6 吸附
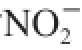 能力的测定
能力的测定
参照阮传英等
[29]方法,准确称取干燥样品0.20 g于250 mL锥形瓶中,加入50 mL质量浓度为0.1 mg/mL的亚硝酸钠溶液,分别配制pH 2(模拟胃环境)和pH 7(模拟小肠环境)的磷酸盐缓冲溶液,37 ℃水浴振荡2、4、6、8、10、12、24 h后,在室温条件下3 800 r/min离心15 min,分别取上清液1 mL,采用盐酸萘乙二胺法,以亚硝酸钠标品制备标准曲线y=0.353 8x-0.043 7(R
2=0.990 3),测定538 nm波长处上清液中
 含量,吸附NO
2
-能力按公式(6)计算。
含量,吸附NO
2
-能力按公式(6)计算。
式中:m为恒质量样品质量/g;m
1为吸附前样品中
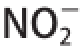 质量/mg;m
0为吸附后样品中
质量/mg;m
0为吸附后样品中
 质量/mg。
质量/mg。
1.4 数据统计分析
所有实验重复3 次,测定结果以± s表示,使用SPSS 17.0软件进行差异显著性分析和方差分析。
2.1 绿豆皮基本组成成分
表1 绿豆皮基本组成成分
Table 1 General chemical composition of mung bean skin

注:同列肩标小写字母不同表示差异显著( P<0.05)。下同。
SDF含量/(g/100 g)未发芽6.47±0.16 a1.41±0.02 a9.27±0.12 a1.34±0.071.80±0.03 a33.12±4.32 a79.58±0.28 a76.51±0.27 a3.01±0.11 a发芽后6.31±0.10 a1.03±0.04 b8.17±0.24 b1.78±0.03 a79.01±6.13 b82.29±0.16 a78.87±0.34 a3.42±0.18 b组成水分含量/(g/100 g)脂肪含量/(g/100 g)蛋白质含量/(g/100 g)淀粉含量/(g/100 g)灰分含量/(g/100 g)多酚含量/( g/100 g)TDF含量/(g/100 g)IDF含量/(g/100 g)
由表1可知,发芽后绿豆皮中T D F含量由(79.58±0.28) g/100 g增加到(82.29±0.16) g/100 g,SDF由(3.01±0.11) g/100 g增加到(3.42±0.18) g/100 g,I D F含量由(7 6.5 1±0.2 7) g/1 0 0 g增加到(78.87±0.34) g/100 g,TDF和IDF含量变化差异性不显著,SDF含量变化差异性显著。发芽后绿豆皮中蛋白质和脂肪含量变化具有显著性差异,蛋白质含量由(9.27±0.12) g/100 g降低到(8.17±0.24) g/100 g,脂肪含量由(1.4 1±0.0 2) g/1 0 0 g降低到(1.03±0.04) g/100 g,发芽前后水分含量及灰分含量变化差异性不显著。王慧 [30]研究发现,豆类发芽后营养成分会因其品种不同而有差异,大多数豆类在发芽后蛋白质含量会呈现先上升后缓慢下降的趋势,而脂肪含量呈下降趋势,这与本研究结果比较一致。发芽后绿豆皮多酚含量由(33.12±4.32) μg/100 g增加到(79.01±6.13) μg/100 g,多酚含量变化具有显著性差异。未经发芽绿豆皮中含有少量淀粉,这可能是在绿豆取皮过程中黏连导致。
2.2 X射线衍射扫描结果

图1 绿豆皮膳食纤维X射线衍射图
Fig. 1 X-ray diffraction pattern of dietary fiber in mung bean skin
由图1可以看出,发芽没有改变绿豆皮膳食纤维的结晶结构,较好地保留了膳食纤维的结晶区和非结晶区,2 种绿豆皮膳食纤维的主衍射峰位置未发生明显改变,分别为2
θ=16.7 、2
θ=22 ,且在2
θ=34.4 出现一个小的衍射峰。2
θ为15
 ~25
~25
 范围为纤维素和半纤维素的衍射峰
[31-32],说明绿豆皮膳食纤维中存在着纤维素和半纤维素。A-DF在2
θ为17.9
范围为纤维素和半纤维素的衍射峰
[31-32],说明绿豆皮膳食纤维中存在着纤维素和半纤维素。A-DF在2
θ为17.9
 ~31.9
~31.9
 范围内衍射峰的峰面积略有降低,但峰高变化不明显。
范围内衍射峰的峰面积略有降低,但峰高变化不明显。
2.3 电子显微镜扫描结果

图2 绿豆皮膳食纤维扫描电子显微镜图
Fig. 2 Scanning electron micrographs of dietary fiber in mung bean skin
由图2a可以看出,N-DF表面存在少量孔隙,相对较为光滑,略有褶皱;由图2b可以看出,A-DF表面存在大量的孔隙,表面较为粗糙,有不规则颗粒状物质存在,存在着大量褶皱,该结构可增加膳食纤维与物质作用时的接触面积,孔隙较多有利于水分子进入形成氢键或偶极作用,增加膳食纤维的吸附能力,进而提高膳食纤维的持水力和膨胀力 [33],这与A-DF的持水力和膨胀力都高于N-DF的结果(表2)相一致。
2.4 傅里叶红外光谱扫描结果
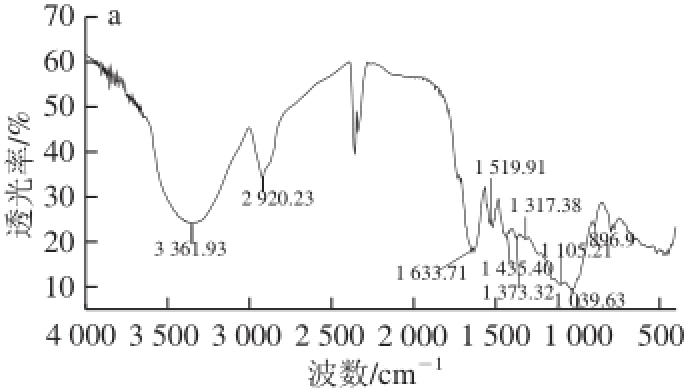

图3 绿豆皮膳食纤维N-DF(a)和A-DF(b)傅里叶红外光谱扫描图Fig. 3 Infrared spectra of N-DF (a) and A-DF (b)
由图3可知,N-DF和A-DF分别在3 361.93、3 286.70 cm -1处出现强宽峰,这是由O—H的伸缩振动引起的,说明可能存在着分子内或分子间缔合状态的氢键 [34];2 种膳食纤维分别在2 920.23、2 918.30 cm -1处的吸收峰为C—H的伸缩振动峰;在1 633.71、1 618.28 cm -1处的吸收峰是由C=O伸缩振动引起的,说明绿豆皮膳食纤维中可能存在糖醛酸 [35];在1 519.91、1 539.20 cm -1处的吸收峰是苯环特征吸收峰,说明绿豆皮膳食纤维中可能存在木质素 [36];2 种膳食纤维在1 435.40 cm -1和1 373.32 cm -1、1 436.97 cm -1和1 373.32 cm -1处双峰为C—H的变角振动,这是纤维素类多糖的特征吸收峰;1 105.21 cm -1和1 039.63 cm -1、1 157.29 cm -1和1 118.77 cm -1出现双峰,这是C—O的2 种伸缩振动引起的,一种是糖环的醚键C—O—C,另一种是C—O—H [37];896.90 cm -1处的吸收峰表明2 种绿豆皮膳食纤维单糖含有β型吡喃糖C—H的弯曲振动 [34]。A-DF在825.53 cm -1处的吸收峰为α型吡喃糖的C—H弯曲振动 [38]。N-DF和A-DF主体官能团吸收峰的数量、位置、峰形大体没有改变,发芽没有破坏绿豆皮膳食纤维的官能团结构。
2.5 膳食纤维的理化性质
表2 膳食纤维的理化性质
Table 2 Physiochemical properties of dietary fiber

阳离子交换能力/(mmol/g)N-DF5.77±0.12 a3.28±0.07 a2.48±0.03 a0.64±0.03 aA-DF6.97±0.32 b4.93±0.10 b4.79±0.11 b0.47±0.02 b样品持水力/(g/g)持油力/(g/g)膨胀力/(mL/g)
由表2可知,发芽对绿豆皮膳食纤维的持水力、持油力、膨胀力等理化性质有一定的改善作用,其中A-DF的持水力为(6.97±0.32) g/g,是N-DF的1.21 倍;持油力为(4.93±0.10) g/g,是N-DF的1.50 倍;膨胀力为(4.79±0.11) mL/g,是N-DF的1.93 倍。这是由于发芽过程中绿豆皮膳食纤维表面出现褶皱和孔隙,比表面积增大,有利于更多的亲水基团暴露出来 [33],水分子可以更好渗入到绿豆皮膳食纤维内部并与之结合。而A-DF的阳离子交换能力较N-DF则有所降低,由(0.64±0.03) mmol/g下降到(0.47±0.02) mmol/g,阳离子交换能力的强弱与其中的糖醛酸含量有关 [39],可能是发芽过程中使膳食纤维中糖醛酸溶出,从而使A-DF的阳离子交换能力较N-DF降低。N-DF的持水力、持油力、膨胀力和阳离子交换能力均具有显著性差异变化。有研究报道玉米皮膳食纤维持水力为(5.20±0.66) g/g、持油力为(2.50±0.87) g/g、膨胀力为(2.40±0.09) mL/g [14],与其相比发芽绿豆皮膳食纤维持水力、持油力和膨胀力高于玉米皮膳食纤维。
2.6 吸附葡萄糖能力
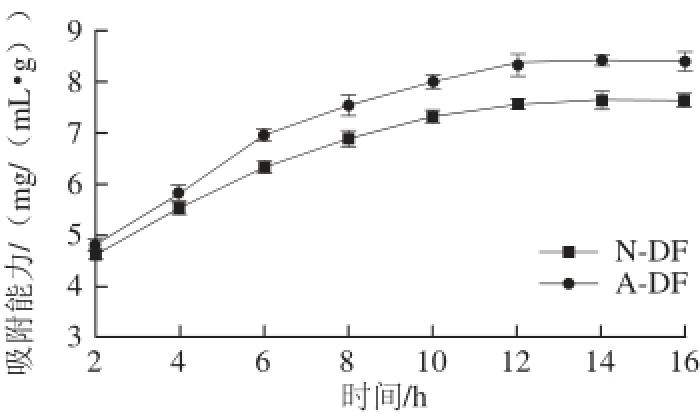
图4 绿豆皮膳食纤维吸附葡萄糖能力
Fig. 4 Glucose adsorption capacity of dietary fiber
由图4可以看出,2 种膳食纤维对葡萄糖的吸附能力呈逐渐上升趋势,最后达到平衡。在2~6 h内,葡萄糖吸附能力增加较为明显,6~12 h内增加较为缓慢,12 h基本达到吸附平衡。吸附时间为2 h时,N-DF和A-DF 对葡萄糖的吸附能力分别为(4.61±0.09)、(4.83±0.12) mmol/g;吸附平衡时,N-DF吸附葡萄糖能力为(7.57±0.12) mmol/g,A-DF对葡萄糖吸附能力为(8.37±0.18) mmol/g。这可能是具有黏性的SDF将葡萄糖包裹进去,从而截留住葡萄糖分子 [40],这与表1中发芽后SDF含量高于发芽前SDF含量结果相一致。
2.7 吸附胆固醇能力
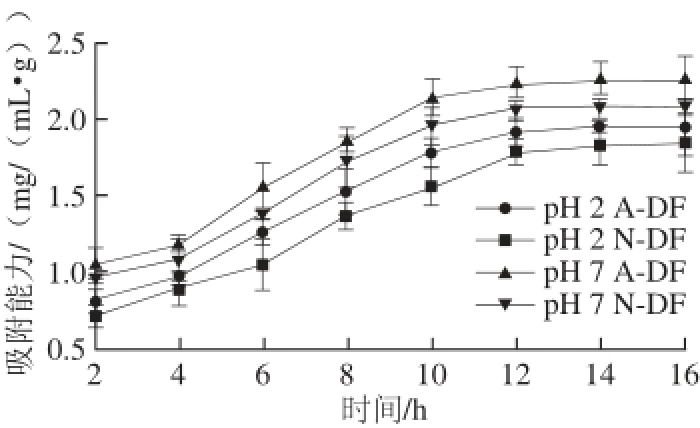
图5 绿豆皮膳食纤维吸附胆固醇能力
Fig. 5 Cholesterol adsorption capacity of dietary fiber
由图5可以看出,在pH 2(模拟胃环境)和pH 7(模拟小肠环境)条件下,N-DF和A-DF对胆固醇的吸附能力呈逐渐上升趋势,12 h左右基本达到平衡。在相同条件下,A-DF对胆固醇的吸附能力明显高于N-DF。pH 2条件下,吸附2 h时N-DF对胆固醇吸附能力为(0.71±0.08) mg/(mL·g)、A-DF对胆固醇的吸附能力为(0.82±0.07) mg/(mL·g),吸附平衡时N-DF和A-DF对胆固醇的吸附能力分别为(1.78±0.07)、(1.92±0.09) mg/(mL·g)。pH 7条件下,吸附2 h时N-DF和A-DF对胆固醇的吸附能力分别为(0.97±0.09)、(1.04±0.11) mg/(mL·g),吸附平衡时N-DF和A-DF对胆固醇的吸附能力分别为(2.08±0.14)、(2.23±0.11) mg/(mL·g)。相同pH值条件下A-DF吸胆固醇附能力略优于N-DF,可能是因为SDF易于吸附胆固醇 [41],这与表1中A-DF中SDF含量略优于N-DF这一结果相一致。研究发现pH值对胆固醇的吸附有一定的影响 [42],相同绿豆皮膳食纤维在pH 7时(模拟小肠环境)对胆固醇的吸附能力优于pH 2时(模拟胃环境)的绿豆皮膳食纤维。可能是因为膳食纤维对胆固醇的吸附过程属于物理吸附 [43],这与电子显微镜扫描结果A-DF表面出现更多的褶皱,有利于膳食纤维对胆固醇的吸附相一致。
2.8 吸附
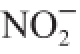 能力
能力
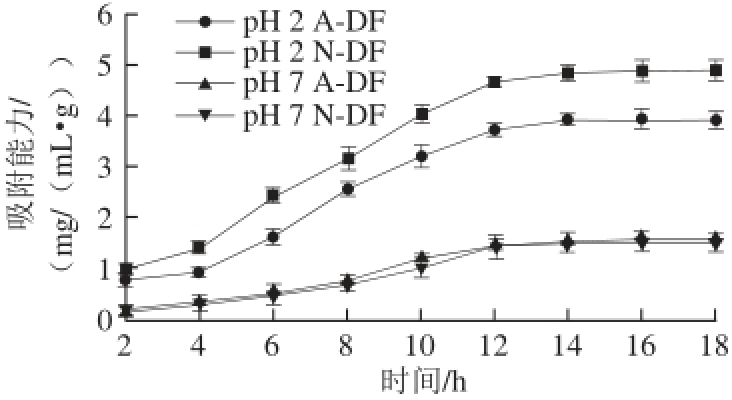
图6 绿豆皮膳食纤维吸附
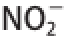 能力
能力
Fig. 6
 adsorption capacity of dietary fiber
adsorption capacity of dietary fiber
由图6可以看出,在pH 2(模拟胃环境)和pH 7(模拟小肠环境)条件下,N-DF和A-DF对
 的吸附能力随时间延长呈上升趋势,14 h左右基本达到吸附平衡。在pH 2条件下,N-DF对
的吸附能力随时间延长呈上升趋势,14 h左右基本达到吸附平衡。在pH 2条件下,N-DF对
 的吸附能力高于A-DF。吸附2 h时N-DF对
的吸附能力高于A-DF。吸附2 h时N-DF对
 的吸附能力为(0.98±0.11) mg/g、A-DF对
的吸附能力为(0.98±0.11) mg/g、A-DF对
 的吸附能力为(0.76±0.10) mg/g,吸附平衡时N-DF和A-DF对
的吸附能力为(0.76±0.10) mg/g,吸附平衡时N-DF和A-DF对
 的吸附能力分别为(4.85±0.18) mg/g和(3.92±0.09) mg/g。pH 7条件下2 种绿豆皮膳食纤维吸附
的吸附能力分别为(4.85±0.18) mg/g和(3.92±0.09) mg/g。pH 7条件下2 种绿豆皮膳食纤维吸附
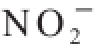 能力相差较小,吸附2 h时N-DF和A-DF对
能力相差较小,吸附2 h时N-DF和A-DF对
 的吸附能力分别为(0.21±0.04) mg/g和(0.18±0.05) mg/g,吸附平衡时N-DF与A-DF的吸附
的吸附能力分别为(0.21±0.04) mg/g和(0.18±0.05) mg/g,吸附平衡时N-DF与A-DF的吸附
 能力分别为(1.57±0.17)、(1.51±0.13) mg/g。有研究表明,膳食纤维对
能力分别为(1.57±0.17)、(1.51±0.13) mg/g。有研究表明,膳食纤维对
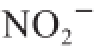 吸附可能是由于膳食纤维细胞壁中的酚酸与
吸附可能是由于膳食纤维细胞壁中的酚酸与
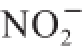 反应,从而阻断亚硝胺类物质的生成
[41],这与表1结果相一致。绿豆皮膳食纤维在pH 2(模拟胃环境)条件下的吸附能力优于pH 7(模拟小肠环境)条件,这可能是由于随着pH值的升高,含羧基化合物(糖醛酸、阿魏酸等)上的羧基发生解离,增加了附着在膳食纤维表面的负电荷密度,对
反应,从而阻断亚硝胺类物质的生成
[41],这与表1结果相一致。绿豆皮膳食纤维在pH 2(模拟胃环境)条件下的吸附能力优于pH 7(模拟小肠环境)条件,这可能是由于随着pH值的升高,含羧基化合物(糖醛酸、阿魏酸等)上的羧基发生解离,增加了附着在膳食纤维表面的负电荷密度,对
 产生排斥作用,促使
产生排斥作用,促使
 释放出来,进而发生解吸
[44]。
释放出来,进而发生解吸
[44]。
发芽有利于提高绿豆皮中膳食纤维含量,发芽后绿豆皮中TDF含量由(79.58±0.28) g/100 g增加到(82.29±0.16)g/100 g,提高了3.40%;SDF含量由(3.01±0.11) g/100 g增加到(3.42±0.18) g/100 g,提高了13.62%。
绿豆经发芽处理后尚未破坏绿豆皮膳食纤维结构:X射线衍射结果表明,发芽没有破坏绿豆皮膳食纤维结晶度,仍保留着相近的晶体结构;扫描电子显微镜结果表明,A-DF表面出现更多孔隙和褶皱,有利于提高膳食纤维的吸附能力;傅里叶红外光谱结果表明,两种膳食纤维中均具有C—H键、O—H键、C=O键等纤维素及半纤维素的特征吸收峰。
绿豆经发芽处理后有利于绿豆皮膳食纤维的大部分功能性质提高:有效改善了绿豆皮膳食纤维的持水力、持油力、膨胀力、吸附葡萄糖能力、吸附胆固醇能力等功能特性,但对阳离子交换能力和吸附
 能力有所降低。
能力有所降低。
绿豆经发芽处理后可以保留原有绿豆皮膳食纤维的结构,同时还可有效改善绿豆皮膳食纤维除阳离子交换能力和吸附
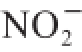 能力以外的大部分功能性质,如能将这一良好资源应用到食品加工中,可有效提高绿豆精深加工行业的经济效益。
能力以外的大部分功能性质,如能将这一良好资源应用到食品加工中,可有效提高绿豆精深加工行业的经济效益。
参考文献:
[1] 周显青. 食用豆类加工与利用[M]. 北京: 化学工业出版社, 2003: 23-24.
[2] 曾志红, 王强, 林伟静, 等. 绿豆的品质特性及加工利用研究概况[J]. 作物杂志, 2011, 26(4): 14-19. DOI:10.16035/j.issn.1001-7283.2011.04.007.
[3] 袁艳娟, 金苗, 赵珺, 等. 响应曲面法优化绿豆皮中膳食纤维的提取工艺[J]. 安徽农业科学, 2008, 36(23): 9900-9901. DOI:10.3969/ j.issn.0517-6611.2008.23.017.
[4] 张燕, 么杨, 潘国清, 等. 绿豆皮中总黄酮的提取工艺研究[J]. 中国粮油学报, 2009, 24(10): 124-127.
[5] MBITHI S, CAMP J V, RODRIGUEZ R, et al. Effects of sprouting onnutrient and antinutrient composition of kidney beans (Phaseolus vulgaris var. Rose coco)[J]. European Food Research and Technology, 2001, 212(2): 188-191. DOI:10.1007/s002170000200.
[6] GUO Xinbo, LI Tong, TANG Kexuan, et al. Effect of germination on phytochemical profiles and antioxidant activity of mung bean sprouts (Vigna radiata)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(44): 11050-11055.
[7] CEVALLOS-CASALS B A, CISNEROS-ZEVALLOS L. Impact of germination on phenolic content and antioxidant activity of 13 edible seed species[J]. Food Chemistry, 2010, 119(4): 1485-1490. DOI:10.1016/j.foodchem.2009.09.030.
[8] DOBLADO R, FR AS J, VIDAL-VALVERDE C. Changes in vitamin C content and antioxidant capacity of raw and germinated cowpea (Vigna sinensis var. carilla) seeds induced by high pressure treatment[J]. Food Chemistry, 2007, 101(3): 918-923. DOI:10.1016/ j.foodchem.2006.02.043.
[9] CHANDRASIRI S D, LIYANAGE R, VIDANARACHCHI J K, et al. Does processing have a considerable effect on the nutritional and functional properties of mung bean (Vigna Radiata)?[J]. Procedia Food Science, 2016, 6: 352-355. DOI:10.1016/j.profoo.2016.02.071.
[10] PEREIRA M, OREILLY E, AUGUATSSON K. Dietary fiber and risk of coronary heart disease: a pooled analysis of cohort studies[J]. Archives of Internal Medicine, 2004, 164(4): 370-376. DOI:10.1001/ archinte.164.4.370.
[11] HAMAUZU Y, MIZUNO Y. Non-extractable procyanidins and lignin are important factors in the bile acid binding and radical scavenging properties of cell wall material in some fruits[J]. Plant Foods for Human Nutrition, 2011, 66(1): 70-77. DOI:10.1007/s11130-010-0207-z.
[12] NSOR-ATINDANA J, ZHONG F, MOTHIBE K J. In vitro hypoglycemic and cholesterol lowering effects of dietary fiber prepared from cocoa (Theobroma cacao L.) shells[J]. Food and Function, 2012, 3(10): 1044-1050. DOI:10.1039/C2FO30091E.
[13] IAIN A, BROWNLEE. The physiological roles of dietary fiber[J]. Food Hydrocolloids, 2011, 25(2): 238-250. DOI:10.1016/ j.foodhyd.2009.11.013.
[14] 王大为, 郭雪飞, 杨羿. 高温高压挤出处理对玉米皮膳食纤维溶解特性及物性的影响[J]. 食品科学, 2011, 32(13): 84-88.
[15] 刘婷婷, 张传智, 浦静舒, 等. 双螺杆挤出工艺对米糠可溶性膳食纤维含量的影响[J]. 食品科学, 2011, 32(24): 41-45.
[16] YAN Xiaoguang, YE Ran, CHEN Ye. Blasting extrusion processing: the increase of soluble dietary f ber content and extraction of solublef ber polysaccharides from wheat bran[J]. Food Chemistry, 2015, 180: 106-115. DOI:10.1016/j.foodchem.2015.01.127.
[17] 张洪微, 冯传威, 陶园钊. 绿豆皮膳食纤维提取的研究[J]. 农产品加工(学刊), 2006, 2(7): 38-40. DOI:10.3969/j.issn.1671-9646-B.2006.07.011.
[18] 李积华, 郑为完, 杨静, 等. 绿豆膳食纤维的分析[J]. 食品研究与开发, 2006, 27(7): 176-178.
[19] 杜冰, 黄守耀, 姜龙波, 等. 双螺杆挤压对绿豆皮中膳食纤维的改性研究[J]. 食品工业科技, 2012, 33(10): 170-176. DOI:10.13386/ j.issn.1002-0306.2012.10.063.
[20] 邬海雄, 张延杰, 宁初光. 绿豆膳食纤维超微粉在杏仁饼中的应用研究[J]. 食品工业科技, 2006, 27(6): 170-176. DOI:10.3969/ j.issn.1002-0306.2006.06.039.
[21] 隋银强, 杨继红, 李华, 等. 酿酒葡萄皮渣红外干燥研究[J]. 食品工业科技, 2014, 35(15): 258-263. DOI:10.13386/j.issn1002-0306.2014.150.48.
[22] ZHANG Min, BAI Xin, ZHANG Zesheng. Extrusion process improves the functionality of soluble dietary fiber in oat bran[J]. Journal of Cereal Science, 2011, 54(1): 98-103. DOI:10.1016/j.jcs.2011.04.001.
[23] 张艳荣, 魏春光, 崔海月, 等. 马铃薯膳食纤维的表征及物性分析[J].食品科学, 2013, 34(11): 19-23. DOI:10.7506/spkx1002-6630-201311005.
[24] RUPÉREZ P, SAURA-CALIXTO F. Dietary fiber and physicochemical properties of edible Spanish seaweeds[J]. Europe Food Research Technology, 2001, 212(3): 349-354. DOI:10.1007/ s002170000264.
[25] SOWBHAGYA H B, SUMAP F, MAHADEVAMMA S, et al. Spent residue from cumin-a potential source of dietary fiber[J]. Food Chemistry, 2007, 104(3): 1220-1225. DOI:10.1016/ j.foodchem.2007.01.066.
[26] CHAU C F, CHEUNG P C K. Effect of the physics-chemical properties of three legume fibers on cholesterol absorption in hamsters[J]. Nutrition Research, 1999, 19(2): 257-265. DOI:10.1016/ S0271-5317(98)00189-4.
[27] CHAU C F, HUANG Y L, LEE M H. In vitro hypoglycemic effect of different insoluble fibre-rich fractions prepared from the peel of Citrus sinensis L. cv. Liucheng[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6623-6626. DOI:10.1021/jf034449y.
[28] ZHANG Ning, HUANG Caihuan, OU Shiyi. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J]. Journal of Hazardous Materials, 2011, 186(1): 236-239. DOI:10.1016/j.jhazmat.2010.10.120.
[29] 阮传英, 涂宗财, 王辉, 等. 豆渣膳食纤维的体外吸附性能[J]. 食品科学, 2014, 35(15): 109-112. DOI:10.7506/spkx1002-6630-201415022.
[30] 王慧. 大豆品种及发芽时间对豆芽营养成分与产量的影响[D]. 哈尔滨: 东北农业大学, 2014: 19-22.
[31] WANG Jinquan, WANG Yan, XIAO Qing. Effects of hemicellulose removal on cellululose fiber structure and recycling characteristics of eucalyptus pulp[J]. Bioresource Technology, 2010, 101(12): 4577-4583. DOI:10.1016/j.biortech.2010.01.026.
[32] CHEN D, LAWTON D, THOMPSON M R, et al. Biocomposites reinforced with cellulose nanocrystals derived from potato peel waste[J]. Carbohydrate Polymers, 2012, 90(1): 709-716. DOI:10.1016/ j.carbpol.2012.06.002.
[33] AL-SHERAJI S H, ISMAIL A, MANAP M Y, et al. Functional properties and characterization of dietary fiber from Mangifera pajang Kort. fruit Pulp[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8): 3980-3985. DOI:10.1021/jf103956g.
[34] 樊红秀. 高品质人参膳食纤维制取工艺优化及其功能特性的研究[D].长春: 吉林农业大学, 2013: 40-41.
[35] 刘志广. 仪器分析[M]. 大连: 大连理工大学出版社, 2007: 273-292.
[36] 令博. 葡萄皮渣膳食纤维的改性及其生理功能和应用的研究[D]. 重庆: 西南大学, 2012: 24-25.
[37] SHI Ying, SHENG Jianchun, YANG Fangmei, et al. Purification and identification of polysaccharide derived from Chlorella pyrenoidosa[J]. Food Chemistry, 2007, 103(1): 101-105. DOI:10.1016/ j.foodchem.2006.07.028.
[38] 郭振楚. 糖类化学[M]. 北京: 化学工业出版社, 2005: 106-119.
[39] SANDHU D K, JOSHI V K. Solid state fermentation of apple pomace for concomitant production of ethanol and animal feed[J]. Journal of Scientif c & Industrial Research, 1997, 56(2): 86-90.
[40] OU S, KWOK K, LI Y, et al. In vitro study of possible role of dietary f ber in lowering postprandial serum glucose[J]. Journal of Agricultural and Food Chemistry, 2001, 49(2): 1026-1029. DOI:10.1021/jf000574n.
[41] 苏钰, 席路, 杨武, 等. 四种玉米皮膳食纤维的组分对其吸附等功能性质影响的研究[J]. 食品工业, 2012, 33(7): 81-84.
[42] NOBUYUKI S, KUNIMASA M, MASAMI N. Binding effect of polychlorinated compounds and environmental carcinogens on rice bran f ber[J]. Journal of Nutritional Biochemistry, 2005, 1(16): 50-58. DOI:10.1016/j.jnutbio.2004.09.005.
[43] 吕金顺, 徐继明. 马铃薯膳食纤维对胆固醇的吸附性能及动力学研究[J]. 食品科学, 2006, 27(6): 55-58. DOI:10.3321/ j.issn:1002-6630.2006.06.008.
[44] 欧仕益, 高孔荣, 黄惠华. 麦麸水不溶性膳食纤维对NO 2 -清除作用的研究[J]. 食品科学, 1997, 18(3): 6-9.
Effect of Germination on the Structure and Properties of Dietary Fiber in Mung Bean Skin
WANG Dawei, ZHAO Xin, DONG Xin, SONG Yunyu, DONG Yanfu, REN Huahua
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:This research was done to study the effect of germination on the structure and functional properties of skin dietary f ber in mung bean. The structure of dietary f ber was determined by X-ray diffraction, scanning infrared spectroscopy and scanning electron microscopy. Functional properties such as water-holding capacity, oil-holding capacity, swelling capacity, cation exchange capacity, glucose adsorption capacity, cholesterol adsorption capacity and NO 2 -adsorption capacity were compared. The results showed that the content of total dietary f ber in mung bean skin increased by 3.40%, and soluble dietary f ber increased by 13.62% after germination. Additionally, water-holding capacity, oil-holding capacity and swelling capacity signif cantly increased to (6.97 ± 0.32) g/g, (4.93 ± 0.10) g/g and (4.79 ± 0.11) mL/g, respectively. Cation exchange capacity slightly decreased to (0.47 ± 0.02) mmol/g. Glucose and cholesterol adsorption capacities rose to (8.37 ± 0.18) mmol/g, and (2.23 ± 0.11) mg/(mL·g), respectively. NO 2 -adsorption capacity declined to (3.92 ± 0.09) mg/g. The results of scanning electron microscope showed that the surface of dietary fiber in mung bean skin after germination showed more cavities and wrinkles, thereby improving its adsorption capacity. X-ray diffraction showed that the degree of crystallinity of dietary f ber in mung bean skin did not change after germination and the crystalline region and amorphous region were well reserved. Fourier transform infrared spectroscopy analysis indicated that the functional groups of dietary f ber in mung bean skin were not destroyed after germination. After germination, most functional properties of dietary f ber in mung bean skin were improved, and its structure was well retained, which is conducive to the development and utilization of mung bean by-products.
Key words:germination; mung bean; dietary f ber; structure; properties
DOI:10.7506/spkx1002-6630-201623019
中图分类号:TS214.9
文献标志码:A
文章编号:1002-6630(2016)23-0111-07
引文格式:
王大为, 赵鑫, 董欣, 等. 发芽对绿豆皮膳食纤维结构及性质的影响[J]. 食品科学, 2016, 37(23): 111-117. DOI:10.7506/ spkx1002-6630-201623019. http://www.spkx.net.cn
WANG Dawei, ZHAO Xin, DONG Xin, et al. Effect of germination on the structure and properties of dietary fiber in mung bean skin[J]. Food Science, 2016, 37(23): 111-117. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623019. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:吉林省重大科技攻关项目(2012ZDGG007);吉林省科技发展计划项目(20140520181JH)
作者简介:王大为(1960—),男,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com