弧菌外膜蛋白Ompk基因序列分析及其多克隆抗体的制备
丁承超,谢曼曼,曾海娟,刘 箐
*
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:弧菌外膜蛋白(outer membrane protein,OMP)OmpK不仅可激发机体的体液免疫和细胞免疫,而且可在不同血清型菌株之间产生免疫交叉反应。本研究利用克隆测序和查找GenBank获得20 株弧菌的Ompk基因序列并构建Ompk系统进化树,对比分析20 株弧菌Ompk基因序列;利用原核表达系统表达野生株Vibrio parahaemolyticus B的OmpK,纯化OmpK后制备兔多克隆抗体;采用酶联免疫吸附分析法和蛋白质印迹法(Western-blotting)分别检测抗体效价和特异性。系统进化树和基因序列比对结果显示Ompk基因在弧菌中高度保守,核苷酸序列相似性在77%以上;原核表达系统成功表达了弧菌OmpK,蛋白经纯化后成功制备的兔多抗效价达1∶16 000;Western-blotting实验证实抗体具有很好的特异性;OmpK多克隆抗体在弧菌中普遍存在免疫交叉性。因此,弧菌Ompk基因序列分析及其抗体研制,不仅为弧菌快速免疫学检测提供可能性,也为以OmpK为靶点的水产疫苗研制奠定了基础。
关键词:弧菌;Ompk;原核表达;纯化;多克隆抗体;免疫学检测
由弧菌属(Vibrio spp.)引起的弧菌病是水产动物中普遍流行且危害最大的细菌性疾病,鳗弧菌(Vibrio anguillarum)、副溶血性弧菌(Vibrio parahaemolyticus)等弧菌的危害每年给水产养殖业造成严重的经济损失
[1-2]。弧菌不仅是水产品细菌性疾病的最重要的病原菌之一,而且部分弧菌如副溶血性弧菌还是重要的食源性致病菌
[3-5]。第九版《伯杰氏细菌学手册》收录了35 种弧菌属细菌,我国已报道危害严重的弧菌有10余种。因此,弧菌病的有效预防和检测已成为我国水产品产业健康可持续发展的重要保障。
外膜蛋白(outer membrane protein,OMP)位于革兰氏阴性菌表面,呈β-桶状结构,其具有良好的免疫原性,不仅可激发机体体液免疫和细胞免疫,而且在不同弧菌及血清型菌株之间具有良好的免疫交叉保护作用,因而被国内外公认为是一种潜在的共同保护性抗原
[6-9]。近年来的研究也证实了病原细菌OMP在作为保护性抗原方面的作用:Li Chuchu等
[10]证实副溶血弧菌中的OMP VP0802氨基酸序列与其他弧菌具有70%左右的同源性,认为其是制备亚单位疫苗的良好候选材料;1995年Inoue等
[11-12]首次将在V. parahaemolyticus发现的一种分子质量约为28 kD的OMP命名为OmpK,该蛋白广泛存在于不同血清型的V. parahaemolyticus中;另外,Li Ningqiu等
[13-14]研究发现从哈维氏弧菌提取的OmpK与溶藻弧菌、副溶血弧菌OMP具有高度同源性,是弧菌疫苗中一种潜在的共同抗原。综合分析国内外研究发现,OmpK是一种潜在的弧菌共同抗原。以Ompk为抗原基因的弧菌渔用疫苗可能具有较高的免疫保护效率。在食品安全检测方面,OmpK抗体的制备对提高水产弧菌的快速检测具有重要意义,利用生物信息学技术和流式细胞术分析发现OmpK抗体能够识别弧菌中相同或相似的抗原表位,这为水产食品的安全检测奠定了良好基础
[15-16]。李雨辰等
[17]建立的OmpK免疫磁珠检测方法与显色平板法结合较传统的二次增菌法能够节省72 h,并且相比于常用的免疫学检测方法检测灵敏度可以提高两个数量级。因此,弧菌Ompk基因序列分析及其抗体研制,不仅为水产动物的免疫保护提高了新思路,也为实现试剂盒等快速检测技术检测水产品中弧菌提供了依据。
本研究根据测序和查找GenBank拟构建弧菌Ompk的分子进化树。根据所得进化树构建原核表达载体,利用镍柱对OmpK进行纯化,并用纯化得到的OmpK对新西兰白兔进行免疫,制备OmpK多克隆抗体。为水产品中弧菌检测产品如检测试剂盒、试纸条和蛋白芯片的开发和研制提供理论和实践基础。另外,以启动黏膜免疫系统为目标,以OmpK为弧菌共同抗原靶标,从疫苗载体和抗原高效递呈等入手,研发方便使用、高效保护的新型疫苗,为解决水产品弧菌污染提供新型生物制品。
1 材料与方法
1.1 材料与试剂
限制性内切酶、Taq DNA聚合酶、dNTPs、DNA Ladder Marker、T4 DNA连接酶和pMD19-T载体大连宝生物公司;实验引物、硫酸铵、His单克隆抗体、异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)和Ni-IDA亲和纯化柱 上海生工生物有限公司;3%碱性蛋白胨水、胰蛋白胨和酵母浸粉 北京陆桥技术有限责任公司;细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒和质粒抽提试剂盒杭州博日科技生物有限责任公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔二抗、弗氏佐剂 美国Sigma公司。
1.2 菌株、质粒与实验动物
水产品中分离出的17 株弧菌(表1)、大肠杆菌(E. coil)BL21和DH5a及pET-30(a)质粒由上海理工大学系统生物医学研究中心保存;2.5 kg雄性6 月龄新西兰白兔由第二军医大学实验动物中心提供。
表1 实验弧菌及其来源
Table 1 le 1 Vibrioibrio tested in this study
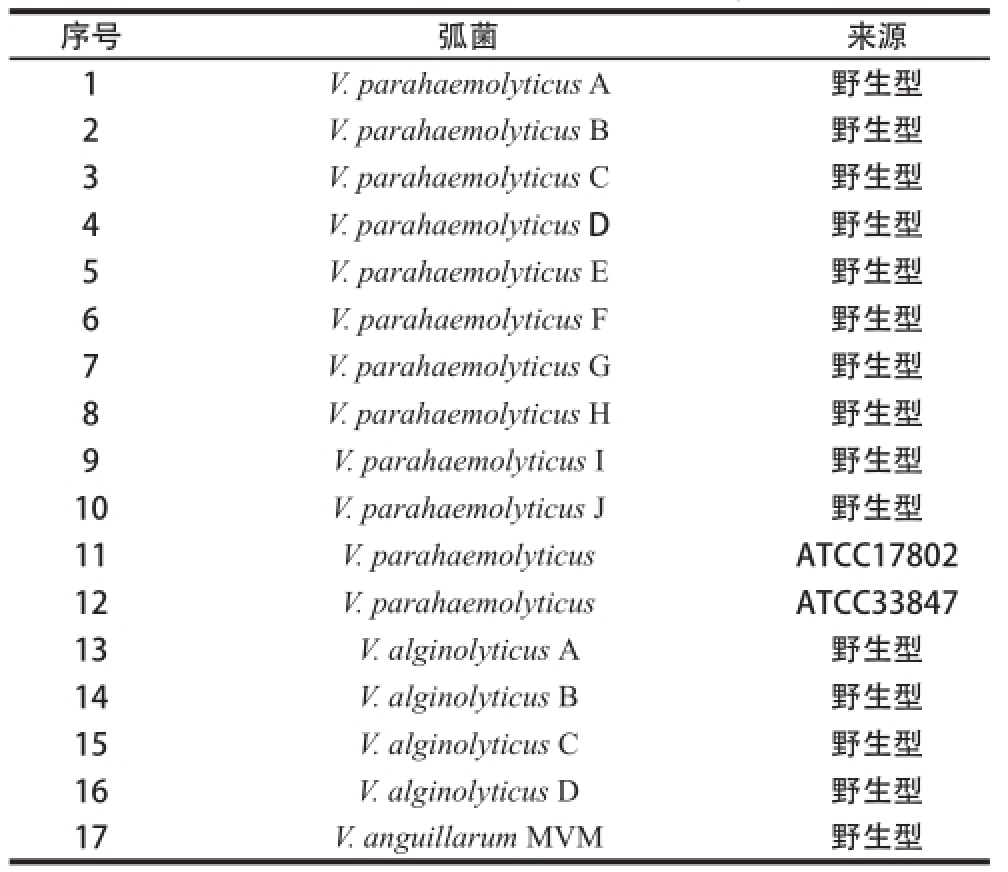
序号弧菌来源1 V. parahaemolyticus A野生型2 V. parahaemolyticus B野生型3 V. parahaemolyticus C野生型4 V. parahaemolyticus D野生型5 V. parahaemolyticus E野生型6 V. parahaemolyticus F野生型7 V. parahaemolyticus G野生型8 V. parahaemolyticus H野生型9 V. parahaemolyticus I野生型10V. parahaemolyticus J野生型11V. parahaemolyticusATCC17802 12V. parahaemolyticusATCC33847 13V. alginolyticus A野生型14V. alginolyticus B野生型15V. alginolyticus C野生型16V. alginolyticus D野生型17V. anguillarum MVM野生型
1.3 仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像仪 香港基因有限公司;SpectraMax M2酶标仪 美国Molecular Devices公司;Odyssey双色红外荧光成像系统 美国Li-Cor公司。
1.4 方法
1.4.1 系统进化树的构建及基因序列分析
利用细菌基因组DNA提取试剂盒提取17 株弧菌的DNA,根据美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)公布的副溶血弧菌的Ompk基因序列(GenBank登陆号:NC_004603.1)采用Primer 3设计Ompk测序引物:P1:5’-ATGCGTAAATCACTTTTAGC-3’;P2:5’-TTAGAACTTGTAAGTTACTGC-3’。利用引物扩增17 株弧菌的Ompk片段,PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35 个循环;72 ℃延伸7 min;4 ℃保存。PCR产物分别经1.5 g/100mL琼脂糖凝胶电泳,回收电泳产物后连接pMD19-T载体。将连接成功的产物送由上海华大基因科技有限公司测序,测序结果连同NCBI已知的3 株弧菌Ompk序列采用MEGA 6.0邻接(neighbor-joining,NJ)法构建系统进化树。利用TMHMM Server v. 2.0(http:// www.cbs.dtu.dk/services/TMHMM/)和SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对Ompk基因序列进行分析,进而分析OmpK具有的功能和性质。
1.4.2 原核表达重组质粒的构建
根据系统进化树亲缘关系选择V. parahaemolyticus B基因组作为模板,采用Primer 3设计Ompk的表达引物:P3:5’-ATTGGATCCATGCGTAAATCACTTTTAGC-3’;P4:5’-ATTAAGCTTTTAGAACTTGTAAGTTACTGC-3’(引物P3和P4中下划线部分分别为限制性内切酶BamH Ⅰ和Hind Ⅲ酶切位点)。使用BamH I和Hind Ⅲ同时对PCR产物和质粒pET-30(a)进行双酶切;T
4DNA连接酶连接双酶切后的产物,得到重组质粒;将获得的重组质粒导入DH5α中,使用PCR和双酶切(BamH Ⅰ和Hind Ⅲ)对扩增得到的重组质粒进行鉴定。鉴定为阳性的克隆送由上海华大基因科技有限公司测序,将测序正确的阳性克隆命名为pET-30(a)-Ompk。最后将重组质粒pET-30(a)-Ompk导入大肠杆菌表达菌株BL21中。
1.4.3 蛋白的诱导表达及纯化
取重组大肠杆菌BL21过夜培养,以1∶100(V/V)转接入新鲜LB培养基中,待OD
600
nm达到约0.6时,加入终浓度为0.3 mmol/L的IPTG,37 ℃培养约8 h后收集菌体
[18]。以无IPTG诱导组作为对照,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate polyacrylamide gel electrophoresis,SDS-PAGE)分别检测菌体上清和包涵体,确定蛋白在原核表达系统中的分子质量大小和分泌位置并利用Ni-IDA亲和纯化柱对蛋白进行纯化;利用His标签抗体蛋白质印迹法(Western-blotting)检测纯化后的蛋白,确定纯化的蛋白为原核表达带有His标签的OmpK。
1.4.4 多克隆抗体的制备
新西兰白兔免疫前耳部取血作为阴性对照血清,0.5 mL纯化后质量浓度为2 mg/mL的OmpK与等体积的弗氏完全佐剂混合乳化,颈背部皮下多点注射免疫新西兰白兔。首次免疫2 周后进行第2次免疫;第2次免疫2 周后进行第3次免疫;第3次免疫1 周后进行第4次加强免疫。首次免疫佐剂采用弗氏完全佐剂,后续免疫均采用弗氏不完全佐剂。最后一次免疫3 d后心脏采血,室温放置1 h待血清凝固后置于4 ℃冰箱,过夜析出血清后2 500 r/min离心15 min分离血清。分离后的血清经33 g/100 mL的硫酸铵沉淀,12 000 r/min离心30 min后获得的沉淀即为OmpK兔多克隆抗体,最后将抗体置于-80 ℃冰箱中保存。
1.4.5 多克隆抗体效价检测
将纯化后的OmpK稀释至20 μg/mL,100 μL/孔加入96 孔板中,37 ℃孵育2 h;加入200 μL封闭液,37 ℃孵育2 h;加入100 μL不同稀释倍数的OmpK多克隆抗体,37 ℃孵育1 h,免疫之前兔血清作为阴性对照;洗涤后加入100 μL HRP标记羊抗兔二抗(pH 7.4、0.01 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)1∶10 000(V/V)稀释),37 ℃孵育1 h;洗涤后加入100 μL显色液,37 ℃避光显色15 min;加入50 μL终止液后测定450 nm波长处光密度值
[19]。
1.4.6 多克隆抗体免疫学识别能力验证
纯化后的蛋白样品处理后SDS-PAGE电泳,转硝酸纤维素膜(nitrocellulose filter membrane,N C膜)后加入O m p K多克隆抗体(分别用p H 7.4、0.01mol/L PBS以体积比1∶1 000、1∶2 000、1∶4 0 0 0稀释),阴性对照为免疫前兔血清(用pH 7.4、0.01 mol/L PBS 1∶1 000(V/V)稀释),4 ℃过夜振荡。洗涤后加入HRP标记山羊抗兔二抗(用pH 7.4、0.01 mol/L PBS 1∶10 000(V/V)稀释),37 ℃避光振荡1 h,最后使用双色红外荧光成像系统扫描NC膜,通过显色条带的对比确定OmpK抗体的特异性。
1.4.7 多克隆抗体交叉反应筛查
包被过夜培养后灭活的17 株弧菌,将OmpK多克隆抗体用pH 7.4、0.01 mol/L PBS 1∶500(V/V)稀释,阴性血清(用pH 7.4、0.01 mol/L PBS 1∶500(V/V)稀释)作对照。利用间接酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)法检测抗体与弧菌之间的免疫交叉反应。
1.5 数据分析方法
实验数据用Microsoft Excel与SPSS软件处理。
2 结果与分析
2.1 系统进化树构建及基因序列分析
由20 株弧菌Ompk基因构建的NJ系统进化树如图1所示。经分析Ompk基因在弧菌属中高度保守,核苷酸序列相似性在77%以上,V. parahaemolyticus间核苷酸序列相似性在84%以上(表2)。进化树上游弧菌V. parahaemolyticus B与其他弧菌亲缘关系较近,因此以V. parahaemolyticus B的Ompk基因序列为研究对象。其氨基酸序列经TMHMM Server v. 2.0和SignalP 4.1 Server软件分析发现,序列前1~20个氨基酸为OmpK分泌信号肽(图2方框内),跨膜分析推测V. parahaemolyticus B的OmpK整体在细胞膜外,证实OmpK确是一种弧菌OMP。

图1 基于Ompk基因序列构建弧菌NNJJ进化树
Fig. 1 NJ phylogenetic tree based on Ompk sequence in Vibrio
表2 20 株弧菌OOmmppkk的对比分析
Table 2 Comparative analysis ofOOmmppkk among 2200 Viibbrriioo straaiinnss
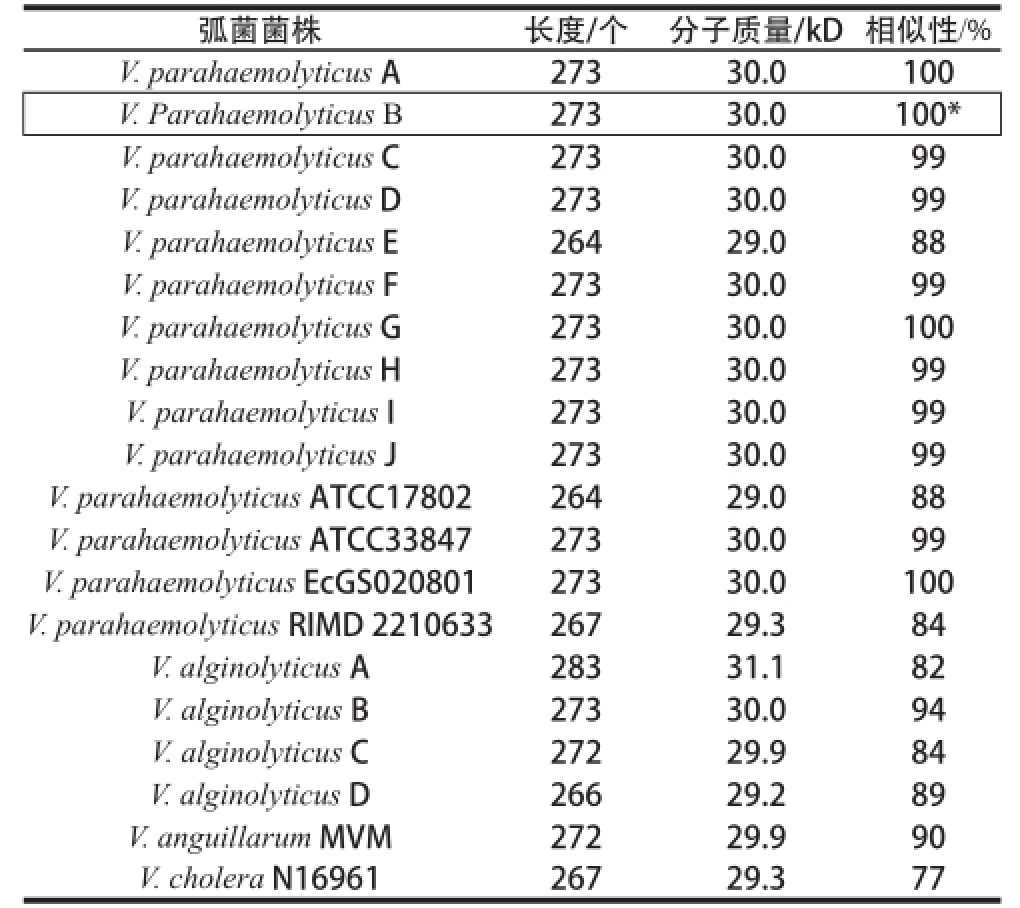
注:*.相似性结果为各弧菌菌株Ompk的氨基酸序列与V. parahaemolyticus B的Ompk氨基酸序列对比所得。
弧菌菌株长度/个分子质量/kD相似性/% V. parahaemolyticus A27330.0100 V. Parahaemolyticus B27330.0100
*V. parahaemolyticus C27330.099 V. parahaemolyticus D27330.099 V. parahaemolyticus E26429.088 V. parahaemolyticus F27330.099 V. parahaemolyticus G27330.0100 V. parahaemolyticus H27330.099 V. parahaemolyticus I27330.099 V. parahaemolyticus J27330.099 V. parahaemolyticus ATCC1780226429.088 V. parahaemolyticus ATCC3384727330.099 V. parahaemolyticus EcGS02080127330.0100 V. parahaemolyticus RIMD 221063326729.384 V. alginolyticus A28331.182 V. alginolyticus B27330.094 V. alginolyticus C27229.984 V. alginolyticus D26629.289 V. anguillarum MVM27229.990 V. cholera N1696126729.377
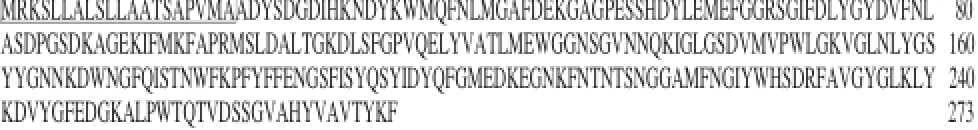
图2 V. parahaemolytiiccuuss B OmpK氨基酸序列
Fig. 2 Amino acid sequence of OmpK in V. parahaemolyticus B
2.2 原核表达重组质粒的构建
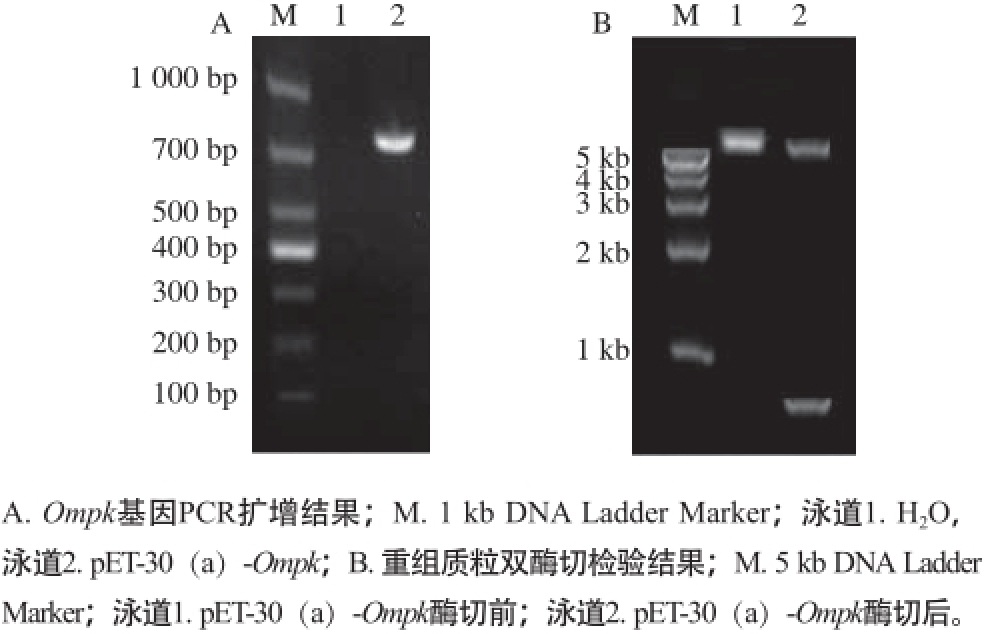
图3 重组质粒pET-30(aa)--OOmmppkk鉴定结果
Fig. 3 Identification of recombinant plasmid pET-30(a)-Ompk
以V. parahaemolyticus B基因组DNA为模板,进行Ompk基因的PCR扩增,泳道2获得一段分子质量约800 bp的片段(图3A);将PCR产物与质粒pET-30(a)双酶切后通过T4 DNA连接酶连接;连接产物导入大肠杆菌DH5α菌株;提取重组质粒,使用BamH I和Hind Ⅲ对扩增得到的重组质粒进行双酶切鉴定,泳道2分别获得分子质量约800 bp和5 kb的2 个片段(图3B)。质粒测序结果证实pET-30(a)连接片段与之前的pMD19-T载体连接片段的基因序列相同。
2.3 蛋白的诱导表达及纯化

图4 4 OmpKOmpK在BL21菌株中的表达
Fig. 4 Expression of OmpKOmpK in BL21
将测序正确的重组质粒pET-30(a)-Ompk导入大肠杆菌表达菌株BL21中,SDS-PAGE电泳分别检测IPTG诱导组和无IPTG诱导组的菌体上清液和包涵体,确定诱导蛋白的大小和在菌体中的分泌位置。结果如图4所示,泳道2在35 kD位置有明显的诱导蛋白产生,包括Ompk编码约30 kD和质粒pET-30(a)自带标签蛋白约5 kD;另外,诱导的蛋白在BL21菌株中形成包涵体。利用Ni-IDA亲和纯化柱对OmpK蛋白进行纯化(图5A),泳道2为纯化蛋白。使用His标签抗体Western-blotting检测纯化后的蛋白(图5B),泳道2在35 kD位置有明显的蛋白条带,证明该蛋白确为原核表达带有His标签的OmpK蛋白。

图5 SDS-PAGE和Western-blotting检测OmpK纯化结果
Fig. 5 OmpK tested by SDS-PAGE and western-blotting
2.4 多克隆抗体效价的检测
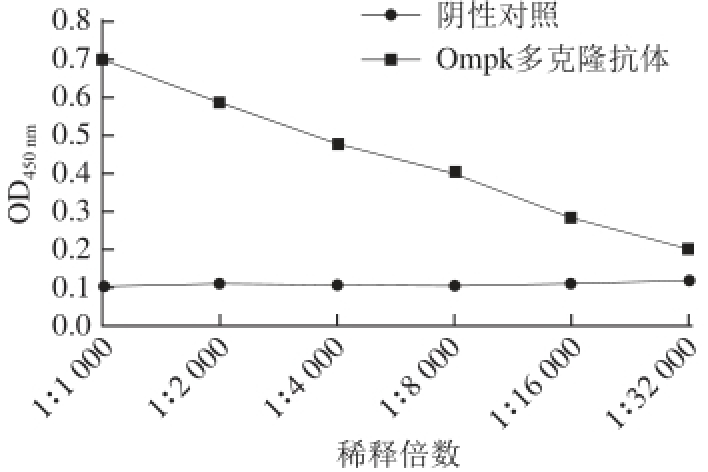
图6 OmpK多克隆抗体效价
Fig. 6 Polyclonal antibody titer of OmpK tested by ELISA
由图6可知,免疫获得的OmpK多克隆抗体经间接EILSA法测定,450 nm波长处光密度值大于阴性对照2.1倍确定为最终效价,因此其抗体效价可以达到1∶16 000。
2.5 多克隆抗体免疫学识别能力验证
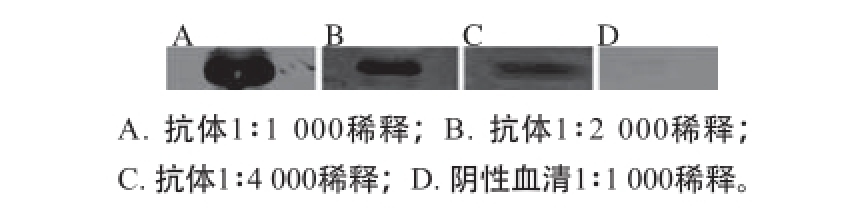
图7 Western-blotting检测OmpK多克隆抗体特异性
Fig. 7 Polyclonal antibody specificity of OmpK tested by western-blotting
采用Western-blotting技术检测由V. parahaemolyticus B制备的OmpK多克隆抗体特异性。发现不同稀释梯度均出现明显的条带(图7A、B、C),免疫之前阴性血清(图7D)无对应条带,表明制备的OmpK多克隆抗体可与OmpK蛋白特异性结合,成功制备了OmpK兔多克隆抗体。
2.6 多克隆抗体交叉反应筛查
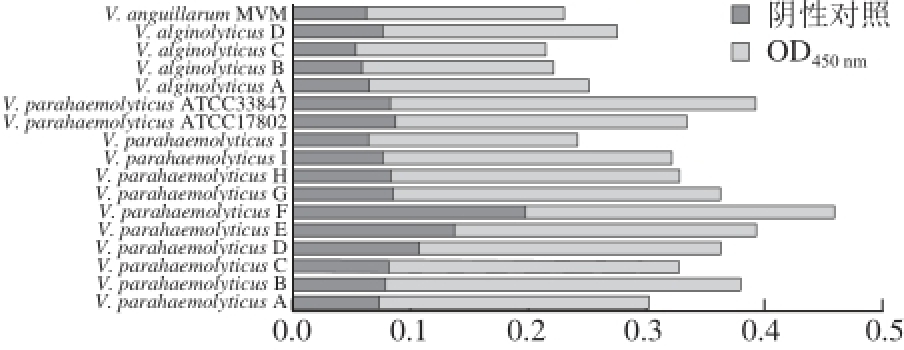
图8 OmpK多克隆抗体在弧菌中的免疫交叉性
Fig. 8 Immune cross-reactivity of OmpK polyclonal antibody in Vibrio
经间接ELISA法测定OD
450
nm值得到17 株实验室保藏弧菌的效价均在阴性对照血清效价的2.1 倍以上,即由V. parahaemolyticus B制备的OmpK多克隆抗体与17 株弧菌存在不同程度交叉(图8)。另外,抗体在V. parahaemolyticus中的免疫交叉反应强于在V. alginolyticus和V. anguillarum,测得的交叉性与Ompk分子的系统进化树(图1)亲缘关系基本一致。
3 讨 论
弧菌长期以来给水产养殖业带来巨大损失,抗生素是水产养殖中防范弧菌的最主要手段,但随着抗生素滥用导致细菌抗药性、抗生素残留、水体污染等问题的日益突出,寻求新的弧菌控制方法已成产业、学术界的共识
[20-21]。而以OmpK为抗原靶标的新型免疫制剂如OmpK亚单位疫苗等有望成为预防弧菌危害的另一有效手段。伦镜盛等
[22]研究发现在弧菌的OmpK氨基酸序列中存在8 个高度保守的抗原表位,包括7 个T细胞抗原以及1 个T细胞和B细胞共有的抗原表位。这些抗原表位中的一个或多个可能位于细菌表面,而使抗血清中的OmpK抗体能够识别这些相同或相似的抗原表位。因此,以OmpK为抗原靶标的OmpK亚单位疫苗在弧菌预防方面具有很大潜力。郑磊等
[23]使用胶囊材料包裹副溶血弧菌融合蛋白FlaA-OmpK制成的肠溶口服疫苗的免疫保护效果可达到50%。
在食品安全方面,弧菌常存在于海产品及高盐食品中,可引起急性肠胃炎,严重时会导致败血病
[24],由于弧菌引起的食品安全事故层出不穷,研究其快速、准确的检测方法,为食品企业和监督部门提供技术支撑是控制该菌污染的主要手段。目前,副溶血性弧菌检测的方法主要仍以生化反应为基础的国家标准方法为主,该方法准确但耗时较长。近年来,分子生物学方法如定性、定量PCR等在检测周期、特异性、准确性等方面显示出一定的优势,但由于对设备、实验环境、技术人员要求较高,因此较难在大多数中小食品企业推广使用。综上所述,以OmpK抗体研发的快速检测技术在检测弧菌方面具有时间快、覆盖范围广、操作简便等优势。
本研究通过构建弧菌Ompk分子系统进化树发现Ompk序列在弧菌中高度保守,其核苷酸序列的相似性在77%以上,在副溶血弧菌间更是高达88%以上,这些相似性是决定OmpK在弧菌间具有很强免疫交叉的分子基础。通过对氨基酸序列的分析发现,OmpK分子自带分泌信号肽。Mao Zhijuan等
[25]成功在毕赤酵母(Pichia pastoris)表达了哈维氏弧菌的OmpK。这些研究证实OmpK分子与相应的表达载体结合可以有效将OmpK分子递呈至载体表面,为弧菌疫苗的开发和研制提供了新思路。本研究利用纯化后OmpK蛋白制得的多克隆抗体效价可达1∶16 000,加之OmpK在弧菌间具有较强的免疫交叉性。因此,以OmpK抗体研发的快速检测工具如免疫层析试纸、试剂盒等可以在保证较高灵敏度的同时检测多种弧菌,而以OmpK分子为抗原靶标制得的抗体有望在水产品检测领域发挥重要作用。
参考文献:
[1] ALEJANDRO G M, ANTONIO L L, RAFAEL R S, et al. Presence of pathogenic Vibrio species in fresh mussels harvested in the southern Rias of Galicia (NW Spain)[J]. Food Control, 2016, 59(1): 759-765. DOI:10.1016/j.foodcont.2015.06.054.
[2] PANG H Y, CHEN L M, HOARE R, et al. Identification of DLD, by immunoproteomic analysis and evaluation as a potential vaccine antigen against three Vibrio species in Epinephelus coioides[J]. Vaccine, 2016, 34(9): 1225-1231. DOI:10.1016/j.vaccine.2015.11.001.
[3] LIU Y Y, ZHANG Z H, WANG Y L, et al. A highly sensitive and flexible magnetic nanoprobe labeled immunochromatographic assay platform for pathogen Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2015, 211(1): 109-116. DOI:10.1016/ j.ijfoodmicro.2015.07.005.
[4] FRANCESCA L, GIULIA T, LAURA M, et al. Trh (tdh-/trh+) gene analysis of clinical, environmental and food isolates of Vibrio parahaemolyticus as a tool for investigating pathogenicity[J]. International Journal of Food Microbiology, 2016, 225(2): 43-53. DOI:10.1016/j.ijfoodmicro.2016.02.016.
[5] RAHAMAN M M, KABIR J I, MINHUI K, et al. Variability in biof lm formation correlates with hydrophobicity and quorum sensing among Vibrio parahaemolyticus isolates from food contact surfaces and the distribution of the genes involved in biof lm formation[J]. Biofouling, 2016, 32(4): 497-509. DOI:10.1080/08927014.2016.1149571.
[6] RAJANJ J, SANTIAGO T C, SINGARAVEL R, et al. Outer membrane protein C (OmpC) of Escherichia coli induces neurodegeneration in mice by acting as an amyloid[J]. Biotechnology Letters, 2016, 38(4): 689-700. DOI:10.1007/s10529-015-2025-8.
[7] RANA A, AKHTER Y. A multi-subunit based, thermodynamically stable model vaccine using combined immunoinformatics and protein structure based approach[J]. Immunobiology, 2016, 221(4): 544-557. DOI:10.1016/j.imbio.2015.12.004.
[8] PEDERSEN P L, KO Y H. The outer mitochondrial membrane, a smooth ‘coat’ with many holes and many roles: preparation, protein components, interactions with other membranes, involvement in health, disease, and as a drug target[J]. Molecular Cell Biology, 2016, 1(1): 237-243. DOI:10.1016/B978-0-12-394447-4.10029-X.
[9] LINDSAY M M, DAVID J B, SHEENA E R. Mechanistic studies of the biogenesis and folding of outer membrane proteins in vitro and in vivo: what have we learned to date?[J]. Archives of Biochemistry and Biophysics, 2014, 564(15): 265-280. DOI:10.1016/j.abb.2014.02.011.
[10] LI C C, YE Z C, WEN L G, et al. Identification of a novel vaccine candidate by immunogenic screening of Vibrio parahaemolyticus outer membrane protein[J]. Vaccine, 2014, 32(46): 6115-6121. DOI:10.1016/j.vaccine.2014.08.077.
[11] INOUE T, MATSUZAKI S, TANAKA S. A 26-kDa outer membrane protein, OmpK, common to Vibrio species is the receptor for a broadhost-range vibriophage, KVP40[J]. Fems Microbiology Letters, 1995, 125(1): 101-105. DOI:10.1016/0378-1097(94)00480-F.
[12] INOUE T, MATSUZAKI S, TANAKA S. Cloning and sequence analysis of Vibrio parahaemolyticus ompK gene encoding a 26-kDa outermembrane protein, OmpK, that serves as receptor for a broadhost-range vibriophage, KVP40[J]. FEMS Microbiology Letters, 1995, 134(2/3): 245-249.
[13] LI N Q, BAI J J, WU S Q, et al. An outer membrane protein, OmpK, is an effective vaccine candidate for Vibrio harveyi in Orange-spotted grouper (Epinephelus coioides)[J]. Fish and Shellfish Immunology, 2008, 25(6): 829-833. DOI:10.1016/j.fsi.2008.09.007.
[14] LI N Q, YANG Z H, BAI J J, et al. A shared antigen among Vibrio species: outer membrane protein-OmpK as a versatile Vibriosis vaccine candidate in Orange-spotted grouper (Epinephelus coioides)[J]. Fish and Shellf sh Immunology, 2010, 28(5/6): 952-956. DOI:10.1016/ j.fsi.2010.02.010.
[15] MAO Z J, YU L, YOU Z Q, et al. Cloning, expression and immunogenicty analysis of five outer membrane proteins of Vibrio parahaemolyticus zj2003[J]. Fish and Shellfish Immunology, 2007, 23(3): 567-575. DOI:10.1016/j.fsi.2007.01.004.
[16] 杨智慧, 李宁求, 白俊杰, 等. 19 株海水鱼致病性弧菌OmpK基因序列及其抗原性分析[J]. 中国水产科学, 2006, 13(5): 807-813. DOI:1005 -8737 -(2006)05 -0807-07.
[17] 李雨辰, 闻一鸣, 童吉宇, 等. 副溶血弧菌外膜蛋白OmpK免疫磁珠检测方法的建立[J]. 生物技术通报, 2013, 1(6): 209-214. DOI:10.13560/j.cnki.biotech.bull.1985.2013.06.018.
[18] 陈春琳, 刘祥, 俱雄. 溶藻弧菌外膜蛋白OmpK的原核表达及多克隆抗体制备[J]. 西北农林科技大学学报(自然科学版), 2015, 43(7): 1-8. DOI:10.13207/j.cnki.jnwafu.2015.07.022.
[19] 李明云, 丁文, 陈炯, 等. 溶藻弧菌外膜蛋白OmpK基因表达和间接ELISA检测方法的初步建立[J]. 水产学报, 2010, 34(10): 1559-1565. DOI:10.3724/SP.J.1231.2010.07005.
[20] LIU X H, ZHANG H, GAO Y, et al. Efficacy of chitosan oligosaccharide as aquatic adjuvant administrated with a formalininactivated Vibrio anguillarum vaccine[J]. Fish and Shellfish Immunology, 2015, 47(2): 855-860. DOI:10.1016/j.fsi.2015.10.012.
[21] CHU T, GUAN L G, SHANG P F, et al. A controllable bacterial lysis system to enhance biological safety of live attenuated Vibrio anguillarum vaccine[J]. Fish and Shellf sh Immunology, 2015, 45(2): 742-749. DOI:10.1016/j.fsi.2015.05.030.
[22] 伦镜盛, 袁传飞, 夏常艳, 等. 弧菌外膜蛋白OmpK免疫交叉反应性的分析[J]. 汕头大学学报, 2013, 28(3): 52-63.
[23] 郑磊, 郭养浩, 马振宁, 等. 副溶血弧菌融合蛋白FlaA-OmpK疫苗的制备及免疫保护作用[J]. 中国水产科学, 2012, 19(5): 848-853. DOI:10.3724/S P.J.1118.2012.00848.
[24] REGINE H S, OSCARINA V S, RENATA A C, et al. Raw oysters can be a risk for infections[J]. The Brazilian Journal of Infectious Diseases, 2010, 14(1): 66-70. DOI:10.1016/S1413-8670(10)70013-1.
[25] MAO Z J, HE C J, QIU Y J, et al. Expression of Vibrio harveyi OmpK in the yeast Pichia pastoris: the f rst step in developing an oral vaccine against vibriosis?[J]. Aquaculture, 2011, 318(3/4): 268-272. DOI:10.1016/j.aquaculture.2011.05.047.
Gene Sequence Analysis and Polyclonal Antibody Preparation of Outer Membrane Protein, Ompk, in Vibrio
DING Chengchao, XIE Manman, ZENG Haijuan, LIU Qing
*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Outer membrane protein (OmpK) in Vibrio not only can stimulate humoral immunity and cellular immunity in the body, but also can produce immu ne cross-reaction among strains of different serotypes. In this paper, cloning of sequences and comparison with Genebank sequences were carried out to build Ompk phylogenetic trees of 20 Vibrio strains. A prokaryotic expression system was used to express the OmpK of Vibrio parahaemolyticus B, and rabbit polyclonal antibody was prepared after OmpK was purif ed and used to immunize rabbits. Antibody titer and specif city were detected by enzyme linked immunosorbent assay (ELISA) and Western-blotting. Phylogenetic tree and gene sequence alignment results showed that the Ompk gene was highly conservative in Vibrio and the similarity of nucleotide sequences was approximately 77%. OmpK was successfully expressed in the prokaryotic expression system and rabbit polyclonal antibody was successfully induced by immunization with the purif ed protein with a titer of 1:16 000 as detected by ELISA. Western-blotting results conf rmed that the antibody had good specif city. Vibrio Ompk gene sequence analysis and anti-Vibrio antibody preparation will provide a theoretical basis for rapid and high-throughput detection of Vibrio in aquatic products..
Key words:Vibrio; Ompk; prokaryotic expression; purif cation; polyclonal antibody; immunological detection
DOI:10.7506/spkx1002-6630-201623024
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)23-0141-06
引文格式:
丁承超, 谢曼曼, 曾海娟, 等. 弧菌外膜蛋白Ompk基因序列分析及其多克隆抗体的制备[J]. 食品科学, 2016, 37(23): 141-146. DOI:10.7506/spkx1002-6630-201623024. http://www.spkx.net.cn
DING Chengchao, XIE Manman, ZENG Haijuan, et al. Gene sequence analysis and polyclonal antibody preparation of outer membrane protein, Ompk, in Vibrio[J]. Food Science, 2016, 37(23): 141-146. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623024. http://www.spkx.net.cn
收稿日期:2016-03-02
基金项目:国家自然科学基金面上项目(31371776);“科技创新行动计划”长三角科技联合攻关领域项目(15395810900);上海市研究生教育创新计划项目
作者简介:丁承超(1992—),男,博士研究生,研究方向为病原微生物疫苗。E-mail:ding10118026@163.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理及控制。E-mail:liuq@usst.edu.cn








