 表示,并进行单因素方差分析,最小显著性差异法(least significant difference,LSD)两两比较,P<0.05为差异具有统计学意义。
表示,并进行单因素方差分析,最小显著性差异法(least significant difference,LSD)两两比较,P<0.05为差异具有统计学意义。
贾 彦,李毛毛,陈 蕊,江 岩,明 珠,赵 培,庞广昌,阎亚丽 *,陈庆森 *
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:制备5 种不同质量浓度的杜仲水提液添加到MRS培养基中对嗜酸乳杆菌(Lactobacillus acidophilus)CICC6005进行培养,旨在探究不同质量浓度的杜仲水提液对L. acidophilus CICC6005增殖情况及对发酵过程中胞外和胞内蛋白含量变化的影响,并对其蛋白组分进行分析。发酵所得胞外和胞内蛋白分别用三氯乙酸-丙酮沉淀法和试剂盒法获得,采用Sephadex G-100凝胶层析分离技术对胞外和胞内蛋白分离纯化,用二喹啉甲酸法和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分别测得各组分蛋白的含量及分子质量。结果显示:当培养基中添加的杜仲水提液质量浓度为0.125 0 g/mL时,对菌体增殖有明显的促进作用,菌体生物量最大(4.38×10 8CFU/mL),同时在此质量浓度时菌体胞外和胞内蛋白含量也达到最大值;胞外和胞内蛋白经过Sephadex G-100凝胶层析分离后均得到2 个明显的蛋白峰,胞外蛋白两组分分子质量分别为67、31 ku,胞内蛋白两组分分子质量分别为57、17 ku。综上,添加适宜质量浓度的杜仲水提液对L. acidophilus CICC6005的增殖起到了一定的促进作用,并对其发酵产物组成产生了一定的影响。
关键词:杜仲;嗜酸乳杆菌CICC6005;增殖;胞外蛋白;胞内蛋白
杜仲属多年生落叶乔木,是我国特有的名贵经济树种。传统中医学中主要以杜仲树皮入药,《神农本草经》中记载其药用功效为“主治腰膝痛,补中益精气” [1]。其有效成分主要有木脂素类、环烯醚萜类、苯丙素类、黄酮类、多糖类和氨基酸等,此外还含有丰富的Ca、Fe等无机元素和Be、Se等微量元素 [2]。研究发现杜仲还具有降血压、降血脂、降血糖、抗肿瘤、抗炎、抗氧化、保肝护肾、抗骨质疏松、镇静、减肥等药理作用 [3]。现代研究表明 [4-5],杜仲皮中含有的绿原酸、有机酸、糖肽类等活性物质具有明显的抑菌作用。还有研究发现,杜仲树皮总黄酮能促进体外培养成骨细胞的增殖,并且能抑制人肺腺癌细胞H1299的增殖 [6-9]。
人体肠道内栖生着大量的微生物,在漫长的进化过程中,人类与这些微生物协同进化形成互惠互利的共生复合体,它们的存在与人体健康息息相关。2016年5月,鉴于微生物组对人类与环境健康的重要性,美国推出了重大国家级大型科研计划“国家微生物组计划”,重点回答什么是健康的微生物组。目前人们知晓的肠道有益菌中,乳杆菌为优势菌群,其属、种可黏附于肠上皮细胞发挥着免疫应答、抑制有害菌、抵御炎症等重要作用。嗜乳酸杆菌(Lactobacillus Acidophilus)CICC6005是兼性厌氧菌,属于乳杆菌科中的乳杆菌属,是人体肠道中重要的益生菌之一,具有抑制致病菌、增强免疫调节作用、防止癌症发生和发展、缓解乳糖不耐症等对健康有益功效 [10-12]。随着人们对肠道健康保健意识的增长,以及食品工业对益生菌的需求,近年来许多研究对提高益生菌增殖问题进行了报道,其中一些开展了中药材对益生菌增殖作用的探索。李平兰等 [13]以加入五味子、枸杞、地黄水提液的培养基来培养乳酸菌,结果证明3 种中药的水提液对乳酸菌的增殖有一定促进作用。刘阳等 [14]研究表明一定浓度的黄芪水提液对乳酸菌的生长能起到促生作用。张庆庆等 [15]研究了黄芪对嗜酸乳杆菌生长量的影响,并确定了最佳的黄芪水提液浓度。舒国伟等 [16]初步分析了中药提取物对益生菌的增菌机理,揭示益生菌分泌的一些酶将中药中的某些成分分解或转化为可利用的物质,从而促进自身生长。目前,国内外有关我国传统医药宝库中药材对益生菌的促生作用的研究较少,关于中药杜仲对L. acidophilus的促生作用未见报道。本实验以市售杜仲树皮为原料,制备其水提液添加到培养基中,探讨不同质量浓度的杜仲水提液对L. acidophilus CICC6005体外生长情况的影响,进而确定杜仲对其有促生作用。这对于服用杜仲增加肠道内益生菌的定殖数量、促进机体健康,以及体外扩大益生菌的产量都具有重要的意义。此外,本研究还对L. acidophilus CICC6005发酵产物,即胞外、胞内蛋白进行了分离分析,以期为后续探究其发酵产物的益生功能奠定基础。
1.1 材料与试剂
杜仲 市售; L. acidophilus CICC6005 中国工业微生物菌种保藏中心。
MRS肉汤培养基、琼脂粉 北京奥博星生物技术有限公司。
三氯乙酸(trichloroacetic acid,TCA) 天津市福晨化学试剂厂;丙酮 天津市科密欧化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上海威奥科技有限公司;四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED) 碧云天生物技术研究所;葡聚糖凝胶Sephadex G-100、30%丙烯酰胺、1.0 mol/L Tris-HCl 北京索莱宝科技有限公司;过硫酸铵 天津市风船化学试剂科技有限公司;考马斯亮蓝R-250 美国Sigma公司;细菌总蛋白抽提试剂盒 上海生工生物工程股份有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒 北京康为世纪生物科技有限公司。
1.2 仪器与设备
紫外分光光度计 北京普析通用仪器有限责任公司;SPX-250BS-Ⅱ生化培养箱 上海新苗医疗器械制造有限公司;Multiskan MK3酶标仪 美国Thermo公司;DYCZ-24DN迷你双垂直电泳槽 北京六一仪器厂;HD-5电脑紫外检测仪、BT-100恒流泵 上海沪西分析仪器有限公司。
1.3 方法
1.3.1 杜仲水提液的制备
称取100 g杜仲皮,加入800 mL蒸馏水浸泡16 h,将浸泡液煮至沸腾,煎煮30 min,过滤,保留滤液;残渣用3~5 倍蒸馏水再次煎煮30 min,再次过滤,保留滤液;残渣用2 倍蒸馏水煎煮20 min,合并滤液,将其继续加热浓缩至0.5 g/mL(即100 g杜仲/200 mL水),115 ℃条件下灭菌15 min,4 ℃冰箱保存备用。用糖量计测定水提液的水溶物质量分数为1.7%。
1.3.2 基础培养基和L. acidophilus CICC6005种子液的制备
以MRS肉汤培养基作为基础培养基,称取一定质量的基础培养基粉末,按比例加入蒸馏水,加热溶解均匀,并调节其pH值为6.2。
将冻存的L. acidophilus CICC6005菌种于固体斜面培养基上活化24~36 h,再转接入MRS肉汤培养基中活化24 h,以此作为种子液。
1.3.3 杜仲水提液对L. acidophilus CICC6005生物量的影响
通过预实验,将杜仲水提液稀释为5 个不同的质量浓度,即0.250 0、0.167 0、0.125 0、0.100 0、0.062 5 g/mL,分别取2 mL逐个加入48 mL MRS液体培养基中,另取2 mL蒸馏水添加到48 mL MRS液体培养基中作为对照组,以上6 组分别做3 个平行,121 ℃条件下灭菌15 min,按1%接种量接入L. acidophilus CICC6005,在37 ℃条件下培养24 h后,在600 nm波长处测定各组发酵液的光密度(OD)值,并通过平板计数法检测各组发酵液中的活菌数。
1.3.4 生物量随培养时间变化的进程曲线
在MRS液体培养基中添加体积分数4%的最适质量浓度的杜仲药液,以未添加杜仲药液的MRS液体培养基为对照,接种量1%,在37 ℃条件下培养36 h,每隔3 h取样测定发酵液OD 600 nm,每个时间点重复3 次,求平均值并绘制两组发酵液中L. acidophilus CICC6005在0~36 h的生长曲线。
1.3.5 L. acidophilus CICC6005胞外和胞内蛋白的提取及定量测定
将以上各组发酵液于4 ℃条件下8 000 r/min离心5 min,分离上清液和菌体。收集移出的上清液并于4 ℃条件下保存。沉淀的菌体用2 mL预冷的0.01 mol/L磷酸盐缓冲溶液(phosphate buffer saline,PBS)振荡洗涤,离心除去上清液,-20 ℃条件下冻存。
采用TCA-丙酮沉淀法浓缩胞外蛋白 [17-18]。上清液与TCA以体积比4∶1混合,4 ℃条件下处理60 min,4 ℃条件下14 000 r/min离心20 min,弃去上清液。用预冷丙酮溶液反复洗去蛋白沉淀中的TCA,4 ℃条件下14 000 r/min离心5 min,弃上清液,待丙酮挥发完全,用0.01 mol/L PBS溶解沉淀,于-20 ℃条件下存放。
取出冻存的菌体,按《细菌总蛋白提取试剂盒说明书》提取菌体胞内蛋白,并将提取的蛋白溶液存放于-20 ℃条件下。
L. acidophilus CICC6005胞外和胞内蛋白质量浓度均采用BCA试剂盒进行定量;通过绘制出标准曲线,得到回归方程为y=0.000 1x+0.082 5(R 2=0.990 6)。
1.3.6 L. acidophilus CICC6005胞内和胞外蛋白的纯化
将Sephadex G-100凝胶柱(1.6 cm×100 cm)用0.05 mol/L pH 7.4 PBS平衡后,取胞外或胞内蛋白2 mL进行上样,然后用PBS以1 mL/min的流速进行洗脱,用紫外检测仪在280 nm波长处检测,并用核酸、蛋白检测系统收集信号,收集各峰组分;用PEG10000包埋浓缩;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)检测。
1.3.7 SDS-PAGE
上样前用4×蛋白电泳上样缓冲液与蛋白样品混匀,煮沸5~10 min,采用10%的分离胶进行变性电泳,考马斯亮蓝染液染色2~3 h后脱色过夜,对凝胶拍照进行后续分析。
1.4 数据统计分析
所有数据均做平行实验,采用SPSS 16.0统计软件对结果进行分析,各组数据结果以
 表示,并进行单因素方差分析,最小显著性差异法(least significant difference,LSD)两两比较,P<0.05为差异具有统计学意义。
表示,并进行单因素方差分析,最小显著性差异法(least significant difference,LSD)两两比较,P<0.05为差异具有统计学意义。
2.1 不同质量浓度的杜仲水提液对L. acidophilus CICC6005增殖的影响
按照1.3.3节方法,将不同质量浓度的杜仲水提液添加到MRS液体培养基中培养L. acidophilus CICC6005。通过紫外分光光度计测定各组发酵液的OD值,通过平板计数法检测其活菌数,分析L. acidophilus CICC6005在各组培养基中的增殖情况,结果如图1所示。
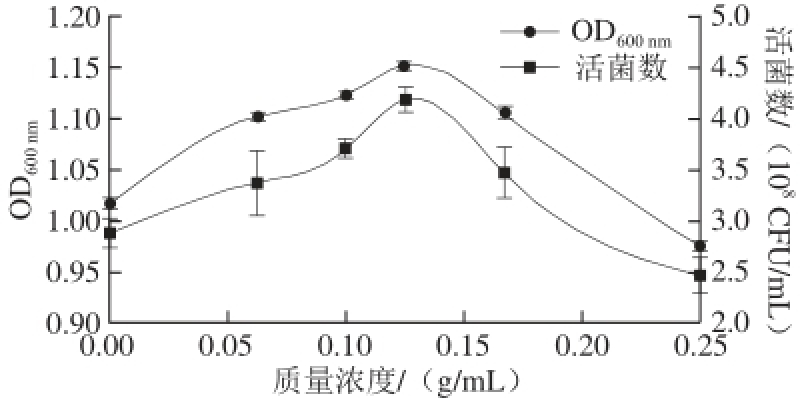
图1 不同质量浓度杜仲水提液对L. acidophiilluuss CICC6005生物量的影响
Fig. 1 Effect of Eucommia ulmoides Oliv. bark aqueous extract at different concentrations on L. acidophilus CICC6005 biomass
由图1可知,菌液的OD值与活菌数随杜仲水提液质量浓度变化趋势相似。当培养基中添加质量浓度为0.062 5~0.167 0 g/mL的杜仲水提液时,发酵液的OD值和生物量均高于对照组(未添加杜仲水提液),且在0.125 0 g/mL时发酵液的OD值和活菌数达到最大;当培养基中添加的杜仲水提液质量浓度达到0.250 0 g/mL时,发酵液的OD值和生物量低于对照组。各组添加不同质量浓度杜仲水提液的发酵样品中,L. acidophilus CICC6005的生物量存在显著差异(P<0.05),表明了杜仲水提液的添加对L. acidophilus CICC6005的生长产生了显著影响;通过LSD 两两比较法分析,添加0.125 0 g/mL杜仲水提液组与对照组存在极显著差异(P<0.01),并与其他各实验组差异显著(P<0.05)。说明适宜质量浓度范围的杜仲水提液可提高菌体的生物量,当质量浓度为0.125 0 g/mL时可明显促进L. acidophilus CICC6005的增殖。分析杜仲促进菌体增殖的原因,可能是其含有的多糖类、氨基酸、维生素和微量元素等营养成分为菌体提供了生长因子,同时L. acidophilus CICC6005通过分泌各种酶来分解利用杜仲的一些有机物而促进自身的增殖。此外,添加0.250 0 g/mL杜仲水提液组与对照组相比差异显著(P<0.05),说明过高的杜仲水提液质量浓度会对L. acidophilus CICC6005的增殖产生一定的抑制作用,可能是杜仲中具有抑菌作用的绿原酸、糖肽类等活性物质 [5]质量浓度增高,产生量效关系,抑制了L. acidophilus CICC6005的生长。因此本研究将0.125 0 g/mL作为杜仲水提液的最适添加质量浓度。
2.2 L. acidophilus CICC6005的生物量随培养时间的变化
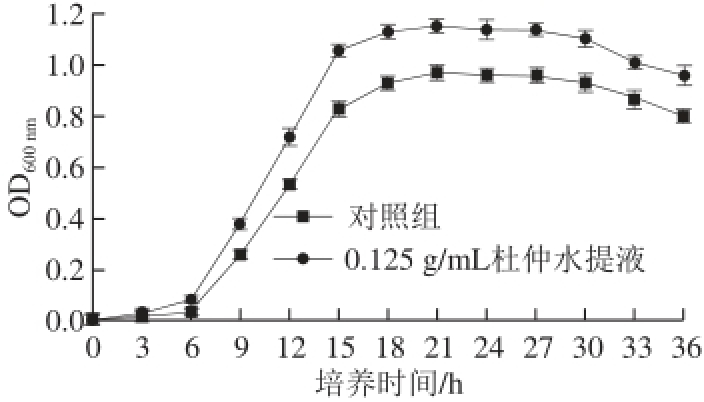
图2 L. acidophiilluuss CICC6005生长曲线
Fig. 2 Growth curve of L. acidophilus CICC6005
将质量浓度为0.125 0g/mL(最适质量浓度)的杜仲水提液添加到MRS培养基中,以对照组作对比,按照方法1.3.4节绘制两组的生长曲线。由图2可知,对照组在0~6 h处于延滞期,6 h后进入对数期,至约21 h到达平稳期,而最适杜仲质量浓度组比对照组提前进入对数期,并在18 h左右到达稳定期,且生物量一直高于对照组,比对照组提前进入稳定期。说明适宜质量浓度的杜仲水提液可以促进L. acidophilus CICC6005在对数期的增殖,并且与对照组相比可缩短对数期的时间,提前进入平稳期。另外,最适杜仲质量浓度组和对照组均在30 h左右进入衰亡期,因此,L. acidophilus CICC6005菌体及其发酵产物的最佳收获期应为21 h。
2.3 不同质量浓度杜仲水提液对L. acidophilus CICC6005胞外和胞内蛋白质量浓度的影响
按照方法1.3.5节方法分离得到L. acidophilus CICC6005的胞外和胞内蛋白,并采用BCA试剂盒进行定量。根据酶标仪测得蛋白样品稀释液的A 562 nm值,计算平均值,在标准曲线上确定出该样品稀释液的蛋白质浓度。所得胞外、胞内蛋白质量浓度如表1所示。
表1 L. acidophilus CICC6005胞外、胞内蛋白质量浓度
Table 1 Contents of extracellular and intracellular proteins from L. acidophilus CICC6005
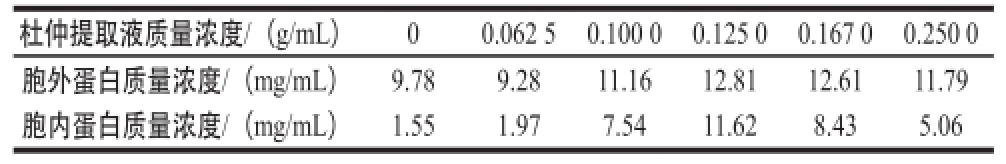
注:胞外蛋白质量浓度为每毫升发酵上清液中蛋白的质量;胞内蛋白质量浓度为每毫升发酵液(OD 600 nm=1)中嗜酸乳杆菌胞内蛋白的质量。
杜仲提取液质量浓度/(g/mL)00.062 50.100 00.125 00.167 00.250 0胞外蛋白质量浓度/(mg/mL)9.789.2811.1612.8112.6111.79胞内蛋白质量浓度/(mg/mL)1.551.977.5411.628.435.06
由表1可知,不同质量浓度杜仲水提液对L. acidophilus CICC6005胞外和胞内蛋白质量浓度产生不同影响,与对照相比,当基础培养基中加入杜仲药液时,L. acidophilus CICC6005胞外和胞内蛋白质量浓度有所提高,且总体变化趋势与不同质量浓度的杜仲水提液对L. acidophilus CICC6005增殖影响的结果呈正相关,并且胞外和胞内蛋白含量均在杜仲制剂质量浓度为0.125 0 g/mL时达到最大,分别为12.81、11.62 mg/mL。杜仲水提液质量浓度为0.062 5~0.125 0 g/mL时,胞外蛋白质量浓度逐渐升高,胞内蛋白质量浓度明显升高;当杜仲水提液质量浓度为0.250 0 g/mL时,与L. acidophilus CICC6005增殖的结果对比,虽然此时生长量已低于对照组,但胞外和胞内蛋白质量浓度仍高于对照组,可能是因为L. acidophilus CICC6005在抵御较高质量浓度杜仲水提液的不良刺激时产生较多的应激蛋白所致。
通过SDS-PAGE对胞外蛋白和胞内蛋白的构成进行初步分析鉴定,观察添加的杜仲水提液对胞外及胞内蛋白表达的影响,取各组未经稀释的胞外及胞内蛋白粗提液,上样体积均为10
 L,SDS-PAGE结果如图3所示。
L,SDS-PAGE结果如图3所示。
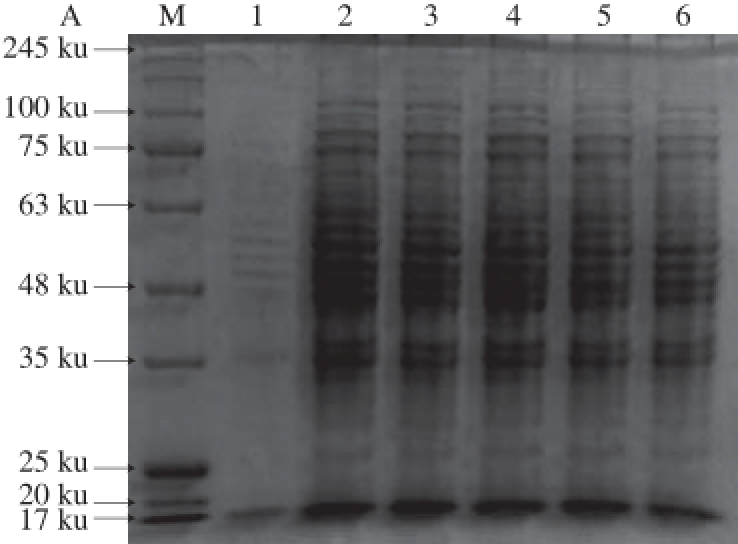
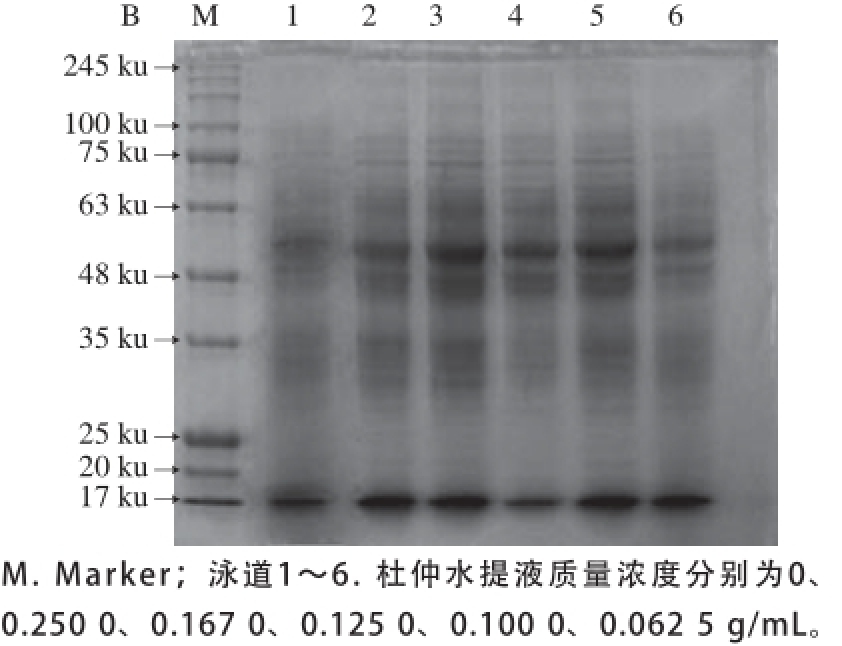
图3 不同质量浓度杜仲水提液对L. acidophiilluuss CICC6005胞外(A)、胞内(B)蛋白的影响
Fig. 3 Effect of Eucommia ulmoides Oliv. bark aqueous extract at different concentration on the composition of extracellular (A) and
intracellular (B) proteins from L. acidophilus CICC6005
由图3A可知,各泳道中蛋白条带清晰,条带在17 ku和35~100 ku处均有集中。添加不同质量浓度杜仲水提液各组条带构成相似,但添加杜仲水提液各组与未添加组相比条带颜色区别明显,且随着杜仲质量浓度的增大条带颜色有所加深,变化趋势与表1中结果呈正相关。说明杜仲水提液的添加促进了胞外蛋白的分泌。
由图3B可知,各泳道中蛋白条带清晰,均有两条主条带,分别位于48~63 ku之间和17 ku处。添加不同质量浓度杜仲水提液各组条带构成相似,但条带颜色深浅不一,在48~63 ku之间尤为明显,且随着杜仲质量浓度的增大条带颜色逐渐加深,变化趋势与表1中结果呈正相关。表明此蛋白分泌量与杜仲水提液质量浓度有一定的关系,培养基中添加杜仲水提液可能主要促进了48~63 ku之间胞内蛋白的分泌。
2.4 L. acidophilus CICC6005胞内和胞外蛋白的纯化
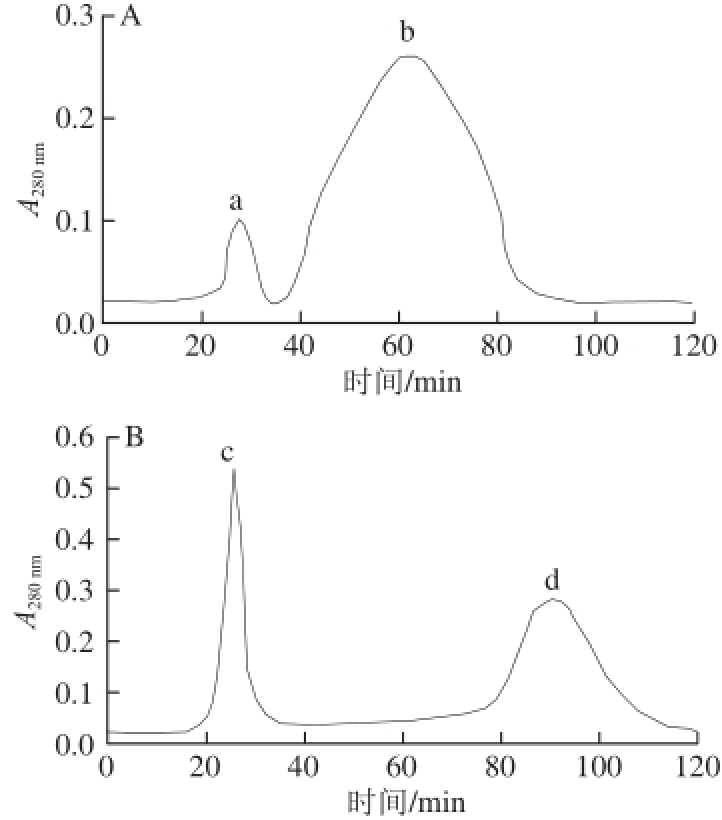
图4 L. acidophiilluuss CICC6005胞外(A)、胞内(B)蛋白层析图谱
Fig. 4 Gel filtration chromatograms of the extracellular (A) and intracellular (B) proteins from L. acidophilus CICC6005
采用1.3.6节方法对添加杜仲水提液质量浓度为0.125 0 g/mL的粗提蛋白进行纯化,所得层析图谱如图4所示。胞外和胞内蛋白层析图谱上各出现2 个明显的洗脱峰,将其命名为a、b、c、d。对各峰分别进行收集,用BCA法和通过标准曲线测定a、b、c、d 4 个峰的蛋白质质量浓度,依次为0.018、0.084、0.061、0.033 mg/mL。对收集的各峰组分进行透析、浓缩,备用。
2.5 SDS-PAGE检测各峰组分蛋白的分子质量

图5 L. acidophiilluuss CICC6005胞外(A)、胞内(B)蛋白SDS-PAAGGEE结果
Fig. 5 SDS-PAGE of the extracellular (A) and intracellular (B) proteins from L. acidophilus CICC6005
对杜仲水提液培养L. acidophilus CICC6005的胞外蛋白粗提液及两组胞外蛋白组分(a、b)进行SDS-PAGE凝胶电泳分析,判断胞外蛋白组分分子质量大小,结果如图5A所示,L. acidophilus CICC6005胞外蛋白粗提液对应的泳道1中包含3 条主条带,分别位于63、48、35 ku附近,泳道2对应的a峰组分中主条带位于63 ku附近处,泳道3对应的b峰组分条带位于35 ku附近,泳道2、3中条带与泳道1中条带吻合,且2泳道和3泳道条带有明显差异,说明胞外蛋白粗提液经Sephadex G-100凝胶层析后实现了较好的分离。
对L. acidophilus CICC6005胞内蛋白粗提液及两组胞外蛋白组分(c、d)进行SDS-PAGE分析,判断胞外蛋白组分分子质量大小,结果如图5B所示,L. acidophilus CICC6005胞内蛋白粗提样品对应的泳道4中包含2条主条带,分别位于63~48 ku之间和11 ku附近,泳道5对应的c峰组分中主条带和泳道6对应的d峰组分条带与泳道4中条带吻合,且泳道5和泳道6条带有明显差异,说明胞内蛋白经凝胶层析后同样达到了较好的分离效果。
根据SDS-PAGE图,以蛋白质Marker中各蛋白迀移率x作为横坐标,以标准蛋白质分子质量的对数为纵坐标y作图,得到回归方程为y=-1.220 4x+2.279 9(R 2=0.969 96)。根据迁移率标准曲线计算L. acidophilus CICC6005胞外、胞内各组分蛋白的分子质量,得出计算结果:胞外蛋白a峰、b峰分子质量分别为67、31 ku,胞内蛋白c峰、d峰分子质量分别为57、17 ku。
益生菌是一类通过改善宿主肠道微生物菌群的平衡而发挥作用的活性微生物,其调节胃肠道失调,增强肠道免疫功能,抑制过敏反应,保护心血管系统 [19]等重要的生理功效日益凸显,受到国内外学者的广泛关注,成为当今研究的热点。中药作为我国传统文化宝库中的一枚珍宝,在医学、食品、化妆品和养生保健等领域中的地位举足轻重,中药领域还有许多亟待解决的问题需要人们进一步探讨和研究。
本研究以一种具益生功能的嗜酸乳杆菌(L. acidophilus CICC6005)作为研究对象,以中药杜仲为诱导因子(益生菌的增殖性底物),探讨其对L. acidophilus CICC6005生物量水平及所表达蛋白的影响,并了解L. acidophilus CICC6005在一定质量浓度的杜仲水提液的环境中表达胞外和胞内蛋白的水平,进一步阐述L. acidophilus CICC6005的益生功能。通过实验发现,适宜质量浓度范围的杜仲水提液对L. acidophilus CICC6005有显著的促生作用,与菌体胞外及胞内蛋白分泌水平也呈现一定的相关性;而较高质量浓度的杜仲水提液对该菌的增殖表现为抑制作用,相应的胞外及胞内蛋白也呈下降趋势。分析其原因,可能是在杜仲含有的多糖、氨基酸、微量元素等营养物质作为菌体增殖因子,或者菌体分泌的某些酶将杜仲的一些有机成分分解成为自身能够利用的营养物质从而促进了菌体生长;随着杜仲水提液质量浓度升高,可能其含有的某些药用成分(如绿原酸,具有广谱抗菌作用 [20])质量浓度升高到一定水平后对菌体生长产生抑制作用,其具体的影响机理有待进一步深入研究。研究结果揭示,杜仲水提液与L. acidophilus CICC6005的生物量及表达蛋白量之间存在一定的量效关系,为L. acidophilus CICC6005的体外发酵生产以提高生物量及在肠道内的增殖以维护肠道健康,提供一定的科学依据。杜仲除具有明显的强壮筋骨等功效,其一定质量浓度的水提液可能通过促进肠道内有益微生菌群的作用而发挥更广泛的生理作用,比如降血压、降血脂、抗炎等功效,这也为中药行医工作者进行相关研究提供一定参考。
众多研究显示益生菌的益生作用与其代谢产物密切相关 [21-24],如一些乳酸菌通过产酸降低肠道pH值从而抑制致病菌的生长 [21-22],或通过分泌细菌素作用于有害菌的细胞膜 [23],或通过分泌胆盐水解酶降低机体胆固醇含量 [24]等来维持宿主健康。近年来,越来越多的报道集中在研究益生菌中表达的相关蛋白质的益生作用。朱晓等 [25]对3 种乳酸菌表层蛋白的结构和性质进行了研究,并初步推测,表层蛋白的存在有助于乳酸菌黏附性能的发挥,从而发挥其益生功能。Yun等 [26]通过体外和动物实验发现Lactobacillus acidophilus GP1B经灭活后,其细胞提取物能够控制艰难梭菌引起的疾病,并且对艰难梭菌的增殖显示出显著的抑制作用。Meng Jun等 [27]研究了两种嗜酸乳杆菌菌株的表层蛋白对大肠杆菌细胞壁的水解活性,发现这两种菌株的表层蛋白均能破坏大肠杆菌细胞壁,对其有亚致死效果。本研究通过添加最适质量浓度杜仲水提液培养L. acidophilus CICC6005,获得其胞外及胞内蛋白,并对作用前后的L. acidophilus CICC6005表达蛋白质的水平进行了分析鉴定。结果显示,杜仲水提液对L. acidophilus CICC6005的胞外蛋白与胞内蛋白的表达水平产生明显影响,电泳图谱鉴定表明存在一定差异,特别是相同分子质量的蛋白组分含量差异较大,原因一方面可能是胞外与胞内蛋白本身组成存在差异,另一方面可能与两种蛋白不同的提取方法相关。通过葡聚糖凝胶Sephadex G-100的层析分离后,分泌于胞外的主要蛋白质得到很好地分离,经进一步鉴定两种蛋白组分的分子质量为67 ku和31 ku,而主要的胞内蛋白其分子质量为57 ku和17 ku两种蛋白组分;SDS-PAGE图谱显示各组分蛋白条带清晰且均能与各自全蛋白主条带相吻和,说明各组分蛋白得到了较好的分离纯化。L. acidophilus CICC6005在本研究的条件下可高水平表达的蛋白质,其结构尚需鉴定,为后续进一步研究其生物学功能,如抗菌活性、抗炎活性及抑制癌细胞增殖等奠定基础。
本研究探索了不同质量浓度的杜仲水提液对L. acidophilus CICC6005生长量的影响,同时研究了L. acidophilus CICC6005表达胞外和胞内蛋白含量的变化,以及蛋白组分的分析。结果表明:当添加的杜仲水提液质量浓度为0.125 0 g/mL时,L. acidophilus CICC6005的生长量达到最大(4.38×10 8CFU/mL),且与对照组相比有显著差异(P<0.05);分析该条件下获得的胞外和胞内蛋白,经Sephadex G-100凝胶层析纯化,均得到两种被分离的蛋白组分;并通过SDS-PAGE检测,分泌胞外的主要蛋白的分子质量为67 ku和31 ku,胞内的主要蛋白分子质量为57 ku和17 ku。本研究结果可为进一步探究L. acidophilus CICC6005对人类健康所表现的生物学功能奠定基础,同时对更深入层次阐述益生菌表达的蛋白组分的功效具有一定参考价值。
参考文献:
[1] 彭红梅, 李小姝. 杜仲的药理研究现状及应用展望[J]. 中医学报, 2013, 28(1): 72-73. DOI:10.16368/j.issn.1674-8999.2013.01.055.
[2] ZHOU J F, ZHANG T M, CHEN W A, et al. Comparative analysis of chemical components between barks and leaves of Eucommia ulmoides Oliver[J]. Journal of Central South University of Technology, 2009, 16(3): 371-379. DOI:10.1007/s1171-009-0063-x.
[3] 王志宏, 彭胜, 雷明盛, 等. 杜仲主要生物活性研究进展[J]. 天然产物研究与开发, 2013, 25(9): 1302-1309. DOI:10.3969/ j.issn.1001-6880.2013.09.031.
[4] 姜交龙. 杜仲内生菌的分离及其代谢产物抑菌性质研究[D]. 无锡:江南大学, 2013: 1-7.
[5] 谢丽玲, 陈华谱, 曹俊辉. 杜仲提取物对鱼类病原菌作用的研究[J]. 汕头大学学报, 2009, 24(1): 39-44. DOI:10.3969/ j.issn.1001-4217.2009.01.007.
[6] 李三华, 刘坤祥, 莫宁萍, 等. RT-PCR法检测杜仲总黄酮对大鼠成骨细胞骨钙素表达的影响[J]. 遵义医学院学报, 2011, 34(3): 223-225. DOI:10.3969/j.issn.1000-2715.2011.03.001.
[7] 李三华, 何志全, 陈全利, 等. 杜仲总黄酮对成骨细胞增殖及I型胶原蛋白表达的影响[J]. 西北药学杂志, 2011, 26(4): 272-274. DOI:10.3969/j.issn.1004-2407.2011.04.020.
[8] 肖静, 李三华, 莫宁, 等. 杜仲总黄酮对体外培养大鼠成骨细胞增殖的影响[J]. 遵义医学院学报, 2008, 31(3): 238-240. DOI:10.3969/ j.issn.1000-2715.2008.03.007.
[9] 邓宏宇. 杜仲总黄酮对人肺腺癌细胞 H1299 细胞增殖的影响[J]. 遵义医学院学报, 2010, 33(3): 218-219.
[10] 许维娜. 益生菌的研究进展[J]. 生物技术世界, 2012, 10(5): 33-35.
[11] 王丽凤, 张和平. 益生菌、胃肠道微生物和宿主之间相互作用的研究进展[J]. 中国食品学报, 2011, 11(4): 147-153. DOI:10.3969/ j.issn.1009-7848.2011.04.022.
[12] YAMANO T, TANIDA M, NIUJIMA A. Effects of the probiotic strain Lactobacillus johnsonii strain La1 on autonomic nerves and blood glucose in rats[J]. Life Sciences, 2006, 79(20): 1963-1967. DOI:10.1016/j.lfs.2006.06.038.
[13] 李平兰, 时向东, 吕燕妮, 等. 常见中草药对两种肠道有益菌体外生长的影响[J]. 中国农业大学学报, 2003, 8(5): 33-35. DOI:10.3321/ j.issn:1007-4333.2003.05.009.
[14] 刘阳, 启航, 闫晓梅. 中药黄芪有效成分对益生菌的促生作用[J].大连轻工业学院学报, 2005, 24(3): 192-194. DOI:10.3969/ j.issn.1674-1404.2005.03.011.
[15] 张庆庆, 李慧静, 曹乾升, 等. 黄芪对嗜酸乳杆菌生长及其产酶活的影响[J]. 食品工业科技, 2013, 34(15): 166-169. DOI:10.13386/ j.issn1002-0306.2013.15.042.
[16] 舒国伟, 吕嘉枥, 陈合, 等. 中药提取物等益生菌增菌物质研究进展[J].食品科技, 2009, 34(10): 162-165.
[17] 徐宁, 赵丽云, 洪钦辉, 等. 几株米曲霉成曲胞外蛋白鉴定及发酵结果分析[J]. 中国食品学报, 2012, 12(11): 178-182.
[18] 王斐斐. 基于凝胶电泳的Lysobacter sp. SNNU513胞外抗菌蛋白分离分析和质谱鉴定[D]. 西安: 陕西师范大学, 2013: 18-20.
[19] ARAYA N, MORELLI L, REID G, et al. Guidelines for the evaluation of probiotics in food[J]. AIP Conference Proceedings, 2002, 1678(1): 5-39. DOI:10.1063/1.4931319.
[20] 辛晓明, 冯蕾, 王浩, 等. 杜仲的化学成分及药理活性研究进展[J]. 医学综述, 2007, 13(19): 1507-1509. DOI:10.3969/ j.issn.1006-2084.2007.19.028.
[21] SERVIN, ALAIN L. Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens[J]. FEMS Microbiology Reviews, 2004, 28(4): 405-440. DOI:10.1016/j.femsre.2004.01.00 3S0168644504000142.
[22] de KEERSMAECKER S C, VERHOEVEN T L, DESAIR J, et al. Strong antimicrobial activity of Lactobacillus rhamnosus GG against Salmonella typhimurium is due to accumulation of lactic acid[J]. FEMS Microbiology Letters, 2006, 259(1): 89-96. DOI:10.1111/ j.1574-6968.2006.00250.x.
[23] EIJSINK V G H, AXELSSON L, DIEP D B, et al. Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and communication[J]. Advances in Water Resources, 2002, 81(1/2/3/4): 957-966. DOI:10.1023/A:1020582211262.
[24] 国立东, 杨丽杰, 霍贵成. 乳酸菌降胆固醇机制的研究进展[J]. 食品与发酵工业, 2013, 39(2): 117-122. DOI:10.13995/j.Cnki.11-1802/ ts.2013.02.040.
[25] 朱晓, 胡斌, 李景艳, 等. 乳酸菌表层蛋白的分离及其结构和性质[J].食品与发酵工业, 2011, 37(10): 19-24. DOI:10.13995/j.cnki.11-1802/ ts.2011.10.039.
[26] YUN B, OH S, GRIFFITHS M W. Lactobacillus acidophilus, modulates the virulence of Clostridium diff cile[J]. Journal of Dairy Science, 2014, 97(8): 4745-4758. DOI:10.3168/jds.2014-7921.
[27] MENG J, GAO S M, ZHANG Q X, et al. Murein hydrolase activity of surface layer proteins from Lactobacillus acidophilus, against Escherichia coli[J]. International Journal of Biological Macromolecules, 2015, 79: 527-532. DOI:10.1016/j.ijbiomac.2015.03.057.
Effect of Eucommia ulmoides Oliv. Bark Aqueous Extract on the Growth and Fermentation Products of Lactobacillus acidophilus
JIA Yan, LI Maomao, CHEN Rui, JIANG Yan, MING Zhu, ZHAO Pei, PANG Guangchang, YAN Yali
*, CHEN Qingsen
*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:This paper is concerned with the effect of different concentrations of Eucommia ulmoides Oliv. bark aqueous extract on the proliferation of Lactobacillus acidophilus CICC6005 and the changes in extracellular and intracellular protein contents during fermentation. For this purpose, Lactobacillus acidophilus CICC6005 was cultured in MRS medium added with five different concentrations of Eucommia ulmoides Oliv. bark aqueous extract. The extracellular and intracellular proteins were obtained with trichloroacetic acid-acetone precipitation and a commercial kit, respectively, and purified by Sephadex G-100 gel filtration chromatography. All separated fractions were quantified by the bicinchoninic acid (BCA) method and their molecular weights were measured by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDSPAGE). Results showed that addition of 0.125 0 g/mL Eucommia ulmoides Oliv. bark aqueous extract significantly promoted bacterial growth, giving the maximum biomass of 4.38 × 10 8CFU/mL and maximum extracellular and intracellular protein contents. The extracellular proteins were separated into two apparent peaks with molecular weights of 67 and 31 ku, and the intracellular proteins were also separated into two apparent peaks with molecular weights of 57 and 17 ku. In conclusion, the appropriate concentration of Eucommia ulmoides Oliv. bark aqueous extract played a role in promoting the growth of L. acidophilus CICC6005 and also affected its fermentation products.
Key words:Eucommia ulmoides Oliv. bark; Lactobacillus acidophilus CICC6005; proliferation; extracellular proteins; intracellular proteins
DOI:10.7506/spkx1002-6630-201623025
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)23-0147-07
收稿日期:2016-06-15
基金项目:国家自然科学基金面上项目(31071522)
作者简介:贾彦(1990—),女,硕士研究生,研究方向为发酵生物技术。E-mail:jiayan3123@163.com
*通信作者:阎亚丽(1962—),女,副教授,硕士,研究方向为发酵生物技术、微生物学。E-mail:yyali@tjcu.edu.cn陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、功能成分与肠道健康。E-mail:chqsen@tjcu.edu.cn
引文格式:
贾彦,李毛毛,陈蕊, 等. 杜仲水提液对嗜酸乳杆菌生长及发酵产物的影响[J]. 食品科学, 2016, 37(23): 147-153.
DOI:10.7506/spkx1002-6630-201623025. http://www.spkx.net.cn
JIA Yan, LI Maomao, CHEN Rui, et al. Effect of Eucommia ulmoides Oliv. bark aqueous extract on the growth and fermentation products of Lactobacillus acidophilus[J]. Food Science, 2016, 37(23): 147-153. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201623025. http://www.spkx.net.cn