刘回民 1,2,陈方奇 2,3,郑明珠 2,3,佟维娜 2,3,靳 松 3,刘景圣 2,3,*
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.小麦和玉米深加工国家工程实验室,吉林 长春 130118;3.吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:玉米半胱氨酸蛋白酶是一种重要的蛋白水解酶,作为C1家族蛋白酶的一员,可在食品、医药等领域广泛应用。本研究从玉米幼苗中提取总RNA,反转录扩增得到玉米半胱氨酸蛋白酶基因,进而构建重组真核表达载体pPICZα-zmCP1,转化毕赤酵母GS115构建重组菌。对表达的玉米半胱氨酸蛋白酶进行酶学性质研究,结果表明该酶最适反应温度为55 ℃,最适反应pH值为6.0,具有较好的热稳定性和有机溶剂抗性,但是pH值的稳定性、金属离子耐受性表现一般。底物特异性研究发现,该酶对小分子底物具有较强的水解能力,且偏爱P1位点为精氨酸的底物。
关键词:玉米半胱氨酸蛋白酶;真核表达;酶学性质
半胱氨酸蛋白酶是以Cys-His-Asn/Glu氨基酸序列为活性中心的一类酶,广泛分布于从病毒至脊椎动物的生物体中 [1-2]。在植物中,半胱氨酸蛋白酶是一类重要的蛋白水解酶,参与种子萌发、生长、应激反应、组织分化和衰老等生理过程 [3-6]。木瓜蛋白酶家族(C1家族)属于典型的半胱氨酸蛋白酶 [7],该家族成员具有较好的热稳定性和酸碱稳定性,并具有较好的金属离子、有机溶剂抗性,能满足食品和医药生产加工的要求。在食品行业,C1家族常应用于大豆蛋白改性、啤酒澄清、肉嫩化等方面;在医药行业可用于清理伤口和止痛等方面 [8-10]。国内外学者对该家族酶学性质以及开发应用开展了大量研究。来源于小麦(Triticum aestivum)的半胱氨酸蛋白酶对偶氮酪蛋白表现出极强的活性,除了少数金属阳离子,像钴、镁、锰和锂外,其他的金属阳离子都起到抑制作用,其最适反应pH值为4.0,最适反应温度为50 ℃,50 ℃处理30 min保留55%的活性,于-20 ℃条件下贮存150 d后酶活力无明显变化 [11]。
玉米作为一种重要的粮食作物,不仅在粮食安全方面发挥着举足轻重的作用,还是化学工业、燃料、医药等领域的重要原料 [12-14]。序列比对可知,玉米半胱氨酸蛋白酶(zmCP1)是C1家族的一员,可能在酶学性质上具有同样的工业应用潜力。因此,本研究拟从玉米幼苗中提取总RNA,利用反转录技术扩增zmCP1基因,进而构建真核表达载体,转化毕赤酵母GS115构建重组菌,对表达产物的酶学性质进行表征,为该酶的工业应用提供理论依据。
1.1 材料与试剂
大肠杆菌DH5α、真核表达载体pPICZα-A、毕赤酵母GS115由小麦和玉米深加工国家工程实验室保存。
DNA分子质量标准品DL2000、蛋白分子质量标准品Blue Plus、RNAiso Plus、反转录试剂盒、T4 DNA连接酶、BCA蛋白测定试剂盒限制性内切酶EcoRⅠ、XbaⅠ 宝生物工程(大连)有限公司;引物、16 种荧光肽底物、7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC) 上海生工生物工程股份有限公司;Phusion DNA聚合酶 美国NEB公司;凝胶回收试剂盒、质粒提取试剂盒 美国A x y g e n公司;氯化镁、生物素、酵母氮源、咪唑 北京鼎国生物技术有限公司;博来霉素(Zeocin)美国Invitrogen公司;酵母浸粉、蛋白胨 美国Sigma公司;组氨酸抗体(penta-His-antibody)、辣根过氧化物酶偶联的羊抗鼠抗体(HRP-goat anti-mouse IgG) 德国Qiagen公司;超滤管 美国密理博公司;其他试剂均为国产分析纯。
1.2 仪器与设备
核酸电泳仪、蛋白电泳仪、细胞融合仪 美国伯乐公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;HZQ-F160全温振荡培养箱 哈尔滨东联公司;LD5-2B 离心机北京雷勃尔离心机有限公司;全自动酶标仪 德国BMG公司;凝胶成像系统、镍预装柱 美国GE公司;核酸蛋白检测仪 上海精科公司;-80 ℃超低温冰箱美国Thermo公司。
1.3 方法
1.3.1 zmCP1基因的扩增
根据NCBI公布的序列(NP_001151293)设计引物,在上游加入EcoRⅠ酶切位点,下游加入XbaⅠ酶切位点,序列分别为:zmCP1-F:5’-GGCTGAAGCTGAATT CATGTCCGCGTCACGGTTCCT-3’;zmCP1-R:5’-GAG TTTTTGTTCTAGATAGACGGGGTAAGACGGCAACT-3’(划线部分为添加的酶切位点)。
取10 粒玉米种子放入装有蒸馏水的平皿,25 ℃恒温培养箱培养7 d,将幼苗转移至装有灭菌土的泡沫盒中继续培养。提取RNA前将材料暗箱培养24 h。称取玉米幼苗叶片0.1 g提取总RNA。
第一链cDNA的合成按照试剂盒(TAKARA)操作说明进行。反应体系为10 μL,其中Oligo dT Primer(50 μmol/L)1 μL,脱氧核糖核苷三磷酸混合液(10 mmol/L)1 μL,总RNA 1 μg,不含RNA酶的重蒸水6.3 μL。
以合成的第一链cDNA为模板,进行zmCP1的PCR扩增。反应体系为50 μL,其中cDNA 2μL,引物各2 μL,Phusion DNA聚合酶0.5 μL,2×GC缓冲液25 μL,脱氧核糖核苷三磷酸混合液(2.5 mmol/L)4 μL,不足部分用重蒸水补齐。PCR扩增条件:94 ℃预变性5 min;94 ℃ 变性45 s,65 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。PCR产物使用1.0 g/100 mL琼脂糖凝胶电泳检测,使用Axygen DNA凝胶回收试剂盒进行回收。
1.3.2 重组真核表达载体的构建
使用限制性内切酶EcoRⅠ和XbaⅠ进行双酶切,1.0 g/100 mL琼脂糖凝胶电泳回收目的基因片段和载体片段,用T4 DNA连接酶于16 ℃金属浴中连接过夜,连接产物转化大肠杆菌感受态细胞DH5α,培养于含100 μg/mL博来霉素的LB固体培养基上进行筛选。筛选得到的重组载体进行菌液PCR和双酶切鉴定,并送至生工生物工程上海(股份)有限公司测序,将测序正确的载体命名为pPICZα-zmCP1。
1.3.3 重组菌的构建
重组表达载体pPICZα-zmCP1经过PmeⅠ线性化后进行回收,电转化至毕赤酵母GS115感受态细胞,涂布于博来霉素终质量浓度为100 μg/mL的YPDS平板上进行筛选,挑取转化平板上的单落进行PCR验证,用1.0 g/100 mL琼脂糖凝胶电泳进行检测。
1.3.4 重组蛋白的表达纯化
挑取阳性转化子于25 mL 液体培养基中,30 ℃、200 r/min培养,当OD 600 nm达到4时停止培养,6 000 r/min离心5 min收集菌体,然后置于25 mL BMMOL/LY液体培养基进行诱导表达,每24 h补加100%甲醇至终体积分数为0.5%,发酵96 h后,离心收集上清液,进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分析 [15-16]。SDS-PAGE结束后,以1∶1 000稀释的penta-His antibody作为一抗,1∶1 000稀释的HRP-goat anti-mouse IgG作为二抗进行蛋白免疫印迹(Western blotting)分析。甲醇诱导96 h后收集上清液,用0.22 μm微孔滤膜过滤除菌,再经超滤管(蛋白截留分子质量10 kD)进行浓缩后用镍预装柱进行纯化,收集目的蛋白。
1.3.5 重组蛋白的酶活力测定
以由精氨酸(R)和AMC合成的荧光肽R-AMC为底物,根据参考文献[17-19]方法测定zmCP1的酶活力。反应体系为200 μL:5 μL酶液,10 μL底物(20%二甲基亚砜(100 mmol/L)),185 μL Tris-HCl(pH 8.0、50 mmol/L)。反应液50 ℃水浴30 min,冰浴60 min,检测荧光活力。激发波长380 nm、发射波长460 nm、狭缝宽5 nm/1.5 nm。酶活力单位定义为每分钟催化生成1 μmol/L AMC所需要的酶量(U)。比活力按下式计算。
其中,蛋白含量采用BCA蛋白测定试剂盒进行测定。
1.3.6 最适反应温度和最适反应pH值的测定
在30~90 ℃的条件下,以R-AMC为底物,在Tris-HCl缓冲液(pH 8.0、50 mmol/L)中测定酶活力。以最高酶活力作为100%,相对酶活力为纵坐标,温度为横坐标确定最适反应温度。
以三羟甲基甲胺基丙磺酸(N-[tris(hydroxymethyl)metyl]-3-aminopropanesulfonic acid,TAPS)、2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)、N-环己基-3-氨基丙磺酸(N-cyclohexyl-3-aminopropanesulfonic acid,CAPS)和4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)配制pH值范围在3.0~10.0的缓冲液,以R-AMC为底物,在55 ℃条件下测定酶活力。以最高酶活力作为100%,相对酶活力为纵坐标,pH值为横坐标确定最适反应pH值。
1.3.7 热稳定性和酸碱稳定性研究
在0.5 mL离心管中分别加入5 μL酶液,185 μL Tris-HCl缓冲液(pH 6.0、50 mmol/L),同时置于5、60、70、80、90 ℃金属浴中放置120 min,每20 min 取1 管,加入10 μL荧光底物R-AMC进行酶活力测定,以初始活力为100%分析酶的热稳定性。
分别取5 μL酶液和185 μL缓冲液(pH值为5.0、6.0、7.0、8.0、9.0、10.0)置于0.5 mL离心管中,于37 ℃金属浴孵育120 min,每20 min取样,pH 6.0、55 ℃条件下测定酶活力。以初始酶活力为100%分析酶的酸碱稳定性。
1.3.8 有机溶剂和金属离子对酶活力的影响
在1.3.5节反应体系中分别引入体积分数为5%、10%、20%的有机溶剂(甲醇、乙醇、丙三醇、异丙醇、乙腈、丁醇、二甲基亚砜和聚乙二醇),混合后静置1 h。以R-AMC为底物,在55 ℃,pH 6.0条件下测定酶活力。
在1.3.5节反应体系中分别引入5、10、20 mmol/L的金属离子(K +、Na +、Ca 2+、Zn 2+、Cu 2+、Mg 2+、Mn 2+、Hg 2+、Co 2+),混合后静置1 h。以R-AMC为底物,在55 ℃,pH 6.0条件下测定酶活力。
1.3.9 底物特异性研究
在1.3.5节反应体系中,55 ℃、pH 6.0条件下,分别以16 种荧光肽为底物,测定相对酶活力,以最高酶活力为100%分析底物特异性。
2.1 zmCP1基因的扩增

图1 玉米幼苗叶总RNA的提取
Fig. 1 Agarose gel electrophoresis of RNA extracted from Zea mays seedlings
以玉米幼苗为材料进行总RNA的提取,经1 g/100 mL琼脂糖凝胶电泳鉴定。如图1所示,28S、18S和5S 3 条带清晰可见,A 260 nm/A 280 nm=1.95,表明玉米幼苗叶总RNA提取成功,RNA质量较好,可用于后续实验。

图2 2 zmCPzmCP1基因的PCR扩增PCR
Fig. 2 Agarose gel electrophoresis of PCR amplified zmCP1
以反转录得到第一链cDNA为模板,zmCP1-F、z m C P 1-R为引物进行目的基因的扩增,产物用1.0 g/100 mL琼脂糖凝胶电泳进行分析,结果如图2所示,在1 000 bp左右有一条清晰可见的条带,与目的基因大小(1 023 bp)接近。
2.2 重组真核表达载体的构建
将目的基因zmCP1和真核表达载体pPICZα-A进行连接,然后转入至大肠杆菌DH5α,37 ℃培养后以菌液为模板进行PCR验证,提取质粒进行双酶切验证,结果见图3。验证正确的转化子送至上海生工测序公司测序,结果表明成功构建了真核表达载体pPICZα-zmCP1。
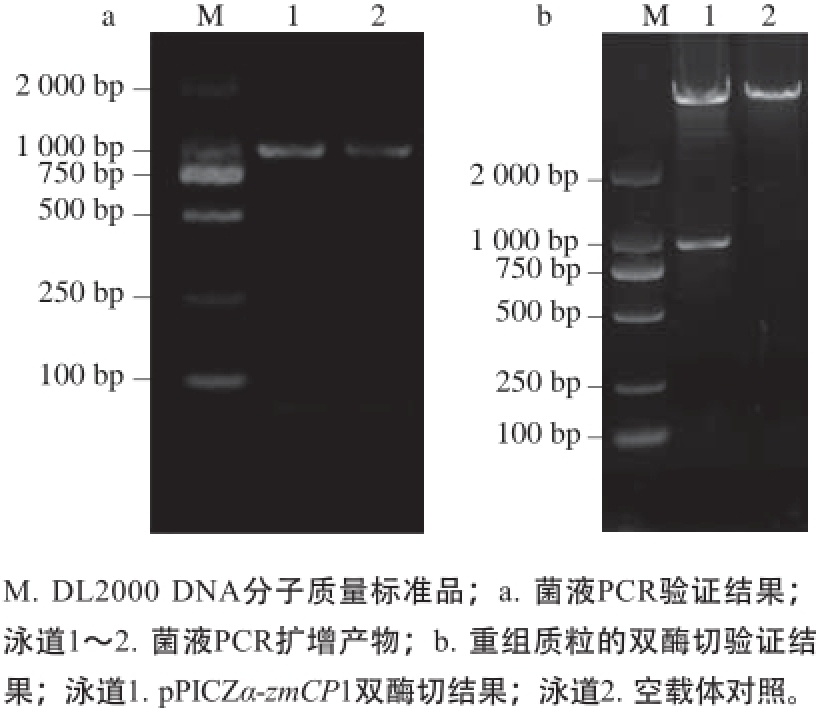
图3 重组表达载体pPPIICCZα--zzmmCCPP11的鉴定
Fig. 3 Identification of recombinant plasmid pPICZα-zmCP1

图4 pPIICCZZα-zzmmCCPP1的菌液PPCCRR验证
Fig. 4 PCR identification of pPICZα-zmCP1
pPICZα-zmCP1线性化后电转至毕赤酵母GS115中,挑取单菌落进行菌液PCR验证。由图4可知,可特异性扩增出大小为1 000 bp左右的条带,证明成功筛选得到阳性克隆,重组酵母菌命名为GS115-zmCP1。
2.3 zmCP1的诱导表达、鉴定及纯化
GS115-zmCP1经甲醇诱导表达96 h,取上清液进行SDSPAGE和Western blotting分析。由图5可知,GS115-zmCP1经甲醇诱导后,可特异性表达分子质量约为34 kD的蛋白,同时不经甲醇诱导的GS115-zmCP1也有较低水平的表达,目的蛋白分子质量与zmCP1的理论分子质量接近。Western blotting结果进一步证明了可特异性表达zmCP1。表达产物经镍柱纯化,纯度可达到90%以上。

图5 5 zmCP1的鉴定与纯化
Fig. 5 Identification and purification of zmCP1
2.4 zmCP1的最适反应温度和最适反应pH值
以荧光肽R-AMC为底物,考察zmCP1在不同温度和pH值条件下的酶活力。由图6可知,zmCP1在40~70 ℃范围内,相对酶活力保持在50%以上,最适反应温度是55 ℃。由图7可知,在pH 6.0时,相对酶活力最高,在pH 5.0~8.0范围内,相对酶活力保持在50%以上,表明玉米半胱氨酸蛋白酶适合中性偏酸的反应环境,这与之前的研究结果一致 [19-20]。
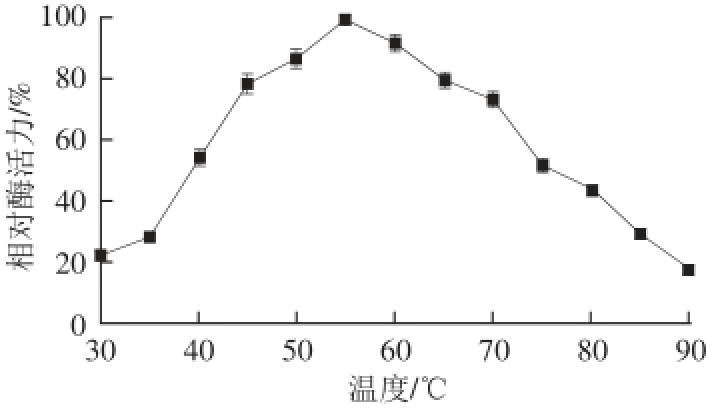
图6 zmCP1的最适反应温度
Fig. 6 Optimal temperature of zmCP1

图7 zmCP1的最适反应ppHH值
Fig. 7 Optimal pH of zmCP1
2.5 热稳定性和酸碱稳定性
不同温度条件下放置酶液,每20 min取样测定酶活力,经Graphprism软件拟合得到zmCP1的热稳定性曲线。由图8可知,随着时间的延长,相对酶活力都呈现下降趋势。经计算可知50、60、70、80、90 ℃条件下,zmCP1分别在74.18、72.21、66.55、49.06、39.20 min后仍保持有50%的活力,可见zmCP1具有较好的热稳定性。

图8 zmCP1的热稳定性
Fig. 8 Thermal stability of zmCP1
取等体积的酶液在不同pH值的缓冲液中孵育,每20 min取样测定酶活力,经Graphprism软件拟合得酸碱稳定性曲线,结果见图9。经计算可知,zmCP1在pH 5.0、6.0、7.0、8.0、9.0条件下放置48.10、77.76、79.84、49.47、36.98 min后酶活力仍保持50%。由此可见,pH 6.0、7.0条件下酶活力较为稳定。而在pH 5.0、8.0、9.0条件下,酶活力下降较快,因此zmCP1的酸碱耐受性表现一般。

图9 9 zmCP1的酸碱稳定性
Fig. 9 pH stability of zmCP1
2.6 有机溶剂和金属离子对酶活力的影响
表1 有机溶剂对zmCP1活性的影响
Table 1 Effects of organic solvents on the activity of zmCP1

有机溶剂相对酶活力/% 5%10%20%对照100100100聚乙二醇108.32±2.71103.14±2.5889.33±2.23二甲基亚砜104.3±2.6197.53±2.4489.42±2.24乙腈103.49±2.5998.53±2.4573.24±1.83甲醇98.34±2.4696.99±2.4295.84±2.40乙醇94.36±2.3694.55±2.3991.37±2.28丁醇85.75±2.1477.70±1.9550.13±1.25丙三醇81.34±2.0349.53±1.2428.88±0.72异丙醇71.43±1.7965.86±1.6538.42±0.96
分别在反应体系中加入不同体积分数的有机溶剂和不同浓度金属离子,检测对酶活力的影响。由表1可知,随着有机溶剂在反应体系中体积分数的增大,zmCP1的酶活力逐渐减小,尤其是丙三醇、异丙醇和丁醇具有明显的抑制作用,但其在大多数有机溶剂存在时仍能保持60%以上的酶活力,低体积分数的乙腈、二甲基亚砜、聚乙二醇对于zmCP1活性具有轻微的促进作用,可见zmCP1具有一定的有机溶剂抗性。
从表2可以看出,大部分金属离子对酶活力都起到抑制作用,尤其是Cu 2+、Hg 2+。其中5 mmol/L的K +、Mg 2+和Mn 2+对zmCP1的酶活力起到了一定的促进作用。总的来说,zmCP1的金属离子耐受力表现一般。
表2 金属离子对zmCP1活性的影响
Table 2 Effects of metal ions on the activity of zmCP1
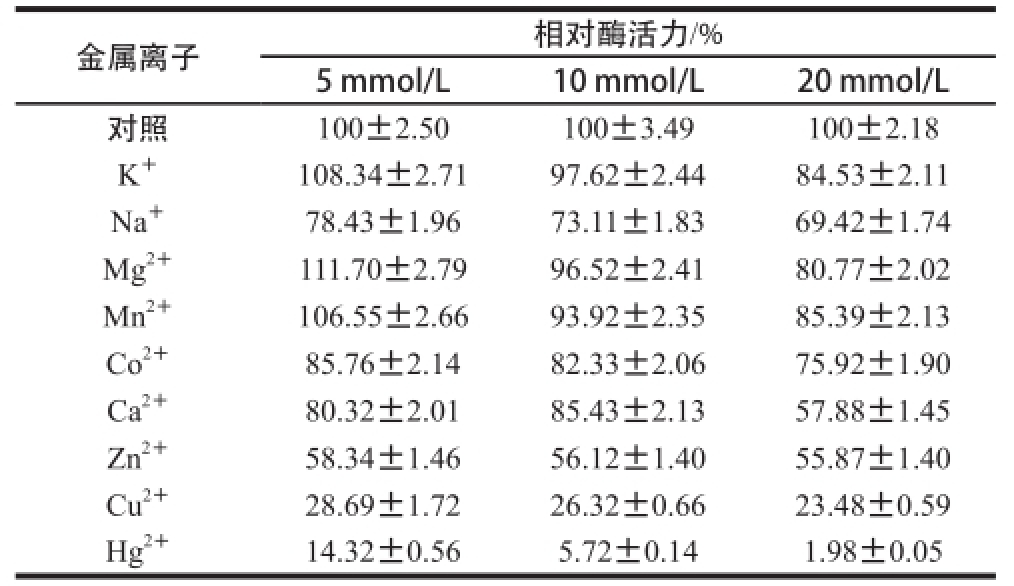
金属离子相对酶活力/% 5 mmol/L10 mmol/L20 mmol/L对照100±2.50100±3.49100±2.18 K +108.34±2.7197.62±2.4484.53±2.11 Na +78.43±1.9673.11±1.8369.42±1.74 Mg 2+111.70±2.7996.52±2.4180.77±2.02 Mn 2+106.55±2.6693.92±2.3585.39±2.13 Co 2+85.76±2.1482.33±2.0675.92±1.90 Ca 2+80.32±2.0185.43±2.1357.88±1.45 Zn 2+58.34±1.4656.12±1.4055.87±1.40 Cu 2+28.69±1.7226.32±0.6623.48±0.59 Hg 2+14.32±0.565.72±0.141.98±0.05
2.7 底物特异性研究
以设计的16 种荧光肽为底物,在55 ℃、pH 6.0的条件下测定酶活力,以最高酶活力为100%作图,考察zmCP1的底物特异性。由图10可知,zmCP1对于底物的水解能力大小总体上呈现一肽底物>二肽底物>三肽底物>四肽底物。我们通常将底物裂解位点两侧的氨基酸残基所在的位点分别命名为P1、P2、P3…P1’、P2’、P3’…。由图10可知,一肽底物中R-AMC的相对酶活力最高,二肽和三肽底物中P1位点为精氨酸(R)的底物相对酶活力最高。因此,zmCP1对于小分子底物的水解活性较高,且偏爱P1位点为精氨酸的底物,这与之前的报道一致 [18,21]。

图 10zmCP1的底物特异性
Fig. 10 Substrate specificity of zmCP1
本研究在实验室前期研究的基础上,进一步开展了玉米半胱氨酸蛋白酶的真核表达研究。利用RT-PCR技术扩增得到玉米半胱氨酸蛋白酶基因,构建真核表达载体pPICZα-zmCP1,并成功用毕赤酵母GS115进行异源真核表达,使得表达出的玉米半胱氨酸蛋白酶具有天然活性。对异源表达的重组酶zmCP1进行酶学性质研究,结果表明:zmCP1最适反应温度为55 ℃,最适反应pH值为6.0,具有较好的热稳定性和有机溶剂抗性,对于小分子底物具有较好的水解能力,酶学性质上与C1家族很多成员具有相似性 [22-25]。关于玉米半胱氨酸蛋白酶真核表达的研究尚未见报道,本实验可为该酶进一步在食品、医药等领域的开发应用提供理论依据。
参考文献:
[1] RAWLINGS N D, BARRETT A J. Families of cysteine peptidases[J]. Methods in Enzymology, 1994, 244: 461-486. DOI:10.1016/0076-6879(94)44034-4.
[2] WIEDERANDERS B, KAULMANN G, SCHILLING K. Functions of propeptide parts in cysteine proteases[J]. Current Protein and Peptide Science, 2003, 4(5): 309-326. DOI:10.2174/1389203033487081.
[3] GRUDKOWSKA M, ZAGDANSKA B. Multifunctional role of plant cysteine proteinases[J]. Acta Biochimica Polonica, 2004, 51(3): 609-624.
[4] GONZALEZ-RABADE N, BADILLO-CORONA J A, ARANDABARRADAS J S, et al. Production of plant proteases in vivo and in vitro-a review[J]. Biotechnology Advances, 2011, 29(6): 983-996. DOI:10.1016/j.biotechadv.2011.08.017.
[5] 闫龙凤, 杨青川, 韩建国, 等. 植物半胱氨酸蛋白酶研究进展[J]. 草业学报, 2005, 14(5): 11-19. DOI:10.3321/j.issn:1004-5759.2005.05.003.
[6] WATANABE Y, MATSUSHIMA S, YAMAGUCHI A, et al. Characterization and cloning of cysteine protease that is induced in green leaves of barley[J]. Plant Science, 2009, 176(2): 264-271. DOI:10.1016/j.plantsci.2008.11.002.
[7] LECAILLE F, KALETA J, BRÖMME D. Human and parasitic papainlike cysteine proteases: their role in physiology and pathology and recent developments in inhibitor design[J]. Chemical Reviews, 2002, 102(12): 4459-4488. DOI:10.1021/cr0101656.
[8] AFAF S F, AHMED A, SALEH A M. Characterization of a cysteine protease from wheat Triticum aestivum (cv. Giza 164)[J]. Bioresource Technology, 2003, 9(13): 297-304. DOI:10.1016/S0960-8524(03)00193-7.
[9] 吴显荣. 木瓜蛋白酶的开发与应用[J]. 中国农业大学学报, 2005, 10(6): 17-21. DOI:10.3321/j.issn:1007-4333.2005.06.004.
[10] LEITE A P, de OLIVEIRA B G, SOARES M F, et al. Use and effectiveness of papain in the wound healing process: a systematic review[J]. Revista Gaúcha De Enfermagem. 2012, 33(3): 198-207.
[11] STARLEY I F, MOHAMMED P, SCHNEIDER G, et al. The treatment of paediatric burns using topical papaya[J]. Burns, 1999, 25(7): 636-639. DOI:10.1016/S0305-4179(99)00056-X.
[12] 郭玲霞, 黄朝禧, 彭开丽. 从中国玉米生物乙醇发展分析生物能源对粮食安全的影响[J]. 中国科技论坛, 2011, 27(9): 139-145. DOI:10.3969/j.issn.1002-6711.2011.09.024.
[13] 王莉, 胡胜德. 玉米用途之争: 粮食消费还是能源消费[J]. 农业经济, 2008, 28(11): 8-9. DOI:10.3969/j.issn.1001-6139.2008.11.003.
[14] 王雪茜, 陈正华, 孙军. 玉米秸秆能源化利用途径与方法[J].中国资源综合利用, 2014, 32(10): 35-38. DOI:10.3969/ j.issn.1008-9500.2014.10.016.
[15] LI Yangyuan, ZHONG Kaixin, HU Aihong, et al. High-level expression and characterization of a thermostable xylanase mutant from Trichoderma reesei in Pichia pastoris[J]. Protein Expression and Purif cation, 2014, 108: 90-96. DOI:10.1016/j.pep.2014.11.014.
[16] YU Ping, SHEN Xiaoqin. Enhancing the production of S-adenosyl-L-methionine in Pichia pastoris GS115 by metabolic engineering[J]. AMB Express, 2012, 2(1): 1-7. DOI:10.1186/2191-0855-2-57.
[17] 詹冬玲. 超嗜热古菌Pyrococcus horikoshii OT3半胱氨酸蛋白酶的研究[D]. 长春: 吉林大学, 2011: 50-51.
[18] THAN M E, HELM M, SIMPSON D J, et al. The 2.0 Å crystal structure and substrate specificity of the kdel-tailed cysteine endopeptidase functioning in programmed cell death of Ricinus communis endosperm[J]. Journal of Molecular Biology, 2004, 336(5): 1103-1116. DOI:10.1016/j.jmb.2003.12.075.
[19] 刘回民, 陈方奇, 郑明珠, 等. 玉米半胱氨酸蛋白酶的原核表达及酶学性质表征[J]. 吉林大学学报(理学版), 2015,14(5): 232-237. DOI:10.13413/j.cnki.jdxblxb.2015.05.43.
[20] 刘回民, 程国栋, 陈方奇, 等. 玉米半胱氨酸蛋白酶突变体W308C的原核表达和酶学性质表征[J]. 食品科学, 2014, 35(15): 132-136. DOI:10.7506/spkx1002-6630-201415025.
[21] LIU Huimin, CHEN Liangcheng, LI Quan, et al. Computational study on substrate specif city of a novel cysteine protease 1 precursor from Zea mays[J]. International Journal of Molecular Sciences, 2014, 15(6): 10459-10478. DOI:10.3390/ijms150610459.
[22] VORSTER J, KUNERT K. Cysteine protease expression and activity in soybean nodules during development and stress[J]. South African Journal of Botany, 2013, 86: 164. DOI:10.1016/j.sajb.2013.02.097.
[23] DOMSALLA A, MELZIG M F. Occurrence and properties of proteases in plant latices[J]. Planta Medica, 2008, 74(7): 699-711. DOI:10.1055/s-2008-1074530.
[24] 方正武, 景雄, 刘志雄. 甜荞半胱氨酸蛋白酶FaRDL基因的克隆和序列结构分析[J]. 湖北农业科学, 2013, 52(22): 5609-5611. DOI:10.3969/j.issn.0439-8114.2013.22.064.
[25] ITO-INABA Y, MASUKO H, WATANABE M, et al. Isolation and gene expression analysis of a papain-type cysteine protease in thermogenic skunk cabbage (Symplocarpus renifolius)[J]. Bioscience, Biotechnology, and Biochemistry, 2012, 76(10): 1990-1992. DOI:10.1271/bbb.120434.
Eukaryotic Expression and Characterization of Cysteine Protease Gene from Zea mays
LIU Huimin
1,2, CHEN Fangqi
2,3, ZHENG Mingzhu
2,3, TONG Weina
2,3, JIN Song
3, LIU Jingsheng
2,3,*
(1. College of Life Science, Jilin Agricultural University, Changchun 130118, China; 2. National Engineering Laboratory for Wheat and Corn Deep Processing, Changchun 130118, China; 3. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:Cysteine protease from Zea mays (zmCP1) is a proteolytic enzyme that, as a member of the C1 protease family, can be widely used in the food and medicine industry. In this study, the total RNA of Zea mays was extracted from its seedlings, zmCP1 was cloned by reverse transcription-polymerase chain reaction (RT-PCR), and then the recombinant eukaryotic expression vector pPICZα-zmCP1 was constructed and transformed into P. pastoris GS 115. The optimal temperature and pH for the expressed enzyme zmCP1 were 55 ℃ and 6.0, respectively, and it possessed good thermal stability and high organic solvent tolerance. But it had medium pH stability and metal ion tolerance. Substrate specif city analysis showed that the enzyme had strong hydrolysis ability for small molecules and preferred to hydrolyze substrates with Arg residue at the P1 site.
Key words:cysteine protease from Zea mays; eukaryotic expression; enzymatic properties
DOI:10.7506/spkx1002-6630-201623026
中图分类号:Q786
文献标志码:A
文章编号:1002-6630(2016)23-0154-06
引文格式:
刘回民, 陈方奇, 郑明珠, 等. 玉米半胱氨酸蛋白酶的真核表达及酶学性质表征[J]. 食品科学, 2016, 37(23): 154-159.
DOI:10.7506/spkx1002-6630-201623026. http://www.spkx.net.cn
LIU Huimin, CHEN Fangqi, ZHENG Mingzhu, et al. Eukaryotic expression and characterization of cysteine protease gene from Zea mays[J]. Food Science, 2016, 37(23): 154-159. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201623026. http://www.spkx.net.cn
收稿日期:2016-02-03
基金项目:国家自然科学基金面上项目(31171760);公益性行业(粮食)科技专项(201313011-3);吉林农业大学科研启动基金项目(2015013)
作者简介:刘回民(1984—),男,讲师,博士,研究方向为食品生物技术和长白山特色植物资源开发利用。E-mail:liuhuimin@jlau.edu.cn
*通信作者:刘景圣(1964—),男,教授,博士,研究方向为粮食深加工与功能性食品。E-mail:liujs1007@vip.sina.com