吐温-80对钝齿棒杆菌产L-赖氨酸的影响
赖木兰,万 方,朱蔷云,陈雪岚
*
(江西师范大学生命科学学院,江西 南昌 330022)
摘 要:对吐温-80提高L-赖氨酸产量的分子机制进行探究。以钝齿棒杆菌MT-M4 ΔproB为出发菌株,在菌株生长至对数初期36 h时,添加5 mg/mL吐温-80进行摇瓶发酵,通过反转录实时荧光定量聚合酶链式反应(reverse translate real-time f uorescence quantitative polymerase chain reaction,RT-qPCR)监控相关基因的转录水平、胞内的还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate reduced form,NADPH)水平及α-酮戊二酸脱氢酶复合物(α-oxoglutarate dehydrogenase complex,ODHC)的活力。摇瓶发酵结果表明,添加吐温-80使L-赖氨酸产量提高了215%;RT-qPCR结果表明,编码ODHC的基因odhA、sucB和lpdA、参与ODHC调控的基因pknG、dtsR和ppp以及合成NADPH的磷酸戊糖途径基因zwf的转录水平均发生了变化,其中odhA、sucB、lpdA、pknG及dtsR1基因分别发生了上调,ppp基因下调,相应ODHC活力提高了32.9%;zwf基因上调了17.6倍,相应胞内NADPH水平提高了137%。因此,在对数生长初期36 h添加吐温-80具有双重功效,既提高了ODHC的表达又使NADPH积累,从而诱导L-赖氨酸的高产。
关键词:钝齿棒杆菌;吐温-80;L-赖氨酸;α-酮戊二酸脱氢酶复合物;NADPH
L-赖氨酸作为人和动物的必需氨基酸,具有促进个体发育、增强免疫、促进钙吸收、预防心血管疾病等重要功能,因此其在饲料、食品、医药等工业中应用广泛
[1-4]。现今,L-赖氨酸的工业生产主要通过微生物发酵,如谷氨酸棒杆菌(Corynebacterium glutamicum)
[5-6]、钝齿棒杆菌(C. crenatum)
[7]、乳糖发酵短杆菌(Brevibacterium lactofermentum)
[8]等。随着对L-赖氨酸需求的增加,如何提高L-赖氨酸产量成为研究的热点。其中,通过代谢工程对菌体进行菌种改造及发酵培养基优化成为提高L-赖氨酸产量的主要途径。Xu Jianzhong等
[9]敲除编码丙酮酸脱氢酶复合物E1亚基的aceE,阻断丙酮酸合成乙酰-辅酶A,使得代谢通量流向草酰乙酸,L-赖氨酸产量提高了59.31%。Becker等
[10]敲除了编码草酰乙酸合成磷酸烯醇式丙酮酸的磷酸烯醇式丙酮酸羧激酶基因pck,阻断了草酰乙酸的分流,使L-赖氨酸产量提高了12.81%。
吐温-80作为一种非离子型表面活性剂被应用于L-赖氨酸的生产。Koníček等
[11]在对数期向发酵培养基中添加体积分数0.2%的吐温-80,C. glutamicum的L-赖氨酸产量提高25%。齐秀兰等
[7]在相同条件下添加体积分数0.2%的吐温-80,C. crenatum的L-赖氨酸产量提高12.8%,但其作用机制仍不十分清楚。L-赖氨酸的生物合成是通过细胞内众多基因的表达调控完成的,因此实验拟通过摇瓶发酵生产L-赖氨酸并在对数生长初期添加吐温-80,检测相关酶活力以及还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)水平,并通过反转录实时荧光定量聚合酶链式反应(reverse translate real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)监控相关基因的转录水平以揭示吐温-80提高L-赖氨酸产量的分子机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
C. crenatum MT-M4 ΔproB 为江西师范大学生命科学学院生物技术实验室构建的1 株产L-赖氨酸菌株。
Trizol Plus RNA提取试剂盒 美国Invitrogen公司;Primer Script
TM反转录试剂盒、SYBR Premix Ex Taq
TM(Tli RNaseH Plus)试剂盒、DNAaseⅠ 大连TaKaRa公司;NADP
+/NADPH分析试剂盒 美国BioAssay Systems公司;其余试剂均为国产分析纯。
1.1.2 培养基
种子培养基(g/L):葡萄糖30、硫酸铵20、磷酸二氢钾0.5、硫酸镁0.5、玉米浆20、尿素1.5,NaOH调节pH值至7.0,250 mL三角瓶分装30 mL。
发酵培养基(g/L):葡萄糖120、硫酸铵45、磷酸二氢钾0.05、硫酸镁0.5、玉米浆25、脯氨酸2.5、碳酸钙30,NaOH调节pH值至7.0,250 mL挡板三角瓶分装25 mL。
LB培养基用于C. crenatum MT-M4 ΔproB的培养。种子培养基和发酵培养基用于L-赖氨酸发酵。
1.1.3 RT-qPCR引物
表1 RT-qPCR所用引物
Table 1 Primers used in this work

引物序列(5’→3’)dtsR1-FCCTCCCATCCAACAATCGCT dtsR1-RTAAGGAACGGTCGCGGAATC pknG-FGGCGGCATGGGTTGGATTT pknG-RGTGCCTTGGTCTTGAACGGA ppp-FCGGTATTGATCGTAGCCCTG ppp-RCGCGACGTAAAAAGTGCTG odhA-FTCATTGAGGCATACCGCTCC odhA-RTGAAGGTACGGTCCAGATCC sucB-FTCGTGAAGCGTCCAGTTGTC sucB-RGGTCCTTGATGGTGGTCAGG lpdA-FTGGGACTTAACCGTGGGCT lpdA-RCACACCGTTAATCATGCGGAC zwf-FACTGAGATTGCCGTGGTGTT zwf-RAGCGGATGAGCACACCTTC 16S rRNA-FAAGAAGCACCGGCTAACTAC 16S rRNA-RCCGGGATTTCACAGACGAC
1.2 仪器与设备
S-433D氨基酸分析仪 德国Sykam公司;ABI7000荧光定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 发酵实验
将C. crenatum MT-M4 ΔproB划线培养至LB平板,30 ℃培养48 h。挑取单菌落接种到5 mL LB液体培养基,30 ℃、220 r/min培养24 h。取1 mL菌液接种到30 mL种子培养基,30 ℃、220 r/min培养24 h。以体积分数10%的接种量接种到25 mL的发酵培养基,30 ℃、200 r/min发酵120 h。为了探究吐温-80对L-赖氨酸生产的影响,在菌株生长至对数初期36 h时向发酵培养基中添加终质量浓度为5 mg/mL的吐温-80
[12]。
1.3.2 菌体生长量的测定
将样品离心后的沉淀加1 mL 0.125 mol/L HCl中和过量的CaCO
3。稀释适当倍数后于562 nm波长处测定其光密度(OD
562
nm)值。根据OD
562
nm每变化1表征0.375 g菌体,计算菌体生物量。
1.3.3 L-赖氨酸产量的测定
1 mL发酵液6 000 r/min离心后弃沉淀,取20 μL上清液通过氨基酸分析仪测定其中L-赖氨酸产量,此为细胞外L-赖氨酸含量;细胞内赖氨酸浓度的测定是首先取1 mL发酵液6 000 r/min离心后收集细胞,再用pH 7.2的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次;用pH 7.2的PBS恢复体积1 mL,再超声波破碎后12 000 r/min离心10 min除去细胞碎片沉淀,取20 μL上清液通过氨基酸分析仪测定细胞内L-赖氨酸含量。
1.3.4 残糖量的测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定发酵液中的残糖(葡萄糖)量。取0.1 mL发酵液用超纯水稀释至1 mL,加入750 μL的DNS试剂沸水浴5 min,迅速冷却至室温,再稀释适当的倍数后于540 nm波长处测定其OD值。
1.3.5 α-酮戊二酸脱氢酶复合物(α-oxoglutarate dehydrogenase complex,ODHC)活力的测定
参照文献[13],取1 mL处于发酵对数期的菌液,1 000 r/min离心1 min去除CaCO
3后6 000 r/min离心5 min获得菌体。用预冷的 0.2 g/100 mL KCl洗涤2 次,然后用三羟甲基甲胺基乙磺酸(N-(tris(hydroxymethyl)metyl)-2-aminopropanesulfonic acid,TES)-NaOH缓冲液(含体积分数30%甘油)重悬,接着用10 mg/mL的溶菌酶37 ℃条件下处理约4 h,6 000 r/min离心5 min后加适量的含30%甘油的TES-NaOH缓冲液重悬,冰浴条件下超声破碎菌体。最后10 000 r/min离心10 min取上清液进行酶活力测定。
ODHC活力测定体系(3 mL)中含有:100 mmol/L TES-NaOH缓冲液(pH 7.7)、5 mmol/L MgCl
2、3 mmol/L半胱氨酸、0.3 mmol/L硫胺素焦磷酸、0.2 mmol/L辅酶A、1 mmol/L 3-乙酰吡啶腺嘌呤二核苷酸,以及适量的粗酶液,反应温度31.5 ℃。测酶活力时,加入1 mmol/L α-酮戊二酸,混匀,每隔30 s测定340 nm波长处的光密度值(OD
340
nm)。其中NAD
+的摩尔消光系数为9.1 L/(mol·cm)。ODHC活力单位(U)定义为:反应体系中每分钟转化1 μmol NAD
+为NADH所需的酶量。
1.3.6 胞内NADP
+/NADPH水平的测定
参照NADP
+/NADPH分析试剂盒说明书,取2 份1 mL发酵对数期的菌液,1 000 r/min离心1 min去除CaCO
3后6 000 r/min离心5 min收集菌体。PBS洗涤2 次,6 000 r/min离心5 min后收集沉淀。一份样品中加入100 μL烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)提取液,另一份加入100 μL NADPH提取液,60 ℃水浴5 min,冰水浴冷却,然后加入20 μL测定缓冲液,混匀后分别加入100 μL NADPH提取液、100 μL NADP提取液,10 000 r/min离心5 min取上清液进行NADP
+/NADPH水平的测定。
NADP
+/NADPH反应体系(85 μL)含60 μL Assay Buffer、1 μL Enzyme Mix、10 μL葡萄糖、14 μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,混匀后测定0~30 min内样品在562 nm波长处的OD
562
nm变化速率(ΔOD
562
nm/min)。
1.3.7 总RNA的提取及反转录
取发酵对数期的菌液500 μL,6 000 r/min离心5 min后获得的菌体。根据提取试剂盒说明书进行总RNA的提取。然后以经DNAase Ⅰ消化的总RNA作为模板,根据反转录试剂盒说明书进行反转录获得cDNA。
1.3.8 RT-qPCR
以16S rRNA作为内参,根据试剂盒说明进行RT-qPCR。反应体系(20 μL):2×SYBR
®Premix Ex Taq
TM(Tli RNaseH Plus)10 μL、50×ROX Reference Dye 0.4 μL、cDNA 2 μL、上下游引物各0.8 μL、无菌水6 μL。RT-qPCR反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,循环40 次;RT-qPCR数据采用2
-ΔΔCt方法
[14]对基因的各Ct值进行定量分析。
1.4 数据统计分析
每次实验重复3 次,结果以
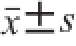 表示。实验数据采用GraphPad Prism 5.0软件进行分析,其中统计学比较采用方差分析(analysis of variance,ANOVA)进行,显著性差异采用Tukey-t分析(P<0.05)。
表示。实验数据采用GraphPad Prism 5.0软件进行分析,其中统计学比较采用方差分析(analysis of variance,ANOVA)进行,显著性差异采用Tukey-t分析(P<0.05)。
2 结果与分析
2.1 吐温-80对钝齿棒杆菌产L-赖氨酸生理代谢的影响
表2 吐温-80对-赖氨酸产量的影响
Table 2 Effect of Tween-80 on -lysine production
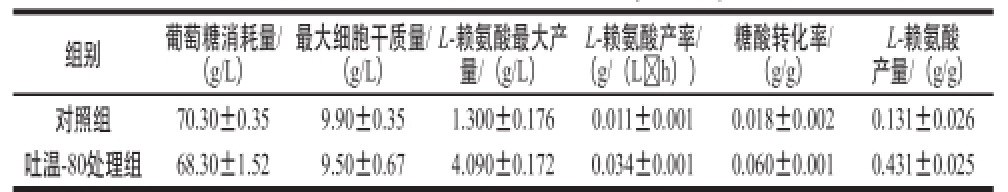
L-赖氨酸产量/(g/g)对照组70.30±0.359.90±0.351.300±0.1760.011±0.0010.018±0.0020.131±0.026吐温-80处理组68.30±1.529.50±0.674.090±0.1720.034±0.0010.060±0.0010.431±0.025组别葡萄糖消耗量/(g/L)最大细胞干质量/(g/L)L-赖氨酸最大产量/(g/L)L-赖氨酸产率/(g/(L h))糖酸转化率/(g/g)
为了探究吐温-80对C. crenatum MT-M4 ΔproB生理代谢的影响,以未添加吐温-80作为对照组,在葡萄糖为碳源的条件下进行摇瓶发酵,比较L-赖氨酸产量、细胞生长及葡萄糖消耗等。如表2所示,在添加吐温-80的条件下,发酵120 h,L-赖氨酸产量提高了约215%,达4.09 g/L,L-赖氨酸产率提高了2.09 倍;葡萄糖消耗量及菌体生长量略有下降,其糖酸转化率提高了2.33 倍,L-赖氨酸单位产量提高了2.29 倍。因此,吐温-80有利于L-赖氨酸、葡萄糖转化率以及L-赖氨酸产率的提高。
2.2 吐温-80对胞内ODHC活力的影响
α-酮戊二酸是三羧酸循环的关键中间产物,它可以在谷氨酸脱氢酶的作用下合成谷氨酸,同时又能在ODHC的催化下合成琥珀酰-辅酶A。ODHC活力的降低有利于代谢流流向谷氨酸合成途径
[15],而该酶活力的提高有利于L-赖氨酸合成的前体物质草酰乙酸的积累。因此实验监测了胞内ODHC的活力,以探究吐温-80对其影响。
表3 吐温-80对胞内ODHC活力及NADP
+/NADPH 的影响
Table 3 Effect of Tween-80 on intracellular ODHC specific activity and NADP
+/NADPH

NADP
+/ NADPH对照组4.395±0.1670.134±0.0120.253±0.0231.889±0.124吐温-80处理组5.840±0.2010.318±0.0020.491±0.0111.547±0.109组别ODHC比活力/(U/mg pro)NADPH水平/(mmol/L)NADP
+水平/(mmol/L)
如表3所示,在添加吐温-80的条件下,ODHC比酶活力达5.84 U/mg,较对照组提高了32.95%,这说明了吐温-80确实能通过某些调控因子来提高ODHC的活力,以提高L-赖氨酸产量。
2.3 吐温-80对胞内NADP
+/NADPH水平的影响
1 mol L-赖氨酸的合成要消耗4 mol NADPH,因此提高NADPH水平可以提高L-赖氨酸产量
[16-17]。细胞内NADPH的合成主要通过磷酸戊糖途径(pentose phosphate pathway,PPP),zwf编码的6-磷酸葡萄糖脱氢酶是PPP途径产NADPH的关键酶。为探究吐温-80对NADPH池积累的影响,通过NADP
+/NADPH测定试剂盒对胞内NADPH及NADP
+浓度进行检测。结果如表3所示,胞内NADPH水平提高了137%,NADP
+/NADPH降低了18.1%。因此,吐温-80有利于NADP
+转化为NADPH,从而提高NADPH水平,这为L-赖氨酸合成提供了更多的辅助因子。
2.4 总RNA的提取及吐温-80对胞内相关基因转录水平的影响
参照Trizol试剂说明书,对新鲜样品立即提取总RNA,电泳后溴化乙锭染色,结果见图1,RNA完整度良好,纯度较高,适合进行后续实验。
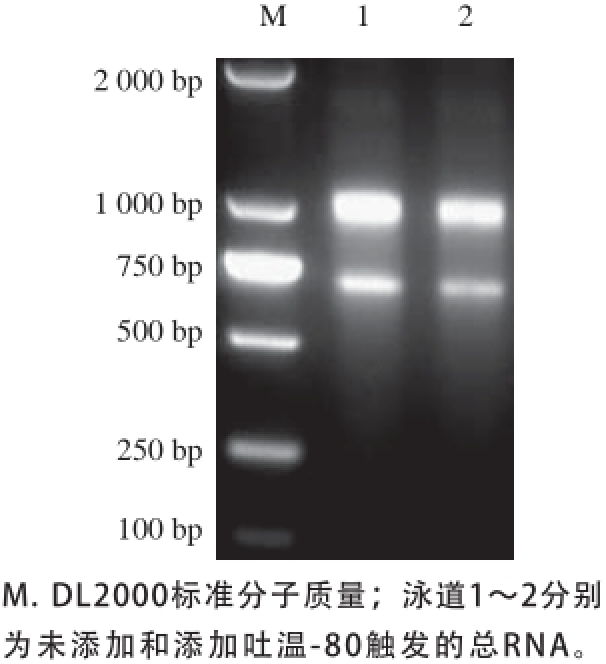
图1 提取的总RNA电泳图
Fig. 1 Electrophoretogram of total RNA
ODHC活力以及NADPH水平的提高应是胞内相关基因的转录水平发生了变化。ODHC是由3 种酶组成的复合物,分别是odhA编码的α-酮戊二酸脱氢酶、sucB编码的二氢硫辛酰胺琥珀酰转移酶以及lpdA编码二氢硫辛酰胺脱氢酶组成的复合物
[18]。Niebisch等
[19]发现O D H C的活力受胞内酮戊二酸抑制蛋白(oxoglutarate dehydrogenase inhibitor,OdhI)的磷酸化水平调控,其主要机制是未磷酸化的OdhI可以通过其FDH区域与ODHC中的OdhA亚基结合,从而抑制ODHC的活力;蛋白激酶G(PknG)可以对OdhI的第14位苏氨酸进行磷酸化,磷酸化的OdhI从OdhA上脱离下来,从而解除对ODHC的抑制。Schultz等
[20]还发现由ppp编码的磷酸蛋白磷酸酶ppp可将磷酸化的OdhI去磷酸化,从而使去磷酸化的OdhI与OdhA结合抑制ODHC的活性;dtsR1编码乙酰辅酶A羧化酶,是合成脂肪酸的起始关键酶,Kimura等
[21]发现dtsR1的敲除能够显著降低ODHC的活力。因此,我们监控了上述基因及与NADPH合成有关的基因zwf的转录水平。结果如图2所示,编码ODHC的3 种酶的基因odhA、sucB、lpdA的转录水平均有所提高,分别提高了10.6 倍、2.4 倍和4.1 倍;正调控ODHC活力的基因dtsR1、pknG的转录水平分别提高了20.3 倍、5.2 倍;负调控ODHC酶活力的基因ppp的转录水平降低了3.9 倍;zwf的转录水平提高了17.6 倍。由此可见,吐温-80能通过显著提高sucB、lpdA、pknG、dtsR1转录水平以及降低ppp的转录水平从而提高ODHC的酶活力,同时通过提高zwf的转录水平增加了NADPH的供给,其双重作用使L-赖氨酸产量大幅提高。

图2 吐温-80对相关基因转录水平的影响
Fig. 2 Effect of Tween-80 on the transcription level of the related genes
3 讨 论
吐温作为一类非离子型表面活性剂,广泛应用于微生物发酵工业。Koníček等
[11]推测吐温-80促进L-赖氨酸合成的原因是改变了细胞的渗透性,从而有利于L-赖氨酸积累。但本实验监控了48 h的发酵菌体内外的L-赖氨酸,结果显示L-赖氨酸在胞外含量为(1.34±0.10)g/g,而细胞内L-赖氨酸的含量仅为(0.45±0.04)g/g。虽然Taoka等
[22]发现添加吐温-80可以改变细胞脂肪酸的组成,其中C
18脂肪酸的合成显著增加导致细胞渗透性增加,但是渗透模型不能解释细胞膜内外物质的不平衡性。吐温40能够通过降低ODHC的活力,提高谷氨酸合成支路的代谢流量从而提高谷氨酸的产量
[15,23]。因此,课题组推测吐温-80是否也与吐温40一样,能够影响ODHC活力,使代谢流集中流入L-赖氨酸合成途径。基于此,本研究通过RT-qPCR监测与ODHC活力及NADPH合成相关基因的转录水平,以研究吐温-80提高L-赖氨酸产量的分子机制。实验结果表明,当添加吐温-80诱导培养时,相关基因的转录水平发生了显著改变(P<0.05),致使ODHC的比酶活力提高了32.95%;ODHC活力的提高会导致α-酮戊二酸合成谷氨酸的流量降低
[24-25],我们监控了120 h谷氨酸产量的变化,结果显示谷氨酸产量由(4.83±0.46)g/L降为(4.64±0.29)g/L,降低不显著(P>0.05),这与Kataoka等
[23]添加吐温-80至谷氨酸棒杆菌中并没有改变谷氨酸的产量是基本一致的。同时,PPP的zwf基因转录水平也发生了显著提高,这有利于NADPH水平的积累,为L-赖氨酸的生物合成提供足够的还原力。因此,课题组认为吐温-80具有双重功效,既提高ODHC活力又促进NADPH供应,从而提高了L-赖氨酸的产量。有关吐温-80具有这双重功能的本质原因将进一步通过转录组学、蛋白组学和代谢工程等进行研究。
参考文献:
[1] FLODIN N W. The metabolic roles, pharmacology, and toxicology of lysine[J]. Journal of the American College of Nutrition, 1997, 16(1): 7-21. DOI:10.1080/07315724.1997.10718644.
[2] CIVITELLI R, VILLAREAL D T, AGNUSDEI D, et al. Dietary L-lysine and calcium metabolism in humans[J]. Nutrition, 1991, 8(6): 400-405.
[3] 周俊, 宋代军. 赖氨酸营养研究进展[J]. 饲料工业, 2006, 27(8): 48-50. DOI:10.3969/j.issn.1001-991X.2006.08.015.
[4] 黄元新, 鲁力. 赖氨酸对机体健康促进作用的研究进展[J]. 广西医学, 2008, 30(7): 1031-1033.
[5] SAHM H, EGGELING L, EIKMANNS B, et al. Construction of L-lysine-, L-threonine-, or L-isoleucine-overproducing strains of Corynebacterium glutamicum[J]. Annals of the New York Academy of Sciences, 1996, 782(1): 25-39. DOI:10.1111/j.1749-6632.1996. tb40544.x.
[6] 苏会波, 林海龙, 罗虎, 等. 谷氨酸棒杆菌生产L-赖氨酸的培养优化和产酸特性研究[J]. 食品工业科技, 2014, 35(17): 130-133. DOI:10.13386/j.issn1002-0306.2014.17.019.
[7] 齐秀兰, 阎浩林, 郭信梅, 等. 二甲基亚砜和吐温-80对钝齿棒杆菌产生赖氨酸影响的研究[J]. 生物技术, 1997, 7(5): 21-25.
[8] 董迅衍, 徐大庆, 李烨, 等. 乳糖发酵短杆菌lysC突变对L-赖氨酸积累的影响[J]. 食品与生物技术学报, 2011, 30(4): 592-596.
[9] XU Jianzhong, HAN Mei, ZHANG Junlan, et al. Improvement of L-lysine production combines with minimization of by-products synthesis in Corynebacterium glutamicum[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(12): 1924-1933. DOI:10.1002/jctb.4278.
[10] BECKER J, ZELDER O, HÄFNER S, et al. From zero to hero-Designbased systems metabolic engineering of Corynebacterium glutamicum for L-lysine production[J]. Metabolic Engineering, 2011, 13(2): 159-168. DOI:10.1016/j.ymben.2011.01.003.
[11] KONÍČEK J, SMEKAL F, KONÍČKOVÁ-RADOCHOVÁ M. Effect of Tween-80 and dimethyl sulfoxide on biosynthesis of L-lysine in regulatory mutants of Corynebacterium glutamicum[J]. Folia Microbiologica, 1991, 36(6): 587-589.
[12] CHEN Minliang, CHEN Xuelan, WAN Fang, et al. Effect of Tween 40 and DtsR1 on L-arginine overproduction in Corynebacterium crenatum[J]. Microbial Cell Factories, 2015, 14: 119-129. DOI:10.1186/s12934-015-0310-9.
[13] KIM J, HIRASAWA T, SATO Y, et al. Effect of odhA overexpressionand odhA antisense RNA expression on Tween40-triggered glutamate production by Corynebacterium glutamicum[J]. Applied Microbiological Biotechnology, 2009, 81(6): 1097-1106. DOI:10.1007/s00253-008-1743-4.
[14] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/ meth.2001.1262.
[15] KAWAHARA Y, TAKAHASHI-FUKE K, SHIMIZU E, et al. Relationship between the glutamate production and the activity of 2-oxoglutarate dehydrogenase in Brevibacterium lactofermentum[J]. Bioscience, Biotechnology and Biochemistry, 1997, 61(7): 1109-1112.
[16] TAKENO S, MURATA R, KOBAYASHI R, et al. Engineering of Corynebacterium glutamicum with an NADPH-generating glycolytic pathway for L-lysine production[J]. Applied and Environmental Microbiology, 2010, 76(21): 7154-7160. DOI:10.1128/AEM.01464-10.
[17] 张伟国, 徐建中. L-赖氨酸合成代谢中NADPH代谢的研究进展[J].食品与生物技术学报, 2012, 31(10): 1009-1017.
[18] KUMARAN S, PATEL M S, JORDAN F. Nuclear magnetic resonance approaches in the study of 2-oxo acid dehydrogenase multienzyme complexes: a literature review[J]. Molecules, 2013, 18(10): 11873-11903. DOI:10.3390/molecules181011873.
[19] NIEBISCH A, KABUS A, SCHULTZ C, et al. Corynebacterial protein kinase G controls 2-oxoglutarate dehydrogenase activity via the phosphorylation status of the OdhI protein[J]. The Journal of Biological Chemistry, 2006, 281(18): 12300-12307. DOI:10.1074/jbc. M512515200.
[20] SCHULTZ C, NIEBISCH A, SCHWAIGER A, et al. Genetic and biochemical analysis of the serine/threonine protein kinases PknA, PknB, PknG and PknL of Corynebacterium glutamicum: evidence for non-essentiality and for phosphorylation of OdhI and FtsZ by multiple kinases[J]. Molecular Microbiology, 2009, 74(3): 724-741. DOI:10.1111/j.1365-2958.2009.06897.x.
[21] KIMURA E, YAGOSHI C, KAWAHARA Y, et al. Glutamate overproduction in Corynebacterium glutamicum triggered by a decrease in the level of a complex comprising DtsR and a biotincontaining subunit[J]. Bioscience, Biotechnology and Biochemistry, 1999, 63(7): 1274-1278.
[22] TAOKA Y, NAGANO N, OKITA Y, et al. Effect of Tween-80 on the growth, lipid accumulation and fatty acid composition of Thraustochytrium aureum ATCC 34304[J]. Journal of Bioscience and Bioengineering, 2011, 111(4): 420-424. DOI:10.1016/ j.jbiosc.2010.12.010.
[23] KATAOKA M, HASHIMOTO K I, YOSHIDA M, et al. Gene expression of Corynebacterium glutamicum in response to the conditions inducing glutamate overproduction[J]. Letters in Applied Microbiology, 2006, 42(5): 471-476. DOI:10.1111/j.1472-765X.2006.01905.x.
[24] SHIMIZU H, TANAKA H, NAKATO A, et al. Effects of the changes in enzyme activities on metabolic flux redistribution around the 2-oxoglutarate branch in glutamate production by Corynebacterium glutamicum[J]. Bioprocess and Biosystems Engineering, 2003, 25(5): 291-298.
[25] ASAKURA Y, KIMURA E, USUDA Y, et al. Altered metabolic flux due to deletion of odhA causes L-glutamate overproduction in Corynebacterium glutamicum[J]. Applied and Environmental Microbiology, 2007, 73(4): 1308-1319. DOI:10.1128/AEM.01867-06.
Effect and Molecular Mechanisms of Tween-80 on L-lysine Production in Corynebacterium crenatum
LAI Mulan, WAN Fang, ZHU Qiangyun, CHEN Xuelan
*
(School of Life Sicence, Jiangxi Normal University, Nanchang 330022, China)
Abstract:The current work aimed to investigate the molecular mechanisms of Tween-80 for triggering L-lysine overproduction by Corynebacterium crenatum. L-lysine yield was increased by approximately 215% with the addition of Tween-80 in C. crenatum. By using reverse translate real-time fluorescence quantitative polymerase chain reaction, we determined that the transcriptional levels of odhA, sucB and lpdA, which encode three subunits of 2-oxoglutarate dehydrogenase complex (ODHC), were up-regulated; pknG and dtsR1 involved in the signal transduction pathway for ODHC regulation were up-regulated but ppp was down-regulated. As a result, ODHC-specific activity was increased by 32.9%. Furthermore, the transcriptional level of zwf involved in the pentose phosphate pathway was increased by 17.6 folds; thus, intracellular NADPH level was enhanced by 137% in C. crenatum triggered by Tween-80. The addition of Tween-80 to the fermentation medium at the early exponential growth phase induced a bifunctional mechanism for L-lysine overproduction by improving ODHC activity and NADPH supply in C. crenatum.
Key words:Corynebacterium crenatum; Tween-80; L-lysine; 2-oxoglutarate dehydrogenase complex; NADPH
DOI:10.7506/spkx1002-6630-201623029
中图分类号:Q939.9
文献标志码:A
文章编号:1002-6630(2016)23-0173-05
引文格式:
赖木兰, 万方, 朱蔷云, 等. 吐温-80对钝齿棒杆菌产L-赖氨酸的影响[J]. 食品科学, 2016, 37(23): 173-177. DOI:10.7506/ spkx1002-6630-201623029. http://www.spkx.net.cn
LAI Mulan, WAN Fang, ZHU Qiangyun, et al. Effect and molecular mechanisms of Tween-80 on L-lysine production in Corynebacterium crenatum[J]. Food Science, 2016, 37(23): 173-177. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201623029. http://www.spkx.net.cn
收稿日期:2016-01-11
基金项目:国家自然科学基金地区科学基金项目(31360219);江西省自然科学基金面上项目(2016BAB204173)
作者简介:赖木兰(1992—),女,硕士研究生,主要从事代谢工程研究。E-mail:2521248166@qq.com
*通信作者:陈雪岚(1970—),女,教授,博士,主要从事代谢工程研究。E-mail:xuelanchen162@163.com

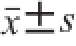 表示。实验数据采用GraphPad Prism 5.0软件进行分析,其中统计学比较采用方差分析(analysis of variance,ANOVA)进行,显著性差异采用Tukey-t分析(P<0.05)。
表示。实验数据采用GraphPad Prism 5.0软件进行分析,其中统计学比较采用方差分析(analysis of variance,ANOVA)进行,显著性差异采用Tukey-t分析(P<0.05)。



