
杨培青 1,李 斌 1,*,颜廷才 1,孟宪军 1,智洪涛 2,黎 盛 3,殷秀岩 4,王维生 5,高凝轩 1,丑述睿 1,李恩惠 1
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.辽宁省农产品质量安全中心,辽宁 沈阳 110001;3.西南大学食品科学学院,重庆 400715;4.通化禾韵现代农业股份有限公司,吉林 通化 134001;5.沈阳皇冠蓝莓生物科技有限公司,辽宁 沈阳 110161)
摘 要:以蓝莓果渣为主要原料,优化最佳发酵工艺条件,提高酵素产品质量。选取工艺参数为酵母菌和干酪乳酸菌的最佳接种量、发酵温度、初始pH值、发酵时间,分析其对酵母菌的蛋白酶活力和浓度及对干酪乳酸菌浓度的影响。按照单因素试验和正交试验法设计上述工艺参数的优化试验。确定最佳酵母菌发酵工艺条件为:发酵液初始pH 3.5、发酵温度30 ℃、接种量0.15%、发酵时间16 h。酵母菌发酵16 h后在37 ℃条件下,发酵液pH 4.0,干酪乳杆菌接种量0.50%,静置发酵24 h,温度保持在18~20 ℃左右,静置进行24 h的后发酵,使发酵液产香,品质优良,将浓缩后的发酵液通过真空冷冻干燥,制成蓝莓果渣酵素粉状产品。
关键词:蓝莓果渣;酵素;发酵;真空冷冻干燥
蓝莓(blueberry),又名越橘、甸果,属杜鹃花科,越橘属植物 [1]。蓝莓果实营养丰富,除含有丰富的糖、蛋白质、脂肪、有机酸外,还富含花青素,多酚,VC、VE等多种维生素,黄酮类化合物,矿物质和多种微量元素 [2-3],有“浆果之王”的美誉,也是世界联农组织推荐的五大健康水果之一。近年来,蓝莓产业发展迅速,各种新产品不断涌现。但是,蓝莓果酒生产过程中产生大量的果渣通常作为废弃物处理,不但造成了资源的浪费,同时又对环境造成污染。但如果将这些果渣进一步加工成蓝莓酵素,经济价值提升巨大。
酵素是一种在日本和台湾非常流行的植物功能食品,酵素又称为酶,是生物体中所产生的具有催化作用的活性大分子 [4-5]。酵素作为一种生物催化剂,参与人体内的各种代谢活动。目前,国内关于蓝莓酵素的介绍和研究还很少。从蓝莓果渣中制备的酵素是经多种有益菌发酵得到的,含有丰富的蛋白酶、超氧化物歧化酶(superoxide dismutase,SOD)、脂肪酶、花青素、多酚、维生素、矿物质和次生代谢产物等营养成分 [6-7],具有优化体内环境、消炎、抗菌、降低胆固醇、抗癌解毒、净化血液等作用 [8-9]。
本实验以蓝莓加工业的下脚料蓝莓果渣为原料,通过复合酶酶解、浓缩、复合发酵、真空冷冻干燥等工艺,制成蓝莓果渣酵素成品,提高了蓝莓的利用率,延伸了蓝莓深加工产业链 [10]。蓝莓果渣酵素作为一种新型的食品,同时还可以作为添加剂用在化妆品中,能够明显提高产品品质,因此具有非常广阔的应用前景。
1.1 材料与试剂
蓝莓果渣由辽宁省农产品深加工重点实验室冷冻保存。
葡萄酒、果酒专用酵母 湖北安琪酵母股份有限公司;干酪乳杆菌(Lactobacillus casei Zhang) 内蒙古普泽生物制品有限责任公司。
β-葡聚糖酶(酶活力20 000 U/g)、木聚糖酶(酶活力50 000 U/g)、纤维素酶(酶活力50 000 U/g);果胶酶(酶活力100 000 U/g) 江苏锐阳生物科技有限公司。
1.2 仪器与设备
CR21G高速冷冻离心机 日本日立公司;手持式折光仪 河北润联科技开发有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HZP-250型全温振荡培养箱 上海精宏实验设备有限公司;血球计数板 上海求精生化试剂仪器有限公司;真空冷冻干燥机 沈阳航天新阳速冻设备制造有限公司。
1.3 方法
1.3.1 工艺流程

1.3.1.1 复合酶酶解
采用β-葡聚糖酶、木聚糖酶、纤维素酶和果胶酶酶解蓝莓果渣,酶解成使微生物和人体易于利用的小分子糖类 [6,11]。复合酶酶解蓝莓果渣的工艺为:pH 5、料液比1∶2(m/V)、温度50 ℃、酶解时间180 min。加酶量按质量分数添加如下:纤维素酶1%、果胶酶0.5%、β-葡聚糖酶-木聚糖酶(1∶2,m/m)加酶量为0.5% [12-13]。
1.3.1.2 菌种的活化和培养
酵母菌:用0.5 mL生理盐水溶解酵母菌粉,使菌体溶解成悬浮液状态,然后将菌液在酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基上进行涂布,在30 ℃恒温培养箱内培养2~3 d。菌种经过冷冻干燥后,生长延迟期较长,故需经过两次继代培养,菌液待用 [14-16]。
干酪乳杆菌:采用MRS培养基,其他活化、培养方法同酵母菌。
1.3.1.3 发酵液制备
将经复合酶酶解后的酶解液用旋转蒸发仪浓缩到可溶性固形物质量分数为20% [6,17-18]。按质量分数补充以下营养物质:酵母膏0.2%、碳酸铵0.8%、磷酸氢钾1.7%、磷酸钙0.02%、硫酸镁0.02%。
1.3.1.4 接种和发酵
在30 ℃、pH 3.5条件下接种0.15%酵母菌到发酵液,酵母菌初始活菌浓度为2.03×10 5CFU/mL左右,发酵16 h。然后在37 ℃条件下,接种0.50%干酪乳杆菌,发酵液初始干酪乳杆菌活菌浓度为0 CFU/mL,静置发酵24 h,最后保持温度在18~20 ℃左右,静置24 h,进行后发酵,使发酵液产香 [19-21]。
1.3.1.5 真空冷冻干燥
将发酵液可溶性固形物质量分数浓缩到30%,通过真空冷冻干燥得到水分质量分数小于5%的蓝莓果渣酵素粉。真空冷冻干燥条件:冷冻温度为-20 ℃,真空度为10~20 Pa,冷阱温度为-45 ℃ [9]。
1.3.2 测定方法
蛋白酶活力的测定参照SB/T 10317—1999《蛋白酶活力测定法》;SOD活力测定参照GB/T 5009.171—2003《保健食品中超氧化物歧化酶活性的测定》;脂肪酶活力测定参照GB/T 23535—2009《脂肪酶制剂》;酵母菌菌体浓度的测定采用血球计数板法;干酪乳杆菌菌体浓度的测定参照GB 4789.35—2010《食品微生物学检验 乳酸菌检验》;还原糖含量的测定参照GB/T 5009.7—2008《食品中还原糖的测定》;可滴定酸度测定参照GB/T12456—2008《食品中总酸的测定》;总酚含量的测定参考蒋增良等 [5]的方法;总花色苷含量的测定参考Mahideen [7]和Wang [12]等的方法,pH示差法测总花色苷含量;水分含量的测定参照GB 5009.3—2010《食品中水分的测定》;可溶性固形物含量采用手持折光仪测定。
1.3.3 酵母菌发酵单因素试验
1.3.3.1 发酵温度的确定
在保证蓝莓果渣发酵液充分溶氧的前提下,酵母菌接种量为0.20%,分别控制在21、23、25、27、29 ℃条件下进行发酵,发酵时间为16 h,发酵结束后测定酵母菌浓度和蛋白酶活力,确定最适的酵母菌发酵温度。
1.3.3.2 初始pH值的确定
蓝莓发酵液自身的pH值在3.3左右,本试验所用的葡萄酒酵母适宜在微酸性环境下生长。在保证蓝莓果渣发酵液充分溶氧的前提下,控制发酵温度为25 ℃,酵母菌接种量为0.20%,用CaCO 3调节发酵液酸度,分别在pH 3.6、3.8、4.0、4.2、4.5条件下进行发酵,发酵时间为16 h。发酵结束后测定酵母菌浓度和蛋白酶活力,确定最适的发酵初始pH值。
1.3.3.3 接种量的确定
保证蓝莓果渣发酵液充分溶氧,控制发酵温度为25℃,pH 4.0,分别接种0.10%、0.15%、0.20%、0.25%、0.30%酵母菌进行发酵,发酵时间为16 h。发酵结束后测定酵母菌浓度和蛋白酶活力,确定最适的酵母菌接种量。
1.3.3.4 发酵时间的确定
保证蓝莓果渣发酵液充分溶氧,控制发酵温度为25 ℃,酵母菌接种量为0.15%,pH 4.0,发酵时间分别设置为8、16、24、32、40 h,发酵结束后测定酵母菌浓度和蛋白酶活力,确定最适的发酵时间。
1.3.3.5 正交试验
根据单因素试验结果,发酵温度、发酵时间、初始pH值、酵母菌接种量是影响酵母菌发酵的主要因素。故以此四因素设计L 9(3 4)正交试验,以酵母菌数量和蛋白酶活力为评价指标,确定酵母菌发酵的最佳工艺条件。
1.3.4 干酪乳杆菌发酵单因素试验
1.3.4.1 发酵温度的确定
为确定干酪乳杆菌在蓝莓果渣发酵液中的最适发酵温度,干酪乳杆菌接种量为0.50%,分别在33、35、37、39、41、43、45 ℃条件下进行发酵,发酵时间为20 h,发酵结束后测定干酪乳杆菌浓度和可滴定酸度。
1.3.4.2 接种量的确定
为确定干酪乳杆菌在蓝莓果渣发酵液中的最适接种量,在发酵温度37 ℃,发酵时间20 h的条件下,接种量分别设为0%、0.25%、0.50%、0.75%、1.00%、1.25%,发酵结束后测定干酪乳杆菌浓度和可滴定酸度。
1.3.4.3 发酵时间的确定
为确定干酪乳杆菌在蓝莓果渣发酵液中的最适发酵时间,在接种量0.50%、发酵温度37 ℃条件下,发酵时间分别设置为10、15、20、25、30、35 h,发酵结束后测定干酪乳杆菌浓度和可滴定酸度。
1.3.5 复合发酵中干酪乳杆菌最佳接种时间的确定
由于干酪乳杆菌利用发酵基质中营养成分的速率比酵母菌快,所以先接种酵母菌发酵,然后再接种干酪乳杆菌进行发酵 [17,22-23]。在25 ℃条件下,保证蓝莓果渣发酵液充分溶氧,先进行酵母菌发酵,发酵时间设定为8、16、24 h,然后再在37 ℃条件下接种干酪乳杆菌,总发酵时间设定为40 h。通过测定酵母菌浓度、干酪乳杆菌浓度、蛋白酶活力、总花色苷含量、总酚含量和还原糖含量,确定干酪乳杆菌的最佳接种时间。
1.4 数据处理
每次实验均进行3 次重复操作,所有实验数据采用SPSS 16.0统计软件对结果进行显著性分析,处理结果均以
 表示,图表制作利用Excel 2007软件。
表示,图表制作利用Excel 2007软件。
2.1 酵母菌发酵单因素试验
2.1.1 发酵温度对酵母菌发酵的影响
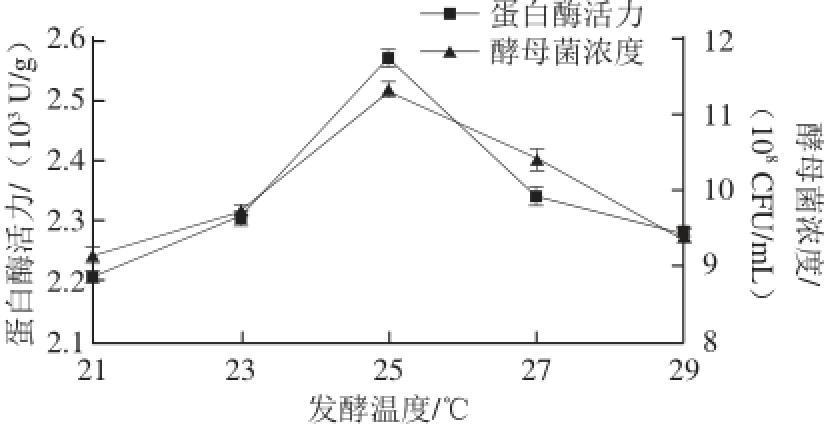
图1 温度对酵母菌发酵的影响
Fig. 1 Effect of fermentation temperature on yeast biomass and protease activity
由图1可知,温度在21 ℃时发酵速率慢,随着温度的升高,发酵速率加快。当温度超过25 ℃时,随着发酵温度的升高,发酵速率明显降低。所以发酵温度控制在25 ℃,酵母菌浓度和蛋白酶活力最高。
2.1.2 初始pH值对酵母菌发酵的影响

图2 初始pH值对酵母菌发酵的影响
Fig. 2 Effect of initial pH on yeast biomass and protease activity
由图2可知,随着pH值的升高,发酵速率逐渐加快,当pH值超过4.0后,随着pH值的升高,酵母菌浓度和蛋白酶活力逐渐降低。所以初始pH值为4.0时,蛋白酶活力达到最大值2 542.1 U/g,酵母菌浓度也达到最大值11.2×10 8CFU/mL,所以确定该酵母的最适初始pH值为4.0。
2.1.3 酵母菌接种量对酵母菌发酵的影响
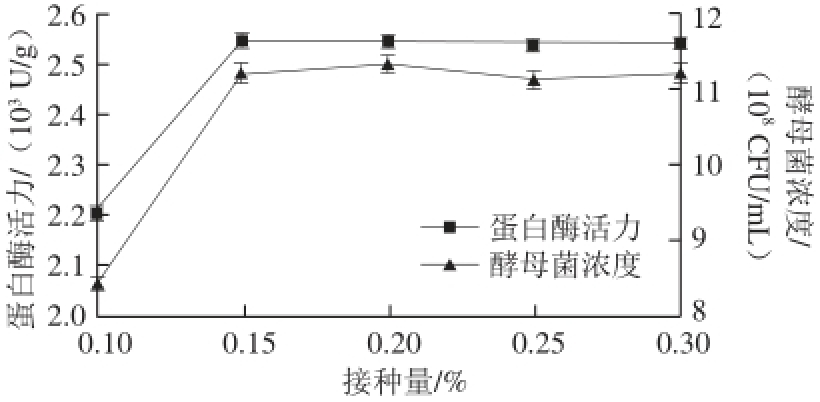
图3 接种量对酵母菌发酵的影响
Fig. 3 Effect of inoculum amount on yeast biomass and protease activity
由图3可知,随着酵母菌接种量的增加,发酵液中的酵母菌浓度和蛋白酶活力随之提高,当接种量为0.15%时,酵母菌浓度和蛋白酶活力分别达到11.2×10 8CFU/mL和2 545.2 U/g,当接种量超过0.15%后,酵母菌数量和蛋白酶活力基本保持不变。考虑到经济等因素,将酵母菌的最适接种量定为0.15%。
2.1.4 发酵时间对酵母菌发酵的影响
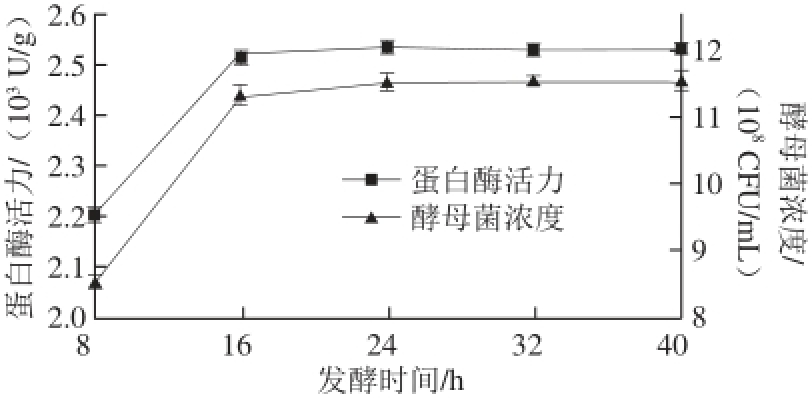
图4 发酵时间对酵母菌发酵的影响
Fig. 4 Effect of fermentation time on yeast biomass and protease activity
由图4可知,随着发酵时间的延长,发酵液中酵母菌浓度和蛋白酶活力逐渐提高,16 h以后,酵母菌浓度和蛋白酶活力增长缓慢,故将发酵时间定为16~24 h。
2.2 酵母菌发酵工艺条件优化
由表1极差值分析,影响酵母菌数量的因素主次顺序为A>B>D>C,发酵温度对酵母菌生长有很大影响,是主要控制因素,其次是发酵时间,最优组合是A 3B 1D 2C 3。对蛋白酶活力而言,极差影响酵母产蛋白酶的活性的因素主次顺序为A>B>C>D,而且最优组合也是A 3B 1D 2C 3。综合来说,试验指标越大越好,对因素A、B分析,确定优水平为A 3、B 1,因素C的水平改变对试验结果影响不大,从经济角度考虑,选择C 1,因素D选择D 2。故最佳配方为A 3B 1D 2C 1,即发酵温度为30 ℃,发酵时间为16 h,接种量为0.15%,初始pH 3.5。
表1 L 1 L 9(33 4)正交试验设计与结果Table 1 Le 1 L 9(3(3 4) Orthogonal array design with experimental values of ) Orthogonal array design with experimental values of yeast biomass and protease activity
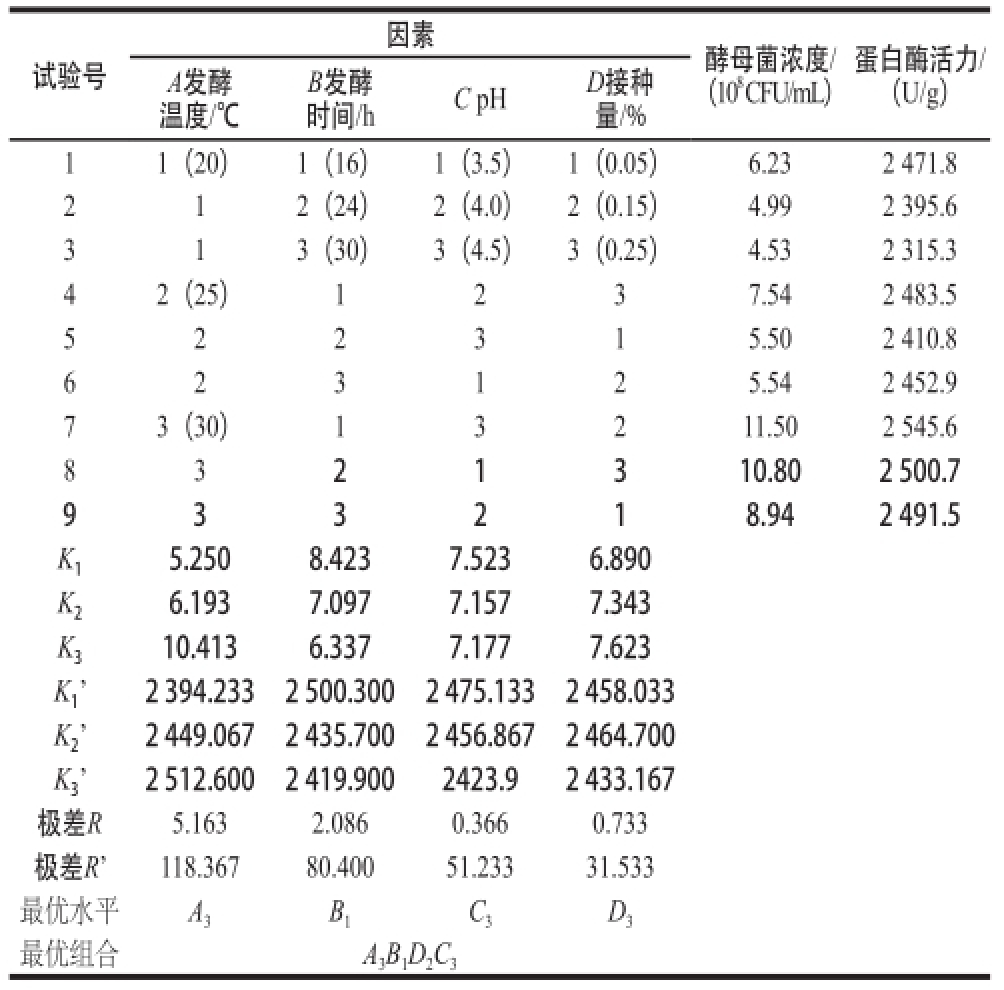
时间/hC pHD接种量/% 11(20)1(16)1(3.5)1(0.05)6.232 471.8 212(24)2(4.0)2(0.15)4.992 395.6 313(30)3(4.5)3(0.25)4.532 315.3 42(25)1237.542 483.5 522315.502 410.8 623125.542 452.9 73(30)13211.502 545.6 8321310.802 500.7 933218.942 491.5 K 15.2508.4237.5236.890 K 26.1937.0977.1577.343 K 310.4136.3377.1777.623 K 1’2 394.2332 500.3002 475.1332 458.033 K 2’2 449.0672 435.7002 456.8672 464.700 K 3’2 512.6002 419.9002423.92 433.167极差R5.1632.0860.3660.733极差R’118.36780.40051.23331.533最优水平A 3B 1C 3D 3最优组合A 3B 1D 2C 3试验号A发酵温度/℃B发酵因素酵母菌浓度/(10 8CFU/mL)蛋白酶活力/(U/g)
2.3 干酪乳杆菌发酵单因素试验
2.3.1 发酵温度对干酪乳杆菌发酵的影响
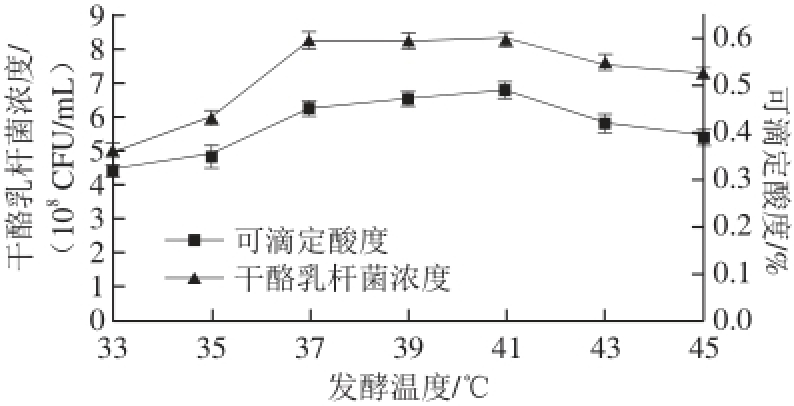
图5 发酵温度对干酪乳杆菌发酵的影响
Fig. 5 Effect of fermentation temperature on Lactobacillus casei fermentation
由图5可知,随着前期发酵温度的升高,发酵速率加快,在37~41 ℃之间,干酪乳杆菌浓度和可滴定酸度变化不大,当温度超过41 ℃,随着温度的升高,发酵液中干酪乳杆菌浓度和可滴定酸度随之降低,所以干酪乳杆菌最适发酵温度为37~41 ℃。
2.3.2 接种量对干酪乳杆菌发酵的影响
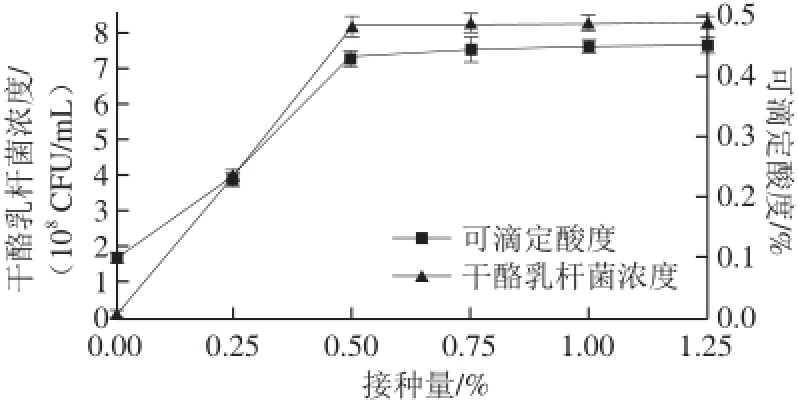
图6 接种量对干酪乳杆菌发酵的影响
Fig. 6 Effect of inoculum amount on Lactobacillus casei fermentation
由图6可知,随着干酪乳杆菌接种量的增加,发酵液中的干酪乳杆菌浓度和可滴定酸度随之提高,当接种量为0.50%时,干酪乳杆菌浓度和可滴定酸度分别达到8.21×10 8CFU/mL和0.43%,当接种量超过0.50%后,干酪乳杆菌浓度和可滴定酸度基本保持不变。故干酪乳杆菌的最适接种量为0.50%。
2.3.3 发酵时间对干酪乳杆菌发酵的影响
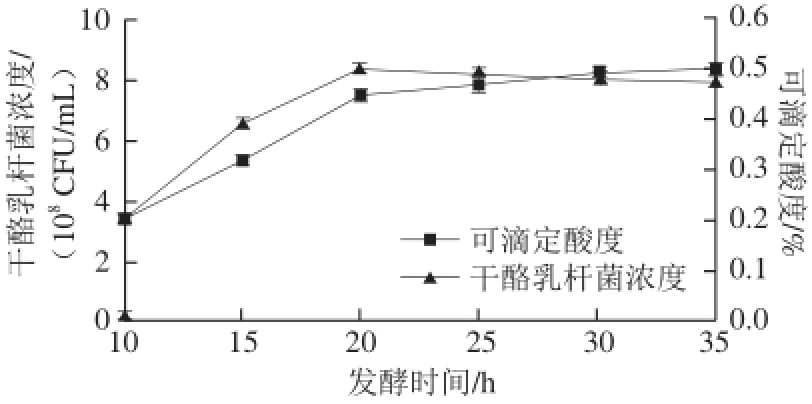
图7 发酵时间对干酪乳杆菌发酵的影响
Fig. 7 Effect of fermentation time on Lactobacillus casei fermentation
如图7所示,在蓝莓果渣发酵液中接种干酪乳杆菌后,随着发酵时间的延长,干酪乳杆菌浓度和可滴定酸度不断增大,在20 h时,干酪乳杆菌活菌数是8.26×10 8CFU/mL,此时干酪乳杆菌活菌数达到最大值,随着时间的延长,干酪乳杆菌活菌数逐渐降低,故将发酵时间定为20 h。
2.4 复合发酵中干酪乳杆菌的接种时间
表2 干酪乳杆菌接种时间对发酵液的影响
Table 2 Effect off Lactobacillus caasseeii inoculation time on fermentation broth
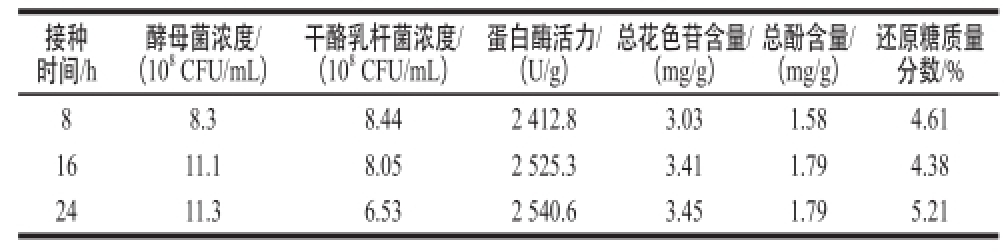
接种时间/h还原糖质量分数/% 88.38.442 412.83.031.584.61 1611.18.052 525.33.411.794.38 2411.36.532 540.63.451.795.21酵母菌浓度/(10 8CFU/mL)干酪乳杆菌浓度/(10 8CFU/mL)蛋白酶活力/(U/g)总花色苷含量/(mg/g)总酚含量/(mg/g)
由表2可知,当酵母菌发酵8 h后再接种干酪乳杆菌,发酵液中干酪乳杆菌的浓度最高,但是酵母菌浓度、蛋白酶活力和总花色苷等指标较低。当酵母菌发酵16 h后再接种干酪乳杆菌,发酵液中酵母菌浓度、干酪乳杆菌浓度、蛋白酶活力、总花色苷含量等指标较高。当酵母菌发酵24 h后在接种干酪乳杆菌,虽然酵母菌浓度、蛋白酶活力和总花色苷含量最高,但发酵液中干酪乳杆菌浓度较低。综合以上各因素,干酪乳杆菌最佳接种时间为酵母菌发酵16 h后。然后在37 ℃条件下,静置发酵24 h,温度保持在18~20 ℃左右,进行24 h的后发酵,在此条件下制得的发酵液中干酪乳杆菌浓度为8.05×10 8CFU/mL,蛋白酶活力为2 525.3 U/g。
2.5 真空冷冻干燥制得蓝莓果渣酵素产品质量指标
2.5.1 感官指标
色泽:蓝紫色、有光泽、且颜色均匀;气味:具有蓝莓特有的果香味,并伴有发酵香味;酸度:酸味纯正、持久不刺激;组织形态:松散无结块。
2.5.2 理化指标
水分含量≤5%、蛋白酶活力≥(3 675±10) U/g、SOD活力≥(515±10) U/g、脂肪酶活力≥(45±5) U/g、干酪乳杆菌浓度≥(8.5±0.5)×10 8CFU/g。
本实验以蓝莓果酒酿制过程中废弃的蓝莓果渣为原料,利用酵母菌和干酪乳杆菌进行复合发酵。通过对蓝莓果渣发酵制备酵素的工艺进行优化,得到了复合发酵的工艺条件:发酵液在温度30 ℃,初始pH 3.5的条件下接种0.15%酵母菌,发酵16 h。然后在37 ℃条件下,接种0.50%干酪乳杆菌,静置发酵24 h,最后保持温度在18~20 ℃左右,静置,进行24 h的后发酵,使发酵液产香。在该条件下制得的蓝莓果渣酵素香气清爽、具有发酵香味、酸味纯正、松散、有光泽。相较于市场上的酵素类产品,本实验制得的蓝莓果渣酵素粉剂中的蛋白酶活力、SOD活力、脂肪酶含量均有显著提高,同时采用真空冷冻干燥工艺,使产品中的益生菌得到有效保留,提高了产品品质。今后的研究中,还可以利用不同的酵母菌和其他种类益生菌进行发酵,或将其他蓝莓产品加工过程中废弃的蓝莓果渣用以制备蓝莓果渣酵素,使资源得到有效利用。
参考文献:
[1] 李斌, 矫馨瑶, 孟宪军, 等. 蓝莓果脯真空渗糖工艺研究[J]. 沈阳农业大学学报, 2014, 45(5): 552-558. DOI:10.3969/j.issn.1000-1700.2014.05.009.
[2] 陈介甫, 李亚东, 徐哲. 蓝莓的主要化学成分及生物活性[J]. 药学学报, 2010, 45(4): 422-429.
[3] 曹雪丹, 方修贵, 赵凯, 等. 蓝莓花色苷研究进展[J]. 中国农学通报, 2012, 28(15): 221-226. DOI:10.3969/j.issn.1000-6850.2012.15.043.
[4] 毛建卫, 吴元锋, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯, 2010, 39(3): 42-44. DOI:10.3969/j.issn.1674-2214.2010.03.018.
[5] 蒋增良, 毛建卫, 黄俊, 等. 蓝莓酵素在天然发酵过程中抗氧化性能的变化[J]. 食品工业科技, 2013, 34(2): 194-197; 201. DOI:10.13386/ j.issn1002-0306.2013.02.059.
[6] 董洁, 夏敏敏, 王成忠, 等. 金丝小枣枣泥酵素发酵工艺的研究[J].食品工业科技, 2014, 35(2): 197-200; 205. DOI:10.13386/ j.issn1002-0306.2014.02.034.
[7] MOHIDEEN F W, KEVIN M S, LI J , et al. Effect of continuous ultrasonication on microbial counts and physico-chemical properties of blueberry (Vaccinium corymbosum) juice[J]. LWT-Food Science and Technology, 2015, 60(1): 563-570. DOI:10.1016/j.lwt.2014.07.047.
[8] 李颖畅, 孟宪军, 孙靖靖, 等. 蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业, 2008, 34(10): 44-48. DOI:10.13995/j.cnki.11-1802/ ts.2008.10.040.
[9] 许晴晴, 陈杭君, 郜海燕, 等. 真空冷冻和热风干燥对蓝莓品质的影响[J]. 食品科学, 2014, 35(5): 64-68. DOI:10.7506/spkx1002-6630-201405013.
[10] 李丽敏, 吴林. 蓝莓深加工的研究进展[J]. 中国农机化学报, 2014, 35(4): 174-179. DOI:10.13733/j.jcam.issn.2095-5553.2014.04.043.
[11] 仇小妹, 王英, 董明盛, 等. 复合酶酶解对蓝莓出汁率及总抗氧化能力的影响[J]. 食品科学, 2013, 34(24): 25-29. DOI:10.7506/spkx1002-6630-201324005.
[12] WANG S Y, CHEN H J, EHLENFELDT M K. Variation in antioxidant enzyme activities and nonenzyme components among cultivars of rabbiteye blueberries (Vaccinium ashei Reade) and V. ashei derivatives[J]. Food Chemistry, 2011, 129(1): 13-20. DOI:10.1016/ j.foodchem.2010.11.126.
[13] 李斌, 雷月, 孟宪军, 等. 响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J]. 食品科学, 2015, 36(22): 33-39. DOI:10.7506/spkx1002-6630-201522006.
[14] 李加兴, 孙金玉, 陈双平, 等. 猕猴桃果醋发酵工艺优化及质量分析[J].食品科学, 2011, 23(24): 306-310.
[15] 马宏慧, 孔保华, 夏秀芳, 等. 干酪乳杆菌KLDS1.0381高密度培养条件研究[J]. 东北农业大学学报, 2012, 43(2): 13-19. DOI:10.3969/ j.issn.1005-9369.2012.02.003.
[16] 盖禹含, 辛秀兰, 李浡, 等. 蓝莓果酒发酵工艺条件的研究[J]. 食品工业, 2010, 31(2): 44-46.
[17] SEUNG H S , CHANG S N, DAE H Y, et al. Effectiveness of banana additions for completion of stuck and sluggish fermentation of blueberry wine[J]. LWT-Food Science and Technology, 2015, 64(2): 1143-1148. DOI:10.1016/j.lwt.2015.07.038.
[18] 曲宝妹. 利用蓝莓发酵副产物制作低糖果酱的工艺研究[D]. 青岛:中国海洋大学, 2014: 14-19.
[19] YU Keda, ZHU Kaili, YE Meijuan, et al. Heat tolerance of highbush blueberry is related to the antioxidative enzymes and oxidative protein-repairing enzymes[J]. Scientia Horticulturae, 2016, 198: 36-43. DOI:10.1016/j.scienta.2015.11.018.
[20] SU M S, CHIEN P J. Antioxidant activity, anthocyanins, and phenolics of rabbiteye blueberry (Vaccinium ashei) f uid products as affected by fermentation[J]. Food Chemistry, 2007, 104(1): 182-187. DOI:10.1016/j.foodchem.2006.11.021.
[21] ŚCIBISZ I, ZIAMO M, MITEK M, et al. Effect of probiotic cultures on the stability of anthocyanins in blueberry yoghurts[J]. LWTFood Science and Technology, 2012, 49(2): 208-212. DOI:10.1016/ j.lwt.2012.06.025.
[22] 张玲, 左广垒, 刘子菱, 等. 比较蓝莓发酵酒、浸泡酒和蓝莓果间总酚、总黄酮及DPPH的差异[J]. 食品科技, 2015, 40(1): 68-72. DOI:10.13684/j.cnki.spkj.2015.01.015.
[23] 王行, 张海宁, 马永昆, 等. 蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J]. 现代食品科技, 2015, 31(1): 90-95. DOI:10.13982/j.mfst.1673-9078.2015.1.017.
Fermentation of Blueberry Pomace for the Production of Biomass and Protease Activity
YANG Peiqing
1, LI Bin
1,*, YAN Tingcai
1, MENG Xianjun
1, ZHI Hongtao
2, LI Sheng
3, YIN Xiuyan
4, WANG Weisheng
5, GAO Ningxuan
1, CHOU Shurui
1, LI Enhui
1
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. Quality and Safety Center of Farm Product, Shenyang 110001, China; 3. College of Food Science, Southwest University, Chongqing 400715, China; 4. Tonghua Heyun Modern Agricultural Co. Ltd., Tonghua 134001, China; 5. Huangguan Blueberry Biological Technology Co. Ltd., Shenyang 110161, China)
Abstract:In this experiment, the fermentation of blueberry pomace was optimized to improve the quality of fermented products. The fermentation parameters inoculum quantity, temperature, initial pH and fermentation time were selected to investigate their effects on yeast biomass and protease activity and to carry out the optimization experiments using onefactor-at-a-time and orthogonal array methods. The optimal fermentation conditions were determined as follows: yeast fermentation of blueberry pomace was conducted for 16 h at 30 ℃ with an inoculum size of 0.15% at an initial pH of 3.5, and then the fermented mash was adjusted to pH 4.0 and inoculated with Lactobacillus casei at an inoculum size of 0.50% for further fermentation for 24 h at 18–20 ℃. Concentration and vacuum freeze drying of the f nal product gave a powder with an aroma and good quality.
Key words:blueberry pomace; ferment; fermentation; vacuum freezing drying
DOI:10.7506/spkx1002-6630-201623034
中图分类号:TS255.4
文献标志码:A
文章编号:1002-6630(2016)23-0205-06
引文格式:
杨培青, 李斌, 颜廷才, 等. 蓝莓果渣酵素发酵工艺研究[J]. 食品科学, 2016, 37(23): 205-210. DOI:10.7506/spkx1002-6630-201623034. http://www.spkx.net.cn
YANG Peiqing, LI Bin, YAN Tingcai, et al. Fermentation of blueberry pomace for the production of biomass and protease activity[J]. Food Science, 2016, 37(23): 205-210. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623034. http://www.spkx.net.cn
收稿日期:2016-01-24
基金项目:沈阳市科学技术局农业科技攻关专项(F16-137-3-00);辽宁省高等学校优秀人才支持计划项目(LJQ2014068);沈阳农业大学天柱山英才项目(2014);公益性行业(农业)科研专项(201303073-04)
作者简介:杨培青(1988—),男,硕士,研究方向为浆果深加工及功能食品开发。E-mail:479028547@qq.com
*通信作者:李斌(1979—),男,副教授,博士,研究方向为浆果深加工及功能食品开发。E-mail:libinsyau@163.com