益生菌Lactobacillus paracasei LC01对小鼠肠道菌群的调节作用
陆文伟
1,杨震南
2,丁历伟
2,叶佳蓉
2,田丰伟
1,陈 卫
1,*
(1.江南大学食品学院,江苏 无锡 214000;2.杭州味全食品有限公司,浙江 杭州 310018)
摘 要:探讨益生菌Lactobacillus paracasei LC01对小鼠肠道菌群的调节作用。将32 只Balb/c小鼠随机分成4 组,分别作为对照组、灌胃LC01灭活菌组、灌胃LC01活菌组和活菌定殖组。干预2 周后,通过MiSeq高通量测序手段,分析不同处理条件下小鼠肠道菌群变化。结果表明:相对于对照组和灌胃灭活菌组,灌胃LC01活菌可以显著提高小鼠肠道内Lactobacillus属、Ruminococcaceae_UCG014属、Alistpes属的相对含量。进一步通过荧光定量聚合酶链式反应和群落聚类分析发现,灌胃LC01活菌不但可以显著提高小鼠肠道内乳酸菌LC01的相对含量,同时可以促进小鼠肠道中格氏乳杆菌、罗伊氏乳杆菌和唾液乳杆菌的增殖。在活菌定殖组中,停止灌胃2 周后,小鼠粪便中不能检测到菌株LC01,说明菌株LC01不能在小鼠肠道内长期定殖。以上结果表明菌株LC01对肠道小鼠菌群结构具有一定的调节作用,具有潜在的益生作用和应用价值。
关键词:益生菌;副干酪乳杆菌;高通量测序;肠道菌群
人体和动物肠道为微生物的生长和繁殖提供了良好的栖息环境,肠道微生物是被忽视的“微生物器官”
[1]。越来越多的研究发现,肠道微生态失调会引发肥胖、肠易激综合症、动脉粥样硬化、糖尿病、抑郁症等疾病
[2-4]。联合国粮食及农业组织/世界卫生组织指出益生菌是一类活的微生物,摄入足量益生菌会对宿主健康有益。益生菌的功效包括维持肠道内环境稳态、拮抗肠道致病菌、重建失调的肠道菌群、调节肠道免疫系统、遏制毒性因子对肠道的损害、保证肠道营养代谢等
[5-8]。
伴随着脉冲场凝胶电泳、末端限制性片段长度多态性分析、变性梯度凝胶电泳及实时荧光定量聚合酶链式反应等分子生物学手段的应用和高通量测序技术的成熟
[3,9-12],肠道微生物的多态性分析及定性定量研究取得了重大突破,进一步深入阐明了肠道微生态的结构和功能
[13]。
益生菌对肠道微生态平衡起着重要作用。因此筛选具有优良益生特性的益生菌菌株己经成为研究热点
[14]。益生菌Lactobacillus paracasei LC01具有良好的耐酸耐胆盐特性,并且通过口服实验证实是一株安全有效的益生菌株
[15-16]。本研究以小鼠为实验动物,通过灌胃Lactobacillus paracasei LC01,结合高通量测序技术分析灌胃前后的肠道菌群差异,评价菌株LC01对小鼠肠道菌群的影响,探讨益生菌Lactobacillus paracasei LC01对肠道微生态的调节作用。
1 材料与方法
1.1 材料与试剂
清洁级B a l b/c雄性小鼠3 2 只(合格证号2015000506106,许可证号码:SCXK(沪)2012-0002),体质量(18.138±0.895) g 南京大学模式动物研究所。
L. paracasei LC01 杭州味全食品有限公司;MRS培养基 青岛海博生物技术有限公司;土壤基因组提取试剂盒 美国MP Biomedicals公司;本研究所用引物购于生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。
1.2 仪器与设备
GRP-9160型隔水式恒温培养箱 上海森信实验仪器有限公司;RC BIOS 10型冷冻离心机 赛默飞世尔科技(中国)有限公司;FE-20型pH计 瑞士梅特勒-托利多公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 菌悬液制备
采用MRS液体培养基,37 ℃条件下静止培养L. paracasei LC01,生长至稳定前期时,室温条件下5 000 r/min离心5 min收集菌体,菌体沉淀用pH 7.4磷酸盐缓冲液(NaCl 137 mmol/L、KCl 2.7 mmol/L、Na
2HPO
410 mmol/L、KH
2PO
42 mmol/L)清洗后,制成10
9CFU/mL菌体悬液,LC01灭活菌组灌胃的菌株则通过高压蒸汽灭菌处理。
1.3.2 动物分组及处理条件
Balb/c小鼠随机平均分为4 组:对照组、LC01灭活菌组、LC01活菌组、活菌定殖组,具体分组和处理条件如表1所示,适应性饲养1 周后进行正式实验,分别灌胃磷酸盐缓冲液、LC01灭活菌和LC01活菌。
表1 小鼠分组及处理情况
Table 1 Grouping and treatment of mice

分组分组描述分组情况对照组1~15 d,每天每只灌胃磷酸盐缓冲液100 μL2 只/笼,共4 笼灭活菌组1~15 d,每天每只灌胃灭活LC01菌悬液100 μL(1×10
9CFU/mL)2 只/笼,共4 笼LC01活菌组1~15 d,每天每只灌胃活性LC01菌悬液100 μL(1×10
9CFU/mL)2 只/笼,共4 笼LC01定殖组1~15 d,每天每只灌胃活性L C01菌悬液100 μL(1×10
9CFU/mL)16~28 d,正常饲养2 只/笼,共4 笼
1.3.3 小鼠粪便宏基因组提取
分别收集灌胃前、灌胃后和停止灌胃2 周后的小鼠粪便,使用MP土壤基因组提取试剂盒提取小鼠粪便的宏基因组。具体方法按照试剂盒说明书进行。
1.3.4 16S rRNA扩增分析
通过N a n o D r o p 2 0 0 0和琼脂糖凝胶电泳来评价上述宏基因组的提取效果,通过引物5 1 5 F(5’-G T G C C A G C M G C C G C G G-3’)和9 0 7 R(5’-CCGTCAATTCMTTTRAGTTT-3’)扩增细菌16S rRNA的515-906区域。进一步将得到的PCR产物构建MiSeq测序文库,通过MiSeq测序分析每条序列信息,并通过一定的质控手段,去除不符合要求的测序结果,最终的有效测序结果用于分析小鼠肠道微生物多样性。
1.3.5 荧光定量聚合酶链式反应(polymerase chain reaction,PCR)
以1 6 S r R N A为检测的靶向基因,通过L. p a r a c a s e i种特异性引物p a r a c a s e i F(5’-GCACCGAGATTCAACATGG-3’)和paracaseiR(5’-GGTTCTTGGATYTATGCGGTATTAG-3’)进行荧光定量PCR
[17]。通过2
—ΔΔCt法测定目的菌株在不同组别和灌胃前后的丰度差异。
1.4 数据统计分析
实验中不同组之间的差异显著性通过Graphpad Prism 6.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)判断(Tukey’s检验),P<0.05则认为差异显著。
2 结果与分析
2.1 菌株LC01调节小鼠肠道菌群结构

图1 小鼠肠道菌群结构PCA(A)和PcoA(B)分析
Fig. 1 Principal component analysis (A) and principal co-ordinates analysis (B) of the intestinal microbiota structure in mice
由图1可知,物种多样性已经饱和,测序深度满足分析要求。进一步的生物信息学分析发现,小鼠肠道微生物菌群在属水平上以拟杆菌属为优势菌群,不同个体间其含量在30.5%~58.1%范围内。厚壁菌门中的Lachnospiraceae_NK4A136_group和乳杆菌属在小鼠肠道中的相对含量较高,可以达到总菌数的10%左右,但是不同个体间的相对含量差异显著。通过Chao和Ace指标分析发现,小鼠菌群丰度没有发生显著改变;Shannon和Simpson指数则表明,菌群多样性在灌胃前后也没有显著改变。进一步通过主成分分析(principal component analysis,PCA)和主坐标分析(principal co-ordinates analysis,PcoA)对照组、灌胃活菌和灌胃死菌在灌胃前后的菌群结构差异。结果显示,相对于对照组,LC01活菌组和LC01灭活菌组在灌胃后菌群结构组成发生一定的偏移。说明灌胃LC01活菌和灭活菌对小鼠肠道中的菌群结构具有一定调节作用,但是并不能改变小鼠肠道中的优势菌群。这一结果和West等
[18]的研究结果一致,外源补充益生菌不会显著改变肠道菌群结构。
2.2 菌株LC01对小鼠肠道菌群不同种属相对含量的影响
进一步比较各个实验组在灌胃前后小鼠肠道菌群中不同种属相对含量的变化。结果如图2所示,对照组、LC01活菌组和LC01灭活菌组在灌胃前后,拟杆菌是小鼠肠道中的优势菌群。分析发现,相对于对照组和LC01灭活菌组,LC01活菌组中的部分菌属的相对含量在灌胃后出现了显著增长。

图2 灌胃前后小鼠肠道菌群在属水平上的丰度变化
Fig. 2 Changes in the abundance of intestinal microbiota at genus level before and after gavage
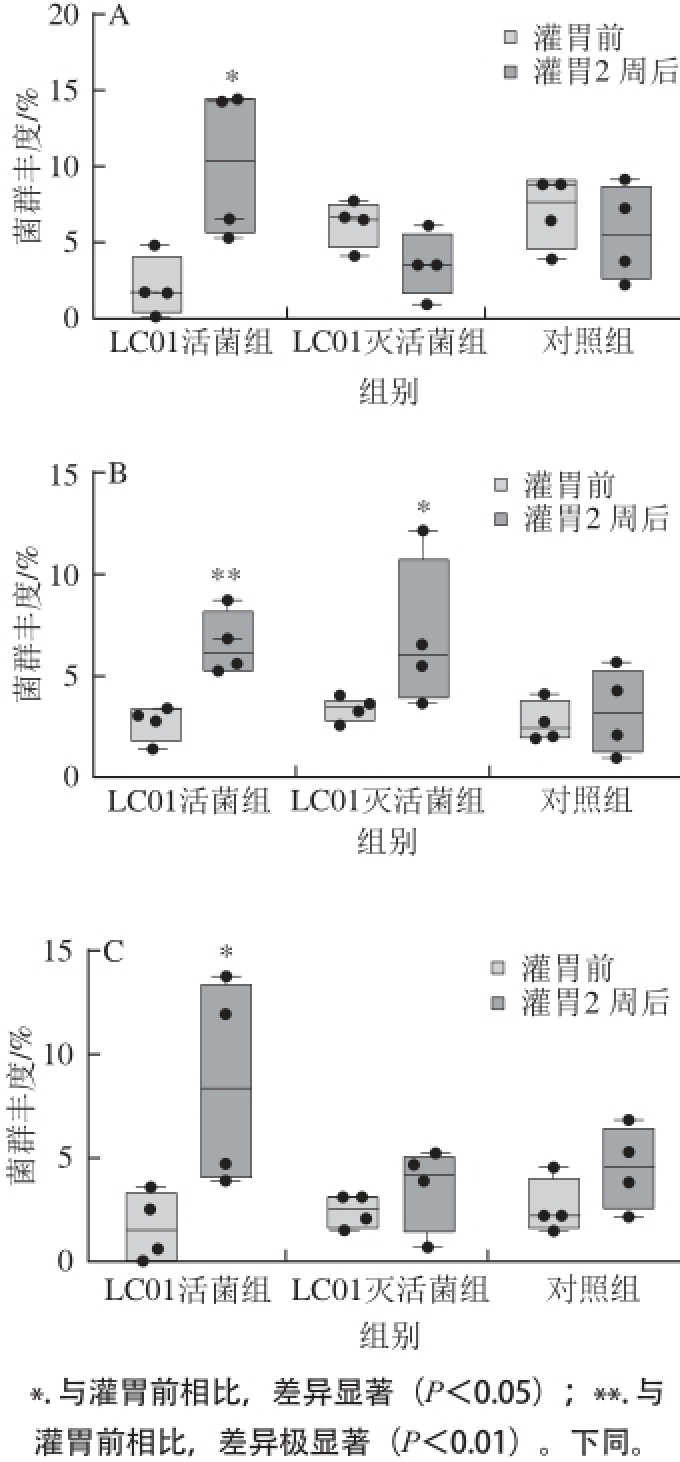
图3 菌株LC01对小鼠肠道中乳杆菌属(A)、Alistipes属(B)和Ruminococcaceae_UCG-014属(C)的影响
Fig. 3 Effect of LC01 on the abundance of Lactobacillus (A), Alistipes (B) and Ruminococcaceae_UCG-014 (C)
由图3A可知,小鼠粪便中乳杆菌属的相对含量较高,在部分小鼠肠道内乳杆菌属的丰度可以达到肠道菌群总数的10%左右。持续灌胃LC01活菌组2 周后,可以显著提高小鼠肠道中乳杆菌属的相对含量,LC01活菌组中小鼠肠道中乳杆菌相对含量分别从2.1%(中位数,下同)、0.1%(最低值,下同)、4.8%(最高值,下同)提高到10.1%、5.3%、14.4%(P<0.05),不同个体间存在很大差异。说明灌胃LC01活菌可以显著提高小鼠肠道内乳杆菌属的相对含量。乳杆菌属的不同种具有显著的益生效果,可以抑制病原菌的生长,改善肠道菌群结构;增强机体免疫功能;降低胆固醇、改善血脂;减轻乳糖消化不良症状
[19-22]。由图3B可知,无论是灌胃LC01活菌组还是LC01灭活菌组,小鼠肠道内Alistipes属的相对含量显著提高,灌胃LC01活菌后,小鼠肠道内Alistipes属的相对含量从2.6%、1.3%、3.3%提高到6.5%、5.2%、8.7%(P<0.01);灌胃LC01灭活菌后,小鼠肠道内Alistipes属的相对含量从3.3%、2.6%、3.9%提高到6.9%、3.5%、12.1%(P<0.05)。而对照组小鼠肠道内Alistipes属的相对含量基本维持不变,从灌胃前的2.7%、1.9%、4.0%到灌胃后的3.2%、0.9%、5.6%。上述结果说明,菌株LC01的细胞组分可以选择性地促进小鼠肠道内Alistipes属的增殖。Dziarski等
[23]的研究发现,Alistipes finegoldii可以减缓肠道炎症,从而减少炎症性肠病的发生。同时Schubert等
[24]的研究则表明,Alistipes属的减少可以增加Clostridium difficile感染的风险。由图3C可知,灌胃LC01活菌组可以显著提高肠道中Ruminococcaceae_ UCG-014属的相对含量(P<0.05),但是个体间存在较大差异。2号样品和4号样品小鼠肠道菌群中Ruminococcaceae_UCG-014的相对含量从0.6%和3.6%分别提高到11.9%和13.8%,使Ruminococcaceae_UCG-014属成为小鼠肠道内相对优势的菌群;而1号样品和3号样品小鼠肠道菌群中Ruminococcaceae_UCG-014属的相对含量从2.5%和0.58%分别增加到3.9%和4.8%。而灌胃LC01灭活菌则不能够促进Ruminococcaceae_UCG-014属的增殖。上述结果说明,LC01活菌的代谢产物可以有效促进Ruminococcaceae_UCG-014属生长,使其成为小鼠肠道内的优势菌群。Jiang Haiyin等
[25]研究发现Ruminococcaceae中部分种属可能与抗抑郁相关,在重度抑郁人群中,Ruminococcaceae的相对含量显著减少。
2.3 菌株LC01对小鼠肠道内不同种属乳杆菌增殖的影响
由图4可知,将小鼠肠道菌群中所有乳杆菌属的分类单元(operational taxonomic unit,OTU)序列比对到乳杆菌属的16S rRNA文库,分析发现,小鼠粪便中乳杆菌属的OTU分布于多个不同种,主要有格式乳杆菌(OTU74)、罗伊氏乳杆菌(OTU929)和唾液乳杆菌(OTU1164)。灌胃2 周后,在LC01活菌组中出现了L. paracasei的OTU(OTU937),同时格式乳杆菌、罗伊氏乳杆菌和唾液乳杆菌的OTU序列显著增加(图4)。而在灭活菌组和对照组中,并未出现L. paracasei的OTU序列,并且其他乳杆菌的OTU序列也没有显著增加,说明灌胃LC01可以促进小鼠肠道中其他乳杆菌的生长。同时采用L. paracasei种属特异性引物进行定量PCR(quantitative PCR,qPCR),结果显示灌胃LC01活菌组的小鼠粪便中,L. paracasei的相对含量显著上升,提高了32.1 倍。当停止灌胃LC01菌株2 周后,菌株LC01的相对含量是灌胃前的1.7 倍,相对于灌胃前的水平没有显著性增加。qPCR结果表明菌株LC01不能够在小鼠肠道中长期定殖。进一步比对分析灌胃前后和停止灌胃后小鼠粪便中乳杆菌属OTU的分布情况,发现灌胃LC01活菌后可以检测到L. paracasei的OTU,停止灌胃2 周后,又不能检测到L. paracasei的OTU,再次表明菌株不能在小鼠肠道中长期定殖。

图4 不同组别小鼠肠道中乳杆菌属OTU序列数在灌胃前后的变化
Fig. 4 Changes in the number of OTU reads of Lactobacillus in different groups
2.4 菌株LC01在小鼠肠道中的定殖及对肠道菌群的持续性影响
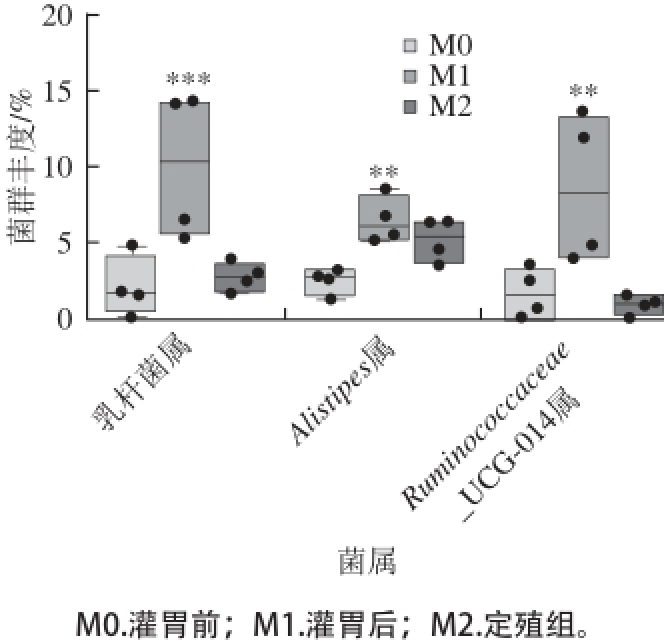
图5 菌株LC01对小鼠肠道内Lactobaciilllluuss属、Alisttiippeess属和Ruminococcaacceeaaee_UCG-014属相对含量的影响
Fig. 5 Effect of LC01 on the abundance of Lactobacillus, Alistipes and Ruminococcaceae_UCG-014 in the intestinal microbiota of mice
为了进一步研究菌株LC01在小鼠肠道中的定殖对肠道菌群的持续性影响,在停止灌胃LC01活菌2 周后,测定小鼠粪便中菌群的多样性,并和灌胃前和灌胃后的结果相比较(图5)。结果显示,停止灌胃LC01活菌后2 周(定殖组),小鼠肠道内菌群结构基本恢复到灌胃前。小鼠肠道内乳杆菌属的相对含量显著降低,恢复到灌胃前的水平;而小鼠肠道内Alistipes属的相对含量也出现明显的下降,Alistipes属的相对含量由灌胃后的6.5%、5.2%、8.7%降低到5.3%、3.6%、6.5%;而Ruminococcaceae_UCG-014属相对含量在停止灌胃2周后也显著降低,从灌胃后的8.6%、0.39%、13.8%降低到0.97%、0.14%、1.6%。说明灌胃LC活菌对小鼠肠道菌群结构具有一定的影响,但是这种改变需要持续不断地补充LC01活菌,当没有外源LC01活菌补充时,菌群结构又会回复到原来的水平。由此推测,乳酸菌LC01不能够在小鼠肠道中长期定殖,并持续影响小鼠正常菌群。
3 结 论
肠道菌群失调会引发一系列的疾病,肥胖、糖尿病、动脉粥样硬化、抑郁症等
[26-28]。通过外源补充益生菌对肠道微生态平衡具有显著的调节作用。本实验中,相对于对照组和LC01灭活菌组,灌胃LC01活菌可以显著改变小鼠肠道菌群。小鼠肠道中乳杆菌属的相对含量显著增加,进一步分析发现,灌胃菌株LC01不但可以增加小鼠肠道中菌株LC01的相对含量,同时可以提高小鼠肠道中格式乳杆菌、罗伊氏乳杆菌和唾液乳杆菌的相对含量。上述结果发现,活性乳酸菌LC01可以显著调节小鼠肠道菌群,从而改善小鼠肠道健康。说明菌株LC01是一株潜在的益生菌,可用于调节肠道菌群。
参考文献:
[1] CLARKE G, STILLING R M, KENNEDY P J, et al. Minireview: gut microbiota: the neglected endocrine organ[J]. Molecular Endocrinology, 2014, 28(8): 1221-1238. DOI:10.1210/me.2014-1108.
[2] HEMPEL S, NEWBERRY S J, MAHER A R, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis[J]. Journal of the American Medical, 2012, 307(18): 1959-1969. DOI:10.1001/jama.2012.3507.
[3] FRANK D N, St AMAND A L, FELDMAN R A, et al. Molecularphylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(34): 13780-13785. DOI:10.1073/pnas.0706625104.
[4] SANTOCCHI E, GUIDUCCI L, FULCERI F, et al. Gut to brain interaction in Autism Spectrum Disorders: a randomized controlled trial on the role of probiotics on clinical, biochemical and neurophysiological parameters[J]. BMC Psychiatry, 2016, 16(1): 183-202. DOI:10.1186/s12888-016-0887-5.
[5] DAVID L A, MAURICE C F, CARMODY R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505: 559-563. DOI:10.1038/nature12820.
[6] GIBSON G R, PROBERT H M, LOO J V, et al. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics[J]. Nutrition Research Reviews, 2004, 17(2): 259-275. DOI:10.1079/ NRR200479.
[7] NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336: 1262-1267. DOI:10.1126/science.1223813.
[8] DASTAR B, KHOSRAVI A, BOLDAJIE F, et al. Effect of calcium with and without probiotic, lactose, or both on organ and body weights, immune response and caecal microbiota in moulted laying hens[J]. Journal of Animal Physiology and Animal Nutrition. 2016, 100(2): 243-250. DOI:10.1111/jpn.12358.
[9] HJELMSO M H, HANSEN L H, BAELUM J, et al. High-resolution melt analysis for rapid comparison of bacterial community compositions[J]. Applied and Environmental Microbiology, 2014, 80(12): 3568-3575. DOI:10.1128/AEM.03923-13.
[10] DELGADO S, LEITE A M, RUAS-MADIEDO P, et al. Probiotic and technological properties of Lactobacillus spp. strains from the human stomach in the search for potential candidates against gastric microbial dysbiosis[J]. Frontiers in Microbiology, 2014, 5: 766. DOI:10.3389/ fmicb.2014.00766.
[11] SABIROVA J S, XAVIER B B, COPPENS J, et al. Whole-genome typing and characterization of blaVIM19-harbouring ST383 Klebsiella pneumoniae by PFGE, whole-genome mapping and WGS[J]. Journal of Antimicrobial Chemotherapy, 2016, 71(6): 1501-1509. DOI:10.1093/jac/dkw003.
[12] CASTILLA K S, de GOBBI D D, MORENO L Z, et al. Characterization of H aemophilus parasuis isolated from Brazilian swine through serotyping, AFLP and PFGE[J]. Research in Veterinary Science, 2012, 92(3): 366-371. DOI:10.1016/j.rvsc.2011.04.006.
[13] TURNBA UGH P J, RIDAURA V K, FAITH J J, et al. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice[J]. Science Translational Medicine, 2009, 1(6): 6799-6806. DOI:10.1126/scitranslmed.3000322.
[14] TORRES-MARAVILL A E, LENOIR M, MAYORGA-REYES L, et al. Identification of novel anti-inflammatory probiotic strains isolated from pulque[J]. Applied Microbiology and Biotechnology, 2016, 100(1): 385-396. DOI:10.1007/s00253-015-7049-4.
[15] ZHANG H, SUN J, LIU X, et al. Lactobacillus paracasei subsp. paracasei LC01 pos itively modulates intestinal microflora in healthy young adults[J]. Journal of Microbiology, 2013, 51(6): 777-782. DOI:10.1007/s12275-013-3279-2.
[16] ZHANG H, WANG Y, SUN J, et al. Safety evaluation of Lactobacillus paracasei subsp. paracasei LC-01, a probiotic bacterium[J]. Journal of Mi crobiology, 2013, 51(5): 633-638. DOI:10.1007/s12275-013-3336-x.
[17] BYUN R, NADKARNI M A, CHHOUR K L, et al. Quantitative analysis of diverse Lactobacillus species p resent in advanced dental caries[J]. Journal of Clinical Microbiology, 2004, 42(7): 3128-3136. DOI:10.1128/JCM.42.7.3128-3136.2004.
[18] WEST N P, PYNE D B, CRIPPS A W, et al. Gut balance, a synbiotic suppleme nt, increases fecal Lactobacillus paracasei but has little effect on immunity in healthy physically active individuals[J]. Gut Microbes, 2012, 3(3): 221-2 27. DOI:10.4161/gmic.19579.
[19] KUUGBEE E D, SHANG X, GAMALLAT Y, et al. Structural change in microbiota by a probiotic cocktail enhances the gut barrier and reduces cancer via TLR2 signaling in a rat model of colon cancer[J]. Digestive Diseases and Sciences, 2016, 61(10): 1-13. DOI:10.1007/ s106 20-016-4238-7.
[20] DOLPADY J, SORINI C, di PIETRO C, et al. Oral probiotic VSL#3 prevents autoimmune diabetes by modulating microbiota and promoting indoleamine 2,3-dioxygenase-enriched tolerogenic intestinal environment[J]. Jo urnal of Diabetes Research, 2016. DOI:10.1155/2016/7569431.
[21] WANG J, TANG H, ZHANG C, et al. Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J]. ISME Journal, 2015, 9(1): 1-15. DOI:10.1038/ ismej.2014.99.
[22] RAU CH M, LYNCH S V. Probiotic manipulation of the gastrointestinal microbiota[J]. Gut Microbes, 2010, 1(5): 335-338. DOI:10.4161/gmic.1.5.13169.
[23] DZIARSKI R, PARK S Y, KASHYAP D R, et al. Pglyrp-regulated gut microflora Prevotella falsenii, Parabacteroides distasonis and B acteroides eggerthii enhance and Alistipes f negoldii attenuates colitis in mice[J]. PLoS ONE, 2016, 11(1): e0146162. DOI:10.1371/journal. pone.0146162.
[24] SCHUBERT A M, SINANI H, SCHLOSS P D. Antibiotic-induced alterations of the murine gut micr obiota and subsequent effects on colonization resistance against clostridium difficile[J]. Mbio, 2015, 6(4): e00974. DOI:10.1128/mBio.00974-15.
[25] JIANG H Y, LING Z, ZHANG Y, et al. Altered fecal microbiota composition in patients with major d epressive disorder[J]. Brain, Behavior, and Immunity, 2015, 48: 186-194. DOI:10.1016/ j.bbi.2015.03.016.
[26] SAULNIER D M, RIEHLE K, MISTRETTA T A, et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel s yndrome[J]. Gastroenterology, 2011, 141(5): 1782-1791. DOI:10.1053/j.gastro.2011.06.072.
[27] TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457: 480-484. DOI:10.1038/ nature07540.
[28] QIN J, LI Y, CAI Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490: 55-60. DOI:10.1038/nature11450.
Evaluation of Intestinal Microbiota in Mice after Oral Administration of Lactobacillus paracasei LC01
LU Wenwei
1, YANG Zhennan
2, DING Liwei
2, YE Jiarong
2, TIAN Fengwei
1, CHEN Wei
1,*
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 2. Hangzhou Wei Chuan Foods Co. Ltd., Hangzhou 310018, China)
Abstract:To evaluate the effect of Lactobacillus paracasei LC01 (LC01) on the mouse intestinal microbiota, Balb/c mice were randomized and equally divided into four groups (n = 8). The live LC01, inactive LC01 and control groups were administered with live LC01, inactive LC01 and resuspended buffer for a 2-week period, respectively. The colonization group underwent a 2-week washout period after the administration of LC01. MiSeq high-throughput sequencing was used to determine the intestinal bacterial composition of fecal samples collected at the end of every period. A significant increase in Lactobacillus, Ruminococcaceae_UCG014 and Alistpes was observed in the live LC01 group compared with the control and inactive LC01 groups. Furthermore, species-specific quantitative polymerase chain reaction and operational taxonomic unit classification analysis revealed that LC01 could stimulate the proliferation of Lactobacillus gasseri and Lactobacillus reuteri. After the washout period, operational taxonomic units could not be detected in the fecal samples. The results indicated a modulation effect of LC01 on the intestinal microbiota in mice, suggesting that LC01 may have potential as a probiotic.
Key words:probiotic; Lactobacillus paracasei; fluorescent quantitative polymerase chain reaction; microbiota
DOI:10.7506/spkx1002-6630-201623038
中图分类号:Q935
文献标志码:A
文章编号:1002-6630(2016)23-0230-06
引文格式:
陆文伟, 杨震南, 丁历伟, 等. 益生菌Lactobacillus paracasei LC01对小鼠肠道菌群的调节作用[J]. 食品科学, 2016, 37(23): 230-235. DOI:10.7506/spkx1002-6630-201623038. http://www.spkx.net.cn
LU Wenwei, YANG Zhennan, DING Liwei, et al. Evaluation of intestinal microbiota in mice after oral administration of Lactobacillus paracasei LC01[J]. Food Science, 2016, 37(23): 230-235. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201623038. http://www.spkx.net.cn
收稿日期:2016-07-11
基金项目:国家自然科学基金青年科学基金项目(31501454)
作者简介:陆文伟(1986—),男,助理研究员,博士,研究方向为肠道微生态。E-mail:luwenwei@jiangnan.edu.cn
*通信作者:陈卫(1966—),男,教授,博士,研究方向为食品生物技术。E-mail:chenwei66@jiangnan.edu.cn





