王晓倩,张艳芳,王 倩,高晓梦,李春川,李 敬,吴 薇,董 平 *,梁兴国
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要:基于人结肠癌细胞系Caco-2细胞建立外源核酸的吸收模型,并在此模型的基础上探究质粒DNA的肠道吸收机制。在Transwell孔膜上培养Caco-2细胞21 d后,通过透射电子显微镜观察细胞形态、监测培养期间跨膜电阻(transepithelial electrical resistance,TEER)值、测定荧光黄透过率评价细胞模型是否成功建成;通过细胞毒性实验探究质粒对细胞生长的影响;将质粒DNA加入细胞模型中进行双向转运实验,探究质粒的肠道吸收规律;在低温和添加特异性抑制剂条件下进行质粒转运实验,进一步推测质粒的肠道吸收机制。结果表明,细胞分化形态良好、TEER值及荧光黄表观透过系数(apparent permeability coefficient,P app)均符合要求,细胞模型可用于转运实验;质粒对细胞生长无显著抑制作用,可用于转运实验;随着时间的延长,质粒在模型两方向上的转运均呈逐渐饱和趋势,P app(肠腔侧(apical,AP)→基底侧(basolateral,BL))远大于P app(BL→AP),提示质粒的转运受到某种载体蛋白的介导,膜介导的跨细胞运输方式可能参与其中;在低温和添加特异性抑制剂条件下,质粒的转运均受到显著抑制,进一步表明该过程是一个跨细胞方式的主动运输过程。
关键词:Caco-2细胞模型;外源核酸;吸收机制;质粒DNA
近年来,外源核酸在体内的消化吸收过程已引起人们广泛关注。传统观点认为,食物中的外源核酸经胃肠道消化后,最终完全降解,以单核苷酸、核苷、碱基的形式被机体吸收。但已有研究表明 [1-4],仍有部分外源核酸在消化道中未降解或降解不完全,能够经由肠道吸收进入血液循环,被运送至各组织器官中。外源核酸及其代谢产物在细胞结构、代谢、能量和调节功能等方面都起着重要作用,除了具有提高细胞免疫功能、促进细胞再生与修复等功能作用外 [5-7],细胞内未被完全降解的寡核苷酸可能会插入到宿主细胞基因组中,改变正常宿主基因组的功能。因此,经口服摄入外源核酸对整个机体的长期影响是一个不容忽视的问题,而肠道作为物质进入机体的第一关,探究外源核酸在其中的吸收机制就显得尤为重要。
对于核酸在人体内的吸收转运情况,直接利用人体组织进行研究是非常局限的,培养组织细胞是模拟营养物质透过小肠黏膜机制的一个有效办法。Caco-2细胞的结构和功能类似于分化的小肠上皮细胞,具有微绒毛等结构,并含有与小肠刷状缘上皮相关的酶系。在体外培养条件下,生长在多孔膜上的Caco-2细胞可融合并分化,形成连续的单层,是进行体外肠转运实验的重要手段 [8-9]。本实验通过建立Caco-2细胞模型对外源核酸的吸收机制进行研究,以期为口服补充外源核酸的体内吸收提供科学依据。
1.1 材料与试剂
质粒pPICZα A 美国Invitrogen公司;人结肠癌细胞系Caco-2细胞株 南京凯基生物科技发展有限公司。
无菌滤膜 美国PALL公司;96 孔培养板、12 孔Transwell细胞转运培养槽 美国Corning公司;不完全高糖细胞培养基(Dulbecco’s modified eagle medium,DMEM) 上海立菲生物技术有限公司;胎牛血清杭州四季青生物工程材料有限公司;胰蛋白酶溶液美国Life Technologies公司;磷酸盐缓冲液(phosphate buffer solution,PBS)、噻唑蓝(methylthiazolyldiphenyltetrazolium bromide,MTT) 南京凯基生物科技发展有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、荧光黄 美国Sigma公司;巴弗洛霉素A1(bafilomycin A1,BafA1) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
倒置显微镜 日本Olympus公司;超净工作台美国Nuaire公司;二氧化碳培养箱 上海力康生物医疗科技控股有限公司;多功能酶标仪 美国Thermo Fisher Scientific公司;低速离心机 湖南湘仪离心机仪器有限公司;Millicell-ERS电阻仪 美国Millipore公司;精密电子天平 德国梅特勒-托利多公司。
1.3 方法
1.3.1 细胞培养
从液氮罐中迅速取出冻存Caco-2细胞,置于37 ℃水浴中快速溶解复苏。离心后收集细胞,加入5 mL含10%胎牛血清的DMEM完全培养基混匀,于细胞培养箱中培养(37 ℃、5% CO 2)。当细胞覆盖融合至瓶底面积的70%~80%时,用消化液(含0.25%胰蛋白酶和0.02%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)消化并传代。完全贴壁生长后更换新鲜培养液,每4 d传代1 次。
1.3.2 Caco-2细胞模型的建立 [10]
将细胞接种于带有聚酯膜的Transwell小室中(膜孔径0.4 μm,面积1.12 cm 2),细胞密度为2×10 5个/mL,Tranwell小室肠腔侧(apical,AP)加入0.5 mL DMEM完全培养基,基底侧(basolateral,BL)加入1.5 mL培养基。接种后每2 d换新鲜培养液1次,1 周后每天换培养液,培养21 d。
1.3.3 Caco-2细胞模型的验证
培养21 d后,从3 个方面对细胞单层模型是否建成进行评价:取Transwell板内生长21 d左右的Caco-2细胞进行固定及超薄切片,用透射电子显微镜观察细胞的分化情况 [11];利用Millicell-ERS电阻仪测定模型及空白孔电阻值,并按公式(1)计算培养期间的跨膜电阻(transepithelial electrical resistance,TEER)值 [12]。
式中:R t为实测模型电阻值/Ω;R 0为测定空白孔(未接种细胞)电阻值/Ω;S为膜面积/cm 2。
根据文献[13]的方法计算标记物荧光黄透过率:在AP侧加入0.5 mL荧光黄(20 μg/mL),下室加1.5 mL PBS,在培养箱中培养2 h,取下室的转运液,在发射波长428 nm、吸收波长540 nm条件下检测荧光强度,根据已测得的标准曲线,计算荧光黄在下室转运液的质量浓度,并根据公式(2)计算荧光黄在各孔的表观透过系数(apparent permeability coeff cient,P app)。
式中:P app为荧光黄在各孔的表观透过系数/(cm/s);V为接收池的溶液体积/mL;S为膜面积/cm 2;ρ为物质起始质量浓度/(g/mL);dρ/dt表示接受池在单位时间获得的物质质量浓度/(g/mL),即接收池中物质最终质量浓度除以转运时间/s。
1.3.4 质粒对细胞生长的影响
MTT溶液的制备:称取250 mg MTT样品加入50 mL PBS中,用锡箔纸包好避光搅拌2~3 h,在超净台中进行无菌过滤与分装。于-20 ℃条件下避光冻存,避免反复冻融。
质粒溶液的制备:用PBS稀释至0.9 nmol/L,经0.22 μm滤膜过滤除菌,-20 ℃冻存。临用前用含1%胎牛血清的DMEM稀释至0.45 nmol/L进行实验。
细胞培养与消化:方法同1.3.2节。调整细胞悬液密度至10 4个/mL,将细胞加入96 孔板中(100 μL/孔)。置于培养箱中贴壁24 h后,弃去孔中原有培养液,空白孔不接种细胞,对照孔加入DEME(含0.5%胎牛血清,50% PBS),实验孔加入临用前配制的质粒溶液,置于培养箱中作用48 h。每组设6 个复孔。之后将MTT溶液以20 μL/孔加入板中,再将培养板置入培养箱中培养。4 h后将板中液体倒掉,每孔加入200 μL DMSO,避光振荡15 min。用酶标仪于570 nm波长处测定每孔的吸光度A,按公式(3)计算细胞相对存活率 [14]。
式中:A 0、A 1、A 2分别为空白孔、对照孔、实验孔的吸光度。
1.3.5 质粒的转运实验
1.3.5.1 质粒溶液的制备
配制方法同1.3.4节。临用前用不完全DMEM稀释至0.45 nmol/L进行实验。
1.3.5.2 实验预处理
取经验证的细胞模型,实验前用不完全DMEM培养20 min,培养结束后用不完全DMEM漂洗3 遍,洗去细胞单层表面的杂质。用电阻仪测定跨膜电阻值,以确定细胞单层的紧密与完整。
1.3.5.3 质粒跨膜双向转运实验
对于AP侧到BL侧的转运:将0.5 mL质粒溶液加到AP侧作为供给液,将1.5 mL不完全DMEM加到BL侧作为接受液。对于从BL侧到AP侧的转运:将1.5 mL质粒溶液加到BL侧作为供给液,将0.5 mL不完全DMEM加到AP侧作为接受液。置于37 ℃培养箱中培养,分别于0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h吸取5 μL接受液,实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-qPCR)测定质粒含量,计算质粒转运量。
1.3.5.4 4 ℃条件下的低温转运实验
将0.5 mL质粒溶液加到AP侧作为供给液,将1.5 mL不完全DMEM加到BL侧作为接受液,置于冰上冰浴。2 h后吸取5 μL接受液,RT-qPCR测定质粒含量,计算质粒转运量。对照组置于37 ℃培养箱中培养2 h。
1.3.5.5 加入特异性抑制剂BafA1的转运实验
先将0.5 mL 0.1 μmol/L BafA1加到AP侧,将1.5 mL不完全DMEM加到BL侧,置于37 ℃培养箱中预孵育30 min。之后将AP侧溶液弃去,加入0.5 mL含有0.45 nmol/L质粒、0.1 μmol/L BafA1的溶液。继续置于37 ℃培养箱中,2 h后吸取5 μL接受液,RT-qPCR测定质粒含量,计算质粒转运量。对照组中以不完全DMEM代替BafA1。
1.3.5.6 RT-qPCR定量实验
反应体系为10 μL:ddH 2O 3.6 μL、2×SYBR ®Select Master Mix 5 μL、10 μmol/L上、下游引物各0.2 μL、质粒模板1 μL。扩增模板中72 bp片段。反应程序为94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃延伸10 min。引物序列:上游引物5’-GTGGGTGCCCTCTGTCTACTG-3’,下游引物5’-GAGGAGTCATCAGGGTTGAACTG-3’。
1.4 数据统计分析
结果用
 表示。运用Origin 8.0软件进行作图和分析。运用SPSS 19.0软件,采用单因素方差分析进行统计分析,以P<0.05为差异有统计学意义。
表示。运用Origin 8.0软件进行作图和分析。运用SPSS 19.0软件,采用单因素方差分析进行统计分析,以P<0.05为差异有统计学意义。
2.1 Caco-2细胞模型的建立及验证
2.1.1 Caco-2细胞形态

图1 透射电子显微镜下Caco-2细胞单层结构图示
Fig. 1 Transmission electron microscope photos of Caco-2 monolayers
透射电子显微镜观察表明,细胞生长至21 d时,由微绒毛形成的刷状缘整齐致密(图1a);细胞之间有紧密连接,沿着胞间通道延伸,可清楚看到细胞桥粒(图1b),这是上皮细胞紧密连接所特有的结构,说明细胞生长分化形态良好。
2.1.2 TEER值变化

图2 细胞单层TEER值随时间变化的曲线
Fig. 2 TEER of Caco-2 cell monolayers at different stages
由图2可知,TEER值在第1周时迅速增长,第2周开始缓慢增加,到21 d稳定在1 200 Ω·cm 2左右,可用于吸收和代谢研究。
2.1.3 荧光黄透过率
计算可得P app=(7.61±0.16)×10 -7cm/s,小于通透实验规定的10 -6cm/s,可见Caco-2细胞在Transwell板中培养21 d后,形成了完整的细胞单层,可用于转运实验。
2.2 质粒对Caco-2细胞生长的影响
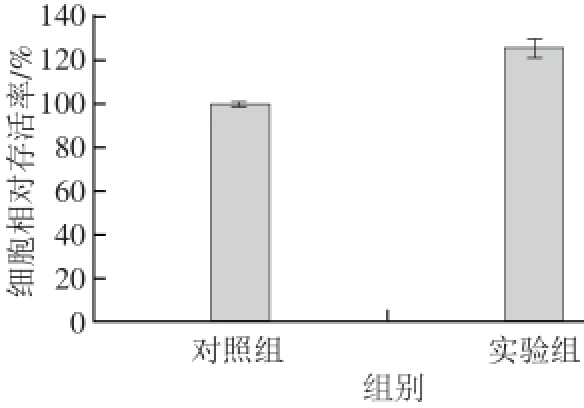
图3 质粒对Caco-2细胞生长的影响
Fig. 3 Effect of plasmids on Caco-2 cells growth
进行细胞模型转运实验前,首先探究了质粒对细胞生长的影响。由图3可知,质粒作用48 h后对Caco-2细胞的生长没有产生显著促进或抑制作用,可在此质粒浓度条件下进行质粒的细胞模型转运实验。
2.3 质粒在Caco-2细胞模型中的转运特征
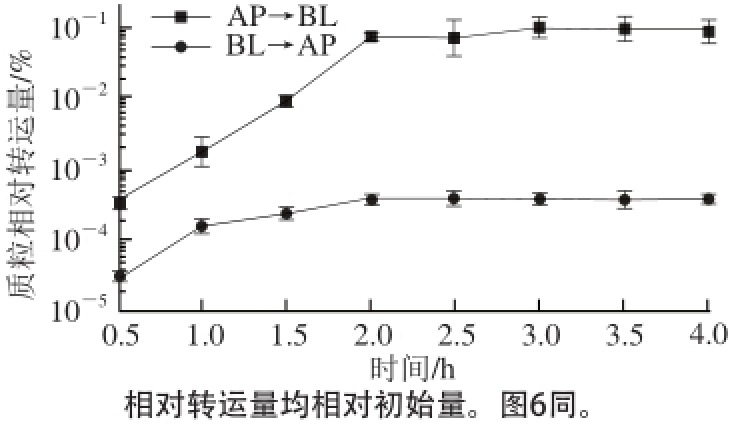
图4 质粒在Caco-2细胞模型两方向上的转运情况
Fig. 4 Time course of plasmid transport across Caco-2 cells in the apical in basolateral AP→BL direction and BL→AP direction
在探究外源物质转运机制时,通常需结合两个方向的转运(AP→BL和BL→AP)来讨论。由图4可知,随着转运时间的延长,质粒在细胞模型两方向上的转运量逐渐累积,均于2 h后达到稳定阶段,此时由AP→BL方向的转运量约为初始量的0.08%,BL→AP方向仅为初始量的4×10 -4%。根据公式对2 h时两个方向的P app进行计算和比较,P app(AP→BL)=(1 430±129)×10 8/(cm/s)、P app(BL→AP)=(7.441±0.582)×10 8/(cm/s),P app(AP→BL)/P app(BL→AP)=192.2,表明质粒的转运受到某种载体蛋白的介导,是一个主动运输过程。
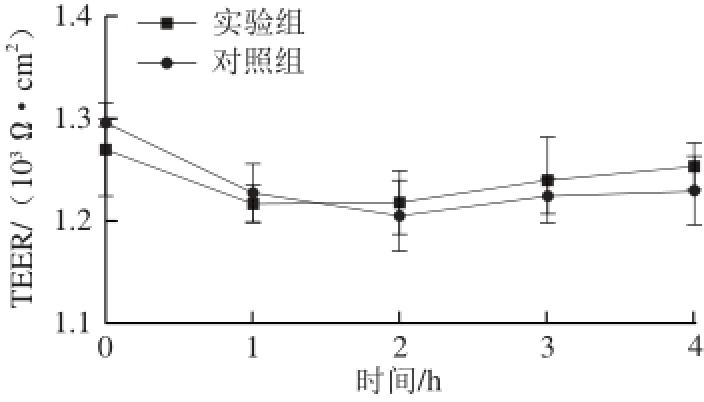
图5 质粒转运期间跨膜电阻的变化
Fig. 5 Change of TEER during transport
图5为加入质粒后细胞单层TEER值的变化,TEER值反映的是胞间的紧密连接程度。实验组电阻基本保持稳定且与对照组无显著差异,说明加入质粒后细胞间紧密连接基本不变,因此质粒的运输过程为跨细胞而非胞间转运。
2.4 质粒在Caco-2细胞模型中的转运机制
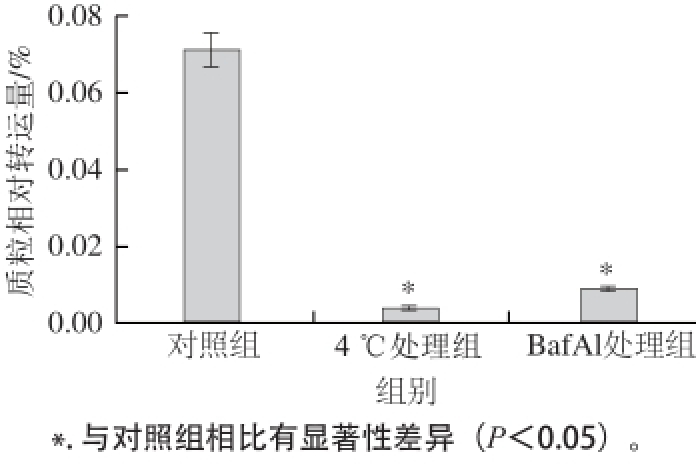
图6 抑制胞吞过程对质粒转运的影响
Fig. 6 Effect of inhibition of endocytosis and transcytosis on transport of plasmids
质粒在细胞模型两方向上转运的差异表明膜介导的跨细胞运输方式可能参与其中,而膜介导的转运在低温条件下可被显著抑制。因此,将细胞模型置于4 ℃条件下进行2 h质粒转运来探究变化。由图6可知,质粒相对转运量大大减少,受到显著抑制(P<0.05)。为了进一步探究质粒的转运机制,向转运体系内加入膜转运特异性抑制剂BafA1并检测2 h后的质粒相对转运量,发现BafA1的存在也大大抑制了质粒的转运(P<0.05)。

图7 抑制胞吞条件下TEER值的变化
Fig. 7 Change in TEER under the inhibition of endocytosis
同时,对实验过程中的TEER值也进行了监测,由图7可知,与对照组相比,两个实验组TEER值均未产生显著变化,表明低温和BafA1存在未影响细胞间的紧密连接。
Caco-2细胞经21 d培养后,细胞可分化成类似小肠上皮的单层细胞。对Caco-2细胞模型是否建成一般可从细胞形态、细胞单层完整性、细胞单层通透性等方面展开。TEER值是通过离子经细胞间隙流动形成,受细胞自身状态(如细胞代数 [15])、培养板孔膜(如膜面积 [16]、膜材质 [17]、膜孔径 [18-19])、培养液 [19]等诸多因素的影响,因此文献报道的TEER值不尽相同(500~1 500 Ω·cm 2) [20]。本实验建立的细胞模型TEER值为(1 238±29) Ω·cm 2,符合实验要求。由于实验条件的不同,TEER值不具备可比性。而离子经细胞间隙透过的总量一定,因而利用细胞旁路转运标记物荧光黄进行细胞间通透性检测比测定TEER值更可靠 [10]。本实验中荧光黄的表观透过系数P app符合要求,证明所建立的细胞模型细胞间紧密连接完整,可用于转运研究。
质粒在Caco-2细胞模型中的转运结果表明,一定质粒浓度条件下,质粒的转运量随时间的延长而增大,2 h后趋向饱和状态。而质粒在模型两方向上转运量的较大差异(P app(AP→BL)/P app(BL→AP)=192.2)表明,在Caco-2细胞中存在某种转运载体且载体位于细胞单层的AP侧 [21]。这也符合质粒跨膜转运表现出的饱和现象,转运时间延长使得载体饱和从而达到平衡状态。在低温条件下,质粒相对转运量大大减少,表明其转运过程是膜介导的主动运输。BafA1是一种囊泡性H +-ATP酶质子泵抑制剂,可通过抑制内涵体酸化来阻碍早期内涵体的成熟和后续运输过程 [22]。BafA1显著抑制了质粒经细胞模型的转运量,进一步表明其转运过程是通过膜转运的方式来完成的。综上所述,质粒经细胞模型的转运是一个跨细胞方式的主动运输过程。
目前,外源核酸经哺乳动物肠道的吸收机制尚未清楚。在细胞膜上已发现并分离了几种DNA结合蛋白 [23-25],但这些蛋白在DNA的细胞摄取过程中发挥何种作用还没有令人信服的结论。因此,依靠体外模型,继续深入开展相关基础性研究很有必要,同时也将为口服补充外源核酸的体内吸收提供科学依据。
参考文献:
[1] DOERFLER W, SCHUBBERT R. Uptake of foreign DNA from the environment: the gastrointestinal tract and the placenta as portals of entry[J]. Wiener Klinische Wochenschrift, 1998, 110(2): 40-44.
[2] FORSMAN A, USHAMECKIS D, BINDRA A, et al. Uptake of amplifiable fragments of retrotransposon DNA from the human alimentary tract[J]. Molecular Genetics and Genomics, 2003, 270(4): 362-368. DOI:10.1007/s00438-003-0930-3.
[3] EINSPANIER R, KLOTZ A, KRAFT J, et al. The fate of forage plant DNA in farm animals: a collaborative case-study investigating cattle and chicken fed recombinant plant material[J]. European Food Research and Technology, 2001, 212(2): 129-134. DOI:10.1007/ s002170000248.
[4] REUTER T, AULRICH K. Investigations on genetically modified maize (Bt-maize) in pig nutrition: fate of feed-ingested foreign DNA in pig bodies[J]. European Food Research and Technology, 2003, 216(3): 185-192. DOI:10.1007/s00217-002-0642-7.
[5] HE Y, SANDERSON I R, WALKER W A. Uptake, transport and metabolism of exogenous nucleosides in intestinal epithelial cell cultures[J]. The Journal of Nutrition, 1994, 124(10): 1942-1949.
[6] ORTEGA , GIL Á, SÁNCHEZ-POZO A. Exogenous nucleosides modulate expression and activity of transcription factors in Caco-2 cells[J]. The Journal of Nutritional Biochemistry, 2011, 22(6): 595-604. DOI:10.1016/j.jnutbio.2010.05.003.
[7] PENG Mo, XU Wei, AI Qinghui, et al. Effects of nucleotide supplementation on growth, immune responses and intestinal morphology in juvenile turbot fed diets with graded levels of soybean meal (Scophthalmus maximus L.)[J]. Aquaculture, 2013, 392/393/394/395: 51-58. DOI:10.1016/j.aquaculture.2013.02.002.
[8] MADGULA V L, AVULA B, CHOI Y W, et al. Transport of Schisandra chinensis extract and its biologically-active constituents across Caco-2 cell monolayers-an in vitro model of intestinal transport[J]. Journal of Pharmacy and Pharmacology, 2008, 60(3): 363-370. DOI:10.1211/jpp.60.3.0012.
[9] PRESS B, di GRANDI D. Permeability for intestinal absorption: Caco-2 assay and related issues[J]. Current drug metabolism, 2008, 9(9): 893-900. DOI:10.2174/138920008786485119.
[10] 孙敏捷, 盛星, 胡一桥. Caco-2细胞单层模型的建立与验证[J]. 中国药学杂志, 2006, 41(18): 1431-1434. DOI:10.3321/j.issn:1001-2494.2006.18.022.
[11] 左克源. Caco-2细胞模型的建立及在口服药物吸收中的应用[D]. 武汉: 华中科技大学, 2007: 1-62. DOI:10.7666/d.d090174.
[12] 余自成, 高瑜, 田薇薇, 等. 肠道转运Caco-2细胞单层模型的建立及验证评价[J]. 中国临床药学杂志, 2012, 21(4): 218-221.
[13] 朱狄峰. 丹参素及芍药苷在Caco-2细胞模型中转运的研究[D]. 杭州: 浙江大学, 2006: 6-58.
[14] 赵嘉惠, 张华屏, 王春芳. MTT法在检测细胞增殖方面的探讨[J].山西医科大学学报, 2007, 38(3): 262-263. DOI:10.3969/ j.issn.1007-6611.2007.03.025.
[15] YU Hongshi, COOK T J, SINKO P J. Evidence for diminished functional expression of intestinal transporters in Caco-2 cell monolayers at high passages[J]. Pharmaceutical Research, 1997, 14(6): 757-762. DOI:10.1023/A:1012150405949.
[16] MARKOWSKA M, OBERLE R, JUZWIN S, et al. Optimizing Caco-2 cell monolayers to increase throughput in drug intestinal absorption analysis[J]. Journal of Pharmacological and Toxicological Methods, 2001, 46(1): 51-55. DOI:10.1016/S1056-8719(01)00161-7.
[17] YU H S, SINKO P J. Influence of the microporous substratum and hydrodynamics on resistances to drug transport in cell culture systems: calculation of intrinsic transport parameters[J]. Journal of Pharmaceutical Sciences, 1997, 86(12): 1448-1457. DOI:10.1021/ js960524q.
[18] TUCKER S, MELSEN L, COMPANS R. Migration of polarized epithelial cells through permeable membrane substrates of defined pore size[J]. European Journal of Cell Biology, 1992, 58(2): 280-290.
[19] GEYS J, NEMERY B, HOET P. Optimisation of culture conditions to develop an in vitro pulmonary permeability model[J]. Toxicology in Vitro, 2007, 21(7): 1215-1219. DOI:10.1016/j.tiv.2007.05.012.
[20] RANALDI G, CONSALVO R, SAMBUY Y, et al. Permeability characteristics of parental and clonal human intestinal Caco-2 cell lines differentiated in serum-supplemented and serum-free media[J]. Toxicology in Vitro, 2003, 17(5): 761-767. DOI:10.1016/S0887-2333(03)00095-X.
[21] 胡晓渝, 姚彤炜, 曾苏. Caco-2细胞系及其在药物吸收、代谢中的应用[J]. 中国现代应用药学, 2002, 19(2): 88-90. DOI:10.3969/ j.issn.1007-7693.2002.02.002.
[22] JOHANNESSEN L E, SPILSBERG B, WIIK-NIELSEN C R, et al. DNA-fragments are transcytosed across Caco-2 cells by adsorptive endocytosis and vesicular mediated transport[J]. PLoS ONE, 2013, 8(2): e56671. DOI:10.1371/journal.pone.0056671.
[23] BASNER-TSCHAKARJAN E, MIRMOHAMMADSADEGH A, BAER A, et al. Uptake and trafficking of DNA in keratinocytes: evidence for DNA-binding proteins[J]. Gene Therapy, 2004, 11(9): 765-774. DOI:10.1038/sj.gt.3302221.
[24] PEISER L, MUKHOPADHYAY S, GORDON S. Scavenger receptors in innate immunity[J]. Current Opinion in Immunology, 2002, 14(1): 123-128. DOI:10.1016/S0952-7915(01)00307-7.
[25] GURSEL M, GURSEL I, MOSTOWSKI H S, et al. CXCL16 influences the nature and specificity of CpG-induced immune activation[J]. The Journal of Immunology, 2006, 177(3): 1575-1580. DOI:10.4049/jimmunol.177.3.1575.
Absorption Model and Mechanism of Exogenous Nucleic Acids Based on Caco-2 Cells
WANG Xiaoqian, ZHANG Yanfang, WANG Qian, GAO Xiaomeng, LI Chunchuan, LI Jing, WU Wei, DONG Ping
*, LIANG Xingguo
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:In this study, we employed Caco-2 cells to establish an absorption model of exogenous nucleic acids. Using this model, we also explored the mechanism of intestinal absorption of plasmid DNA. After culturing Caco-2 cells for 21 days on Transwell membranes, cell morphology, transepithelial electrical resistance (TEER) and apparent permeability coeff cient (P app) of f uorescent yellow were measured and used to evaluate whether the model was established successfully. Cytotoxicity experiments were used to explore the effect of plasmid DNA on cell growth. The mechanism of intestinal DNA absorption was explored by two-way transfer experiments. To further validate vesicle-mediated DNA transport, transport experiments were performed on ice or in the presence of the specif c inhibitor. The results showed that the morphology of differentiated cells was good and both TEER and P appof f uorescent yellow reached the requirements; therefore the model could be applied in transport experiments. The plasmid DNA showed no signif cant inhibitory effect on the growth of Caco-2 cells. As time passed, the transport of plasmid DNA gradually tended to saturate in both directions. P app(AP→BL) was much greater than P app(BL→AP), indicating that the transport was related to some carrier-mediated protein, and the transmembrane transport mode may be involved. These results further demonstrated that the transport of exogenous plasmid DNA was evidently inhibited by low temperature and the specif c inhibitor and therefore a transcellular active transport process.
Key words:Caco-2 cells model; exogenous nucleic acids; absorption mechanism; plasmid DNA
DOI:10.7506/spkx1002-6630-201623039
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)23-0236-06
收稿日期:2016-01-21
基金项目:国家自然科学基金青年科学基金项目(31201327;31301420);国家自然科学基金委员会-山东省人民政府联合资助海洋科学研究中心项目(U1406402);中国博士后科学基金项目(2015M580609)
作者简介:王晓倩(1990—),女,硕士研究生,研究方向为食品科学。E-mail:wxq901225@126.com
*通信作者:董平(1980—),女,副教授,博士,研究方向为食品分子营养及食品核酸营养代谢。E-mail:dongping@ouc.edu.cn
引文格式:
王晓倩, 张艳芳, 王倩, 等. 基于Caco-2细胞的外源核酸吸收模型的建立及其吸收机制[J]. 食品科学, 2016, 37(23): 236-241. DOI:10.7506/spkx1002-6630-201623039. http://www.spkx.net.cn
WANG Xiaoqian, ZHANG Yanfang, WANG Qian, et al. Absorption model and mechanism of exogenous nucleic acids based on Caco-2 cells[J]. Food Science, 2016, 37(23): 236-241. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201623039. http://www.spkx.net.cn