表1 仿刺参精酶解方案
Table 1 Hydrolysis patterns of Apostichopus japoniiccaass speerrmm

注:加酶量均为质量分数,下同。
方案酶种类加酶量/%酶解温度/℃酶解时间/h 1木瓜蛋白酶3705 2复合蛋白酶3455 3风味蛋白酶3455 4木瓜蛋白酶+复合蛋白酶各1.5705 5先木瓜蛋白酶+复合蛋白酶后风味蛋白酶各1先70后45先4后1
张 健 1,2,3,刘少伟 1,*,张 毅 2,王共明 3,赵云苹 3,刘京熙 3,刘 昕 3
(1.华东理工大学生物工程学院,生物反应器工程国家重点实验室,上海 200237;2.中国科学院上海生命科学研究院,上海 200233;3.山东省海洋资源与环境研究院,山东 烟台 264006)
摘 要:本实验以仿刺参精为原料,制备出多肽并考察其体外和体内抗氧化活性。以清除羟自由基(•OH)能力为指标,考察木瓜蛋白酶、复合蛋白酶和风味蛋白酶的5 种酶解方式产生的酶解产物的活性,优化实验用酶。经超滤分级后,测定各级组分的分子质量分布、可溶性蛋白质含量、多肽含量和清除•OH能力。选择清除•OH能力较好的低分子质量多肽组分,测定氨基酸组成,设定低、中、高剂量组(100、200、600 mg/kg(以体质量计,下同))、模型对照组、和空白对照组进行42 d小鼠灌胃实验。实验完成后,检测小鼠血液中超氧化物歧化酶(superoxide dismutase,SOD)活力、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、谷胱甘肽(glutathione,GSH)含量、丙二醛(malondialdehyde,MDA)含量和蛋白质羰基含量。结果表明,由木瓜蛋白酶水解,经超滤制备的<1 000 u仿刺参精多肽具有较好的体外清除•OH能力,其半数抑制浓度为6.02 mg/mL,含量占比为58%,氨基酸组成中谷氨酸等酸性氨基酸和酪氨酸等疏水性氨基酸含量丰富。小鼠抗氧化模型实验表明,实验组生长正常,高剂量多肽组小鼠体内SOD活力显著提高(P<0.05),GSH的含量提高极显著(P<0.01)、GSH-Px活力也呈剂量依赖性升高,但未达到差异显著(P>0.05)。MDA和蛋白质羰基含量得到有效降低,后者达到差异显著(P<0.05)。研究结果显示:<1 000 u仿刺参精多肽具有提高小鼠抗氧化能力的效果,可以作为相关功能产品开发的原材料。
关键词:仿刺参精;多肽;抗氧化;小鼠
仿刺参是我国传统的名贵海产品,具有很高的营养价值 [1]。其含有的海参多糖 [2-3]、海参多肽 [4]、皂苷 [5-6]等成分具有抗肿瘤、免疫调节、抗氧化等功效。其中的海参多肽多采用将海参组织生物酶解后分离得到,具有较为明显的抗氧化效果 [4]。
目前,相关研究材料多集中于仿刺参体壁组织,而对于仿刺参加工的副产物——生殖腺组织的研究有待于进一步深入。相关研究证实,仿刺参生殖腺组织同样含有丰富的营养成分,有些功效成分含量甚至高于海参体壁 [1,7]。海参精中的粗蛋白含量更是高达70%以上。目前,国内学者已逐渐对其展开系统研究 [8-11]。本研究利用显微镜对仿刺参生殖腺组织进行雌雄分类,并收集海参精制备多肽,以抗氧化性为指标考察优化的生物酶解参数,在测定了多肽体外抗氧化性的基础上,以小鼠为对象进行了体内抗氧化实验,以期为提高仿刺参的综合利用和进一步开发海参多肽类产品提供理论依据。
1.1 材料与试剂
鲜仿刺参(Apostichopus japonicus)生殖腺,由烟台山水海产有限公司提供,经显微鉴定后,分出仿刺参精。无特定病原体(specif c pathogen free,SPF)级昆明种雄性成年小鼠,由山东大学实验动物中心提供。
木瓜蛋白酶(1 000 000 U/g) 南宁庞博生物工程有限公司;风味蛋白酶(500 LAPU/g)、复合蛋白酶(1.5 AU/g) 丹麦诺维信公司;牛血清白蛋白 上海蓝季科技发展有限公司;蛋白质羰基含量测定试剂盒、谷胱甘肽(glutathione,GSH)含量测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活力测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活力测定试剂盒、丙二醛(malondialdehyde,MDA)含量测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
FD-2A冷冻干燥机 北京博医康实验仪器有限公司;5430R高速冷冻离心机 德国Eppendorf公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;氨基酸自动生化分析仪L-8900 日本日立公司;xMARK微孔板分光光度计 美国伯乐公司;Pellicon超滤系统、超滤膜包(10 000、5 000、1 000 u) 美国密理博公司。
1.3 方法
1.3.1 酶解提取
由于蛋白酶的酶切位点不同,不同的蛋白酶及复配使用水解得到的肽段也有差异,其活性也会随之不同。本实验采用3 种蛋白酶、5 种酶解方案共得到5 种酶解液。具体酶解方案如表1所示,酶解液经3 000 r/min离心20 min后取上清液,减压浓缩后真空冷冻干燥。取冻干粉配制成4、8、12、16、20 mg/mL的水溶液,检测清除•OH活性。
表1 仿刺参精酶解方案
Table 1 Hydrolysis patterns of Apostichopus japoniiccaass speerrmm

注:加酶量均为质量分数,下同。
方案酶种类加酶量/%酶解温度/℃酶解时间/h 1木瓜蛋白酶3705 2复合蛋白酶3455 3风味蛋白酶3455 4木瓜蛋白酶+复合蛋白酶各1.5705 5先木瓜蛋白酶+复合蛋白酶后风味蛋白酶各1先70后45先4后1
1.3.2 超滤分级
将得到的仿刺参精酶解液,先用普通滤纸、0.45 μm和0.22 μm微孔滤膜澄清。然后采用Pellicon超滤系统,依次安装截留分子质量为10 000、5 000 u和1 000 u的切向流超滤膜包,控制压力在70~200 kPa条件下室温进行超滤,制备出截留分子质量在5 000~10 000、1 000~5 000 u和<1 000 u的3 级组分,使用截留分子质量为100 u的透析袋对<1 000 u的截留液进行透析脱盐处理。3 级组分经真空冷冻干燥后,采用直接称量法测定各级截留组分的质量,采用双缩脲法 [12]测定组分中可溶性蛋白质和多肽的含量,而后配制成4、8、12、16、20 mg/mL的水溶液,测定各级组分的清除•OH活性。
1.3.3 •OH清除能力测定
取1 mL 0.75 mmol/L邻二氮菲,依次加入2 mL pH 7.4的磷酸盐缓冲液和1 m L蒸馏水,混匀后,加入1 mL 0.75 mmol/L硫酸亚铁溶液和1 mL 0.01% H 2O 2,立即混匀,于37 ℃条件下水浴60 min,在536 nm波长处测得吸光度A p;用1 mL蒸馏水代替1 mL 0.01% H 2O 2,其余操作同上,测得吸光度A b;分别用1 mL 4、8、12、16、20 mg/mL的样品溶液代替1 mL蒸馏水,其余操作同上,测得样品吸光度A s。按公式(1)计算•OH清除率。
1.3.4 氨基酸组成分析
利用氨基酸自动生化分析仪进行低分子质量多肽的氨基酸组成分析。样品处理步骤:称取多肽样品(约含20 mg蛋白质)于安瓿瓶中,加入6 mL 6 mol/L的HCl溶液,通入氮气,抽真空,用酒精喷灯密封。110 ℃条件下水解22 h,冷却,蒸馏水定容至50 mL。取1 mL滤液于蒸发皿中加热,期间加2 次1 mL蒸馏水分别蒸干,然后加入1 mL稀释试剂,经0.22 μm微孔滤膜(水相)过滤,进行氨基酸组成分析。
1.3.5 多肽抗氧化性动物实验
参考体外抗氧化结果,选择目标多肽进行抗氧化性动物实验,实验环境温度(22±2)℃,相对湿度(50±10)%。小鼠体质量25~30 g。根据小鼠体质量随机分为模型对照组、低剂量组(100 mg/kg(以体质量计,下同))、中剂量组(200 mg/kg)、高剂量组(600 mg/kg)和空白对照组,每组10 只小鼠。实验组用去离子水溶解多肽,每日一次经口灌胃小鼠,灌胃体积按20 mL/kg;空白对照组和模型对照组小鼠连续灌胃42 d等体积去离子水。末次灌胃后,模型对照组和3 个实验组禁食16 h(过夜),然后一次性给予50%乙醇(12 mL/kg)灌胃,空白对照组不作处理,正常喂食。6 h后,所有小鼠从眼眶取血样,测定血中脂质氧化产物MDA含量、蛋白质羰基含量、GSH含量、抗氧化酶SOD和GSH-Px活力。
1.3.5.1 全血中过氧化脂质降解产物MDA浓度测定
采用硫代巴比妥酸法 [13],取0.1 mL血浆加入各种反应试剂,混匀后于95 ℃条件下水浴40 min,流水冷却至室温,以3 500 r/min离心10 min,取全部上清液,于532 nm波长处,1 cm光径,蒸馏水调零,测定各管光密度(OD)值。全血中MDA浓度参照试剂盒说明书,按公式(2)计算。
式中:10为MDA标准品浓度/(nmol/L);n为样本测定前稀释倍数。
1.3.5.2 红细胞SOD活力测定
采用羟胺法 [14],用肝素处理过的毛细管从小鼠眼内眦采血10 μL,冲入盛有0.5 mL生理盐水的带刻度玻璃离心管中,以2 000 r/min离心3 min。在沉淀红细胞中加入所需试剂,振荡后3 500 r/min离心8 min。记录上清液体积,取20 μL测定SOD活力。加所需试剂,混匀,于37 ℃条件下水浴40 min,加显色剂混匀,室温放置10 min,采用1 cm光径,蒸馏水调零,于550 nm波长处测定吸光度A,红细胞SOD活力参照试剂盒说明书,按公式(3)计算。
式中:3.32为反应液体积/mL;0.02为测定抽提液体积/mL;0.3为抽提液体积/mL;0.105为血红蛋白质量浓度/(g/mL);V为采血量/mL。
1.3.5.3 全血GSH-Px活力测定
采用二硫对硝基苯甲酸法 [15]。用肝素处理过的毛细管从小鼠眼内眦采血10 μL,加入双蒸水稀释至1 mL,充分振荡使之全部溶血,取0.2 mL,加入所需试剂,37 ℃水浴中进行酶促反应5 min,终止反应。3 500~4 000 r/min离心10 min得上清液,加入所需试剂显色,采用1 cm光径,蒸馏水调零,于412 nm波长处测定各管吸光度A。GSH-Px活力参照试剂盒说明书,按公式(4)计算。
式中:20为GSH-Px标准品浓度/(μmol/L);10为稀释倍数。
1.3.5.4 蛋白质羰基含量测定
各取血浆0.1 mL分别放入测定管与对照管,加入所需试剂,漩涡混匀1 min,37 ℃条件下准确避光反应30 min。再加入三氯乙酸,混匀1 min,在4 ℃条件下12 000 r/min离心10 min,弃上清液留沉淀,加入无水乙醇-乙酸乙酯混合溶液,重复5 次后,加入盐酸胍混匀,37 ℃条件下准确水浴15 min。涡旋混匀,将全部沉淀溶解,12 000 r/min离心15 min得上清液,采用0.5 cm光径石英比色皿,于波长370 nm处测定吸光度A。用双缩脲法测定血清蛋白质含量,按公式(5)计算蛋白质羰基含量。
式中:0.5为比色皿光径/cm。;ρ为样品蛋白质量浓度/(mg/L)
1.3.5.5 全血GSH含量测定
取肝素抗凝全血0.1 mL加双蒸水0.9 mL充分混匀,直至透亮为止。取0.5 mL,加所需试剂2 mL混匀,3 500~4 000 r/min离心10 min,取上清液1 mL并加入所需试剂进行显色反应。混匀,室温放置10 min后,于420 nm波长处,1 cm光径处测定吸光度。按公式(6)计算GSH含量。
式中:20×10 -6为标准品浓度/(mol/L);307为GSH分子质量/u;n为样品测试前稀释倍数。
1.4 数据统计分析
采用Microsoft Excel软件进行数据统计,SPSS 20.0软件进行统计分析。
2.1 不同酶解液的清除•OH能力

图1 仿刺参精不同酶解产物清除 OH的能力
Fig. 1 Hydroxyl radical scavenging capacity of different enzymatic hydrolysates of Apostichopus japonicus sperm
由图1可知,相对于复合蛋白酶酶解产物和风味蛋白酶酶解产物,木瓜蛋白酶、双酶和三酶酶解产物清除•OH的能力较好,而且在高质量浓度时木瓜蛋白酶酶解产物的抗氧化效果优于另外两者。此结果与陈卉卉等 [11]采用木瓜蛋白酶和风味蛋白酶水解海参体壁制备抗氧化肽实验结果类似。Zhou Xiaoqiu等 [16]的实验数据中也显示出采用木瓜蛋白酶制备出的海参体壁多肽具有较好的清除•OH能力。从工艺的简单程度和抗氧化效果两方面综合考虑后,决定选择木瓜蛋白酶作为实验用酶。
2.2 分级组分的清除•OH效果
由表2可知,仿刺参精的木瓜蛋白酶水解产物经超滤分级后得到3 级组分,其中截留分子质量<1 000 u的多肽质量分数最大(约58%),这与赵强忠等 [17]采用胰酶水解秋刀鱼得到的肽段中分子质量1 000~3 000 u占比最大的结果有所不同。随着截留分子质量的降低,3 级组分中可溶性蛋白质和多肽的质量分数逐级升高,截留分子质量<1 000 u的组分中,可溶性蛋白质和多肽质量分数高达97%以上,说明其主要组分为低分子质量多肽。图2显示,3级组分都具有较好的清除•OH能力,经计算得出5 000~10 000、1 000~5 000 u和<1 000 u多肽的半数抑制浓度分别为8.73、7.54、6.02 mg/mL。其中,截留分子质量<1 000 u的多肽清除效果最好。该结果与相关研究中认为小分子质量海参多肽具有更好的抗氧化效果的结论相符 [18-19]。
2 分级组分及其可溶性蛋白质和多肽质量分数
Table 2 Molecular weight distribution and the total contents of soluble protein and peptide in the ultrafiltration fractions

各级组分质量分数可溶性蛋白质和多肽质量分数5~10 ku15.32±0.2857.66±0.80 1~5 ku26.83±0.4570.48±1.60<1 ku58.17±0.4397.72±1.60
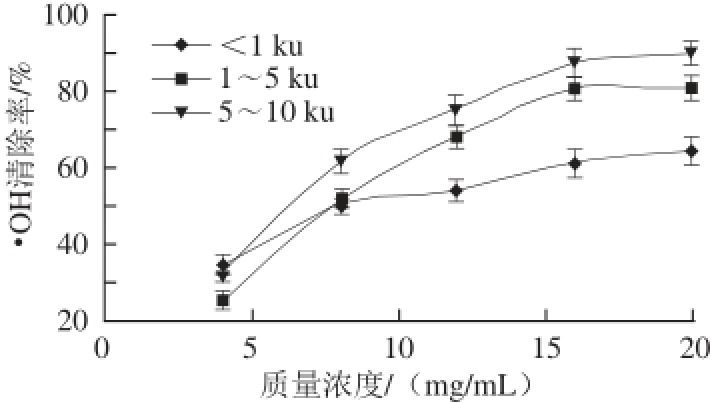
图2 分级多肽的清除
 OHH能力
OHH能力
Fig. 2 Hydroxyl radical scavenging capacity of the ultrafiltration fractions
2.3 氨基酸组成分析结果
由表3可知,截留分子质量<1 000 u多肽中Glu质量分数最高,达到19.76%,这与海参精原材料本身Glu含量高 [7]直接相关。其他质量分数较高的氨基酸分别为Asp、Lys、Tyr、Gly、Arg、Ala、Leu和Val。推测Arg、Lys和Gly质量分数较高与木瓜蛋白酶酶切位点的特异性有关。相关研究认为多肽的抗氧化性质与其氨基酸结构和分子质量等有直接关系 [20-25]。Ranathunga等 [20]认为疏水性氨基酸对小分子多肽的抗氧化效果具有重要贡献。制备多肽中Tyr、Ala、Leu和Val的较高质量分数有助于其具备良好的抗氧化性。Udenigwe等 [23]研究发现含硫氨基酸、酸性氨基酸和疏水性氨基酸的存在有助于提升多肽清除1,1-二苯基-2-三硝基苯肼自由基和•OH的能力。相关研究发现富含酸性氨基酸的多肽具有更好的抗氧化能力 [24-25],Glu和Asp属于酸性氨基酸,它们在多肽氨基酸组分中占比较大的结果与其他抗氧化肽氨基酸组分分析结果类似 [25]。
表3 分子质量小于1 000 u多肽的氨基酸组成
Table 3 Amino acid composition of the peptide with molecular weight less than 1 000 u
氨基酸苏氨酸精氨酸缬氨酸蛋氨酸异亮氨酸亮氨酸苯丙氨酸赖氨酸组氨酸天冬氨酸谷氨酸丝氨酸甘氨酸丙氨酸半胱氨酸酪氨酸(Thr)(Arg)(Val)(Met)(Iso)(Leu)(Phe)(Lys)(His)(Asp)(Glu)(Ser)(Gly)(Ala)(Cys)(Tyr)质量分数4.70±0.016.45±0.175.14±0.032.28±0.063.62±0.006.08±0.043.40±0.057.18±0.101.88±0.0210.78±0.0819.76±0.124.28±0.016.53±0.106.12±0.122.76±0.686.58±0.25
2.4 多肽抗氧化动物实验结果
2.4.1 小鼠体质量变化
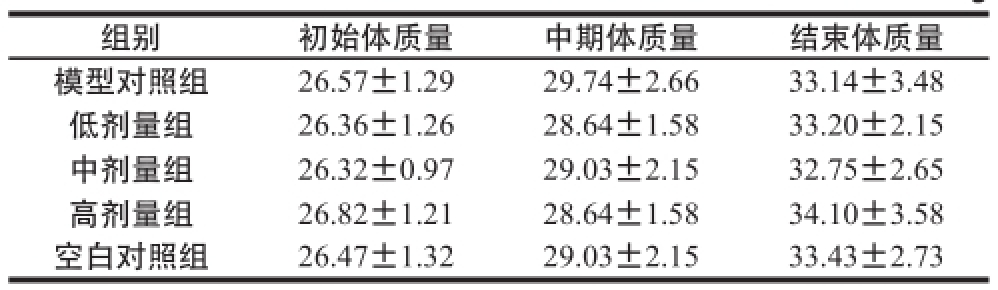
表4 小鼠体质量变化
Table 4 Change in body weight in mice
注:各组实验数据均为测定10 只小鼠的
 表5、6同。
表5、6同。
组别初始体质量中期体质量结束体质量模型对照组26.57±1.2929.74±2.6633.14±3.48低剂量组26.36±1.2628.64±1.5833.20±2.15中剂量组26.32±0.9729.03±2.1532.75±2.65高剂量组26.82±1.2128.64±1.5834.10±3.58空白对照组26.47±1.3229.03±2.1533.43±2.73
由表4可知,模型对照组、各剂量组小鼠体质量在实验初始阶段、中期和结束时与空白对照组相比,均无明显差异(P>0.05)。
2.4.2 小鼠血中SOD活力和GSH含量
所有的需氧生物体在呼吸过程中都会产生副产物活性氧(reactive oxygen species,ROS),ROS分子不稳定,易对DNA、蛋白质和脂质等生物大分子造成损伤,从而引发一系列衰老性疾病,如癌症、老年痴呆症、动脉硬化、糖尿病等 [26-29]。ROS分子可以由外源性条件刺激产生,如吸烟、饮酒、辐照等 [30]。这种内源性氧化应激反应可以被SOD、GSH-Px和过氧化氢酶等内源性酶调控 [29]。在体内防御机制中,SOD能够把超氧阴离子转化成H 2O 2,进而再由过氧化氢酶或GSH-Px催化形成H 2O [30]。若H 2O 2不能被及时消除,产生•OH,将会引起细胞死亡。
表5 小鼠血中抗氧化酶活力和GSH质量浓度
Table 5 Antioxidant enzyme activities and GSH content in serum of mice

注:*. 与模型对照组相比差异显著(P<0.05);**. 与模型对照组相比差异极显著(P<0.01)。下同。
组别SOD活力/(U/g)GSH-Px活力/UGSH质量浓度/(g/L)模型对照组12 535.70±7 345.4439.93±6.500.315±0.058低剂量组16 179.38±8 796.3440.26±4.930.347±0.053中剂量组18 310.39±9 471.0741.78±4.300.365±0.086高剂量组21 513.02±6 391.89*43.71±4.670.406±0.058**空白对照组22 528.57±7 064.72**44.46±6.330.408±0.076**
由表5可知,模型对照组小鼠经酒精灌胃后,体内SOD活力下降明显。与模型对照组相比,实验组小鼠红细胞SOD活力均有提高,其中高剂量多肽组小鼠差异显著(P<0.05),活力恢复至接近空白对照组水平。实验组中高剂量组小鼠血液中GSH含量差异极显著(P<0.01)。实验组小鼠全血GSH-Px活力未达到差异显著水平(P>0.05)。GSH和GSH-Px同属于二相解毒代谢酶,GSH能够启动针对烷基化试剂、诱变剂和致癌物等的解毒作用,GSH-Px能够防止细胞膜脂质过氧化 [31]。通过实验数据可知,实验组喂食高剂量多肽后其抗氧化能力有了明显提高。
2.4.3 小鼠血中MDA浓度和蛋白质羰基含量
表6 小鼠肝组织中MDA浓度和蛋白质羰基含量
Table 6 The contents of MDA and protein carbonyl in serum of mice

组别MDA浓度/(nmol/L)羰基含量/(nmol/mg pro)模型对照组7.77±2.234.81±1.42低剂量组7.18±3.434.12±1.54中剂量组7.13±1.624.08±0.94高剂量组6.91±1.543.42±1.13 *空白对照组6.49±2.383.28±0.76 **
MDA通常由小鼠体内脂质过氧化产生,是检测脂质过氧化程度的常用指标 [28]。在蛋白质氧化损伤过程中,ROS攻击氨基酸分子中的自由氨基或亚氨基,最终形成NH 3和蛋白质羰基。蛋白质羰基是蛋白质被氧化损伤的一个重要指标,通过其含量可以判断蛋白质的氧化程度 [32-34]。由表6可知,多肽实验组和空白对照组的MDA浓度均低于模型对照组,虽然未达到差异显著的程度,但随着多肽剂量的增加,MDA含量呈逐级降低的趋势。高剂量组小鼠血液中蛋白质羰基含量显著低于模型对照组(P<0.05)。
通过酶解筛选、体外抗氧化和小鼠模型抗氧化实验,由木瓜蛋白酶水解,经超滤制备的<1 000 u仿刺参精多肽具有较好的体外清除•OH的能力。氨基酸组分分析结果表明,酸性氨基酸和疏水性氨基酸含量丰富,推测是其良好抗氧化性的化学基础。小鼠抗氧化模型实验结果表明,实验组生长正常,通过高剂量多肽的饲喂,能够有效提高小鼠体内SOD、GSH-Px活力和GSH质量浓度,MDA和蛋白质羰基含量得到有效降低,显示出<1 000 u仿刺参精多肽具有提高小鼠抗氧化能力的效果,具有进行相应功能产品开发的潜力。
参考文献:
[1] SUN Weihong, LENG Kailiang, LIN Hong, et al. Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J]. Chinese Journal of Animal Nutrition, 2010, 22(1): 212-220. DOI:10.3969/j.issn.1006-267x.2010.01.033.
[2] 苏秀榕, 娄永江, 常亚青, 等. 海参的营养成分及海参多糖的抗肿瘤活性的研究[J]. 营养学报, 2003, 25(2): 181-182. DOI:10.3321/ j.issn:0512-7955.2003.02.025.
[3] 盛文静, 薛长湖, 赵庆喜, 等. 不同海参多糖的化学组成分析比较[J]. 中国海洋药物杂志, 2007, 26(1): 44-49. DOI:10.3969/ j.issn.1002-3461.2007.01.012.
[4] 王静, 张京楼, 王铎喜, 等. 海参多肽的抗氧化性能研究[J]. 食品与机械, 2010, 26(2): 67-71.
[5] 孙鹏, 易杨华, 李玲, 等. 海参皂苷的生源分类和化学结构特征(楯手目)[J]. 中国天然药物, 2007, 5(6): 463-469.
[6] 樊廷俊, 袁文鹏, 丛日山, 等. 仿刺参水溶性海参皂苷的分离纯化及其抑瘤活性研究[J]. 药学学报, 2009, 44(1): 25-31. DOI:10.3321/ j.issn:0513-4870.2009.01.004.
[7] 张健, 王茂剑, 马晶晶, 等. 仿刺参生殖腺营养成分分析[J]. 食品科学, 2013, 34(14): 232-236. DOI:10.7506/spkx1002-6630-201314047.
[8] 向怡卉, 苏秀榕, 董明敏, 等. 复合蛋白酶水解海参生殖腺工艺的研究[J]. 食品工业科技, 2007, 28(3): 143-146. DOI:10.3969/ j.issn.1002-0306.2007.03.042.
[9] 赵鸿霞, 周大勇, 秦磊, 等. 响应面法优化海参卵酶解工艺[J]. 食品与机械, 2010, 26(5): 114-117. DOI:10.3969/j.issn.1003-5788.2010.05.033.
[10] 曹荣, 刘淇, 殷邦忠. 响应面法优化海参性腺酶解工艺的研究[J]. 食品科学, 2012, 33(2): 29-33.
[11] 陈卉卉, 于平, 励建荣. 东海海参胶原蛋白多肽的制备及清除自由基功能研究[J]. 中国食品学报, 2010, 10(1): 19-25. DOI:10.3969/ j.issn.1009-7848.2010.01.003.
[12] 王颖, 张健, 王茂剑, 等. 仿刺参肠道组织酶解工艺优化及肽段分析[J].食品科学, 2014, 35(23): 182-187. DOI:10.7506/spkx1002-6630-201423036.
[13] 许长成, 邹琦, 程炳嵩. 硫代巴比妥酸(TBA)法检测脂质过氧化水平的探讨[J]. 植物生理学报, 1989(6): 58-60.
[14] 孟雪莲, 陈长兰, 孔维娟, 等. 虫草素抑制脂多糖诱导的小胶质细胞活化及神经保护作用[J]. 食品科学, 2014, 35(19): 224-230. DOI:10.7506/spkx1002-6630-201419045.
[15] YAO Ping, LI Ke, JIN You, et al. Oxidative damage after chronic ethanol intake in rat tissues: prophylaxis of Ginkgo biloba extract[J]. Food Chemistry, 2006, 99(2): 305-314. DOI:10.1016/ j.foodchem.2005.07.047.
[16] ZHOU Xiaoqiu, WANG Changhai, JIANG Aili. Antioxidant peptides isolated from sea cucumber Stichopus Japonicus[J]. European Food Research and Technology, 2012, 234(3): 441-447. DOI:10.1007/ s00217-011-1610-x.
[17] 赵强忠, 刘丹. 秋刀鱼抗氧化肽制备及其抗氧化活性的研究[J]. 现代食品科技, 2014, 30(10): 165-171.
[18] 王天明, 苏意钢, 马永钧, 等. 海地瓜多肽分离及抗氧化活性研究[J].现代食品科技, 2014, 30(5): 75-81.
[19] WANG Jingfeng, WANG Yuming, TANG Qingjuan, et al. Antioxidation activities of low-molecular-weight gelatin hydrolysate isolated from the sea cucumber Stichopus japonicus[J]. Journal of Ocean University of China, 2010, 9(1): 94-98. DOI:10.1007/s11802-010-0094-9.
[20] RANATHUNGA S, RAJAPAKSE N, KIM S K. Purification and characterization of antioxidative peptide derived from muscle of conger eel (Conger myriaster)[J]. European Food Research & Technology, 2006, 222(3): 310-315. DOI:10.1007/s00217-005-0079-x.
[21] BAMDAD F, CHEN Lingyun. Antioxidant capacities of fractionated barley hordein hydrolysates in relation to peptide structures[J]. Molecular Nutrition & Food Research, 2013, 57(3): 493-503. DOI:10.1002/mnfr.201200252.
[22] BAMDAD F, AHMED S, CHEN L Y. Specifically designed peptide structures effectively suppressed oxidative reactions in chemical and cellular systems[J]. Journal of Functional Foods, 2015, 18(Part A): 35-46. DOI:10.1016/j.jff.2015.06.055.
[23] UDENIGWE C C, ALUKO R E. Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J]. International Journal of Molecular Sciences, 2011, 12(5): 3148-3161. DOI:10.3390/ijms12053148.
[24] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3661-3667. DOI:10.1021/jf021156g.
[25] 常飞, 杨雪果, 肖士成, 等. 脱脂羊脑蛋白水解多肽的分离纯化及抗氧化活性[J]. 食品科学, 2016, 37(1): 33-39. DOI:10.7506/spkx1002-6630-201601007.
[26] HARMAN D. Free-radical theory of aging: an update: increasing the functional life span[J]. Annals of the New York Academy of Sciences, 1994, 1067: 10-21. DOI:10.1111/j.1749-6632.1994.tb12069.x.
[27] MARITIM A C, SANDERS R A, WATKINS J B, et al. Diabetes, oxidative stress, and antioxidants: a review[J]. Journal of Biochemical & Molecular Toxicology, 2003, 17(1): 24-38. DOI:10.1002/jbt.10058.
[28] HALLIWELL B, WHITEMAN M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean?[J]. British Journal of Pharmacology, 2004, 142(2): 231-255. DOI:10.1038/sj.bjp.0705776.
[29] KUMAR N S S, NAZEER R A. In vivo antioxidant activity of peptide purified from viscera protein hydrolysate of horse mackerel (Magalaspis cordyla)[J]. International Journal of Food Science & Technology, 2012, 47(7): 1558-1562. DOI:10.1111/j.1365-2621.2012.03002.x.
[30] RILEY P A. Free radicals in biology: oxidative stress and the effects of ionizing radiation[J]. International Journal of Radiation Biology, 1994, 65(1): 27-33. DOI:10.1080/09553009414550041.
[31] DAS I, SAHA T. Effect of garlic on lipid peroxidation and antioxidation enzymes in DMBA-induced skin carcinoma[J]. Nutrition, 2009, 25(4): 459-471. DOI:10.1016/j.nut.2008.10.014.
[32] 文镜, 张春华, 董雨, 等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学, 2003, 24(10): 153-157.
[33] REZNICK A Z, PACKER L. Oxidative damage to proteins: spectrophotometric method for carbonyl assay[J]. Methods in Enzymology, 1994, 233: 357-363. DOI:10.1016/S0076-6879(94)33041-7.
[34] SOHAL R S, AGARWAL S, DUBEY A, et al. Protein oxidative damage is associated with life expectancy of housef ies[J]. Proceedings of the National Academy of Sciences, 1993, 90(15): 7255-7259. DOI:10.1073/pnas.90.15.7255.
Preparation and Antioxidant Activity of Low Molecular Weight Peptide from Apostichopus japonicus Sperm
ZHANG Jian
1,2,3, LIU Shaowei
1,*, ZHANG Yi
2, WANG Gongming
3, ZHAO Yunping
3, LIU Jingxi
3, LIU Xin
3
(1. State Key Laboratory of Bioreactor Engineering, College of Biotechnology, East China University of Science and Technology, Shanghai 200237, China; 2. Shanghai Institutes for Biological Sciences, Chinese Academy of Science, Shanghai 200233, China; 3. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China)
Abstract:The chemical components and in vivo antioxidant activity of peptides prepared from Apostichopus japonicus sperm were detected. The best enzyme to prepare antioxidant peptides from Apostichopus japonicus sperm was selected by comparing the hydroxyl radical scavenging activities of f ve protein hydrolysates obtained with papain, protamex and f avourzyme. After ultraf ltration of the hydrolysates, the weight distribution, soluble protein and polypeptide contents and hydroxyl radical scavenging capacity of the fractions were determined. The low molecular weight component of the peptide with higher hydroxyl radical scavenging capacity was analyzed for its amino acid composition, and then it was orally administered to mice at low, middle and high dosages (100, 200, 600 mg/kg), respectively. The administration period for the three dosage groups as well as the model control and blank control groups lasted for 42 days. At the end of administration, superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) activities, GSH, malondialdehyde (MDA) and protein carbonyl contents were measured in the serum of mice. Results showed that the peptide prepared by papain hydrolysis and ultraf ltration with molecular weight cut-off of < 1 000 u had better hydroxyl radical scavenging capacity in vitro with half maximal inhibitory concentration of 6.02 mg/mL, accounting for 58% of the total peptides. The acidic amino acid glutamic acid and the hydrophobic amino acid tyrosine dominated its amino acid composition. The results of antioxidant tests with a mouse model showed that all experimental mice could normally growth, and serum SOD activity and GSH content in themice from the high-dosage group were improved signif cantly (P < 0.05) and highly signif cantly (P < 0.01), respectively. The activity of GSH-Px also exhibited a dosage-dependent improvement, but did not show a signif cant difference (P > 0.05). The contents of MDA and protein carbonyl were both reduced and the latter was signif cant (P < 0.05). All these results demonstrated that the peptide with a molecular weight less than 1 000 u could enhance antioxidant function in mice, and therefore it has potential as an ingredient of functional foods.
Key words:Apostichopus japonicus sperm; peptide; antioxidation; mouse
收稿日期:2016-03-09
基金项目:国家海洋公益性行业科研专项(201205027-4);山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-22-07);山东省自然科学基金培养基金项目(ZR2014CP030);烟台市科技发展计划项目(2014ZH081)
作者简介:张健(1980—),男,副研究员,博士,研究方向为生物化学与分子生物学、食品科学与工程。E-mail:zjsd408@163.com
*通信作者:刘少伟(1972—),男,教授,博士,研究方向为生物化学与分子生物学、食品科学与工程。E-mail:swliu@ecust.edu.cn
DOI:10.7506/spkx1002-6630-201623041
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2016)23-0248-06
引文格式:
张健, 刘少伟, 张毅, 等. 仿刺参精低分子质量多肽的制备及抗氧化作用[J]. 食品科学, 2016, 37(23): 248-253.
DOI:10.7506/spkx1002-6630-201623041. http://www.spkx.net.cn
ZHANG Jian, LIU Shaowei, ZHANG Yi, et al. Preparation and antioxidant activity of low molecular weight peptide from Apostichopus japonicus sperm[J]. Food Science, 2016, 37(23): 248-253. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201623041. http://www.spkx.net.cn