
图1 单端孢酶烯族毒素的基本结构
Fig. 1 Basic chemical structure of trichothecenes
薛华丽 1,2,毕 阳 2,*,宗元元 2,蒲陆梅 1,王 毅 2,李永才 2
(1.甘肃农业大学理学院,甘肃 兰州 730070;2. 甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
摘 要:果蔬在生长、贮存、运输及加工等一系列过程中,极易受到各种病原菌的侵染而发生腐烂,腐烂果蔬不仅造成巨大的经济损失,而且导致果蔬积累大量的真菌毒素。真菌毒素可通过食物链的传递对人或动物的健康带来巨大威胁。本文就果蔬中常见真菌毒素的种类、产毒菌株、侵染途径、产毒条件、毒性作用、检测方法和限量标准等方面进行详细的总结,旨在为果蔬中真菌毒素的控制提供参考。
关键词:真菌毒素;果蔬;控制;检测
水果和蔬菜是人类膳食的重要组成部分,具有其他类食品所不可替代的作用。然而,果蔬在采后贮藏和运输等过程中,极易受到各种病原菌的侵染而发生腐烂。腐烂的果蔬不仅造成巨大的经济损失,而且会在其腐烂部位及其周围健康组织中积累大量的真菌毒素,对人类和动物健康造成潜在的威胁 [1-3]。然而,目前关于该方面的研究还未引起人们的足够重视。本文主要阐述了果蔬中常见几种典型的真菌毒素的产毒菌株、侵染途径、产毒条件以及对人体健康的危害,以期为提高食品的质量安全,减少果蔬中生物毒素对人体健康的危害提供理论依据。
真菌毒素不仅污染小麦、大麦、燕麦、玉米等禾谷类作物 [4-6],也危害苹果和梨 [7]、马铃薯 [8]、葡萄 [9]、石榴 [10]等果蔬类经济作物及其制品。被污染的果蔬不但可能失去经济价值,重要的是,受真菌毒素污染的果蔬被人和动物食用后会产生广泛的毒性效应,包括致癌、致畸、致突变等作用。不过,并不是所有病原菌在任何条件下都可以产生真菌毒素,只有产毒菌株在适宜的温、湿度条件下才可成功侵染寄主,从而在寄主体内积累真菌毒素,并且不同食品、尤其果蔬类制品中积累的真菌毒素种类不同。目前已发现的果蔬中常见的真菌毒素有几十种,可分为四大类,分别介绍如下。
1.1 单端孢霉烯族毒素
1.1.1 单端孢霉烯族毒素产毒菌种
单端孢霉烯族毒素(trichothecenes) 主要是由镰刀菌(Fusarium)、木霉(Trichoderma)、单端孢(Trichthecium)、头孢霉(Cephalosporium)、漆斑霉(Myrothecium)、轮枝孢(Verticillium)和黑色葡萄状穗霉(Stachybotrys)等属的真菌产生 [11]。它是一类化学性质相关的真菌毒素,据其化学结构的不同,可将其分为A、B、C、D四大类,其中以A和B型较为常见,A型(图1A)在C8位上有羟基(—OH)或酯基(—COOR)的存在,B型(图1B)在C8位上有羰基(—C=O),具体结构如图1。

图1 单端孢酶烯族毒素的基本结构
Fig. 1 Basic chemical structure of trichothecenes
1.1.2 病原菌侵入果蔬的途径及产毒条件
产生该类毒素的病原菌在果蔬采收之前其实已经通过寄主表面的伤口或自然孔口成功定殖于寄主体内。在低温、高湿、pH值偏酸性条件下,病原菌生长迅速。如Jawad等 [12]分析了温、湿度和pH值对F. graminearum代谢产生单端孢霉烯族毒素的影响,结果表明:对T-2毒素(T-2 toxin,T-2)和HT-2毒素来说,总的产毒变化趋势是20 ℃>26 ℃>33 ℃;高水分含量>低水分含量;酸性>碱性。本实验室也比较了室温(20 ℃)和低温(5 ℃)贮藏条件对马铃薯块茎中单端孢霉烯族毒素积累的影响,结果表明:室温贮藏更有利于干腐病马铃薯块茎中单端孢霉烯族毒素的积累 [1]。Tang Yamei等 [2]也发现室温贮藏条件下,心腐病苹果中单端孢霉烯族毒素的含量更高。
1.1.3 单端孢霉烯族毒素的污染及毒性
单端孢霉烯族类毒素广泛存在于干腐病马铃薯块茎、心腐病苹果等果蔬类中,如Xue Huali等 [1]在人工损伤接种F. sulphureum,F. sambucinum和F. solani菌种干腐病马铃薯块茎中均检测到了3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3-ADON)、镰刀菌烯醇(fusarenon X,Fus-X)、T-2和蛇形毒素(diacetoxyscirpenol,DAS)的存在。Tang Yamei等 [2]在由T. roseum引起的心腐病苹果中检测到了T-2和新茄病镰刀菌烯醇(neosolaniol,NEO)毒素。单端孢霉烯族毒素的毒性作用机理主要是通过抑制和干扰人和动物体内的蛋白质和核酸的合成,从而对人畜健康产生免疫抑制 [13]。人畜在食用该类毒素污染的食品后可产生广泛的毒性效应。如脱氧雪腐镰刀菌烯醇可引起人和动物头昏、腹胀、恶心、呕吐等症状,若长期摄入,则具有致癌、致畸、遗传毒性、肝细胞毒性、中毒性肾损害、生殖紊乱、免疫抑制的作用。T-2可损伤细胞膜,引起淋巴腺和造血细胞组织的凋亡,同时还可导致骨髓坏死、白细胞减少和软骨组织退行性变化等。
1.1.4 单端孢霉烯族毒素的检测及限量标准
目前,关于单端孢霉烯族类毒素常用的检测方法基本上可分为免疫学检测和化学检测两大类。免疫学检测方法主要是酶联免疫(enzyme linked immune sorbent assay,ELISA)法。如将DON的C15位羟基与牛血清白蛋白形成的偶联物作为抗原制备出的单抗用于进行ELISA检测,可检测出DON和15-ADON的存在,但不与3-ADON反应,检出限为0.05~20 μg/mL [14]。化学检测主要包括薄层色谱法、气相色谱法和高效液相色谱法。如Sokolovic等 [15]采用薄层色谱法对食品中T-2和DAS进行检测,回收率分别为85%和90%,最低检测限0.1 mg/kg。以priboFastM270为净化柱,结合超高压液相色谱-串联质谱法(ultra performance liquid chromatograph-mass/mass,UPLC-MS/MS)对马铃薯块茎干腐病组织中3-ADON、DAS、T-2和Fus-X 4种单端孢霉烯族毒素进行测定,发现该方法除对T-2回收率为78%,3-ADON、DAS、Fus-X回收率均高于80% [8]。Tang Yamei等 [2]通过UPLC-MS/MS同时检测了苹果中NEO和T-2的含量,检出限为0.002~0.005 μg/g、定量限为0.005~0.010 μg/g、平均回收率为73.48%~96.35%。目前,果蔬中单端孢霉烯族毒素的研究报道尚处于起步阶段,我国及欧盟对该类毒素在果蔬中还未设立限量标准。
1.2 展青霉素
1.2.1 展青霉素产毒菌
展青霉素(patulin),又名棒曲霉毒素、珊瑚青霉毒素,可由曲霉属和青霉属中的棒曲霉(Aspergillus clavatus)、扩展青霉(Penicillium expansum)、展青霉(P. patulin)、曲青霉(P. pergillus) 等病原真菌产生。其中扩展青霉是引起苹果、梨等果蔬腐烂且产生展青霉素的主要菌种 [16]。棒曲霉毒素的化学结构式如图2所示。
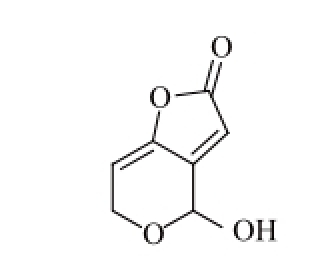
图2 棒曲霉毒素的基本结构
Fig. 2 Chemical structure of patulin
1.2.2 病原菌侵入果蔬的途径及产毒条件
病原菌主要在果蔬采收后贮藏和运输的过程中通过寄主表面的伤口或自然孔口侵入。病原菌产生展青霉素的温度范围较宽,一般在0~40 ℃范围内均可产生。Yang Qiya等 [17]分析了不同温度及培养时间对扩展青霉生长量及展青霉素产量的影响,结果发现,扩展青霉产生展青霉素的最适温度为20~25 ℃,且随着培养时间的延长,产毒量呈现先增加而后降低的单峰型变化趋势。同时高湿条件有利于展青霉素的产生 [18]。此外,pH值环境对展青霉素的产生也具有至关重要的作用。Zong Yuanyuan等 [19]研究了不同环境pH值对扩展青霉菌体生物量和展青霉素产量的影响。结果表明,酸性环境比碱性环境更利于展青霉素合成,pH 4~5是展青霉素合成的最适pH值。
1.2.3 展青霉素的污染及毒性
展青霉素是一种世界范围内的水果污染物,在多种水果、水果制品和果酒中均有发现。如刘华锋等 [20]在富士、小国光、黄香蕉苹果中均检测到展青霉素的存在,且随着霉心病病斑直径的增大,展青霉素含量在增加。María等 [21]对西班牙不同超市苹果汁样品进行抽样分析,结果发现,11%样品中展青霉素超出了欧洲的最高限量水平50 μg/L,污染水平为0.7~18.7 μg/L,平均和中位含量分别为19.4 μg/L和4.8 μg/L。展青霉素对人及动物均具有较强的毒性作用。当人摄取了展青霉素,可通过影响细胞膜的透过性间接地引起生理呼吸异常。而动物如大鼠摄取了该毒素,其急性中毒症状主要表现为痉挛、肺出血水肿、皮下组织水肿、肾淤血变性、无尿直至死亡;中毒奶牛主要表现为上行性神经麻痹、中枢神经系统水肿及灶性出血 [22]。亚急性毒性实验表明,中剂量的展青霉素对大鼠饮食和饮液减少,体质量减轻,而高剂量的展青霉素则对大鼠的肾和胃肠系统有毒性作用,可直接导致基底胃溃疡 [23]。
1.2.4 展青霉素的检测及限量标准
鉴于展青霉素的毒性及其污染情况,开展展青霉素的检测非常必要。对于展青霉素的检测方法主要有薄层色谱法、气相色谱法和高效液相色谱法等。Tarter等 [24]首次采用七氟丁酰衍生化毛细管气相色谱法(gas chromatograph,GC)测定展青霉素的含量,衍生产物经GC-MS确认,电子捕获检测器对七氟丁酸展青霉素在0.05~0.50 ng范围内成线性,平均回收率为84%,检测限低于10 μg/L。最近,色谱串联技术(高效液相色谱-紫外(high performance liquid chromatographyultroviolet,HPLC-UV)、HPLC-二极管阵列器(HPLC-diode array detection,HPLC-DAD)和HPLC-MS/MS)广泛运用于展青霉素的检测。Li等 [25]建立了苹果和山楂中展青霉素测定的UPLC-MS/MS检测方法。在短短不到4 min的时间内即可得到样品中展青霉素的含量。关于展青霉素的限量标准,目前世界上已有十几个国家制定了水果及其制品中展青霉素的现行限量标准。如欧盟对果蔬及其制品中展青霉素限量标准:果汁、浓缩果汁及水果花蜜、酒精饮料苹果酒和其他以苹果为原料或包含苹果汁的发酵饮料≤50 μg/kg;固体苹果制品包括糖渍苹果、直接食用苹果汤类≤50 μg/kg;婴幼儿及儿童食用苹果汁或苹果制品≤10 μg/kg;而我国只规定苹果和山楂制品中展青霉素的最高允许量为50 μg/kg [22]。
1.3 赭曲霉毒素
1.3.1 赭曲霉毒素产毒菌
赭曲霉毒素(ochraceors)主要是由曲霉属,如赭曲霉(Aspergillus ochraceus)、硫黄色曲霉(A. sulphureus)、菌核(A. sclerotium)、洋葱曲霉(A. alliaceus)、孔曲霉(A. ostianus)、炭黑曲霉(A. niveus)等7 种曲霉;和青霉属真菌,如纯绿青霉(Penicillium viridicatum)、疣孢青霉(P. verrucosum)、产紫青霉(P. purpurescens)、圆弧青霉(P. cyclopium)等6 种青霉产生的一种病原真菌毒素,属于聚酮类化合物,包括7 种结构类似的化合物(图3) [26]。其中,赭曲霉毒素A(ochratoxin A,OTA)在自然界分布最广泛,毒性最强,对人类和动植物影响最大。

图3 赭曲霉毒素的基本结构
Fig. 3 Basic chemical structure of ochraceors
1.3.2 病原菌侵入果蔬的途径及产毒条件
产赭曲霉毒素的病原菌主要在果蔬采收后贮藏和运输的过程中通过寄主表面的伤口或果实之间的相互接触而侵染。青霉属真菌产生OTA的条件一般是气温低于30 ℃且水分活度较低的地方生长。因此,在寒冷地区,粮食作物中OTA的来源主要是青霉菌产生的 [27]。曲霉菌属的生长条件与青霉菌属刚好相反,主要在热带和亚热带地区生长,Schmidt-Heydt等 [28]分析了不同温度、湿度和pH值对OTA毒素合成的影响,结果发现,温度在25~30 ℃、湿度98%,pH 6~8条件下最适宜赭曲霉毒素的产生。
1.3.3 赭曲霉毒素的污染及毒性
由于OTA产生菌广泛分布于自然界,所以在干果、葡萄及葡萄酒、罐头食品等多种果蔬及制品中均有检出。葡萄酒中的OTA最早是由Zimmerli等 [29]首次报道。随后,澳大利亚、法国、西班牙等许多国家相继在葡萄酒中检测到了OTA 的存在 [30]。此外,葡萄汁和葡萄干也存在高含量OTA,为1.16~2.32 μg/kg和40 μg/kg [31]。葡萄制品中OTA的污染来源于葡萄原料,Rita等 [32]对葡萄牙11 个葡萄园酿酒葡萄进行抽样分析,结果发现3 个葡萄园检测到了OTA的存在,含量0.035~0.061 μg/kg。OTA对人类和动物的毒性作用主要表现为肾脏毒、肝毒、致畸、致癌、致突变和免疫抑制作用。国际癌症研究机构将其定为2B类致癌物,如当OTA含量为1 mg/kg时,可使家禽产蛋率下降;含量超过5 mg/kg时,对动物肝脏组织和肠产生损坏作用 [22]。通过动物细胞实验,将其暴露于OTA中,结果发现DNA损伤不再修复,该致病机理主要是通过胎盘的致畸致癌物,因为,OTA可通过怀孕小鼠胎盘到达致命器官并产生DNA加合物,同时发现,雄性小鼠对OTA的毒性较雌性小鼠更敏感 [30]。
1.3.4 赭曲霉毒素的检测及限量标准
由于OTA较强的毒性效应,以及其在果蔬、尤其葡萄及其制品中存在的广泛性。所以,开展果蔬中OTA的检测研究势在必行。OTA的常用的检测分析手段有薄层层析法、HPLC和ELISA法等。OTA 的薄层层析法是在1973年通过,1988年成为国际分析化学家协会的官方方法 [33]。Curto等 [34]采用HPLC法对23 份红、白葡萄酒中的OTA含量进行了调查分析,结果表明,所有红葡萄酒均有OTA污染,且红葡萄酒比白葡萄酒污染OTA的频率更高,检测下限为0.01 μg/L。ELISA法由于其具有快速、灵敏、可定量、操作简便、无需贵重仪器设备,对样品纯度要求不高和经济等特点,适合批量样品的筛选和普检,因此,被广泛应用于食品中真菌毒素快速检测。Ruprich等 [35]建立的检测OTA的ELISA法中采用的抗OTA多克隆抗体与OTB和OTC的交叉反应率分别为0.01%和1.4%,大大提高了检测的精密度和准确度。目前已有11 个国家和地区制定了OTA的限量标准,其中大多是欧洲国家。欧盟委员会于2005年1月1日在食品中OTA的限量标准增加了葡萄酒及其制品,分别为葡萄酒、以及用于饮料制作的葡萄酒或者葡萄,限量标准为2.0 μg/kg;葡萄汁及其他饮料中的葡萄汁成分中为2.0 μg/kg,国际葡萄与葡萄酒组织也推荐葡萄酒中OTA的最大限量标准为2.0 μg/kg [36]。
1.4 交链孢霉毒素
1.4.1 交链孢酶毒素产毒菌
交链孢霉毒素主要是由互隔链格孢(Alternaria alternata)病原菌产生 [37]。交链孢霉可以产生40多种毒素及其衍生物,据其化学结构和毒性作用不同,可分为三大类:1)二苯吡喃酮化合物,又称聚酮,主要有交链孢酚(alternaiol,AOH)、交链孢酚单甲醚(alternariol monomethyl ether,AME)、交链孢烯(altenuene,A LT);2)四价酸类化合物,如交链孢菌酮酸(tenuazonic acid,TA);3)戊醌类化合物,主要包括:交链孢毒素Ⅰ(altertoxinⅠ,ATX-Ⅰ)、ATX-Ⅱ、ATX-Ⅲ。其中,AOH、AME、ALT和TA是果蔬中最常见的,也是最重要的交链孢霉毒素种类,其化学结构式如图4所示 [22]。

图4 交链孢霉毒素的基本结构
Fig. 4 Basic chemical structure of alternaiol
1.4.2 病原菌侵入果蔬的途径及产毒条件
由于交链孢霉是一种广泛污染食品的病菌之一。这种病菌具有腐生寄生以及植物致病性,既可以在田间通过果蔬类作物的自然孔口侵入,也可以在果蔬采后贮藏和运输过程中通过伤口或健康果蔬与腐烂果蔬的相互接触而霉变 [38-39]。 交链孢霉产毒需要在一定的条件,如Pose等 [40]分析了不同温、湿度条件对TA、AOH和AME产生的影响,结果表明,在温度为6 ℃、高水分活度条件下可检测到TA和痕量的AOH和AME,但低水分活度条件下未发现3 种毒素的存在;当温度升高时,3 种毒素的积累量呈现增加的趋势,对TA来说,最佳的产毒条件为21 ℃,水分活度0.982;对于AME毒素最佳产毒条件为35 ℃,水分活度0.954;对AOH最佳产毒条件为21℃,水分活度为0.982。交链孢霉毒素产生的最佳pH值为4~5 [41]。ALT在一定的温度和低氮状况时产生,在天然或培养中相对检出较低。
1.4.3 交链孢毒素的污染及毒性
交链孢毒素广泛存在于霉变的果蔬中,Stinson等 [42]发现霉变苹果中的AOH的最高含量可达160 μg/kg。Magnani等 [43]调查橘皮样品中的链格孢霉毒素含量,阳性检出率75%,其中AOH和AME含量分别为2.5~17.4 μg/kg和0.9~3.5 μg/kg。Delgado等 [44]在红葡萄汁中也检测到高含量AOH和AME的存在,质量浓度分别为0.03~0.46 μg/L和0.01~39.5 μg/L。何强等 [45]在浓缩苹果汁样品中也检测到了1.2 μg/kg交链孢毒素的存在。大多数交链孢毒素的急性毒性较低,但AOH、AME却具有明显的遗传毒性和致突变性 [46-47]。Yekeler等 [48]给小鼠经口半数致死量为100 mg/kg的AME 10 个月,小鼠食管黏膜出现癌前病变。Lehmann等 [49]用AOH处理V79细胞,结果发现细胞周期停滞在G2和S期。此外,我国食管癌高发区可能与进食被交链孢毒素污染的食品有关 [50]。
1.4.4 交链孢毒素的检测及限量标准
目前,交链孢毒素的检测方法与其他真菌毒素类似,包括薄层色谱法、GC法、HPLC法和ELISA法等。但以LC法占主导。如陈月萌 [51]建立了同时检测水果中ALT、AOH、AME的HPLC-荧光检测法,该法加标回收率在78.2%~110.2%,相对标准偏差为5.9%~8.6%。史文景 [52]建立了同时测定柑橘中链格孢酚甲基乙醚、AOH、腾毒素和桔青霉素等4 种真菌毒素的简便、快速、安全、价格低廉(QUEChERS)-UPLC-MS/MS的分析方法,该法检出限为0.2~0.7 μg/kg,加标回收率为78.0%~103.3%。同时还测定了不同果汁(橙汁、苹果汁、梨汁、葡萄汁、桃汁)中3 种链格孢霉毒素(AOH、链格孢酚甲基乙醚、腾毒素)的分散液液微萃取-超高效液相色谱-DAD分析方法,该发现相对标准偏差为1.9%~9.2%,净化效果好,13 min就可完成对果汁中3 种毒素的检测。目前对交链孢毒素还未设立限量标准。
霉变果蔬中的真菌毒素主要以单端孢霉烯族毒素、展青霉素、赭曲霉毒素和交链孢毒素为主,产生这些真菌毒素的病原菌种类较多,其中一些病原菌是在果蔬采收之前就已经通过自然孔口或伤口侵染,另一些病原菌是在果蔬采收后贮藏和运输过程中通过伤口或腐烂果蔬与健康果蔬相互接触而霉变。众所周知,霉变果蔬中积累的真菌毒素对人畜的健康存在较大的威胁。所以,开展果蔬中真菌毒素污染的检测研究极为重要和迫切。目前,果蔬中真菌毒素的检测方法主要以LC法为主,该法检出限、定量限和加标回收率均可达到检测的目的。然而,由于LC-MS仪器设备昂贵,检测费用较高,很难在实际生产和生活中得到广泛应用。所以,开展果蔬中真菌毒素的快速、简便、灵敏的检测技术必将成为提高当前果蔬品质的一个重要方面,只有改进和完善检测技术,才能确保人畜健康和农产品安全。
参考文献:
[1] XUE H L, BI Y, TANG Y M, et al. Effect of cultivars, Fusarium strains and storage temperature on trichothecenes production in inoculated potato tubers[J]. Food Chemistry, 2014, 151(1): 236-242. DOI:10.1016/j.foodchem.2013.11.060.
[2] TANG Y M, XUE H L, YANG B, et al. A method of analysis for T-2 toxin and neosolaniol by UPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J]. Food Additives and Contaminants-Part A, 2015, 32(4): 480-487. DOI:10.1080/19440049.2014.968884.
[3] HE J, ZHOU T, YOUNG J C, et al. Chemical and biological transformations for detoxi cation of trichothecene mycotoxins in human and animal food chains: a review[J]. Trends in Food Science & Technology, 2010, 21(2): 67-76. DOI:10.1016/j.tifs.2009.08.002.
[4] TWARUŻEK M, BŁAJET-KOSICKA A, WENDA-PIESIK A, et al. Statistical comparison of Fusarium mycotoxins content in oat grain and related products from two agricultural systems[J]. Food Control, 2013, 34(2): 291-295. DOI:10.1016/j.foodcont.2013.05.010.
[5] GOERTZ A, ZUEHLKE S, SPITELLER M, et al. Fusarium species and mycotoxin profiles on commercial maize hybrids in Germany[J]. European Journal of Plant Pathology, 2010, 128(1): 101-111. DOI:10.1007/s10658-010-9634-9.
[6] JESUS B, JUAN-CARLOS M, SAMIRA E L, et al. Simultaneous determination of Fusarium mycotoxins in wheat grain from Morocco by liquid chromatography coupled to triple quadrupole mass spectrometry[J]. Food Control, 2014, 46(12): 1-5. DOI:10.1016/ j.foodcont.2014.04.019.
[7] PASTER N, HUPPERT D, BARKAI-GOLAN R. Production of patulin by different strains of Penicillium expansum in pear and apple cultivars stored at different temperatures and modified atmospheres[J]. Food Additives and Contaminants, 1995, 12(1): 51-58. DOI:10.1080/02652039509374278.
[8] XUE H L, BI Y, WEI J M, et al. New method for the simultaneous analysis of types A and B trichothecenes by ultrahigh-performance liquid chromatography coupled with tandem mass spectrometry in potato tubers inoculated with Fusarium sulphureum[J]. Journal of Agricultural and Food Chemistry, 2013, 61(39): 9333-9338. DOI:10.1021/jf402997t.
[9] ZIMMERLI B, DICK R. Ochratoxin A in table wine and grape-juice: occurrence and risk assessment[J]. Food Additives & Contaminants, 1996, 13(1) : 655-68. DOI:10.1080/02652039609374451.
[10] CHARALAMPOS K M, STEFANOS T, ZISIS V, et al. Determination of mycotoxins in pomegranate fruits and juices using a QUEChERS-based method[J]. Food Chemistry, 2015, 182(1): 81-88. DOI:10.1016/ j.foodchem.2015.02.141.
[11] MENEELY J P, RICCI F, van EGMOND H P, et al. Current methods of analysis for the determination of trichothecene mycotoxins in food[J]. Trends in Analytical Chemistry, 2011, 30(2): 192-203. DOI:10.1016/j.trac.2010.06.012.
[12] JAWAD M, FLORENCE R, CHRISTIAN B. The pH regulatory factor Pac1 regulates Tri gene expression and trichothecene production in Fusarium graminearum[J]. Fungal Genetics and Biology, 2011, 48(3): 275-284. DOI:10.1016/j.fgb.2010.11.008.
[13] ROCHA O, ANSARI K, DOOHAN F M. Effects of trichothecene mycotoxins on eukaryotic cells: a review[J]. Food Additives and Contaminants, 2005, 22(4): 369-378. DOI:10.1080/02652030500058403.
[14] SINHA R C, SAVARD M E, LAU R. Production of monoclonal antibodies for the specific detection of DON and 15-acetyldeoxyivalenol by ELISA[J]. Agricultural Food Chemistry, 1995, 43(6): 1740-1744. DOI:10.1021/jf00054a061.
[15] SOKOLOVIC M, SIMPRAGA B. Survey of trichothecene mycotoxins in grains and animal feed in Croatia by thin layer chromatography[J]. Food Control, 2006, 17(9): 733-740. DOI:10.1016/ j.foodcont.2005.05.001.
[16] LEGGOTT N L, VISMER H F, SYDENHAM E W, et al. Occurrence of patulin in the commercial processing of cider[J]. South African Journal of Science, 2000, 96(32): 241-243. DOI:10.1080/02652030500073550.
[17] YANG Q Y, ZHANG H Y, ZHANG X Y, et al. Phytic acid enhances biocontrol activity of Rhodotorula mucilaginosa against Penicillium expansum contamination and patulin production in apples[J]. Frontiers in Microbiology, 2015, 6: 1296. DOI:10.3389/fmicb.2015.01296.
[18] ROLAND J, BEUCHAT L R. Influence of temperature and water activity on growth and patulin production by Byssochlamys nivea in apple juice[J]. Applied and Environmental Microbiology, 1984, 47(1): 205-207. DOI:10.1016/j.ijfoodmicro.2010.06.017.
[19] ZONG Y Y, LI B Q, TIAN S P. Effects of carbon, nitrogen and ambient pH on patulin production and related gene expression in Penicillium expansum[J]. International Journal of Food Microbiology, 2015, 206(8): 102-108. DOI:10.1016/j.ijfoodmicro.2015.05.007.
[20] 刘华峰, 韩舜愈, 盛文军, 等.腐烂苹果中棒曲霉素的分布研究[J].食品科学, 2010, 31(7): 51-53.
[21] MARÍA M A, SUSANA A, ELENA G P, et al. Occurrence of patulin and its dietary intake through cider consumption by the Spanish population[J]. Food Chemistry, 2009, 113(2): 420-423. DOI:10.5958/ j.2277-9396.3.1.002.
[22] 张艺兵, 兵鲍蕾, 褚庆华. 农产品中真菌毒素检测分析[M]. 北京: 化学工业出版社, 2006: 11-13.
[23] SPEIJERS G J, FRANKEN M A, van LEEUWEN F X. Subacute toxicity study of patulin in the rat: effects on the kidney and the gastrointestinal tract[J]. Food and Chemical Toxicology, 1988, 26(1): 23-30. DOI:10.1016/0278-6915(88)90037-3.
[24] TARTER E J,SCOTT P M. Determination of patulin by capillary gas chromatography of the heptaf uorobutyrate derivative[J]. Journal of Chromatogr A, 1991, 538(2): 441-446. DOI:10.1016/S0021-9673(01)88866-X.
[25] LI F, ZHAO S, CHIN L, et al. Determination of patulin in apple and hawthorn beverages by solid-phase filtration column and liquid chromatography[J]. Journal of AOAC International, 2007, 90(1): 167-172. DOI:10.5740/jaoacint.11-261.
[26] 杨超. 四种真菌毒素检测方法的建立以及赭曲霉毒素A 脱除方法的初步研究[D]. 青岛: 中国海洋大学, 2009: 1-3.
[27] RAMOS A J, LABERNIA N, MARIN S, et al. Effect of water activity and temperature on growth and ochratoxin production by three strains of Aspergillum ochraceus on a barley extract medium and on barley grains[J]. International Journal of Food Microbiology, 1998, 44(2): 133-140. DOI:10.1016/S0168-1605(98)00131-7.
[28] SCHMIDT-HEYDT M, MAGAN M, GEISEN N. Stress induction of mycotoxin biosynthesis genes byabiotic factors[J]. FEMS Microbiology Letter, 2008, 284(2): 142-149. DOI:10.1111/j.1574-6968.2008.01182.
[29] ZIMMERLI B, DICK R. Ochratoxin a in table wine and grape-juice: occurrence and risk assessment[J]. Food Additives and Contaminants, 1996, 13(6): 655-668. DOI:10.1080/02652039609374451.
[30] 杨家岭. 我国主要食品中赭曲霉毒素A调查与风险评估[D]. 杨凌:西北农林科技大学, 2008: 4-6.
[31] VARGA J, KOZAKIEWICZ Z. Ochratoxin A in grapes and grapederived products[J]. Trends in Food Science &Technology, 2006, 17(2): 72-81. DOI:10.1016/j.tifs.2005.10.007.
[32] RITA S, CARLA M, LUÍS A, et al. Determination of ochratoxin A in wine grapes: comparison of extraction procedures and method validation[J]. Analytica Chimica Acta, 2004, 513(1): 41-47. DOI:10.1016/j.aca.2003.09.043.
[33] 李凤琴. 赭曲霉毒素A 分析方法进展[J]. 中国食品卫生杂志, 2004, 16(6): 545- 550.
[34] CURTO R L, PELLICANO VILASI T F. Ochratoxin A occurrencein experimental wines inrelationship with different pesticide treatments on grapes[J]. Food Chemistry, 2004, 84(2): 71-75. DOI:10.1016/ S0308-8146(03)00168-7.
[35] RUPRICH J, OSTRY V. Enzymo-immunological assays of the mycotoxin ochratoxin A (in Czech) [J]. Veterinary Medicine, 1991, 36(2): 245-251. DOI:10.3390/toxins7020238.
[36] PONSONE M L, CHIOTTA M L, COMBINA M, et al. Natural occurrence of ochratoxin A in musts, wines and grape vine fruits from grapes harvested in Argentina[J]. Toxins, 2010, 2(8): 1984-1996. DOI:10.3390/toxins2081984.
[37] 李凤琴. 链格孢毒素及其食品卫生问题[J]. 中国食品卫生杂志, 2001, 13(6): 45-49. DOI:1004 -8456(2001)06 -0045 -05.
[38] ASAM S, KONITZER K, RYCHLIK M. Precise determination of the alternaria mycotoxins alternariol and alternariol monomethyl ether in cereal, fruit and vegetable products using stable isotope dilution assays[J]. Journal of Mycotoxin Research, 2011, 27(2): 23-28. DOI:10.1007/s12550-010-0071-6.
[39] SOMMA S, POSE G, PARDO A, et al. AFLP variability, toxin production, and pathogenicity of Alternaria species from Argentinean tomato fruits and puree[J]. Journal of Food Microbiology, 2011, 145(2/3): 414-419. DOI:10.1016/j.ijfoodmicro.2011.01.006.
[40] POSE G, PATRIARCA A, KYANKO V, et al. Water activity and temperature effects on mycotoxin production by Alternaria alternata on a synthetic tomato medium[J]. International Journal of Food Microbiology, 2010, 142(1): 348-353. DOI:10.1016/ j.ijfoodmicro.2010.07.017.
[41] BRZONKALIK K, HÜMMER D, SYLDATK C, et al. Inf uence of pH and carbon to nitrogen ratio on mycotoxin production by Alternaria alternata in submerged cultivation[J]. AMB Express, 2012, 28(2): 1-8. DOI:10.1186/2191-0855-2-28.
[42] STINSON E E, OSMAN S F, HEISLER E G. Mycotoxin production in whole tomatoes, apples, oranges and lemons[J]. Agricultural Food Chemistry, 1981, 29(4): 790-792. DOI:10.1021/jf00106a025.
[43] MAGNANI R F, de SOUZA G D, RODRIGUES FILHO E. Analysis of alternariol and alternariol monomethyl ether on f avedo and albedo tissues of tangerine (Citrus reticulate) with symptoms of Alternaria brown spot[J]. Agricultural Food Chemistry, 2007, 55(13): 4980-4986. DOI:10.1021/jf0704256.
[44] DELGADO T, GOMEZ CORDOVES C. Natural occurrence of alternariol and alternariol methyl ether in Spanish apple juice concentrates[J]. Chromatography A, 1998, 815(1): 93-97. DOI:10.1016/S0021-9673(98)00124-1.
[45] 何强, 李建华, 孔祥虹, 等. 超高效液相色谱-串联质谱法同时测定浓缩苹果汁中的4种链格孢霉毒素[J]. 色谱, 2010, 28(12): 1128-1131. DOI:10.3724/SP.J.1123.2010.01128.
[46] CHIESI C, FERNANDEZ-BLANCO C, COSSIGNANI L, et al. Alternariol-induced cytotoxicity in Caco-2 cells. protective effect of the phenolic fraction from virgin olive oil[J]. Toxicon, 2015, 93(1): 103-111. DOI:10.1016/j.toxicon.2014.11.230.
[47] SOLHAUG A, WISBECH C, CHRISTOFFERSEN T E, et al. The mycotoxin alternariol induces DNA damage and modify macrophage phenotype and inflammatory responses[J]. Toxicology Letters, 2015, 239(1): 9-21. DOI:10.1016/j.toxlet.2015.08.1107.
[48] YEKELER H, BITMIS K, OZCELIK N. Analysis of toxic effects of alternaria toxins on esophagus of mice by light and electron microscopy[J]. Toxicol Pathology, 2001, 29(4): 492-497. DOI:0192-6233/013.00 0.00.
[49] LEHMANN L, ESCH H L, WAGNER J. Estrogenic and genotoxic potential of equol and two hydroxylated metabolites of daidzein in cultured human Ishikawa cells[J]. Toxicol Letter, 2005, 158(1): 72-86. DOI:10.1016/j.toxlet.2005.02.011.
[50] 杨胜利, 董子明, 裴留成, 等. 河南林县居民粮食中互隔交链孢霉及其毒素污染和人群暴露状况研究[J]. 癌变·畸变·突变, 2006, 19(1): 44-46.
[51] 陈月萌. 液相色谱法测定水果中链格孢霉毒素含量的研究[D]. 西安: 陕西师范大学, 2012: 21-40.
[52] 史文景. 柑橘和果汁中链格抱霉毒素的检测技术研究[D]. 重庆: 西南大学, 2014: 20-40.
Progress in Mycotoxins Contamination and Detection in Fruits and Vegetables and Their Processed Products
XUE Huali
1,2, BI Yang
2,*, ZONG Yuanyuan
2, PU Lumei
1, WANG Yi
2, LI Yongcai
2
(1. College of Science, Gansu Agricultural University, Lanzhou 730070, China; 2. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Abstract:Fruits and vegetables are highly vulnerable to invasion by various pathogens and thus perishable during growth, storage, transportation and processing, which not only causes huge economic losses, but also leads to the accumulation of plenty of mycotoxins during the decay of fruits and vegetables. Mycotoxins have brought great threat to animals and humans through the transmission of food chains. The common mycotoxins, the conditions for their production, and their toxic effects, analytical methods and maximum allowable limit as well as the infection pathways of the pathogenic fungi that produce the mycotoxins are systematically reviewed in this article, which is expected to provide some references for further studying control strategies of mycotoxins.
Key words:mycotoxins; fruits and vegetables; control strategies; detection
DOI:10.7506/spkx1002-6630-201623047
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2016)23-0285-06
引文格式:
薛华丽, 毕阳, 宗元元, 等. 果蔬及其制品中真菌毒素的污染与检测研究进展[J]. 食品科学, 2016, 37(23): 285-290.
DOI:10.7506/spkx1002-6630-201623047. http://www.spkx.net.cn
XUE Huali, BI Yang, ZONG Yuanyuan, et al. Progress in mycotoxins contamination and detection in fruits and vegetables and their processed products[J]. Food Science, 2016, 37(23): 285-290. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201623047. http://www.spkx.net.cn
收稿日期:2015-10-31
基金项目:“十三五”国家重点研发计划项目(2016YFD04009-05);国家自然科学基金地区科学基金项目(31560475);国家高技术研究发展计划(863计划)项目(2012AA101607);甘肃农业大学伏羲人才培养项目(FXRC2013C105)作者简介:薛华丽(1977 —),女,副教授,博士,研究方向为果蔬采后生物学与技术。E-mail:xuehuali77@sina.com
*通信作者:毕阳(1962 —),男,教授,博士,研究方向为果蔬采后生物学与技术。E-mail:biyang@gsau.edu.cn