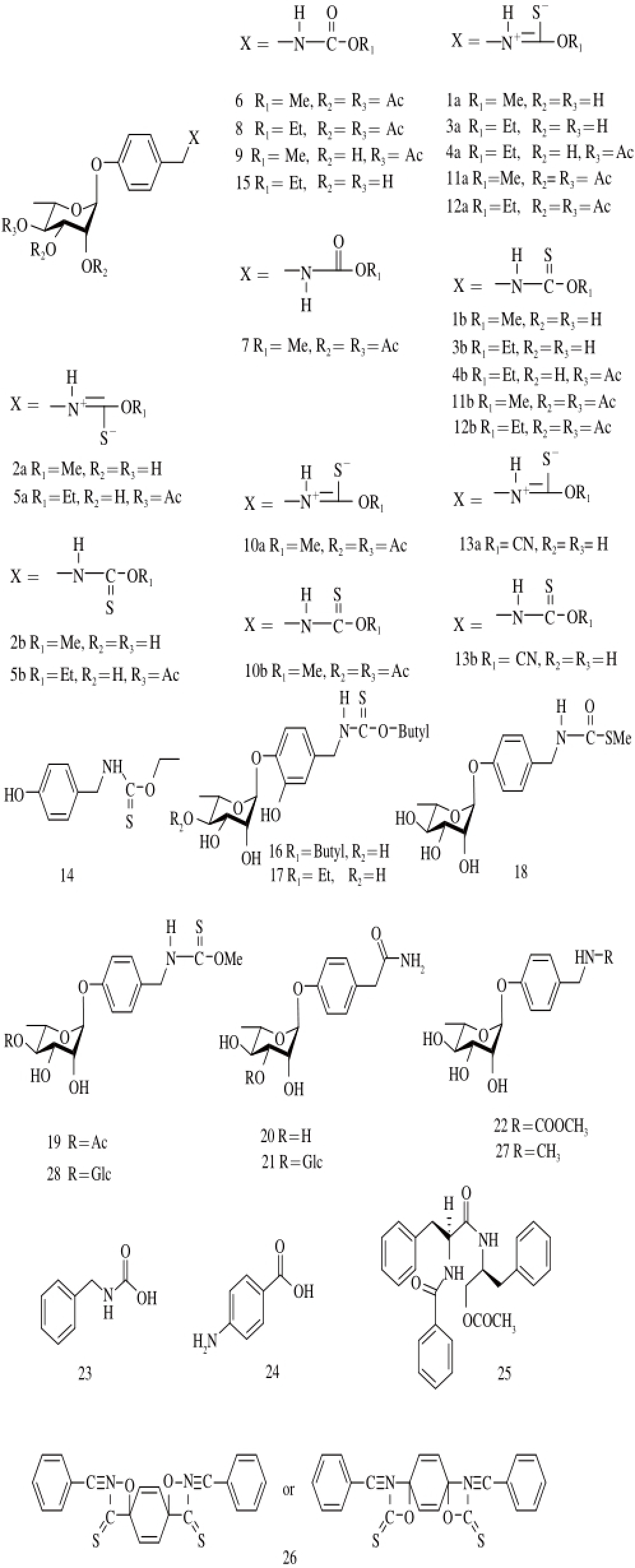
图1 辣木中的氨基甲酸酯和硫代氨基甲酸酯类衍生物
Fig. 1 Carbamate and thiocarbamate derivatives of Moringa oleifera
许 敏 1,2,3,赵三军 4,宋 晖 2,杨崇仁 2,3,*
(1.昆明理工大学生命科学与技术学院,云南 昆明 650500;2.云南现代民族药工程技术研究中心,云南 昆明 650101;3.中国科学院昆明植物研究所,植物化学与西部植物资源可持续利用国家重点实验室,云南 昆明 650201;4.云南师范大学生命科学学院,云南 昆明 650500)
摘 要:辣木(Moringa oleifera)为辣木科辣木属多年生热带落叶乔木,广泛种植于亚洲和非洲热带和亚热带地区。我国广东、台湾、云南等地引种栽培。辣木因生长快速且具有很高的经济价值,被称为“奇迹之树(miracle tree)”。辣木的根、叶和嫩果可食用,种子可榨油,含油量大于30%。此外,辣木种子含有净水活性很高的蛋白质,这种净水蛋白具有天然、无毒、无副作用、易于降解等特点。此外,辣木主要含有氨基甲酸酯和酚性成分,具有抗菌、降血压、降糖尿病等生理活性。本文主要从化学成分和药理研究出发,围绕辣木的安全性和成分检测的研究概况进行综述,为辣木的开发和利用提供依据和参考。
关键词:辣木;化学成分;生物活性;安全性;成分分析
辣木(Moringa oleifera)为辣木属多年生热带落叶乔木。辣木科仅有一属l4种。辣木原产印度北部喜马拉雅山南麓,是辣木属中可以食用且利用和研究最多、最有商业价值的品种。目前,辣木已在亚洲和非洲热带和亚热带地区广泛种植。我国云南省芒市在20世纪初已从缅甸引种 [1-2]。20世纪60年代以来,在台湾、广东、广西、福建、云南等地开展种植 [2-5]。近年来,辣木的种植发展到长江以南各省区。同属植物中,辣木等在埃塞俄比亚、肯尼亚北部、苏丹、阿拉伯半岛、以及安哥拉和纳米比亚等亦有栽培利用 [3]。
辣木耐干旱、耐贫瘠、生长迅速、适应性强,是热带和亚热带地区的速生树种。辣木叶和嫩果在印度和东南亚地区为常用的木本蔬菜,辣木种子富含油脂,可食用,种子有净水功能。辣木叶、种子、树皮、辣木根等是民间传统药物,用于保健和治疗多种疾病。因此,辣木被称为“奇迹之树”,故而近些年,辣木作为新型的保健食品引起研究领域的广泛重视 [3-5]。
2012年11月,我国卫生部批准辣木叶作为新资源食品。中国热带农业科学院辣木工程技术研究中心开展新品种培育、栽培及病虫害防治新技术的研究推广。近年来,辣木作为一种新型的保健食品得到开发。国内外学者对其化学成分、药理活性及安全性开展了一些研究工作。迄今为止,关于辣木的综述多集中在其传统利用(食用和药用)及净化饮水功能方面。但少有文章对其安全性及其成分进行系统综述。故本文重点将从辣木的化学成分和药理活性出发,围绕辣木的安全性和成分检测的研究概况进行综述,以期为我国辣木资源理性的开发,合理利用提供科学依据。
1.1 蛋白质和氨基酸
与许多植物富含叶蛋白一样,辣木叶富含蛋白质(鲜叶约6%,干叶约27%)。辣木叶蛋白的氨基酸组成以天冬氨酸(24.5 mg/100g)和谷氨酸(10.5 mg/100g)为主,并含有人体必需的苏氨酸(14 mg/100g)、缬氨酸(12.0 mg/100g)、甘氨酸(5.5mg/100g)、异亮氨酸(4.5 mg/100g)、赖氨酸(4.5 mg/100g)、苯丙氨酸(4.0 mg/100g)和蛋氨酸(3.5 mg/100g)。此外,还含有丙氨酸(13.5 mg/100g)、组胺酸(9.5 mg/100g)、精氨酸(9.0 mg/100g)、半胱氨酸(5.0 mg/100g)、亮氨酸(4.5 mg/100g)和色氨酸(3.5 mg/100g)等 [1]。研究发现在辣木的花和果实中能检测到丙氨酸、精氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸和缬氨酸,但是赖氨酸仅能在花中检测到 [2]。
1.2 维生素
辣木果实、花、种子中均含有丰富的维生素。其中,辣木干叶含VC(173 mg/100 g) [2-3]、VB(30.7 mg/100 g)、VA(163 mg/100 g)、VE(113 mg/100 g)等 [1,4]。2015年Asghari等 [5]对伊朗东南部野生辣木(Moringa peregrina)干叶及种子营养成分的研究显示,辣木富含VC及VA。其中VC和VA在干叶及种子中的含量分别为(83±0.5)、(14±0.6) mg/100 g和(6.8±0.7)、(24.8±0.7)mg/100 g。辣木花及果实中维生素含量的研究未见报道。
1.3 油脂
辣木种子油脂含量为38.0%左右。不饱和脂肪酸在油脂中占70%左右,主要为油酸(占63.4%)和亚油酸(占3.1%) [6-7]。辣木种子油的含量较油橄榄低,与茶籽和玉米胚芽近似。1998年,Tsaknis等 [8]分析发现辣木种子油的不饱和氨基酸含量比油橄榄、玉米胚芽和茶籽油低。最新的研究表明,辣木种子油有抗紫外线活性,粗制油和溶剂提取油比精制油好 [9-10]。
1.4 矿物质
辣木各部位均富含矿物质。丁音琴 [11]分析发现,干叶每100 g含钙2 000.3 mg、钾1 324 mg、硫870 mg、镁368 mg、磷282 mg、铁282 mg、锰64 mg、铜0.60 mg。此外,还含有多种微量元素,矿物质的含量随产地和采集季节变化。Asghari等 [5]研究表明,在波斯辣木叶及种子中,钙的含量分别为(764.8±1.6)、(1 164.8±43.4)mg/100 g,钾的含量分别为(900.2±14)、(572±10 )mg/100 g。
2.1 含氮化合物
2.1.1 氨基甲酸酯类和硫代氨基甲酸酯类
氨基甲酸酯类化合物是辣木中的特征性成分,也是主要生理活性成分。Faizi等 [12-13]报道了辣木鲜叶中的12个氨基甲酸酯类化合物1~12(图1、表1)。Sahakitpichan等 [14]又报道了辣木叶中2个新氨基甲酸酯类marumosides A(20)和B(21),以及已知氨基甲酸酯类配糖体22(图1、表1)。
Faizi等 [15-16]报道了辣木新鲜的荚果中2个硫代氨基甲酸酯类化合物13和14以及1个新的氨基甲酸酯类化合物15(图1、表1)。Tewari等 [17]从辣木果实乙酸乙酯提取物中分离鉴定到新的具有抗炎活性的氨基甲酸酯类化合物S-甲基-N-硫代氨基甲酸酯(S-methyl-N-thiocarbamate)(18),以及已知的氨基甲酸酯类化合物niazicinA(19)和niazinin A(1)(图1、表1)。
Tewari等 [17]从辣木的种子中分离到2个新的硫代氨基甲酸酯类化合物16和17(图1、表1)。Oluduro等 [18]报道辣木种子中具有抗菌活性的化合物氨基甲酸酯类化合物27和28(图1、表1)。Horwath等 [19]报道辣木的种子、荚果和叶子中均分离到印度辣木素(pterygospermin)(26)(图1、表1),该化合物为辣木的抗菌活性成分之一。Chen Guofeng等 [20]从辣木的根皮中分离到新氨基甲酸酯类化合物N-苄基氨基甲酸乙酯(N-benzylcarbamicacid)(23)以及已知的4-氨基苯甲酸(4-aminobenzoic acid)(24)和金色酰胺醇酯(aurantiamide acetate)(25)(图1、表1)。

图1 辣木中的氨基甲酸酯和硫代氨基甲酸酯类衍生物
Fig. 1 Carbamate and thiocarbamate derivatives of Moringa oleifera
表1 辣木中的含氮化合物
Table 1 Nitrogenous compounds of Moringa oleiffeerraa

注: *.无中文名称。表2同。
编号英文名称来源参考文献氨基甲酸酯类1 niazinin A*果实、新鲜叶[21] 2 niazinin B*鲜叶[12] 3 niazimicin*鲜叶[12] 4 niazimimin A*鲜叶[12] 5 niazimimins B*鲜叶[12] 6O-methy,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] carbamate (E)*鲜叶[13] 7O-methy,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] carbamate (Z)*鲜叶[13] 8O-ethyl,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] carbamate (E)*鲜叶[13] 9O-methy,4-[(4’-O-actyl-α-L-rhamnosyloxy) benzyl] carbamate (E)*鲜叶[13] 10O-methy,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] thiocarbamate*鲜叶[13] 11O-methy,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] thiocarbamate (Z)*鲜叶[13] 12O-ethyl,4-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] thiocarbamate (E)*鲜叶[13] 13niazidin*新鲜的荚果[15] 14O-ethyl p-hydroxy benzyl thiocarbamate*新鲜的荚果[15] 15O-ethyl-4-[(α-L-rhamnosyloxy)-benzyl] carbamate*新鲜的荚果[16] 16O-n-butyl-4-[(α-L-rhamnopyranosyloxy) benzyl]thiocarbamate*种子[17] 17O-ethyl-4-[(α-L-rhamnopyranosyloxy)-3-hydroxybenzyl]thiocarbamate*种子[16] 18S-甲基-N-硫代氨基甲酸酯(S-methyl-N-thiocarbamate)果实[17] 19niazicin A*果实[17] 20marumoside A*叶[14] 21marumoside B*叶[14] 22methyl 4-(α-L-rhamnopyranosyloxy)benzylcarbamate*叶[14] 23N-苄基氨基甲酸乙酯(N-benzylcarbamic acid)根皮[20] 244-氨基苯甲酸(4-aminobenzoic acid)根皮[20] 25金色酰胺醇酯(aurantiamide acetate)根皮[20] 26印度辣木素(pterygospermin)根皮、荚果、叶子[19] 27Me-N-4-(α-L-rhamnopyranosyloxy) benzyl carbamate*种子[22] 284-(β-D-glucopyranosyl-1→4-α-L-rhamnopyranosyloxy)-benzyl*种子[22]异硫氰酸酯类294-[(2’-O-acetyl-α-L-rhamnosyloxy) benzyl]isothiocyanate*果实[17] 304-[(3’-O-acetyl-α-L-rhamnosyloxy) benzyl]isothiocyanate*果实[17] 314-[(4’-O-acetyl-α-L -rhamnosyloxy)benzyl]isothiocyanate*果实[17-18] 324-[(α-L-rhamnosyloxy) benzyl]isothiocyanate*果实[17]氰基类334-[(2’,3’,4’-tri-O-actyl-α-L-rhamnosyloxy) benzyl] nitrile*叶[13] 34niazirin*叶[18] 35niazirinin*叶[17,19,23] 36methyl1-aminopentasulf de 5-sulf nate*荚果[15] 37苯乙腈(phenylacetonitrile)根皮[20]吡咯生物碱38pyrrolemarumine 4’-O-α-L-rhamnopyranoside*叶[14]
2.1.2 异硫氰酸酯类
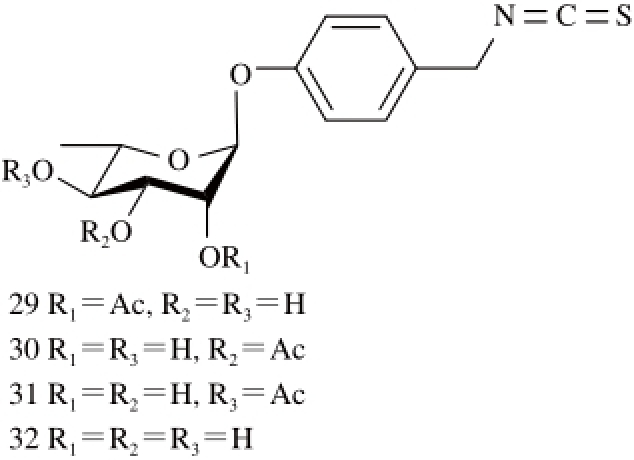
图2 辣木中的异硫氰酸酯类衍生物
Fig. 2 Isothiocyanate derivatives of Moringa oleifera
Cheenpracha等 [21]从辣木果实乙酸乙酯提取物中分离到4个异硫氰酸酯类衍生物29~32。Oluduro等 [18]也曾从辣木叶中分离得到化合物31(图2、表1)。
2.1.3 氰基类
Faizi等 [22]从辣木鲜叶中分离到1个氰基类化合物33(图3、表1)。Oluduro等 [18]报道了辣木叶中的氰基配糖体niazirin(34)和niazirinin(35)(图3、表1)。其中,niazirin(34)从果实和根皮中也分离得到 [19,21-22](图3、表1)。Faizi等 [15]又从辣木新鲜的荚果中分离到新的乙氰酯类化合物methyl 15-cyanopentadecanoate(36)。Chen Guofeng等 [20]报道了辣木的根皮中的已知氰基衍生物苯乙腈(phenylacetonitrile)(37)(图3、表1)。Kashiwada等 [24]从烤焦的种子中也分离到化合物34和37(图3、表1)。

图3 辣木中的氰基类衍生物
Fig. 3 Nitrile derivatives of Moringa oleifera
2.1.4 吡咯生物碱
Sahakitpichan等 [14]从辣木叶中分离到结构新颖的吡咯生物碱38(图4、表1)。
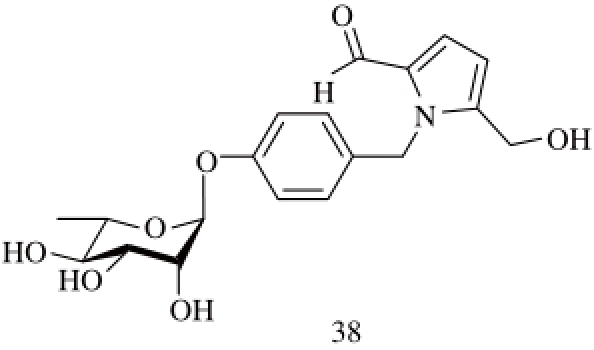
图4 辣木中的吡咯生物碱类衍生物
Fig. 4 Pyrrolidine alkaloid derivatives of Moringa oleifera
2.2 多硫化合物
Faizi等 [15]报道从辣木新鲜荚果中分离到的methyl 1-aminopentasulf de 5-sulfinate(39)(图5)是辣木中唯一个多硫化合物。

图5 辣木中的多硫类化合物
Fig. 5 Polysulfide derivatives of Moringa oleifera
2.3 辣木中的多酚类成分
2.3.1 黄酮类

图6 辣木中的黄酮类化合物
Fig. 6 Flavonoid derivatives of Moringa oleifera
表2 辣木中的酚性成分
Table 2 Phenolic compounds ofM oringa oleiffeerraa

编号名称来源文献黄酮类40kaempferol 3-O-β-D-glucopyranoside*叶[25] 41quercetin 3-O-β-D-glucopyranoside*叶[25] 42kaempferide 3-O-(2’,3’-diacetylglucoside)*叶[23] 43kaempferide 3-O-(2’-O-galloylrhamnoside)*叶[23] 44kaempferide 3-O-(2’-O-galloylrutinoside)-7-O-α-rhamnoside*叶[23] 45kaempferol 3-O-[β-glucosyl-(1→2)]-[α-rhamnosyl-(1→6)]-β-glucoside-7-O-α-rhamnoside*叶[23] 46kaempferol 3-O-[α-rhamnosyl- (1→2)]-[α-rhamnosyl-(1→4)]-β-glucoside-7-O-α-rhamnoside*叶[23] 477-O-(β-D-glucopyranosyl)-5-O-Me naringenin-4’-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside*茎[26] 48isoquercitrin*叶[14] 49quercetin 3-O-β-D-(6’-O-malonyl)-glucoside*叶[14] 50astragalin*叶[14] 51kaempferol 3-O-β-D-(6’-O-malonyl)-glucoside*叶[14] 52quercetin 3-O-β-D-(6’-O-3-hydroxy-3-methylglutaryl)-glucoside*叶[14] 534-O-(4’-O-α-D-glucopyranosyl)-caffeoyl quinic acid*叶[24] 544-O-(3’-O-α-D-glucopyranosyl)-caffeoyl quinic acid*叶[24] 55绿原酸(chlorogenic acid)叶[24] 564-O-caffeoyl quinic acid*叶[24] 575-O-咖啡酰基奎宁酸(5-O-caffeoyl quinic acid)叶[24]酚苷类584-羧基蜂蜜曲菌素(4-hydroxymellein)茎[27] 59香草醛(vanillin)茎[27] 60moringyne*种子[28] 61benzaldehyde 4-O-β-glucoside*叶[23] 62benzoic acid 4-O-β-glucoside*叶[23] 63benzoic acid 4-O-β-rhamnosyl-(1→2)-β-glucoside*叶[23] 64benzyl β-D-glucopyranoside*叶[14] 65benzylβ-D-xylopyranosyl-(1→6)-β-D-glucopyranoside*叶[14] 664-(α-L-rhamnopyranosyloxy)benzaldehyde*根皮[20]
续表2

编号名称来源文献67methyl vanillate*根皮[20] 68de-O-methyllasiodiplodin*根皮[20 69methylparaben*根皮[20] 70p-hydroxybenzaldehyde*根皮、茎[20] 71methyl ferulate*根皮[20] 72trans-ferulic acid*根皮[20] 73lasiodiplodin*根皮[20] 74p-hydroxybenzoic acid*根皮[20] 75benzylβ-D-arabinopyranosyl-(1→6)-β-D-glucopyranoside*根皮[20] 76benzoic acid*根皮[20]
辣木的黄酮类化合物主要为槲皮素和山奈酚类衍生物。Villasenor等 [25]报道了辣木叶中2个黄酮类化合物40和41(图6、表2)。Manguro等 [23]从辣木叶中分离到5个新山奈酚衍生物42~46(图6、表2)。Jangwan等 [26]报道了辣木茎中新的黄酮三糖苷47(图6、表2)。Sahakitpichan等 [14]从辣木叶中分离到5个黄酮类化合物48~52(图6、表2)。
2.3.2 绿原酸类
Kashiwada等 [24]从辣木叶中分离到5个绿原酸类分子53~57(图7、表2)。

图7 辣木中的绿原酸类衍生物
Fig. 7 Chlorogenic acid derivatives of Moringa oleifera
2.3.3 酚苷类化合物

图8 辣木中的酚苷类衍生物
Fig. 8 Phenolic glycoside derivatives of Moringa oleifera
Saluja等 [27]报道了辣木的茎中分离到4-羧基蜂蜜曲菌素(4-hydroxymellein)(58)和香草醛(vanillin)(59)(图8、表2)。Memon等 [28]从辣木种子中分离到新的酚苷Moringyne(60)(图8、表2)。Manguro等 [23]从辣木叶中分离到3个新酚苷类化合物61~63(图8、表2)。Sahakitpichan等 [14]从辣木叶中分离到2个已知的酚苷64和65(图8、表2)。Chen Guofeng等 [20]辣木的根皮中分离到新酚苷66,以及已知的酚苷67~76(图8、表2)。
2.3.4 其他类型化合物
Eilert等 [29]从辣木叶中还分离到长链葡萄糖苷十四烷酸葡萄糖酯(β-D-glucopyranoside tetradecanoate)。Khan等 [30]从辣木的茎中还分离到磷酸酯类分子glyceropalmityl phosphate和glycerol-oleiostearyl phosphate。Chen Guofeng等 [20]报道了根皮中的甾醇及其衍生物β-谷甾醇、豆甾醇、β-豆甾酮、豆甾-4,22-二烯-3-酮、β-谷甾醇-3-O-D-葡萄糖苷和β-豆甾醇-3-O-β-葡萄糖苷;三萜衍生物白桦脂酸、熊果酸以及木脂素(+)-松脂素、芝麻林素和芝麻素等。
3.1 抗菌活性
Dayrit等 [31]发现辣木种子中的化合物氨基甲酸酯类化合物niazirin(34)有抑制枯草芽孢杆菌的活性,但对大肠杆菌无效。Caceres等 [32]发现辣木新叶汁和辣木种子的水提物能抑制绿脓杆菌和金黄色葡萄球菌的生长,但对白色链珠菌无效。Jha等 [33]发现辣木根皮的提取物具有一定抗真菌活性,对粗糙链孢菌的抑制作用强于黑曲霉。Singh等 [34]报道辣木叶和花的水提物均能抑制青紫色素杆菌12472的群体感应。Oluduro等 [18]发现辣木种子中的氨基甲酸酯类化合物27和28(图1、表1)均显示抗菌活性。其中化合物28活性最好,对痢疾杆菌有99.2%的抑制率,对蜡样芽孢杆菌、大肠杆菌和伤寒沙门氏菌的抑制率为100%。Priya等 [35]报道辣木叶、皮、种子和果肉的苯、甲醇和水提物对枯草芽孢杆菌、大肠杆菌、肺炎杆菌、痢疾杆菌和金黄色葡萄球菌均显示显著的抗菌活性。Kaur等 [36]报道了辣木根和种子中的4-α- L-鼠李糖基-异硫氰酸苄酯类化合物对草分枝杆菌和枯草芽孢杆菌有抑制作用,最小抑制浓度分别为40 μmol/L和56 μmol/L。
3.2 抗癌活性
Eilert等 [29]报道辣木叶中的长链葡萄糖苷β-D-十四烷酸葡萄糖酯(β-D-glucopyranosidetetradecanoate)对结肠癌细胞株Colo-320 DM具有显著抑制作用,90%抑制浓度(90% inhibitory concentration,IC 90)为3.98 mmol/L,对其他3 个癌细胞株PA-1、MCF-7和KB-403显示弱的抑制活性。
Murakami等 [37]发现辣木的硫代氨基甲酸酯和异硫氰酸酯类配糖体对埃-巴二氏病毒诱导的肿瘤有抑制作用,构效关系探讨提示,硫代氨基甲酸酯类配糖体niaziminines A(4)和B(5)中C4位的乙酰基为活性的必需基团,异硫氰酸酯类配糖体的异硫氰基是关键的活性基团。
Sreelatha等 [38]报道辣木叶提取物具有抗肿瘤细胞增殖和诱导其凋亡的作用。Inbathamizh等 [39]发现辣木花能有效抑制前列腺癌细胞株PC3细胞,活性成分是奎宁酸类衍生物。
3.3 保肝作用
Fakurazi等 [40]等报道辣木叶可以通过显著降低谷胱甘肽,保护对乙酰氨基引起的肝损伤。Umaya等 [41]辣木叶汁对黄曲霉毒素B 1诱导的肝毒性有保护作用。Hamza等 [42]发现辣木种子提取物对四氯化碳诱导的肝损伤和肝纤维化有保护作用,可能与抗氧化、抗炎和减少肝星形细胞的激活有关。Bello等 [43]研究表明辣木乙醇提取物对结核药物引起的肝损伤具有保护作用。
3.4 降血糖和降血脂作用
Ghasi等 [44]发现辣木叶提取物能显著降低血清、肝脏和肾脏中胆固醇的含量,可显著降低血胆固醇的活性。陈瑞娇等 [45]的研究表明辣木叶总黄酮能明显降低糖尿病模型小鼠的血糖,提高血清超氧化物歧化酶活力,降低血清丙二醛含量。辣木叶总黄酮对正常小鼠的血糖水平无影响。余建兴等 [46]的研究表明辣木油具有辅助降甘油三酯功效。Momoh等 [47]发现辣木叶打粉制成的胶囊具有降血糖活性,可用于糖尿病患者的辅助治疗。Al-Malki等 [48]的研究表明低剂量的辣木种子粉显示降血糖活性。
3.5 抗病毒作用
Villasenor等 [25]发现辣木叶中的奎宁酸类衍生物具有抗流感A型病毒活性。其中,绿原酸(chlorogenic acid)(55)和绿原酸(5-O-咖啡酰基奎宁酸)(57)的半数IC(half maximal IC,IC 50)分别为30.0、27.81 g/mL,4-O-caffeoyl quinic acid(58)的IC 50为67.01 g/mL(图7、8、表2)。
3.6 抗氧化作用
Sreelatha等 [49]报道辣木花和叶水提物具有很好的抗氧化活性,对DNA的氧化损伤具有保护作用,主要成分为没食子酸(gallic acid)、绿原酸(chlorogenic acid)、鞣花酸(ellagic acid)、阿魏酸(ferulic acid)、山奈酚(kaempferol)、槲皮苷(quercetin)和香草醛(vanillin)等。同年,彭晓云等 [50]的研究表明辣木精油也具有抗氧化能力,可清除体内自由基,使果蝇寿命延长。
3.7 对心血管的作用
Siddiqi等 [51]首次报道了辣木叶的水提物和醇提物均具有降低血压的活性,水提物的活性优于醇提物。孙备 [52]、Jansakul [53]、Oluduro [18]等的后续研究发现,降压的主要活性成分为niazimimins A(4)和B(5)等硫代氨基甲酸酯类和异硫氰酸酯类配糖体(图1、表1)。而且,Jansakul等 [53]的研究表明辣木中的活性成分主要作为钙离子的阻断剂发挥降血压作用 [50]。
Nandave等 [54]的研究表明辣木提取物对异丙去甲肾上腺素诱导的心肌梗模型有显著的保护作用,主要与其抗氧化、抗脂质过氧化和对心肌梗组织病理的影响有关。
3.8 抗生育功能
Prakash [55]和Shukla [56-57]等研究表明辣木根的水提物在小鼠抗生育模型中,不仅影响子宫的组织结构,且改变激素水平,从而影响受精卵的正常着床。Zade等 [58]的研究表明辣木根皮的乙醇提取物具有堕胎活性。
3.9 抗溃疡活性
王柯慧 [59]的研究表明辣木叶甲醇提取物和水提物在小鼠胃溃疡模型中均显示治疗作用。Dahiru等 [60]的研究也表明辣木叶有抗胃溃疡活性。Debnath等 [61]研究表明辣木对阿司匹林诱导的胃黏膜损伤具有保护作用。
3.10 抗炎活性
Mahajan等 [62-63]的研究表明辣木种子的乙醇提取物和正丁醇提取物对卵清白蛋白(ovalbumin,OVA)诱导的气道炎症有治疗作用。Mahajan等 [64]还报道了辣木花的含水乙醇提取物能降低炎性动物模型血清中类风湿因子(rheumatoid factor,RF)、肿瘤坏死因子-a(tumor necrosis factor-α,TNF-α)和白细胞介素(interleukine,IL)-1的水平。组织病理学研究也显示辣木花的含水乙醇提取物治疗组淋巴细胞的渗透和血管生成减少。
Cheenpracha等 [21]的研究表明辣木果实中的异硫氰酸酯类衍生物29~32(图2、表1)具有很好的抑制NO分泌的活性,IC 50分别为1.67、2.66、2.71、14.4 μmol/L。免疫应激法表明,这些活性分子主要影响了脂多糖诱导的诱导型一氧化氮合酶(inducible nitricoxide synthase,iNOS)的表达。构效关系研究表明,异硫氰酸酯基是抗炎活性的必需基团;异硫氰酸酯类衍生物的酰化是增效基团,能有效地增加抗炎活性,特别是鼠李糖基C-2’或C-3’的乙酰化;硫代氨基甲酸酯类分子酰化也能增加分子的抗炎活性。
Lee等 [65]的研究表明辣木果实提取物通过抑制小鼠巨噬细胞RAW 264.7细胞株中核转录因子κB(nuclear factor kappa B,NF-κB)的激活,从而减少炎性介质NO、IL-1β、TNF-α和IL-6的水平。
3.11 神经系统活性
Amrutia等 [66]的研究表明辣木叶的甲醇提取物在戊四唑(pentylenetetrazol,PTZ)诱导癫痫模型和电惊厥模型中均显示抗惊厥活性。Ray等 [67]的研究表明辣木在氯化铁诱导的癫痫模型中显示抗惊厥活性,其作用机制可能与辣木抗氧化损伤和通过调节保护性神经递质抑制神经的亢奋状态有关。Kirisattayakul等 [68]的研究显示辣木叶提取物能有效减少缺血性中风引起的大脑皮层、纹状体和海马的梗塞面积。同年,Sutalangka等 [69]的研究表明辣木叶能减轻记忆衰退和神经退行性病变。Hannan等 [70]研究发现辣木叶的乙醇提取物能促进早期神经元的分化,显著增加神经元树突的长度和数量,增加轴突的数量进而对神经有保护作用。
3.12 镇痛解痉活性
Caceres等 [71]研究表明辣木种子提取物能抑制乙酰胆碱诱导的痉挛,半数有效量(50% effective dose,ED 50)为65.6 mg/mL,抑制角叉菜胶诱导的水肿,并具有利尿功能。辣木根提取物也具有解痉、消肿、利尿的活性。Manaheji等 [72]研究发现辣木根或叶的甲醇提取物能够降低弗氏佐剂致关节炎大鼠的温度痛觉过敏程度,且辣木根与叶在止痛效果上有协同作用。Ahmad等 [73]报道了辣木根皮的退热活性。
3.13 对皮肤的保护作用
段琼芬等 [9-10]研究表明辣木种子油有抗紫外线活性,其中,辣木种子粗制油和溶剂提取油比精制油好。添加质量分数10%~30%(下同)的辣木油可抵抗紫外线(ultraviolet,UV)B、UVC,添加30%~100%的可抵抗UVA、UVB和UVC,10%的辣木油对短波和部分中波紫外线有吸收作用,0.1%的辣木油能吸收UVC波段射线。
Rigano等 [74]报道辣木油可加速创面愈合、缩短愈合时间、减轻组织的病理变化。同年,段琼芬等 [75]研究发现辣木嫩叶能促进伤口愈合,有效成分为黄酮类化合物新西兰牡荆苷Ⅱ。Muhammad等 [76]报道辣木叶能抑制UV诱导的成纤细胞中间质胶原酶的表达,减轻阳光对皮肤的损伤。Ahmad等 [73]的研究发现辣木油是稳定的润滑剂,也是香气成分的稳定剂,对敏感性、干性皮肤以及皮肤皲裂有很好的保护和润滑作用。
3.14 改善性功能作用
Cheng [77]和Prabsattroo [78]等的最新研究发现,辣木叶含水乙醇提取物能抑制B型单胺氧化酶和5型磷酸二酯酶活性、降低血清皮质酮水平、提高血清睾酮水平、增加睾丸间质细胞和精子数量。缩短大鼠交配的插入潜伏期,增加插入频率,改善压力应急大鼠的性行为。
3.15 其他活性
Tahiliani等 [79]报道辣木叶的水提物能调节甲状腺激素水平。Karadi等 [80]报道辣木根皮能治疗肾结石。贺敏 [81]和贺银凤 [82]等的研究表明辣木干叶提取物能缩短小白鼠首次排便时间,增加小白鼠的排便质量和粪便粒数。Kamel等 [83]报道辣木油能阻止草地贪夜蛾对植物的伤害。Pal等 [84]发现辣木荚果能有效缩短抗结核药利福平的治疗周期和毒附作用。Ouedraogo等 [85]研究表明,辣木对庆大霉素诱导的肾毒性具有保护作用。Sharma等 [86]研究发现辣木果实的乙醇提取物具有免疫调节作用。Adeyemi等 [87]发现辣木能保护镍诱导的肾毒性。Sheikh等 [88]的研究显示,辣木能降低砒霜诱导的毒性。
2012年11月,我国卫生部批准辣木叶作为新资源食品。其安全性也受到广泛关注。Nikkon等 [89]的研究表明,辣木根皮氯仿提取物及根皮中的分子benzylcarbamothioethionate对实验动物的血液参数和肝脏、肾脏、心脏和肺组织病理学没有影响。冯丁山等 [90]研究表明,昆明种小鼠经口服观辣树叶的最大耐受剂量>10.0 g/kg(以体质量计),且Ames实验、小鼠骨髓细胞微核实验及小鼠精子畸形实验显示遗传学毒性为阴性,观辣树叶急性毒性分级为实际无毒级,在研究的剂量范围内未见明显遗传毒性作用。段琼芬等 [91]的研究表明,辣木籽油的急性毒性实验未发现动物有明显中毒症状与死亡。遗传毒性实验结果均为阴性。喂食含有6%和12%辣木籽油饲料的雌雄大鼠30 d后血糖水平显著降低,喂食含有12%辣木籽油饲料的雄性大鼠总蛋白水平显著降低,其他各项血液生化指标无明显变化。
但是,也有零星对辣木安全性的负面报道。Mazumder等 [92]的研究表明,辣木根提取物按大于46 mg/(kg·周)或7 mg/(kg·d)剂量摄取,会影响肝脏和肾脏功能,并改变血液参数。Kashiwada等 [24]报道辣木种子烧烤产生致突变的化学成分。Oyagbemi等 [93]在以小鼠为模型的研究发现,有报道长期服用辣木叶具有肝毒性和肾毒性。
5.1 营养成分的检测
王素燕等 [94]采用湿法、泡制法、水煮法处理样品,建立了以电感耦合等离子体原子发射光谱法测定辣木叶中的Ca、K、Mg、Fe、Zn、Cu 6 种微量元素的方法。陈瑞娇等 [95]探讨了蒽酮-硫酸比色法测定辣木叶中多糖的方法。研究表明辣木叶片、叶柄和茎的可溶性糖含量均以11月份采收为最高,以9月中旬采收为最低;辣木叶片和茎的多糖含量也以11月份采收为最高,9月中旬以前采收较低。丁音琴等 [11]采用微波消解电感耦合等离子体发射光谱法对福建省种植的辣木中的32种矿物质元素含量进行测定。
5.2 挥发性成分的检测
Karthika等 [96]通过气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)的方法鉴定了辣木叶乙酸乙酯提取物中的28个化合物,其中包括氧化芳樟醇、棕榈酸、腺嘌呤等。Marrufo等 [97]通过GC和GC-MS的分析方法检测了非洲东南部国家莫桑比克产辣木精油的成分,研究表明单萜类化合物(81.8%)为辣木油中的主要成分,其主要包括α-水芹烯(25.2%)和对伞花烃(24.9%)。其次还含有二十六碳烷(13.9%)、二十五碳烷(13.3%)和二十五碳烷(11.4%)。Gatade等 [98]应用GC-MS法检测发现辣木叶含有棕榈酸(hexadecanoic acid)、二十五烷(pentacosane)、β-谷甾醇(β-sitosterol)、植醇(phytol)、十八酸甲酯(octadecatrienoic acid methyl ester)和VE醋酸酯(VE acetate)。
陈荣荣等 [99]采用水蒸汽蒸馏(hydrodistillation,HD)结合GC-MS分析辣木叶、茎和根的挥发性香气成分,用峰面积归一化法计算各组分的相对含量。辣木叶中共鉴定出43种化合物,主要为苯乙醛(14.52%)、苯甲醛(1.9%)、2-己烯醛(1.52%)、棕榈酸甲酯(3.41%)、异硫氰酸甲氧基甲酯(2.03%)、邻苯二甲酸正丁异辛酯(1.57%)、二氢猕猴桃内酯(1.41%)、棕榈酸(13.91%)。辣木茎中鉴定出16种化合物,主要成分为苯甲醛(15.69%)、棕榈酸(9.47%)和亚油酸(7.91%)。辣木根中鉴定出13种化合物,主要成分为苯乙腈(36.94%)、苯甲醛(18.21%)和异硫氰酸苄酯(15.96%)。
Faizi等 [100]应用GC-MS方法,指认了辣木根石油醚和二氯甲烷提取物中102种化合物。这些化合物涉及脂肪酸、酯类、乙醇、硫代氨基甲酸酯类化合物、异硫代氨基甲酸酯类化合物、氨基酸、甾体等15种类型。石油醚提取物中的主要成分为trans-13-docosene(37.9%)、nonacosane(32.6%)、cycloartenol(28.6%)、nonadecanoic acid (13.9%)和cyclooctasulfur S8(13.9%)。二氯甲烷提取物包括63种化合物,主要为nasimizinol(58.8%)、oleic acid(46.5%)、N-benzyl-N-(7-cyanato heptanamide(38.3%)、N-benzyl-N-(1-chlorononyl) amide(30.3%)、bis[3-benzyl prop-2-ene]-1-one(19.5%)和N,N-dibenzyl-2-ene pent 1,5-diamide(11.6%)。
5.3 酚性成分的检测
Govardhan Singh等 [101]通过颜色反应法测定了辣木叶中的总多酚和总黄酮含量。并用高效液相色谱(high performance liquid chromatography,HPLC)和MS-MS法研究辣木花和叶水提取物,检测到没食子酸、绿原酸、鞣花酸、阿魏酸、山奈酚、槲皮苷和香草醛。Coppin等 [102]应用快速、敏感的LC-MS法,测定辣木叶提取物中的槲皮素、芦丁及山柰酚。LC-MS法对辣木叶的12个黄酮类成分(槲皮素和山奈酚类衍生物)进行分析。Pachauri等 [103]应用HPLC鉴定出辣木根的两个主要的抗炎活性成分1,3-二苄基尿素(1,3-dibenzyl urea)和金色酰胺醇酯(aurantiamide acetate)。
2014年,Vongsak等 [104]建立了快速HPLC定量分析方法,测定辣木叶中的绿原酸、异槲皮素和黄芩苷成分。
综上所述,研究者在辣木化学成分和药理活性研究方面都开展了大量的研究工作。迄今为止,从辣木的不同部位分离得到超过70个小分子。其中,氨基甲酸酯类化合物和黄酮类衍生物是辣木中的主要成分。尤其是氨基甲酸酯类化合物,显示出降压、抗菌、抗肿瘤等生理活性。此外,辣木的安全性评价显示,辣木的安全性还需要进一步深入研究。但是,辣木的品质控制研究方面做的工作相对不够深入。前期研究表明,氨基甲酸酯类化合物稳定性非常不好,报道的大部分分子均来源于辣木鲜叶或新鲜的荚果 [15-16]。但是,非常有限的文献对氨基甲酸酯类化合物在辣木中的含量及其变化进行定性和定量分析。因此,非常有必要基于前期化学成分研究,深入研究辣木的安全性和质量控制,为辣木理性的利用提供科学依据和基础。
参考文献:
[1] DAS J M. Free amino acids and carotenes in the leaves of Moringa oleifera[J]. Current Science,1965, 34(12): 374-375.
[2] RAMIAH N, NAIR G A. Amino acids and sugars in the f owers and fruits of Moringa oleifera Lam. (Syn. Moringa pterygosperma Gaertn)[J]. Journal of the Institution of Chemists (India),1977, 49(3): 163-165.
[3] DOGRA P D, SINGH B P, TANDON S. Vitamin C content in the Moringa pod vegetable[J]. Current Science,1975, 44(1): 31.
[4] DAHOT M U. Vitamin contents of the f owers and seeds of Moringa oleifera[J]. Pakistan Journal of Biochemistry,1988, 21(1/2): 21-24.
[5] ASGHARI G, PALIZBAN A B B. Quantitative analysis of the nutritional components in leaves and seeds of the Persian Moringa[J]. Pharmacognosy Research, 2015, 7(3): 8-11.
[6] BADAMI R C, SHANBHAG M R. Minor seed oils. VIII: examination of seed oils rich in unsaturated acids[J]. Journal of the Oil Technologists’ Association of India,1975, 7(3): 78-79.
[7] NJOKU O U, ADIKWU M U. Investigation on some physicochemical antioxidant and toxicological properties of Moringa oleifera seed oil[J]. Acta Pharmaceutica,1997, 47(4): 287-290.
[8] TSAKNIS J, LALAS S, GERGIS V, et al. A total characterization of Moringa oleifera Malawi seed oil[J]. Rivista Italiana delle Sostanze Grasse,1998, 75(1): 21-27.
[9] 段琼芬, 马李一, 余建兴, 等. 辣木油抗紫外线性能研究[J]. 食品科学, 2008, 29(9): 118-121.
[10] 段琼芬, 杨莲, 李钦, 等. 辣木油对小鼠抗紫外线损伤的保护作用[J].林产化学与工业, 2009(5): 69-73.
[11] 丁音琴. 微波消解ICP-OES法测定辣木叶中的矿物质元素[J]. 福建农业科技, 2014(10): 11-14.
[12] FAIZI S, SIDDIQUI B S, SALEEM R, et al. Isolation and structure of elucidation of novel hypotensive agents, niazinin A, niazinin B, niazimicin and niaziminin A+B from Moringa oleifera: the first naturally occurring thiocarbamates[J]. Journal of the Chemical Society, 1992, 32: 3237-3241.
[13] FAIZI S, SIDDIQUI B S, SALEEM R, et al. Fully acetylated carbamate and hypotensive thiocarbamate glycosides from Moringa oleifera[J]. Phytochemistry, 1995, 38(4): 957-963.
[14] SAHAKITPICHAN P, MAHIDOL C, DISADEE W, et al. Unusual glycosides of pyrrole alkaloid and 4’-hydroxyphenylethanamide from leaves of Moringa oleifera[J]. Phytochemistry, 2011, 72(8): 791-795.
[15] FAIZI S, SIDDIQUI B S, SALEEM R, et al. Isolation and structure elucidation of a novel glycoside niazidin from the pods of Moringa oleifera[J]. Journal of Natural Products,1997, 60(12): 1317-1321.
[16] FAIZI S, SIDDIQUI B S, SALEEM R, et al. Hypotensive constituents from the pods of Moringa oleifera[J]. Planta Medica, 1998, 64(3): 225-228.
[17] TEWARI A, BHAKUNI R S. Thiocarbamates from Moringa oleifera[J]. Natural Product Communications, 2006, 1(9): 721-725.
[18] OLUDURO O A, ADERIYE B I, CONNOLLY J D, et al. Characterization and antimicrobial activity of 4-(β-D-glucopyranosyl-1→4-α-L-rhamnopyranosyloxy)-benzyl thiocarboxamide; a novel bioactive compound from Moringa oleifera seed extract[J]. Folia Microbiologica, 2010, 55(5): 422-426.
[19] HORWATH M, BENIN V. Theoretical investigation of a reported antibiotic from the “Miracle Tree” Moringa oleifera[J]. Computational & Theoretical Chemistry, 2011, 965(1): 196-201.
[20] CHEN G F, YANG M L, KUO P C, et al. Chemical constituents of Moringa oleifera and their cytotoxicity against doxorubicin-resistant human breast cancer cell lines (Mcf-7/Adr)[J]. Chemistry of Natural Compounds, 2014, 50(1): 175-178.
[21] CHEENPRACHA S, PARK E J, YOSHIDA W Y, et al. Potential antiinf ammatory phenolic glycosides from the medicinal plant Moringa oleifera fruits[J]. Bioorganic & Medicinal Chemistry, 2010, 18(17): 6598-6602.
[22] FAIZI S, SIDDIQUI B S, SALEEM R, et al. Isolation and structure elucidation of new nitrile and mustard oil glycosides from Moringa oleifera and their effect on blood pressure[J]. Journal of Natural Products, 1994, 57(9): 1256-1261.
[23] MANGURO L O A, LEMMEN P. Phenolics of Moringa oleifera leaves[J]. Natural Product Research, 2007, 21(1): 56-68.
[24] KASHIWADA Y, AHMED F A, KURIMOTO S I, et al. New α-glucosides of caffeoyl quinic acid from the leaves of Moringa oleifera Lam[J]. Journal of Natural Medicines, 2012, 66(1): 217-221.
[25] VILLASENOR I M, LIM-SYLIANCO C Y, DAYRIT F. Mutagens from roasted seeds of Moringa oleifera[J]. Mutation Research, Genetic Toxicology Testing,1989, 224(2): 209-212.
[26] JANGWAN J S, DOBHAL M. New flavanone triglycoside from Moringa oleifera[J]. International Journal of Chemical Sciences, 2008, 6(1): 358-362.
[27] SALUJA M P, KAPIL R S, POPLI S P. Studies in medicinal plants: Part VI. Chemical constituents of Moringa oleifera Lamk. (hybrid variety) and isolation of 4-hydroxymellein[J]. Indian Journal of Chemistry, Section B: Organic Chemistry Including Medicinal Chemistry, 1978, 16B(11): 1044-1045.
[28] MEMON G M, MEMON S A, MEMON A R. Isolation and structure elucidation of moringyne: a new glycoside from seeds of Moringa oleifera Lam.[J]. Pakistan Journal of Scientific and Industrial Research, 1985, 28(1): 7-9.
[29] EILERT U, WOLTERS B, NAHRSTEDT A. The antibiotic principle of seeds of Moringa oleifera and Moringa stenopetala[J]. Planta Medica, 1981, 42(1): 55-61.
[30] KHAN M, ALI M. Phytochemical investigation of the stem bark of Moringa oleifera Lam.[J]. International Journal of Research in Ayurveda & Pharmacy, 2011, 2(5): 1577-1579.
[31] DAYRIT F M, ALCANTAR A D, VILLASENOR I M. Studies on Moringa oleifera seeds. part I. the antibiotic compound and its deactivation in aqueous solution[J]. Philippine Journal of Science, 1990, 119(1): 23-32.
[32] CACERES A, CABRERA O, MORALES O, et al. Pharmacological properties of Moringa oleifera. 1: preliminary screening for antimicrobial activity[J]. Journal of Ethnopharmacology, 1991, 33(3): 213-216.
[33] JHA N, MOHANKA R, AZAD R. Antifungal investigation of the constituents of Moringa oleifera lamk. Root bark extract[J]. Asian Journal of Chemistry, 2009, 21(9): 7437-7439.
[34] SINGH B N, SINGH B R, SINGH R L, et al. Oxidative DNA damage protective activity, antioxidant and anti-quorum sensing potentials of Moringa oleifera[J]. Food and Chemical Toxicology, 2009, 47(6): 1109-1116.
[35] PRIYA V, ABIRAMASUNDARI P, GAYATHRI S, et al. Antibacterial activity of the leaves, bark, seed and flesh of Moringa oleifera[J]. International Journal of Pharmaceutical Sciences and Research, 2011, 2(8): 2045-2049.
[36] KAUR H, SHANTANU. Anticancer activity of a constituent from Moringa oleifera leaves[J]. Journal of Chemical and Pharmaceutical Research, 2015, 7(1): 701-705.
[37] MURAKAMI A, KITAZONO Y, JIWAJINDA S, et al. Niaziminin, a thiocarbamate from the leaves of Moringa oleifera, holds a strict structural requirement for inhibition of tumor promoter-induced Epstein-Barr virus activation[J]. Planta Medica, 1998, 64(4): 319-323. [38] SREELATHA S, JEYACHITRA A, PADMA P R. Antiproliferation and induction of apoptosis by Moringa oleifera leaf extract on human cancer cells[J]. Food and Chemical Toxicology, 2011, 49(6): 1270-1275.
[39] INBATHAMIZH L, PADMINI E. Moringa oleifera f ower compounds as potent ligands to drug targets in PC3 cell lines-an in silico analysis[J]. International Journal of Pharmacy and Pharmaceutical Sciences, 2013, 5(4): 377-383.
[40] FAKURAZI S, HAIRUSZAH I, NANTHINI U. Moringa oleifera Lam prevents acetaminophen induced liver injury through restoration of glutathione level[J]. Food and Chemical Toxicology, 2008, 46(8): 2611-2615.
[41] UMAYA S R, PARVATHAM R. Efficacy of Moringa oleifera and Aloe vera on Af atoxin B1-induced hepatotoxicity in rats[J]. Research Journal of BioTechnology, 2009, 4(3): 20-24.
[42] HAMZA A A. Ameliorative effects of Moringa oleifera Lam seed extract on liver fibrosis in rats[J]. Food and Chemical Toxicology, 2010, 48(1): 345-355.
[43] BELLO B, WUDIL A M. Prevention of liver injury by Moringa oleifera aqueous leaf extract in rats treated with isoniazid and rifampicin[J]. Pharmacognosy Communications, 2012, 2(3): 22-25.
[44] GHASI S, NWOBODO E, OFILI J O. Hypocholesterolemic effects of crude extract of leaf of Moringa oleifera Lam in high-fat diet fed wistar rats[J]. Journal of Ethnopharmacology, 2000, 69(1): 21-25.
[45] 陈瑞娇, 朱必凤, 王玉珍, 等. 辣木叶总黄酮的提取及其降血糖作用[J].食品与生物技术学报, 2007, 26(4): 42-45.
[46] 余建兴. 辣木油提取技术及对大鼠辅助降血脂作用的研究[D]. 昆明: 昆明医学院, 2009: 42-45.
[47] MOMOH M A, CHIME S A, KENECHUKWU F C. Novel drug delivery system of plant extract for the management of diabetes: an antidiabetic study[J]. Journal of Dietary Supplements, 2013, 10(3): 252-263.
[48] AL-MALKI A L, el RABEY H A. The antidiabetic effect of low doses of Moringa oleifera Lam. seeds on streptozotocin induced diabetes and diabetic nephropathy in male rats[J]. BioMed Research International, 2015, 38: 1040-1042.
[49] SREELATHA S, PADMA P R. Antioxidant activity and total phenolic content of Moringa oleiferaleaves in two stages of maturity[J]. Plant Foods for Human Nutrition, 2009, 64(4): 303-311.
[50] 彭晓云, 李均祥, 张明. 辣木精油对黑腹果蝇寿命及SOD和MDA的影响[J]. 湖北农业科学, 2009, 48(3): 555-557.
[51] SIDDIQI S, KHAN M I. Pharmacological study of Moringa pterygosperma[J]. Pakistan Journal of Scientific and Industrial Research, 1968, 11(3): 268-272.
[52] 孙备. 辣木荚果中的降压成分[J]. 国外医学(中医中药分册), 1999, 22(3): 43.
[53] JANSAKUL C, WUN-NOI A, CROFT K, et al. Pharmacological studies of thiocarbamate glycosides isolated from Moringa oleifera[J]. Journal of the Science Society of Thailand, 1997, 23(4): 335-346.
[54] NANDAVE M, OJHA S K, JOSHI S, et al. Moringa oleifera leaf extract prevents isoproterenol-induced myocardial damage in rats: evidence for an antioxidant, antiperoxidative, and cardioprotective intervention[J]. Journal of Medicinal Food, 2009, 12(1): 47-55.
[55] PRAKASH A O, PATHAK S, SHUKLA S, et al. Uterine histoarchitecture during pre and post-implantation periods of rats treated with aqueous extract of Moringa oleifera Lam.[J]. Acta Europaea Fertilitatis, 1987, 18(2): 129-135.
[56] SHUKLA S, MATHUR R, PRAKASH A O. Antifertility profile of the aqueous extract of Moringa oleifera roots[J]. Journal of Ethnopharmacology, 1988, 22(1): 51-62.
[57] SHUKLA S, MATHUR R, PRAKASH A O. Histoarchitecture of the genital tract of ovariectomized rats treated with an aqueous extract of Moringa oleifera roots[J]. Journal of Ethnopharmacology, 1989, 25(3): 249-261.
[58] ZADE V, PARE S, DABHADKAR D, et al. Abortifacient efficacy of Moringa oleifera in albino rats[J]. International Journal of Pharmacology and Biological Sciences, 2010, 4(2): 133-138.
[59] 王柯慧. 辣木抗溃疡作用的研究[J]. 国外医学(中医中药分册), 1997, 20(1): 37.
[60] DAHIRU D, ONUBIYI J A, UMARU H A. Phytochemical screening and antiulcerogenic effect of Moringa oleifera aqueous leaf extract[J]. African Journal of Traditional, Complementary and Alternative Medicines, 2006, 3(3): 70-75.
[61] DEBNATH S, BISWAS D, RAY K, et al. Possible modulatory role of Moringa oleifera in gastric mucus secretion with serotonin and enterochromaffin cell interaction in aspirin induced experimental gastric ulceration[J]. Biogenic Amines, 2010, 24(2): 157-168.
[62] MAHAJAN S G, MEHTA A A. Effect of Moringa oleifera Lam-seed extract on ovalbumin-induced airway inf ammation in guinea pigs[J]. Inhalation Toxicology, 2008, 20(10): 897-909.
[63] MAHAJAN S G, BANERJEE A, CHAUHAN B F, et al. Inhibitory effect of n-butanol fraction of Moringa oleifera Lam seeds on ovalbumin-induced airway inflammation in a guinea pig model of asthma[J]. International Journal of Toxicology, 2009, 28(6): 519-527.
[64] MAHAJAN S G, MEHTA A A. Anti-arthritic activity of hydroalcoholic extract of f owers of Moringa oleifera Lam. in Wistar rats[J]. Journal of Herbs, Spices & Medicinal Plants, 2009, 15(2): 149-163.
[65] LEE H J, JEONG Y J, LEE T S, et al. Moringa fruit inhibits LPS-induced NO/iNOS expression through suppressing the NF-κB activation in RAW264.7 cells[J]. The American Journal of Chinese Medicine, 2013, 41(5): 1109-1123.
[66] AMRUTIA J N, LALA M, SRINIVASA U, et al. Anticonvulsant activity of Moringa oleifera leaf[J]. International Research Journal of Pharmacy, 2011, 2(7): 160-162.
[67] RAY K, DUTTA A, HAZRA R, et al. Anticonvulsive and antioxidant activity of aqueous root extract of Moringa oleifera in ferric chlorideinduced epileptic rats[J]. International Journal of Phytomedicine, 2012, 4(4): 486-495.
[68] KIRISATTAYAKUL W, WATTANATHORN J, TONG-UN T, et al. Cerebroprotective effect of Moringa oleifera against focal ischemic stroke induced by middle cerebral artery occlusion[J]. Oxidative Medicine and Cellular Longevity, 2013, 2013(1): 951415.
[69] SUTALANGKA C, WATTANATHORN J, MUCHIMAPURA S, et al. Moringa oleifera mitigates memory impairment and neurodegeneration in animal model of age-related dementia[J]. Oxidative Medicine and Cellular Longevity, 2013(12): 695936.
[70] HANNAN M A, KANG J Y, MOHIBBULLAH M, et al. Moringa oleifera with promising neuronal survival and neurite outgrowth promoting potentials[J]. Journal of Ethnopharmacology, 2014, 152(1): 142-150.
[71] CACERES A, SARAVIA A, RIZZO S, et al. Pharmacologic properties of Moringa oleifera. 2: screening for antispasmodic, antiinflammatory and diuretic activity[J]. Journal of Ethnopharmacology, 1992, 36(3): 233-237.
[72] MANAHEJI H, JAFARI S, ZARINGHALAM J, et al. Analgesic effects of methanolic extracts of the leaf or root of Moringa oleifera on complete Freund’s adjuvant-induced arthritis in rats[J]. Journal of Chinese Integrative Medicine, 2011, 9(2): 216-222.
[73] AHMAD S, SHAH S M, ALAM M K, et al. Antipyretic activity of hydro-alcoholic extracts of Moringa oleifera in rabbits[J]. Pakistan Journal of Pharmaceutical Sciences, 2014, 27(4): 931-934.
[74] RIGANO L, ANDOLFATTO C, RADICE A. Moringa seed oil: the new soul of cosmetics[J]. S fw Journal, 2011, 137(3): 48; 50-54.
[75] 段琼芬, 李钦, 林青, 等. 辣木油对家兔皮肤创伤的保护作用[J]. 天然产物研究与开发, 2011, 23(1): 159-162.
[76] MUHAMMAD A A, PAUZI N A S, ARULSELVAN P, et al. In vitro wound healing potential and identification of bioactive compounds from Moringa oleifera Lam.[J]. BioMed Research International, 2013: 974580-974581.
[77] CHENG D M, WATERMAN C, TUMER T B, et al. Moringa leaf phytochemicals for skin benefits[J]. Cosmetics & Toiletries, 2014, 129(9): 16; 18-23.
[78] PRABSATTROO T, WATTANATHORN J, IAMSAARD S, et al. Moringa oleifera extract enhances sexual performance in stressed rats[J]. Journal of Zhejiang University Science B, 2015, 16(3): 179-190.
[79] TAHILIANI P, KAR A. Role of Moringa oleifera leaf extract in the regulation of thyroid hormone status in adult male and female rats[J]. Pharmacological Research: the Off cial Journal of the Italian Pharmacological Society, 2000, 41(3): 319-323.
[80] KARADI R V, PALKAR M B, GAVIRAJ E N, et al. Antiurolithiatic property of Moringa oleifera root bark[J]. Pharmaceutical Biology, 2008, 46(12): 861-865.
[81] 贺敏, 贺银凤. 辣木通便作用研究初探[J]. 内蒙古医学杂志, 2009(12): 1420-1423.
[82] 贺银凤, 任安祥, 林经桓. 辣木叶对小白鼠通便作用的初步研究[J].食品工业, 2009, 29(6): 10-12.
[83] KAMEL A M. Can we use the moringa oil as botanical insecticide against Spodoptera frugiperda?[J]. Academic Journal of Entomology, 2010, 3(2): 59-64.
[84] PAL A, BAWANKULE D U, DAROKAR M P, et al. Influence of Moringa oleifera on pharmacokinetic disposition of rifampicin using HPLC-PDA method: a pre-clinical study[J]. Biomedical Chromatography, 2011, 25(6): 641-645.
[85] OUEDRAOGO M, LAMIEN-SANOU A, RAMDE N, et al. Protective effect of Moringa oleifera leaves against gentamicin-induced nephrotoxicity in rabbits[J]. Experimental and Toxicologic Pathology, 2013, 65(3): 335-339.
[86] SHARMA A K, AHMAD S, SHARMA S. Phytochemical investigation & immunomodulatory activity of Moringa oleifera root[J]. Asian Journal of Biochemical and Pharmaceutical Research, 2013, 3(1): 261-266.
[87] ADEYEMI O S, ELEBIYO T C. Moringa oleifera supplemented diets prevented nickel-induced nephrotoxicity in Wistar rats[J]. Journal of Nutrition and Metabolism, 2014: 958621-958629.
[88] SHEIKH A, YEASMIN F, AGARWAL S, et al. Protective effects of Moringa oleifera Lam. leaves against arsenic-induced toxicity in mice[J]. Asian Pacific Journal of Tropical Biomedicine, 2014, 4(Suppl 1): 353-358
[89] NIKKON F, HASAN S, SALAM K A, et al. Benzylcarbamothioethionate from root bark of Moringa oleifera Lam. and its toxicological evaluation[J]. Boletin Latinoamericano Y Del Caribe de Plantas Medicinales Y Aromaticas, 2009, 8(2): 130-138.
[90] 冯丁山, 黄业宇, 张晓昕, 等. 观辣树叶的急性毒性及遗传毒性研究[J].中国热带医学, 2014, 14(2): 139-141.
[91] 段琼芬, 马李一, 王有琼, 等. 辣木籽油食用安全性毒理学评价[J].中国油脂, 2014, 39(2): 48-52.
[92] MAZUMDER U K, GUPTA M, CHAKRABARTI S, et al. Evaluation of hematological and hepatorenal functions of methanolic extract of Moringa oleifera Lam root-treated mice[J]. Indian Journal of Experimental Biology, 1999, 37(6): 612-614.
[93] OYAGBEMI A A, OMOBOWALE T O, AZEEZ I O, et al. Toxicological evaluations of methanolic extract of Moringa oleifera leaves in liver and kidney of male Wistar rats[J]. Journal of Basic and Clinical Physiology and Pharmacology, 2013, 24(4): 307-312.
[94] 王素燕, 刘静华. ICP-AES同时测定辣木叶中的6种微量元素[J]. 光谱实验室, 2005(5): 1102-1104.
[95] 陈瑞娇, 彭珊珊, 王玉珍, 等. 辣木叶中多糖含量的测定[J]. 时珍国医国药, 2007, 18(7): 1700-1701.
[96] KARTHIKA S, RAVISHANKAR M, MARIAJANCYRANI J, et al. Study on phytoconstituents from Moringa oleifera leaves[J]. Asian Journal of Plant Science and Research, 2013, 3(4): 63-69.
[97] MARRUFO T, NAZZARO F, MANCINI E, et al. Chemical composition and biological activity of the essential oil from leaves of Moringa oleifera Lam. cultivated in Mozambique[J]. Molecules, 2013, 18(9): 10989-11000.
[98] GATADE A A, RANVEER R C, SAHOO A K. Nutritional analysis, total phenolic content, free radical scavenging activity and phytochemical analysis of leaves powder of Moringa oleifera (Drumstick) and Cicer arietinum (Chick pea)[J]. International Journal of Pharma and Bio Sciences, 2013, 4(3): 922-933.
[99] 陈荣荣, 张献忠, 王根女, 等. HD/GC-MS法测定辣木树不同部位挥发性香气成分的研究[J]. 粮食与食品工业, 2014(4): 58-61.
[100] FAIZI S, SUMBUL S, VERSIANI M A, et al. GC/GCMS analysis of the petroleum ether and dichloromethane extracts of Moringa oleifera roots[J]. Asian Pacif c Journal of Tropical Biomedicine, 2014, 4(8): 650-654.
[101] GOVARDHAN SINGH R S, NEGI P S, RADHA C. Phenolic composition, antioxidant and antimicrobial activities of free and bound phenolic extracts of Moringa oleifera seed f our[J]. Journal of Functional Foods, 2013, 5(4): 1883-1891.
[102] COPPIN J P, XU Y, CHEN H, et al. Determination of f avonoids by LC/MS and anti-inf ammatory activity in Moringa oleifera[J]. Journal of Functional Foods, 2013, 5(4): 1892-1899.
[103] PACHAURI S D, KHANDELWAL K, SINGH S P, et al. HPLC method for identification and quantification of two potential antiinf ammatory and analgesic agents-1,3-dibenzyl urea and aurantiamide acetate in the roots of Moringa oleifera[J]. Medicinal Chemistry Research, 2013, 22(11): 5284-5289.
[104] VONGSAK B, SITHISARN P, GRITSANAPAN W. Simultaneous HPLC quantitative analysis of active compounds in leaves of Moringa oleifera Lam.[J]. Journal of Chromatographic Science, 2014, 52(7): 641-645.
Advances in Knowledge of Moringa oleifera
XU Min
1,2,3, ZHAO Sanjun
4, SONG Hui
2, YANG Chongren
2,3,*
(1. Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China; 2. Center for Drug Discovery & Technology Development of Yunnan Traditional Medicine, Kunming 650101, China; 3. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China; 4. School of Life Sciences, Yunnan Normal University, Kunming 650500, China)
Abstract:Moringa oleifera, belonging to the Moringaceae family, is a biennial deciduous tree that is distributed in tropical and sub-tropical regions of Africa and Asia. The plant has been introduced into China and planted in Guangdong, Yunnan and Taiwan provinces. Moringa oleifera is called as “Miracle Tree” due to its rapid growth. Both its leaves and tender fruits are edible. Moringa oleifera seeds contain more than 30% oil. Moringa oleifera seed proteins are traditionally utilized for water purification owing to advantages such as natural occurrence, no toxic or side effects and easy degradation. Furthermore, Moringa oleifera contains carbamate derivatives and phenolic compounds, which show a diversity of biological activities including antifungal, anti-hypertensive, anti-diabetic effects. This paper reviews the chemical constituents and biological activities of Moringa oleifera with focus on safety evaluation and chemical analysis of Moringa oleifera for the purpose of providing evidence for the development and utilization of Moringa oleifera.
Key words:Moringa oleifera; chemical constituents; biological activities; safety evaluation; constituents analysis
DOI:10.7506/spkx1002-6630-201623048
中图分类号:R274.9
文献标志码:A
文章编号:
引文格式:
许敏, 赵三军, 宋晖, 等. 辣木的研究进展[J]. 食品科学, 2016, 37(23): 291-301.
DOI:10.7506/spkx1002-6630-201623048. http://www.spkx.net.cn
XU Min, ZHAO Sanjun, SONG Hui, et al. Advances in knowledge of Moringa oleifera[J]. Food Science, 2016, 37(23): 291-301. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201623048. http://www.spkx.net.cn
收稿日期:2015-06-16
基金项目:云南省中青年学术和技术带头人后备人才计划项目(2011CI044)
作者简介:许敏(1976—),女,副研究员,博士,主要从事天然药物化学研究。E-mail:xumin8121@hotmail.com
*通信作者:杨崇仁(1942—),男,研究员,博士,主要从事中药资源和化学研究。E-mail:1208558650@qq.com