陈其玲 1,任晓宁 1,王 玲 1,田 雨 1,赵美静 1,宋巧智 1,刘树文 1,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术中心,陕西 杨凌 712100;3.西北农林科技大学合阳葡萄试验示范站,陕西 渭南 715300)
摘 要:目的:β-葡萄糖苷酶是葡萄酒中结合态香气物质释放的关键酶,但其活性受诸多因素的影响。本研究旨在从酒酒球菌自身耐酸能力的视角去分析评估菌株糖苷酶活性,探索酸胁迫下不同耐酸表型酒酒球菌与其β-葡萄糖苷酶活性之间存在的相关性关系。方法:结合利用离子注入诱变与胁迫环境筛选的方式,获得耐酸(pH 3.0)、酸敏(pH 9.0)突变酒酒球菌菌株,对其β-葡萄糖苷酶的活力进行测定,并筛选3 组酸胁迫下表型差异大的β-葡萄糖苷酶基因送样测序。结果:耐酸突变酒酒球菌的β-葡萄糖苷酶酶活力是出发菌株的2~4 倍,是相应酸敏突变株的2~7 倍。测序结果显示,除菌株a3的β-葡萄糖苷酶基因在108位(G置换成C)和1 232(A置换成T)位处发生了突变外,其余菌株β-葡萄糖苷酶的基因均未发生改变。结论:酒酒球菌β-葡萄糖苷酶活性与菌株酸胁迫能力显著相关(P<0.05)。耐酸胁迫能力越强的菌株,β-葡萄糖苷酶活性越高。
关键词:酒酒球菌;离子注入诱变;酸胁迫;β-葡萄糖苷酶;相关性分析
葡萄酒的香气是评价葡萄酒品质的重要指标之一。在麝香类的葡萄酒中,萜烯醇(尤其是单萜烯)是构成葡萄酒典型品种香气的重要化合物 [1-2]。但是,多数萜烯醇在葡萄酒中通常与糖以糖苷的形式结合,因而不能表现出其香气特征 [3]。在葡萄酒生产中,常采用酶促水解法分解风味前体物质以增强其香气浓度及复杂性。通常情况下,糖苷类物质的水解需要多种糖苷酶共同参与完成,其中β-葡萄糖苷酶是结合态香气物质释放的关键酶 [4-7]。
葡萄酒中的乳酸菌,尤其是酒酒球菌代谢产生的β-葡萄糖苷酶对葡萄酒香气品质的提升效果尤为显著 [8-10]。但是,葡萄酒生境十分恶劣且复杂,高酸、高酒精、高二氧化硫、低糖环境等都会对糖苷酶活性产生影响 [11-14]。目前的研究多是针对外界胁迫条件对酒酒球菌β-葡萄糖苷酶活性的影响,鲜有对酒酒球菌β-葡萄糖苷酶活性与菌株自身耐酸胁迫能力进行相关性研究。
因此,本研究通过离子注入诱变对3 株酒酒球菌进行离子注入,并于pH 3.0胁迫环境筛选耐酸突变株,于pH 9.0胁迫环境筛选酸敏突变株。通过比较这些耐酸差异菌株及其出发菌株的β-葡萄糖苷酶的β-葡萄糖苷酶活性,分析研究酒酒球菌的抗酸胁迫能力与其β-葡萄糖苷酶活性之间的关系。
1.1 菌种
3 株酒酒球菌Oenococcus oeni SX-1a [15]、SX-1b [15]、CS-1b [16]由西北农林科技大学葡萄酒学院保藏。
1.2 培养基与试剂
酸性番茄汁培养基(acid tomato juice broth,ATB)(1 L):番茄汁250 mL、蛋白胨10 g、酵母浸粉5 g、葡萄糖10 g、MgSO 40.2 g、MnSO 40.05 g、盐酸半胱氨酸0.5 g。固体培养基再加入琼脂27 g,所有培养基再使用前均需在121 ℃条件下灭菌20 min,灭菌后用HCl和NaOH溶液调节培养基pH值。
对硝基苯-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)、对硝基苯酚(p-nitrophenol,pNP) 美国Sigma公司;其他试剂均为国产分析纯。
1.3 仪器与设备
AIR TECH超净台 中国苏州安泰空气技术有限公司;MJ-250B培养箱、H-4数显恒温水浴锅 上海森信实验仪器有限公司;5417R1冷冻离心机 德国Eppendorf公司;Nanodrop1000紫外分光光度计、Orion Star A111 pH计 美国Thermo Scientific公司;SS325灭菌锅 日本Tomy公司;多功能复合离子注入机 成都同创材料表面新技术工程中心。
1.4 方法
1.4.1 菌株的诱变处理
菌体悬浮液的制备:挑取平板中的单个菌落(原始菌株)接入10 mL ATB液体培养基。以4%的接种量将活化种子液转接于10 mL ATB液体培养基中进行二次活化。
离子注入:将制备好的菌体悬浮液0.1 mL均匀涂布于9 cm的无菌空白培养皿中央,置于超净台下,用无菌风吹干备用。将均匀涂布有菌体并吹干的培养皿置于离子注入小靶室内,注入离子N +,能量为50 keV,注入靶室的真空度为10 -3ions/cm 2。
1.4.2 菌株的筛选
经离子注入后的样品,用1 mL无菌水冲洗后,分别转入到pH 3.0和pH 9.0的液体胁迫ATB培养基中,于26 ℃条件下培养,并在同样胁迫环境中连续培养12 代后,于pH 4.8固体ATB培养基上通过划线的方法进行两次分离纯化。最终获得的单菌落于pH 4.8 ATB液体培养基中进行活化,将活化后的菌液再次接种到相应胁迫培养条件下(pH 3.0和pH 9.0),连续培养12 代,获得性状稳定的纯化菌株。
1.4.3 酒酒球菌诱变菌株酸胁迫生长曲线绘制
将诱变菌株及其出发菌株于10 mL pH 4.8液体ATB培养基中26 ℃静置培养,活化2 代后,取对数生长中期的菌体(A 600 nm=1.0),并以4%接种量接种到pH 3.0液体ATB培养基中,绘制菌株酸胁迫生长曲线。
1.4.4 β-葡萄糖苷酶样品的制备
按照1.4.3节中活化好的菌株,取对数生长末期(A 600 nm=1.2)菌液各1 mL,10 000 r/min 离心10 min得菌体,将菌体用0.85% NaCl溶液洗涤2 次,最后使其悬浮于0.5 mL的0.85% NaCl溶液中。
1.4.5 β-葡萄糖苷酶活力测定
β-葡萄糖苷酶活力测定方法参照Barbagallo等 [12]的方法略作修改。反应体系(3 mL)为:吸取0.5 mL柠檬酸磷酸缓冲液-pNPG混合液(pH 5.0,pNPG浓度5 mmol/L),加入1.4.4节制备的悬浮菌体0.5 mL,混合后于37 ℃条件下反应1 h,立即加入2 mL 1 000 mmol/L Na 2CO 3溶液终止反应。10 000 r/min离心15 min,转移上清液至另一试管中。使用全波长酶标仪测定其在400 nm波长处的吸光度。对照样品用0.85% NaCl缓冲液代替菌悬液制备,其他处理与样品相同。标准曲线通过测定不同浓度(0~60 μmol/L)pNP溶液在400 nm波长处的吸光度获得。菌体干质量按以下公式计算:
式中:A 600 nm为600 nm波长处菌悬液的吸光度;2.616 8为固定系数。
β-葡萄糖苷酶活力定义为每克菌体(干质量)每分钟生成pNP的物质的量/(μmol/(g·min))。
pNP标准曲线的绘制:在1~60 μmol/L浓度范围内,回归方程为y=0.018 8x+0.027 4,R 2=0.999 5,线性关系良好,满足实验需求。
1.4.6 β-糖苷酶基因聚合酶链式反应(polymerase chain reaction,PCR)扩增
参照文献[1 6]设计的引物,由生工生物(上海)股份有限公司合成:b g l-F:5’-GTGACTATGGTAGAGTTTCC-3’;bgl-R:5’-TCAAAACCCATTCCGTTCCCCA-3’。扩增产物用10 mg/mL的琼脂糖凝胶进行电泳分离(电压80 V),电泳结束后将凝胶放在全自动凝胶成像分析系统中,拍照并分析。
对所有供试菌株β-葡萄糖苷酶进行PCR扩增,并筛选菌株酶活及抗酸表型差异较大的菌株,将其酶切产物送生工生物工程(上海)有限公司纯化并测序。然后,利用生物信息学分析软件MAGA 6.0将所有测序糖苷酶基因序列进行核苷酸同源性比对,并提交到GenBank上。以确保酶活力的差异并不是由于诱变造成的糖苷酶基因突变所引起。
1.5 数据处理
酶活力为3 次测定的平均值。实验结果采用SPSS 20.0分析软件进行数据分析。
2.1 诱变菌株
离子注入诱变获得的诱变菌株、相应的诱变剂量和后期筛选条件见表1。
表1 诱变菌株
Table1 Information about O. ooeennii mutants

菌株出发菌株诱变剂量/(N +/cm 2)筛选、分离纯化pH a3SX-1a3×10 153.0 a1-1、a1-2SX-1a1×10 159.0 b1SX-1b1×10 153.0 b3SX-1b3×10 153.0 b2SX-1b2×10 159.0 c1CS-1b1×10 153.0 c2 CS-1b1×10 153.0 c2-1CS-1b2×10 159.0 c2-2CS-1b2×10 159.0
离子注入诱变育种具有高突变率、突变谱广、性状稳定等特点 [17]。经离子注入菌株转入pH 3.0低酸胁迫环境下培养,分离纯化后共获得5 株突变菌,其中SX-1a突变菌1 株、SX-1b突变株2 株、CS-1b突变株2 株;pH 9.0碱胁迫条件下分离纯化后获得突变株5 株,其中SX-1a 2 株、SX-1b 1 株、CS-1b 2株,所有纯化后的突变菌株都再次经过继代培养(不少于12代),确保获得的突变株具有稳定的耐酸/酸敏性状。其中,出发菌株SX-1a、SX-1b、CS-1b在pH 3.0以及pH 9.0胁迫环境中连续培养3~5 代后,菌株基本已经丧失活性。
2.2 酸胁迫环境下菌体的生长曲线
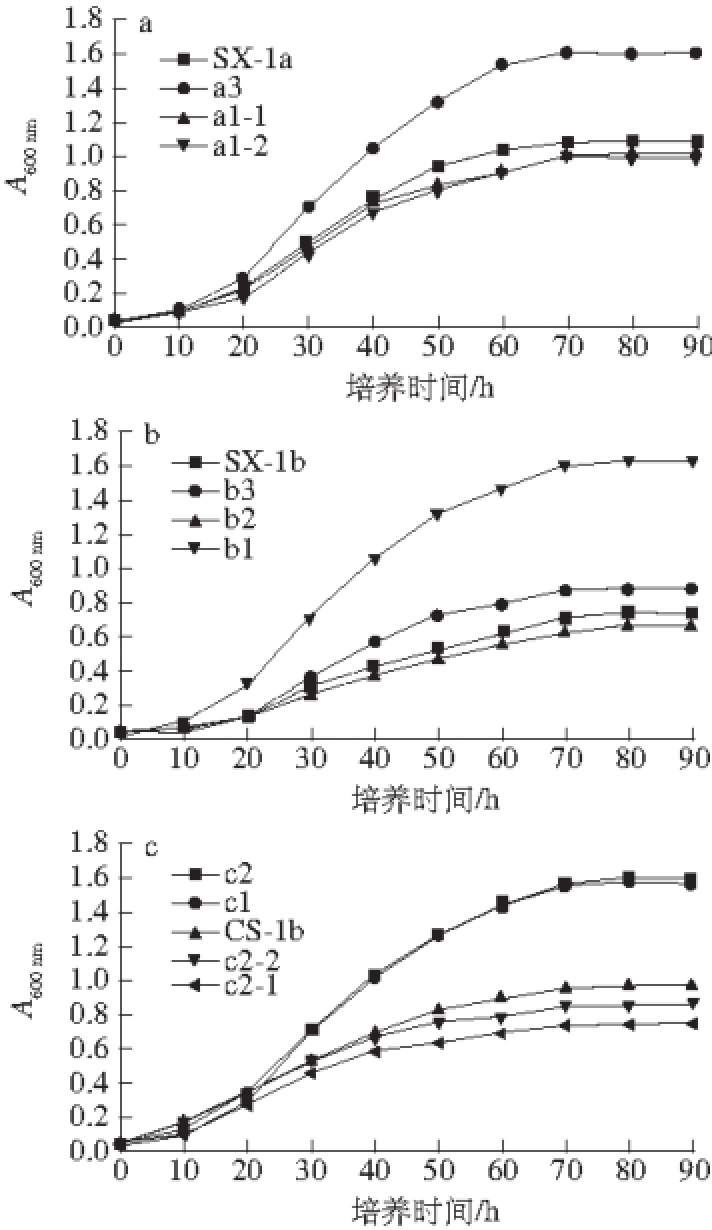
图1 酒酒球菌SX-1a(a)、SX-1b(b)、CS-1b(c)及其诱变株在酸胁迫环境中的生长曲线(pH 3.0 ATB培养基)
Fig. 1 Growth curves of O. oeni SX-1a (a), SX-1b (b), CS-1b (c) and corresponding mutants cultured in ATB medium (pH 3.0)
由图1可知,pH 3.0低酸性胁迫环境中,筛选获得的突变株b1、a3、c1和c2在稳定期的生物量(即A 600 nm值)高于对应的出发菌株SX-1b、SX-1a、CS-1b。而于pH 9.0碱性胁迫环境中筛选获得的突变株b2、a1-1、a1-2、c2-1、c2-2,在稳定期的生物量则低于对应的出发菌株。实验结果显示,筛选自pH 3.0环境的突变株(即耐酸突变株)耐酸胁迫能力高于出发菌株,而筛选自pH 9.0环境的突变株(即酸敏突变株)耐酸胁迫能力低于出发菌株。
葡萄酒的高酸环境是限制乳酸菌活性的重要因素之一 [18-19]。酒酒球菌能否耐受葡萄酒酒体的高酸环境,直接决定着菌体能否在酒体环境中生长繁殖、启动并主导完成苹果酸-乳酸发酵、代谢产生糖苷酶酶解糖苷等 [20-21]。在某些冷凉产区,苹果酸-乳酸发酵强葡萄酒的pH值较低,约为2.5~3.0。Tourdot-Maréchal等 [22]研究显示,当
酒酒球菌暴露于pH 3.2胁迫环境时,菌株生长受到严重的抑制。本实验筛选获得的耐酸突变株b1、a3、c1和c2在pH 3.0低酸环境中,累积最大生物量(稳定期A 600 nm值)与出发菌株在最适环境(pH 4.8)中的能够达到的最大生物量相近(SX-1b、SX-1a、CS-1b在pH 4.8环境下,稳定期A 600 nm值分别是1.538、1.828和1.611)。结果表明,耐酸突变菌株在酸胁迫环境中表现出很强的生长能力。
2.3 不同菌株β-葡萄糖苷酶活力的比较
表2 酒酒球菌CS-1b及其诱变菌株β-葡萄糖苷酶活力
Table2 β-Glycosidase activities ofO. ooeennii CS-1b and the corresponding mutants

注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
菌株编号平均酶活力/(μmol/(g·min))CS-1b0.632±0.023 cc11.065±0.027 ac20.837±0.009 bc2-20.372±0.019 dc2-10.286±0.034 e
以pNPG为反应底物,于37 ℃条件下反应1 h,测定13 株酒酒球菌中β-葡萄糖苷酶活力。由表2可知,耐酸突变株c1、c2的β-葡萄糖苷酶活力高于出发菌株,其中突变株c1的酶活力最高,是出发菌株酶活力的1.69 倍。而酸敏突变株c2-1、c2-2的β-糖苷酶活力低于出发菌株CS-1b,其中c2-1的酶活力最低,仅是出发菌株酶活力的45.25%,是耐酸突变菌株c1酶活力的26.85%。
表3 酒酒球菌SX-1b及其诱变菌株β-葡萄糖苷酶活力
Table3 β-Glycosidase activitiesof O. oeennii SX-1b and the corresponding mutants
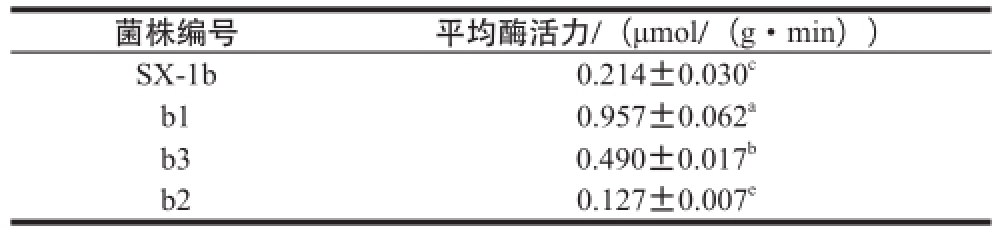
菌株编号平均酶活力/(μmol/(g·min))SX-1b0.214±0.030 cb10.957±0.062 ab30.490±0.017 bb20.127±0.007 e
由表3可知,耐酸突变株b1、b3的β-葡萄糖苷酶活力高于出发菌株SX-1b,其中突变株b1的酶活力是出发菌株酶活的4.47 倍,是突变株b3酶活力的1.95 倍,是突变株b2酶活力的7.50 倍。突变株b2的β-糖苷酶活力最低,仅是出发菌株酶活力的59.35%。
表4 酒酒球菌SX-1a及其诱变菌株β-葡萄糖苷酶活力
Table4 β-Glycosidase activity ofO. oeennii SX-1a and the corresponding mutants

菌株编号平均酶活力/(μmol/(g·min))SX-1a0.398±0.007 ba31.011±0.038 aa1-10.359±0.007 ba1-20.404±0.035 b
由表4可知,突变株a3的β-葡萄糖苷酶活力最高,是出发菌株SX-1a酶活力的2.54 倍,是突变株a1-1酶活力的2.82 倍,是突变株a1-2酶活力的2.5 倍。结果显示,酸胁迫能力强的菌株(如a3、b1、
c1),其β-葡萄糖苷酶活力远高于酸敏突变株。这可能是因为相较于酸敏突变株,耐酸突变株在低酸环境中具有较强的维持胞内pH值平衡的能力,而细胞内酸碱稳定的状态能够确保参与菌株各个代谢系统的酶活性 [23-25],使各代谢有条不紊的进行,从而维持了菌株的正常生长繁殖。且当O. oeni各项生理机能维持正常水平时,其参与的苹果酸代谢、氨基酸代谢等反过来帮助调控细胞内酸碱平衡、维持细胞内的pH值平衡,更有利于菌体在高酸的环境下生长代谢 [15,19]。由此也可以证实,当将酸敏菌株暴露于酸性环境中,其胞内的酸碱平衡瞬间被打破,且其调节细胞内生境pH值平衡的能力差,因而得不到很好的修复,使得胞内参与各个代谢通路的酶活性受到抑制,直接导致胞内的各个代谢通路停滞,细胞更加不能正常代谢生长 [22],相应的生产β-葡萄糖苷酶效率也不高。
2.4 β-葡萄糖苷酶基因检测
2.4.1 β-葡萄糖苷酶目的基因PCR扩增
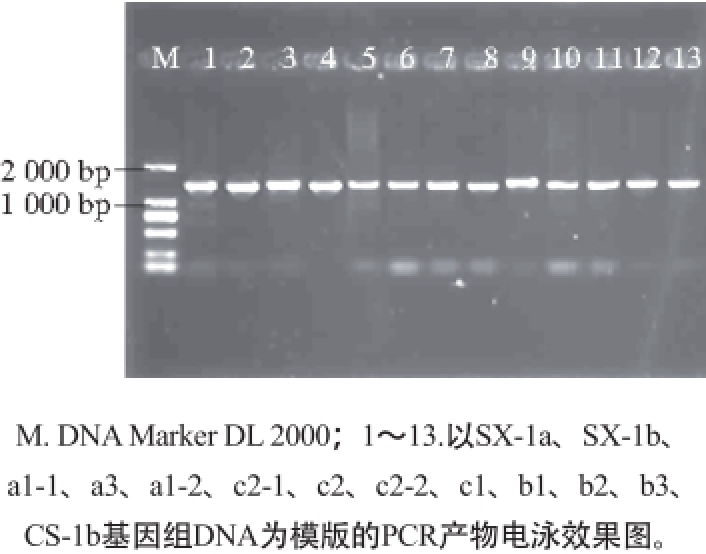
图2 目的基因PCR扩增产物电泳图
Fig. 2 Electrophoresis of PCR-amplified products
13 株菌株β-葡萄糖苷酶基因的PCR扩增产物电泳图如图2所示。所有菌株都得到了1 400 bp左右大小的扩增产物。
2.4.2 β-葡萄糖苷酶基因序列分析
为排除诱变可能引发菌株β-葡萄糖苷酶基因的改变,从而导致其β-葡萄糖苷酶活性发生变化可能性。筛选3 组耐酸胁迫能力差异大且酶活性差异大的菌株(耐酸突变株a3、c1、b1,以及对应的酸敏突变株a1-1、c2-1、b2,出发菌株SX-1a、SX-1b),对其β-葡萄糖苷酶基因进行分析。测序结果提交GenBank核酸数据库,菌株SX-1a、SX-1b、a1-1、a3、c2-1、c1、b1、b2的β-葡萄糖苷酶基因访问号依次为KU594295、KU594296、KU594297、KU594298、KU594299、KU594300、KU594301、KU594302。BLAST比对结果显示,8 株测定序列与GenBank中已发表的酒酒球菌β-糖苷酶基因序列(GenBank:AY489108.1)同源性高达99%。
此外,除菌株a3的糖苷酶基因序列在108位(G置换成C)和1 232位(A置换成T)碱基处发生了改变,翻译成蛋白质序列的比对结果显示,a3菌株对应的蛋白质序列仅在411位处发生了改变,由酪氨酸(Y)突变成了苯丙氨酸(F)。其余7 株菌的β-葡萄糖苷酶基因序列一致。实验数据表明,β-葡萄糖苷酶基因不是造成耐酸突变株与酸敏突变株之间酶活性差异的原因。
2.5 相关性分析
表5 酒酒球菌pH 3.0累积生物量和β-葡萄糖苷酶活性的相关性分析
Table5 Correlation analysis between O. oeennii maximum biomass at pH 3.0 anndd β-glycosidase activviittyy

注:*.在0.05水平上相关;**.在0.01水平上相关。
编号相关性显著性第1组0.995**0.005第2组0.981*0.019第3组0.957*0.011
分别对酒酒球菌SX-1a及其突变株(第1组)、SX-1b及其突变株(第2组)、CS-1b及其突变株(第3组),pH 3.0累积最大生物量(稳定期的A 600 nm)与β-葡萄糖苷酶平均酶活进行相关性分析。从表5可知,酒酒球菌β-葡萄糖苷酶活性与菌株自身耐酸胁迫能力显著相关。
为了挖掘酒酒球菌β-葡萄糖苷酶活力与其耐酸胁迫能力之间的关联性。本实验通过结合利用离子注入诱变和胁迫培养的方式,获得了耐酸性状能够稳定遗传、pH 3.0低酸胁迫下生长能力具有明显差异的酒酒球菌耐酸和酸敏突变菌株,最大限度地避免菌株遗传背景的差异,为酶活力与耐酸胁迫能力关联性提供可靠的佐证。实验结果最终证实,酒酒球菌β-葡萄糖苷酶活力与其耐酸胁迫能力相关。且实验筛选获得的耐酸、酸敏酒酒球菌为研究酒酒球菌酸胁迫调控基因提供了优良菌株资源。β-葡萄糖苷酶活力数据以及糖苷酶基因测序结果显示,耐酸突变株的β-葡萄糖苷酶活力远高于酸敏突变株,可能是参与调控细胞酸胁迫的某些生理机制也参与调控了菌株的β-葡萄糖苷酶基因的表达有关,并且离子注入使得耐酸突变株中,更多同时参与调控耐酸胁迫机制和酶活力表达机制的基因被激活,表现出耐酸突变株更强耐酸能力、酶活力的提升,不过详细的机理还需进一步的研究。
酒酒球菌β-葡萄糖苷酶的活性还受到酒体其他因素的影响,如酒精、二氧化硫、糖含量等。因此,理论上认为酒酒球菌耐酒精、二氧化硫等胁迫环境的能力与酶活力之间也存在着相关性。本实验的方法可为其他相关性研究提供参考。
本实验中筛选获得的耐酸突变酒酒球菌,能够在酸性环境下保持旺盛的活力和较高的β-葡萄酒苷酶的活性,可以适应葡萄酒酒体的低酸环境,为低酸葡萄原料接种启动苹果酸-乳酸发酵提供了优秀菌种资源。但是,耐酸突变酒酒球菌菌株否能够顺利启动苹果酸-乳酸发酵,并且实现可靠且安全的高产、稳产β-葡萄糖苷酶,提高葡萄酒感官质量,这仍需要进一步的研究。
参考文献:
[1] MAICAS S, MATEO J J. Hydrolysis of terpenyl glycosides in grape juice and other fruit juices: a review[J]. Applied Microbiology and Biotechnology, 2005, 67(3): 322-335. DOI:10.1007/s00253-004-1806-0.
[2] ZIETEMA A J J, de KLERK D, van RENSBURG P. Coexpression of alpha-L-arabinofuranosidase and beta-glucosidase in Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2011, 11(1): 88-103. DOI:10.1111/j.1567-1364.2010.00694.x.
[3] MATEO J J, JIMÉNEZ M. Monoterpenes in grape juice and wines[J]. Journal of Chromatography A, 2000, 881(1/2): 557-567. DOI:10.1016/ S0021-9673(99)01342-4.
[4] GUEGUEN Y, CHEMARDIN P, JANBON G, et al. A very eff cient beta-glucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices[J]. Journal of Agricultural and Food Ch emistry, 1996, 44(8): 2336-2340. DOI:10.1021/jf950360j.
[5] GUEGUEN Y, CHEMARDIN P, PIEN S, et al. Enhancement of aromatic quality of Muscat wine by the use of immobilized betaglucosidase[J]. Journal of Biotechnology, 1997, 55(3): 151-156. DOI:10.1016/S0168-1656(97)00069-2.
[6] PARK S K, NOBLE A C. Monoterpenes and monoterpene glycosides in wine aromas[J]. ACS Symposium Series, 1993, 536: 98-109. DOI:10.1021/bk-1993-0536.ch 006.
[7] SARRY J E, GÜNATA Z. Plant and microbial glycoside hydrolases: volatile release from glycosidic aroma precursors[J]. Food Chemistry, 2004, 87(4): 509-521. DOI:10.1016/j.foodchem.2004.01.003.
[8] MESAS J M, RODRÍGUEZ M C, ALEGRE M T. Basic characterization and partial purification of beta-glucosidase from cell-free extracts of Oenococcus oeni ST81[J]. Letters in Applied Microbiology, 2012, 55(3): 247-255. DOI:10.1111/j.1472-765X.2012.03285.x.Epub 2012 Jul 24.
[9] MICHLMAYR H, SCHUMANN C, WURBS P, et al. A betaglucosidase from Oenococcus oeni ATCC BAA-1163 with potential for aroma release in wine: cloning and expression in E. coli[J]. World Journal of Microbiology and Biotechnology, 2010, 26(7): 1281-1289. DOI:10.1007/s11274-009-0299-5.
[10] MTSHALI P S, DIVOL B, van RENSBURG P, et al. Genetic screening of wine-related enzymes in Lactobacillus species isolated from South African wines[J]. Journal of Applied Microbiology, 2010, 108(4): 1389-1397. DOI:10.1111/j.1365-2672.2009.04535.x.Epub2009Aug 22.
[11] UGLIANO M, GENOVESE A, MOIO L. Hydrolysis of wine aroma precursors during malolactic fermentation with four commercial starter cultures of Oenococcus oeni[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5073-5078. DOI:10.1021/jf0342019.
[12] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of β-glucosidase activity in selected wild strains of Oenococcus oeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34(3/4): 292-296. DOI:10.1016/j.enzmictec.2003.11.013.
[13] MCMAHON H, ZOECKLEIN B W, FUGELSANG K, et al. Quantification of glycosidase activities in selected yeasts and lactic acid bacteria[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 23(3): 198-203. DOI:10.1038/sj.jim.2900720.
[14] SPANO G, RINALDI A, UGLIANO M, et al. A beta-glucosidase gene isolated from wine Lactobacillus plantarum is regulated by abiotic stresses[J]. Journal of Applied Microbiology, 2005, 98(4): 855-861.
[15] JIN G, WANG H, ZHANG C H, et al. Characterization and amino acid metabolism performances of indigenous Oenococcus oeni isolated from Chinese wines[J]. European Food Research and Technology, 2014, 238(4): 597-605. DOI:10.1007/s00217-013-2112-9.
[16] 杨芮, 吕珍, 文彦, 等. 酒类酒球菌中β-葡萄糖苷酶性质研究[J]. 食品科学, 2013, 34(23): 206-211. DOI:10.7506/ spkxl1002-6630-201323043.
[17] 孟佑婷, 刘桂君, 杨素玲, 等. 离子注入诱变改良农业微生物的研究进展及应用前景[J]. 安徽农业科学, 2012, 40(19): 9992-9993; 10014. DOI:10.3969/j.issn.0517-6611.2012.19.009.
[18] 李亚辉, 董梅, 崔禾苗, 等. 酒酒球菌SD-2a的β-D-葡萄糖苷酶活性研究[J]. 食品科技, 2013, 38(8): 48-52.
[19] PIMENTEL M S, SILVA M H, CORTES I, et al. Growth and metabolism of sugar and acids of Leuconostoc oenos under different conditions of temperature and pH[J]. Journal of Applied Microbiology, 1994, 76(1): 42-48. DOI:10.1111/j.1365-2672.1994.tb04413.x.
[20] VERSARI A, PARPINELLO G P, CATTANEO M. Leuconostoc oenos and malolactic fermentation in wine: a review[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 23(6): 447-455. DOI:10.1038/ sj.jim.2900733.
[21] CARRASCOSA A V, MUÑOZ R, GONZALEZ R, et al. Molecular wine microbiology[M]. San Diego: Academic Press, 2011: 191-226. DOI:10.1016/B978-0-12-375021-1.10018-9.
[22] TOURDOT-MARÉCHAL R, FORTIER L C, GUZZO J, et al. Acid sensitivity of neomycin-resistant mutants of Oenococcus oeni: a relationship between reduction of ATPase activity and lack of malolactic activity[J]. FEMS Microbiology Letters, 1999, 178(2): 319-326. DOI:10.1016/S0378-1097(99)00377-8.
[23] GUZZO J, COUCHENEY F, PIERRE F, et al. Acidophilic behaviour of the malolactic bacterium Oenococcus oeni[J]. Sciences des Aliments, 2002, 22(1/2): 107-111. DOI:10.3166/sda.22.107-111.
[24] GUZZO J, DELMAS F, PIERRE F, et al. A small heat shock protein from Leuconostoc oenos induced by multiple stresses and during stationary growth phase[J]. Letters in Applied Microbiology, 1997, 24(5): 393-396. DOI:10.1046/j.1472-765X.1997.00042.x.
[25] GUZZO J, JOBIN M P, DELMAS F, et al. Regulation of stress response in Oenococcus oeni as a function of environmental changes and growth phase[J]. International Journal of Food Microbiology, 2000, 55(1/2/3): 27-31. DOI:10.1016/S0168-1605(00)00209-9.
Correlation between β-Glycosidase Activity and Acid Stress Tolerance in Oenococcus oeni
CHEN Qiling
1, REN Xiaoning
1, WANG Ling
1, TIAN Yu
1, ZHAO Meijing
1, SONG Qiaozhi
1, LIU Shuwen
1,2,3,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China; 3. Heyang Experimental Demonstration Station, Northwest A&F University, Yangling 715300, China)
Abstract:Objective: β-Glycosidase plays a crucial role in the hydrolysis of aglycones and subsequent release of grapederived aroma compounds in wine. However, β-glycosidase activity is inf uenced by many factors. This study was designed taking into account the acid tolerance of Oenococcus oeni to assess and correlate their glucosidase activities with acid stress tolerance. Methods: The cells of O. oeni were implanted with N +ion to obtain acid-tolerant (pH 3.0) and acid-sensitive (pH 9.0) mutants. Besides, β-glycosidase activities of all the tested strains were determined. Three groups of variant O. oeni were selected and their β-glycosidase genes were sequenced. Results: The acid-tolerant mutants harbored a signif cantly increased β-glucosidase activity that was 2-4 times higher than that of the original strains, and 2-7 times higher than that of the corresponding acid-sensitive mutants. Sequencing results of eight representative amplicons indicated that all the mutants and their parental strains were identical to each other, except a3 mutant, which formed two base transversions at 108 gene locus (G→C) and at 1 232 locus (A→T). Conclusion: Correlation analysis indicated that O. oeni β-glycosidase activity was signif cantly positively related to acid stress resistance (P < 0.05).
Key words:Oenococcus oeni; ion implantation; acid tolerance; β-glucosidase; correlation analysis
DOI:10.7506/spkx1002-6630-201702019
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2017)02-0115-06
引文格式:
陈其玲, 任晓宁, 王玲, 等. 酒酒球菌β-葡萄糖苷酶活性与耐酸胁迫能力的相关性分析[J]. 食品科学, 2017, 38(2): 115-120. DOI:10.7506/spkx1002-6630-201702019. http://www.spkx.net.cn
CHEN Qiling, REN Xiaoning, WANG Ling, et al. Correlation between β-glycosidase activity and acid stress tolerance in Oenococcus oeni[J]. Food Science, 2017, 38(2): 115-120. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702019. http://www.spkx.net.cn
收稿日期:2016-03-11
作者简介:陈其玲(1991—),女,硕士研究生,研究方向为酿酒微生物。E-mail:fjgcql@sina.com
*通信作者:刘树文(1965—),男,教授,博士,研究方向为酿酒微生物。E-mail:liushuwen@nwsuaf.edu.cn