倪逸群,吴 娜,王锡昌*
(上海海洋大学食品学院,上海 201306)
摘 要:研究中华绒螯蟹在蒸制过程中脂质及其脂肪酸组成变化与挥发性化合物形成之间的关系。采用顶空固相微萃取结合气相色谱-质谱联用法测定挥发性化合物。使用固相萃取法分离总脂,并对极性脂和中性脂中的脂肪酸进行气相色谱分析。结果显示:去除总脂对于中华绒螯蟹挥发性物质气味轮廓有显著影响,特别是醛类物质(己醛、庚醛、(E)-2-辛烯醛、(E,Z)-2,6-壬二烯醛、(Z)-2-癸烯醛、十一醛、十五醛)和酮类物质(2-壬酮)。在蒸制过程中,中性脂含量上升极性脂含量下降,而总脂含量变化不显著。进一步分析表明极性脂在蒸制过程中的饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量有所降低。并且极性脂中减少的不饱和脂肪酸,特别是C 18:1n-9c、C 20:1n-9、C 20:4n-6和C 22:6n-3与总脂中的脂肪酸有相同变化趋势。研究表明,这些极性脂中的脂肪酸可能是在蒸制过程中,通过热氧化降解形成的醛类和酮类的风味前体物质。
关键词:中华绒螯蟹;挥发性化合物;脂质提取;固相萃取;脂肪酸
中华绒螯蟹(Eriocheir sinensis)俗称大闸蟹,简称河蟹,是我国重要的水产养殖品种之一,具有重要的经济价值、营养价值和食用价值 [1]。河蟹的市场需求巨大,据统计2014年我国成蟹养殖产量高达79.65万 t,与2013年相比,涨幅为9.14% [2]。香气是影响水产品特征和品质的重要原因之一。蟹的香气物质主要是通过酶解反应、脂质自动氧化、微生物活动及热降解而产生的 [3]。在前期研究中利用气相色谱-质谱-嗅辨(gas chromatographymass spectrometry-olfactometry,GC-MS-O)联用仪已经确定了蒸制过后中华绒螯蟹体内的关键性气味物质,结果显示,醛类、酮类和醇类物质是对整体香气贡献最大的关键香气物质 [4],这些挥发性化合物主要是从美拉德反应和脂质降解而来的。
对于挥发性化合物形成机制的研究主要集中在美拉德反应上。鲜有文章明确香气化合物是由加热过程中的脂质氧化和热降解而形成的。Smith等 [5]对牛肉肌肉的总脂内进行脂肪酸组成的分析,发现在烹饪过程中脂肪酸组成变化不显著。Sweeten [6]和Duckett [7]等进行了进一步研究,表明中性脂和极性脂有不同的脂肪酸组成,其中多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)主要集中在极性脂上。Zhou等 [8]对分布在甘油三酯和卵磷脂内的油酸和亚油酸在加热过程中的氧化稳定性进行研究,发现磷脂酰胆碱比甘油三酯对热氧化具有更高的稳定性,这意味着磷脂中的极性基团可能会影响甘油链脂质的氧化稳定性。
固相萃取(solid phase extraction,SPE)法是一种柱色谱技术,又称柱层析法,与高效液相色谱的分离机理以及洗脱溶剂的选择有很大的相似之处,被广泛用来进行化学分析及化合物提纯,成为了样品制备最常用的技术。由于SPE操作简单且副产物少,因此在脂质分离中被广泛运用。将总脂分离成不同组分的脂质多使用硅胶填料。Fauland等 [9]报道了利用SPE分离和鉴定复杂生物系统中的磷脂组成,并且确定了发酵物和有机污物中的7 种脂质和78 种磷脂分子种。
前人研究表明,雌雄蟹肝胰腺在基本营养成分上无显著性差异,香气物质的种类无明显区别 [10],香气品质较足肉及体肉等其他部位最高 [11],体肉、钳肉和足肉在相同条件下测得的香气物质含量远小于肝胰腺 [12],故本实验不作进一步讨论。另外,高先楚等 [13]对生、熟中华绒螯蟹肝胰腺内的挥发性物质进行了报道,指出熟样会产生更多挥发性气味物质,因此本实验旨在探究雌性中华绒螯蟹肝胰腺在蒸制过程中脂质与挥发性物质形成之间的关联,预测中华绒螯蟹在脂质降解过程中所产生的挥发性化合物前体物质。由于雌性中华绒螯蟹肝胰腺具有独特香气并且脂质含量较高,因此作为本实验原料。利用顶空固相微萃取-气相色谱-质谱(headspacesolid phase micro extraction-gas chromatography mass spectrometry,HS-SPME-GC-MS)联用法测定挥发性化合物。使用SPE法分离总脂,并对极性脂和中性脂中的脂肪酸进行GC分析,以期为蟹类及其他相似水产品的挥发性化合物形成机制提供理论依据。
1.1 材料与试剂
中华绒螯蟹:雌性活蟹60 只(约为150 g/只),2014年9月购于苏州市阳澄湖某中华绒螯蟹养殖基地。
甲醇、三氯甲烷、二氯甲烷、氢氧化钠、氯化钠(均为分析纯) 国药集团化学试剂有限公司;正己烷(色谱纯)、37 种脂肪酸甲酯混标 上海安谱科学仪器有限公司;14% BF 3-CH 3OH溶液 美国Supelco公司。
1.2 仪器与设备
6890 GC(配质量选择检测器)、硅胶柱(MEGA BE-SI,10 g填料,60 mL) 美国安捷伦仪器公司;TRACE GC ULTRA GC-MS仪(氢火焰离子检测器)美国Thermo Fisher公司;Shimadzu AUY220型电子天平、15 mL棕色顶空萃取瓶 上海安谱科学仪器有限公司;SENCO GG17型旋转蒸发仪 上海申生科技有限公司;DZKW-4电子恒温水浴锅 北京中兴伟业仪器有限公司;65 μm碳分子筛/聚二甲基硅氧烷(carboxen/ polydimethylsiloxane,CAR/PDMS)萃取头 美国Supelco公司。
1.3 方法
1.3.1 样品处理
活蟹捕捞后立即用棉线扎紧,置于底部铺冰的泡沫箱内,迅速运回实验室。从中随机选取30 只用来进行气味物质分析,另外30 只则进行不同脂质的脂肪酸分析。在低温环境中快速手工剥离肝胰腺,均质后尽快进行气味及脂肪酸组成分析。
1.3.2 SPME法测定挥发性化合物
取雌性中华绒螯蟹肝胰腺3 g,用氯仿-甲醇(2∶1,V/V)溶液浸泡24 h以进行去脂,将去脂后的剩余物置于真空干燥箱内过夜去除有机溶剂,在去脂样品中加入蒸馏水复溶至3 g,置于4 ℃条件下保持12 h确保水分完全渗入去脂样品内。使用前将新鲜样品与去脂样品放在20 mL玻璃瓶内沸水浴30 min待用。
SPME萃取方法参照Gu Saiqi等 [14]的基础上略有改动,即萃取温度为正常大气压条件下50 ℃,萃取时间30 min。
1.3.3 GC-MS分析条件
弹性毛细管柱DB-5MS(60 m×0.32 mm,1 μm);载气为氦气,流速1 mL/min;升温程序:起始柱温40 ℃,不保持;以4 ℃/min升至100 ℃,保持1 min;再以8 ℃/min升至180 ℃,不保持;最后以14 ℃/min升至250 ℃,保持5 min;采用不分流模式;溶剂延迟时间为3 min。MS界面温度250 ℃;离子源温度230 ℃。
挥发性化合物采用内标法进行定量,在进行SPME萃取前在每3 g样品中加入2 μL三甲基吡啶(trim ethyl pyridine,TMP)(1×102 mg/L) [4]。挥发性化合物含量按公式(1)计算:
式中:C为挥发性化合物含量/(ng/g);A为挥发性化合物与内标物TMP的峰面积之比;2为加入的内标物TMP质量/μg;3为样品质量/g。
1.3.4 总脂的萃取
中华绒螯蟹雌蟹肝胰腺的新鲜样品被分为生样和熟样2 部分。生样可立即进行脂质分析,而熟样需经过沸水浴30 min后进行分析。
提取总脂参照Folch等 [15]的方法,提取物在40 ℃条件下旋蒸后置于真空干燥箱中过夜,去除有机溶剂后称质量。
每个样品进行3 次平行实验,以
 ±s(n=3)表示。1.3.5 SPE法分离中性脂和极性脂
±s(n=3)表示。1.3.5 SPE法分离中性脂和极性脂
提取出总脂后,利用SPE法分离出极性脂与中性脂。实验参照Caboni等 [16]的方法,并根据具体实验进行适当修改。利用100 mL二氯甲烷进行SPE柱活化,以排出空气。将100 mg脂质样品溶解在1 mL二氯甲烷内,随后点样于活化完成的硅胶柱内。用400 mL二氯甲烷洗脱得到中性脂;同样,用600 mL甲醇洗脱得到极性脂。随后用40 ℃旋蒸得到脂质并称质量,脂质含量,以干质量计,用g/100 g表示。
1.3.6 脂肪酸甲酯的定量
脂肪酸甲酯化方法参考三氟化硼甲醇法。首先将样品脂质(约400 mg总脂、320 mg中性脂、80 mg极性脂)置于烧瓶中,用5 mL 0.5 mol/L氢氧化钠-甲醇溶液溶解,烧瓶连接冷凝管后放入沸水中水浴5 min,加入3 mL三氟化硼-甲醇溶液,继续水浴5 min,最后加入2 mL正己烷溶液,回流提取2 min,最后冷却至室温,加入5 mL饱和氯化钠溶液,待溶液分层后取上清液,过有机相滤膜注射入气相瓶中以备分析。
利用安捷伦6890 GC仪配备火焰离子化检测器进行脂肪酸甲酯的测定。选用SP-2560毛细管柱(100 m×0.25 mm,0.2 μm),进样量1 μL,分流比45∶1,载气为He,流速1mL/min。升温程序:起始柱温70 ℃,以50 ℃ /min升至140 ℃,保持1 min;再以4 ℃/min升至180 ℃,保持1 min,最后以3 ℃/min升至225 ℃,保持30 min。
脂肪酸甲酯通过与37 种脂肪酸标准品对照进行定性。37 种脂肪酸甲酯标准品为C
4:0、C
6:0、C
8:0、C
10:0、 C
11:0、C
12:0、C
13:0、C
14:0、C
14:1、C
15:0、C
16:0、C
16:1、C
17:0、
![]()
![]()
![]() C
24:1n-9和C
22:6n-3。脂肪酸定量采用十九烷酸作为内标进行定量。脂肪酸含量按公式(2)计算:
C
24:1n-9和C
22:6n-3。脂肪酸定量采用十九烷酸作为内标进行定量。脂肪酸含量按公式(2)计算:
式中:X i为样品中脂肪酸i的含量/(mg/100 g);F i为脂肪酸甲酯i的响应因子;A i为样品中脂肪酸甲酯i的峰面积;A C19:0为样品中加入的内标物(十九烷酸甲酯)的峰面积;C C19:0为C 19:0的质量浓度/(mg/mL);V C19:0为样品中加入的内标物十九烷酸的体积/mL;1.047为十九烷酸转化为十九烷酸甲酯的转换系数;m为样品质量/g;F FAMEi-FAi为脂肪酸甲酯转换成脂肪酸的转换系数。
总脂、中性脂和极性脂中的脂肪酸组成以mg/100 g干基表示,每次实验3 次平行。
1.4 数据分析
使用SPSS 20.0软件进行数据处理。新鲜样品与去脂样品之间挥发性化合物含量的差异,以及生样和熟样内脂肪酸含量比较均使用t检验进行分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 中华绒螯蟹去脂前后挥发性化合物变化
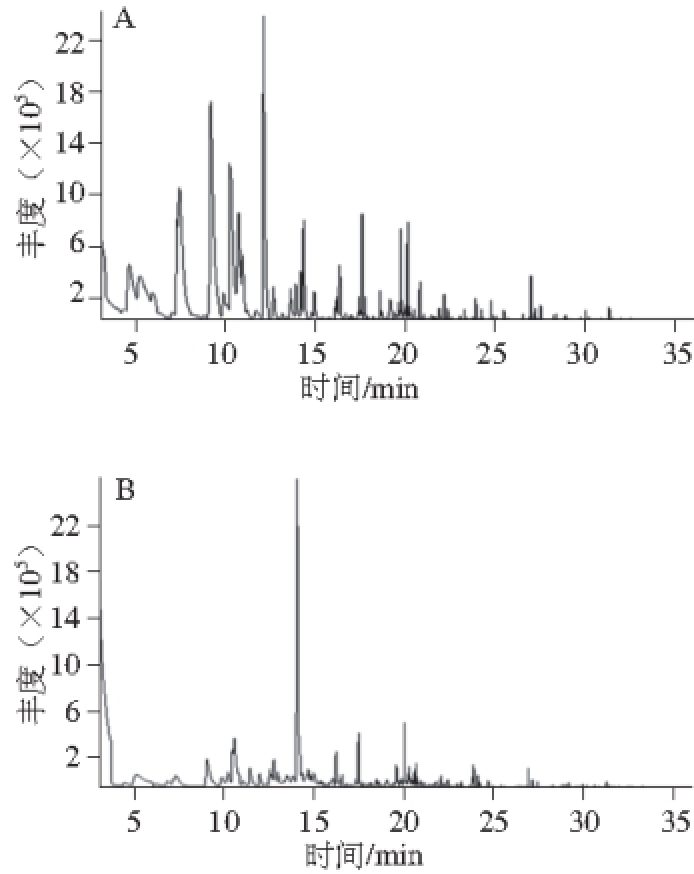
图1 中华绒螯蟹去脂前(A)和后(B)挥发性化合物总离子色谱图
Fig. 1 Total ion chromatograms (TIC) of volatile compounds in E. sinensis before (A) and after (B) removal of lipids
如图1可知,在去脂前后挥发性化合物有相当大的变化。雌蟹中主要的挥发性化合物如表1所示,可见去脂后醛类物质含量明显下降,而烃类物质则呈相反趋势。
表1 雌性中华绒螯蟹肝胰腺内挥发性化合物含量(n=3)
Table1 Estimated concentrations of volatile compounds identified in hepatopancreas of female E. sinennssiiss (n=3)

注:*.差异显著(P<0.05);**.差异极显著(P<0.01);ND.未检出。下同。
序号化合物含量/(ng/g)显著性去脂前去脂后醛类(11 种)1己醛35.63±0.970.61±0.00** 3庚醛92.92±0.5224.99±0.14** 4苯甲醛105.17±0.22235.33±0.58** 8苯乙醛72.33±0.2451.63±4.25** 9(E)-2-辛烯醛6.50±0.02ND 14壬醛16.73±0.0390.27±0.21** 15(E,Z)-2,6-壬二烯醛1.77±0.00ND 17癸醛2.20±0.0011.86±0.06** 18(Z)-2-癸烯醛7.77±0.06ND 20十一醛0.69±0.00ND 26十五醛0.27±0.00ND酮类(2 种)10乙酰苯ND115.99±0.84 112-壬酮6.71±0.07ND烃类(12 种)2对二甲苯ND13.50±0.02 6癸烷ND 7 D-柠檬烯ND 13十一烷7.43±0.07 16十二烷10.03±0.00 19十三烷6.91±0.09 21十四烷1.68±0.01 222,6,10-三甲基十二烷0.56±0.01 232,6,10-三甲基十四烷ND 24十五烷1.29±0.00 25 2,6,10,14-四甲基十五烷2.96±0.03 27十九烷0.56±0.00其他(2 种)52-正戊基呋喃ND 128.54±0.56 100.39±0.75 48.61±0.02** 66.33±0.25** 82.47±0.23** 12.82±0.03** 5.36±0.00** 40.75±0.52 10.11±0.03** 17.80±0.24** 11.70±0.38** 23.13±0.21 122-乙酰基噻唑ND29.98±0.29
在所有挥发性化合物中,8 种醛类和1 种酮类物质在去脂后变化显著,其中包括己醛、庚醛、苯乙醛、(E)-2-辛烯醛、(E,Z)-2,6-壬二烯醛、(Z)-2-癸烯醛、十一醛、十五醛和2-壬酮。一般简单醛类(例如己醛、庚醛、十一醛和十五醛)是脂质热氧化降解的产物。己醛是由n-6系列PUFA氧化产生的,被视为海产品降解的标志 [17]。庚醛、十一醛和十五醛可能是油酸和亚油酸在自动氧化过程中产生的挥发性成分 [18]。2-烯基类物质(如(E)-2-辛烯醛、(Z)-2-癸烯醛)是脂肪酸的热降解产物,如油酸等,同时,这类物质也能从花生四烯酸和亚油酸等n-6 PUFA中产生 [19]。酮类物质(如2-壬酮)可能是由脂质热氧化与美拉德反应产生的 [20]。 C 3~C 17的甲基酮如乙酰苯,是碳链烃β-氧化及脱羧基作用后生成的,具有独特的清香和果香 [21]。
另一方面,与醛酮类物质不同的是,烃类与其他物质的含量在去脂后均增加。烃类化合物大体上可分为2 类:烷烃类和芳香烃类,其来源比较复杂,部分有香味的烃可能来自于脂质热降解产物,也可能由烷基自由基的脂质氧化或类胡萝卜素的分解过程生成 [22]。烷烃类物质通常具有较高的阈值,对蟹类等水产品的总体风味贡献不大,但一些含苯环的芳香烃类化合物往往阈值较低,可对样本总体风味造成一定的影响。如柠檬烯具有令人愉快的、新鲜的橙甜味,一般认为是由蟹自身摄食的饵料所造成的 [23]。2-正戊基呋喃主要由十八碳二烯酸氢过氧化物及二十碳四烯酸氢过氧化物氧化产生 [24]。
肝胰腺内含有40%水分、40%脂质和仅8%的蛋白质,因此蛋白质可能被脂质所覆盖,这意味着雌蟹肝胰腺中的脂-水相可能会阻止像蛋白质和碳水化合物这种前体物质的反应。
为了探明挥发性化合物和脂质在雌蟹肝胰腺中的关系,因此需要进行中华绒螯蟹在蒸制过程中脂质含量的变化实验。
2.2 中华绒螯蟹在蒸制过程中脂肪含量的变化
使用Folch等 [15]的方法从雌性中华绒螯蟹肝胰腺中提取总脂后,分别用二氯甲烷和甲醇对中性脂和极性脂进行SPE洗脱。总脂、中性脂和极性脂在雌蟹蒸制前后的含量变化如表2所示。
表2 雌性中华绒螯蟹肝胰腺内脂肪含量(n==33)
Table2 Lipid composition in hepatopancreas of femalesis (nn == 33)) g/100 g
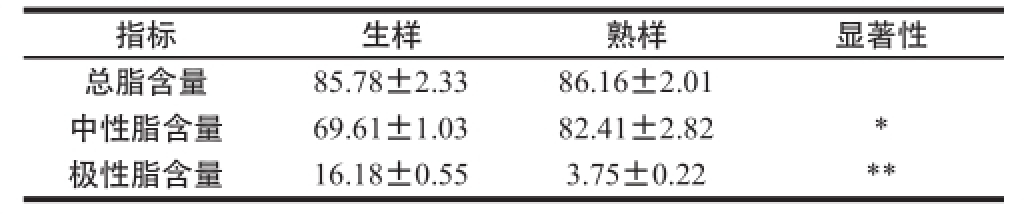
指标生样熟样显著性总脂含量85.78±2.3386.16±2.01中性脂含量69.61±1.0382.41±2.82*极性脂含量16.18±0.553.75±0.22**
2.3 总脂、中性脂及极性脂中脂肪酸组成
蒸制过程中3 类脂质的脂肪酸组成情况如表3所示。在中性脂中,C 16:0、C 18:0、C 21:0、C 16:1和C 20:1n-9含量在蒸制后急剧上升(P<0.01),而C 14:0和C 14:1含量急剧下降(P<0.01),这导致总饱和脂肪酸(saturated fatty acids,SFA)和单不饱和脂肪酸(monounsaturated fatty acids,MUFA)的含量也显著上升(P<0.01)。相反,总PUFA含量在蒸制后显著下降(P<0.01),这主要是由于C18:2n-6c、C18:3n-6、C18:3n-3、C20:2n-6和C20:3n-6的含量下降明显。总体来说,加热导致总PUFA含量减少,而总SFA含量和MUFA含量上升。因此说明蒸制期间存在不饱和脂肪酸(unsaturated fatty acids,UFA)和SFA之间的转化。总的来说,中性脂中的脂肪酸含量在蒸制后有上升趋势,这与表2中中性脂在蒸制后含量上升的趋势一致。
表3 雌性中华绒螯蟹肝胰腺内总脂、中性脂和极性脂的脂肪酸组成(n==33)
Table3 Fatty acid composition of neutral, polar and total lipids in hepatopancreas of female E. sinennssiiss ((n == 33)) mg/100 g

总脂含量显著性生样熟样生样熟样生样熟样C 10:04.30±0.112.79±0.54*0.14±0.010.23±0.00**4.92±0.122.46±0.08** C 11:02.15±0.071.41±0.08**NDND2.09±0.051.60±0.07** C 12:031.39±1.1025.94±0.86*NDND32.90±0.91 21.84±0.49** C 13:014.12±0.6112.46±0.54*NDND14.78±0.3610.82±0.37** C 14:0777.02±10.23724.56±9.77**7.90±0.215.39±0.11**775.54±1.06738.66±1.68** C 15:019.97±0.8848.93±0.51**8.14±0.232.32±0.07**47.82±0.9629.48±0.81** C 16:07 577.30±8.439 514.52±6.54**7.04±0.317.60±0.258 518.18±3.458 354.56±3.17** C 17:097.06±0.6594.74±0.61**16.31±0.364.20±0.17**122.94±3.2295.80±1.95** C 18:0916.16±5.631 200.24±7.51**69.90±2.0641.25±3.01947.14±6.181 488.32±9.98** C 20:091.84±1.2288.62±0.65**3.52±0.15ND109.64±2.7193.00±2.91* C 21:033.07±2.21200.21±7.63**0.82±0.020.92±0.0460.56±1.2221.08±0.29** C 22:0107.77±2.516.72±0.27**0.52±0.010.52±0.02133.98±4.194.10±0.16** C 24:068.57±3.5667.71±1.20NDND73.64±0.5876.26±2.36∑SFA9 740.71±40.28 11 988.26±32.17**114.49±3.3699.92±3.67*10 844.12±25.01 10 927.44±24.32 C 14:1214.23±2.58176.41±1.71**3.02±0.073.08±0.13288.68±8.03197.60±3.57** C 15:116.72±1.4525.69±1.09**25.74±0.0518.30±0.01**21.06±0.8116.24±0.38** C 16:12 886.70±47.693 774.90±22.14**52.56±0.4542.15±0.76**3 506.98±87.88 3 679.96±65.54 C 17:1n-77.15±0.784.03±0.01**0.29±0.015.16±0.12**10.60±0.438.26±0.36* C 18:1n-9t4.58±0.510.59±0.02**6.57±0.167.76±0.14*137.86±6.1071.62±1.18** C 18:1n-9cNDND281.62±2.28260.82±1.51**1 455.36±2.27544.56±1.86** C 20:1n-9623.79±2.95677.52±0.97**13.38±0.592.76±0.05**780.16±4.55654.58±5.94** C 22:1n-936.41±2.6240.59±0.330.52±0.02ND44.68±0.8938.74±0.93* C 24:1n-928.39±1.3529.52±0.53NDND34.56±1.2329.04±1.10*∑MUFA 3 818.25±63.534 728.28±26.80**379.92±3.63339.98±2.72**6 279.94±112.19 5 240.60±80.86** C 18:2n-6t1.19±0.150.72±0.07NDND3.24±0.602.42±0.08 C 18:2n-6c5 066.10±34.214 667.1±3.27**151.56±0.39140.78±0.32**8 602.56±39.11 9 201.52±28.05** C 18:3n-6404.88±2.7949.48±0.81**6.38±0.186.78±0.23433.92±13.6248.78±2.02** C 18:3n-31 003.92±7.23871.66±2.90**NDND1 197.44±45.30818.84±30.40** C 20:2n-6493.12±9.51101.24±3.55**14.18±0.2821.48±0.90**775.46±28.04488.22±8.01** C 20:3n-6200.49±9.98105.66±2.14**1.75±0.052.24±0.09*268.96±10.58181.74±3.27** C 20:3n-3136.12±6.82215.92±4.29**5.78±0.226.38±0.2441.38±1.47171.28±6.07** C 20:4n-619.85±1.22ND94.94±0.0384.24±0.38**664.52±24.304.82±0.10** C 22:2n-63.28±0.992.67±0.05**0.26±0.013.32±0.06**173.58±4.033.82±0.08** C 20:5n-31 142.06±5.741 205.22±1.1596.92±0.4397.54±0.461 333.64±0.381 322.90±0.12** C 22:6n-32 029.71±3.762 123.62±4.21**74.74±0.7354.6±0.11**2 471.22±15.25 2 182.12±9.12**∑PUFA 10 500.73±76.48 9 341.38±22.44**446.34±2.32417.42±2.79**15 985.92±182.6814 426.46±87.32**脂肪酸中性脂含量显著性极性脂含量显著性
在极性脂中,C
14:0、C
15:0、C
17:0、C
20:0、C
15:1、C
16:1、
![]() 的含量随着蒸制而下降,而C
10:0与C
17:1n-7的含量上升。这些变化导致熟样中总SFA含量显著下降(P<0.05),而MUFA和PUFA含量都极显著下降(P<0.01)。结果表明极性脂中总脂肪酸的减少与蒸制过程中总体脂肪酸的损失变化相似,因此认为极性脂是肝胰腺中重要风味前体物质。
的含量随着蒸制而下降,而C
10:0与C
17:1n-7的含量上升。这些变化导致熟样中总SFA含量显著下降(P<0.05),而MUFA和PUFA含量都极显著下降(P<0.01)。结果表明极性脂中总脂肪酸的减少与蒸制过程中总体脂肪酸的损失变化相似,因此认为极性脂是肝胰腺中重要风味前体物质。
在总脂中,C 14:0、C 16:0、C 17:0、C 21:0和C 22:0的含量明显减少,但是C 18:0的含量上升极显著,因此总SFA含量在蒸制前后无显著性差异。总MUFA和总PUFA含量极显著减少,这主要是由C 14:1、C 18:1n-9t、C 18:1n-9c、C 20:1n-9、C 18:3n-3、 C 20:3n-6、C 20:4n-6、C 22:2n-6、C 22:5n-3和C 22:6n-3的含量减少所引起的。总体而言,加热减少了C 18:1n-9t、C 18:1n-9c、C 18:2n-6t、C 18:3n-6和C 18:3n-3的含量。而Smith等 [5]的研究表明牛排总脂中的脂肪酸在加热过程中无明显变化,与本实验结果相反。
综合分析可得,不同脂质组分中单个脂肪酸含量在蒸制过程中的变化不同。由于UFA多存在于极性脂内 [6-7],因此在加热过程中更容易产生脂肪酸组成及含量的变化。如表3所示,虽然中性脂在肝胰腺中为主要脂质,但是总脂中脂肪酸的变化趋势主要取决于极性脂中的脂肪酸。因此,通过对脂肪酸组成的研究表明,蒸制后样品中,中性脂含量上升而极性脂的含量下降。
2.4 脂肪酸组成与挥发性化合物的关系
脂质氧化是由于抗氧化剂、含氧量、热强度以及脂肪酸中的双键数目所影响的 [25-26]。在特定温度时,脂质会发生氧化,氢过氧化物会产生许多化合物 [27]。此前有许多脂质氧化产物形成机理的研究表明,这些化合物的形成涉及到氢过氧化物基团变成烷氧自由基以及羟基的均裂 [28]。烷氧自由基的分解是挥发性化合物形成的重要途径 [29]。
本研究表明,由于蒸制过程中,极性脂含量下降而中性脂含量有所增加,因此认为极性脂是香气所需必需脂类物质。许多研究集中在磷脂的热氧化降解产生的挥发性化合物上,Meynier等 [30]分析了猪肉和火鸡肉中的磷脂氧化产生的挥发性化合物。Lin等 [31]鉴别出鸡蛋中的磷脂在热处理时所产生的挥发性化合物。Mottram等 [32]报道了牛肉内甘油三酯和磷脂在加热过程中的香气物质,与本实验研究结果相同。Igene等 [33]研究表明由于磷脂的不饱和度较甘油三酯更高,因此磷脂氧化速度高于甘油三酯。
磷脂是极性脂中的主要组成部分,这是一种双亲脂质,包含了亲脂性和亲水性两部分。磷脂富含PUFA,特别是亚油酸、花生四烯酸及其他高不饱和脂肪酸 [34]。正如本实验研究所示C 16:1、C 18:1n-9c、C 20:1n-9、C 22:1n-9、C 20:4n-6和C 22:6n-3含量在蒸制后减少。其中C 18:1n-9c、C 20:1n-9、C 20:4n-6和C 22:6n-3含量变化趋势与总脂相同,这对于加热时的脂质热氧化具有重要的意义。
己醛、庚醛、苯乙醛、(E)-2-辛烯醛、(E,Z)-2,6-壬二烯醛、(Z)-2-癸烯醛、十一醛、十五醛和2-壬酮在去脂后含量下降,这表明脂质,特别是极性脂中的C 18:1n-9c、C 20:1n-9、C 20:4n-6和C 22:6n-3脂肪酸是这些挥发性物质的主要来源。己烷被认为是加热磷脂中的C 20:4n-6后产生的主要挥发性气味活性物质 [31]。庚醛、十一醛和十五醛可能在C 18:1n-9c自动氧化过程中形成 [18]。2-烯醛(包括(E)-2-辛烯醛、(Z)-2-癸烯醛)是脂肪酸(例如油酸、n-6 PUFA、花生四烯酸和亚油酸)氧化的产物 [35]。
利用氯仿-甲醇方法去除雌性中华绒螯蟹总脂后,挥发性化合物轮廓产生了巨大的改变,这表明脂质的存在对于肝胰腺整体香气是必要的。进一步研究表明,极性脂中的C 18:1n-9c、C 20:1n-9、C 20:4n-6和C 22:6n-3脂肪酸对挥发性化合物的形成贡献显著,例如己醛、庚醛、苯乙醛、(E)-2-辛烯醛、(E,Z)-2,6-壬二烯醛、(Z)-2-癸烯醛、十一醛、十五醛及2-壬酮。本实验通过研究极性脂中的脂肪酸在热氧化条件下的变化,对挥发性香气物质的形成机制进行初探。
参考文献:
[1] SHAO L, WANG C, HE J, et al. Meat quality of Chinese mitten crabs fattened with natural and formulated diets[J]. Journal of Aquatic Food Product Technology, 2014, 23(1): 59-72. DOI:10.1080/10498850.201 2.694583.
[2] 农业部渔业局. 2014中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2014: 30.
[3] ALASALVAR C, TAYLOR K D A, SHAHIDI F. Comparison of volatiles of cultured and wild sea bream (Sparus aurata) during storage in ice by dynamic headspace analysis/gas chromatographymass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2616-2622. DOI:10.1021/jf0483826.
[4] WU N, GU S, TAO N, et al. Characterization of important odorants in steamed male chinese mitten crab (Eriocheir sinensis) using gas chromatography-mass spectrometry-olfactometry[J]. Journal of Food Science, 2014, 79(7): C1250-C1259. DOI:10.1111/1750-3841.12511.
[5] SMITH D R, SAVELL J W, SMITH S B, et al. Fatty acid and proximate composition of raw and cooked retail cuts of beef trimmed to different external fat levels[J]. Meat Science, 1989, 26(4): 295-311. DOI:10.1016/0309-1740(89)90014-4.
[6] SWEETEN M K, CROSS H R, SMITH G C, et al. Subcellular distribution and composition of lipids in muscle and adipose tissues[J]. Journal of Food Science, 1990, 55(1): 43-45. DOI:10.1111/j.1365-2621.1990.tb06012.x.
[7] DUCKETT S K, WAGNER D G, YATES L D, et al. Effects of time on feed on beef nutrient composition[J]. Journal of Animal Science, 1993, 71(8): 2079-2088. DOI:1993.7182079x.
[8] ZHOU L, ZHAO M, BINDLER F, et al. Comparison of the volatiles formed by oxidation of phosphatidylcholine to triglyceride in model systems[J]. Journal of Agricultural and Food Chemistry, 2014, 62(33): 8295-8301. DOI:10.1021/jf501934w.
[9] FAULAND A, TR☒TZM☒LLER M, EBERL A, et al. An improved SPE method for fractionation and identification of phospholipids[J]. Journal of Separation Science, 2013, 36(4): 744-751. DOI:10.1002/ jssc.201200708.
[10] WU N, WANG X C, TAO N P, et al. Odor prof les of hepatopancreas and gonad of Eriocheir sinensis by sensory analysis, electronic nose, and GC-MS analysis[J]. Fisheries Science, 2016, 82(3): 537-547. DOI:10.1007/s12562-016-0979-7.
[11] 顾赛麒, 王锡昌, 陶宁萍, 等. 中华绒螯蟹不同部位中活性香气物质的研究[J]. 核农学报, 2013, 27(7): 975-987. DOI:10.11869/ hnxb.2013.07.0975.
[12] 王锡昌, 吴娜, 顾赛麒, 等. MMSE-GC-MS/GC-O法鉴定熟制阳澄湖大闸蟹关键嗅感物质[J]. 现代食品科技, 2014, 30(4): 245-254. DOI:10.13982/j.mfst.1673-9078.2014.04.012.
[13] 高先楚, 顾赛麒, 陶宁萍, 等. 生、熟中华绒螯蟹肝胰腺和性腺中的挥发性成分比较[J]. 食品科学, 2014, 35(18): 128-135. DOI:10.7506/ spkx1002-6630-201418026.
[14] GU S Q, WANG X C, TAO N P, et al. Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab (Eriocheir sinensis)[J]. Food Research International, 2013, 54(1): 81-92. DOI:10.1016/j.foodres.2013.05.018.
[15] FOLCH J, LEES M, SLOANE S G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[16] CABONI M F, MENOTTA S, LERCKER G. Separation and analysis of phospholipids in different foods with a light-scattering detector[J]. Journal of the American Oil Chemists’ Society, 1996, 73(11): 1561-1566. DOI:10.1007/BF02523525.
[17] PROST C, SEROT T, DEMAIMAY M. Identification of the most potent odorants in wild and farmed cooked turbot (Scophtalamus maximus L.)[J]. Journal of Agricultural and Food Chemistry, 1998, 46(8): 3214-3219. DOI:10.1021/jf980128o.
[18] SHAHIDI F, PEGG R B. Hexanal as an indicator of meat flavor deterioration[J]. Journal of Food Lipids, 1994, 1(3): 177-186. DOI:10.1111/j.1745-4522.1994.tb00245.x.
[19] HSIEH R J, KINSELLA J E. Oxidation of polyunsaturated fatty acids: mechanisms, products, and inhibition with emphasis on f sh[J]. Advances in Food and Nutrition Research, 1989, 33: 233-341. DOI:10.1016/S1043-4526(08)60129-1.
[20] SELLI S, RANNOU C, PROST C, et al. Characterization of aromaactive compounds in rainbow trout (Oncorhynchus mykiss) eliciting an off-odor[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9496-9502. DOI:10.1021/jf0619582.
[21] 张娜. 中华绒螯蟹风味物质的研究[D]. 无锡: 江南大学, 2008: 29-31. DOI:10.7666/d.y1398372.
[22] REINECCIUS G. Off-flavors in foods[J]. Critical Reviews in Food Science and Nutrition, 1991, 29(6): 381-402. DOI:10.1080/10408399109527534.
[23] 蒋根栋. 中华绒螯蟹与锯缘青蟹挥发性风味物质及相关滋味成分的研究[D]. 上海: 上海海洋大学, 2008. DOI:10.7666/d.y1575819.
[24] MEYNIER A, GENOT C, GANDEMER G. Volatile compounds of oxidized pork phospholipids[J]. Journal of the American Oil Chemists’Society, 1998, 75(1): 1-7. DOI:10.1007/s11746-998-0001-3.
[25] ORT☒Z C M L, MOYA M S P, NAVARRO V B. A rapid chromatographic method for simultaneous determination of β-sitosterol and tocopherol homologues in vegetable oils[J]. Journal of Food Composition and Analysis, 2006, 19(2): 141-149. DOI:10.1016/ j.jfca.2005.06.001.
[26] MERRILL L I, PIKE O A, OGDEN L V, et al. Oxidative stability of conventional and high-oleic vegetable oils with added antioxidants[J]. Journal of the American Oil Chemists’ Society, 2008, 85(8): 771-776. DOI:10.1007/s11746-008-1256-4.
[27] M☒RQUEZ-RUIZ G, TASIOULA-MARGARI M, DOBARGANES M C. Quantitation and distribution of altered fatty acids in frying fats[J]. Journal of the American Oil Chemists’ Society, 1995, 72(10): 1171-1176. DOI:10.1007/BF02540984.
[28] FRANKEL E N, NEFF W E, SELKE E. Analysis of autoxidized fats by gas chromatography-mass spectrometry: Ⅶ. Volatile thermal decomposition products of pure hydroperoxides from autoxidized and photosensitized oxidized methyl oleate, linoleate and linolenate[J]. Lipids, 1981, 16(5): 279-285. DOI:10.1007/BF02534950.
[29] FRANKEL E N. Lipid oxidation[J]. Progress in Lipid Research, 1980, 19(1/2): 1-22. DOI:10.1016/0163-7827(80)90006-5.
[30] MEYNIER A, GENOT C, GANDEMER G. Volatile compounds of oxidized pork phospholipids[J]. Journal of the American Oil Chemists’Society, 1998, 75(1): 1-7. DOI:10.1007/s11746-998-0001-3.
[31] LIN J, BLANK I. Odorants generated by thermally induced degradation of phospholipids[J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4364-4369. DOI:10.1021/jf034300m.
[32] MOTTRAM D S, EDWARDS R A. The role of triglycerides and phospholipids in the aroma of cooked beef[J]. Journal of the Science of Food and Agriculture, 1983, 34(5): 517-522. DOI:10.1002/ jsfa.2740340513.
[33] IGENE J O, PEARSON A M, DUGAN L R, et al. Role of triglycerides and phospholipids on development of rancidity in model meat systems during frozen storage[J]. Food Chemistry, 1980, 5(4): 263-276. DOI:10.1016/0308-8146(80)90048-5.
[34] FARMER L J, MOTTRAM D S. Interaction of lipid in the Maillard reaction between cysteine and ribose: the effect of a triglyceride and three phospholipids on the volatile products[J]. Journal of the Science of Food and Agriculture, 1990, 53(4): 505-525. DOI:10.1002/ jsfa.2740530409.
[35] VARLET V, PROST C, SEROT T. Volatile aldehydes in smoked fish: analysis methods, occurence and mechanisms of formation[J]. Food Chemistry, 2007, 105(4): 1536-1556. DOI:10.1016/ j.foodchem.2007.03.041.
Correlation between the Formation of Volatile Compounds and Lipids in Hepatopancreas of Female Chinese Mitten Crab during Cooking
NI Yiqun, WU Na, WANG Xichang*
(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Abstract:The relationship between the formation of volatile compounds and changes in the fatty acid composition of female Chinese mitten crab (Eriocheir sinensis) during cooking was investigated. The volatile compounds were detected by head-space solid phase microextraction and gas chromatography-mass spectrometry (GC-MS). The total lipids (TLs) were separated by solid phase extraction for GC analysis of the fatty acid composition of polar (PLs) and neutral (NLs) lipids. Removal of total lipids had a marked effect on the prof le of volatile compounds, especially aldehydes (hexanal, heptanal, (E)-2-octenal, (E,Z)-2,6-nonadienal, (Z)-2-decenal, undecanal, and pentadecanal) and ketone (2-nonanone). An increase in the NLs and a decrease in the PLs were observed during cooking, while the TLs did not change signif cantly. Further analysis showed reduced contents of saturated fatty acids (SFA), monounsaturated fatty acids (MUFA) and polyunsaturated fatty acids (PUFA) in the PLs during cooking. Furthermore, unsaturated fatty acids of the PLs, especially C 18:1n-9c, C 20:1n-9, C 20:4n-6and C 22:6n-3, showed the same decreasing trend as those of the TLs. The f ndings demonstrated that the fatty acids in the PLs might be the f avor precursors of the aldehydes and ketone derived from lipid thermo-oxidation and degradation during cooking.
Key words:Eriocheir sinensis; volatile compounds; lipid fractionation; solid-phase extraction (SPE); fatty acid
DOI:10.7506/spkx1002-6630-201702021
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)02-0127-06
引文格式:
倪逸群, 吴娜, 王锡昌. 雌性中华绒螯蟹蒸制过程中肝胰腺脂质与挥发性风味物质形成的关联性分析[J]. 食品科学,
2017, 38(2): 127-132.
DOI:10.7506/spkx1002-6630-201702021. http://www.spkx.net.cn
NI Yiqun, WU Na, WANG Xichang. Correlation between the formation of volatile compounds and lipids in hepatopancreas of female Chinese mitten crab during cooking[J]. Food Science, 2017, 38(2): 127-132. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201702021. http://www.spkx.net.cn
收稿日期:2016-05-16
基金项目:国家自然科学基金面上项目(31471608)
作者简介:倪逸群(1992—),女,硕士研究生,研究方向为食品香气成分评价。E-mail:qunqunnemo@163.com
*通信作者:王锡昌(1964—),男,教授,博士,研究方向为食品风味及品质评价。E-mail:xcwang@shou.edu.cn