 ±s表示。采用统计软件CAMO Unscrambler 10.3对本实验中挥发性成分进行PCA。
±s表示。采用统计软件CAMO Unscrambler 10.3对本实验中挥发性成分进行PCA。
刘云花 1,2,胡 晖 1,刘红芝 1,李 军 2,杨 颖 1,石爱民 1,刘 丽 1,王 强 1,*
(1.中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193;2.河北科技师范学院食品科技学院,河北 秦皇岛 066600)
摘 要:采用顶空固相微萃取和气相色谱-质谱联用技术对不同花生饼粕和花生壳的烘烤风味进行分析,比较不同原料的烘烤风味强弱,并对鉴定出的挥发性风味成分进行主成分分析,明确不同原料烘烤风味的主要风味物质。结果表明:从不同花生饼粕、花生壳的烘烤风味中共鉴定出119 种挥发性物质,包括醛类、酮类、烃类、吡嗪类、呋喃类、吡咯类、吡啶类、胺类和其他共9 类化合物。根据不同原料烘烤风味的总峰面积进行风味强度对比,低温饼2的烘烤风味强度最高,花生壳烘烤风味强度最弱。其中,花生饼粕中的主要风味物质为吡嗪类、吡咯类、呋喃类和吡啶类等氮氧杂环化合物,而醛类和呋喃类化合物是花生壳中主要的风味物质。通过主成分分析,2,5-二甲基吡嗪、甲基吡嗪、2-乙酰基-3-甲基吡嗪、2-乙基-3-甲基吡嗪和N-甲基吡咯等化合物是烘烤花生饼粕中的主要风味物质,2-戊基呋喃、壬醛、5-甲基呋喃醛、正己醛和癸醛等化合物是烘烤花生壳中的主要风味物质。
关键词:花生饼粕;花生壳;烘烤;风味;主成分分析
我国每年大约有330万 t的花生饼粕 [1]和300万 t的花生壳 [2]。花生饼粕是花生仁提取油脂后的副产物,营养成分丰富,其蛋白质含量约50%;花生壳中除大量粗纤维外,含有10.6%~21.2%的单糖、双糖和低聚糖 [1],这些蛋白质和糖类经水解可作为风味的前体物质,但目前大部分仍用作饲料和肥料,未能得到有效利用,附加值与利用率低 [2-4]。近年来,随着低碳、高营养以及资源综合利用的趋势,花生油的生产工艺由高温压榨型向低温压榨型转变。尽管低温压榨花生油的氧化稳定性、VE及甾醇含量均远高于高温压榨花生油,并且采用低温压榨工艺制油可以得到高附加值的副产物——低温压榨花生饼,但是低温压榨花生油风味偏弱,无法满足消费者需求。因此,通过研究花生饼粕、花生壳等花生加工副产物的烘烤风味,并与风味浓郁的高温压榨花生油中的风味物质进行对比,筛选出最佳的原料制备烘烤风味,从而应用于低温压榨花生油风味增强以及其他新型花生风味产品的开发,对于实现资源综合利用,提高花生附加值和增加经济价值有重要意义。
近40年来,大量学者对新鲜花生 [5-7]、微波/烘箱烘烤花生风味 [8-9]、贮存花生风味 [10]、花生异味(水果/发酵味) [11-13]以及不同品种花生的风味 [14-15]等方面的研究不断深入。另外,Chetschik等 [5-6]将花生直接粉碎,研究花生粉的烘烤风味,通过与新鲜花生烘烤风味对比,认为2-乙酰基-1-吡咯啉和4-羟基-2,5-二甲基-3(2H)-呋喃酮是花生粉烘烤过程中产生的主要风味物质,然而没有研究花生粉取油后形成的花生饼粕的烘烤风味。Shu等 [10]研究认为2-异丁基-3-甲氧基吡嗪、4-羟基-2,5-二甲基-3(2H)-呋喃酮和3,5-二甲基-2-乙基吡嗪等化合物是带壳新鲜花生主要的烘烤风味物质,而未区分烘烤花生和烘烤花生壳分别产生的主要风味物质。张春红等 [16]虽然对比了烘烤花生仁、花生饼粕和花生壳中的挥发性物质的种类,在烘烤花生饼粕和花生壳中则分别鉴定出41 种和34 种挥发性化合物与烘烤花生仁中的挥发性化合物是相同的,但是未对花生饼粕和花生壳通过烘烤产生的挥发性风味成分组成与含量差异进行研究。
本实验采用顶空固相微萃取-气相色谱-质谱(headspace solid phase micro-extraction and gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术对花生壳和4 种不同类别花生饼粕通过烘烤形成的挥发性风味物质进行分析,从而比较不同原料对烘烤风味物质组成与相对含量的影响;通过主成分分析(principle component analysis,PCA)明确不同花生饼粕和花生壳烘烤风味的主要挥发性成分,旨在为利用花生饼粕和花生壳通过烘烤制备烘烤花生的主要风味物质的研究提供理论依据,从而应用于低温压榨花生油风味增强以及其他新型花生风味产品的开发。
1.1 材料
花生品种为鲁花17,花生壳、低温饼1和低温饼2由长寿集团提供,高温饼1和高温粕2由金胜粮油集团提供。低温饼1和低温饼2分别是鲁花17采用低温压榨工艺压榨1次和压榨2 次形成的低温一次压榨花生饼和低温二次压榨花生饼,高温饼1是鲁花17采用高温压榨工艺压榨后形成的高温压榨花生饼,高温粕2是高温饼1经过溶剂浸出后形成的高温压榨浸出花生粕。
1.2 仪器与设备
QP2010 SE单四极杆GC-MS联用仪 日本岛津公司;6 5 μ m聚二甲基硅氧烷/二乙基苯(polydimethylsiloxane/divinylbenzene,PDMS/DVB)萃取头 美国Supelco公司;101A-2B型电热鼓风干燥箱上海实验仪器厂有限公司;YP50001电子天平 梅特勒-托利多(上海)仪器有限公司。
1.3 方法
1.3.1 基本成分测定
粗蛋白含量测定:参照GB/T 14489.2—2008《粮油检验 植物油料粗蛋白质的测定》;粗脂肪含量测定:参照GB/T 10359—2008《油料饼粕含油量的测定 第1部分:己烷(或石油醚)提取法》;水分含量测定:参照GB/T 10358—2008《油料饼粕 水分及挥发物含量的测定》;总糖和还原糖含量测定:参照3,5-二硝基水杨酸法。基本成分含量测定均为干基含量计。
1.3.2 样品处理
根据国际风味组织法规 [17],当食品原料的处理温度不超过180 ℃时,时间不超过15 min形成的风味,可以视为天然食品风味,因此本实验研究不同原料在180 ℃烘烤15 min条件下形成的风味。准确称取3.0 g原料(花生壳、花生饼粕)至20 mL顶空进样小瓶中,在电热鼓风干燥箱中烘烤。将样品置于50 ℃条件下平衡20 min后,采用65 μm PDMS/DVB萃取头 [18-19],萃取时间40 min,最后将萃取头拔出并置于250 ℃的进样口中解吸2 min,采用GC-MS联用仪进行烘烤风味分析。
1.3.3 GC-MS条件
GC条件:J&W DB-5MS石英毛细柱(30 m× 0.25 mm,0.25 μm);进样口温度250 ℃;不分流进样;载气(He)流速1.2 mL/min;压力2.4 kPa;升温程序:35 ℃保持2 min,以5 ℃/min升至85 ℃,再以3.5 ℃/min升至130 ℃,再以5 ℃/min升至190 ℃,保持2 min。
MS条件:电子电离源;电子能量70 eV;离子源温度200 ℃;传输线温度250 ℃;采用全扫描模式采集信号;质量扫描范围m/z 35~500。
1.3.4 定量计算
使用NIST 14数据库检索挥发性风味物质,并采用面积归一化法计算各个挥发性成分的相对含量。
1.4 数据处理
采用统计软件IBM SPSS Statistics 19.0进行方差分析,实验所测数据以
 ±s表示。采用统计软件CAMO Unscrambler 10.3对本实验中挥发性成分进行PCA。
±s表示。采用统计软件CAMO Unscrambler 10.3对本实验中挥发性成分进行PCA。
2.1 基本成分测定
对4 种不同的花生饼粕及花生壳的基本成分进行分析,结果如表1所示。
表1 原料基本成分
Table1 Nutrient composition of the test samples %

注:同列肩标小写字母不同表示差异显著(P<0.05)。
原料粗蛋白含量粗脂肪含量总糖含量还原糖含量水分含量低温饼155.20±0.03 b15.50±0.04 a16.63±0.05 e0.41±0.03 b7.62±0.02 a低温饼260.63±0.54 a4.15±0.03 c20.78±0.06 c0.30±0.28 c5.53±0.04 b高温饼154.08±0.10 c7.07±0.04 b21.81±0.03 b0.34±0.35 c2.83±0.04 c高温粕255.37±0.03 b0.67±0.02 d19.81±0.01 d0.27±0.21 c7.19±0.13 a花生壳6.26±0.06 d0.41±0.02 e33.48±0.04 a2.01±0.21 a5.58±0.09 b
2.2 不同花生饼粕、花生壳烘烤风味分析

图1 不同原料的GC-MS离子流图
Fig. 1 Total ion chromatograms (TIC) of the test samples by GC-MS
采用HS-SPME-GC-MS对花生壳和4 种花生饼粕的烘烤风味进行分析,如图1所示。通过谱库检索共鉴定出119 种挥发性成分,包括醛类(19 种)、酮类(13 种)、烃类(12 种)、吡嗪类(27 种)、呋喃类(15 种)、吡咯类(9 种)、吡啶类(5 种)、胺类(4 种)以及其他化合物(15 种)共9 类化合物,各化合物峰面积及相对含量如表2所示,图中的峰号与表2中化合物的峰号一致。羰基化合物主要由Strecker降解和油脂氧化、降解反应形成。其中,己醛、庚醛、壬醛、2-庚酮等化合物是油酸、亚油酸等不饱和脂肪酸氧化、降解形成,2-甲基丙醛、2-甲基丁醛、3-甲基丁醛、苯甲醛、苯乙醛等化合物则是蛋白质经高温水解形成的氨基酸参与Strecker降解的产物 [3,20-21]。
根据表2中鉴定出的119 种化合物的相对含量,得到9 大类化合物的峰面积和相对含量如表3所示。
由表3可以看出,4 种花生饼粕中醛、酮类物质的总相对含量占挥发性物质总量的9.45%~23.08%,平均相对含量为15.75%,而烘烤花生壳挥发性物质中醛、酮类物质总相对含量达45.89%,是烘烤花生壳风味物质中最重要的成分。这些羰基化合物是美拉德反应的中间体,在烘烤时间较短、温度较低时形成,之后继续与游离氨基进行反应形成吡嗪类、吡咯类等其他物质,从而导致其含量降低;另外,Strecker醛也可能最终结合在各种食品组分(如蛋白质)中,这种不可逆结合使其没有足够的蒸汽压从而挥发出来,从而导致花生饼粕中的羰基化合物含量较低 [22]。花生壳中蛋白质含量较低,水解形成的游离氨基数量较少,因此这些羰基化合物可能无法实现进一步的美拉德反应,也无法与大量蛋白质进行结合,从而使花生壳中的羰基化合物得以保持较高的含量。
烷基吡嗪最可能的形成途径是Strecker降解生成的氨基酮自身缩合,吡啶类化合物由氨基酮进一步环化、脱水形成。呋喃类化合物由Amadori化合物经1,2-烯醇化途径产生,其中2-糠醛是其他呋喃类化合物的重要前体物质之一,也是形成其他杂环化合物如噻吩和吡咯的前体物质 [23]。在4 种烘烤花生饼粕产生的挥发性物质中,吡嗪类、吡咯类、呋喃类、吡啶类等氮氧杂环化合物为主要挥发性物质。其中,吡嗪类和吡咯类物质的相对含量最高,两者总含量占挥发性物质总量的57.47%~73.43%,平均相对含量为63.78%,呋喃类化合物含量占挥发性物质总量的6.22%~10.26%,平均相对含量为8.40%,以及0.55%~2.18%的吡啶类化合物。而烘烤花生壳产生的挥发性风味物质中,呋喃类是相对含量最高的杂环化合物,占挥发性物质总量的31.63%,而吡嗪类(2.35%)、吡咯类(3.91%)化合物相对含量较低,吡啶类和胺类化合物未检出。由于呋喃类化合物在烘烤时间较短、温度较低时即可形成,且呋喃类化合物是吡咯类化合物的前体物质 [22],因此在烘烤花生壳中,呋喃类化合物保持较高的相对含量,且呋喃类化合物进一步反应生成少量的吡咯类化合物。而吡嗪类、吡啶类、胺类以及少量的咪唑、噻唑和喹唑啉等含氮化合物的形成均需要在长时、高温条件下有大量含氨基的化合物参与 [23-24],因此在花生饼粕中含量较高。
从各花生饼粕及花生壳烘烤产生的挥发性风味物质的峰面积来看,低温饼2的中鉴定出的风味物质总峰面积最高,而花生壳中风味物质峰面积最低。由表1可知,花生壳中虽然总糖含量最高,但是其蛋白质含量较低,因此花生壳烘烤产生的风味物质强度明显低于花生饼粕。高温饼1和高温粕2在前期高温炒籽的过程中产生大量挥发性风味物质,这些风味物质随着制油过程进入高温压榨花生油中,因此,采用高温压榨花生饼粕再次进行烘烤时,产生的风味物质强度低于低温压榨花生饼2。对比2 种不同油脂含量的低温压榨花生饼可以看出,油脂含量较低时,花生饼烘烤风味强度显著提高,2 种高温饼粕的烘烤风味也存在同样的趋势。一方面可能由于烘烤过程中形成的挥发性风味物质部分溶解于花生饼粕的油脂中,难以挥发出来 [20],另一方面也可能是由于大量油脂的存在阻碍了碳水化合物与蛋白质热反应产物之间的相互作用,从而影响了低温饼1中烘烤风味物质的形成 [25]。另外,Ozel等 [25]研究压榨取油对烘烤咖啡豆的风味物质影响时,发现通过低温压榨法降低油脂的咖啡豆烘烤产生的挥发性风味物质含量高于直接烘烤咖啡豆产生的风味物质,与本研究结果一致。
表2 烘烤花生饼粕、花生壳的挥发性风味成分分析
Table2 Volatile compounds identified in roasted peanut cake and peanut shell

峰号保留时间/ min化合物(×10 6)相对含量/%峰面积低温饼1低温饼2高温饼1高温粕2花生壳峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%醛类(19 种)12.152-甲基丙醛1.13±0.04 e0.65±0.02 e7.42±0.04 a2.78±0.01 a4.67±0.02 b2.74±0.01 b2.31±0.03 c1.26±0.01 c1.18±0.01 d1.06±0.01 d33.192-甲基丁醛4.07±0.052.34±0.049.18±0.023.44±0.013.61±0.012.12±0.0212.48±0.066.83±0.065.90±0.055.29±0.06 65.93正己醛0.19±0.03 e0.11±0.02 e8.14±0.02 a3.05±0.01 b2.45±0.02 c1.44±0.02 c1.01±0.04 d0.55±0.02 d6.97±0.01 b6.25±0.03 a148.93庚醛——1.03±0.04 b0.39±0.01 c0.98±0.04 b0.58±0.03 b——1.48±0.03 a1.33±0.04 a28 12.20辛醛——3.40±0.013.04±0.02 103 25.442-丁基-2-辛烯醛6.45±0.11 a3.71±0.09 a——0.22±0.01 b0.12±0.01 b——57 15.64壬醛1.90±0.05 e1.09±0.03 e4.62±0.05 b1.73±0.02 d4.17±0.04 c2.44±0.05 b3.90±0.04 d2.14±0.03 c12.41±0.11 a11.12±0.13 a66 17.662-壬醛——0.99±0.030.89±0.03 75 19.37癸醛——0.46±0.01 c0.17±0.01 c0.33±0.01 d0.19±0.01 c0.56±0.04 b0.30±0.01 b4.02±0.05 a3.60±0.06 a85 21.45癸烯醛——0.46±0.010.42±0.01 99 23.53(E,E)-2,4-癸二烯醛——0.60±0.010.54±0.02 95 23.14十一烷醛——0.12±0.01 b0.04±0.01 c0.12±0.01 b0.07±0.01 b0.06±0.01 c0.03±0.01 c0.76±0.02 a0.68±0.01 a102 25.22E-2-十一碳烯醛——0.41±0.01 b0.24±0.01 b——0.43±0.01 a0.39±0.01 a108 26.79十二烷醛——0.34±0.02 b0.13±0.01 b——0.26±0.03 c0.14±0.01 b1.06±0.02 a0.95±0.01 a91 22.582,4-十二碳二烯醛——0.96±0.020.86±0.02 79 32.63十四烷醛——0.60±0.020.54±0.02 72 18.97紫苏醛——0.97±0.020.87±0.02 22 10.88苯甲醛——1.24±0.02 b0.46±0.01 b——1.55±0.02 a0.85±0.01 a——38 13.54苯乙醛0.64±0.06 a0.37±0.03 a0.66±0.03 a0.25±0.01 a0.35±0.02 a0.21±0.01 a0.59±0.02 a0.33±0.02 a0.54±0.38 a0.48±0.37 a酮类(13 种)117.91过氧化乙酰丙酮0.61±0.05 b0.35±0.03 b0.42±0.01 bc0.16±0.01 c0.90±0.02 a0.53±0.01 a0.37±0.26 c0.20±0.14 c——127.963-氯-2-丁酮——0.66±0.010.59±0.01 20 10.753-乙基环戊酮——0.33±0.02 a0.12±0.01 a0.12±0.07 b0.07±0.05 b——138.572-庚酮0.13±0.02 e0.08±0.01 e16.62±0.07 a6.23±0.04 a0.41±0.01 d0.24±0.01 d3.72±0.05 b2.04±0.01 b0.80±0.02 c0.72±0.02 c36 13.343-辛烯-2-酮——0.94±0.01 a0.35±0.01 b——0.46±0.02 b0.41±0.01 a50 15.162-壬酮——4.79±0.02 a1.80±0.01 b——3.45±0.04 b1.89±0.02 a——18 10.383-壬烯-1-酮——0.16±0.01 b0.09±0.01 b0.31±0.02 a0.28±0.01 a70 18.80癸酮0.68±0.35 c0.39±0.02 c4.96±0.04 a1.86±0.02 a0.48±0.07 d0.28±0.04 d3.20±0.04 b1.75±0.03 b——71 18.836,10-二甲基-2-十一烷酮——1.35±0.071.21±0.07 111 27.96 6,10-二甲基-5,9-十一碳二烯-2-酮——0.06±0.04 c0.04±0.03 c0.13±0.07 b0.07±0.04 b0.25±0.13 a0.22±0.07 a61 16.472,15-十六烷二酮——0.29±0.030.26±0.02 42 14.28苯乙酮0.18±0.07 c0.10±0.01 d0.32±0.07 b0.12±0.06 c0.34±0.03 a0.20±0.02 a0.34±0.03 a0.19±0.02 b0.06±0.12 d0.05±0.06 e60 16.42苯基丙酮0.25±0.21 b0.14±0.01 b——0.53±0.11 a0.31±0.09 a——烃类(12 种)15 8.945壬烷——1.48±0.040.81±0.02——56 15.52十一烷0.12±0.07 c0.07±0.03 c0.23±0.06 a0.08±0.01 b——0.15±0.07 b0.14±0.05 a116 31.054-环己基十一烷0.14±0.21 a0.08±0.01 a0.13±0.17 a0.05±0.26 a——0.40±0.09 a0.22±0.01 a——74 19.18十二烷——0.22±0.08 d0.08±0.06 d0.51±0.09 b0.30±0.06 c1.26±0.04 a0.69±0.01 a0.47±0.05 c0.42±0.03 b104 25.634,6-二甲基十二烷0.14±0.02 a0.08±0.01 a0.15±0.01 a0.06±0.01 b0.11±0.01 b0.07±0.01 b——0.09±0.00 b0.08±0.00 a105 25.642,6,10-三甲基十二烷——0.50±0.01 a0.29±0.01 a0.10±0.01 b0.06±0.01 b——94 22.90十三烷——0.46±0.01 b0.17±0.01 c0.46±0.01 b0.27±0.01 b0.63±0.02 a0.35±0.01 a0.39±0.04 c0.35±0.03 a113 28.402,6,10-三甲基十三烷0.50±0.08 a0.29±0.01 b——0.13±0.12 d0.08±0.06 c0.17±0.09 c0.09±0.06 c0.40±0.08 b0.35±0.06 a107 26.241-十三烯——0.21±0.14 b0.11±0.08 b0.51±0.05 a0.46±0.01 a114 28.354-甲基十四烷0.13±0.03 b0.08±0.01 b——0.06±0.21 c0.03±0.14 c0.64±0.01 a0.57±0.01 a106 26.50十四烯——0.50±0.01 c0.19±0.05 c——0.57±0.00 b0.31±0.00 b0.96±0.01 a0.86±0.01 a115 29.391-十五碳烯0.73±0.04 c0.42±0.03 c——0.47±0.05 d0.28±0.04 d1.52±0.03 b0.83±0.02 b4.03±0.07 a3.61±0.08 a吡嗪类(27 种)86.56甲基吡嗪17.88±0.66 a10.28±0.34 a16.85±0.07 a6.32±0.05 c13.50±0.06 b7.92±0.1 b2.00±0.04 c1.10±0.02 d0.18±0.00 d0.16±0.00 e179.232,5-二甲基吡嗪36.65±0.51 b21.08±0.41 a39.19±0.13 a14.68±0.08 b25.39±0.14 c14.89±0.2 b23.47±0.35 d12.85±0.25 c2.22±0.01 e1.99±0.02 d25 11.962-乙基-6-甲基吡嗪6.64±0.05 b3.82±0.01 a8.21±0.06 a3.08±0.01b c5.42±0.02 c3.18±0.04 b5.72±0.21 c3.13±0.1 c——27 12.152-乙基-3-甲基吡嗪12.66±0.15 b7.28±0.12 b20.91±0.04 a7.83±0.03 a10.30±0.06 c6.04±0.09 c9.40±0.04 d5.15±0.04 d——29 12.612-乙烯基-6-甲基吡嗪0.48±0.02 b0.28±0.01 a——0.35±0.02 a0.21±0.02 b—— ddbceeaacb
续表2

峰号保留时间/ min化合物低温饼1低温饼2高温饼1高温粕2花生壳峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/% 32 12.782-乙酰基吡嗪1.81±0.04 a1.04±0.01 a1.33±0.02 c0.50±0.01 d1.16±0.01 d0.68±0.01 c1.55±0.01 b0.85±0.01 b——45 14.613-乙基-2,5-二甲基吡嗪7.86±0.02 b4.52±0.04 a11.16±0.07 a4.18±0.02 b5.53±0.03 d3.24±0.05 d6.80±0.06 c3.72±0.05 c——46 14.822-乙基-3,5-二甲基吡嗪1.44±0.02 c0.83±0.01 b1.76±0.02 a0.66±0.01 c1.11±0.01 d0.65±0.01 c1.59±0.03 b0.87±0.01 a——47 14.935-乙基-2,3-二甲基吡嗪2.29±0.04 c1.32±0.03 a2.74±0.04 a1.02±0.02 c2.10±0.02 d1.23±0.02 b2.41±0.02 b1.32±0.01 a——51 15.252-甲基-3-丙基吡嗪0.28±0.04 b0.16±0.02 b0.72±0.01 a0.27±0.01 a——0.14±0.03 c0.08±0.02 c——52 15.292-甲基-5-丙基吡嗪——0.31±0.090.18±0.04——53 15.382-甲基-6-丙烯基吡嗪0.40±0.01 c0.23±0.01 a——0.89±0.07 a0.30±0.16 a0.58±0.04 b0.32±0.02 a——54 15.422-甲基-5-丙烯基吡嗪4.42±0.05 a2.54±0.04 a1.83±0.03 b0.68±0.01 c0.88±0.05 c0.52±0.05 d1.85±0.02 b1.01±0.02 b——55 22.132,3-二甲基-5-丙烯基吡嗪0.35±0.02 a0.20±0.02 a——0.08±0.15 c0.27±0.16 ab0.18±0.04 b0.10±0.02 ab——58 15.962-乙酰基-3-甲基吡嗪12.72±0.08 a7.32±0.09 a8.05±0.03 b3.02±0.01 d5.69±0.02 d3.34±0.01 c7.35±0.03 c4.02±0.04 b——62 16.692-异丁基-3-甲基吡嗪0.08±0.01 c0.05±0.01 c0.24±0.01 a0.09±0.01 b0.23±0.09 b0.13±0.04 a——64 17.292,3-二乙基-5-甲基吡嗪0.27±0.01 d0.16±0.01 d1.56±0.02 a0.59±0.01 a0.47±0.13 c0.28±0.07 c0.79±0.13 b0.43±0.09 b——65 17.403,5-二乙基-2-甲基吡嗪0.94±0.02 c0.54±0.01 c1.54±0.02 a0.58±0.01 b0.79±0.23 d0.46±0.01 d1.23±0.01 b0.67±0.01 a——77 19.042,5-二甲基-3-异丁基吡嗪0.34±0.020.20±0.01——78 19.442-乙酰基-3,5-二甲基吡嗪3.69±0.04 a2.13±0.01 a0.61±0.01 c0.23±0.01 c——1.63±0.03 b0.89±0.02 b——81 20.602-异戊基-6-甲基吡嗪2.28±0.02 c1.31±0.01 c4.65±0.03 a1.74±0.01 b1.94±0.01 d1.14±0.02 d3.89±0.04 b2.13±0.01 a——89 22.282-甲基-3-丙基吡嗪0.40±0.02 a0.23±0.02 a——0.20±0.14 c0.12±0.06 c0.32±0.02 b0.17±0.01 b——90 22.512-乙酰基-3,4,6-三甲基吡嗪0.78±0.020.45±0.01——97 23.32 2,6-二甲基-3-(2-甲基-1-丁基)吡嗪——0.43±0.010.24±0.01——100 24.014-甲基吡咯-[1,2-a]-吡嗪0.68±0.040.39±0.02——101 24.682,5-二甲基-3-戊基吡嗪——0.35±0.01 a0.13±0.01 a——0.11±0.01 b0.06±0.01 b——112 28.042-丁基-3,5-二甲基吡嗪——0.53±0.040.20±0.01——呋喃类(15 种)76.132-甲基四氢呋喃-3-酮0.43±0.04 c0.25±0.02 c——3.39±0.01 a1.99±0.02 a2.00±0.03 b1.10±0.02 b——96.85糠醛——7.49±0.076.71±0.09 169.212-乙酰基呋喃——0.52±0.080.47±0.06 21 10.855-甲基呋喃醛1.61±0.04 c0.93±0.03——2.84±0.02 b1.67±0.02 b——6.27±0.07 a5.62±0.06 a24 11.772-戊基呋喃1.08±0.03 d0.62±0.01 d15.65±0.07 a5.87±0.01 b7.44±0.04 c4.37±0.05 c7.61±0.04 c4.17±0.04 c14.77±0.28 b13.24±0.25 a26 12.062-戊烯基呋喃——0.09±0.030.08±0 34 13.105-甲基-2-呋喃甲醇1.08±0.03 b0.62±0.01 b——1.28±0.17 a1.15±0.01 a41 13.825-乙基二氢呋喃酮——0.96±0.020.36±0.01——44 14.63呋喃酮——0.87±0.070.78±0.05 48 14.856-戊基四氢呋喃-2-酮——0.64±0.010.57±0.01 76 19.625-甲基呋喃酮——0.31±0.020.28±0.01 79 19.993-苯基呋喃0.73±0.010.42±0.01——82 20.762,3-二氢苯并呋喃5.17±0.07 b2.97±0.06 b2.92±0.04 d1.09±0.01 d3.81±0.01 c2.23±0.03 c8.30±0.04 a4.54±0.04 a0.09±0.04 e0.08±0.02 e109 26.812-丙基呋喃0.58±0.030.33±0.02——110 26.842-呋喃甲基吡咯——0.14±0.09 b0.08±0.05 b——0.20±0.01 a0.18±0.01 a吡咯类(9 种)54.46N-甲基吡咯3.99±0.06 d2.30±0.02 d45.61±0.21 a17.09±0.12 a23.39±0.21 b13.72±0.23 b15.91±0.07 c8.72±0.01 c——107.762,5-二甲基吡咯——0.13±0.09 b0.05±0.07 b——10.01±0.19 a5.48±0.12 a——33 12.882-吡咯甲醛2.49±0.01 b1.43±0.17 b1.54±0.01 c0.58±0.01 e1.46±0.02 d0.86±0.02 d3.40±0.04 a1.86±0.03 a1.14±0.02 e1.02±0.02 c39 13.661-乙基-2-吡咯甲醛——0.20±0.12 b0.11±0.01 b0.43±0.01 a0.23±0.01 a——40 13.811-戊基吡咯——0.26±0.001 a0.14±0.01 a0.10±0.02 b0.09±0.01 b43 14.452-乙酰基吡咯0.96±0.04 b0.55±0.02 c0.28±0.06 e0.10±0.02 e0.61±0.23 d0.36±0.14 d1.48±0.01 a0.81±0.01 a0.75±0.12 c0.68±0.01 b63 16.851-甲基-2-吡咯甲醛1.99±0.041.14±0.02——67 17.861-乙酰基吡咯啉——0.84±0.050.75±0.01 68 18.321-糠基吡咯1.40±0.02 b0.81±0.02 c0.50±0.01 e0.19±0.05 e0.86±0.24 d0.51±0.14 d2.04±0.07 a1.12±0.04 a0.97±0.01 c0.87±0.01 b吡啶类(5 种)31 12.73N-乙酰基吡啶0.40±0.01 c0.23±0.01 c0.58±0.03 a0.22±0.02 d0.46±0.11 b0.27±0.07 b0.58±0.01 a0.32±0.01 a——35 13.122-乙酰基吡啶——1.22±0.010.72±0.01——37 13.352-乙酰基-1,4,5,6-四氢吡啶——0.52±0.07 a0.30±0.01 a0.42±0.01 b0.23±0.01 b——73 19.012-丙基吡啶——1.27±0.01 b0.48±0.01 b1.51±0.01 a0.89±0.01 a——83 21.091,4-二氢-4-亚氨基-1-(N-甲基乙酰氨基)吡啶1.98±0.051.14±0.02——
续表2
注:分别对同一行中化合物的峰面积和相对含量进行方差分析,同行肩标小写字母不同表示差异显著(P<0.05);—.未检出。下同。
峰号保留时间/ min化合物(×10 6)相对含量/%峰面积低温饼1低温饼2高温饼1高温粕2花生壳峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%胺类(4 种)43.65二己胺——3.79±0.032.22±0.04——84 21.352-环丙基苯胺——0.48±0.03 b0.18±0.02 b0.30±0.06 c0.18±0.00 b0.64±0.01 a0.35±0.01 a——117 31.32N,N-二甲基辛酰胺——4.85±0.022.85±0.03——118 31.55N,N-二甲基月桂酰胺——2.86±0.021.68±0.02——其他(15 种)22.70乙酸4.09±0.06 b2.35±0.05 c1.48±0.01 d0.56±0.03 e1.77±0.01 c1.04±0.01 d4.91±0.07 a2.69±0.03 b4.97±0.04 a4.46±0.03 a30 12.62己酸——5.48±0.07 a2.05±0.02 a——3.71±0.04 b2.03±0.03 a0.45±0.03 c0.41±0.01 b59 16.10四甲基苯——0.48±0.07 c0.28±0.05 c0.79±0.04 b0.43±0.02 b0.85±0.05 a0.76±0.03 a69 18.61萘——1.44±0.021.29±0.02 92 22.731-甲基萘——0.15±0.10 c0.09±0.06 b0.17±0.01 b0.09±0.01 b0.43±0.04 a0.39±0.01 a80 20.032-萘酚——0.75±0.01 a0.28±0.05 b——0.66±0.01 b0.36±0.01 a0.20±0.01 c0.18±0.01 c88 22.004-乙基-2-甲氧基苯酚0.55±0.03 a0.32±0.02 a——0.27±0.13 c0.16±0.06 c0.42±0.01 b0.23±0.01 b——98 23.404-乙烯基-2-甲氧基苯酚3.07±0.06 a1.76±0.04 a2.03±0.14 d0.76±0.05 d2.43±0.01 c1.43±0.02 c2.91±0.07 b1.60±0.04 b0.60±0.12 e0.54±0.07 e49 15.12愈创木酚1.23±0.04 b0.71±0.03 b——1.51±0.01 a0.88±0.02 a——86 21.431-醛基苯并咪唑——1.59±0.01 a0.93±0.01 a1.55±0.03 b0.85±0.01 b——87 21.404-羟基喹唑啉2.83±0.011.63±0.01——93 22.871-乙酰基-2-苯基咪唑1.49±1.050.85±0.62——19 10.622,4-二甲基-2-二氢噻唑——0.45±0.010.17±0.06——96 23.292-己基噻吩1.34±0.02 a0.77±0.02 a——0.57±0.01 b0.34±0.01 b——23 11.08二甲基三硫——0.96±0.04 a0.36±0.01 a0.40±0.01 c0.24±0.01 c0.56±0.04 b0.31±0.02 b——
表3 不同烘烤花生饼粕、花生壳中9 大类挥发物的总相对含量
Table3 Total contents of 9 classes of volatile compounds in roasted peanut cakes and peanut shell

(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%峰面积(×10 6)相对含量/%醛类(19 种)14.38±0.14 e8.37±0.07 e33.21±0.13 b12.44±0.02 c17.09±0.09 d10.03±0.13 d22.94±0.09 c12.55±0.11 b42.73±0.19 a41.80±0.10 a酮类(13 种)1.85±0.21 e1.08±0.02 e28.38±0.11 a10.64±0.07 a2.84±0.40 d1.67±0.01 d11.37±0.21 b6.23±0.09 b4.18±0.10 c4.09±0.11 c烃类(12 种)1.76±0.16 c1.02±0.04 cd1.69±0.74 c0.63±0.28 d2.18±0.20 c1.29±0.02 c6.40±0.25 b3.50±0.05 b7.64±0.09 a7.47±0.11 a吡嗪类(27 种)115.34±0.31 b67.13±0.34 a122.23±0.24 a45.80±0.02 b76.34±0.38 c44.78±0.58 b71.44±0.31 d39.11±0.34 c2.40±0.01 e2.35±0.02 d呋喃类(15 种)10.68±0.78 e6.22±0.08 e19.53±0.13 b7.32±0.03 d17.48±0.17 d10.26±0.12 b17.91±0.11 c9.81±0.10 c32.33±0.27 a31.63±0.19 a吡咯类(9 种)10.83±0.43 d6.30±0.05 d48.06±0.18 a18.01±0.11 b26.66±0.24 c15.64±0.27 c33.52±0.25 b18.36±0.21 a4.00±0.02 e3.91±0.03 e吡啶类(5 种)2.38±0.40 b1.39±0.02 b1.85±0.02 c0.70±0.00 c3.71±0.22 a2.18±0.03 a1.00±0.01 d0.55±0.00 d——胺类(4 种)——0.48±0.11 c0.18±0.00 c11.80±0.07 a6.93±0.09 a0.64±0.01 b0.35±0.00 b——其他(15 种)14.60±0.83 b8.50±0.44 b11.15±0.10 c4.18±0.05 d9.17±0.24 d5.39±0.06 c15.68±0.13 a8.59±0.04 ab8.94±0.07 d8.75±0.02 a总计171.82±0.91 c266.58±0.86 a167.27±0.93 d180.90±0.47 b102.22±0.23 e化合物低温饼1低温饼2高温饼1高温粕2花生壳峰面积
2.3 不同花生饼粕、花生壳的PCA
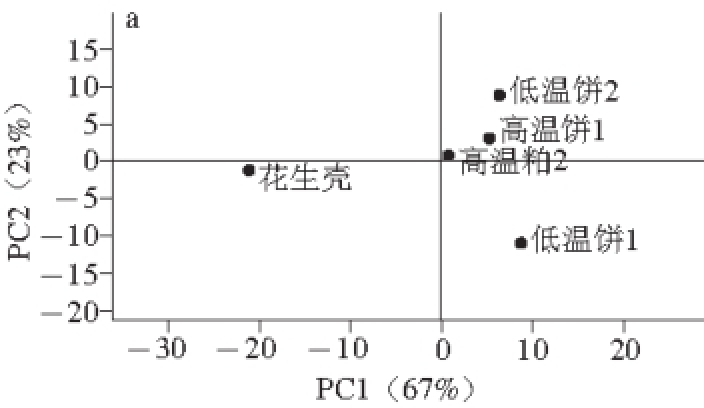

图2 不同烘烤风味的得分图(a)和化合物的载荷图(b)
Fig. 2 PCA scores (a) and PCA loadings (b) of different roasting flavors
根据GC-MS鉴定出来的119 种挥发性风味物质,对5 种不同原料烘烤风味进行PCA,如图2所示。PCA图可以对不同样品间风味物质实现多维比较,通过得分图中不同样品之间的距离判断其差异程度,根据载荷图中不同化合物与原点之间距离和方向确定其与各个主成分之间的相关性以及不同样品间该化合物相对含量的差异程度 [26]。由图2a可以看出,PC1解释所有变量方差的67%,是方差贡献率最大的主成分;PC2解释所有变量方差的23%,PC1和PC2累计解释所有变量的90%,可以表示所有样品的大部分信息。低温饼1、低温饼2、高温饼1和高温粕2均与PC1呈正相关,而花生壳与PC1呈负相关,因此通过PC1区分花生饼粕和花生壳的烘烤风味;由图1b可知2,5-二甲基吡嗪(峰17)、N-甲基吡咯(峰5)、甲基吡嗪(峰8)、2-乙基-3-甲基吡嗪(峰27)和2-乙酰基-3-甲基吡嗪(峰58)等含氮杂环化合物与PC1呈正相关,是烘烤花生饼粕中的主要风味物质;2-戊基呋喃(峰24)、壬醛(峰57)、5-甲基呋喃醛(峰21)、正己醛(峰6)和癸醛(峰75)等醛类和呋喃类化合物与PC1呈负相关,是烘烤花生壳中的主要风味物质。
由图2a可知,低温饼2、高温饼1和高温粕2均与PC2呈正相关,而花生壳和低温饼1与PC2呈负相关,通过PC2可以很好地区分不同花生饼粕之间的烘烤风味。由图2b可知,2,5-二甲基吡嗪(峰17)、2-乙酰基-3-甲基吡嗪(峰58)、甲基吡嗪(峰8)和2-甲基-5-丙烯基吡嗪(峰54)等化合物均与PC2呈负相关,是低温饼1区别于其他花生饼粕烘烤风味的主要物质;N-甲基吡咯(峰5)、2-庚酮(峰13)、2-甲基丙醛(峰1)、2-戊基呋喃(峰24)等化合物均与PC2呈正相关,且与原点距离较远,对PC2贡献较大,是低温粕2区别于其他花生饼粕烘烤风味的主要物质,另外这些物质对高温饼1的烘烤风味也有较大的影响。与低温饼1和高温饼1相比,高温粕2虽然与PC2和PC1均呈正相关,但其在PC2和PC1上的得分均较低,因此高温粕2烘烤形成吡嗪类、呋喃类等关键风味物质比低温饼2和高温饼1弱一些。
采用HS-SPME-GC-MS从不同花生饼粕、花生壳的烘烤风味中共鉴定出9大类119 种挥发性风味物质,其中4 种花生饼粕中醛类、酮类、烃类、吡嗪类、呋喃类、吡咯类、吡啶类、胺类和其他化合物的相对含量的均值分别为10.84%、4.91%、1.61%、49.21%、8.40%、14.57%、1.21%、1.87%、6.67%,花生壳中各类化合物的相对含量分别为41.80%、4.09%、7.47%、2.35%、31.63%、3.91%、未检出、未检出、8.75%。从化合物的峰面积和相对含量来看,花生饼粕中主要风味物质为吡嗪类、吡咯类、呋喃类和吡啶类等氮氧杂环化合物,而醛类和呋喃类化合物是花生壳中主要的风味物质。通过PCA,2,5-二甲基吡嗪、N-甲基吡咯、甲基吡嗪、2-乙基-3-甲基吡嗪和2-乙酰基-3-甲基吡嗪等化合物是烘烤花生饼粕中的主要风味物质,2-戊基呋喃、壬醛、5-甲基呋喃醛、正己醛和癸醛等化合物是烘烤花生壳中的主要风味物质。本研究仅对不同原料烘烤风味进行了对比分析,而花生粕烘烤风味与高温压榨花生油中的风味物质对比,以及温度和时间对花生饼粕烘烤风味的影响未做阐述,将在后续研究中进行全面分析,筛选出最佳的烘烤条件制备烘烤风味,并应用于低温压榨花生油风味增强以及其他新型花生风味产品的开发,对于实现资源综合利用,提高花生附加值和增加经济价值有重要意义。
参考文献:
[1] 王强. 花生深加工技术[M]. 北京: 科学出版社, 2014: 197-198.
[2] 王强. 花生生物活性物质概论[M]. 北京: 中国农业大学出版社, 2012: 62-80.
[3] 周瑞宝, 周兵, 姜元荣. 花生加工技术[M]. 2版. 北京: 化学工业出版社, 2012: 169-182.
[4] 王强. 花生加工品质学[M]. 北京: 中国农业大学出版社, 2013: 18-20.
[5] CHETSCHIK I, GRANVOGL M, SCHIEBERLE P. Comparison of the key aroma compounds in organically grown, raw West-African peanuts (Arachis hypogaea) and in ground, pan-roasted meal produced thereof[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10237-10243. DOI:10.1021/jf802102u.
[6] CHETSCHIK I, GRANVOGL M, SCHIEBERLE P. Quantitation of key peanut aroma compounds in raw peanuts and pan-roasted peanut meal: aroma reconstitution and comparison with commercial peanut products[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 11018-11026. DOI:10.1021/jf1026636.
[7] NG E C, CHIN E. Flavor profiles of Oklahoma-grown peanuts[D]. Stillwater: Oklahoma State University, 2003: 36-39.
[8] ALICIA L S, SHERYL A B. Color and volatile analysis of peanuts roasted using oven and microwave technologies[J]. Journal of Food Science, 2014, 79(10): 1895-1906. DOI:10.1111/1750-3841.12588.
[9] SMITH A L, PERRY J J, MARSHALL J A, et al. Oven, microwave, and combination roasting of peanuts: comparison of inactivation of salmonella, surrogate enterococcus faecium, color, volatiles, flavor, and lipid oxidation[J]. Journal of Food Science, 2014, 79(8): S1584-S1594. DOI:10.1111/1750-3841.12528.
[10] SHU K, SAKAI R, KUMAZAWA K, et al. Key aroma compounds in roasted in-shell peanuts[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(7): 1467-1473. DOI:10.1271/bbb.130112.
[11] DIDZBALIS J, RITTER K A, TRAIL A C, et al. Identification of fruity/fermented odorants in high-temperature-cured roasted peanuts[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4828-4833. DOI:10.1021/jf0355250.
[12] GREENE J L, SANDERS T H, DRAKE M A. Characterization of volatile compounds contributing to naturally occurring fruity fermented flavor in peanuts[J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 8096-8102. DOI:10.1021/jf800450k.
[13] GREENE J L, WHITAKER T B, HENDRIX K W, et al. Fruity fermented off-flavor distribution in samples from large peanut lots[J]. Journal of Sensory Studies, 2007, 22(4): 453-461. DOI:10.1016/ S0304-8853(99)00508-9.
[14] NG E C, DUNFORD N T. Flavour characteristics of peanut cultivars developed for southwestern United States[J]. International Journal of Food Science and Technology, 2009, 44(3): 603-609. DOI:10.1111/ j.1365-2621.2008.01872.x.
[15] ISLEIB T G, PATTEE H E, GORBET D W, et al. Genotypic variation in roasted peanut flavor quality across 60 years of breeding[J]. Peanut Science, 2000, 27(2): 92-98.
[16] 张春红, 王丽, 李淑荣, 等. 烘烤花生仁、花生粕和花生壳中挥发性物质的研究[J]. 食品科技, 2009, 34(1): 32-36.
[17] BOWMAN T. Analysis of factors affecting volatile compound formation in roasted pumpkin seeds with selected ion f ow tube-mass spectrometry (SIFT-MS) and sensory analysis[D]. Columbus: The Ohio State University, 2011: 36-54.
[18] 刘晓君. 炒籽对花生油风味和品质的影响[D]. 无锡: 江南大学, 2011: 25-54.
[19] 史文青. 花生及花生油挥发性气味真实性成分的鉴定[D]. 武汉:武汉工业学院, 2012: 52-61.
[20] European Parliament and of the Council. Regulation (EC). No 1334/2008 of the European Parliament and of the Council on flavourings and certain food ingredients with flavouring properties for use in and on foods[S].
[21] ZHOU Q, YANG M, HUANG F, et al. Effect of pretreatment with dehulling and microwaving on the flavor characteristics of cold-pressed rapeseed oil by GC-MS-PCA and electronic nose discrimination[J]. Journal of Food Science, 2013, 78(7): C961-C970. DOI:10.1111/1750-3841.12161.
[22] 张晓鸣. 食品风味化学[M]. 北京: 中国轻工业出版社, 2009: 166-174.
[23] 夏延斌. 食品风味化学[M]. 北京: 化学工业出版社, 2007: 89-106.
[24] 李淑荣, 王丽, 张春红, 等. 烘烤花生中关键香味化合物的研究[J]. 中国农业科学, 2010, 43(15): 3199-3203. DOI:10.3864/ j.issn.0578-1752.2010.15.018.
[25] OZEL M Z, YANIK D K, GOGUS F, et al. Effect of roasting method and oil reduction on volatiles of roasted Pistacia terebinthus, using direct thermal desorption-GC×GC-TOF/MS[J]. LWT-Food Science and Technology, 2014, 59(1): 283-288. DOI:10.1016/ j.lwt.2014.05.004.
[26] BENDINI A, BARBIERI S, VALLI E, et al. Quality evaluation of cold pressed sunflower oils by sensory and chemical analysis[J]. European Journal of Lipid Science and Technology, 2011, 113(11): 1375-1384. DOI:10.1002/ejlt.201100095.
Analysis of Volatile Compounds in Roasted Peanut Shell and Peanut Cakes by HS-SPME-GC-MS
LIU Yunhua
1,2, HU Hui
1, LIU Hongzhi
1, LI Jun
2, YANG Ying
1, SHI Aimin
1, LIU Li
1, WANG Qiang
1,*
(1. Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Institute of Agro-Products Processing Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. College of Food Science and Technology, Hebei Normal University of Science and Technology, Qinhuangdao 066600, China)
Abstract:The volatile compounds in roasted peanut shell and peanut meals were investigated using headspace solid phase micro-extraction (HS-SPME) and gas chromatography-mass spectrometry (GC-MS). Principal component analysis (PCA) was performed on the relative concentration data. The results showed that a total of 119 volatile compounds were identif ed in roasted peanut shell and peanut cakes. They were grouped into 9 categories including aldehydes, ketones, hydrocarbons, pyrazines, furans, pyrroles, pyridines, amines and other compounds. The main volatile compounds in peanut cakes were N-and O-heterocyclic compounds, including pyrazines, pyrroles, furans and pyridines while furans and aldehydes are the main volatile compounds found in peanut shells. By PCA, 2,5-dimethyl pyrazine, methyl pyrazine, 2-acetyl-3-methyl pyrazine, 2-ethyl-3-methyl-pyrazine and N-methyl pyrrole were found to be the main volatile compounds in roasted peanut cakes while 2-pentyl furan, nonanal, 5-methyl furan aldehydes, n-hexanal and decanal were the main volatile compounds in roasted peanut shell.
Key words:peanut cake; peanut shell; roasted; volatile compounds; principal component analysis
DOI:10.7506/spkx1002-6630-201702024
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)02-0146-08
引文格式:
刘云花, 胡晖, 刘红芝, 等. 花生饼粕及花生壳烘烤风味分析[J]. 食品科学, 2017, 38(2): 146-153. DOI:10.7506/spkx1002-6630-201702024. http://www.spkx.net.cn
LIU Yunhua, HU Hui, LIU Hongzhi, et al. Analysis of volatile compounds in roasted peanut shell and peanut cakes by HSSPME-GC-MS[J]. Food Science, 2017, 38(2): 146-153. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702024. http://www.spkx.net.cn
收稿日期:2016-06-29
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0401400);公益性行业(农业)科研专项(201303072);中国农业科学院科技创新工程项目(CAAS-ASTIP-201X-IAPPST)
作者简介:刘云花(1990—),女,硕士研究生,主要从事食品化学与工艺研究。E-mail:yunhuaguai@163.com
*通信作者:王强(1965—),男,研究员,博士,主要从事粮油加工与副产物综合利用研究。E-mail:wangqiang06@caas.cn