分子印迹固相萃取技术对六堡茶中表儿茶素的分离特性
刘伯洋
1,李利军
1,程 昊
1,黄文艺
1,冯 军
2,孔红星
1,*
(1.广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西 柳州 545006;2.广西科技大学医学院,广西 柳州 545005)
摘 要:以表儿茶素为模板分子,丙烯酰胺为功能单体,偶氮二异丁腈作为引发剂,乙二醇二甲基丙烯酸酯为交联剂,通过原位聚合法制备分子印迹聚合物。首先考察不同模板分子、功能单体、交联剂比例条件下表儿茶素分子印迹聚合物的特异性吸附能力。结果表明表儿茶素与丙烯酰胺、乙二醇二甲基丙烯酸酯物质的量比为1∶6∶40时,分子印迹聚合物的吸附效果最佳,其模板分子回收率K
MIPs为84.62%,特异性识别因子Q为4.55;然后利用扫描电子显微镜和红外光谱技术对制备的印迹聚合材料进行表征;最后在毛细管电泳最优条件下对加载过固相萃取柱的过柱液与洗脱液进行检测,建立分子印迹固相萃取-毛细管电泳联用检测表儿茶素的方法。实验结果表明,分子印迹聚合物成功聚合,形貌良好且具有专一吸附特性。该方法适用于六堡茶中表儿茶素的检测。
关键词:分子印迹;表儿茶素;固相萃取;毛细管电泳
六堡茶是中国千年名茶,属黑茶类,因原产于广西壮族自治区梧州市苍梧县六堡乡而得名。表儿茶素是六堡茶叶中主要活性成分之一,约占儿茶素含量的40%~50%。研究表明,表儿茶素具有防治心血管疾病
[1]、预防癌症、抗氧化
[2-3]等生物活性作用。寻找合适方法分离与测定六堡茶中表儿茶素,已经成为广西本地茶资源推广的重要考量依据。目前检测表儿茶素的方法主要有高效液相色谱法
[4-5]、毛细管电泳(capillary electrophoresis,CE)法
[6]等,但这些方法普遍存在预处理步骤复杂、检测出样品峰受杂质峰干扰严重或无法检测出峰等缺点。
分子印迹固相萃取(molecularly imprinted solidphase extraction,MISPE)技术是近年来发展起来的一种新型SPE技术。通过化学方法合成分子印迹聚合物(molecularly imprinted polymers,MIPs),利用印迹分子对实际样品中某一特定分子具有特异性识别机理的特性,对待测物质进行选择性分离。在MISPE过程中,模板分子会与MIPs中特定大小与形状的空穴相结合,从而将目标分子保留在SPE柱内,然后将其洗脱下来,此时洗脱液中仅含有模板分子,从而达到对目标分子纯化的效果。与传统SPE法相比,MIPs对模板分子拥有较好的吸附性与选择性,可以在复杂体系中选择性吸附目标分子并将其更稳定的保存至柱内,只有使用较强洗脱效果的洗脱溶液才能将目标分子从MIPs上洗脱下来。这种选择性吸附特性在天然活性物质分离领域内显示出良好的应用前景
[7-13]。本实验采用原位聚合法制备表儿茶素MIPs,建立一种新的MISPE-CE联用检测方法以降低杂质峰干扰,从而更好的对六堡茶中表儿茶素进行分离与测定。
1 材料与方法
1.1 材料与试剂
六堡茶 市购;表儿茶素、表儿茶素没食子酸酯标准品、乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EGDMA)(用前重结晶除阻聚剂)、偶氮二异丁腈(azobisisobutyronitrile,AIBN) 上海阿拉丁试剂有限公司;丙烯酰胺(azobisisobutyronitrile,AM),甲醇、乙醇、冰乙酸、正丙醇、1,4-丁二醇(均为分析纯) 西陇化工股份有限公司;十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)、磷酸二氢钾、磷酸二氢钠 天津市科密欧化学试剂有限公司;水为实验室自制去离子双蒸水。
1.2 仪器与设备
ACS2000型高效CE仪(正、负电源,电压0~30 kV可调,未涂层熔融石英毛细管(50 cm×75 μm,有效长度36 cm)) 北京彩陆科学仪器有限公司;UV-2102PC型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;AR124CN电子天平 上海奥豪斯有限公司;RE-5203旋转蒸发器 上海亚荣生化仪器厂;DL-60D超声波清洗器 上海之信仪器有限公司;傅里叶变换红外分光光度计 上海珀金埃尔默仪器有限公司;HV 04-55场发射扫描电子显微镜 德国蔡司公司;ZFD-A5040A全自动新型鼓风干燥箱 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 表儿茶素MIPs的制备
采用原位聚合法合成表儿茶素MIPs:以表儿茶素为模板分子,AM为功能单体,EGDMA为交联剂,AIBN为引发剂,正丙醇与1,4-丁二醇混合溶液为致孔剂,分别按不同比例制备MIPs,如表1所示。
表1 制备表儿茶素MIPs的物料组成
Table1 Chemicals used for making L-epicatechin MIPPss

聚合物模板分子功能单体交联剂 引发剂物质的量比模板分子∶功能单体∶交联剂P1表儿茶素AM EGDMAAIBN1∶2∶40 P2表儿茶素AM EGDMAAIBN1∶4∶40 P3表儿茶素AM EGDMAAIBN1∶6∶40 P4表儿茶素AM EGDMAAIBN1∶8∶40
以P3为例,称取0.007 23 g(0.002 5 mmol)表儿茶素溶于正丙醇与1,4-丁二醇混合溶液中,加入0.010 8 g(0.15 mmol)AM,将混合溶液置于振荡器中振荡0.5 h,使AM与表儿茶素在溶剂中充分混合溶解,然后加入189 μL(1 mmol)EGDMA与1 mg(0.6 mmol)AIBN,将混合溶液放入超声波清洗器中,在30 ℃条件下超声脱气20 min,然后用移液枪取80 μL混合溶液至200 μL移液枪枪头中,充氮除氧10 min,密封枪头两端。将处理好的枪头放入55 ℃恒温水浴锅中加热24 h,加热结束后取出枪头得到图1A所示的MISPE小柱,枪头前端白色固体即为MIPs。将注射器与SPE小柱相连接如图1B所示,用甲醇-冰乙酸(9∶1,V/V)混合溶液冲洗聚合物以去除MIPs中的模板分子,至洗脱液中检测不到模板分子时停止洗脱。再用甲醇溶液对其进行二次洗脱,以除去残留在萃取柱上的冰乙酸。最后将其放入鼓风干燥箱内60 ℃真空干燥24 h,将得到的聚合物枪头放入干燥器中备用。

图1 SPE柱效果图
Fig. 1 Solid phase extraction column
作为对照实验,非印迹聚合物(non-molecularly imprinted polymers,NMIP)在无模板分子存在条件下利用相同条件制备。
1.3.2 MIPs与NMIP模板分子回收率实验
采用SPE-CE法评价聚合物对模板分子的回收率。取制备好的P1、P2、P3、P4与NP1、NP2、NP3、NP4(NP为与聚合物P相对应的非印记聚合物)8 根SPE柱,进行实验。将相同体积与物质的量的表儿茶素溶液加载至各组SPE柱上端,使用甲醇与冰乙酸对SPE柱进行洗脱,最终得到8 组洗脱液。将各组洗脱液在旋转蒸发器中浓缩至干,然后用甲醇定容至初始体积,最后利用CE技术检测8 组洗脱液中表儿茶素的物质的量。根据实验前后溶液中表儿茶素物质的量的变化可计算聚合物模板分子回收率与特异性识别因子(Q)。
模板分子回收率按公式(1)计算:
式中:K为模板分子回收率/%;C
p为经过萃取柱后洗脱溶液中所含表儿茶素的物质的量/mol;C
c为表儿茶素在溶液中的物质的量/mol。
特异性识别因子(Q)按公式(2)计算:
式中:Q为特异性识别因子;K
MIPs为MIPs对模板分子的回收率/%;K
NMIP为NMIP对模板分子的回收率/%。
电泳条件:将相关文献[14-16]与实际效果结合分析,得到CE检测最佳条件。实验室环境温度25 ℃,重力进样,进样高度15 cm,进样时间25 s,分离电压-20 kV,于波长230 nm处直接检测。背景缓冲液为30 mmol/L磷酸盐的混合体系+0.05 mmol/L CTAB+12.5%乙腈混合溶液,pH值为10.0。
1.3.3 聚合物结构与形貌表征
利用傅里叶变换红外分光光度计对表儿茶素MIPs结构进行表征。取1 mg待测物质与100 mg KBr混合压片,在500~4 000 cm
-1光谱范围内分别对MIPs、NMIP与AM 3 种物质进行检测。同时对枪头状的MISPE柱水平切面,经喷金处理后进行电子显微镜扫描,以考察柱内聚合物的形貌。
1.3.4 MIPs选择性能实验
配制甲醇为溶剂,浓度为0.1 mmol/L的表儿茶素和表儿茶素没食子酸酯标准物质混合溶液,置于5 mL的离心管中,通过超声除气装置将其混匀并脱气。将混合溶液加载至SPE柱上端,收集过柱液,然后用甲醇淋洗萃取柱并收集淋洗液,再用甲醇-乙酸(9∶1,V/V)混合溶液对萃取柱进行洗脱,收集洗脱液。过柱液、淋洗液与洗脱液分别在旋转蒸发器中浓缩至干,最后用甲醇定容至相同容积,再在电泳最优条件下分别对其进行检测。
1.3.5 样品处理
将六堡茶干茶叶放入中药材粉碎机粉碎至粉末。取出适量茶叶粉末溶于乙醇溶剂,在85 ℃水浴条件下索氏提取4 h,实验结束后将提取液倒入蒸发皿中,放入烘箱烘干备用。
2 结果与分析
2.1 聚合条件优化
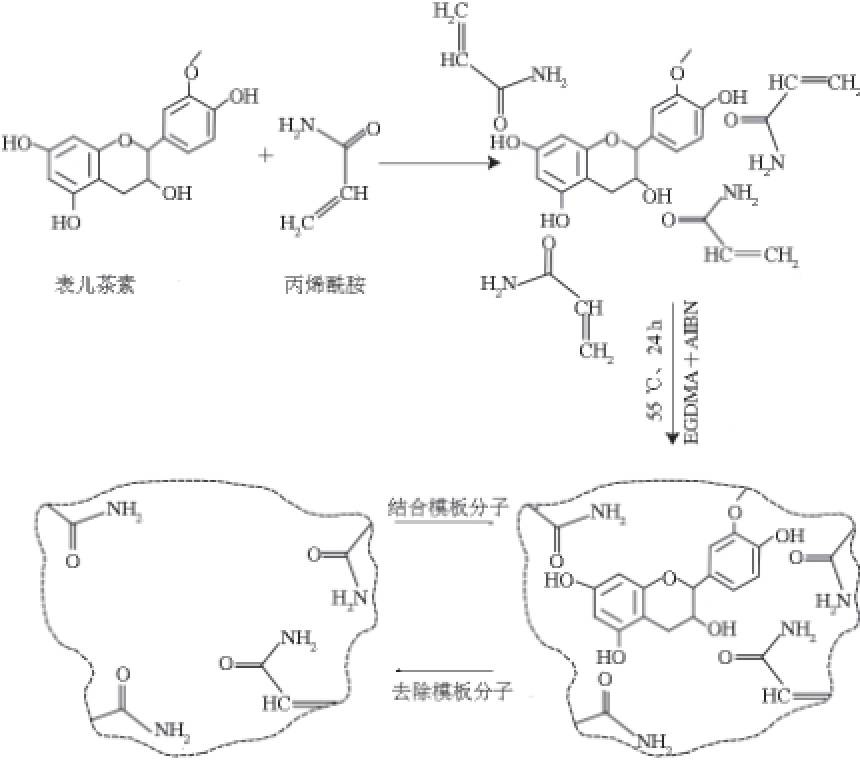
图2 表儿茶素分子印迹过程示意图
Fig. 2 Schematic illustration of molecularly imprinting of L-epicatechin
表儿茶素MISPE柱的特异性吸附性能与聚合物的组成、比例等条件密切相关。对模板分子而言,选择合适功能单体是直接影响SPE柱吸附性能的关键。如图2所示,由于表儿茶素分子中4 个羟基基团都可以形成氢键位点,而AM中含有的羰基基团,易与表儿茶素分子中的多个羟基基团以氢键相结合,因此选用表儿茶素作为模板分子,AM作为功能单体,并对模板分子、功能单体与交联剂之间的配比进行优化与考察,以改善聚合物吸附及选择性能。有文献[17-25]报道,模板分子和功能单体比例一般为1∶4或1∶6,因为在此比例条件下模板分子和功能单体的结合量最大。为了考察模板分子、功能单体、交联剂间配比对模板分子回收率的影响,对制备的8 种聚合物进行回收率分析,如表2所示。由于表儿茶素含有多个羟基,即单个分子能与功能单体作用的识别位点较多,所以需要功能单体的量也比较多,但是功能单体量太大则会增加聚合物非特异性吸附能力,降低SPE柱选择吸附性能。表2实验结果中,按P3比例制备的MIPs回收率最高,且特异性识别因子P3的值最大,说明聚合物特异性吸附作用力最强,非特异性吸附的影响最小。因此本实验选用模板分子、功能单体与交联剂物质的量比例为1∶6∶40作为MIPs制备最优条件。
表2 不同比例对聚合物模板分子回收率的影响
Table2 Effect of template to functional monomer to cross-linking agent ratio on template recovery

聚合物物质的量比MIPs回收率/% NMIP回收率/% Q模板分子∶功能单体∶交联剂P11∶2∶4063.0118.533.40 P21∶4∶4075.8119.243.94 P31∶6∶4084.6218.624.55 P41∶8∶4066.5420.513.24
2.2 MIPs形态结构表征
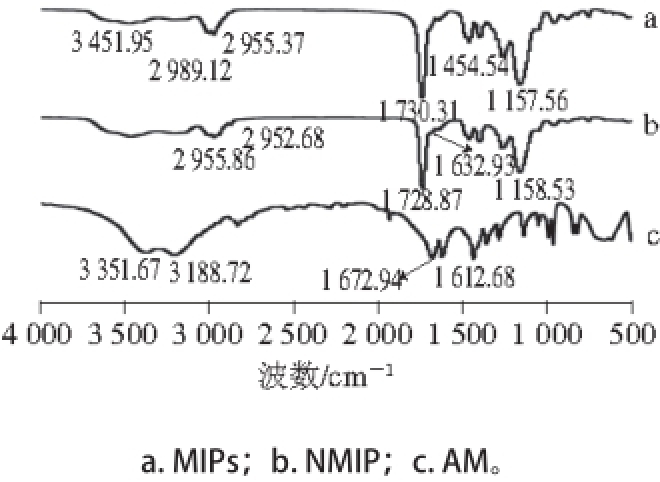
图3 聚合物红外光谱图
Fig. 3 IR spectra of molecularly imprinted and non-imprinted polymers
如图3所示,AM特征峰在3 351.67、1 692.94 cm
-1和1 612.68 cm
-1处,这3 个吸收峰分别代表AM中N—H、C=O和C=C基团。由图3a可知,MIPs的C=O基团特征峰在1 730.31 cm
-1处,说明该聚合物已通过EGDMA与AM成功聚合。NMIP的C=O基团特征峰在1 632.93 cm
-1处,比MIPs特征峰值低,这是因为MIPs中的C=O基团受到了模板分子与功能单体之间氢健作用的影响。图3a中3 451.95 cm
-1处宽峰代表功能单体AM中N—H基团不对称伸缩振动,而1 454.54 cm
-1处的吸收峰则是不对称酯中C—O基团。这些结果都可以表明MIPs已经成功制备。

图4 MIPs扫描电镜图
Fig. 4 Scanning electron micrographs of the molecularly imprinted polymer
在最优比例条件下所制备聚合物,通过扫描电镜对聚合物的形貌进行表征,如图4所示。聚合物呈颗粒状叠加在一起,且拥有疏松多孔、分散性均一的特点,这种网状结构使MIPs在SPE过程中具有较大比表面积与较低流动阻力,这些优点有助于增强其在样品中特异性吸附性能。
2.3 MIPs选择性吸附实验
为近一步研究MIPs在SPE过程中选择特性,本实验选用浓度0.1 mmol/L表儿茶素与表儿茶素没食子酸酯标准物质混合溶液,其结构式如图5所示。对该混合溶液进行SPE实验,如图6所示。
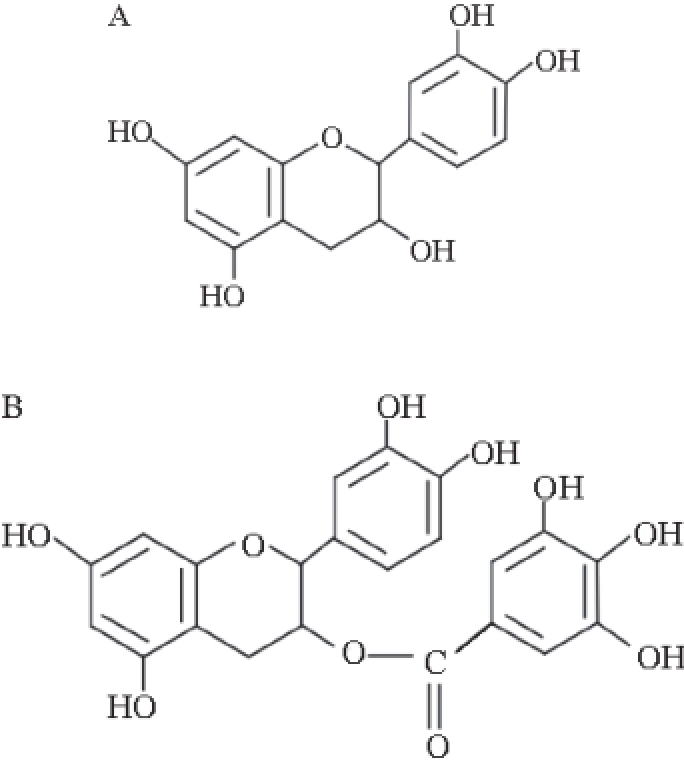
图5 表儿茶素(A)与表儿茶素没食子酸酯(B)的化学结构式
Fig. 5 Structures of L-epicatechin (A) and epicatechin-gallate (B)
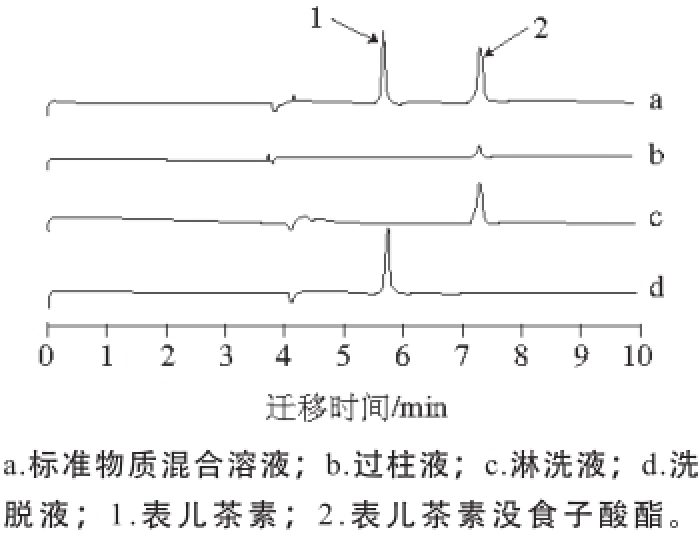
图6 MISPE过程中物混合溶液的CCEE图
Fig. 6 Capillary electropherograms of mixed solutions obtained during molecularly imprinted solid phase extraction
图6 a表明,在最优电泳条件下混合溶液中表儿茶素与表儿茶素没食子酸酯完全分离,峰形良好;在图6b中,经过MISPE柱后过柱液仅检测出小部分表儿茶素没食子酸酯,这是因为表儿茶素与大部分表儿茶素没食子酸酯已经吸附在MIPs上,没有随过柱液流出;SPE柱经甲醇淋洗后,淋洗液中仅能检测到表儿茶素没食子酸酯(图6c);采用更强洗脱能力的甲醇-乙酸(9∶1,V/V)溶液对SPE柱进行洗脱后,表儿茶素成功被洗脱下来如图6d所示,模板分子在该洗脱溶剂条件下的回收率达到84.62%。比较混合溶液中2 种物质结构式(图5)不难发现,表儿茶素没食子酸酯空间体积远大于表儿茶素,所以不容易进入以表儿茶素为模板分子合成的MIPs孔穴中。而由图6b可知,部分表儿茶素没食子酸酯吸附在MIPs上,这是因为SPE柱本身具有非特异性吸附作用,但这种弱吸附作用很容易被淋洗下来。因为表儿茶素是吸附在特定形貌与大小的印迹孔穴内,所以只有采用更强效果洗脱液才能将其洗脱下来。MIPs对不同分子具有不同的吸附能力,这种吸附特性使得表儿茶素分子在MISPE过程中被特异性吸附在SPE柱上,再经洗脱液流出,从而达到对复杂样品中目标分子的纯化作用。
2.4 实际样品检测

图7 六堡茶样品过柱前后CE图
Fig. 7 CE chromatogram of L-picatechin before and after MISPE
为了验证表儿茶素MISPE柱在实际样品中选择特性,对六堡茶样品进行CE检测。配制甲醇作溶剂0.1 mmol/L样品溶液在最优电泳条件下检测,如图7所示。由于六堡茶成分复杂,所以在图7a中表儿茶素色谱峰周围存在很多杂峰。而在过柱洗脱液中这些杂峰在很大程度上减弱甚至消失(图7b)。这说明表儿茶素MISPE柱特异性吸附能力较强,有效分离出表儿茶素分子,从而较好避免实际样品中杂质峰的干扰,且具备较高模板分子回收率。
3 结 论
本实验采用原位聚合法在移液枪头中制备表儿茶素MIPs。对不同组成比例MIPs与NMIP的模板分子回收率进行了对比分析。并对聚合物的结构与形貌进行表征,同时对多种溶质混合物与实际样品进行SPE实验,所得到的过柱液、淋洗液与洗脱液利用CE技术进行分析检测。结果表明MISPE柱对表儿茶素具有专一吸附特性。本实验制备方法操作简单,使用原位聚合技术免去了传统本体聚合技术中研磨聚合物与装填萃取柱步骤,保证了聚合物形貌不被破坏,所制备的SPE柱可以多次重复使用,同时也为六堡茶中表儿茶素的检测提供了一种新方法。
参考文献:
[1] 曹莹, 梁日欣, 杨滨, 等. (-)-儿茶素没食子酸酯和(+)-表儿茶素对心肌细胞保护作用研究[J]. 中国实验方剂学杂志, 2006, 12(10): 36-38. DOI:10.13422/j.cnki.syfjx.2006.10.017.
[2] 黄仁术, 易凡, 何惠利, 等. 金荞麦(-)-表儿茶素抗氧化活性研究[J].食品科学, 2014, 35(15): 118-121. DOI:10.7506/spkx1002-6630-201415024.
[3] YVONNE S, TANKRED S, HELMUT S. Epicatechin protects endothelial cells against oxidized LDL and maintains NO synthase[J]. Biochemical and Biophysical Research Communications, 2005, 331(4): 1277-1283. DOI:10.1016/j.bbrc.2005.04.035.
[4] QIAN Yumei, ZHAO Xianqian, ZHAO Lei, et al. Analysis of stereochemistry and biosynthesis of epicatechin in tea plants by chiral phase high performance liquid chromatography[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2015, 1006: 1-7. DOI:10.1016/j.jchromb.2015.10.024.
[5] DIAS F D S, MIGUEL P L, CARMELO G B, et al. Optimization and validation of a method for the direct determination of catechin and epicatechin in red wines by HPLC/fluorescence[J]. Microchemical Journal, 2010, 96(1): 17-20. DOI:10.1016/j.microc.2010.01.004.
[6] 衷明华, 严赞开, 林燕如. 毛细管区带电泳法测定茶叶中咖啡因、茶氨酸、表儿茶素和表没食子儿茶素没食子酸酯[J]. 食品科学, 2012, 33(24): 286-288. DOI:10.7506/spkx1002-6630-201224061.
[7] DU Ting, CHENG Jing, WU Min, et al. An in situ immobilized pipette tip solid phase microextraction method based on molecularly imprinted polymer monolith for the selective determination of difenoconazole in tap water and grape juice[J]. Journal of Chromatography B, 2014, 951: 104-109. DOI:10.1016/j.jchromb.2014.01.030.
[8] SHAN Huikai, ZHAO Lingguo, CHEN Jian, et al. Preparation, characterization and application of molecularlyimprinted monolithic column for hesperetin[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 111: 241-247. DOI:10.1016/j.jpba.2015.04.006.
[9] JI Xiang, LI Dan, LI Hua. Preparation and application of a novel molecularly imprinted solid-phase microextraction monolith for selective enrichment of cholecystokinin neuropeptides in human cerebrospinal fluid[J]. Biomedical Chromatography, 2015, 29(8): 1280-1289. DOI:10.1002/bmc.3418.
[10] 汪雪雁, 檀华蓉, 祁克宗, 等. 分子印迹固相萃取-高效毛细管电泳法检测鸡肉中的恩诺沙星残留[J]. 色谱, 2010, 28(11): 1107-1110. DOI:10.3724/SP.J.1123.2010.01107.
[11] VICTORIA S, MARIA K, ABUZAR K, et al. Matrix molecularly imprinted mesoporous sol-gel sorbent for efficient solid-phase extraction of chloramphenicol from milk[J]. Analytica Chimica Acta, 2016, 914: 62-74. DOI:10.1016/j.aca.2016.02.003.
[12] HARUM N, ANDERSON R A, CORMACK P A G. Analysis of ketamine and norketamine in hair samples using molecularly imprinted solid-phase extraction (MISPE) and liquid chromatography-tandem mass spectrometry (LC-MS/MS)[J]. Analytical and Bioanalytical Chemistry, 2010, 396(7): 2449-2459. DOI:10.1007/s00216-009-3404-6.
[13] SHEN Zhonglan, YUAN Dong, SU Qingde, et al. Selective solidphase extraction using molecularly imprinted polymer for analysis of methamidophos in water and soil samples[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(3): 473-479. DOI:10.1271/ bbb.100668.
[14] 马晓年, 邵娅婷, 李菲, 等. 毛细管电泳分离检测茶叶中5 种多酚类化合物[J]. 食品科学, 2014, 35(8): 129-132. DOI:10.7506/spkx1002-6630-201408025.
[15] 李利军, 冯军, 黄文艺, 等. 高效毛细管电泳同时分离测定栀子苷、芍药苷及丹皮酚的研究[J]. 分析试验室, 2007, 26(5): 38-41. DOI:10.13595/j.cnki.issn1000-0720.2007.0131.
[16] 张凯歌, 胡玉玲, 胡玉斐, 等. 分子印迹微萃取技术的研究进展[J].色谱, 2012, 30(12): 1220-1228. DOI:10.3724 /SP.J.1123.2012.08002.
[17] 颜流水, 井晶, 黄智敏, 等. 槲皮素分子印迹聚合物的制备及固相萃取性能研究[J]. 分析试验室, 2006, 25(5): 97-100. DOI:10.3969/ j.issn.1000-0720.2006.05.026.
[18] MOHAMMAD K, FOROUZAN A, HAMID R L Z Z, et al. Determination of sulfonamides in chicken meat by magnetic molecularly imprinted polymer coupled to HPLC-UV[J]. Food Analytical Methods, 2014, 7(1): 73-80. DOI:10.1007/s12161-013-9600-1.
[19] WHITCOMBE M J, KIRSCH N, NICHOLLS I A. Molecular imprinting science and technology: a survey of the literature for the years 2004-2011[J]. Journal of Molecular Recognition, 2014, 27(6): 297-401. DOI:10.1002/jmr.2347.
[20] BERNADETTE T S B, KARSTEN H. Molecularly imprinted polymers: synthetic receptors in bioanalysis[J]. Analytical and Bioanalytical Chemistry, 2010, 398(6): 2481-2492. DOI:10.1007/ s00216-010-4158-x.
[21] JULIA S, SAMUEL S R D, YERRAMILLI A, et al. Molecularly imprinted polymers for detection of explosives: computational study on molecular interactions of 2,6-dinitrotoluene and methacrylic acid complex[J]. Structural Chemistry, 2010, 21(6): 1171-1184. DOI:10.1007/s11224-010-9657-z.
[22] ZHONG Dandan, LIU Xin, PANG Qianqian, et al. Rapid preparation of molecularly imprinted polymer by frontal polymerization[J]. Analytical and Bioanalytical Chemistry, 2013, 405(10): 3205-3214. DOI:10.1007/s00216-013-6722-7.
[23] WANG Xuejiao, DONG Shaohua, BAI Quan. Preparation of lysozyme molecularly imprinted polymers and purification of lysozyme from egg white[J]. Biomedical Chromatography, 2014, 28(6): 907-912. DOI:10.1002/bmc.3207.
[24] BURCU O, SECIL O. Molecularly imprinted polymers for separation of various sugars from human urine[J]. Talanta, 2011, 87: 74-79. DOI:10.1016/j.talanta.2011.09.043.
[25] CLAUDIO B, PATRIZIA B, CRISTINA G, et al. Molecularly imprinted polymers for corticosteroids: analysis of binding selectivity[J]. Biosensors and Bioelectronics, 2010, 26(2): 590-595. DOI:10.1016/j.bios.2010.07.023.
Separation of L-Epicatechin in Liubao Tea by Molecularly Imprinted Solid Phase Extraction
LIU Boyang
1, LI Lijun
1, CHENG Hao
1, HUANG Wenyi
1, FENG Jun
2, KONG Hongxing
1,*
(1. Guangxi Key Laboratory of Green Processing of Sugar Resources, College of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China; 2. College of Medical, Guangxi University of Science and Technology, Liuzhou 545005, China)
Abstract:Molecularly imprinted polymers (MIPs) were synthesized by in situ polymerization using L-epicatechin as the template molecule, acrylamide (AM) as the functional monomer, azobisisobutyronitrile (AIBN) as the initiator, and ethylene glycol dimethacrylate (EGDMA) as the cross-linking agent. Firstly, the specific adsorption capacity of L-epicatechin MIPs was evaluated as a function of the proportions of template molecule, functional monomer, and cross-linking agent. The results showed that when the molar ratio of L-epicatechin to acrylamide to ethylene glycol dimethacrylate was 1:6:40, MIPs exhibited the best adsorption capacity, with template molecule recovery (K
MIPs) of 84.62% and specific recognition factor (Q) of 4.55. Scanning electron microscope (SEM) and Fourier transform infrared spectroscopy (FT-IR) were used to characterize the MIPs. Finally, we used capillary electrophoresis to detect the effluent and the eluate under optimum conditions. As a result, a molecularly imprinted solid phase extraction-capillary electrophoresis (MISPE-CE) method for the determination of L-epicatechin was developed. The experimental results showed that molecularly imprinted polymers were successfully synthesized with good morphology and specific adsorption characteristics. This method is feasible for the analysis of L-epicatechin in Liubao tea.
Key words:molecular imprinting; L-epicatechin; solid phase extraction; capillary electrophoresis
DOI:10.7506/spkx1002-6630-201702027
中图分类号:O658
文献标志码:A
文章编号:1002-6630(2017)02-0164-06
引文格式:
刘伯洋, 李利军, 程昊, 等. 分子印迹固相萃取技术对六堡茶中表儿茶素的分离特性[J]. 食品科学, 2017, 38(2): 164-169. DOI:10.7506/spkx1002-6630-201702027. http://www.spkx.net.cn
LIU Boyang, LI Lijun, CHENG Hao, et al. Separation of L-epicatechin in Liubao tea by molecularly imprinted solid phase extraction[J]. Food Science, 2017, 38(2): 164-169. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702027. http://www.spkx.net.cn
收稿日期:2016-03-30
基金项目:广西自然科学基金项目(2014GXNSFAA118402);广西高等学校高水平创新团队及卓越学者计划资助项目
作者简介:刘伯洋(1991—),男,硕士研究生,研究方向为分子印迹技术开发与应用。E-mail:www.lby746129579@qq.com
*通信作者:孔红星(1967—),男,研究员,硕士,研究方向为分析测试技术与糖资源综合利用。E-mail:khx100@sina.com








