定点突变提高极端嗜热α-淀粉酶ApkA的高温活性和热稳定性
曾 静,郭建军,袁 林*
(江西省科学院微生物研究所,江西 南昌 330096)
摘 要:极端嗜热α-淀粉酶具有优良的高温活性和热稳定性,因此在淀粉液化工艺中具有巨大的应用潜力,并且其高温适应性机制研究可以为构建耐高温α-淀粉酶提供理论依据和设计思路。通过分析来源于极端嗜热古生菌Thermococcus kodakarensis KOD1的α-淀粉酶ApkA的氨基酸序列,构建缺失信号肽突变体ApkAds和单点突变体ApkAdsA180K。酶学性质分析表明,与ApkAds相比,突变体ApkAdsA180K的高温活性和热稳定性明显提高。其中ApkAds的最适反应温度为90 ℃,对应的酶比活力为2 946.75 U/mg;突变体ApkAdsA180K的最适反应温度为100 ℃,对应的酶比活力为4 501.08 U/mg。ApkAds于90 ℃的半衰期约为5 h,突变体ApkAdsA180K于90 ℃的半衰期约为7 h。通过同源模建得到的蛋白质三级结构显示,突变体ApkAdsA180K中氨基酸残基K180与D212间形成离子键。本研究结果表明ApkAdsA180K中K180与D212间离子键有利于其维持其高温活性和热稳定性。
关键词:极端嗜热α-淀粉酶;离子键;定点突变;高温活性;热稳定性
淀粉是α-D-葡萄糖苷通过α-1,4糖苷键和α-1,6糖苷键连接而成的高分子量聚合物,是除纤维素之外的数量分布最广的多糖之一
[1-2]。淀粉作为一种基本原材料,广泛应用于食品工业、医药、造纸、纺织、饲料等领域,并且淀粉是发酵、制糖等工业中最重要的原料之一
[3-4]。α-淀粉酶是一类作用于淀粉分子,从其分子内部随机切断α-1,4糖苷键,生成葡萄糖、还原糖、极限糊精和含4 个以上葡萄糖残基的低聚糖的水解酶
[5-7]。α-淀粉酶常被应用于淀粉液化工艺,将淀粉水解成低分子质量的糊精,以制造各种糖浆,是最重要的工业酶制剂之一,占全球工业用酶份额的30%
[8]。因此,α-淀粉酶的研究和开发具有重要意义。
目前淀粉液化工艺存在较多不足
[9-10],例如110 ℃液化条件下,玉米、小麦等蛋白质含量较高的粗原料的液化效果不够理想;目前工业上广泛使用的α-淀粉酶BLA的耐热性与淀粉液化工艺的要求存在一定的差距。针对这些不足,国内外学者致力于寻求更适用于淀粉液化工艺的耐高温α-淀粉酶。已报道的文献表明极端嗜热微生物来源的极端嗜热α-淀粉酶具有较好的高温活性和热稳定性
[11-13],因此在淀粉液化工艺中具有巨大的应用潜力,有关该类α-淀粉酶的热稳定机制研究可以为现有α-淀粉酶的热稳定性改造提供理论依据和设计思路。
由极端嗜热古生菌Thermococcus kodakarensis KOD1所产生的胞外α-淀粉酶ApkA具有较好的高温活性和热稳定性,其最适反应温度为90 ℃,100 ℃条件下可保持80%的酶活性,110 ℃仍有20%的酶活性
[14]。ApkA的最适反应pH值为5~6.5,于pH 4.5保持40%的酶活性
[14]。该酶在未补加Ca
2+的条件下于90 ℃保温1 h后保持90%的剩余活性,在2 mmol/L Ca
2+的条件下于100 ℃保温1 h后仍有40%的剩余活性
[14]。ApkA具有优良的高温活性和热稳定性,并且耐酸性强,综合性质优于其他α-淀粉酶,在淀粉液化工艺中具有较大的应用潜力。为了满足淀粉液化工艺的要求,需要进一步提高ApkA的高温活性和热稳定性。本研究拟通过对ApkA以及其他已知的极端嗜热α-淀粉酶进行氨基酸序列同源比对和结构分析,选定待突变的氨基酸位点,采用定点突变技术构建突变体,在大肠杆菌中进行表达,并验证突变体的高温活性和热稳定性,从而为ApkA的开发与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌DH5α、大肠杆菌BL21-CodonPlus(DE3)-RIL、大肠杆菌克隆载体pUC57、大肠杆菌表达载体pET28a均由本实验室保存。
1.1.2 培养基
大肠杆菌的培养采用LB培养基,筛选培养基采用含50 μg/mL卡那霉素的LB培养基。
1.1.3 试剂
KOD DNA聚合酶及KOD-Plus-neo DNA聚合酶日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、低分子质量蛋白质Marker美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-Tek公司;Chelating Sepharose
TMFast Flow 美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒 上海生工生物工程股份有限公司;其他化学试剂均为国产或进口分析纯;基因合成由上海博益生物科技有限公司完成,聚合酶链式反应(polymerase chain reaction,PCR)引物合成和测序由上海生工生物工程股份有限公司完成。
1.2 仪器与设备
Mastercycler gradient PCR仪 美国Eppendorf公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC紫外-可见分光光度计 上海光谱仪器有限公司;SCIENTZ-ⅡD超声波细胞破碎仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 分子克隆技术和表达产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
分子克隆技术和表达产物的SDS-PAGE分析参照文献[15-16]进行。
1.3.2 重组质粒pET28a-ApkAds的构建及鉴定
α-淀粉酶ApkA基因ApkA由上海博益生物科技有限公司合成,将基因ApkA连接至载体pUC57构建质粒pUC57-ApkA。设计引物ApkAds-F、ApkAds-R扩增基因ApkA不含信号肽的结构基因ApkAds。以质粒pUC57-ApkA为模板,以ApkAds-F、ApkAds-R为引物,进行PCR扩增。PCR扩增条件为:98 ℃预变性5 min;98 ℃变性20 s,60 ℃退火20 s,74 ℃延伸2 min,30 个循环;74 ℃延伸10 min。扩增产物经NcoⅠ和EcoRⅠ双酶切,连接至载体pET28a,构建亚克隆pET28a-ApkAds。采用NcoⅠ和EcoRⅠ双酶切质粒鉴定是否有外源基因的插入。
表1 构建重组质粒所用引物
Table1 Primer sequences used for the construction of recombinant plasmids
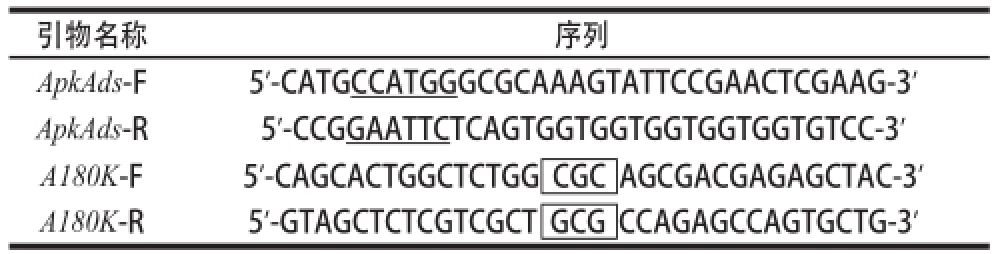
注:下划线标注的部分为限制性酶切割位点,方框标注的部分为突变位点。
引物名称序列ApkAds-F 5’-CCGGAATTCTCAGTGGTGGTGGTGGTGGTGTCC-3’A180K-F5’-CAGCACTGGCTCTGG CGC AGCGACGAGAGCTAC-3’A180K-R5’-GTAGCTCTCGTCGCT GCG CCAGAGCCAGTGCTG-3’5’-CATGCCATGGGCGCAAAGTATTCCGAACTCGAAG-3’ApkAds-R
1.3.3 重组质粒pET28a-ApkAdsA180K的构建及鉴定
根据QuikChange
®点突变试剂盒的原理,结合α-淀粉酶ApkA基因ApkA和拟突变的氨基酸位点设计引物A180K-F、A180K-R。以pET28a-ApkAds为模板,采用引物A180K-F和A180K-R,进行PCR扩增得到包含载体序列和基因序列的线性片段。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,68 ℃延伸4 min,35个循环;68 ℃延伸10 min。扩增产物经DpnⅠ酶处理后,转化大肠杆菌DH5α,卡那霉素抗性平板筛选转化子,经测序鉴定是否为突变基因ApkAdsA180K。
1.3.4 重组α-淀粉酶的诱导表达和纯化
将pET28a-ApkAds和pET28a-ApkAdsA180K质粒分别转化大肠杆菌BL21-CodonPlus(DE3)-RIL。从新鲜的转化平板上挑取重组大肠杆菌单菌落,分别接种于含有卡那霉素的5 mL LB液体培养基中,37 ℃培养过夜。将过夜培养物以1%接种量转接至含有卡那霉素的50 mL LB液体培养基中,37 ℃培养至菌液A
600
nm达到0.5左右。加入IPTG至其终浓度为0.25 mmol/L,继续于16 ℃培养20 h, 12 000 r/min离心5 min收集菌体沉淀。
采用5 0 m m o l/L 2-(N-吗啡啉)乙磺酸(2-morpholinoethanesulfonic acid,MES),pH 6.5缓冲液重悬并洗涤菌体沉淀,再加入适量50 mmol/L MES,pH 6.5缓冲液重悬菌体沉淀,置于冰上用超声波破碎细胞。超声波细胞破碎仪的参数设置如下:超声波功率25%、超声波破碎时间3 s、间歇6 s。超声波处理菌体细胞至菌体悬液变为均一的溶液,采用SDS-PAGE检测重组蛋白质的表达情况。
采用Ni
2+亲和层析柱对细胞可溶成分中目的蛋白质进行纯化,用250 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组α-淀粉酶ApkAds和ApkAdsA180K。利用SDS-PAGE检测重组α-淀粉酶的纯度,并采用Bradford法测定重组α-淀粉酶的质量浓度。
1.3.5 α-淀粉酶活力测定
将10 μL酶液与490 μL含1 g/100 mL可溶性淀粉的50 mmol/L MES,pH 6.5缓冲液混合,于90 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法
[17]测定反应体系中还原糖量。酶活力单位定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.3.6 α-淀粉酶的酶学性质
将酶液与不同pH值的1%可溶性淀粉溶液混合,于90 ℃条件下进行酶比活力测定。采用不同缓冲液配制不同pH值的1%可溶性淀粉溶液:50 mmol/L MES(pH 4.0~7.0)、50 mmol/L 3-(N-玛琳代)丙磺酸缓冲液(3-morpholinopropanesulfonic acid,MOPS)(pH 7.0~9.0)。
按照上述反应体系混合酶液和底物,分别于40~110 ℃反应30 min,测定不同温度条件下酶比活力,并以酶比活力对时间作图,确定其最适反应温度。其中,40~95 ℃范围内的反应于水浴中进行,100~110 ℃范围内的反应于甘油浴中进行。高温条件下测定α-淀粉酶比活力时,反应样品置于O型环螺旋盖密封管内,以防止水分蒸发。
用50 mmol/L MES(pH 6.5)缓冲液配制不同质量分数可溶性淀粉溶液(0.1%、0.2%、0.5%、1%、1.5%、2%、3%、4%、5%),分别向可溶性淀粉溶液中加入等量的酶液,按照1.3.5节方法测定酶活。根据双倒数作图法以底物浓度的倒数为横坐标,以酶比活力的倒数为纵坐标作图,直线的斜率为K
m/V
max,截距为1/V
max,计算以可溶性淀粉为底物时的米氏常数K
m、最大反应速度V
max和反应常数k
cat。
将酶液分别于90、100 ℃保温,分时间梯度取出部分样品,根据如上反应体系测定酶比活力。将未处理酶液的酶比活力定义为100%,并以相对酶活(%)对时间作图,评价酶的热稳定性。
1.3.7 氨基酸序列分析和同源模建
通过BLASTP搜索比对,找出与ApkA在氨基酸序列上高度相似的蛋白质。采用ClustalW2程序对这些蛋白质进行氨基酸序列比对。采用 Swiss-Model(http:// swissmodel.expasy.org)对α-淀粉酶ApkAds和突变体ApkAdsA180K进行三维模建,采用三维图像软件PyMOL v0.99显示蛋白质的三级结构,并进行氨基酸残基之间相互作用分析。
1.4 数据统计分析
α-淀粉酶的酶学性质研究实验中,每个实验做3 个平行。运用软件SigmaPlot 11.0对实验数据进行统计分析并作图,数据均以±s表示。
2 结果与分析
2.1 定点突变位点的选择
采用BLASTP分析ApkA的氨基酸序列,结果表明ApkA与来源于不同极端嗜热古生菌的α-淀粉酶PFA、TH_amy1、TO_amy1分别具有89%、86%、86%的氨基酸序列相似性。其中PFA具有最强的热稳定性,其最适反应温度高达100 ℃,于98 ℃的半衰期长达13 h
[18]。PFA中位于酶分子的保守区域Ⅰ和保守区域Ⅱ之间的Ca
2+结合位点对于PFA维持高温活性和热稳定性非常重要
[19-20]。该Ca
2+结合位点在ApkA中是保守的,并且Tachibana等
[14]发现额外补加的Ca
2+有利于提高ApkA的热稳定性,因此ApkA含有可能的Ca
2+结合位点。PFA的三级结构显示位于该Ca
2+结合位点附近的氨基酸残基K180与D212间离子键有利于维持其结构的紧密性和稳定性
[19]。本研究设计ApkA中氨基酸残基A180为突变位点,构建点突变体ApkAdsA180K,探讨A180K点突变对ApkA的高温活性和热稳定性的影响。
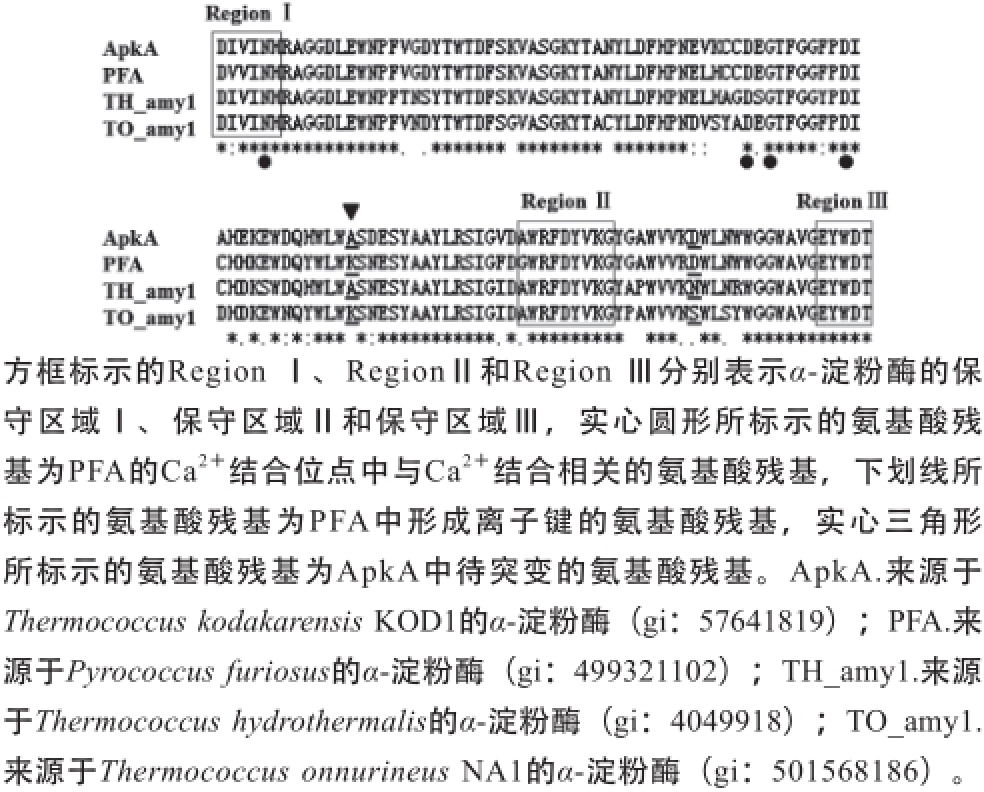
图1 ApkA与其他α-淀粉酶的氨基酸序列比对结果
Fig. 1 Amino acid sequence comparison between ApkA and other three α-amylases
2.2 重组质粒的酶切鉴定
采用化学合成法合成极端嗜热α-淀粉酶ApkA的基因ApkA,将基因ApkA连接至载体pUC57构建质粒pUC57-ApkA。以质粒pUC57-ApkA为模板,采用PCR方法扩增目标片段ApkAds,连接至载体pET28a,构建质粒pET28a-ApkAds。在质粒pET28a-ApkAds的基础上,采用定点突变技术构建质粒pET28a-ApkAdsA180K。采用限制性内切酶NcoⅠ和EcoRⅠ酶切质粒pET28a-ApkAds和pET28a-ApkAdsA180K,得到大小分别约为5.4 kb和1.3 kb的两个片段(图2)。分别转化大肠杆菌BL21-CodonPlus(DE3)-RIL,获得重组大肠杆菌并进行诱导表达。经超声波破碎细胞后,对重组α-淀粉酶进行SDS-PAGE检测。如图3所示,目的蛋白质ApkAds和ApkAdsA180K的分子质量均约为45 kD,大小与理论值一致。采用Ni
2+亲和层析柱纯化位于重组大肠杆菌的细胞可溶成分中的目的蛋白质,得到纯化后的重组α-淀粉酶ApkAds和ApkAdsA180K。

图2 重组质粒的酶切鉴定
Fig. 2 Restriction enzyme digestion pattern of recombinant plasmid vectors
2.3 重组α-淀粉酶的诱导表达与纯化
将重组质粒pET28a-ApkAds和pET28a-ApkAdsA180K

图3 重组α-淀粉酶的SDS-PAGE检测图
Fig. 3 SDS-PAGE analysis of recombinant α-amylases
2.4 ApkAds和ApkAdsA180K的酶学性质比较
2.4.1 pH值对重组α-淀粉酶相对酶活的影响
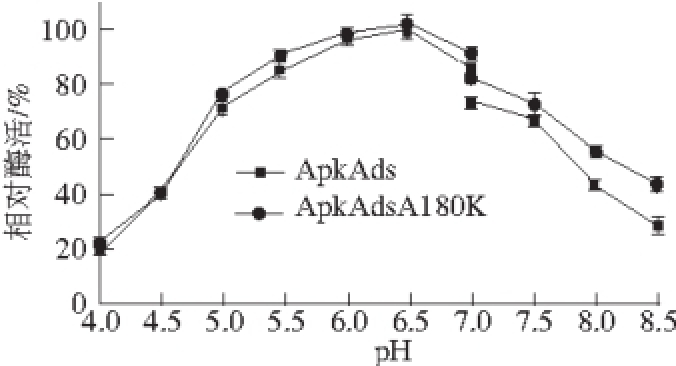
图4 pH值对相对酶活的影响
Fig. 4 pH dependence of α-amylase activity
以1%可溶性淀粉为底物,于不同pH值条件下测定重组α-淀粉酶ApkAds和ApkAdsA180K的相对酶活,结果如图4所示。ApkAds与突变体ApkAdsA180K的最适反应pH值均约为6.5,于pH 4.5~8之间可保持40%以上的相对酶活,即ApkA中A180K点突变未导致其反应pH值发生明显改变。
2.4.2 温度对重组α-淀粉酶比活力的影响

图5 温度对酶比活力的影响
Fig. 5 Temperature dependence of α-amylase activity
以1%可溶性淀粉为底物,于不同温度条件下测定重组α-淀粉酶ApkAds和ApkAdsA180K的酶比活力,结果如图5所示。ApkAds的最适反应温度为90 ℃,在此温度条件下的酶比活力为2 946.75 U/mg,并且在60~100 ℃间ApkAds可保持60%以上的相对酶活;突变体ApkAdsA180K的最适反应温度为100 ℃,在此温度条件下的酶比活力为4 501.08 U/mg,并且在40~110 ℃间其酶比活力均明显高于野生型ApkAds。即与ApkAds相比,突变体ApkAdsA180K的最适反应温度和酶比活力均明显提高。
2.4.3 重组α-淀粉酶的动力学参数
表2 90 ℃重组α-淀粉酶的动力学参数
Table2 Kinetic parameters of recombinant α-amylases at 900 ℃

α-淀粉酶K
m/(mg/mL)k
cat/s
-1k
cat/K
m/(mL/(mg·s))ApkAds0.69±0.084.37×10
36.33×10
3ApkAdsA180K0.63±0.056.65×10
310.56×10
3
以不同质量分数的可溶性淀粉溶液为底物,于90 ℃测定重组α-淀粉酶的酶比活力。根据双倒数作图法以底物浓度的倒数为横坐标,以酶比活力的倒数为纵坐标作图,直线的斜率为K
m/V
max,截距为1/V
max。根据得到的斜率和截距以及重组α-淀粉酶的酶质量浓度,即可计算出以可溶性淀粉为底物时的米氏常数K
m和反应常数k
cat。如表2所示,与野生型ApkAds相比,90 ℃突变体ApkAdsA180K的K
m未明显改变,其k
cat值提高约1.52 倍。即突变体ApkAdsA180K的底物结合能力未明显改变,以可溶性淀粉为底物时的反应速率明显提高。
2.4.4 重组α-淀粉酶的热稳定性
将重组α-淀粉酶于90 ℃或100 ℃分别保温不同的时间,测定其相对酶活,比较重组α-淀粉酶ApkAds和ApkAdsA180K的热稳定性。如图6所示,在90 ℃和100 ℃的条件下,突变体ApkAdsA180K的热稳定性均高于野生型ApkAds的热稳定性。其中ApkAds于90 ℃的半衰期约为5 h,ApkAdsA180K于90 ℃的半衰期约为7 h。于90 ℃保温7 h后,ApkAdsA180K的相对酶活约为51.50%,ApkAds的相对酶活仅为26.71%;此外,于100 ℃保温10 min后,ApkAds保持约29.04%的相对酶活,ApkAdsA180K的相对酶活为66.99%。

图6 90 ℃(A)和100 ℃(B)重组α-淀粉酶的热稳定性
Fig. 6 Thermal stability of α-amylases at 90 and 100 ℃
2.4.5 α-淀粉酶三维结构的同源模建
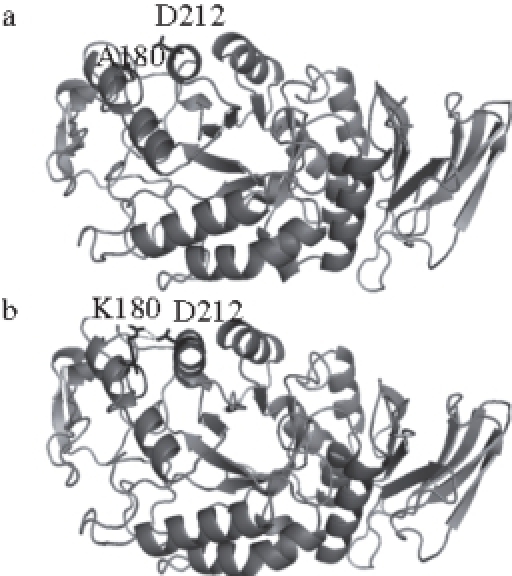
图7 重组α-淀粉酶ApkAds(a)和ApkAdsA1800KK(bb)三维结构模建后突变位点的比较
Fig. 7 Comparison of 3D structures of ApkAds and ApkAdsA180K
经BLASTP分析ApkA的氨基酸序列得知,ApkA与PFA具有89%的氨基酸序列相似性。以PFA的三级结构(1MWO)为模板,采用 Swiss-Model对α-淀粉酶ApkAds和突变体ApkAdsA180K进行三维模建,得到这两种α-淀粉酶的三级结构,结果如图7所示。ApkAds和突变体ApkAdsA180K的三级结构基本相同,在突变体ApkAdsA180K中,第180位氨基酸残基由Ala突变为Lys。采用PyMOL v0.99分析蛋白质三级结构中氨基酸残基A180(或K180)与D212之间相互作用,结果显示突变体ApkAdsA180K中K180与D212间存在离子键。
3 讨 论
目前淀粉液化工艺的几个主要缺点是105 ℃条件下淀粉酶活的丧失、pH值的反复调节、Ca
2+的添加,以及随之而产生的温度和pH值的调节、Ca
2+的添加和排除等复杂的后续处理工艺
[8-9]。针对目前淀粉液化工艺中所存在的问题,特别是常用α-淀粉酶所存在的不足,国内外对α-淀粉酶的研究和开发的主要目标是获得耐高温、低pH值并且不依赖于Ca
2+的高温酸性α-淀粉酶。国内外学者主要是通过以下两种途径以求获得更适用于淀粉液化工艺的α-淀粉酶
[11-12]:1)对现有的α-淀粉酶进行有关提高酶分子热稳定性的分子改造;2)寻找新的热稳定性较好的α-淀粉酶。针对极端嗜热α-淀粉酶的开发及应用研究,不仅可以为淀粉工业提供具有优良性质的α-淀粉酶,而且有关其高温适应机制的研究也将为构建具有优良高温活性和热稳定性的α-淀粉酶提供新的理论依据和设计思路。
极端嗜热α-淀粉酶的高温适应性机制符合极端嗜热蛋白质高温适应性机制的一般规律,包括增强非共价作用力、提高二级结构的稳定性、减少溶剂可及的疏水表面、提高酶分子结构的紧凑性、结合金属离子等因素
[21]。Linden等
[22]通过对比极端嗜热α-淀粉酶PFA与其他低温、中温微生物来源的α-淀粉酶的分子结构发现,PFA分子结构的紧凑性、离子键、Ca
2+-Zn
2+双金属离子结合位点对于其维持热稳定性非常重要。其中位于PFA中Ca
2+结合位点附近的K180-D212离子键有利于维持其结构紧密性和稳定性。大多数α-淀粉酶属于糖苷水解酶类的第13家族
[3],具有第13家族酶分子结构上的共同特征,这有利于参照其他α-淀粉酶的结构特征对某些α-淀粉酶进行分子改造。例如,Ghollasi等
[23]通过分析来源于Bacillus megaterium WHO的α-淀粉酶氨基酸序列,对其Ca
2+结合位点进行改造,获得了最适反应温度提高5 ℃的突变体H77E。姚婷等
[24]通过对比来源于极端嗜热古生菌Thermococcus siculi HJ21的α-淀粉酶TSAM及与其同源性较高的α-淀粉酶的氨基酸序列,对TSAM进行定点突变,获得了催化活性和热稳定性均得到提高的突变体TSAM-23。柯涛等
[25]向高温酸性α-淀粉酶BD5088中引入一对二硫键,获得了100 ℃酶活力和酶活力半衰期均提高约1倍的突变体BD5088C2。
本研究通过对比ApkA和与其同源性较高的极端嗜热α-淀粉酶的氨基酸序列,选取第180位丙氨酸为突变位点,采用定点突变技术构建了突变体ApkAdsA180K。通过比较突变体与野生型的高温活性和热稳定性,发现该位点影响到ApkAds的高温活性和热稳定性。突变体ApkAdsA180K的高温活性和稳定性均得到提高,其最适反应温度由90 ℃提高至100 ℃,90 ℃的酶比活力提高约1.41 倍,100 ℃的酶比活力提高约2.10倍,于90 ℃的半衰期由5 h延长至7 h。此外,重组α-淀粉酶的动力学参数分析显示,突变体ApkAdsA180K结合可溶性淀粉的能力未发生明显变化,其降解可溶性淀粉的反应速率明显提高。蛋白质的三级结构显示,ApkAdsA180K中K180与D212之间形成了离子键。离子键K180-D212可能影响了该区域的结构特征,从而使得突变体ApkAdsA180K的反应速率和热稳定性都有所提高。本研究构建得到的突变体ApkAdsA180K的高温活性和稳定性达到了淀粉液化工艺对α-淀粉酶耐热性的要求,有利于α-淀粉酶的工业化应用。接下来的研究可在该突变体的基础上进一步选择突变位点,来提高其低pH值的酶活等酶学性质,从而逐步达到淀粉液化工艺的要求。
参考文献 :
[1] RANA N, WALIA A, GAUR A. α-Amylases from microbial sources and its potential applications in various industries[J]. National Academy Science Letters, 2013, 36(1): 9-17. DOI:10.1007/s40009-012-0104-0.
[2] SHARMA A, SATYANARAYANA T. Microbial acid-stable α-amylases: characteristics, genetic engineering and applications[J]. Process Biochemistry, 2013, 48(2): 201-211. DOI:10.1016/ j.procbio.2012.12.018.
[3] JANEČEK Š, SVENSSON B, MACGREGOR E A. α-Amylase: an enzyme specificity found in various families of glycoside hydrolases[J]. Cellular and Molecular Life Sciences, 2014, 71(7): 1149-1170. DOI:10.1007/s00018-013-1388-z.
[4] SOUZA P M. Application of microbial α-amylase in industry: a review[J]. Brazilian Journal of Microbiology, 2010, 41(4): 850-861. DOI:10.1590/S1517-83822010000400004.
[5] KUMARI A, SINGH K, M KAYASTHA A. α-Amylase: general properties, mechanism and biotechnological applications-a review[J]. Current Biotechnology, 2012, 1(1): 98-107. DOI:10.2174/221155 1X11201010098.
[6] ATOMI H, SATO T, KANAI T. Application of hyperthermophiles and their enzymes[J]. Current Opinion in Biotechnology, 2011, 22(5): 618-626. DOI:10.1016/j.copbio.2011.06.010.
[7] GUPTA R, GIGRAS P, MOHAPATRA H, et al. Microbial α-amylases: a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11): 1599-1616. DOI:10.1016/S0032-9592(03)00053-0.
[8] PRAKASH O, JAISWAL N. α-Amylase: an ideal representative of thermostable enzymes[J]. Applied Biochemistry and Biotechnology, 2010, 160(8): 2401-2414. DOI:10.1007/s12010-009-8735-4.
[9] KONSOULA Z, LIAKOPOULOU-KYRIAKIDES M. Co-production of α-amylase and β-galactosidase by Bacillus subtilis in complex organic substrates[J]. Bioresource Technology, 2007, 98(1): 150-157. DOI:10.1016/j.biort ech.2005.11.001.
[10] ZHOU W, YOU C, MA H, et al. One-pot biosynthesis of highconcentration α-glucose 1-phosphate from starch by sequential addition of three hyperthermophilic enzymes[J]. Journal of Agri cultural and Food Chemistry, 2016, 64(8): 1777-1783. DOI:10.1021/acs. jafc.5b05648.
[11] DALMASO G Z L, FERREIRA D, VERMELHO A B. Marine extremophiles: a source of hydrolases for biotechnological applications[J]. Marine Drugs, 2015, 13(4): 1925-1965. DOI:10.3390/ md13041925.
[12] UNSWORTH L D, van der OOST J, KOUTSOPOULOS S. Hyperthermophilic enzymes-stability, activity and implementation strategies for high temperature applications[J]. FEBS Journal, 2007, 274(16): 4044-4056. DOI:10.1111/j.1742-4658.2007.05954.x.
[13] 曾静, 郭建军, 邱小忠, 等. 极端嗜热微生物及其高温适应机制的研究进展[J]. 生物技术通报, 2015(9): 30-37. DOI:10.13560/j.cnki. biotech.bull.1985.2015.09.005.
[14] TACHIBANA Y, LECLERE M M, FUJIWARA S, et al. Cloning and expression of the α-amylase gene from the hyperthermophilic archaeon Pyrococcus sp. KOD1, and characterization of the enzyme[J]. Journal of Fermentation and Bioengineering, 1996, 82(3): 224-232. DOI:10.1016/0922-338X(96)88812-X.
[15] GREEN M R, SAMBROOK J. Molecular cloning: a laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press, 2012. [16] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[17] BERNFELD P. Amylases, α and β[J]. Methods in Enzymology, 1955, 1: 149-158.
[18] J☒RGENSEN S, VORGIAS C E, ANTRANIKIAN G. Cloning, sequencing, characterization, and expression of an extracellular α-amylase from the hyperthermophilic archaeon Pyrococcus furiosus in Escherichia coli and Bacillus subtilis[J]. Journal of Biological Chemistry, 1997, 272(26): 16335-16342. DOI:10.1074/ jbc.272.26.16335.
[19] LINDEN A, MAYANS O, MEYER-KLAUCKE W, et al. Differential regulation of a hyperthermophilic α-amylase with a novel (Ca, Zn) two-metal center by zinc[J]. Journal of Biological Chemistry, 2003, 278(11): 9875-9884. DOI:10.1074/jbc.M211339200.
[20] SAVCHENKO A, VIEILLE C, KANG S, et al. Pyrococcus furiosus α-amylase is stabilized by calcium and zinc[J]. Biochemistry, 2002, 41(19): 6193-6201. DOI:10.1021/bi012106s.
[21] HITESHI K, GUPTA R. Thermal adaptation of α-amylases: a review[J]. Extremophiles, 2014, 18(6): 937-944. DOI:10.1007/s00792-014-0674-5.
[22] LINDEN A, WILMANNS M. Adaptation of class-13 α-amylases to diverse living conditions[J]. ChemBioChem, 2004, 5(2): 231-239. DOI:10.1002/cbic.200300734.
[23] GHOLLASI M, GHANBARI-SAFARI M, KHAJEH K. Improvement of thermal stability of a mutagenised α-amylase by manipulation of the calcium-binding site[J]. Enzyme and Microbial Technology, 2013, 53(6): 406-413. DOI:10.1016/j.enzmictec.2013.09.001.
[24] 姚婷, 李华钟, 房耀维, 等. 定点突变提高Thermococcus siculi HJ21高温酸性α-淀粉酶的催化活性[J]. 食品科学, 2011, 32(15): 148-152.
[25] 柯涛, 刘征, 杨建伟, 等. A154C/G155C双点突变对嗜热耐酸淀粉酶酶活性及热稳定性的影响[J]. 食品科学, 2012, 33(3): 207-211.
Improvement of the Thermal Activity and Stability of Hyperthermophilic α-Amylase ApkA by Site-Directed Mutagenesis
ZENG Jing, GUO Jianjun, YUAN Lin*
(Institute of Microbiology, Jiangxi Academy of Sciences, Nanchang 330096, China)
Abstract:Hyperthermophilic α-amylases, which are active and stable at high temperatures, are of great interest for researchers studying starch liquefaction. Research into the molecular basis of thermal adaptation of hyperthermophilic α-amylase can provide theoretical guidance to improve the thermal activity and thermal stability of α-amylases. Based on the sequence analysis of hyperthermophilic α-amylase ApkA from Thermococcus kodakarensis KOD1, a signal peptide deleted mutant (ApkAds) and an A180K site mutant (ApkAdsA180K) were constructed. Compared with ApkAds, the mutant ApkAdsA180K exhibited a sharp increase in thermal activity and stability. The optimal temperature of ApkA was 90 ℃ and the corresponding specif c activity was 2 946.75 U/mg, while the optimal temperature of the mutant was 100 ℃ and the corresponding specif c activity was 4 501.08 U/mg. When incubated at 90 ℃, ApkAds and the mutant exhibited half-lives of 5 h and 7 h, respectively. The tertiary structure of ApkAdsA180K obtained by homologous modeling indicated that K180 and D212 are involved in salt bridge formation. These results suggest that the salt bridge between K180 and D212 plays an important role in maintaining the thermal activity and stability of ApkAdsA180K.
Key words:hyperthermophilic α-amylase; salt bridge; site-directed mutagenesis; thermal activity; thermal stability
DOI:10.7506/spkx1002-6630-201702004
中图分类号:Q814
文献标志码:A
文章编号:1002-6630(2017)02-0020-07
引文格式:
曾静, 郭建军, 袁林. 定点突变提高极端嗜热α-淀粉酶ApkA的高温活性和热稳定性[J]. 食品科学, 2017, 38(2): 20-26. DOI:10.7506/spkx1002-6630-201702004. http://www.spkx.net.cn
ZENG Jing, GUO Jianjun, YUAN Lin. Improvement of the thermal activity and stability of hyperthermophilic α-amylase ApkA by site-directed mutagenesis[J]. Food Science, 2017, 38(2): 20-26. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702004. http://www.spkx.net.cn
收稿日期:2016-04-11
基金项目:国家自然科学基金青年科学基金项目(31501422);江西省青年科学基金项目(20151BAB214001);江西省科学院资助项目(2014-YYB-08;2014-XTPH1-08)
作者简介:曾静(1986—),女,助理研究员,博士,研究方向为极端嗜热酶的开发与应用。E-mail:zengjingwhu@126.com
*通信作者:袁林(1980—),男,副研究员,博士,研究方向为工业微生物的应用。E-mail:yuanlincn2003@aliyun.com








