
图1 蓝莓花色苷单体纯化制备的工艺流程Fig. 1 Schematic illustration of the purification and preparation of blueberry anthocyanin monomers
刘静波,陈晶晶,王二雷*,刘彦君
(吉林大学食品科学与工程学院,吉林 长春 130062)
摘 要:为充分开发蓝莓果实的潜在应用价值,主要采用柱色谱法及半制备高效液相色谱法系统研究蓝莓果实中花色苷(花青素的糖苷形式)单体的制备技术。蓝莓花色苷粗提液经超声辅助浸提、乙酸乙酯萃取2 次,能够促进花色苷类物质的溶出,并有效去除溶液中的黄酮类杂质。经Amberlite XAD-7HP大孔树脂层析、Sep-Pak C 18固相萃取,所得蓝莓花色苷粗品的纯度为62.49%。经Sephadex LH-20凝胶色谱柱分离,获得的3种花色苷纯化组分纯度在65%~75%之间。运用半制备型高效液相色谱技术从3 种花色苷纯化组分中制备出两种蓝莓果实中含量较低的半乳糖苷化的花色苷单体,经分析型高效液相色谱鉴定为飞燕草素-3-O-半乳糖苷和锦葵色素-3-O-半乳糖苷,纯度分别为96.98%和95.63%。本研究为花色苷单体的规模化生产提供了技术参考,同时为实现蓝莓花青素高附加值产品的生产提供良好理论依据。
关键词:蓝莓;花色苷;柱层析;半制备型高效液相色谱法;分离纯化
花青素又称花色素,是一类水溶性天然色素,广泛存在于多种植物中,常与多种糖类结合形成花色苷形式,属类黄酮类化合物 [1]。花青素抗氧化能力强,能有效地清除人体内自由基,具有延缓衰老,增强机体免疫力的功效;花青素除具有极强的抗氧化作用外,还具有保护视力、抗肿瘤、改善老年痴呆、预防骨质疏松、改善肥胖等多种生理活性功能 [2-4]。
蓝莓为多年生灌木,原产于北美洲,在我国又称为越橘、都柿,为杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)被子植物。我国蓝莓主要分布于大、小兴安岭以北的林区地带,为世界上少有的蓝色纯野生浆果。蓝莓果实中含有多种营养成分,如VA、熊果苷、花青素 [5]、食用纤维及多种矿物质等。蓝莓中所含花青素的量居于水果和蔬菜之首,被联合国粮农组织誉为“黄金浆果”。
近年来,随着国内外学者对富含花青素的蓝莓研究的不断深入,如何从蓝莓果实中高效分离纯化花青素单体已成为天然花青素研究的热点之一。花青素的人工合成途径普遍存在工艺复杂、产率低、安全性差等缺点,从自然界植物中分离得到的花青素不仅降低了生产成本,而且简便、安全性高。常见的花青素提取方法主要有萃取、浸提、酶解、超声波和微波等 [6]。常用于纯化花青素的技术主要有:固相萃取技术、柱层析技术、液相色谱技术、高速逆流色谱技术等 [7-11]。但目前大多数研究局限于蓝莓花色苷粗提物的制备及功能活性研究,并未较好地实现花色苷单体的分离。迄今,自然界中已探明的花青素种类有23种,与糖苷结合所形成的花色苷单体多达500余种 [12],现已发现蓝莓果实中花色苷单体约为16种。本实验主要采用超声辅助浸提、液液萃取、固相萃取、层析分离、半制备高效液相色谱等技术,旨在制备高纯度的花色苷单体,为后期工业化生产及应用奠定基础。
1.1 材料与试剂
1.1.1 原料
野生蓝莓果实(采摘地点:吉林省长白山地区,东经127°40’~128°16’,北纬41°35’~42°25’之间的地带;采摘时间:2014年8—9月份;保存方式:采摘后于冰箱内冷冻);矢车菊素-3-O-葡萄糖苷标准品(cyanidin-3-O-glucoside,纯度>97%,相对分子质量448.2) 美国Sigma公司。
1.1.2 试剂
甲醇(色谱纯)、Amberlite XAD-7HP大孔树脂、Sephadex LH-20羟丙基葡聚糖凝胶树脂 美国Sigma公司;Sep-Pak C 18固相萃取柱 美国Waters公司;其他试剂均为分析纯 北京化工厂;高效液相色谱用水为超纯水。1.2 仪器与设备
UV-2550紫外-可见光分光光度计、LC-6AD半制备高效液相色谱仪(色谱柱:Shim-pack PREP-ODS(H) KIT(20 mm×25 cm,5 μm))、分析型高效液相色谱仪(二极管阵列检测器)(色谱柱:Shimpack VP-ODS(4.6 mm×150 mm,5 μm)) 日本岛津公司;CXG-1电脑恒温层析柜(配备HL-2型恒流泵、BS-16A自动部分收集器等设备) 上海青浦沪西仪器厂。1.3 方法
1.3.1 蓝莓花色苷浸提液的制备
蓝莓花色苷浸提液的制备主要分为超声、离心、抽滤、萃取、浓缩等步骤 [13],具体操作见图1。

图1 蓝莓花色苷单体纯化制备的工艺流程Fig. 1 Schematic illustration of the purification and preparation of blueberry anthocyanin monomers
准确称取500 g的冷冻野生蓝莓果实,经组织粉碎,置于1 000 mL体积分数为70%的乙醇(含0.1%的盐酸)溶液中超声浸提(35 ℃,60 min),离心(3 000 r/min,15 min,15 ℃),抽滤,回收滤渣并重复超声浸提一次,两次滤液合并后旋转蒸发至100 mL左右,将旋转蒸发后液体与乙酸乙酯按1∶2的比例避光萃取12 h,重复萃取2 次,收集萃取后水层部分,即得蓝莓花色苷水层浓缩液。
1.3.2 蓝莓花色苷粗提物的柱色谱分离制备工艺
蓝莓花色苷粗提物的柱色谱分离主要分为Amberlite XAD-7HP大孔树脂层析分离、Sep-Pak C 18固相萃取分离和Sephadex LH-20凝胶色谱分离 [14]。准确量取蓝莓花色苷水层浓缩液30 mL,注入Amberlite XAD-7HP大孔树脂柱(2.6 cm×60 cm)中充分吸附,依次用酸化的去离子水(含0.01%HCl)、30%乙醇溶液(含0.01% HCl)和80%乙醇溶液(含0.01% HCl)洗脱,洗脱流速均为1.5 mL/min,收集30%洗脱液并浓缩。将浓缩后的洗脱液上Sep-Pak C 18固相萃取小柱,分别用酸化的去离子水、50%乙醇溶液(含0.01% HCl)洗脱,洗脱流速均为0.5 mL/min,收集洗脱液并浓缩。将浓缩液上Sephadex LH-20凝胶柱(2.6 cm×60 cm),考察流速分别为0.5、1.0、1.5、2.0 mL/min时,对不同花色苷组分分离效果的影响。采用自动部分收集器分管收集不同时间段的洗脱液(10 mL/管),根据分光光度计的检测结果分段合并洗脱液,将不同段的洗脱液减压浓缩干燥,制得3种紫红色蓝莓花色苷粗提物粉末,分别为组分1、2和3。
1.3.3 蓝莓花色苷单体制备
准确称取3 种蓝莓花色苷组分各10 mg,置于试管中,加入3%甲酸溶液超声溶解5 min,定容至10 mL,经0.45 μm的微孔滤膜过滤后进样,进行半制备高效液相色谱分离,根据色谱图中单体出峰时间收集不同单体的洗脱液,多次进样,收集并合并同一单体的洗脱液,减压浓缩至干燥,即得花色苷单体。半制备型高效液相色谱条件 [15]见表1。1.3.4 蓝莓花色苷单体种类分析鉴定
表1 分析型与半制备型高效液相色谱参数条件比较结果
Table1 Comparison between analytical and semi-preparative HPLC parameters
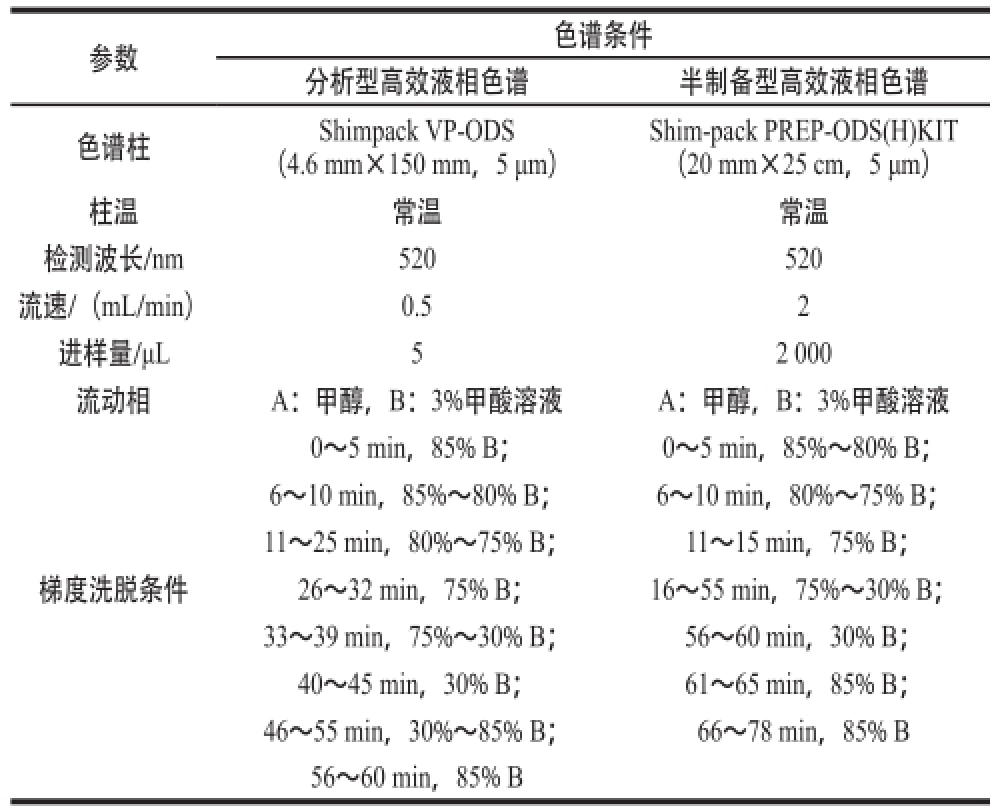
Shim-pack PREP-ODS(H)KIT(20 mm×25 cm,5 μm)柱温常温常温检测波长/nm520520流速/(mL/min)0.52进样量/μL52 000流动相A:甲醇,B:3%甲酸溶液A:甲醇,B:3%甲酸溶液0~5 min,85% B;0~5 min,85%~80% B;6~10 min,85%~80% B;6~10 min,80%~75% B;11~25 min,80%~75% B; 11~15 min,75% B;梯度洗脱条件26~32 min,75% B; 16~55 min,75%~30% B;33~39 min,75%~30% B;56~60 min,30% B;40~45 min,30% B;61~65 min,85% B;46~55 min,30%~85% B;66~78 min,85% B 56~60 min,85% B参数色谱条件分析型高效液相色谱半制备型高效液相色谱色谱柱Shimpack VP-ODS(4.6 mm×150 mm,5 μm)
准确称取1 mg待测样品,于10 mL的50%甲醇(色谱级)溶液中超声溶解5 min,0.45 μm滤膜过滤至液相进样小瓶,进行高效液相色谱分析。分析型高效液相色谱条件 [16]详见表1。
1.3.5 蓝莓花色苷样品的纯度测定
蓝莓果实花色苷样品纯度测定采用pH值示差法 [17]。1.4 数据统计分析
实验所得数据均为平行实验3次取平均值,表示方法为
 ±s,采用Excel和Origin 8.5软件进行数据分析和作图。
±s,采用Excel和Origin 8.5软件进行数据分析和作图。
2.1 蓝莓花色苷提取及萃取实验结果
蓝莓果实中富含多种营养物质,除含丰富的花色素类物质外,还含有水溶性还原糖类、有机酸和维生素,钙、铁、锌、铜等矿物质元素,VE、VA等脂溶性维生素,以及黄酮类、多糖和蛋白质类。花色苷具有极强的生物活性,然而蓝莓果实中非花色苷类物质的存在降低了花色苷质量浓度,这可能干扰或降低其生物活性。前期已研究 [15]蓝莓果实中花色苷的提取工艺,但主要以静态浸取为主,本实验考虑到静态浸提的不充分性,将工艺进行了改进,增加了超声、离心等步骤,使浸提、萃取过程一体化完成,以充分溶出细胞内的花色苷,缩短提取工艺周期,为后期工业化生产花色苷提供了技术参考。经过超声和离心处理的蓝莓花色苷浸提液中花色苷浓度明显提高(图2A),未经超声离心的浸提液中花色苷质量浓度非常低。此外,浸提时间相同的条件下,超声、离心操作对520 nm波长物质(花色苷类)质量浓度影响较大,而对360 nm的物质(黄酮类)质量浓度未有明显作用。超声和离心操作有助于蓝莓果中花色素类物质的析出,较之传统的冷浸法,大大缩短了浸提时间,增大了花色苷的溶出率。
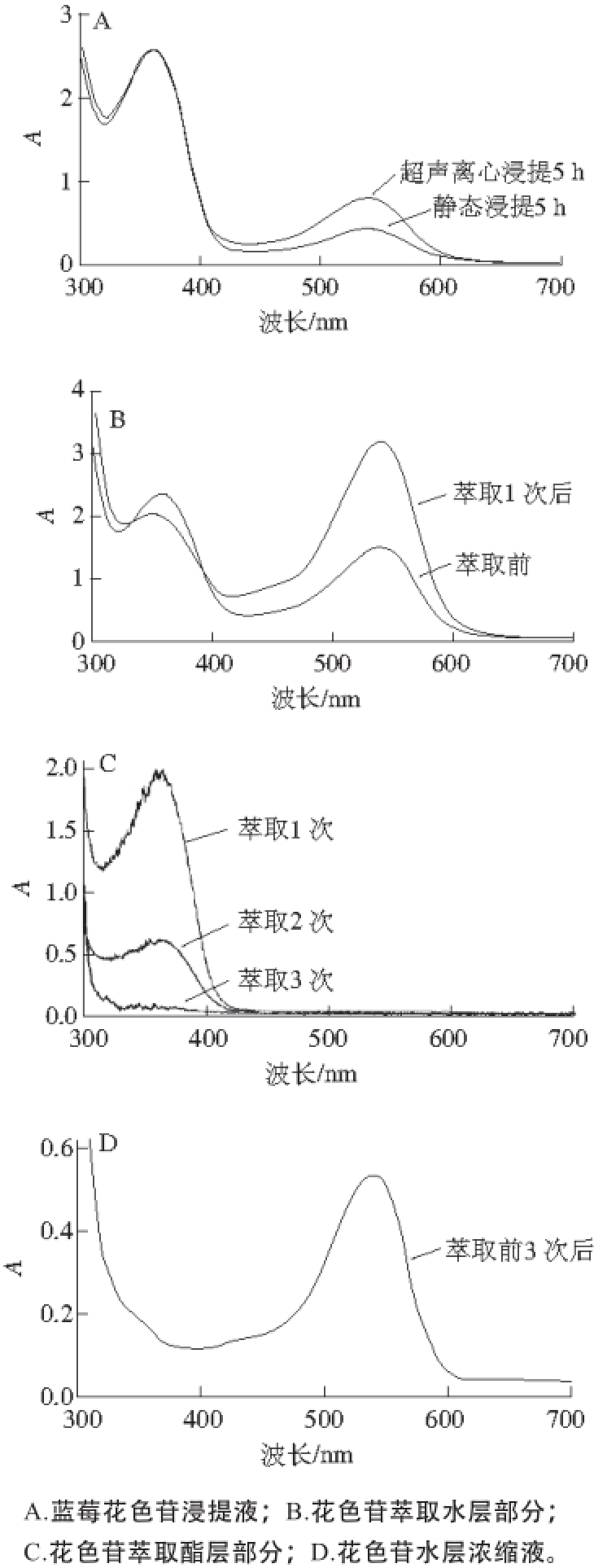
图2 蓝莓花色苷浸提过程中不同提取液的紫外-可见吸收光谱
Fig. 2 UV-vis spectra of blueberry anthocyanin extract and its different solvent fractions
花色苷类物质最大吸收波长约为520 nm,黄酮类杂质在360 nm左右有最大吸收波长,由图2B可知,花色苷浸提液经乙酸乙酯萃取前,黄酮类杂质吸收峰明显高于花色苷类特征吸收峰;萃取1次后,浸提液中花色苷特征峰明显高于黄酮类杂质的吸收峰,说明,乙酸乙酯能有效除去花色苷浸提液中一定量的黄酮类杂质;经过1 次萃取,从乙酸乙酯层检测出大量黄酮类杂质(图2C),萃取2次时仍有部分黄酮类物质持续溶解在乙酸乙酯层,但较萃取1次的黄酮溶出量有明显减少,萃取3次时黄酮类物质几乎未溶出。本实验通过提高乙酸乙酯体积比例(乙酸乙酯与旋转蒸发后液体由初期1∶1提高到2∶1),经过2 次萃取后,可以将浸提液中大部分黄酮类物质除去,且能够达到初期3 次萃取的理想程度,极大地缩短了浸提液萃取时间。图2D表明,蓝莓花色苷水层浓缩液中黄酮类杂质几乎完全被除去,也表明了萃取步骤的有效性。
2.2 蓝莓花色苷的柱色谱分离结果
蓝莓花色苷浓缩液经浸提、萃取操作后虽除去了绝大部分黄酮杂质,但其中仍含有大量水溶性糖类、蛋白质以及部分极性黄酮类杂质。因此,本实验采用柱层析技术结合固相萃取技术对花色苷浓缩液进一步纯化,分别为Amberlite XDA-7HP大孔树脂纯化、Sep-Pak C 18固相萃取柱和LH-20凝胶色谱分离过程 [18],最终达到充分富集花色苷组分的目的。结合课题组前期研究基础,对原有工艺做出以下调整:1)降低大孔树脂层析过程中的乙醇洗脱体积分数(由35%降至30%),收集30%酸化乙醇洗脱液,降低洗脱液体积分数有助于减少非花色苷黄酮被洗脱下来的可能,从而间接促进花色苷的纯化。2)降低LH-20凝胶色谱柱洗脱体积分数,以20%酸化乙醇作为最佳洗脱体积分数,这有助于实现水溶性花色素类的分离。
蓝莓果实中花色苷单体的鉴定主要依据3 种方法:1)基于高效液相色谱-质谱联用技术测得不同液相单体峰对应的一级、二级质谱离子,如图3A中峰1、3、6、9、12对应一级/二级质谱离子质荷比(m/z)分别为465/303、449/287、463/301、479/317、493/331;2)基于花青素在色谱柱上的保留时间先后顺序,如飞燕草素<矢车菊素<牵牛花素<芍药色素<锦葵色素,花青素半乳糖苷形式<花青素其他糖苷形式;3)基于已有相关文献报道 [19],结合前期实验对长白山野生蓝莓果实中花色苷单体鉴定结果 [15,20],从中共鉴定出16 种花色苷单体(图3A)。通过比较野生蓝莓花色苷浓缩液(图3A)与Amberlite XAD-7HP大孔树脂纯化液(图3B)及固相萃取液(图3C)的高效液相色谱-二极管阵列检测器色谱图发现,三者均含有16 种蓝莓花色苷单体,经过大孔树脂层析及固相萃取后,花色苷单体种类没有明显改变,层析纯化前后,花色苷单体间的含量比例略有差异。这说明层析纯化过程中并没有改变野生蓝莓果实中花色苷单体的原始构成。利用pH值示差法分别对不同纯化步骤后的样品进行纯度分析后,得出,经大孔树脂纯化后的花色苷样品纯度为50.52%,经固相萃取后的蓝莓花色苷样品纯度为62.49%,说明经过固相萃取能显著提高花色苷纯度,为后期花色苷单体的制备提供了必备条件。

图3 不同蓝莓花色苷纯化液在波长520 nm条件下的高效液相色谱图
Fig. 3 Analytical HPLC chromatograms of different purified blueberry anthocyanin solutions at 520 nm
Sephadex LH-20是一种葡聚糖凝胶,具备纯化过滤、反相分配和吸附层析3 种特性。在目标物洗脱过程中,利用凝胶过滤作用,大分子物质首先被洗脱下来,小分子物质由于保留作用比大分子物质强,洗脱时间延长,最后被洗脱出柱。利用LH-20的这种结构特性,来实现花色苷组分分离的目的。凝胶色谱层析过程中,洗脱流速是色谱柱层析的一项重要影响因素。经Sephadex LH-20凝胶柱分离后,可以看到样品被大致分成3 段(图4),利用自动部分收集器收集洗脱液,根据不同试管中收集液在波长520 nm处吸光度变化趋势绘制吸光度随时间变化的曲线。为获得极性较大的花色苷单体,采用20%(含0.01% HCl)乙醇溶液进行洗脱,并考察洗脱流速对花色苷单体分离的影响。当洗脱剂的极性不变时,花色苷单体的洗脱主要以凝胶过滤作用为主。由图4可知,当洗脱流速从0.5 mL/min增大到2 mL/min时,组分1的分离效果受流速的影响较小,均能达到完全分离的目的,但组分2和3受流速的影响较大,当流速较小(图4A和B)或较大(图4D)均易造成2种组分的分离不彻底,流速较小时,易造成洗脱时间延长,洗脱能力较差,组分2、3难以洗脱下来,造成分离难度较大;流速较大时(图4D),洗脱能力增强,但组分2、3的吸附能力均变弱,分离过程中会产生组分叠加,也不能获得理想的分离效果。因此,本实验经优化凝胶色谱柱层析工艺后,选择最佳流速为1.5 mL/min,可以基本实现组分2、3的分离(图4C)。

图4 不同流速时蓝莓花色苷组分的凝胶色谱分离结果
Fig. 4 Gel chromatography of blueberry anthocyanins at different flow rates
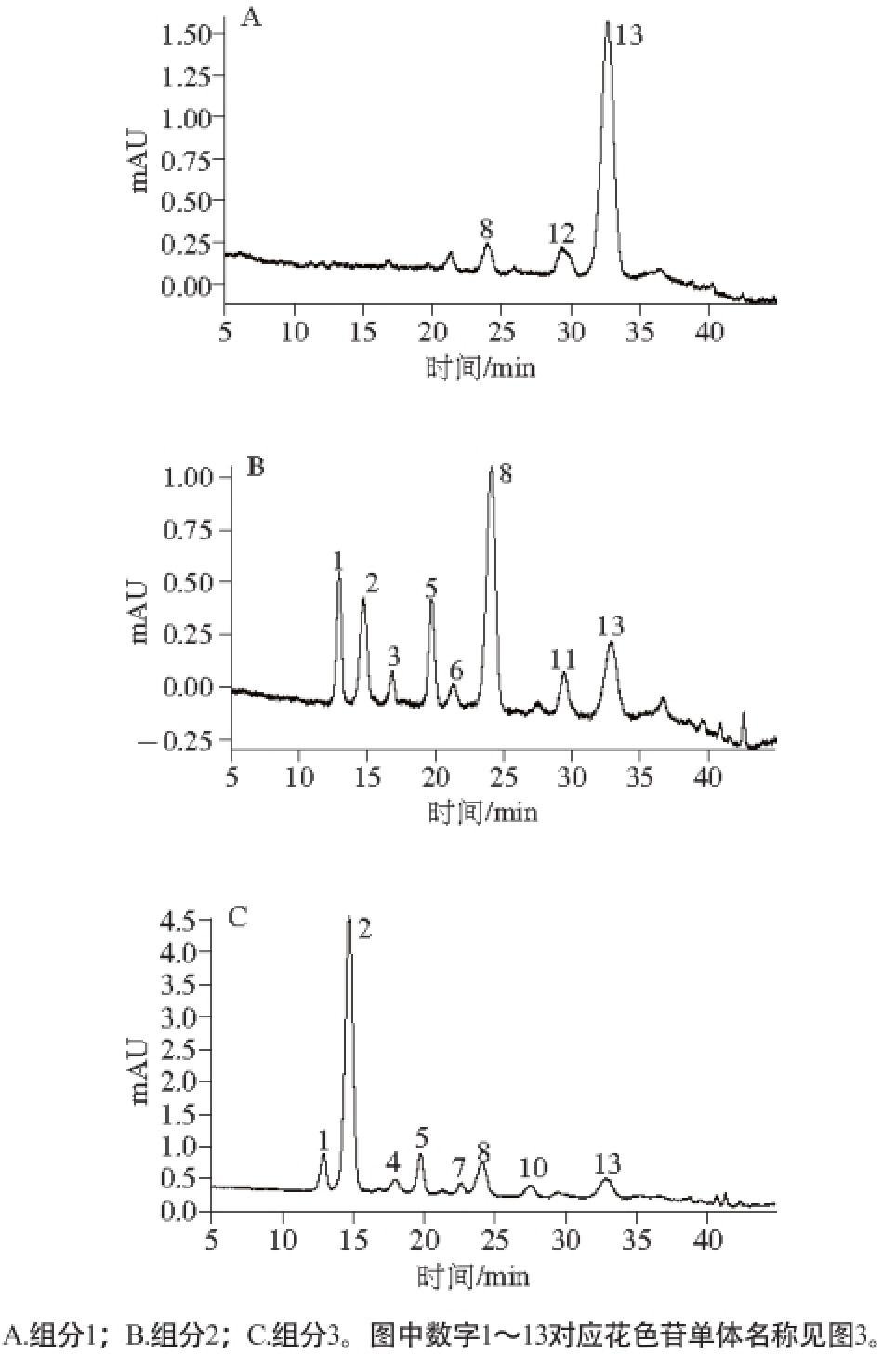
图5 蓝莓花色苷经Sephadex LH-20凝胶色谱柱分离后3 段组分的高效液相色谱图
Fig. 5 HPLC chromatogram of three blueberry anthocyanin fractions purified by Sephadex LH-20 gel chromatography
根据凝胶色谱柱分离结果并按试管合并3 种组分,利用高效液相色谱对凝胶色谱层析的3 种花色苷组分的检测结果如图5所示。图5A为组分1的高效液相色谱检测结果,与浓缩液(图3A)相比,组分1中13号峰面积比例为82.56%,12号峰面积比例为10.68%,8号峰为6.76%,即组分1中含量最丰富的为锦葵色素-3-O-葡萄糖苷,其次为锦葵色素-3-O-半乳糖苷和牵牛花素-3-O-葡萄糖苷。如图5B所示,组分2中8号峰(占45.86%)含量相对较多,除此之外还有1、2、5、13号峰等。组分3(图5C)中以2号峰为主,还有1、5、8、13号峰等。高效液相色谱结果表明,凝胶色谱柱层析初步实现了几种主要花色苷单体的分离,若要得到高纯度花色苷单体,仍需后期实验深入分离单体。利用pH值示差法分别对凝胶色谱纯化后的3种组分进行纯度分析后,得出组1、2、3的纯度分别为66.27%、70.36%及74.81%,这3 种组分较固相萃取后的纯度有明显提高。以上结果表明,凝胶色谱纯化不仅实现了不同种类花色苷单体的分离,而且显著提高了花色苷样品的总体纯度。
2.3 半制备液相色谱分离花色苷单体结果

图6 Sephadex LH-20凝胶色谱制得各组分的半制备高效液相色谱图
Fig. 6 Semi-preparative HPLC profiles of blueberry anthocyanin monomers
由于长白山野生蓝莓果实中花色苷单体多、含量低,难以分离,无法直接通过半制备液相分离手段达到分离目的,因此,本实验首先通过超声浸提、液液萃取、大孔树脂柱、固相萃取柱和凝胶色谱柱逐级分离技术,使得样品中花色苷单体的构成趋于简单化、易于分离。前期已利用半制备液相色谱技术纯化出3 种含量丰富的花色苷单体 [20],主要为飞燕草素-3-O-葡萄糖苷、牵牛花素-3-O-葡萄糖苷和锦葵色素-3-O-葡萄糖苷,分别对应图3A中峰2、峰8和峰13。本实验不仅通过前期调整浸提、萃取、层析等步骤中相关参数,而且在后期应用半制备液相色谱技术上也进行了相关改进,如梯度洗脱程序、上样量等参数条件,旨在收集更多种类、含量相对较少的花色苷单体。此外,对于组分相近且半制备液相色谱不足以实现两种单体或多者之间分离时,采用中心切割法和边缘切割法(图6A)进行收集 [21],从而实现极性相近的花色苷单体的分离与制备。
图6B为凝胶色谱层析后组分1的半制备高效液相色谱图,主峰为蓝莓花色苷中的13号峰(锦葵色素-3-O-葡萄糖苷),主峰前小峰对应12号峰(锦葵色素-3-O-半乳糖苷)。本实验主要以纯化含量较少的糖苷单体为目的,以中心切割法的方式收集12号峰。12号峰出峰时间约为62.5 min,实验收集从63 min开始,64.5 min结束。为了验证收集效果,排除杂质和收集误差的影响,将收集到的12号峰洗脱液再次上样,所得半制备液相色谱峰见图6C,可见12号信号峰单一,未见其他信号峰,重复上述操作,合并花色苷单体洗脱液。图6D和6E分别为凝胶色谱层析后组分2和3的半制备高效液相色谱图结果,通过与图5相比,可知半制备液相图中出现的3 个大峰并非由一种单体构成,而是由两种以上的花色苷单体重叠后得到的大峰。由于组分2和组分3中均含有一定比例的1号峰单体,因此本实验中组分2和3均可作为1号峰的收集来源,在收集目标物时,采用边缘切割法以1号峰为目标峰进行收集,并进行再次上样(图6F),合并花色苷单体的洗脱液。由于半制备型液相检测精度并不高,所得花色苷单体的二次洗脱液,需经分析型高效液相色谱进行分离效果的评价。


图7 半制备高效液相色谱制得的两种花色苷单体的分析液相检测结果
Fig. 7 Analytical HPLC chromatograms of two anthocyanin monomers obtained from semi-preparative HPLC
通过多次进样,收集一定量的花色苷单体洗脱液。将多次进样后制得的花色苷单体洗脱液进行低温浓缩,真空冷冻干燥,得到花色苷单体固体粉末。利用分析型高效液相色谱对花色苷单体进行分析结果见图7,图7A中单体保留时间为12.5 min,对应图3A中1号峰(飞燕草素-3-O-半乳糖苷),图7B中单体保留时间为30.6 min,对应图3A中12号峰(锦葵色素-3-O-半乳糖苷)。利用pH值示差法对两种单体进行纯度分析,得出飞燕草素-3-O-半乳糖苷的纯度为96.98%,锦葵色素-3-O-半乳糖苷的纯度为95.63%。一般来讲,当样品纯度达到95%以上时,便可以被当作物质对照品 [22]。可见,经过半制备液相两次纯化后大大提高了花色苷单体纯度,也说明此方法纯化花色苷单体具有很高的可行性。
为增大花色苷的提取效率,传统用于提取花色苷的溶剂一般为酸化的甲醇或丙酮 [23],本研究从食品安全角度考虑,蓝莓果实中花色苷的提取工艺中采用70%乙醇(0.1% HCl)溶液为提取剂;利用超声辅助提取法开展了花色苷的提取工艺研究。Corrales等 [24]研究结果表明,超声辅助提取花色苷效率与热浸提法相比,可以提高50%以上;本实验中,超声辅助提取法与传统的热浸提法相比能有效提高花色苷的溶出效率,此结果与Corrales等 [24]研究结果保持一致。蓝莓花色苷粗提液中弱极性成分以黄酮类物质为主,本实验中以乙酸乙酯为萃取剂来除去这部分杂质,通过与国内外已有制备蓝莓花色苷粗品的文献报道相比,此步骤常被忽略 [25],但在制备蓝莓花色苷单体过程,此步骤却至关重要。为制备高纯度的蓝莓花色苷样品,柱色谱常被用作花色苷的分离纯化,其中大部分文献中将Amberlite XAD-7HP与Sephadex LH-20的双步层析列为制备花色苷纯品的常用组合 [8],本实验对此组合进行了改进,在两步层析中间加入了固相萃取一步,通过Sep-Pak C 18固相萃取,既使蓝莓花色苷样品纯度提高12%,又避免过多杂质对价格昂贵的凝胶色谱柱的潜在污染。在蓝莓花色苷的半制备过程中,引入中心切割法及边缘切割法的理论,成功制备出两种纯度高于95%的半乳糖苷化的花青素单体。近年来,高速逆流色谱法逐渐成为大批量制备花色苷单体的热门技术之一,且所制备的花色苷单体纯度也高于90%,尽管本研究中所用的半制备高效液相色谱法的制备效率低于高速逆流色谱法,但后者一般采用高沸点、污染大的有机溶剂为流动相,如正丁醇、正己烷等溶剂,容易造成花色苷样品中的大量溶剂残留,本实验中采用的流动相为甲醇和甲酸,通过低温浓缩便可去除。
在蓝莓花色苷单体的纯化过程中,通过计算得出,飞燕草素-3-O-半乳糖苷和锦葵色素-3-O-半乳糖苷单体的回收率分别为10.4%和17.5%,此结果表明花色苷单体的回收率较低。由于本实验中采用了多次柱色谱技术,如大孔树脂层析、固相萃取、凝胶色谱层析、半制备高效液相色谱,其中大孔树脂层析及凝胶色谱层析均能造成50%以上总花色苷的损失。后期将在保证花色苷单体高纯度基础上,通过优化花色苷单体的柱层析步骤,以便获得更加经济实用的花色苷单体制备工艺。
以长白山野生蓝莓果实为原料,运用超声浸提、液液萃取、分步层析、固相萃取等手段,同时结合半制备高效液相色谱技术,开展了花色苷单体的制备技术研究,并对花色苷样品的纯度及单体构成进行了鉴定,所得结论如下:采用超声辅助浸提能促进蓝莓果实中花色苷类物质的溶出,乙酸乙酯能有效萃取出花色苷浸提液中的非花色苷黄酮类物质。采用3 种柱色谱技术(大孔树脂层析、固相萃取、凝胶色谱层析)能够获得纯度在65%以上的花色苷纯化样品。运用半制备型高效液相色谱从花色苷纯化样品中分离出2种花色苷单体,分别为飞燕草素-3-O-半乳糖苷和锦葵色素-3-O-半乳糖苷,纯度均高于95%。
本实验系统研究了花色苷单体的制备技术,并获得了制备花色苷单体的有效途径,为深入开发花青素标准化物质提供良好的研究思路,并为规模化生产蓝莓果实高附加值产品提供一定参考。
参考文献:
[1] YOU Q, WANG B W, CHEN F, et al. Comparison of anthocyanins and phenolics in organically and conventionally grown blueberries in selected cultivars[J]. Food Chemistry, 2011, 125(1): 201-208. DOI:10.1016/j.foodchem.2010.08.063.
[2] SPECIALE A, CIMINO F, SAIJA A, et al. Bioavailability and molecular activities of anthocyanins as modulators of endothelial function[J]. Genes and Nutrition, 2014, 9(4): 1-19. DOI:10.1007/ s12263-014-0404-8.
[3] WU T, JIANG Z, YIN J, et al. Anti-obesity effects of artif cial planting blueberry (Vaccinium ashei) anthocyanin in high-fat diet-treated mice[J]. International Journal of Food Sciences and Nutrition, 2016, 67(3): 257-264. DOI:10.3109/09637486.2016.1146235.
[4] 陈文超, 刘回民, 刘景圣. 花青素抗肿瘤活性的研究进展[J].食品研究与开发, 2016, 37(1): 211-215. DOI:10.3969/ j.issn.1005-6521.2016.01.051.
[5] NORBERTO S, SILVA S, MEIRELES M, et al. Blueberry anthocyanins in health promotion: a metabolic overview[J]. Journal of Functional Foods, 2013, 5(4): 1518-1528. DOI:10.1016/ j.jff.2013.08.015.
[6] 许相雯. 微波辅助萃取蓝莓中花青素及纯化的研究[D]. 哈尔滨:东北农业大学, 2012: 14-36.
[7] LI D N, MENG X J, LI B. Prof ling of anthocyanins from blueberries produced in China using HPLC-DAD-MS and exploratory analysis by principal component analysis[J]. Journal of Food Composition and Analysis, 2015, 47: 1-7. DOI:10.1016/j.jfca.2015.09.005.
[8] BUNEA A, RUGINĂ D, SCONŢA Z, et al. Anthocyanin determination in blueberry extracts from various cultivars and their antiproliferative and apoptotic properties in B16-F10 metastatic murine melanoma cells[J]. Phytochemistry, 2013, 95: 436-444. DOI:10.1016/ j.phytochem.2013.06.018.
[9] CANUTO G A, OLIVEIRA D R, da CONCEIÇÃO L S, et al. Development and validation of a liquid chromatography method for anthocyanins in strawberry (Fragaria spp.) and complementary studies on stability, kinetics and antioxidant power[J]. Food Chemistry, 2016, 192: 566-574. DOI:10.1016/j.foodchem.2015.06.095.
[10] GALLOWAY K R, BRETZ S L, NOVAK M. Paper chromatography and UV-Vis spectroscopy to characterize anthocyanins and investigate antioxidant properties in the organic teaching laboratory[J]. Journal of Chemical Education, 2014, 92(1): 183-188. DOI:10.1021/ed400520n.
[11] CORREA-BETANZO J, PADMANABHAN P, CORREDIG M, et al. Complex formation of blueberry (Vaccinium angustifolium) anthocyanins during freeze-drying and its inf uence on their biological activity[J]. Journal of Agricultural and Food Chemistry, 2015, 63(11): 2935-2946. DOI:10.1021/acs.jafc.5b00016.
[12] ARACELI C, MADELOURDES P H, MAELENA P, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871. DOI:10.1016/j.foodchem.2008.09.001.
[13] 潘利华, 王建飞, 叶兴乾, 等. 蓝莓花青素的提取工艺及其免疫调节活性[J]. 食品科学, 2014, 35(2): 81-86. DOI:10.7506/spkx1002-6630-201402015.
[14] 董周永, 阿嘎, 赵国建, 等. 大孔树脂对红心萝卜花色苷的纯化[J].食品科学, 2011, 32(4): 21-24.
[15] 王二雷. 蓝莓花青素高纯提取物的制备技术及诱导肿瘤细胞凋亡作用研究[D]. 长春: 吉林大学, 2014: 34-93.
[16] 刘均玉, 许晨, 许建中, 等. 高效半制备液相色谱法从橘皮中分离制备黄酮类化合物[J]. 中国食品添加剂, 2009(2): 157-160.
[17] 王二雷, 陈晶晶, 赵叶辉, 等. 小叶女贞果实花青素组分鉴定及色谱纯化技术[J]. 农业工程学报, 2016, 32(4): 302-308. DOI:10.11975/ j.issn.1002-6819.2016.04.043.
[18] 郭丹妮, 向灿辉, 陈阳, 等. 葡聚糖凝胶色谱结合高速逆流色谱提取蓝莓中花青素[J]. 食品工业, 2016, 37(2): 181-183.
[19] BARNES J S, NGUYEN H P, SHEN S, et al. General method for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionization-ion traptime of flight-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(23): 4728-4735. DOI:10.1016/j.chroma.2009.04.032.
[20] WANG E L, YIN Y G, XU C N, et al. Isolation of high-purity anthocyanin mixtures and monomers from blueberries using combined chromatographic techniques[J]. Journal of Chromatography A, 2014, 1327: 39-48. DOI:10.1016/j.chroma.2013.12.070.
[21] 宁德生, 梁小燕, 方宏, 等. 半制备高压液相色谱法制备罗汉果苷Ⅴ标准品[J]. 食品科学, 2010, 31(12): 137-140.
[22] 龚金炎, 毛建卫, 黄伟素, 等. 竹茹中苜蓿素对照品的高效液相半制备色谱制备研究[J]. 中草药, 2012, 43(5): 919-921.
[23] 王秋霜, 凌彩金, 刘淑媚, 等. 花青素分离纯化及其组分鉴定研究进展[J]. 食品工业科技, 2013, 34(3): 358-360. DOI:10.13386/ j.issn1002-0306.2013.03.054.
[24] CORRALES M, TOEPFL S, BUTZ P, et al. Extraction of anthocyanins from grape by-products assisted by ultrasonics, high hydrostatic pressure or pulsed electric fields: a comparison[J]. Innovative Food Science and Emerging Technologies, 2008, 9(1): 85-91. DOI:10.1016/ j.ifset.2007.06.002.
[25] BURAN T J, SANDHU A K, LI Z, et al. Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J]. Journal of Food Engineering, 2014, 128: 167-173. DOI:10.1016/ j.jfoodeng.2013.12.029.
Separation of Anthocyanin Monomers from Blueberry Fruits through Chromatographic Techniques
LIU Jingbo, CHEN Jingjing, WANG Erlei*, LIU Yanjun
(College of Food Science and Engineering, Jilin University, Changchun 130062, China)
Abstract:To fully develop the potential application of blueberry fruits, this paper is focused on the preparation of anthocyanin monomers from blueberry fruits using column chromatography and semi-preparative high performance liquid chromatography (HPLC). Crude blueberry anthocyanins were ultrasonically extracted with acidified 70% ethanol and further subjected to two cycles of ethyl acetate extraction for the purpose of facilitating the dissolution of anthocyanins and removing non-anthocyanin flavonoids. The purity of crude blueberry anthocyanins reached 62.49% after Amberlite XAD-7HP column chromatography separationand Sep-Pak C 18solid-phase extraction. Three anthocyanin fractions were obtained by Sephadex LH-20 column chromatography with purities ranging from 65% to 75%. Using semi-preparative HPLC, two pure anthocyanin monomers were successfully isolated from the three purif ed anthocyanin fractions, which were identif ed as delphinidin-3-O-galactoside and malvidin-3-O-galactoside by analytical HPLC, with purities of 96.98% and 95.63% respectively. The present study can provide technical references for large-scale production of anthocyanin glycoside monomers, and also provide a good theoretical basis for the production of high value-added products of blueberry anthocyanins.
Key words:blueberry; anthocyanins; column chromatography; semi-preparative high performance liquid chromatography (HPLC); separation and purif cation
DOI:10.7506/spkx1002-6630-201702033
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2017)02-0206-08
引文格式:
刘静波, 陈晶晶, 王二雷, 等. 蓝莓果实中花色苷单体的色谱分离纯化[J]. 食品科学, 2017, 38(2): 206-213. DOI:10.7506/ spkx1002-6630-201702033. http://www.spkx.net.cn
LIU Jingbo, CHEN Jingjing, WANG Erlei, et al. Separation of anthocyanin monomers from blueberry fruits through chromatographic techniques[J]. Food Science, 2017, 38(2): 206-213. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702033. http://www.spkx.net.cn
收稿日期:2016-06-29
基金项目:国家自然科学基金面上项目(31271907)
作者简介:刘静波(1962—),女,教授,博士,研究方向为营养与功能食品。E-mail:ljb168@sohu.com
*通信作者:王二雷(1981—),男,实验师,博士,研究方向为营养与功能食品。E-mail:wel@jlu.edu.cn