王晓雅 1,刘文强 1,朱雯婷 1,增 凯 2,朱雪梅 1,*,熊 华 1,胡蒋宁 1
(1.南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌市食品质量卫生安全监督检验中心,江西 南昌 330012)
摘 要:以Lipozyme TLIM催化茶油和共轭亚油酸乙酯制备共轭亚油酸(conjugated linoleic acid,CLA)结构脂,并调控酰基迁移反应以制备Sn-2位含CLA的结构脂。通过响应面法研究反应温度、水分活度、反应时间和底物物质的量比对总CLA键入量和酰基迁移的影响,并优化反应条件。本实验得到的结构脂中含有36.97%的总CLA,其中12.54%的CLA分布在Sn-2位,所得总CLA及Sn-2位的CLA键入量均高于文献报道。
关键词:Lipozyme TLIM;CLA;结构脂;酰基迁移
结构脂是通过酶法或化学方法改变脂质的脂肪酸组成及其在甘油骨架上的位置分布,以增强营养治疗功效或改变其物理性质。与化学法相比,脂肪酶法具有高选择性、反应条件温和、设备简单、低纯化成本和环境友好等优势。因专一性脂肪酶具有精巧的位置特异性和立体结构专一性等特点,可根据需要对目标产品实现精准控制,并可以设计特定脂肪酸组成及特定结构的油脂,因此被广泛用于结构脂的制备,包括中链-长链-中链(MLM)型结构脂、类可可脂、母乳替代脂、低反式脂肪酸脂肪等 [1-5]。
然而随着研究深入,发现专一性脂酶合成结构脂并不是专一性的,如在利用Sn-1,3专一性脂酶催化酸解法和转酯交换法制备MLM型结构脂时发现有中链-中链-长链(MML)型异构体 [6],在Sn-1,3专一性脂酶催化制备Sn-1,3-甘油二酯(diacylglycerol,DAG)时检测到Sn-1,2-DAG和甘油三酯(triglyceride,TAG) [7],在用Sn-1,3专一性脂酶催化天然植物油脂制备低反式脂肪酸的固态脂肪发现得到Sn-2位不饱和脂肪酸减少 [8]。所有结果说明专一性脂酶催化制备结构脂的反应过程中存在副反应-酰基迁移。酰基迁移是指TAG中Sn-2位脂肪酸迁移至Sn-1,3位,或反之。国外研究指出影响酰基迁移的因素主要有反应时间、温度、有无添加溶剂、添加剂种类、反应器的类型等 [9-11],但是反应因素影响酰基迁移的机制尚不清晰,更没有对能否积极利用酰基迁移进行尝试。由于国内在结构脂研究上起步较晚,分析检测技术受到限制,对专一性脂酶催化制备结构脂中的酰基迁移研究较少。
共轭亚油酸(conjugated linoleic acid,CLA)是天然存在的具有抗炎、抗癌作用和提高记忆力、减肥、治疗肠道疾病等多种生理活性的多不饱和脂肪酸 [12]。国内外市场上的CLA原料主要是以富含亚油酸的植物油为原料,采用化学或生物方法进行异构化得到的CLA游离脂肪酸,而游离脂肪酸易氧化产生对人体有害的过氧化物且有酸味,不能作为食品添加剂直接添加到食品中。CLA甘油酯在保持其生理和营养功能的同时,气味平和、更易被人体和动物吸收,是补充CLA的理想脂质。Martinez等 [13]采用专一性脂酶催化CLA游离脂肪酸和TAG制备含CLA的结构脂,但是结果显示CLA主要酰化在TAG的Sn-1,3位。而根据脂肪代谢的研究发现,TAG分子中Sn-2位的脂肪酸被优先代谢吸收 [14]。
因此,本实验以制备CLA结构脂为模型,通过响应面法研究三角瓶-摇床式制备CLA结构脂的最佳条件,探讨各反应因素影响酰基迁移的机制。并尝试有效利用酰基迁移副反应,通过控制反应条件以增强酰基迁移,进而增加Sn-2位CLA的键入量,提高功能性CLA的吸收利用度。
1.1 材料、试剂与仪器
CLA(纯度93%) 大连医诺生物公司;茶油(食用一级) 江西天玉油脂公司;Lipozyme TLIM 丹麦诺维信有限公司;胰脂酶、三氟化硼甲醇溶液、牛胆盐、Supelco 37脂肪酸甲酯混合标准品 美国Sigma公司;甲醇、乙醇、氯化钙、盐酸、乙酸、石油醚、KOH(均为分析纯) 国药集团化学试剂有限公司;正己烷(色谱纯) 美国天地试剂公司。
6890N气相色谱仪 美国Agilent公司;GF254薄层层析板 青岛海洋化工厂分厂;BS 224S型电子天平北京赛多利斯科学仪器有限公司。
1.2 方法
1.2.1 共轭亚油酸乙酯(conjugated linoleic acid ethyl ester,CLAEE)的制备
将CLA加入连有冷凝管的圆底烧瓶,预热至70 ℃后,将预先调配好的KOH-乙醇溶液(催化剂KOH用量为CLA质量的1.4%,醇油物质的量比为6∶1)加入烧瓶中开始反应。搅拌条件下反应2~3 h,冷却除去多余的乙醇和甘油相,剩余物经盐酸溶液中和,饱和氯化钠溶液洗涤至中性,再过无水硫酸钠柱子,即得CLAEE。反应方程式如下:
1.2.2 响应面试验设计
本实验重点考察反应温度(X 1)、水分活度(X 2)、反应时间(X 3)、底物(CLAEE-茶油)物质的量比(X 4) 4个因素对反应中总CLA键入量(Y 1)和酰基迁移(Sn-2位CLA键入量Y 2)的影响,根据已有实验基础 [15-17],响应面法中心组合试验设计(central composite design,CCD)因素及水平,CCD的二项式原理如下:
式中:Y为预测响应值;X i为独立编码变量;β 0为截距;β i为线性系数;β ii为平方系数;β ij为交互作用系数。
1.2.3 CLA-茶油结构脂的合成
由不同饱和盐溶液制备得到不同水分活度,将Lipozyme TLIM、CLAEE、茶油分别置于装有CH 3COOK(水分活度为0.2)、K 2CO 3(水分活度为0.5)和(NH 4) 2SO 4(水分活度为0.8)饱和盐溶液的干燥器内,至少放置48 h,得到相应水分活度的Lipozyme TLIM和反应底物。按比例称取不同水分活度的茶油、CLAEE和Lipozyme TLIM于150 mL锥形瓶中,通入氮气以防止氧化,加入占底物质量10%的脂酶,转速为200 r/min。反应结束后,过滤混合物以除去脂酶得到CLA-茶油结构脂。
1.2.4 Sn-2脂肪酸的制备
称取约10 mg样品,加入10 mg胰脂酶、1 mL 2.2%的CaCl 2溶液、2.5 mL 0.05%胆盐溶液和10 mL Tris-HCl缓冲液,充分混匀,在37 ℃条件下水浴3 min,取出剧烈振荡30 s,以上步骤重复3 次后加入4 mL乙醚,提取上层乙醚液并脱水浓缩用于薄层层析分离,展开剂为正己烷-乙醚-乙酸(体积比50∶50∶1),刮下2-MAG条带,甲酯化供气相色谱分析。
1.2.5 脂肪酸的甲酯化及气相色谱分析条件
称取2 mg油脂样品或刮板的Sn-2 MAG置于螺口试管中。加入1.5 mL 0.5 mol/L的NaOH-MeOH溶液并充分振荡,沸水浴加热5 min,冷却后加入2 mL BF 3-MeOH溶液再加热3 min后,加入2 mL正己烷和1 mL饱和NaCl溶液充分混匀,取上清液经无水Na 2SO 4柱子脱水,用0.45 μm滤膜过滤用于气相色谱分析 [18]。
采用气相色谱分析脂肪酸甲酯,氢火焰离子检测器,CP-Sil88石英毛细管柱(100 m×12.5 mm);载气为H 2;进样口温度为250 ℃;升温程序:在45 ℃的条件下保持4 min,以13 ℃/min的速度升温至175 ℃,保持27 min,然后再以4 ℃/min的速度升温至215 ℃,保持35 min。利用面积归一法得到各脂肪酸的相对百分含量。本研究中酰基迁移程度以Sn-2位CLA的含量为根据。
响应面模型的数据采用Design-Expert 8.0.6方差分析,评估各因素对响应面的影响及因素间的相互作用,并对二项式方程进行回归分析,得出Y 1和Y 2最大值的反应条件即为最佳条件。
2.1 响应面试验结果
响应面试验结果见表1。
表1 响应面试验设计及结果
Table1 Central composite experimental design with experimental response
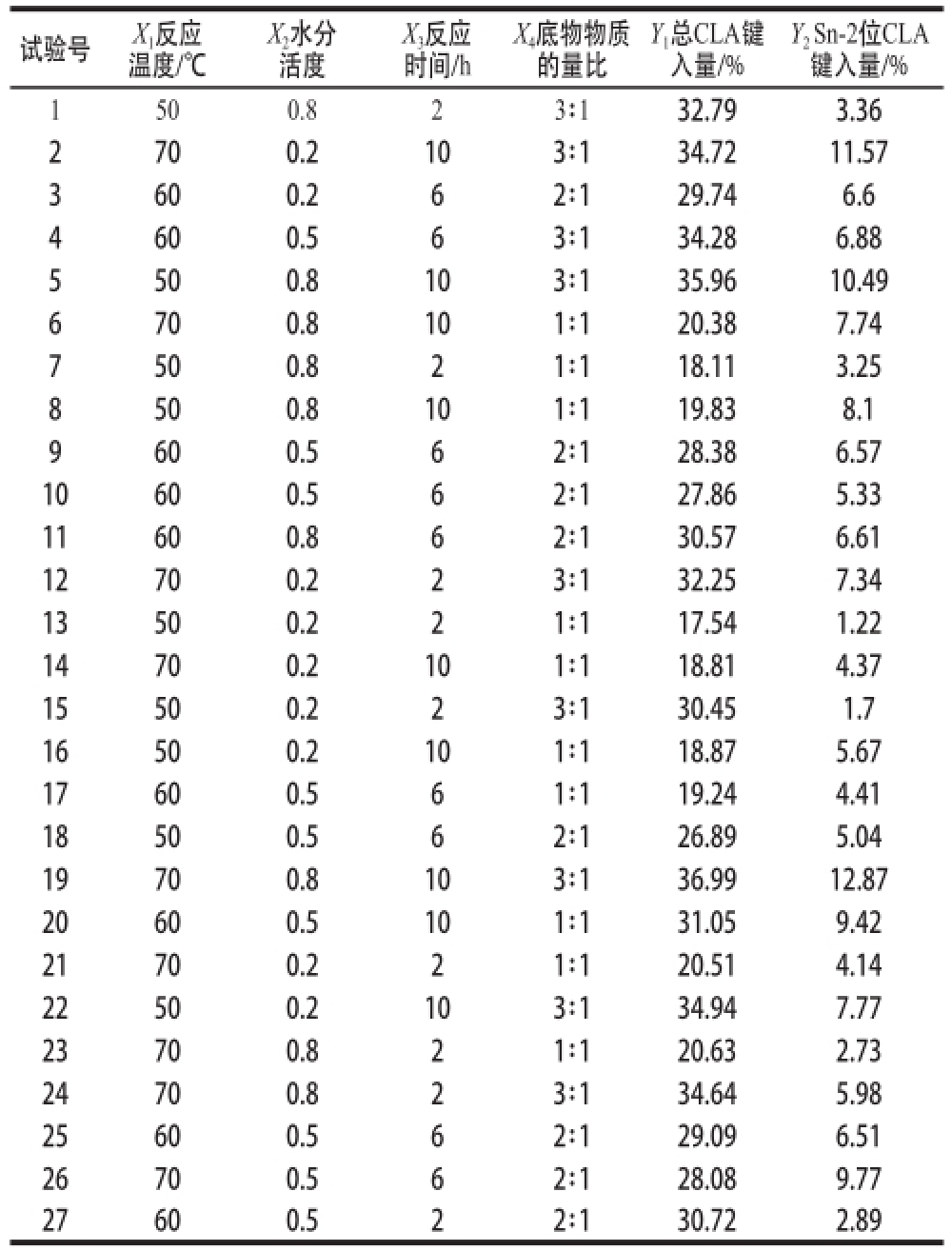
试验号X 1反应温度/℃Y 2 Sn-2位CLA键入量/% 1500.823∶132.793.36 2700.2103∶134.7211.57 3600.262∶129.746.6 4600.563∶134.286.88 5500.8103∶135.9610.49 6700.8101∶120.387.74 7500.821∶118.113.25 8500.8101∶119.838.1 9600.562∶128.386.57 10600.562∶127.865.33 11600.862∶130.576.61 12700.223∶132.257.34 13500.221∶117.541.22 14700.2101∶118.814.37 15500.223∶130.451.7 16500.2101∶118.875.67 17600.561∶119.244.41 18500.562∶126.895.04 19700.8103∶136.9912.87 20600.5101∶131.059.42 21700.221∶120.514.14 22500.2103∶134.947.77 23700.821∶120.632.73 24700.823∶134.645.98 25600.562∶129.096.51 26700.562∶128.089.77 27600.522∶130.722.89 X 2水分活度X 3反应时间/h X 4底物物质的量比Y 1总CLA键入量/%
2.2 模型评价
表2 方差分析
Table2 Analysis of variance
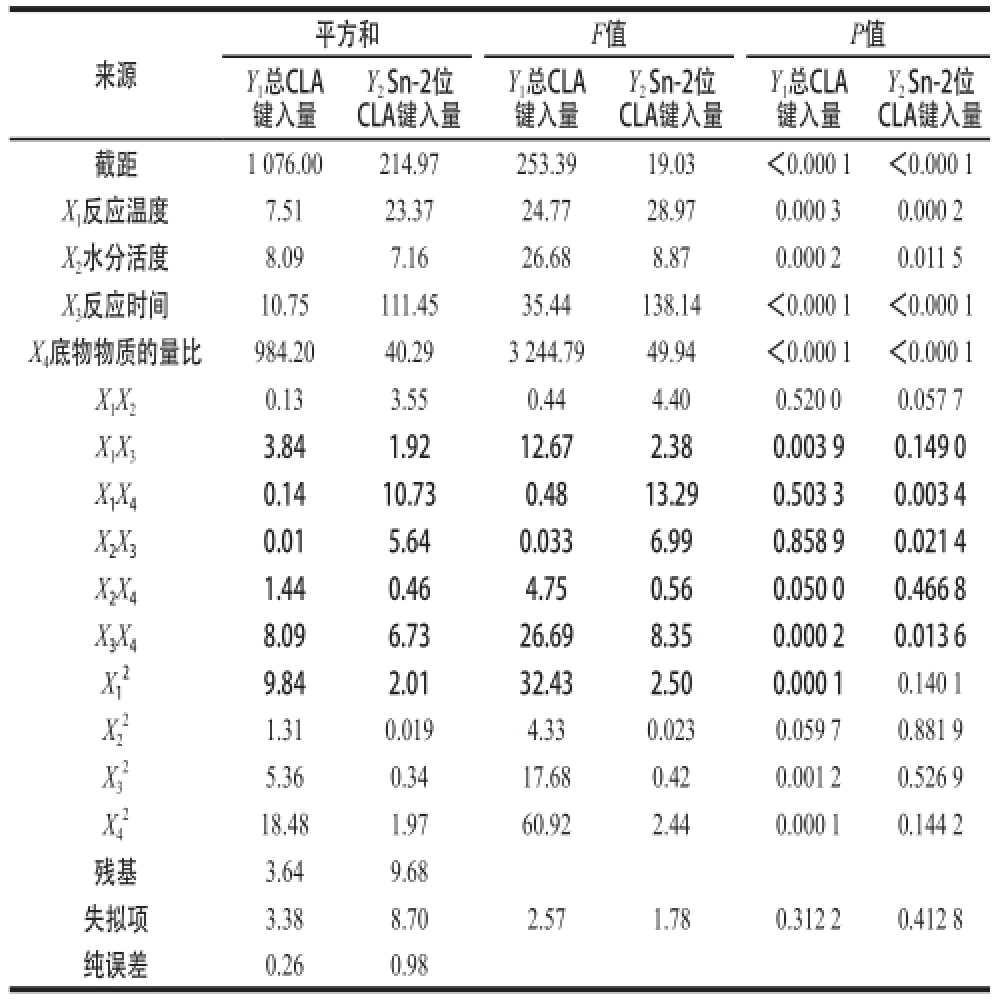
Y 2Sn-2位CLA键入量截距1 076.00214.97253.3919.03<0.000 1<0.000 1 X 1反应温度7.5123.3724.7728.970.000 30.000 2 X 2水分活度8.097.1626.688.870.000 20.011 5 X 3反应时间10.75111.4535.44138.14<0.000 1<0.000 1 X 4底物物质的量比984.2040.293 244.7949.94<0.000 1<0.000 1 X 1X 20.133.550.444.400.520 00.057 7 X 1X 33.841.9212.672.380.003 90.149 0 X 1X 40.1410.730.4813.290.503 30.003 4 X 2X 30.015.640.0336.990.858 90.021 4 X 2X 41.440.464.750.560.050 00.466 8 X 3X 48.096.7326.698.350.000 20.013 6 X1来源平方和F值P值Y 1总CLA键入量Y 2Sn-2位CLA键入量Y 1总CLA键入量Y 2Sn-2位CLA键入量Y 1总CLA键入量9.842.0132.432.500.000 10.140 1 X2 2 1.310.0194.330.0230.059 70.881 9 X3 2 18.481.9760.922.440.000 10.144 2残基3.649.68失拟项3.388.702.571.780.312 20.412 8纯误差0.260.98 5.360.3417.680.420.001 20.526 9 X4 22
用软件Design-Expert 8.0.6对表1的试验数据进行方差分析(表2)。模型P值均小于0.000 1可知回归模型极显著;失拟项P值均大于0.05,表明失拟项相对于绝对误差是不显著的,即回归模型无失拟因素存在,该模型可信度高;响应面试验中总CLA键入量Y 1与Sn-2位CLA键入量Y 2的预测值与实际检测值一致,其中Y 1的回归系数R 2(0.996 6)与校正系数R 2 Adj(0.992 7)相近且均大于0.9,Y 2回归方程R 2(0.956 9)与校正系数R 2 Adj(0.906 6)比较相近,表明Y 1与Y 2的试验值与预测值有较好的拟合度,此模型可用于结果的预测。以上结果均表明该模型不失拟且可有效说明各因素对响应值的影响及因素间的相互作用关系,可有效优化响应值。
表2的各项回归系数表明,一次项模型多项式各因素中对于Y 1和Y 2影响的P值皆小于0.05,说明所选各单因素对响应值有显著影响,且X 3、X 4对Y 1和Y 2影响的比较一致,根据P值小于0.000 1表示其对Y 1和Y 2有极显著的影响。在Y 1的二次项中,X 1X 3和X 3X 4对Y 1有显著的相互作用。而对Y 2而言,X 1与X 4、X 2与X 3、X 3与X 4之间的相互作用显著(P<0.05)。
2.3 各因素及交互作用对总CLA键入量的影响
由图1可以看出,温度在50~60 ℃范围内总CLA键入量缓慢增加;而温度在60~70 ℃时,总CLA键入量又缓慢下降,结果表明:适当提高反应温度可以提高酶活性(Lipozyme TLIM的最适反应温度为55~70 ℃),并能降低反应体系的黏度,加速底物分子的热运动,有利于反应进行;但过高的温度对酶的空间结构影响较大,酶的使用寿命减少,同时会减缓反应速度 [11]。
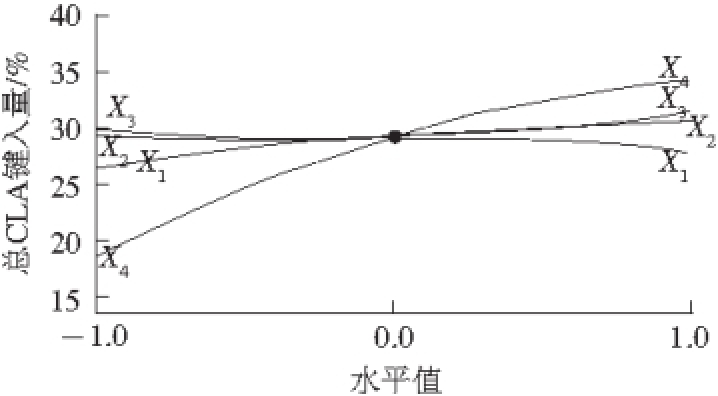
图1 各因素对总CLA键入量的影响
Fig. 1 Effects of reaction temperature (X
1), time (X
2), water activity (X
3) and molar ratio of substrates (X
4) on Sn-2 positional CLA content
反应时间对CLA键入量的影响与温度截然相反,即随着反应时间的延长总CLA的键入量先缓慢减少后增加,可能因为专一性脂酶TLIM催化CLA脂肪酸与茶油Sn-1,3位的酸解反应在2 h内已达到平衡状态,随着反应时间继续延长,副反应酰基迁移增加,部分CLA转移至甘油骨架的Sn-2位,导致总CLA继续增加。
水分活度为0.2~0.5时对总CLA键入量的影响幅度不大,而当水分活度大于0.5时可显著增加总CLA键入量。这个结果表明水是影响脂酶催化活性的重要因素。脂酶是大分子蛋白质,水分子直接或间接地通过氢键、静电作用、疏水键、范德华力等分子力维持着酶分子的活性构象。但是在水溶液中不是所有的水分子都与酶的催化活性构象有关,只有那些与脂酶分子紧密结合的一层单分子水化层会影响酶的催化活性构象,所以维持酶催化活性构象的这一层“紧密结合的水”被称为酶的“必须水”,只要有“必须水”的存在,即使是无水环境脂酶仍可以维持催化活性构象并具有催化活性,这也是我们这里测水分活度而不是水分含量的原因。然而,脂酶的最佳水分活度尚不清楚,本实验发现只有水分活度大于0.5时,对总CLA键入量才有显著影响,说明只有水分活度高于0.5才能维持脂酶的催化活性构象。
各影响因素中底物物质的量比对总CLA键入量的影响最大。总CLA键入量随底物物质的量比的增加而增加,但是CLA质量浓度越大,CLA键入量的增加量越小。这是因为甘油三酯有3 个酰基,当CLAEE与茶油物质的量比为1∶1时,底物中CLA占总脂肪酸的1/4,但是Sn-1,3-专一性脂酶只能水解和酯化甘油三酯的1,3位,即底物中1 mol CLA与2 mol甘油酯的脂肪酸发生碰撞进行交换,所以脂酶可利用的CLA占1/3,反应后Sn-1,3位的CLA含量的理想值为1/3,而在总甘油三酯中CLA的含量为1/3×2/3=22%;依次类推当底物物质的量比是2∶1时,总CLA键入量的理论值为33%,底物物质的量比为3∶1时,总CLA键入量理论值为40%,即底物物质的量比越高甘油三酯内CLA增加量越少。
2.4 各因素及交互作用对Sn-2位CLA键入量的影响

图2 各因素对Sn-2位CLA键入量的影响
Fig. 2 Effects of reaction temperature (X
1), time (X
2), water activity (X
3) and molar ratio of substrates (X
4) on Sn-2 positional CLA content
整个转酯交换反应都是动态变化的,反应温度、反应时间、水分活度和底物物质的量比对总CLA键入量的影响非常复杂,而总CLA键入量又会影响Sn-2位CLA或被Sn-2位CLA正影响。各因素的复杂影响在Sn-2位CLA键入量中完全表现出来,如图2所示,在温度为50~54 ℃范围内,随着温度的升高Sn-2位CLA键入量缓慢降低,因为在这个温度范围内Sn-1,3专一性脂酶TLIM的催化活性逐渐增强,脂酶的活性越强其空间选择性越强,发生酰基迁移副反应的几率越小,因此Sn-2位CLA键入量是减少的趋势。Sn-2位CLA键入量在54~60 ℃内缓慢增加,当反应温度超过60 ℃时,随着温度升高Sn-2位CLA键入量迅速增加,说明温度越高,体系的酰基迁移程度越高,可能原因是反应体系中分子热运动过快使酰基迁移增加,且温度过高会影响脂酶的空间构象及其催化选择性进而也会增加酰基迁移程度。
水分活度(0.2~0.8)对Sn-2位CLA键入量是线性正相关的影响。Oda等 [19]的研究也得到了相似的结论。可能原因是,水分活度越低,Sn-1,3专一性脂酶的催化活性越弱,当水解一分子甘油三酯中的一个脂肪酸(α位)后,生成的中间产物(Sn-1,2(或2,3)-DAG)需要酯化另一分子的脂肪酸等待时间越长,其反应中间体的停留时间越长,所以即使脂酶催化活性很弱也会发生酰基迁移;另一方面,因为高活性的脂酶催化会产生大量含有CLA 的中间体即Sn-1,2(或2,3)-DAG,为酰基迁移提供了足够的前体化合物,也会使酰基迁移增加。再者如果水分活性过高,多余水分子的羟基带有孤电子对,对中间产物甘油二酯酶复合物的仲羰基碳原子形成亲核攻击,造成酰基迁移程度加深 [20]。
反应时间对Sn-2位CLA键入量的影响也趋近于线性正相关,但是反应时间的影响极显著,其远远强于反应温度和水分活度的影响。如图2所示,当其他因素处于中心点时(0水平),反应时间从2 h延长至10 h使得Sn-2位CLA键入量从3.54%增加至8.50%。这个结果表明增强酰基迁移最简单的办法即为延长反应时间,反之如抑制酰基迁移则需缩短反应时间 [10,21]。
除了反应时间,底物物质的量比对Sn-2位CLA键入量的影响也极显著。在1∶1~2∶1范围内随着底物中CLA物质的量的增加,Sn-2位CLA键入量也增加,但是当底物物质的量比大于2∶1以后Sn-2位CLA键入量增速缓慢,当底物物质的量比达到2.7∶1后Sn-2位CLA键入量不再增加达到最大化。底物物质的量比对酰基迁移的影响归因于对总CLA键入量的影响,如图1、2所示,底物物质的量比对总CLA和Sn-2位CLA的影响趋势完全一致。
反应温度与底物物质的量比、水分活度与反应时间、反应时间与底物物质的量比两两间相互作用对Sn-2位CLA均有显著影响,各因素在本研究所选的水平范围内皆是正影响,冯永方等 [22]在棕榈酸的研究中也发现类似的结果。
2.5 模型优化及验证实验
对试验数据进行二次回归分析,得到回归方程如下:
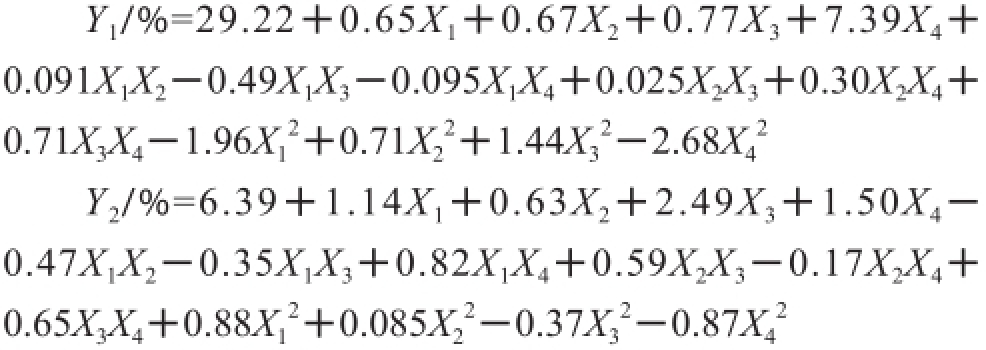
用Design-Expert软件对模型进行优化,取Y 1和Y 2的最大值,得出最佳反应条件为反应温度69.6 ℃、水分活度0.8、反应时间10 h、底物物质的量比3∶1,此时Y 1和Y 2分别为36.9%和12.8%。
在优化条件下进行验证实验,实际得到的结构脂中总CLA含量为36.97%,Sn-2位CLA含量为12.54%,与理想接近,此模型优化得到的合成条件准确可靠。本实验在最优条件下得到的CLA结构脂高于已有文献报道。如Goli等 [23]用7% TLIM在55 ℃条件下催化CLA(质量分数40%)和葵花籽油反应48 h得到的结构脂中含有26.6%的CLA。惠菊 [24]用非专一性脂酶Novozyme 435催化CLA和葵花籽油,在底物物质的量比3.55∶1、脂酶用量13.7%、反应温度55 ℃、反应时间37 h的条件下得到结构脂中含有17.1%的总CLA和2.89%的Sn-2位CLA;惠菊用的是非专一性脂酶但是Sn-2位CLA也仅有2.89%,也就是说CLA并不是均一分布在甘油骨架上。尽管本研究用的是专一性脂酶,但是经过促进酰基迁移使Sn-2位CLA含量达到了12%。
Sn-1,3专一性脂酶只能水解或酯化Sn-1,3位脂肪酸,而水分活度不同明显影响酰基迁移,可能机理如下:在本反应中底物是茶油(以三油酸甘油酯为主)和CLAEE,Sn-1,3专一性脂酶Lipozyme TLIM催化反应的第一步是甘油三酯上的Sn-1(3)脂肪酸水解,生成游离脂肪酸和中间体Sn-2,3(1,2)-DAG,而在热反应体系下,体系的能量较高,Sn-1,2-DAG易酰基迁移生成Sn-1,3-DAG;反之也会有少量的Sn-1,3-DAG发生酰基迁移生成Sn-1,2(2,3)-DAG。但Sn-1,3专一性脂酶不能将Sn-1,3-DAG结构中Sn-2上的羟基酯化合成甘油三酯,却可以水解Sn-1,3-DAG生成游离脂肪酸和甘油单酯等副产物,所以即使在酯内交换和转酯交换的反应中也会产生副产物游离脂肪酸和单甘脂 [25]。多数学者认为酰基迁移属于SN2亲核取代反应体系 [20,26](图3),Sn-2,3(1,2)-甘油二酯中羟基上氧的孤立电子对进攻临位的羰基碳,形成一个过渡态中间体-5原子酯环,过渡态中间体不稳定,原酯的碳氧单键断裂生成酰基迁移产物Sn-1,3-甘油二酯,Sn-2位脂肪酸迁移至Sn-1位。然而过渡态中间体很难捕捉且不稳定,难以进一步从理论和实验中加以证实。

图3 酰基迁移的SN2亲核取代反应机理
Fig. 3 SN2 nucleophile substitution reaction mechanism of acyl migration
文献报道指出反应温度和时间是影响酰基迁移最主要的两个因素,本研究组也在实验中发现这两个因素显著影响酰基迁移。此外,本实验也发现酰基迁移与反应时间正相关,说明酰基迁移过程是热力学且非酶参与过程。同理,根据阿伦尼乌斯方程,温度越高,底物的黏度越小,物质间传质越快,反应速度越快,副反应如酰基迁移的速度也越快。但是在实验中发现当温度低于脂酶最佳催化温度时反而会增加酰基迁移程度,在54~60 ℃时对酰基迁移的影响较小;而温度大于60 ℃时酰基迁移会迅速增加,因为低温时脂酶催化活性和选择性较差,这个结果证明,酰基迁移与脂酶的活性有一定关系。另外,水分含量影响脂酶的构象进而影响脂酶的催化活性和选择性,说明酰基迁移与脂酶的选择性相关。所以酰基迁移副反应是一个热力学和脂酶催化选择性共同影响的结果。
酰基迁移在专一性脂酶催化制备结构脂的反应中不可避免,但是可以调控。在已有文献报道中,酰基迁移都是不理想的副反应,主要研究如何抑制酰基迁移,即在保证主反应最大化的同时尽量缩短反应时间和降低反应温度 [11]、选择合适的反应器 [27]、底物类型 [10]和水分活度 [17]。然而本实验发现在一定情况下酰基迁移是有益的,如在专一性脂酶催化条件下可以利用酰基迁移把功能性脂肪酸(如本实验的CLA)目的性地转移到Sn-2位,一方面Sn-2位功能性脂肪酸的生物利用率比Sn-1,3位更高 [28],且最新报道指出多不饱和脂肪酸位于Sn-2位可增强其氧化稳定性 [29]。另一方面目标脂肪酸键入到Sn-2位降低了反应体系中CLA的平衡浓度。此外,本实验中随着底物物质的量比的增加,总CLA的键入量并不是按比例增加的,比例越高总CLA键入量增加的越少,换言之,扩大反应体系达到平衡的“容量”,降低反应平衡的瓶颈值,可以促进CLA的键入。假设酰基迁移最大化即Sn-2位CLA键入几率与Sn-1,3位的几率一致,可以推断当CLAEE与茶油物质的量比为1∶1时,底物中1 mol CLA与3 mol甘油酯的脂肪酸发生碰撞进行交换,反应后甘油三酯中CLA理论值为25%;依次类推当底物物质的量比为2∶1时,总CLA的理论值为40%;底物物质的量比为3∶1时,总CLA的理论值为50%;分别高于未发生酰基迁移的22%、33%和40%。因此,在本反应中可以利用这一机理有效增加目标脂肪酸的键入量。
参考文献:
[1] KAWASHIMA A, NAGAO T, WATANABE Y, et al. Preparation of regioisomers of structured TAG consisting of one mole of CLA and two moles of capric acid[J]. Journal of American Oil Chemistry’s Society, 2004, 81(11): 1013-1020. DOI:10.1007/s11746-004-1015-3.
[2] ZHAO M L, TANG L, ZHU X M, et al. Enzymatic production of zerotrans plastic fat rich in α-linolenic acid and medium chain fatty acids from highly hydrogenated soybean oil, Cinnamomum camphora seed oil, and perilla oil by lipozyme TLIM[J]. Journal of Agricultural and Food Chemistry, 2013, 61(6): 1189-1195. DOI:10.1021/jf305086j.
[3] RUAN X, ZHU X M, XIONG H, et al. Characterisation of zerotrans margarine fats produced from camellia seed oil, palm stearin and coconut oil using enzymatic interesterification strategy[J]. International Journal of Food Science and Technology, 2014, 49(1): 91-97. DOI:10.1111/ijfs.12279.
[4] MOHAMED I O. Lipase-catalyzed acidolysis of palm mid fraction oil with palmitic and stearic fatty acid mixture for production of cocoa butter equivalent[J]. Applied Biochemistry Biotechnology, 2013, 171(3): 655-666. DOI:10.1007/s1200-013-0381-1.
[5] ILYASOGLU H, GULTEKIN-OZGUVEN M, OZCELIK B. Production of human milk fat substitute with medium-chain fatty acids by lipase-catalyzed acidolysis: optimization by response surface methodology[J]. LWT-Food Science and Technology, 2011, 44(4): 999-1004. DOI:10.1016/j.lwt.2010.11.027.
[6] XU X, BALCHEN S, HØY C E, et al. Pilot batch production of specific-structured lipids by lipase-catalyzed interesterification: Preliminary study on incorporation and acyl migration[J]. Journal of the American Oil Chemists’ Society, 1998, 75(2): 301-308. DOI:10.1007/s11746-998-0045-4.
[7] JIN J, LI D, ZHU X M, et al. Production of diacylglycerols from glycerol monooleate and ethyl oleate through free and immobilized lipase-catalyzed consecutive reactions[J]. New Biotechnology, 2011, 28(2): 190-195. DOI:10.1016/j.nbt.2010.10.005.
[8] LEE J H, AKOH C C, LEE K T. Physical properties of trans-free bakery shortening produced by lipase-catalyzed interesterif cation[J]. Journal of the American Oil Chemists’ Society, 2008, 85(1): 1-11. DOI:10.1007/s11746-007-1155-0.
[9] LI W, DU W, LI Q, et al. Dependence on the properties of organic solvent: study on acyl migration kinetics of partial glycerides[J]. Bioresource Technology, 2010, 101(15): 5737-5742. DOI:10.1016/ j.biortech.2010.03.018.
[10] XU X, SKANDS A R H, HØY C E, et al. Production of specificstructured lipids by enzymatic interesterif cation: elucidation of acyl migration by response surface design[J]. Journal of the American Oil Chemists’ Society, 1998, 75(12): 1179-1186. DOI:10.1007/s11746-998-0309-z.
[11] YANG T, FRUEKILDE M B, XU X. Suppression of acyl migration in enzymatic production of structured lipids through temperature programming[J]. Food Chemistry, 2005, 92(1): 101-107. DOI:10.1016/ j.foodchem.2004.07.007.
[12] YUAN G F, CHEN X E, LI D. Conjugated linoleic acids and their bioactivities: a review[J]. Food and Function, 2014, 5(7): 1360-1368. DOI:10.1039/c4fo00037d.
[13] MARTINEZ C E, VINAY J C, BRIEVA R, et al. Lipase-catalyzed acidolysis of corn oil with conjugated linoleic acid in hexane[J]. Journal of Food Lipids, 2003, 10(1): 11-24. DOI:10.1111/j.1745-4522.2003.tb00002.x.
[14] 商允鹏, 生庆海, 王贞瑜, 等. 三酰甘油Sn-2位上棕榈酸生理功能及研究概况[J]. 中国粮油学报, 2010, 25(10): 119-123.
[15] 黄楚楚, 熊辉煌, 龚斌, 等. 脂肪酶催化单油酸甘油酯制备功能性1,3-甘油二酯[J]. 食品科学, 2015, 36(22): 1-5. DOI:10.7506/ spkx1002-6630-201522001.
[16] 胡蒋宁, 张超, 邓泽元, 等. Lipozyme RMIM催化苦瓜籽油和葵酸合成功能性油脂[J]. 食品科学, 2011, 32(24): 92-97.
[17] OH J E, LEE K W, PARK H K, et al. Lipase-catalyzed acidolysis of olive oil with capric acid: effect of water activity on incorporation and acyl migration[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 9280-9283. DOI:10.1021/jf9023245.
[18] 曹昱. 新型结构脂的酶法制备与功能特性研究[D]. 广州: 华南理工大学, 2013.
[19] ODA M, KAIEDA M, HAMA S, et al. Facilitatory effect of immobilized lipase-producing Rhizopus oryzae, cells on acyl migration in biodiesel-fuel production[J]. Biochemical Engineering Journal, 2005, 23(1): 45-51. DOI:10.1016/j.bej.2004.10.009.
[20] 李人望. 溶剂和水活度对脂肪酶1,3-位置选择性和酰基迁移的影响研究[D]. 北京: 清华大学, 2010.
[21] ZHU X M, HU J N, XUE C L, et al. Physiochemical and oxidative stability of interesterified structured lipid for soft margarine fat containing Δ5-UPIFAs[J]. Food Chemistry, 2012, 131(2): 533-540. DOI:10.1016/j.foodchem.2011.09.018.
[22] 冯永方, 韦伟, 童静静, 等. Sn-2位富含棕榈酸甘油三酯的酶法制备研究[J]. 食品工业科技, 2012, 33(24): 227-232. DOI:10.13386/ j.issn1002-0306.2012.24.024.
[23] GOLI S A H, KADIVAR M, KERAMAT J, et al. Conjugated linoleic acid (CLA) production and lipase-catalyzed interesterification of purified CLA with canola oil[J]. European Journal of Lipid Science and Technology, 2008, 110(5): 400-404. DOI:10.1002/ejlt.200700267.
[24] 惠菊. 共轭亚油酸甘油酯的酶法制备及其降脂功能的研究[D]. 无锡: 江南大学, 2009.
[25] KIM I H, YOON C S, CHO S H, et al. Lipase-catalyzed incorporation of conjugated linoleic acid into tricaprylin[J]. Journal of the American Oil Chemists Society, 2001, 78(5): 547-551. DOI:10.1007/s11746-001-0301-4.
[26] LI W, LI R W, LI Q, et al. Acyl migration and kinetics study of 1(3)-positional specific lipase of Rhizopus oryzae-catalyzed methanolysis of triglyceride for biodiesel production[J]. Process Biochemistry, 2010, 45(12): 1888-1893. DOI:10.1016/j.procbio.210.03.034.
[27] XU X, BALCHEN S, H☒Y C E, et al. Production of specificstructured lipids by enzymatic interesterification in a pilot continuous enzyme bed reactor[J]. Journal of the American Oil Chemists’ Society, 1998, 75(11): 1573-1579. DOI:10.1007/s11746-998-0096-6.
[28] HUNTER J E. Studies on effects of dietary fatty acids as related to their position on triglycerides[J]. Lipids, 2001, 36(7): 655-668. DOI:10.1007/s11745-001-0770-0.
[29] ZHU X M, HU J N, LEE J H, et al. Oxidation and antioxidative effects of rosemary extract and catechin on enzymatically modified lipids containing different total and positional fatty acid compositions[J]. Food Science and Biotechnology, 2014, 23(5): 1389-1396. DOI:10.1007/s10068-014-0190-5.
Optimization of Production of Structured Lipids Containing Conjugated Linoleic Acid by Lipozyme TLIM Catalysis
WANG Xiaoya
1, LIU Wenqiang
1, ZHU Wenting
1, ZENG Kai
2, ZHU Xuemei
1,*, XIONG Hua
1, HU Jiangning
1
(1. State Key Laboratory of Food Science and Technology, School of Food Scicence and Technology, Nanchang University, Nanchang 330047, China; 2. Nanchang Food Quality Health Safety Supervision and Inspection Center, Nanchang 330012, China)
Abstract:In this study, structured lipids containing conjugated linoleic acid (CLA) were produced from the reaction between camellia seed oil and CLA ethyl ester catalyzed by Lipozyme TLIM, where Sn-2 positional CLA was obtained by enhancing acyl migration. Four reaction parameters, namely temperature, water activity, reaction time and molar ratio of substrates, were optimized by response surface methodology (RSM) for improved total CLA incorporation and acyl migration. In the synthesized structured lipids, total and Sn-2 positional CLA were up to 36.97% and 12.54% when acyl migration was maximized. The incorporation ratios of total CLA and Sn-2 positional CLA were both higher than the published data.
Key words:Lipozyme TLIM; CLA; structured lipid; acyl migration
DOI:10.7506/spkx1002-6630-201702034
中图分类号:TQ645
文献标志码:A
文章编号:1002-6630(2017)02-0214-06
引文格式:
王晓雅, 刘文强, 朱雯婷, 等. 响应面试验优化Lipozyme TLIM催化制备共轭亚油酸结构脂工艺[J]. 食品科学, 2017, 38(2): 214-219. DOI:10.7506/spkx1002-6630-201702034. http://www.spkx.net.cn
WANG Xiaoya, LIU Wenqiang, ZHU Wenting, et al. Optimization of production of structured lipids containing conjugated linoleic acid by Lipozyme TLIM catalysis[J]. Food Science, 2017, 38(2): 214-219. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702034. http://www.spkx.net.cn
收稿日期:2016-04-11
基金项目:国家自然科学基金地区科学基金项目(31460427);国家自然科学基金面上项目(31571870);食品科学与技术国家重点实验室自由探索资助课题(SKLF-ZZB-201510)
作者简介:王晓雅(1993—),女,硕士研究生,研究方向为粮食油脂与蛋白质工程。E-mail:765502833@qq.com
*通信作者:朱雪梅(1982—),女,副教授,博士,研究方向为粮食油脂与蛋白质工程。E-mail:zhuxuemei@ncu.edu.cn