吴 昊,王艺颖,甄天元,罗 丹,张 潇,杨绍兰,王成荣*
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
摘 要:利用漆酶、辣根过氧化物酶在均相和非均相反应体系中催化壳聚糖与没食子酸反应,以增强壳聚糖的抗氧化性。研究酶种类、反应体系pH值、反应温度、反应时间、酶用量和底物的质量比等因素对产物接枝率的影响。利用单因素试验和正交试验确定的最适反应条件为反应pH 4.5、反应温度25 ℃、反应时间5 h、没食子酸与壳聚糖的质量比3∶1、漆酶用量4 U,此条件下衍生物的接枝率为65.2%。对衍生物分别进行体外抗氧化活性和细胞毒性检测,结果表明,在相同添加量的情况下,衍生物的抗氧化性显著高于未改性的壳聚糖,而且产物无细胞毒性。
关键词:酶;壳聚糖没食子酸衍生物;抗氧化;细胞毒性
壳聚糖(chitosan,CTS)是甲壳素脱乙酰基后得到的一种无毒的、生物可降解多糖,广泛应用于食品工业、医药、化妆品和废水处理等方面 [1]。CTS的抗氧化能力主要来自于氨基上N的螯合能力以及氨基和羟基较弱的给电子能力,被称为次级型抗氧化剂 [2]。由于CTS仅能溶于稀酸,故限制了CTS的应用,因此,对CTS进行改性,在提高其溶解度的同时赋予其新的特性,已成为研究开发CTS应用的方向之一 [3]。
没食子酸(gallic acid,GA)是一种从植物(特别是绿茶)中提取的天然酚类抗氧化剂,具有较强的清除自由基和抗氧化作用,GA作为初始型抗氧化剂,可以很好地提供氢原子或电子以抑制氧化链的反应 [4],但是GA作为小分子抗氧化剂的稳定性较差,在高温、光照等条件下易分解。有效的方法是将这些小分子共价结合到配体上,以增强它的稳定性 [5]。已有研究者采用化学方法将其结合到CTS分子上来增强CTS的抗氧化性 [6-7]和GA的稳定性,但化学方法存在着反应步骤多、专一性差等特点,随着人们环保意识的增强,作为绿色化学研究的一个重要部分,生物催化剂酶用于高分子的合成及改性正成为一个新的研究热点。
漆酶(EC1.10.3.2)是一种含铜的多酚氧化酶,在果汁加工、生物漂白、物质合成和废水处理等方面被广泛应用,它利用铜离子特有的氧化还原能力氧化酚类和芳香类化合物,利用自由基反应机理完成4 个电子的转移,同时将分子氧还原成水 [8]。酚类化合物是典型的漆酶底物,它的氧化还原电势较低,可以允许电子传递给Cu(Ⅰ),反应过程中,酚被氧化成苯氧自由基,根据反应条件的不同,可以进一步通过自由基偶合反应发生聚合或重排生成苯醌。漆酶可以使酚型结构单元失去一个电子形成酚氧游离基,进而形成醌型结构 [9],醌可以与CTS上的氨基基团产生化学键连接,目前普遍认为醌与氨基通过席夫碱或迈克尔加成反应机理发生共价作用。
辣根过氧化物酶(horse radish peroxidase,HRP)是应用较广泛的一种酶制剂,是一种含铁卟啉辅基的糖蛋白复合酶 [10],对底物具有光谱选择性,能催化氧化漆酶所不能催化的一元酚和一元胺 [11]且具有特殊的催化效果,在H 2O 2的存在下,能够使苯胺类物质或酚类的单体发生聚合反应,在单体氨基、羟基的邻、对位发生交联 [12]。在酶促反应中通常把过氧化氢作为HRP的底物,在有供氢体存在时,二者反应快且专一,被视作理想的催化组合。HRP易于提取、价格低廉、性能稳定、耐热性好且活性很少受损失,因此适于催化CTS与GA的聚合。
本实验以CTS和GA为原料,利用漆酶与HRP为催化剂催化二者合成,通过单因素试验和正交试验考察最适反应条件,以接枝率和溶解度为考察指标得出最适酶种类和反应方法,并在此基础上对产物的体外抗氧化活性和细胞毒性进行研究,旨在为CTS-GA衍生物的酶法制备和应用提供理论参考。
1.1 材料与试剂
CTS(脱乙酰度为90.8%) 青岛云宙生物科技有限公司;GA 天津市科密欧化学试剂有限公司;漆酶(由米曲霉制得,酶活力1 000 U/g)、HRP(酶活力300 U/mg) Solarbio专业分子试剂生产商;其他试剂均为国产分析纯。
1.2 仪器与设备
AR 2140电子分析天平(万分位) 奥豪斯国际商贸有限公司;81-2恒温磁力搅拌器 国华电器有限公司;pH计 瑞士Mettler Toledo公司;真空循环水式真空泵 郑州科工贸有限公司;真空冷冻干燥机 德国Marin Christ公司;Elx808型自动酶标仪 美国Bio-Tek公司;MCO-18AIC型CO 2培养箱 日本Sanyo公司;CKX-41型倒置显微镜 日本Olympus公司;SW-CJ-1FD型单人单面超净化工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 接枝率的测定
用线性电位滴定法 [13]测定CTS自由氨基含量,按下式计算接枝率:
式中:D 0为接枝前CTS的自由氨基含量;D 1为接枝后CTS-GA衍生物的自由氨基含量;D为未处理CTS的自由氨基含量。
1.3.2 接枝反应酶和方法的选择
1.3.2.1 均相方法
将1.0 g CTS粉末溶于100 mL pH 4.5的乙酸-乙酸钠缓冲溶液中,搅拌至完全溶解后按质量比3∶1的量加入GA,继续搅拌,溶解完全后分别加入同等酶活的漆酶和HRP,于25 ℃气浴摇床中反应8 h,反应完成后加无水乙醇醇沉24 h,抽滤,将产物溶于超纯水中,透析24 h,每隔8 h换一次水,冷冻干燥后得CTS-GA衍生物。
1.3.2.2 非均相方法
取一定质量的CTS薄膜溶于pH 6.5的乙酸-乙酸钠缓冲液中,按质量比为3∶1的量加入GA,搅拌均匀后加入同等酶活的漆酶和HRP,于25 ℃气浴摇床中反应8 h,反应结束后将CTS-GA膜取出烘干至质量恒定。
1.3.3 溶解度测定
取20 mg干燥至质量恒定的CTS-GA溶解于50 mL蒸馏水中,气浴摇床中振荡溶解24 h,目测溶解情况,将不溶解的样品过滤干燥后称量质量,比较前后质量差,计算溶解度。
1.3.4 单因素试验
接枝反应方法和酶种类确定后,测定制备得到的CTS-GA接枝率。固定其他条件,分别考察反应pH(2.7~4.5)、反应时间(1~8 h)、反应温度(25~55 ℃)、漆酶用量(1~20 U)和GA与CTS的质量比(1∶1~6∶1)对接枝率的影响。
1.3.5 正交试验
在单因素试验的基础上,为了获得制备CTS-GA的最适条件,利用正交试验法,以反应时间、反应温度、漆酶用量和GA与CTS质量比(GA/CTS)为4 个考察因素,选取3 个水平进行试验。采用L 9(3 4)正交表进行正交试验设计,确定反应的最适条件。因素水平设计见表1,每组试验重复3 次。
表1 正交试验因素与水平
Table1 Factors and their levels used in orthogonal array design

水平因素A反应温度/℃B漆酶用量/UC反应时间/hD GA/CTS 1 25342∶1 2 30453∶1 3 35564∶1
1.3.6 DPPH自由基清除能力测定
参照杨娜等 [14]的方法测定。
1.3.7 羟自由基(·OH)清除能力测定
参照朱庆麟等 [15]的方法,采用水杨酸法。
1.3.8 超氧阴离子自由基(O 2 -·)清除能力测定
参照赵强忠等 [16]的方法,采用邻苯三酚自氧化法。
1.3.9 细胞毒性实验
参照张林朴等 [17]的方法,采用MTT比色法检测,实验所用细胞为大鼠成纤维细胞。用酶标仪检测样本孔的吸光度A,计算各组在490 nm波长吸光度,计算相对增殖率后,按表2所列标准评价其细胞毒性。
表2 细胞毒性评价标准
Table2 Criteria for cytotoxicity evaluation
细胞毒性0级1级2级3级4级5级相对增殖率/%≥10075~9950~7425~491~240
1.4 数据处理
实验数据为3 次实验的平均值,采用Origin 8.5绘图,SPSS 19.0进行统计分析。
2.1 接枝反应酶种类及方法的确定
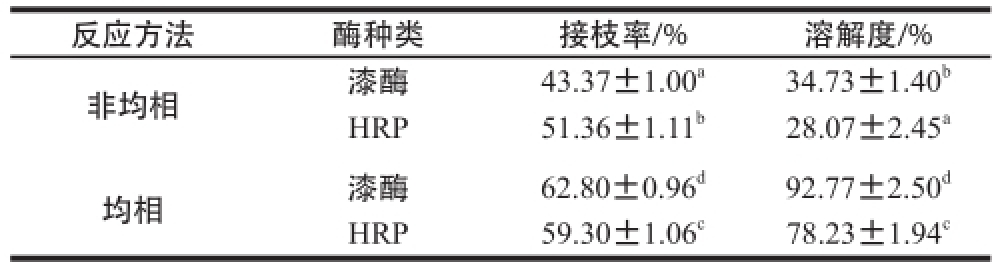
表3 不同酶种类及反应方法对CTS-GA接枝率和溶解度的影响
Tabel 3 Effect of different types of enzymes and different grafting methods on grafting ratio and solubility of CTS-GA
注:表中数据以“±s”表示,同列数据肩标字母不同表示差异显著(P<0.05)。
反应方法酶种类接枝率/%溶解度/%非均相漆酶43.37±1.00 a34.73±1.40 bHRP51.36±1.11 b28.07±2.45 a均相漆酶62.80±0.96 d92.77±2.50 dHRP59.30±1.06 c78.23±1.94 c
由表3可以看出,利用漆酶催化反应,采用均相方法可以使CTS获得较高的接枝率。采用非均相方法制备的CTS-GA接枝率低于均相方法,HRP的最适pH 6.0左右,因此采用HRP催化反应时适宜采用非均相方法,但非均相制备得到的衍生物溶解度并不理想。有研究表明,CTS在均相条件下脱乙酰,当CTS的自由氨基脱去50%左右时,产物具有良好的水溶性,但如果反应在非均相的条件下进行,不论其脱乙酰度如何,都不溶于水 [18-19]。本实验中酶种类和合成方法对接枝率和溶解度的影响差异显著,因此,该实验采用均相方法来合成CTS-GA,使用漆酶来催化该反应。
2.2 单因素试验结果
2.2.1 反应pH值对接枝率的影响
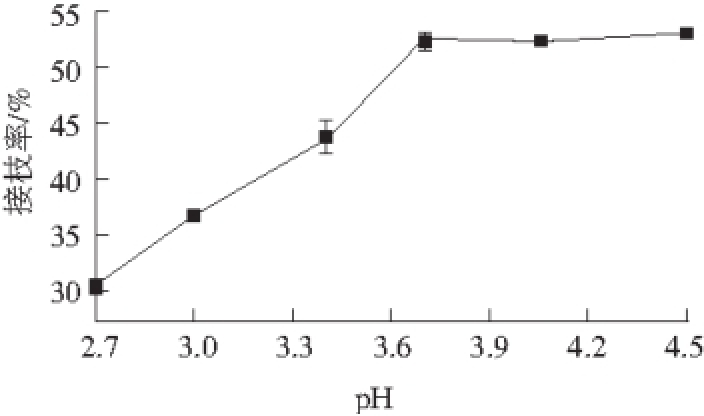
图1 pH值对衍生物接枝率的影响
Fig. 1 Influence of initial reaction pH on grafting ratio of derivatives
从图1可以看出,pH值小于3.0时,CTS-GA的接枝率小于40%,随着酸性的逐渐减弱,CTS-GA接枝率逐渐升高,当pH值在3.7~4.5范围内,接枝率保持稳定,维持在50%~55%之间,无显著性差异。随着pH值的增大,CTS溶解度下降。当pH值在3.7~4.5范围内时,可使CTS-GA获得较高的接枝率,这与漆酶在pH 4.5附近具有较高活性的性质是一致的 [20]。综合考虑接枝率与漆酶最适pH值范围,后续正交试验中并不把pH值作为考察因素,直接选用4.5为最佳反应pH值。
2.2.2 反应温度对接枝率的影响
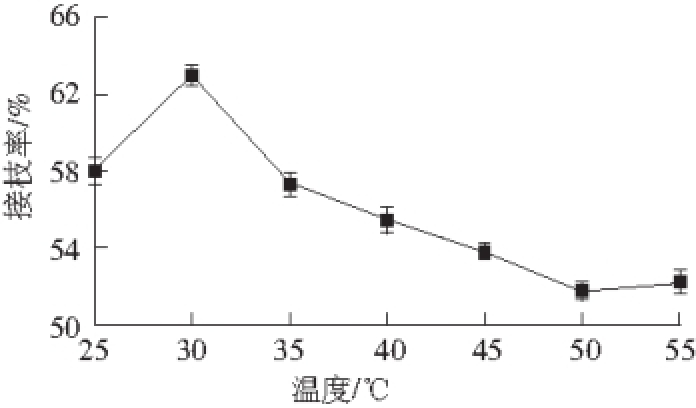
图2 温度对衍生物接枝率的影响
Fig. 2 Influence of reaction temperature on grafting ratio of derivatives
漆酶的最适反应温度较低,一般在25~50 ℃之间,从图2可以看出,在室温(25 ℃)条件下,CTS-GA的接枝率为58%,随着温度的逐渐升高,接枝率随之升高,在30 ℃时达到最高值(63.5%),但当温度继续升高时,接枝率出现逐渐下降的趋势,这可能是由于温度升高,漆酶催化活性提高,等量漆酶能催化更多GA产生自由基,并增加GA上酚氧自由基与CTS链的接触几率,所以温度升高有利于提高接枝率。但温度过高,影响漆酶活力,接枝率降低。同时由于CTS的接枝反应是加成和解聚反应的可逆过程,当温度达到30 ℃时,由于加成反应速率小于解聚反应速率,接枝率反而有所下降。因此,30 ℃是漆酶催化CTS与GA反应的最适温度。
2.2.3 漆酶用量对接枝率的影响
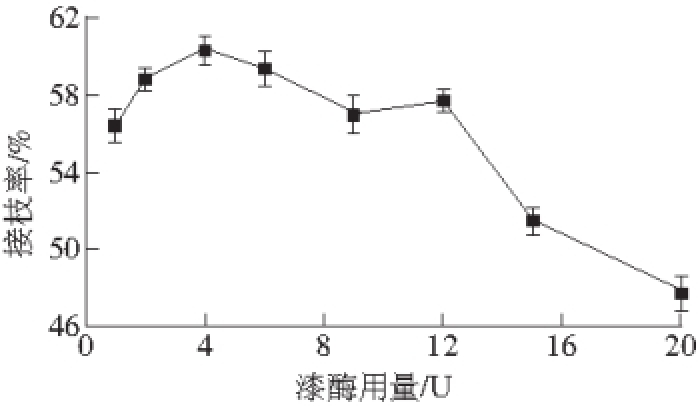
图3 漆酶用量对衍生物接枝率的影响
Fig. 3 Influence of enzyme dosage on grafting ratio of derivatives
从图3可以看出,随着漆酶用量的增加,接枝率呈先上升后下降的趋势,当漆酶用量达到4 U后,CTS-GA的接枝率逐渐下降,这可能是由于催化氧化GA的反应速率加快,反应中间产物还未充分与CTS上氨基反应完全就自身发生聚合反应引起接枝率下降。在该反应体系中,当漆酶用量为4 U时,可使CTS-GA的接枝率达到最高(60.3%)。
2.2.4 反应时间对接枝率的影响

图4 反应时间对衍生物接枝率的影响
Fig. 4 Influence of reaction time on grafting ratio of derivatives
从图4可以看出,随着反应时间的延长,CTSGA接枝率呈先上升后下降的趋势,在4 h达到最高值(63.4%),随着时间的延长,接枝率逐渐降低。反应前期,随着反应时间的延长,CTS-GA的接枝率逐渐增加,CTS-GA达到一定浓度后,会抑制正反应的进行,使逆反应的速率增加,最终反应逐渐趋于平衡。
2.2.5 GA/CTS对接枝率的影响
从图5可以看出,当GA/CTS为3∶1时,接枝率最大。当GA的质量浓度较低时,CTS分子中的氨基位点多于GA分子的数量,使得CTS并不能全部参与反应,进而导致CTS-GA接枝率降低。随着反应体系中GA质量浓度的不断增加,有利于GA酚氧自由基的生成,但由于CTS接枝位点数量有限,GA/CTS大于3∶1时,接枝率趋于平衡。当GA质量浓度继续增加时,过量的GA使漆酶催化氧化GA速率加快,反应中间产物未充分与CTS上的氨基反应完全就自身发生聚合反应引起接枝率下降。因此,当GA/CTS为3∶1时,可达到最高接枝率。

图5 GA 5 GA/CTS对衍生物接枝率的影响
Fig. 5 Influence of GA-to-CTS ratio on grafting ratio of derivatives
2.3 正交试验结果及数据分析
表4 正交试验设计及结果
Table4 Orthogonal array design with experimental results
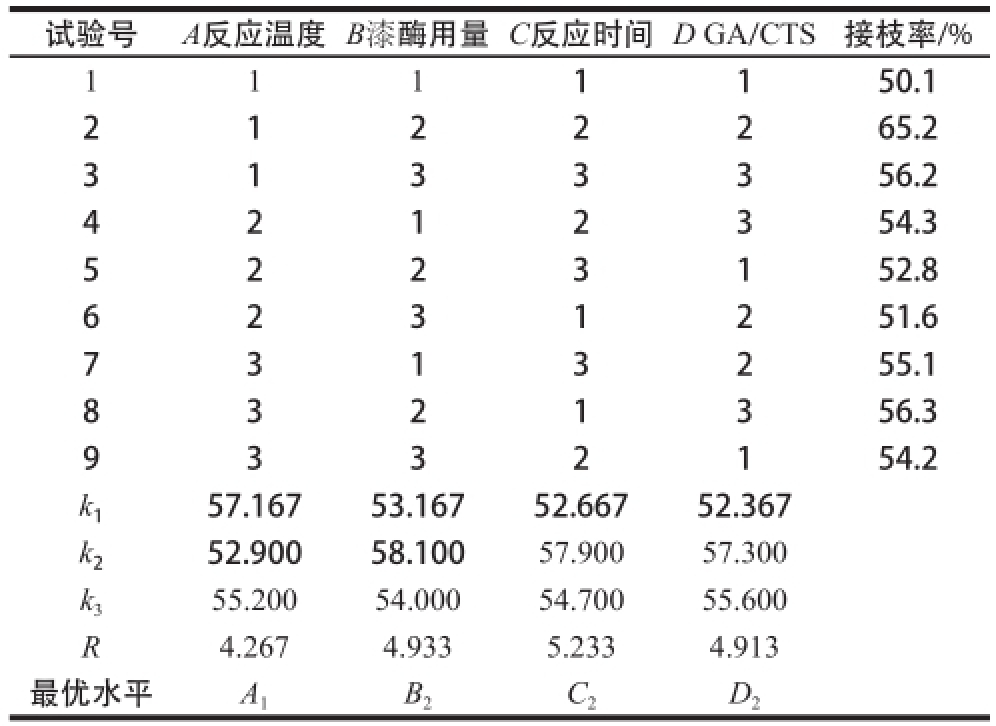
试验号A反应温度B漆酶用量C反应时间D GA/CTS接枝率/% 1 1 1 1 150.1 2 265.2 3 1 3 3 356.2 1 2 2 4 354.3 5 2 2 3 152.8 2 1 2 6 251.6 7 3 1 3 255.1 2 3 1 8 356.3 9 3 3 2 154.2 3 2 1 k 157.16753.16752.66752.367 k 252.90058.10057.90057.300 k 355.20054.00054.70055.600 R4.2674.9335.2334.913最优水平A 1B 2C 2D 2
如表4所示,在所选试验范围内,各因素对接枝率的影响主次为C(反应时间)>B(漆酶用量)>D(GA/CTS)>A(反应温度)。由正交试验结果得出,反应温度25 ℃、漆酶用量4 U、反应时间5 h、GA/CTS 3∶1是合成CTS-GA的最适条件。
2.4 CTS-GA抗氧化活性
2.4.1 清除DPPH自由基的能力
如图6所示,CTS对DPPH自由基的清除率最高不超过30%,原因是CTS给电子能力较弱,属于次级抗氧化剂,以及CTS分子间和分子内氢键抑制了对自由基的清除,而CTS-GA在很小质量浓度变化范围内对DPPH自由基清除作用显著提高,6.5 μg/mL时对DPPH自由基的清除率高达90%。CTS-GA和GA对DPPH自由基清除率的IC 50值分别为1.45 μg/mL和1.39 μg/mL,二者IC 50值显著低于未改性CTS,并且CTS-GA对DPPH自由基的清除效果优于GA,这可能是由于改性后的CTS-GA活性羟基增多,能提供更多质子与DPPH自由基结合生成稳态的DPPH 2
[21],进而有效地清除了DPPH自由基,因此,通过GA改性CTS制备的CTS-GA抗氧化能力得到显著提高。
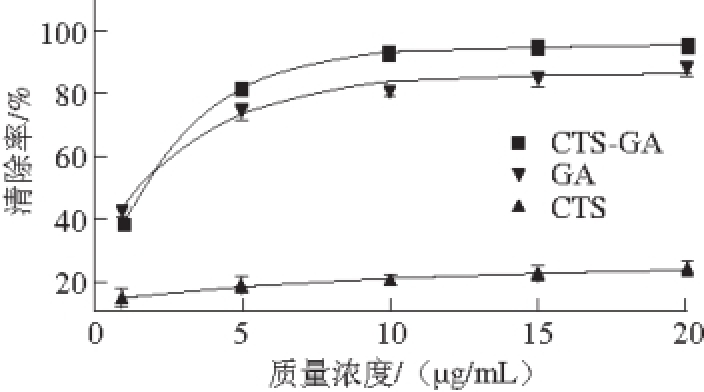
图6 CTS、GA和衍生物清除DPPH自由基能力
Fig. 6 DPPH scavenging capacity of CTS, GA and CTS-GA
2.4.2 清除·OH能力

图7 CTS、GA和衍生物清除☒OH能力
Fig. 7 Hydroxyl radical scavenging capacity of CTS, GA and CTS-GA
由图7可以看出,CTS由于自身结构等原因具备极低的清除·OH的能力,在质量浓度为250 μg/mL时,CTS对☒OH的清除率仅为19.1%,而GA和CTS-GA对☒OH的清除率分别高达54.5%和78.6%。各样品对☒OH的清除能力随质量浓度的增大而增加,其中CTS-GA最为明显。CTS-GA之所以具备较高的清除☒OH能力,可能是由于CTS-GA含有较多的羟基(一部分是CTS本身存在的羟基,另一部分是经GA改性后新引入的羟基),羟基的氢原子可以与☒OH发生夺氢反应从而起到清除☒OH的作用 [22]。
2.4.3 清除
 ·的能力
·的能力
CTS中存在伯、仲羟基、—NH
2,可与
 ·发生反应,清除
·发生反应,清除
 ·,由于高分子CTS含较多氢键,结构紧密,使得CTS中的活性官能团与
·,由于高分子CTS含较多氢键,结构紧密,使得CTS中的活性官能团与
 ·作用的几率降低
[23]。而CTS与GA反应生成CTS-GA后,虽然相应的—NH
2位点减少,但由于GA的加入引入了更多的—OH,更易与
·作用的几率降低
[23]。而CTS与GA反应生成CTS-GA后,虽然相应的—NH
2位点减少,但由于GA的加入引入了更多的—OH,更易与
 充分作用,因此,清除
充分作用,因此,清除
 ·能力增强。从图8可以看出,CTS-GA清除
·能力增强。从图8可以看出,CTS-GA清除
 ·效果显著优于CTS,但与GA相比,差异不显著,GA已被证实在体外具有较强的抗氧化作用,因此,CTS-GA也可作为一种有效的抗氧化剂
[24]。
·效果显著优于CTS,但与GA相比,差异不显著,GA已被证实在体外具有较强的抗氧化作用,因此,CTS-GA也可作为一种有效的抗氧化剂
[24]。

图8 CTS、GA和衍生物清除
 ☒能力
☒能力
Fig. 8 Superoxide anion radical scavenging capacity of CTS, GA and CTS-GA
2.5 细胞毒性检验结果
表5 CTS、GA和CTS-GA细胞毒性结果
Table5 Cytotoxicity of CTS, GA and CTS-GA
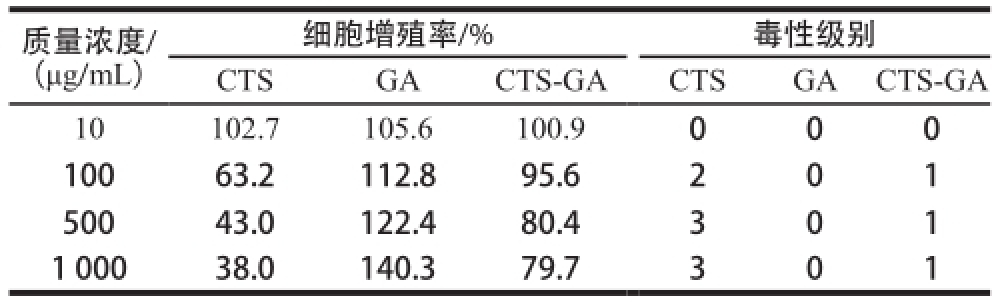
质量浓度/(μg/mL)细胞增殖率/%毒性级别CTSGACTS-GACTSGACTS-GA 10102.7105.6100.9000 10063.2112.895.6201 50043.0122.480.4301 1 00038.0140.379.7301
MTT比色法检测CTS-GA细胞毒性结果见表5。在低质量浓度(10 μg/mL)时CTS、GA和CTS-GA细胞增殖率均大于100%,毒性级别为0级,当质量浓度范围在500~1 000 μg/mL时,CTS-GA毒性级别显著低于CTS。这一结果表明,采用GA对CTS进行适当改性后,CTSGA细胞毒性明显降低,CTS-GA有可能成为一类用途更为广泛、安全无毒的抗氧化剂。
采用均相方法合成CTS-GA,最适反应条件为pH 4.5、反应温度25 ℃、漆酶用量4 U、反应时间5 h,GA/CTS 3∶1,此条件下CTS-GA的接枝率为65.2%。CTS经过GA改性生成CTS-GA后,抗氧化能力明显提高;在500~1 000 μg/mL质量浓度范围内,CTS-GA的毒性明显低于CTS,属安全范围。
参考文献:
[1] MOJCA B, SELESTINA G, VANJA K. Laccase-mediated functionalization of chitosan by caffeic and gallic acids for modulating antioxidant and antimicrobial properties[J]. Carbohydrate Polymers, 2012, 87: 2388-2398. DOI:10.1016/j.carbpol.2011.11.006.
[2] SCHREIBER B. Introduction of primary antioxidant activity to chitosan for application as a multifunctional food packaging material[J]. Food Hydrocolloids, 2013, 33(2): 207-214. DOI:10.1016/ j.foodhyd.2013.03.006.
[3] 陶露丝, 司菲斐. N-琥珀酰壳聚糖制备及理化特性研究[J]. 现代食品科技, 2007, 23(7): 26-28. DOI:10.3969/ j.issn.1673-9078.2007.07.007.
[4] PASANPHAN W, CHIRACHANCHAI S. Conjugation of gallic acid onto chitosan: an approach for green and water-based antioxidant[J]. Carbohydrate Polymers, 2008, 72(1): 169-177. DOI:10.1016/ j.carbpol.2007.08.002.
[5] SUN X, WANG Z, KADOUH H. The antimicrobial, mechanical, p hysical and structural properties of chitosan-gallic acid films[J]. LWT-Food Science and Technology, 2014, 57(1): 83-89. DOI:10.1016/ j.carbpol.2007.08.002.
[6] 吴昊, 朱俊向, 王成荣, 等. 壳聚糖没食子酸衍生物制备及其对鲜切苹果的保鲜作用[J]. 现代食品科技, 2014, 30(5): 251-257. DOI:10.13982/j.mfst.1673-9078.2014.05.043.
[7] YU S H, MI F L, PANG J C, et al. Preparation and characterization of radical and pH-responsive chitosan-gallic acid conjugate drug carriers[J]. Carbohydrate Polymers, 2011, 84: 794-802. DOI:10.1016/ j.carbpol.2010.04.035.
[8] MOJCA B, JANEZ S, VANJA K. Laccase-initiated reaction between phenolic acids and chitosan[J]. Reactive and Functional Polymers, 2013, 73: 1377-1383. DOI:10.1016/j.reactfunctpolym.2013.01.005.
[9] SUTEERA W, ARTHUR J, RAGAUSKAS A J. Modification of high-lignin softwood kraft pulp with laccase and amino acid[J]. Enzyme and Microbial Technology, 2009, 44: 176-181. DOI:10.1016/ j.enzmictec.2008.10.011.
[10] 王刊, 王菊芳. 辣根过氧化物酶在亲水性离子液体中的活性与稳定性研究[J]. 分子催化, 2009, 23(1): 73-79. DOI:10.16084/j.cnki. issn1001-3555.2009.01.001.
[11] 钟平方. 漆酶、酪氨酸酶和辣根过氧化物酶催化酚类及苯胺化合物动力学分析及应用[D]. 重庆: 重庆医科大学, 2010.
[12] 李晔, 杨慧, 韩伟伟, 等. 一种可用于酚类化合物检测的酶传感器[J]. 光谱学与光谱分析, 2010, 30(2): 571-574. DOI:10.3964/j.is sn.1000-0593(2010)02-0571-04.
[13] 裴继诚, 余成华, 张方东, 等. 漆酶催化壳聚糖-阿魏酸接枝共聚提高产物抗氧化及抗菌性的研究[J]. 功能材料, 2014, 45(14): 14037-14043. DOI:10.3969/j.issn.1001-9731.2014.14.007.
[14] 杨娜, 王鸿飞, 许凤, 等. 蕨麻多糖提取及抗氧化活性研究[J]. 中国食品学报, 2014, 14(2): 60-66. DOI:10.16429/j.1009-7848.2014.02.013.
[15] 朱庆麟, 吕丽爽. 何首乌多糖的纯化及功能性研究[J]. 当代化工, 2014, 43(10): 2005-2008. DOI:10.3969/j.issn.1671-0460.2014.10.020.
[16] 赵强忠, 刘丹. 秋刀鱼抗氧化肽制备及其抗氧化活性的研究[J]. 现代食品科技, 2014, 30(10): 165-172. DOI:10.13982/ j.mfst.1673-9078.2014.10.028.
[17] 张林朴, 王冠华, 连小丽, 等. 海藻酸钠/壳聚糖复合凝胶的制备与细胞毒性评价[J]. 中国组织工程研究, 2014, 18(21): 3310-3315. DOI:10.3969/j.issn.2095-4344.2014.21.006.
[18] 宋巍, 陈元维, 史国齐, 等. 不同脱乙酰度壳聚糖的制备及结构性能的研究[J]. 功能材料, 2007, 10(38): 1705-1710. DOI:10.3321/ j.issn:1001-9731.2007.10.042.
[19] 多英全, 陈煜, 梁彩仪, 等. 水溶性壳聚糖的制备及表征[J].高分子材料科学与工程, 2003, 19(2): 69-73. DOI:10.3321/ j.issn:1000-7555.2003.02.016.
[20] 司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. DOI:10.13560/j.cnki.biotech. bull.1985.2011.02.018.
[21] 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32(1): 86-90.
[22] 孙涛, 银旭红, 谢晶, 等. 取代度相同的N-酰化低聚壳聚糖清除自由基作用的研究[J]. 食品与生物技术学报, 2010, 29(3): 406-409.
[23] 邢荣娥, 刘松, 于华华, 等. 不同分子量壳聚糖和壳聚糖硫酸酯的抗氧化活性[J]. 应用化学, 2005, 22(9): 958-961. DOI:10.3969/ j.issn.1000-0518.2005.09.008.
[24] 谢晓艳, 刘洪涛, 张吉, 等. 没食子酸体外抗氧化作用研究[J]. 重庆医科大学学报, 2011, 36(3): 319-322. DOI:10.13406/j.cnki. cyxb.2011.03.005.
Optimization of Enzymatic Reaction between Chitosan and Gallic Acid for Enhanced Antioxidative Activity and Reduced Cytotoxicity
WU Hao, WANG Yiying, ZHEN Tianyuan, LUO Dan, ZHANG Xiao, YANG Shaolan, WANG Chengrong*
(College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China)
Abstract:In this paper, chitosan (CTS) grafted copolymer with gallic acid (GA) was synthesized by laccase and horse radish peroxidase to enhance the antioxidant activity of chitosan. The effects of enzyme type and dosage, initial reaction pH, temperature, reaction time, and enzyme-to-substrate ratio on the grafting ratio were studied. The maximum grafting ratio (65.2%) was obtained when the reaction took place at 25 ℃ for 5 h in 100 mL of acetate buffer solution (100 mmol/L) at pH 4.5 with a mass ratio of GA to CTS of 3 in the presence of 4 U of laccase under constant stirring. At the same dosage, the CTSGA copolymer showed signif cantly higher antioxidant activity than chitosan and had no cytotoxicity.
Key words:enzyme; derivative from chitosan and gallic acid; antioxidant; cytotoxicity
DOI:10.7506/spkx1002-6630-201702036
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)02-0227-06
引文格式:
吴昊, 王艺颖, 甄天元, 等. 壳聚糖没食子酸衍生物酶法催化条件优化及抗氧化活性和细胞毒性[J]. 食品科学, 2017, 38(2): 227-232. DOI:10.7506/spkx1002-6630-201702036. http://www.spkx.net.cn
WU Hao, WANG Yiying, ZHEN Tianyuan, et al. Optimization of enzymatic reaction between chitosan and gallic acid for enhanced antioxidative activity and reduced cytotoxicity[J]. Food Science, 2017, 38(2): 227-232. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702036. http://www.spkx.net.cn
收稿日期:2016-05-20
基金项目:山东省现代农业(蔬菜)产业技术体系建设项目(SDAIT-05-21);山东省农业重大应用技术创新项目(SDNYCX-2015-ZD06-02);国家自然科学基金青年科学基金项目(31401549);山东省高等学校科技计划项目(J14LE11);青岛市科技计划项目(14-2-4-71-jch);青岛农业大学高层次人才科研基金项目(1207)
作者简介:吴昊(1981—),女,副教授,博士,研究方向为食品科学。E-mail:wuhaoqau@163.com
*通信作者:王成荣(1958—),男,教授,硕士,研究方向为农产品贮藏与加工、食品科学。E-mail:qauwcr@126.com