谭 莉,陈瑞战*,常清泉,陆 娟,金辰光,殷 薇
(长春师范大学化学学院,吉林 长春 130032)
摘 要:探索和优化超声复合酶解提取淫羊藿叶粗多糖工艺。在单因素试验的基础上,通过正交试验优化复合酶添加量,再采用Box-Behnken设计和响应面优化超声复合酶解提取工艺参数。结果显示:不同酶添加量对多糖提取得率的影响次序是:纤维素酶>果胶酶>木瓜蛋白酶>α-淀粉酶,最佳复合酶(木瓜蛋白酶、果胶酶、纤维素酶和α-淀粉酶)的添加量分别为50、250、200、100 U/g;最佳提取条件为提取温度46.8 ℃、超声时间42.3 min、pH 4.3、超声功率311 W。在此实验条件下,粗多糖提取得率为5.98%,与模型预测值(6.2%)接近。粗多糖通过琼脂糖离子交换和葡聚糖分子筛凝胶柱色谱分离纯化,得到3 个主要多糖组分(EPs-1、EPs-2、EPs-3),多糖组分采用DPPH自由基、羟自由基、超氧阴离子自由基清除和铁离子还原能力实验进行了抗氧化活性评价。结果表明,超声复合酶提取作为一个高效和环保的提取技术,可以应用于从植物原料中提取活性成分;抗氧化活性实验显示3 个多糖组分都具有显著的抗氧化活性,其活性呈添加量依赖关系。这些结果说明淫羊藿多糖可以探索作为潜在的抗氧剂应用于功能食品和药品。
关键词:淫羊藿多糖;超声复合酶;响应面;抗氧化活性
淫羊藿为小檗科植物淫羊藿、箭叶淫羊藿、巫山淫羊藿、朝鲜淫羊藿等多种淫羊藿的茎叶,是一味有名的中药。研究表明淫羊藿富含多糖、黄酮、苷、萜和生物碱等活性成分 [1]。
多糖是富含在植物、动物、菌类和微生物中的天然高分子化合物 [2],具有多种药理活性,如抗氧化活性 [3]、免疫调节活性 [4]和抗肿瘤活性 [5],广泛应用于医疗、功能食品和药品中。从植物组织中提取多糖的传统方法是浸渍、热回流提取等方法,这些方法一般需要较长的超声时间、较高的提取温度和能量消耗。然而多糖的提取率却很低,且容易导致多糖的降解和药理学活性的降低 [6]。近年来发展起来的超声辅助提取 [7]、酶解提取 [8]、微波提取 [9]等绿色环保提取技术,既提高了多糖得率,又最大限度地保持了多糖的结构和活性 [10]。
在姜虹等 [11]响应面优化淫羊藿多糖超声提取工艺的基础上,采用超声复合酶解提取法从淫羊藿叶中提取多糖,利用正交试验和响应面法优化提取工艺,对分离得到的多糖组分进行了体外抗氧化活性评价,为淫羊藿多糖的开发提供理论依据。
1.1 材料与试剂
干的淫羊藿叶购于吉林省抚松县兴隆镇。
葡萄糖、1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三吡啶基吖三嗪(1,3,5-tri(2-pyridyl)-2,4,6-triazine,TPTZ)、VC 美国Sigma公司;木瓜蛋白酶(500 U/mg)、果胶酶(6 U/mg)、纤维素酶(15 U/mg)、α-淀粉酶(4 U/mg) 国药集团化学试剂有限公司;DEAE-Sepharose fast-flow、Sephadex G-100分子筛凝胶 美国Pharmacia公司;其他试剂均为国产分析纯。
1.2 仪器与设备
N-1100旋转蒸发仪 上海爱郎仪器有限公司;UV-1601紫外-可见分光光度计 北京北分瑞利分析仪器公司;X1R高速离心机 德国Heraeus Multifuge公司;SL-2010N超声发生器 南京顺流仪器有限公司。
1.3 方法
1.3.1 粗多糖的提取
干的淫羊藿叶粉碎,依次用石油醚、95%乙醇溶液回流2 次,脱色、脱脂、去低聚糖和小分子物质,挥干溶剂,得预处理样品。称取10 g预处理样品置于烧瓶中,加入复合酶液、蒸馏水,用醋酸调节溶液的pH值。样品在室温条件下浸泡6 h,按照选定的超声功率、时间、温度和溶液pH值进行提取,提取液用Sevag法去除游离蛋白质 [11],减压浓缩至一定体积,加入乙醇至最终乙醇体积分数为70%,在4 ℃的温度条件下沉淀24 h,离心,收集沉淀用流水透析48 h,冻干得到粗多糖。用苯酚-硫酸光度法测多糖含量 [12],计算提取得率。
1.3.2 复合酶添加量正交试验优化
在单因素试验的基础上,固定其他提取条件为提取温度45 ℃、超声时间40 min、pH 5和超声功率300 W,分别考察木瓜蛋白酶添加量(50、100、150 U/g)、果胶酶添加量(150、200、250 U/g)、纤维素酶添加量(100、150、200 U/g)和α-淀粉酶添加量(50、100、150 U/g)对粗多糖提取得率的影响,并采用四因素三水平的L 9(3 4)正交试验来确定复合酶的最佳添加量。
1.3.3 Box-Behnken试验设计
在正交试验确定复合酶配比以及单因素试验的基础上,选择提取温度(X 1)、超声时间(X 2)、溶液pH值(X 3)和超声功率(X 4)4 个因素为自变量,每个因素选取3 个水平,以多糖提取得率为响应值,采用Box-Behnken设计优化超声复合酶解提取条件。利用Design-Expert软件进行数据分析,建立四元二次回归模型。
1.3.4 粗多糖的分离和纯化
称取一定质量的粗多糖用蒸馏水溶解为10 mg/mL的溶液,然后用截留分子质量6 kU超滤装置循环至截留液为原来体积的1/5左右,收集截留溶液,浓缩、过0.45 μm膜,通过离子交换琼脂糖凝胶进行分离,用Tris-HCl缓冲溶液平衡,随后用0.1~0.8 mol/L NH 4HCO 3溶液(流速0.8 mL/min)梯度洗脱。用自动留分收集仪收集洗脱液(每管5 mL),用苯酚-硫酸法跟踪检测多糖含量,合并各吸收峰的洗脱液,得到3 个组分,然后分别上葡聚糖G-100凝胶色谱柱(16 cm×500 mm)进一步纯化,用0.1 mol/L NaCl溶液(流速1.0 mL/min)进行洗脱,收集洗脱液(5 mL/管),苯酚-硫酸法跟踪检测多糖含量,合并主要洗脱峰留分,减压浓缩,然后用蒸馏水透析、冻干,得到纯化多糖组分EPs-1、EPs-2和EPs-3。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除活性测定
取1.0 mL(0.1 mmol/L)DPPH-甲醇溶液与3.0 mL与不同质量浓度(0.1~5.0 mg/mL)多糖溶液混合,于25 ℃避光处反应30 min,然后在517 nm波长条件下测定其吸光度。样品对DPPH自由基清除率计算如式(1)所示:
式中:A 0为只加DPPH溶液的吸光度;A 1为加样品和DPPH溶液的吸光度;A 2为只加样品溶液的吸光度。
1.3.5.2 羟自由基清除活性测定
羟自由基清除实验按文献[13]报道的方法,并作稍微修改。1 mL不同质量浓度的多糖样品(0.5~5 mg/mL)与1 mL(10 mmol/L)FeSO 4、1 mL(2 mmol/L)水杨酸-乙醇溶液和1 mL(5 mmol/L)H 2O 2混合,于37 ℃水浴中反应1 h,在波长510 nm条件下测量其吸光度。样品对羟自由基清除率计算如式(2)所示:
式中:A 0为蒸馏水代替样品的吸光度;A 1为样品反应后的吸光度;A 2为样品和蒸馏水替代H 2O 2的吸光度。1.3.5.3 超氧阴离子自由基清除活性测定
超氧阴离子自由基清除实验按照文献[14]报道的方法,并作稍微修改。5 mL pH值为8.2的Tris-HCl缓冲溶液(0.05 mol/L)分别与0.1 mL不同质量浓度样品(0.5~5 mg/mL)混合,在25 ℃水浴中恒温20 min,加入0.2 mL(3 mmol/L)邻苯三酚,然后在25 ℃水浴中恒温4 min,在325 nm波长条件下测定吸光度,样品对超氧阴离子自由基清除率计算如式(3)所示:
式中:A 1为样品的吸光度;A 0为水代替样品的吸光度。
1.3.5.4 总抗氧化能力测定
样品的总抗氧化能力用铁离子还原能力实验(FRAP)来测定 [15]。新鲜FRAP试剂3.9 mL(300 mmol/L醋酸盐缓冲溶液、10 mmol/L TPTZ溶解在40 mmol/L HCl溶液中、20 mmol/L FeCl 3按照体积比10∶1∶1混合)与0.1 mL样品混合,在37 ℃温度条件下恒温8 min,在593 nm波长处测定吸光度。分别用0.1 mL不同浓度的(0.1~1.0 mmol/L)的FeSO 4与3.9 mL FRAP试剂混合,在37 ℃条件下反应8 min,在593 nm波长处测定吸光度,以FeSO 4浓度和吸光度回归,绘制标准曲线,由标准曲线计算样品的总抗氧化能力,总抗氧化能力以达到同样吸光度所需的FeSO 4的浓度表示。
2.1 酶添加量对多糖提取得率的影响
其他提取参数分别固定为:浸泡时间6 h、超声频率40 kHz、提取温度45 ℃、超声功率300 W、超声时间40 min、水料比30∶1(mL/g)、pH 4。

图1 不同种类酶添加量对多糖提取得率的影响
Fig. 1 Effect of enzyme dose on the yield of CEPs
如图1a所示,木瓜蛋白酶添加量50~100 U/g,粗多糖的提取得率逐渐增加,当添加量超过100 U/g提取得率保持相对不变。这表明粗多糖中大多数蛋白质由Sevag试剂除去,但在多糖中会有一定量的糖蛋白,适当增加木瓜蛋白酶添加量对多糖的提取是有利的。当这些结合蛋白酶解趋于完全时,再增加木瓜蛋白酶添加量粗多糖提取得率不再增加。所以,木瓜蛋白酶较为适宜的添加量是100 U/g。
如图1b所示,果胶酶添加量在50~200 U/g提取得率快速增加。超过这一添加量范围,增加果胶酶添加量,粗多糖提取得率随添加量的增加缓慢增加。增加果胶酶的添加量可以有效酶解提取液中的果胶,适当降低提取液的黏度,这些都有利于多糖的提取。然而,较高的添加量会导致更高的成本。因此,本实验选择的最佳果胶酶添加量为200 U/g。
如图1c显示,纤维素酶添加量在50~150 U/g,添加量对提粗多糖取得率有显著的影响。随着纤维素酶添加量增加提取得率快速增加,在150 U/g时得率达到峰值。超过这个添加量,随着纤维素酶添加量增加提取得率反而降低。这是由于更高添加量的纤维素酶会导致细胞壁的快速水解,利于胞内多糖向周围提取溶剂的扩散,粗多糖得率快速增加,过量的纤维素酶会抑制底物水解,导致多糖提取得率降低 [16]。所以,较为适宜的纤维素酶添加量为150 U/g。
如图1d所示,α-淀粉酶添加量在100 U/g以内,提取得率逐渐增加。然而,当α-淀粉酶的添加量超过100 U/g时,随着α-淀粉酶添加量增加多糖提取得率增加并不明显。因此,α-淀粉酶较为适宜的添加量为100 U/g。
2.2 复合酶添加量的正交试验结果
表1 复合酶添加量正交试验设计与结果
Table1 Orthogonal array design with experimental results

试验号A木瓜蛋白酶添加量/(U/g)B果胶酶添加量/(U/g)C纤维素酶添加量/(U/g)D α-淀粉酶添加量/(U/g)Y得率/% 11(50)1(150)1(100)1(50) 3.28 2 1 2(200)2(150) 2(100) 4.52 3 3(250)3(200)3(150) 5.99 42(100)1233.31 5 2 2 3 1 5.34 1 6 4.12 73(150)1325.05 8 3 2 1 3 2.85 2 3 1 2 9 3 3 2 1 4.35 k 14.603.883.574.32 k 34.264.244.064.56 k 34.084.825.464.05 R 0.520.941.890.51最优条件A 1B 3C 3D 2
如表1所示,不同酶添加量对多糖提取得率的影响次序是:纤维素酶>果胶酶>木瓜蛋白酶>α-淀粉酶。纤维素酶在复合酶解提取过程中起着重要的作用,接下来是果胶酶、木瓜蛋白酶和α-淀粉酶。通过正交试验得到复合酶添加量的最佳条件是A 1B 3C 3D 2,即木瓜蛋白酶50 U/g、果胶酶250 U/g、纤维素酶200 U/g、α-淀粉酶100 U/g,在该条件下可以实现超声复合酶解效率的最大化。以下实验的复合酶添加量采用A 1B 3C 3D 2条件。
2.3 提取参数单因素试验结果

图2 不同提取参数对粗多糖提取得率的影响
Fig. 2 Effect of different extraction parameters on the yield of CEPs
如图2a所示,在25~45 ℃的范围内,粗多糖提取得率随温度的升高快速增加;当温度超过45 ℃时,随温度升高提取得率逐渐下降。说明在一定的温度范围内较高温度对多糖的快速溶解有利。在相同的时间内,更高的温度可以有效降低提取剂的黏度和密度,利于提取溶剂向固体组织内部的渗透和多糖由组织内部向周围溶剂的扩散,从而使多糖的提取得率升高。此外,在一定范围内升高温度会增加酶的催化活性,提高酶解的效率。然而,当提取温度超过45 ℃时,粗多糖的提取得率随着温度进一步升高而降低。分析可能的原因是较高的温度使空化气泡数目减少,降低了超声波的空化作用和复合酶的活性,也可能导致多糖降解 [17]。而且较高的温度可能会导致溶剂的挥发和杂质溶出量的增加。因此,提取温度选择45 ℃左右较为合适。
如图2b所示,在最初的30 min内,提取得率随超声时间延长快速增加。超过40 min时提取得率开始降低。一方面,延长超声时间,超声波对固体组织的空化、剪切效能累积量增加,组织细胞破碎程度和多糖的溶出量增加,因此提取率明显提高。另一方面,过分延长超声时间,可能会导致复合酶失活和多糖的降解,最终导致提取得率降低 [18-19],因此,超声复合酶解的时间为40 min左右较为适宜。
如图2c所示,pH值升高提取得率持续增加,当pH 4时提取得率达到最大值。当pH值超过4时,提取得率不再增加。这一现象说明复合酶的pH值在2~4时是比较合适的,当pH值超过4时,复合酶的活性降低。因此,适宜的pH值为4。
如图2d所示,超声功率从100 W增加至300 W时,提取得率随功率的增加显著增加。超声功率超过300 W后提取得率随功率的增加缓慢降低。对于一个给定的介质和单位体积的提取溶剂,振动与超声功率呈正比。高的超声功率产生更强的振动,导致更强空化和剪切效应,多糖的传质效率提高,提取得率增加。然而,过高超声功率可能造成多糖解聚和黏度降低,从而导致提取得率降低 [20]。因此,300 W超声功率是最佳的选择。
2.4 响应面试验设计与结果及方差分析
表2 响应面试验设计及结果
Table2 Box-Behnken design (BBD) matrix with response values for the yield of CEPs

试验号X 1提取温度/℃时间/minX 3pHX 4超声功率/WY得率/% 1505043004.09 2454054002.04 3 454052006.01 4454043005.91 5403043002.92 6 405043002.61 7504033000.68 8454043005.54 9 453053004.65 10454043005.87 11503043002.86 12504042000.85 13404033001.88 14455044003.87 15454032003.11 16454034002.65 17454043005.84 18404044000.85 19455042001.99 20453033001.51 21454043005.94 22455033002.08 23453044002.33 24404053003.81 25404044003.96 26504042004.38 27504053005.88 28453042002.96 29455053005.02 X 2超声
在正交试验和单因素试验的基础上,选取提取温度(X 1)、超声时间(X 2)、pH值(X 3)和超声功率(X 4)4 个因素、每个因素取3 个水平的Box-Behnken设计对提取工艺进行优化,试验设计及结果如表2所示。
利用Design-Expert 8.0软件对表2试验数据进行多元回归拟合,所得的回归方程为:
![]()
![]()
![]()
![]()
表3 回归模型方差分析
Table3 Analysis of variance for the fitted quadratic polynomial model

注:**. P<0.000 1,差异极显著;*. P<0.05,差异显著。
变异来源平方和自由度均方F值P值模型82.47145.89105.35<0.000 1** X 1提取温度0.7210.7212.920.002 9* X 2超声时间0.4910.498.800.010 2* X 3pH22.90122.96410.63<0.000 1** X 4超声功率0.1510.152.700.122 7 X 1X 213.28113.28237.53<0.000 1** X 1X 38.8418.84158.05<0.000 1** X 1X 411.23111.23200.92<0.000 1** X 2X 321.70121.70388.11<0.000 1** X 2X 40.5910.5910.600.005 7* X 3X 42.2012.2039.31<0.000 1** X 113.26113.26237.11<0.000 1** X2 2 1.5811.5828.170.000 1* X 4 29.6219.62172.02<0.000 1**残差0.78140.06失拟0.6790.073.220.105 2误差0.1250.02 0.0110.010.180.678 8 X3 22 R 2= 0.990 6,R 2 Adj= 0.981 2
对回归模型进行方差分析,从表3可以看出,一次项X
3,二次项
 和交互项X
1X
2、X
1X
3、X
1X
4、X
2X
3、X
3X
4对粗多糖提取得率影响极显著(P<0.000 1)。一次项X
1、X
2,二次项
和交互项X
1X
2、X
1X
3、X
1X
4、X
2X
3、X
3X
4对粗多糖提取得率影响极显著(P<0.000 1)。一次项X
1、X
2,二次项
 和交互项X
2X
4对提取得率有显著的影响(P<0.05)。其他项对提取得率影响不显著(P>0.05)。其中pH值是影响粗多糖提取得率的主要因素。
和交互项X
2X
4对提取得率有显著的影响(P<0.05)。其他项对提取得率影响不显著(P>0.05)。其中pH值是影响粗多糖提取得率的主要因素。
从表3还可以看出,优化建立的回归模型P小于0.000 1,说明回归模型达到极显著水平,方程对实际实验有较好的拟合性;相关系数R
2为0.990 6,修正相关系数
 为0.981 2也显示模型拟合程度较好,试验误差较小;失拟项不显著(P = 0.105 2>0.05),说明非试验因素对结果的影响不大,可以用此模型对超声复合酶解提取淫羊藿叶多糖进行预测分析。
为0.981 2也显示模型拟合程度较好,试验误差较小;失拟项不显著(P = 0.105 2>0.05),说明非试验因素对结果的影响不大,可以用此模型对超声复合酶解提取淫羊藿叶多糖进行预测分析。
2.5 响应面分析
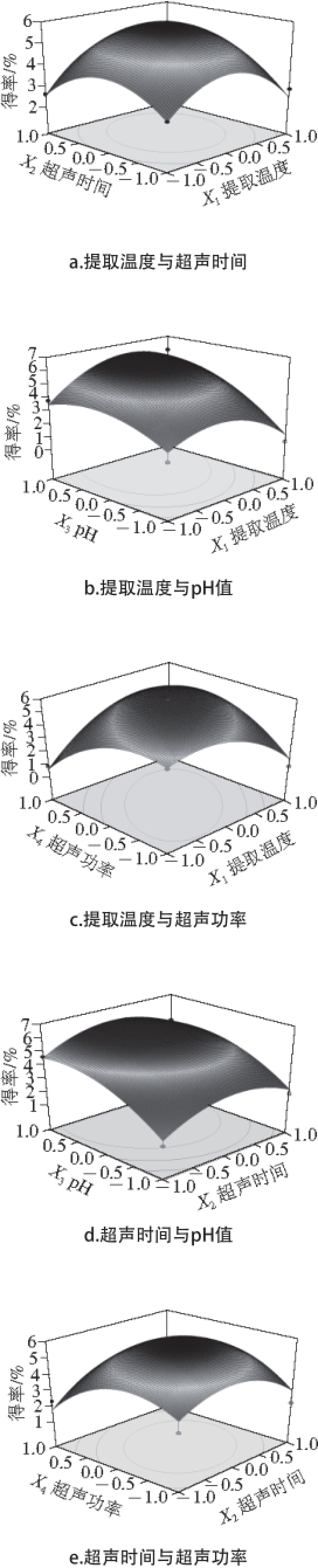
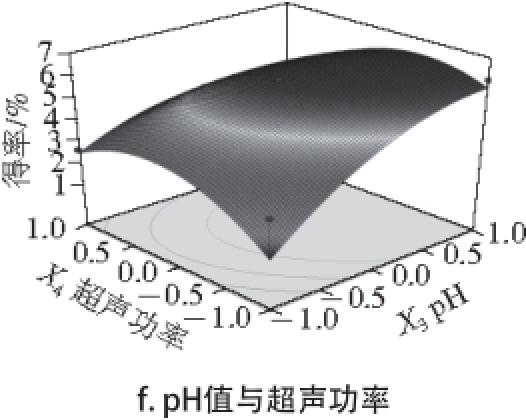
图3 各因素交互作用对粗多糖提取得率影响的响应面图
Fig. 3 Response surface plots showing the effects of various factors on the yield of CEPs
固定提取溶液pH 4和超声功率300 W,如图3a所示,提取得率随提取温度升高和超声时间延长呈先增大后减小的趋势。说明在一定的范围内增加提取温度和延长超声时间都有利于多糖的提取,但过高的提取温度和较长超声时间可能会造成多糖的降解,提取得率的降低。
固定超声时间40 min、超声功率300 W,如图3b所示,当溶液pH值一定时,提取温度升高提取得率快速提高,当温度超过47 ℃后,提取得率随温度升高快速降低。而在试验的pH值范围内,随溶液pH值的升高提取得率逐渐提高,说明在试验范围内较高pH值对提取是有利的。
固定提取溶液pH 4、超声时间40 min,如图3c所示,随超声功率和超声温度水平增大,多糖提取得率呈现先增大后减小的趋势。在一定范围内,超声波的空化、剪切作用与温度对植物组织的影响是一致的,增大提取温度和超声功率水平,单位提取溶剂得到的能量都会增加,较高的超声功率和温度利于提取得率的增加。超过一定值后,继续升高温度和增加功率会破坏多糖分子的结构,使提取得率降低 [21]。超声功率和温度对提取得率的交互影响相对较小。
固定超声功率300 W和超声温度46.8 ℃,如图3d所示,随着pH值升高提取得率逐渐增加,说明pH值升高对复合酶的活性影响较大,在试验的范围升高溶液pH值有利于多糖的提取。随着超声时间的延长多糖提取得率呈现先增大后减小的趋势,超声时间对提取得率的影响相对较小,当达到合适的值后继续延长超声时间就会破坏多糖的结构,使多糖提取得率降低。
固定提取溶液pH 4和超声温度46.8 ℃,如图3e所示,提取得率随超声时间和超声功率水平的增大呈先增大后减小的趋势,超声时间和超声功率对提取得率的影响呈现相似的趋势。随着时间的延长和功率的增大,有效地增加了多糖的提取得率,当达到一定值时继续增加提取功率和时间水平,产生无用空化气泡增加散射衰减,导致多糖提取得率降低 [22]。
当超声温度46.8 ℃和超声时间40 min时,如图3f所示,提取得率随着溶液pH值的升高而增加。随着超声功率的增大,超声功率产生空化气泡使植物组织破裂,细胞内多糖向周围溶剂扩散速率增加,提取得率提高,当超声功率达到一定限度时继续增大,破坏多糖结构使其提取得率快速降低。
对回归模型进行参数优化,得到最优的提取条件是:提取温度46.8 ℃、超声时间42.3 min、pH 4.3、超声功率311 W。在最优的条件下,实际实验中粗多糖的提取得率为(5.98±0.13)%,接近预测值6.2%。
2.6 粗多糖的分离纯化
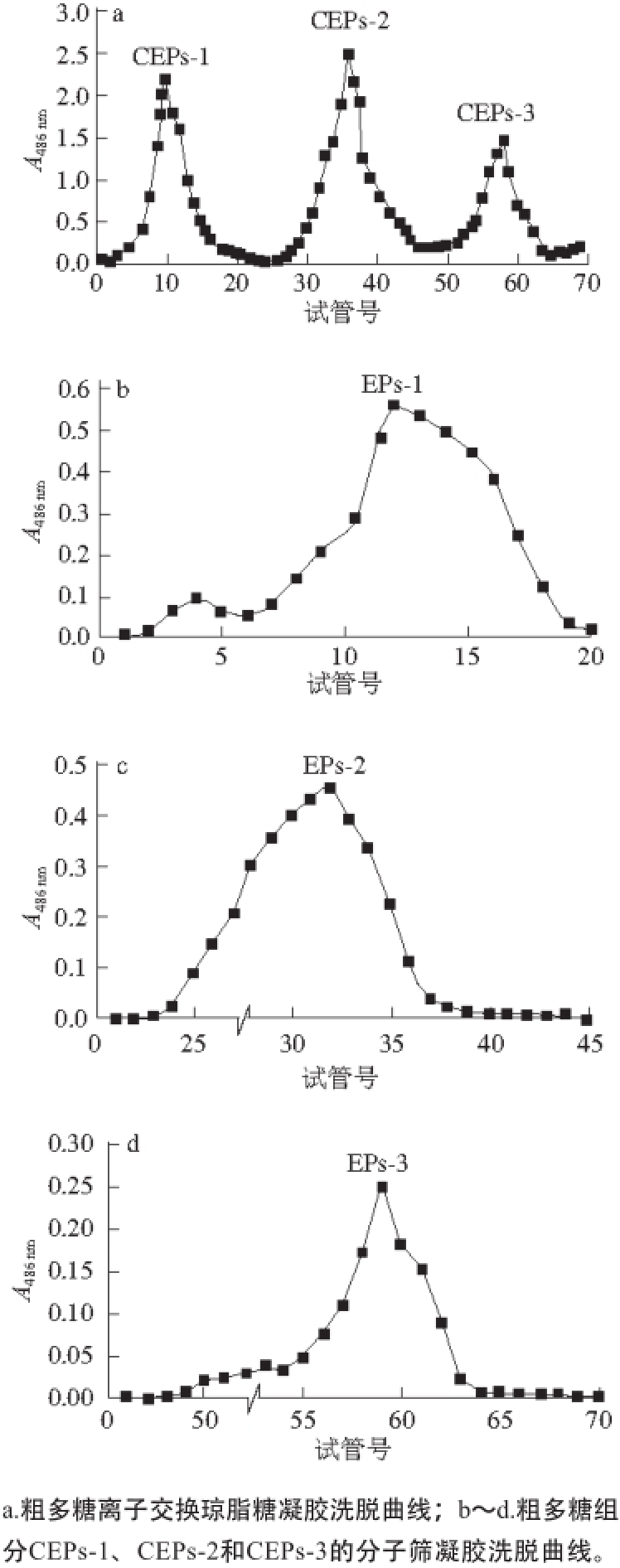
图4 淫羊藿粗多糖的分离纯化洗脱曲线
Fig. 4 Isolation and purification of CEPs
超声复合酶解提取得到的粗多糖经过截留分子质量6 ku超滤膜纯化,然后用离子交换琼脂糖凝胶进行分离纯化,得到3 个组分CEPs-1、CEPs-2、CEPs-3,洗脱分离曲线见图4a。得到的主要组分分别用分子筛凝胶进一步纯化,收集3 个主要洗脱峰的洗脱液冻干,得到3 个多糖组分,分别记为EPs-2、EPs-1和EPs-3(洗脱曲线见图4b~d),得率分别为20.86%、26.02%和14.52%,其中的总糖含量EPs-2<EPs-1<EPs-3。
2.7 抗氧化活性
2.7.1 DPPH自由基清除活性
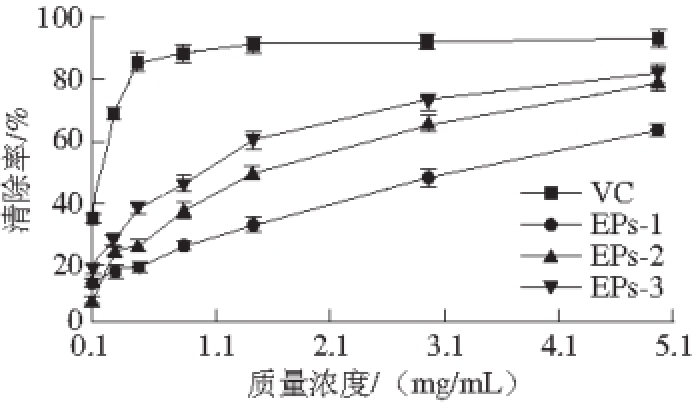
图5 DPPH自由基清除活性
Fig. 5 DPPH radical-scavenging capacity of three CEP fractions
DPPH自由基是一种稳定的自由基,甲醇溶液显紫色,自由基清除剂能够与DPPH的单电子被配对,在最大吸收波长处颜色变浅,吸光度也会随之变小 [23]。DPPH自由基清除率越高表明其抗氧化能力越大。以VC作为参照品,如图5所示,3 个多糖组分都有显著的清除活性,清除率随质量浓度的增加快速增加,其中EPs-3清除率最高,EPs-1清除率最低。分析可能的原因是多糖抗氧化活性与多糖的分子质量分布有关,较小的分子质量其抗氧化活性相对较高。
2.7.2 羟自由基清除活性

图6 羟自由基清除活性
Fig. 6 Hydroxyl radical-scavenging capacity of three CEP fractions
如图6所示,3 个多糖组分都具有相对较高的羟自由基清除活性,都具有量效依赖关系,特别是在较高的质量浓度时,其清除活性接近于VC,清除率的大小顺序为:EPs-2>EPs-1>EPs-3。
2.7.3 超氧阴离子自由基清除活性
如图7所示,3 个多糖组分都有一定的超氧阴离子自由基的清除活性,其清除率随多糖质量浓度的增加逐渐增加,与VC比较3 个组分的超氧阴离子自由基清除活性相对较低,其清除活性顺序为:EPs-3>EPs-2>EPs-1,与DPPH自由基的清除效果一致。

图7 超氧阴离子自由基清除活性
Fig. 7 Superoxide anion radical-scavenging of three CEP fractions
2.7.4 总抗氧化活性

图8 总抗氧化活性
Fig. 8 Ferric-reducing antioxidant power (FRAP) of three CEP fractions
Fe 3+-TPTZ可被样品中的多糖还原成Fe 2+的形式,溶液颜色由无色变为浅蓝色,在593 nm波长处有最大吸收,根据吸光度的大小可以计算样出品总的抗氧化活性。如图8所示,在实验质量浓度范围内其活性与VC接近,说明3 个多糖组分都具有较高的抗氧化活性,且都有显著的量效依赖关系,总抗氧化活性顺序为EPs-3>EPs-2>EPs-1,其抗氧化能力的不同与多糖的单糖组成、分子质量分布和结构等多种因素有关,采用超声复合酶解提取多糖,可以有效降低多糖的分子质量分布,增加多糖的抗氧化活性 [24]。
用超声复合酶解提取方法从淫羊藿叶中高效提取粗多糖。通过正交试验和响应面优化得到最优提取工艺如下:复合酶添加量(木瓜蛋白酶、果胶酶、纤维素酶和α-淀粉酶)分别为50、250、200、100 U/g,提取温度46.8 ℃、超声时间42.3 min、pH 4.3、超声功率311 W。粗多糖经过分离、纯化得到3 个多糖组分,3 个多糖组分都具有显著的抗氧化活性,活性呈量效依赖关系,组分EPs-3抗氧化活性最高,可以探索作为潜在的抗氧剂应用于功能食品和药品。超声复合酶解提取作为一个高效的绿色提取技术,可以广泛应用于从植物原料中提取有效成分。
参考文献:
[1] 苏瑛, 郑晓翠, 唐咏, 等. 淫羊藿多糖的酶法提取及其抗氧化作用的研究[J]. 食品科技, 2009, 34(4): 200-203. DOI:10.13684/j.cnki. spkj.2009.04.068.
[2] FAN T, HU J G, FU L D, et al. Optimization of enzymolysis-ultrasonic assisted extraction of polysaccharides from Momordica charabtia L. by response surface methodology[J]. Carbohydrate Polymers, 2015, 115: 701-706. DOI:10.1016/j.carbpol.2014.09.009.
[3] 李海平, 陈瑞战, 金辰光, 等. 黄芩多糖的超声提取工艺优化及抗氧化活性研究[J]. 食品工业科技, 2014, 35(16): 237-242. DOI:10.13386/j.issn1002-0306.2014.16.044.
[4] CHEN R Z, LI H P, LI S Z, et al. Extraction optimization, preliminary characterization and immunological activity of polysaccharides from f gs[J]. International Journal of Biological Macromolecules, 2015, 72: 185-194. DOI:10.1016/j.ijbiomac.2014.08.021.
[5] 鞠瑶瑶, 曹纯洁, 陈美珍, 等. 响应面试验优化脆江蓠多糖提取工艺及其对肿瘤细胞的抑制作用[J]. 食品科学, 2016, 37(8): 57-62. DOI:10.7506/spkx1002-6630-201608010.
[6] WANG C, ZHANG J, WANG F, et al. Extraction of crude polysaccharides from Gomphidius rutilus and their antioxidant activities in vitro[J]. Carbohydrate Polymers, 2013, 94: 479-486. DOI:10.1016/j.carbpol.2013.01.034.
[7] KASRA A, VAHID S, SEYED S. Ultrasonic-assisted extraction and in-vitro antioxidant activity of polysaccharide from Hibiscus leaf[J]. International Journal of Biological Macromolecules, 2015, 74: 558-567. DOI:10.1016/j.ijbiomac.2014.07.023.
[8] WANG J, ZHAO Y M, LI W, et al. Optimization of polysaccharides extraction from Tricholoma mongolicum Imai and their antioxidant and antiproliferative activities[J]. Carbohydrate Polymers, 2015, 131: 322-330. DOI:10.1016/j.carbpol.2015.06.009.
[9] CHENG Z Y, SONG H Y, YANG Y J, et al. Optimization of microwave-assisted enzymatic extraction of polysaccharides from the fruit of Schisandra chinensis Baill[J]. International Journal of Biological Macromolecules, 2015, 76: 161-168. DOI:10.1016/ j.ijbiomac.2015.01.048.
[10] CHEN C, YOU L J, ARSHAD M A, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130: 122-132. DOI:10.1016/j.carbpol.2015.05.003.
[11] 姜虹, 李新龙, 李海平, 等. 响应面法优化淫羊藿多糖超声提取工艺的研究[J]. 长春师范学院学报(自然科学版), 2013, 32(1): 59-64. DOI:10.3969/j.issn.1008-178X(z).2013.01.018.
[12] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4): 158-163. DOI:10.7506/spkx1002-6630-201604028.
[13] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060. DOI:10.1016/0031-9422(89)80182-7.
[14] CHEN R Z, LIU Z Q, ZHAO J M, et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J]. Food Chemistry, 2011, 127(2): 434-440. DOI:10.1016/j.foodchem.2010.12.143.
[15] BENZIE I F, STRAIN J J. The reducing ability of plasma as a measure of ‘antioxidant power’: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[16] 黎英, 陈雪梅, 严月萍, 等. 超声波辅助酶法提取红腰豆多糖工艺优化[J]. 农业工程学报, 2015, 31(15): 293-230. DOI:10.11975/ j.issn.1002-6819.2015.15.040.
[17] PALMA M, BARROSO C G. Ultrasound-assisted extraction and determination of tartaric and malic acids from grapes and winemaking by-products[J]. Analytica Chimica Acta, 2002, 458(1): 119-130. DOI:10.1016/S0003-2670(01)01527-6.
[18] LIU J C, MIAO S, WEN X C, et al. Optimization of polysaccharides (ABP) extraction from the fruiting bodies of Agaricus blazei Murill using response surface methodology (RSM)[J]. Carbohydrate Polymers, 2009, 78: 704-709. DOI:10.1016/j.carbpol.2009.06.003.
[19] 刘航, 国旭丹, 马雨洁, 等. 超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J]. 食品科学, 2013, 34(14): 45-50. DOI:10.7506/ spkx1002-6630-201314010.
[20] 刘晓鹏, 张俊霞, 姜宁, 等. 响应面试验优化超声辅助提取连钱草多糖工艺及其体外抗氧化活性[J]. 食品科学, 2016, 37(4): 13-19. DOI:10.7506/spkx1002-6630-201604003.
[21] 陆娟, 常清泉, 王思齐, 等. 响应面法优化核桃青皮粗多糖超声提取工艺研究[J]. 北方园艺, 2015(22): 125-129. DOI:10.11937bfyy .201522033.
[22] 龚玉雷. 纤维素酶和果胶酶复合体系在茶叶提取加工中的应用研究[D]. 杭州: 浙江工业大学, 2013.
[23] 陈瑞平, 陈瑞战, 张敏, 等. 复合酶法提取大蒜多糖及其抗氧化活性研究[J]. 分子科学学报, 2012, 28(1): 47-52. DOI:10.3969/ j.issn.1000-9035.2012.01.008.
[24] FAN Y N, WU X Y, ZHNG M, et al. Physical characteristics and antioxidant effect of polysaccharides extracted by boiling water and enzymolysis from Grifola frondosa[J]. International Journal of Biological Macromolecules, 2011, 48: 798-803. DOI:10.1016/ j.ijbiomac.2011.03.013.
Optimization of Extraction and Antioxidant Activity of Polysaccharides from Epimedium Leaves
TAN Li, CHEN Ruizhan*, CHANG Qingquan, LU Juan, JIN Chenguang, YIN Wei
(College of Chemistry, Changchun Normal University, Changchun 130032, China)
Abstract:In this study, an ultrasonic-assisted enzymatic extraction (UAEE) method was proposed and optimized for the extraction of polysaccharides (CEPs) from Epimedium leaves. In the first step, the optimization of enzyme mixtures for the hydrolysis of Epimedium leaves was carried out by the combined use of one-factor-at-a-time method and orthogonal array design. Subsequently, the optimization of extraction parameters was done using Box-Behnken design with response surface methodology. The results showed that the influence of the dosage of enzymes on the extraction yield of CEPs was in the following order: cellulose > pectinase > papain > α-amylase, and the optimal combination found were papain 50 U/g, pectinase 250 U/g, cellulase 200 U/g and α-amylase 100 U/g. The optimal extraction parameters were determined as 46.8 ℃, 42.3 min, 4.3 and 311 W for temperature, time, pH, and ultrasonic power, respectively. Under these conditions, the experimental yield of CEPs was 5.98%, which was well in close agreement with the value (6.2%) predicted by the proposed model. Three major fractions (EPs-1, EPs-2 and EPs-3) from the CEPs were purified by DEAE-Sepharose fast-flow and Sephadex G-100 column chromatography. The antioxidant activities of the three fractions were evaluated by 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical, hydroxyl radical and superoxide anion racial scavenging capacity assays, and ferricreducing antioxidant power (FRAP) assay in vitro. It was indicated that UCEE could be an effective and environmentfriendly technique for extracting active ingredients from plant materials. All the three polysaccharides exhibited significant antioxidant activities in a dose-dependent manner. These results suggested that Epimedium polysaccharides could be explored as potential antioxidants for use in functional foods or medicines.
Key words:Epimedium polysaccharide; ultrasonic-assisted enzymatic extraction (UAEE); response surface methodology; antioxidant activity
DOI:10.7506/spkx1002-6630-201702040
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2017)02-0255-09
收稿日期:2016-05-10
基金项目:吉林省教育厅“十二五”科学技术研究项目([2014]258;[2015]355)
作者简介:谭莉(1991—),女,硕士研究生,研究方向为天然有机化合物分离结构与活性。E-mail:litan1235@163.com
*通信作者:陈瑞战(1967—),男,教授,博士,研究方向为天然有机化合物提取结构与活性。E-mail: ruizhanchen@163.com
引文格式:
谭莉, 陈瑞战, 常清泉, 等. 淫羊藿叶多糖工艺优化及抗氧化活性[J]. 食品科学, 2017, 38(2): 255-263. DOI:10.7506/ spkx1002-6630-201702040. http://www.spkx.net.cn
TAN Li, CHEN Ruizhan, CHANG Qingquan, et al. Optimization of extraction and antioxidant activity of polysaccharides from Epimedium leaves[J]. Food Science, 2017, 38(2): 255-263. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702040. http://www.spkx.net.cn