表1 响应面试验因素及水平
Table1 Factors and levels used in response surface analysis

水平因素A超高压时间/minB提取压力/MPa C料液比(g/mL)-1103001∶15 0 124001∶20 1 145001∶25
李新原 1,李 斌 1,颜廷才 1,刘素稳 2,孙希云 1,史依沫 1,张 琦 1,孟宪军 1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.河北科技师范学院食品科技学院,河北 秦皇岛 066004)
摘 要:采用响应面法对蓝靛果多酚超高压提取条件进行优化,并从提取量、提取条件和提取多酚抗氧化活性等因素综合比较超高压和超声波提取蓝靛果多酚的差异。结果表明:响应面优化超高压提取条件为料液比1∶19(g/mL)、提取温度30 ℃、提取压力406 MPa、超高压时间11.5 min、乙醇体积分数50%,此条件下多酚提取量最高,为(778.23±3.45) mg/100 g果浆;超声波辅助提取条件为料液比1∶25(g/mL)、提取温度40 ℃、乙醇体积分数50%、超声功率500 W、提取时间90 min,此条件下多酚提取量为(785.74±3.89) mg/100 g果浆,略高于超高压提取。抗氧化实验结果表明,经过超高压提取的蓝靛果多酚对1,1-二苯基-2-三硝基苯肼自由基清除能力、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基清除能力、Fe 3+还原能力显著高于同质量浓度条件下超声波提取的蓝靛果多酚和VC对照组。综上,虽然超高压提取缩短了蓝靛果多酚提取时间,且提取的多酚活性高,但受到容器大小的限制,在大批量提取蓝靛果多酚的情况下,超高压提取的效率和提取量仍然不及超声波提取,因此,从多酚提取量和提取效率的角度考虑,超声波提取蓝靛果多酚优于超高压提取。
关键词:蓝靛果多酚;超高压提取;超声波提取;抗氧化
蓝靛果忍冬(Lonicera enulis Turcz)简称蓝靛果,属被子植物门忍冬科忍冬属。在中国华北、东北、四川、西北等地山区都有分布。果实中含多种维生素如VB 1、VB 2、Vpp等,还富含黄酮类多酚、花青素、芸香苷等抗氧化成分 [1-2]。近年来多酚因为其具有抗氧化活性越来越受到关注,根据吕闻明 [3]的报道,蓝靛果忍冬多酚具有较强的2,2′-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基(2,2′-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt radical,ABTS +·)清除率、羟自由基清除率、超氧阴离子自由基(O 2 -·)清除率、1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)自由基清除率、还原能力优于VC。此外还有研究表明黄酮类多酚物质具有预防癌症、心血管、神经性疾病等多种慢性疾病 [4-7]。目前常用多酚提取方法有溶剂提取法、酶解法、微波辅助提取法以及超声波辅助提取法等 [8-10],溶剂提取法和酶解法提取虽然操作简单,但溶剂提取法得到的多酚色价和纯度均较低,酶解法受酚类物质在植物中存在形态的影响,提取量受到限制。微波浸提法成本高,且长时间微波辐射对操作人员身体产生不良影响。超声波辅助提取虽然提取量较高,但耗时长,且噪音较大。
超高压(ultra-high pressure,UHP)技术是将液体或气体加压到100 MPa以上压力的技术。超高压提取或超高压萃取是将UHP应用在生物活性成分提取的过程中,通常提取的压力范围在100~600 MPa之间。与其他提取方法对比超高压提取具有诸多优点,有研究表明超高压提取具有提取时间短、提取量高、对生物活性物质影响小等特点 [11-13]。目前超高压提取被视为生物活性物质最具潜力的提取方式之一,已经成功地被应用到番茄红素、花色苷、茶多酚等活性成分的提取 [14-15],但是利用UHP提取蓝靛果多酚鲜见报道。本实验利用响应面试验优化了超高压提取蓝靛果多酚的工艺条件,并且与超声波提取法作对比,从多酚提取量和抗氧化活性的角度探讨了超高压提取与超声波提取的差异,为以后蓝靛果深加工提供了技术参考。
1.1 材料与试剂
新鲜野生蓝靛果采自吉林省白山市,待完全成熟,采摘后12 h送达实验室,保存于-80 ℃冰箱中备用。
福林-酚试剂、没食子酸标准品、ABTS、DPPH美国Sigma公司;无水乙醇、95%乙醇、盐酸、氢氧化钠、无水碳酸钠 国药集团化学试剂有限公司。
1.2 仪器与设备
JYL-C012九阳榨汁机、电子分析天平、PHS-3C型pH计 北京赛多利斯科学仪器有限公司;真空泵巩义市予华仪器有限责任公司;旋转蒸发仪 上海亚荣生化仪器厂;UV-1600型紫外-可见分光光度仪 北京瑞利分析仪器公司;BCD-186KB型冰箱 青岛海尔电器有限公司;全制动超高压杀菌机 温州滨一机械科技有限公司;离心机 日本日立公司;酶标仪 美国博腾仪器有限公司;LG0.2真空冷冻干燥机 沈阳新阳航空速冻设备制造有限公司。
1.3 方法
1.3.1 蓝靛果多酚超高压提取工艺优化
1.3.1.1 单因素试验设计
精确称取30.00 g解冻后打浆的蓝靛果果浆,无损失地转移到塑料瓶中,加入酸化乙醇溶液(0.1% HCl、50%乙醇),在超高压辅助提取条件下,分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25,g/mL)、提取压力(200、300、400、500、600 MPa)、提取时间(6、8、10、12、14 min)和提取温度(20、30、40、50、 60 ℃)对蓝靛果多酚提取量的影响。
1.3.1.2 响应面优化试验设计
根据单因素试验结果,采用Box-Behnken数据处理软件,以蓝靛果多酚提取量为响应值,选取对影响较为显著的条件:料液比、提取压力、超高压时间3 个因素,进行响应面分析,对工艺条件进行三因素三水平的试验设计,优化超高压辅助提取蓝靛果多酚工艺参数。响应面试验因素及水平见表1。
表1 响应面试验因素及水平
Table1 Factors and levels used in response surface analysis

水平因素A超高压时间/minB提取压力/MPa C料液比(g/mL)-1103001∶15 0 124001∶20 1 145001∶25
1.3.2 蓝靛果多酚超声波辅助提取
蓝靛果多酚超声波辅助提取参考李斌等 [16]的方法,提取工艺条件为:料液比1∶25(g/mL)、提取温度40 ℃、乙醇体积分数50%、超声功率500 W、提取时间90 min。在此条件下提取获得蓝靛果多酚样品与超高压提取多酚样品作比较。
1.3.3 多酚含量的测定
采用福林-酚法 [16]进行测定,取经过不同条件超高压提取的样品1 mL,加入福林试剂2 mL,混匀,在0.5~8 min内加入3 mL质量分数7.5%的Na 2CO 3溶液,充分混合,30 ℃避光放置2 h后,测在波长765 nm处吸光度。以没食子酸为标样,制作标准曲线,所得标准曲线方程为:y=0.081 07+5.011 50x(R 2=0.999 8)。没食子酸在0.005~0.05 mg/mL质量浓度范围内具有良好的线性关系,根据标准曲线方程求出提取液中多酚质量浓度。总酚含量按式(1)计算:
式中:X为样品中总酚的质量浓度/(mg/mL);ρ为根据标准曲线方程计算出待测液中多酚的质量浓度/(mg/mL);V为待测液体积/mL;N为稀释倍数;m为样品质量/g。最后将含量转换为mg/100 g。
1.3.4 蓝靛果提取物体外抗氧化活性的测定
按照确定的最佳超高压和超声波提取蓝靛果多酚工艺条件提取蓝靛果提取物,并对其进行抽滤、真空旋转蒸发后得到多酚提液进行真空冷冻干燥处理,对获得的冻干粉末进行抗氧化活性评价分析。
1.3.4.1 ABTS +·清除能力测定
取两种方法提取的多酚冻干粉末样品和VC用磷酸盐溶液配制成不同质量浓度溶液待测 [17]。取96孔板,在每个检测孔中加入200 μL ABTS工作液后将10 μL不同质量浓度待测液或梯度浓度VE标准液放入检测孔中,轻轻混匀。在酶标仪中,室温孵育2~6 min后测定其在734 nm波长处吸光度,得到标准曲线y = -0.602 9x+0.667 3(R 2= 0.999 4),式中:y为样品对应的吸光度;x为VE标准品浓度/(mmol/L)。以VE当量表示待测样品的ABTS +·清除能力。
1.3.4.2 Fe 3+还原能力(ferric reducing ability of plasma,FRAP)测定
取两种方法提取的多酚冻干粉末样品和VC用磷酸盐溶液配制成不同质量浓度溶液待测 [18]。取96孔板,在每个检测孔中加入180 μL FRAP工作液。后将5 μL待测液或梯度浓度FeSO 4标准液放入检测孔中,轻轻混匀。37℃孵育2~6 min后测定其在593 nm波长处吸光度,得到标准曲线y = 0.043 8x+0.015 8(R 2= 0.999 1),式中:y为样品对应的吸光度;x为FeSO 4标准品浓度/(mmol/L)。以FeSO 4当量表示待测样品的FRAP值。
1.3.4.3 DPPH自由基清除能力测定
取两种方法提取的多酚冻干粉末样品和VC用磷酸盐溶液配制成不同质量浓度溶液待测。参照吕春茂等 [19]的方法略作改动,配制0.2 mmol/L DPPH乙醇溶液,放在避光低温条件处保存,在96 孔板中加入100 μL DPPH乙醇溶液及100 μL样品溶液,在室温避光放置30 min,于517 nm波长处用测定吸光度(A 1);将DPPH乙醇溶液用等体积的无水乙醇代替,其他操作相同,测定吸光度(A 2);将样品溶液用等体积无水乙醇溶液代替,其他操作相同,测定吸光度(A 0)。按公式(2)计算DPPH自由基清除能力:
1.4 数据处理与统计分析
所有实验重复3 次,采用Excel 2007软件对实验数据进行整理绘图,用SPSS 19.0软件对数据进行方差分析,并进行Duncans’差异显著性分析,P<0.05表示差异显著。
2.1 超高压辅助提取蓝靛果多酚的单因素试验结果
2.1.1 料液比对蓝靛果多酚提取量的影响

图1 料液比对蓝靛果多酚提取量的影响
Fig. 1 Effect of solid-to-liquid ratio on the yield of polyphenols
提取压力为400 MPa、超高压时间10 min、提取温度30 ℃的条件下,考察料液比对蓝靛果多酚提取量的影响。由图1可知,料液比在1∶5~1∶20的范围内,随着溶剂用量的增大,蓝靛果多酚提取量有明显的提高,且不同料液比之间蓝靛果多酚提取量存在显著性差异(P<0.05)。当料液比为1∶20时,多酚含量达到最大值707.09 mg/100 g,继续增大溶剂用量,多酚提取量有下降的趋势,表明此条件下多酚物质已不再溶出。另外溶剂用量过大导致分离纯化困难增加,且造成资源的浪费,因此,料液比选择在1∶15~1∶25范围内,进行后续响应面优化试验。

图2 提取温度对蓝靛果多酚提取量的影响
Fig. 2 Effect of extraction temperature on the yield of polyphenols
2.1.2 提取温度对蓝靛果多酚提取量的影响提取压力在400 MPa、超高压时间10 min、料液比
1∶20条件下,考察提取温度对蓝靛果多酚提取量的影响。由图2可知,随着提取温度的升高,蓝靛果多酚提取量并没有呈现出逐渐增加后再下降的趋势,而是呈现出不规律的折线状态,但总体上随温度升高,蓝靛果提取量呈下降趋势,且差异显著(P<0.05)。这可能是由于温度过高和多酚热不稳定性,使得多酚提取量有所下降 [20]。因此,将提取温度的范围确定在30 ℃,进行后续响应面优化试验。
2.1.3 提取压力对蓝靛果多酚提取量的影响

图3 提取压力对蓝靛果多酚提取量的影响
Fig. 3 Effect of extraction pressure on the yield of polyphenols
超高压时间10 min、料液比1∶20、提取温度30 ℃的条件下,考察提取压力对蓝靛果多酚提取量的影响。由图3可知,提取压力对蓝靛果多酚提取量有显著性的影响(P<0.05)。在提取压力在200~400 MPa范围内,多酚提取量随提取压力的增大而显著增大(P<0.05),当提取压力达到400 MPa时,多酚含量达到最大值710.76 mg/100 g,此后继续增加提取压力,多酚提取量呈极具下降趋势。一般来说压力越大植物细胞受到压力的破坏作用越大,越有利于植物多酚物质的提取 [18],但试验中提取压力高于400 MPa时多酚含量下降,造成这种现象的原因可能为当提取压力在400~600 MPa时使蓝靛果中蛋白质分子结构改变,位于分子折叠结构中易于接近的反应位点得到充分暴露并与小分子多酚结合,从而降低了多酚的含量 [21-22]。
2.1.4 超高压时间对蓝靛果多酚提取量的影响

图4 超高压时间对蓝靛果多酚提取量的影响
Fig. 4 Effect of ultra-high pressure processing time on the yield of polyphenols
提取压力在400 MPa、料液比1∶20、提取温度30 ℃的条件下,考察超高压时间对蓝靛果多酚提取量的影响。由图4可知,当超高压时间为6~12 min时,蓝靛果多酚提取量随着时间的延长而升高,超高压时间12 min时提取量为707.09 mg/100 g,显著高于其他时间(P<0.05),随着超高压时间继续延长,多酚提取量降低,因此,选择最佳的时间范围为10~14 min进行后续优化试验。
2.2 超高压提取蓝靛果多酚的响应面优化试验结果
2.2.1 响应模型的建立与分析
表2 响应面试验设计及结果
Table2 Experimental design and results for response surface analysis

试验号A超高压时间B提取压力C料液比多酚提取量/(mg/100 g)1-110590.12 2-1-10610.13 3000788.44 41-10596.14 5000765.26 60-11617.58 7-101624.21 8101732.31 910-1674.56 10011636.99 110-1-1643.47 12000778.65 13-10-1735.16 1401-1687.97 15110641.24
利用Box-Behnken设计响应面分析,优化并找出多因素系统中寻找最佳测试条件 [23]。利用Design-Expert 8.0软件对表2中各个条件下试验数据进行二次多项式回归拟合,得到多酚提取量对超高压时间(A)、提取压力(B)、料液比(C)的回归模型方程为:多酚提取量/(mg/100 g)=777.45+10.58A+11.12B-16.26C+16.28AB+42.17AC-6.27BC-61.49A 2-106.55B 2-24.40C 2。从表3可以看出,回归模型具有高度的显著性(P<0.001),失拟项不显著(P =0.645 4>0.05),校正决定系数(R 2 Adj)为0.99 66,R 2为0.993 3,表明此模型试验误差小,拟合度好,能够反映响应值的变化,可以用此方程模型对超高压辅助提取蓝靛果多酚的工艺参数进行分析和预测。对回归模型显著性检验可知,A、B、AB对多酚提取量有显著影响(P<0.05),C、AC、A 2、B 2、C 2对多酚提取量有极显著影响(P<0.01),BC影响不显著。根据F值各个因素对蓝靛果多酚提取量影响的大小顺序为:料液比(C)>提取压力(B)>超高压时间(A)。
表3 回归方程方差分析
Table3 Analysis of variance and statistical parameters of the regression mooddeell

注:*.影响显著(P<0.05);**.影响极显著(P<0.01)。下同。
来源平方和自由度均方F值P值模型65 374.68 97 263.85 66.93 0.000 1** A超高压时间895.28 1895.28 8.25 0.034 9* B提取压力990.12 1990.12 9.12 0.029 4* C料液比2 114.78 12 114.78 19.49 0.006 9** AB1 059.83 11 059.83 9.77 0.026 1* AC7 114.92 17 114.92 65.56 0.000 5** BC157.38 1157.38 1.45 0.282 4 A 213 961.82 113 961.82 128.64 <0.000 1** B 241 918.42 141 918.42 386.23 <0.000 1** C 22 197.80 12 197.80 20.25 0.006 4**残差542.67 5108.53失拟项271.85 390.62 0.67 0.645 4纯误差270.82 2135.41综合65 917.35 14
2.2.2 响应面优化


图5 各因素交互作用对多酚提取量影响的响应面和等高线图
Fig. 5 Response surface and contour plots showing the effects of extraction parameters on the yield of polyphenols
通过观察图5中响应面和等高线的变化情况可直观得出超高压时间(A)、提取压力(B)、料液比(C)之间交互作用对蓝靛果多酚提取量的影响,当等高线呈椭圆形或马鞍形时则表示两因素交互作用,而呈显著圆形时表示两因素交互作用不显著 [23]。由图5a可知,提取压力的变化曲面和超高压时间变化曲面均较陡峭,说明压力和超高压时间对蓝靛果多酚提取量影响均较显著,与方差分析结果相符。由图5b可知,料液比的变化曲面比超高压时间的变化曲面陡峭,说明料液比对多酚提取量的影响更显著一些,与方差分析结果相符。图5等高线图均呈明显的椭圆形,说明提取压力和超高压时间、料液比和超高压时间之间交互作用均较为显著,对蓝靛果多酚提取量影响较大。
2.2.3 最佳条件的确定和回归模型的验证
通过响应面法得到超高压取蓝靛果多酚最佳工艺条件为料液比1∶18.6(g/mL)、提取压力405.9 MPa、超高压时间11.92 min条件下得到的多酚含量为780.519 mg/100 g。实际操作中稍作调整确定的最佳工艺条件为料液比1∶19(g/mL)、提取压力406 MPa、超高压时间11.5 min、提取温度30 ℃、乙醇体积分数50%,在此条件下进行验证实验,得到的多酚含量为(778.23±3.45) mg/100 g,与理论值非常接近。
2.3 超声波提取蓝靛果多酚的结果
超声波提取试验条件采用李斌等 [16]优化后的提取条件,保证试验场地和设备等因素相同,在料液比为1∶25(g/mL)、提取温度为40 ℃、乙醇体积分数为50%、超声功率为500 W、提取时间为90 min条件下,进行3 次平行提取实验,得到的蓝靛果多酚的提取量为(785.74±3.89) mg/100 g。
通过两种方法的条件及试验结果可以看出超高压提取蓝靛果多酚过程需要的时间短,但受到容器大小的限制,在大批量提取蓝靛果多酚的情况下,超高压提取的效率和提取量仍然不及超声波提取,因此,从多酚提取量和提取效率的角度考虑,利用超声波提取蓝靛果多酚比超高压更适合。
2.4 两种方法提取蓝靛果多酚的体外抗氧化活性分析2.4.1 清除DPPH自由基能力分析
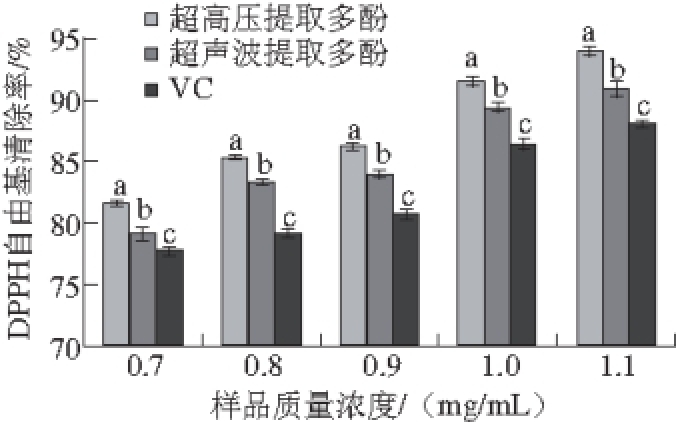
图6 两种方法提取蓝靛果多酚DPPH自由基清除率差异
Fig. 6 Comparison of DPPH radical scavenging capacity of polyphenols extracted by two different methods
由图6可知,经过超高压和超声波提取的蓝靛果多酚与VC对照组相比,对DPPH自由基的清除能力均较显著(P<0.05),且清除率随着质量浓度的增加而增强。整体而言,质量浓度在0.7~1.1 mg/mL的范围内,三者对DPPH自由基清除能力大小顺序为超高压提取>超声波提取>VC且差异显著(P<0.05)。
2.4.2 清除ABTS +·能力分析
由图7可知,超高压提取的蓝靛果多酚和超声波提取的蓝靛果多酚对ABTS +·均具有较强的清除能力,且清除率随着质量浓度的增加而增强,尤其当质量浓度在0.8~1.0 mg/mL范围内,超高压提取的蓝靛果多酚对ABTS +·清除能力增强最明显。当质量浓度为0.7~1.1 mg/mL时,超高压提取蓝靛果多酚与超声波提取的蓝靛果多酚和VC对照组相比对ABTS +·清除能力存在显著性差异(P<0.05)。说明在相同质量浓度条件下,超高压提取蓝靛果多酚比超声波提取的蓝靛果多酚清除ABTS +·能力强且差异显著(P<0.05)。

图7 两种方法提取蓝靛果多酚ABBTTSS
+·清除能力差异
Fig. 7 Comparison of total antioxidant capacity of polyphenols extracted by two different methods
2.4.3 FRAP分析

图8 两种方法提取蓝靛果多酚FRAP差异
Fig. 8 Comparison of ferric reducing antioxidant power of polyphenols extracted by two different methods
由图8可知,各质量浓度超高压提取的蓝靛果多酚与超声波提取的蓝靛果多酚和VC相比,FRAP均较强,且能力随着质量浓度的增加而增强。当质量浓度在0.7、0.8、1.0、1.1 mg/mL时,超声波提取的蓝靛果多酚与VC相比FRAP存在显著性差异(P<0.05)。说明在相同质量浓度条件下,蓝靛果多酚与VC对照组相比FRAP强,且经过超高压提取的各质量浓度蓝靛果多酚FRAP最强,且差异显著(P<0.05)。
虽然同为相同质量浓度的蓝靛果多酚,但是抗氧化活性却不同,说明提取方法对蓝靛果活性影响很大,这与叶新红 [24]研究结果相似,造成这种现象的原因可能是因为不同的提取方法需要的提取条件不同,对多酚抗氧化官能团与其他分子结合的作用也不同,从而导致提取的抗氧化活性的差异。从以上抗氧化能力的测定结果来看,超高压提取比超声波提取更有利于蓝靛果多酚抗氧化活性的保护。
在超高压提取蓝靛果多酚的单因素试验基础上,利用Box-Behnken响应面优化试验设计软件确定的最佳工艺条件为料液比1∶19(g/mL)、提取压力406 MPa、超高压时间11.5 min、提取温度30 ℃、乙醇体积分数50%,得到的多酚提取量为(778.23±3.45) mg/100 g。参考李斌等 [16]方法,在料液比为1∶25(g/mL)、提取温度为40 ℃、乙醇体积分数为50%、超声功率为500 W、提取时间为90 min条件下,得到的蓝靛果多酚提取量为(785.74±3.89) mg/100 g。通过比较超高压和超声波提取的蓝靛果多酚体外抗氧化活性发现,超高压提取的蓝靛果多酚对DPPH自由基、ABTS +·和FRAP具有较强的清除能力,且差异显著(P<0.05)。结果表明:虽然超高压提取蓝靛果多酚过程需要的时间短,但受到容器大小的限制,在大批量提取蓝靛果多酚的情况下,超高压提取的效率和提取量仍然不及超声波提取,因此,从多酚提取量和提取效率的角度考虑,利用超声波提取蓝靛果多酚比超高压更适合;蓝靛果多酚经过超高压提取,对DPPH自由基、ABTS +·、FRAP清除能力比经过超声波提取强,说明超高压提取对蓝靛果多酚抗氧化活性具有一定的保护作用,因此,考虑多酚的抗氧化活性,超高压提取优于超声波提取,这与Xi Jun等 [25]研究的结果相似。猜测造成以上两种现象的原因可能与超高压处理对生物大分子的影响有关,多酚具有很高的活性,能与蛋白质、多糖等生物大分子结合 [26],而超高压可以改变蛋白质的结构,蛋白结构上的改变很可能影响多酚与蛋白质在提取过程中的结合,近而影响多酚的提取量及其抗氧化活性。
参考文献:
[1] 臧云. 蓝靛果花色苷酶促衍生物的稳定性及抗氧化研究[D]. 哈尔滨: 东北林业大学, 2013: 1-3.
[2] 李淑芹, 李延冰, 姜福臣, 等. 野生植物: 蓝靛果营养成分研究[J].东北农业大学学报, 1994(4): 401-404.
[3] 吕闻明. 蓝靛果忍冬酚类物质提取及抗氧化性研究[D]. 长春: 吉林大学, 2012: 1-2.
[4] JURIKOVA T, ROP O, MLCEK J, et al. Phenolic profile of edible honeysuckle berries (Genus Lonicera) and their biological effects[J]. Molecules, 2011, 17(1): 61-79. DOI:10.3390/molecules17010061.
[5] JIN H L, PARK K H, LEE M H, et al. Identif cation, characterisation, and quantif cation of phenolic compounds in the antioxidant activitycontaining fraction from the seeds of Korean perilla (Perilla frutescens) cultivars[J]. Food Chemistry, 2013, 136(2): 843-852. DOI:10.1016/j.foodchem.2012.08.057.
[6] 连冠, 鱼毛毛, 徐璐, 等. 葡萄籽多酚降血脂及抗动脉粥样硬化的作用及机制[J]. 中国动脉硬化杂志, 2015, 23(2): 121-126.
[7] 生守喜. 苹果多酚的提取及对心脏保护作用的研究[D]. 泰安: 山东师范大学, 2015: 57-65.
[8] 陈金玉, 曾健, 李春美. 龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J]. 食品科学, 2015, 36(16): 31-37. DOI:10.7506/spkx1002-6630-201516006.
[9] LI Jian, AN Ting, LIU Ning, et al. Optimization of the extraction of apple polyphenols by response surface-microwave methodology[J]. Journal of Food Safety & Quality, 2015, 6: 2029-2035. DOI:10.1002/ jssc.201000430.
[10] 李珍, 哈益明, 李安, 等. 响应面优化苹果皮渣多酚超声提取工艺研究[J]. 中国农业科学, 2013, 46(21): 4569-4577. DOI:10.3864/ j.issn.0578-1752.2013.21.020
[11] CORRALES M, GARC☒A A F, BUTZ P, et al. Extraction of anthocyanins from grape skins assisted by high hydrostatic pressure[J]. Journal of Food Engineering, 2009, 90(4): 415-421. DOI:10.1016/ j.jfoodeng.2008.07.003.
[12] XI Jun, ZHANG Shouqi. Antioxidant activity of ethanolic extracts of propolis by high hydrostatic pressure extraction[J]. International Journal of Food Science & Technology, 2007, 42(11): 1350-1356.
[13] XI Jun. Application of high hydrostatic pressure processing of food to extracting lycopene from tomato paste waste[J]. High Pressure Research, 2006, 26(1): 33-41.
[14] CORRALES M, TOEPFL S, BUTZ P, et al. Extraction of anthocyanins from grape by-products assisted by ultrasonics, high hydrostatic pressure or pulsed electric fields: a comparison[J]. Innovative Food Science & Emerging Technologies, 2008, 9(1): 85-91. DOI:10.1016/j.ifset.2007.06.002.
[15] KARAKASHOV B, GRIGORAKIS S, LOUPASSAKI S, et al. Optimisation of polyphenol extraction from Hypericum perforatum, (St. John’s Wort) using aqueous glycerol and response surface methodology[J]. Journal of Applied Research on Medicinal & Aromatic Plants, 2015, 2(1): 1-8. DOI:10.1016/j.jarmap.2014.11.002.
[16] 李斌, 雷月, 孟宪军, 等. 响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J]. 食品科学, 2015, 36(22): 33-39. DOI:10.7506/spkx1002-6630-201522006.
[17] ZHANG Dongyang, LUO Meng, WANG Wei, et al. Variation of active constituents and antioxidant activity in pyrola [P. incarnate Fisch.] from different sites in Northeast China[J]. Food Chemistry, 2013, 141(3): 2213-2219. DOI:10.1016/j.foodchem.2013.05.045.
[18] LUO Jiangguang, LI Lu, KONG Lingyi, et al. Preparative separation of phenylpropenoid glycerides from the bulbs of Liliumlancifolium by high-speed counter-current chromatography and evaluation of their antioxidant activities[J]. Food Chemistry, 2012, 131(3): 1056-1062. DOI:10.1016/j.foodchem.2011.09.112.
[19] 吕春茂, 王新现, 包静, 等. 越橘果实花色苷的体外抗氧化性[J].食品科学, 2010, 31(23): 27-31.
[20] 石恩慧, 李红, 谷明灿, 等. 响应面法优化超声提取板栗总苞多酚工艺条件[J]. 中国食品学报, 2013, 13(5): 69-76. DOI:10.16429/j.1009-7848.2013.05.021.
[21] 薛路舟, 陈淑花, 夏远景, 等. 超高压处理对生物大分子的影响研究进展[D]. 大连: 大连理工大学, 2010: 27-54.
[22] 苏丹, 李树君, 赵凤敏, 等. 超高压处理对大豆分离蛋白结构的影响[J].食品科技, 2009, 34(12): 51-55.
[23] 王海燕, 李睿, 曾秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J].食品科学, 2014, 35(22): 56-62. DOI:10.7506/spkx1002-6630-201422011.
[24] 叶新红. 不同处理方法对葡萄汁中多酚类物质溶出效果及抗氧化活性影响的研究[D]. 乌鲁木齐: 新疆农业大学, 2009: 25-31.
[25] XI Jun, SHEN Deji, YE Li, et al. Ultrahigh pressure extraction as a tool to improve the antioxidant activities of green tea extracts[J]. Food Research International, 2011, 44(9): 2783-2787. DOI:10.1016/ j.foodres.2011.06.001.
[26] TANG Lin, ZUO Huijin, SHU Li. Comparison of the interaction between three anthocyanins and human serum albumins by spectroscopy[J]. Journal of Luminescence, 2014, 153(3): 54-63. DOI:10.1016/j.jlumin.2014.03.004.
Comparative Effects of Ultra-High Pressure and Ultrasonic Treatment on the Extraction and Antioxidant Activity of Polyphenols from Lonicera caerulea Fruits
LI Xinyuan
1, LI Bin
1, YAN Tingcai
1, LIU Sunwen
2, SUN Xiyun
1, SHI Yimo
1, ZHANG Qi
1, MENG Xianjun
1,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. College of Food Science and Technology, Hebei Normal University of Science and Technology, Qinhuangdao 066004, China)
Abstract:In the present study, response surface methodology was used to optimize the conditions for ultra-high pressure (UHP) extraction of polyphenols from Lonicera caerulea fruits and a comparison was performed with ultrasonic-assisted extraction (UAE) with respect to extraction eff ciency, processing conditions and antioxidant activity of polyphenols. The results showed that the optimal conditions for UHP-assisted extraction that provided the maximum yield of polyphenols of (778.23 ± 3.45) mg/100 g berries were determined as follows: 50% ethanol as the extraction solvent, a solid-to-liquid ratio of 1:19 (g/mL), an extraction temperature of 30 ℃, an extraction pressure of 406 MPa, and an extraction time of 11.5 min. The optimal conditions for ultrasonic-assisted extraction that gave the maximum yield of polyphenols of (785.74 ± 3.89) mg/100 g berries were determined to be 50% ethanol as the extraction solvent, a solid-to-liquid ratio of 1:25 (g/mL), an extraction temperature of 40 ℃, an ultrasonic power of 500 W, and an extraction time of 90 min. Antioxidant test results showed that the antioxidant activity of polyphenols from ultra-high pressure extraction was signif cantly higher in terms of 2,2’-azinobis(3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt radical (ABTS +·) scavenging capacity, ferric reducing antioxidant power (FRAP), and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity when compared with those from ultrasonic extraction and VC at the same concentration levels. Although the ultra-high pressure extraction took a shorter time and yielded polyphenols with higher antioxidant activity, its eff ciency in large-scale extraction of polyphenols was not as good as that of the ultrasonic-assisted extraction due to the limitation in the size of the container used. Therefore, considering extraction yield and extraction efficiency, the ultrasonic-assisted extraction was better than the ultra-high pressure extraction for Lonicera caerulea fruit polyphenols.
Key words:Lonicera caerulea fruit polyphenols; ultra-high pressure extraction; ultrasonic-assisted extraction; antioxidant activity
DOI:10.7506/spkx1002-6630-201702042
中图分类号:TS218
文献标志码:A
文章编号:1002-6630(2017)02-0271-07
收稿日期:2016-06-05
基金项目:辽宁省高等学校优秀人才支持项目(LJQ2014068);公益性行业(农业)科研专项(201303073-04);沈阳农业大学天柱山英才项目(2014)
作者简介:李新原(1991—),男,硕士研究生,研究方向为浆果深加工及功能食品开发。E-mail:497084602@qq.com
*通信作者:孟宪军(1961—),男,教授,博士,研究方向为天然活性成分和功能性食品。E-mail:mengxjsy@126.com
引文格式:
李新原, 李斌, 颜廷才, 等. 超高压与超声波对蓝靛果多酚提取及抗氧化活性的影响[J]. 食品科学, 2017, 38(2): 271-277. DOI:10.7506/spkx1002-6630-201702042. http://www.spkx.net.cn
LI Xinyuan, LI Bin, YAN Tingcai, et al. Comparative effects of ultra-high pressure and ultrasonic treatment on the extraction and antioxidant activity of polyphenols from Lonicera caerulea fruits[J]. Food Science, 2017, 38(2): 271-277. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702042. http://www.spkx.net.cn