宋思圆,苏 平*,王丽娟,邹明明,孙 昕
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
摘 要:以黄秋葵花为原料,在单因素试验的基础上,采用响应面分析法,优化了超声辅助提取果胶多糖工艺。结果表明,超声辅助提取黄秋葵花果胶多糖的最优工艺为提取温度55 ℃、提取时间30 min、超声功率85.5 W、料液比1∶40(g/mL),黄秋葵花果胶多糖提取率为12.62%,与预测值相近,说明模型拟合良好,该优化工艺准确可行。同时,提取的黄秋葵花果胶多糖具有较好的体外抗氧化活性,是一种潜在的天然抗氧化活性成分。
关键词:黄秋葵花;果胶;超声辅助提取;响应面分析;抗氧化
黄秋葵(Abelmoschus esculentus (L.) Moench)原产于非洲的锦葵科热带植物,现在广泛栽培于中东、南美及东南亚等地区 [1]。黄秋葵作为一种食用的蔬菜,富含蛋白质、碳水化合物、不饱和脂肪酸、维生素和矿物质 [2]。近年来,国内外已有对黄秋葵嫩荚的多糖研究,发现其具有抗肿瘤 [2]、降血脂 [3]、免疫调节活性 [4]等生理功能。此外,黄秋葵多糖还具有良好的增稠、乳化等功能特性 [5]。黄秋葵花中同样富含多糖类物质,也可作为一种优质的多糖资源。刘晓霞 [6]优化了黄秋葵花中果胶多糖的酸法提取,并对其理化性质、流变特性和结构进行了研究,发现它是一种主要由半乳糖、鼠李糖和半乳糖醛酸组成的酸性杂多糖;Zheng Wei等 [7]对黄秋葵花多糖进行分离纯化,发现水溶性多糖组分OFPS11能抑制癌细胞增殖,并且有一定免疫调节活性。
为了进一步研究开发和应用黄秋葵花果胶多糖资源,选择高效的提取方法就显得十分重要。提取果胶多糖最常见的是传统酸法工艺 [8],但其提取条件所需温度高、时间长,会使得到的多糖生物活性降低 [9]。超声提取作为一种新型的辅助提取手段,已广泛应用于化学、食品等许多科学研究领域。超声空化效应促进细胞壁的破坏,增强溶剂和目标化合物之间的接触 [10],不仅增加了多糖提取率、降低提取温度,还使得提取过程更高效,更环保。据文献报道,采用超声方法提取的菌丝 [9]、桑叶 [11]、金丝枣 [12]等多糖时,提取率明显增加。此外,超声提取的金丝枣多糖具有更强的抗氧化活性,这可能与超声过程中的多糖结构改变有关 [12]。但超声波处理也会存在一些缺点,如造成多糖降解及其成分的变化 [13]。目前黄秋葵花果胶多糖的超声辅助提取尚未报道,而不同原料所采用的条件差异较大,因此,要针对原料采用适宜的提取条件,提高提取效率,减少提取过程中的不利影响。
本实验探究超声辅助黄秋葵花果胶的提取条件对提取率的影响,采用响应面法应优化提取工艺,同时通过化学抗氧化法评价其体外抗氧化活性,可以为黄秋葵花果胶多糖制备和生物活性的分析与评估提供理论依据,拓展其在食品工业的应用。
1.1 材料与试剂
黄秋葵花产自浙江嘉善,品种为纤指黄秋葵花,70 ℃烘干,破碎后过60 目筛备用。
过硫酸钾、95%乙醇(均为分析纯) 国药集团化学试剂有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、水溶性VE(Trolox)(均为分析纯) 美国Sigma公司;2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)、2,2’-联氮基-双-(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2’-azino bis(3-ethylbenzth iazoline-6-sulfonic acid) diammonium salt,ABTS)、荧光素钠(均为分析纯) 阿拉丁试剂有限公司。
1.2 仪器与设备
SCIENTZ-ⅡD超声波细胞破碎机 宁波新芝生物科技股份有限公司;DC-0506低温恒温槽 宁波海曙赛福实验仪器厂;PH070A恒温鼓风干燥箱 上海一恒科技有限公司;TGL20M高速冷冻离心机 湖南凯达科学仪器有限公司;JA1003N电子天平 上海菁海仪器有限公司;Multiskan GO全波长酶标仪 美国Thermo公司。
1.3 方法
1.3.1 黄秋葵花果胶的提取
参照刘晓霞 [6]的方法,取一定量的黄秋葵干花粉末,按相应的料液比加入去离子水,在一定的时间、功率和温度条件下进行超声波辅助提取。将提取液离心(4 000 r/min,30 min)收集上清液,加入3 倍体积的95%乙醇溶液,4 ℃沉淀过夜,离心(4 000 r/min,15 min);沉淀物依次用70%乙醇溶液、95%乙醇溶液、无水乙醇洗涤,在40 ℃烘箱中烘干至恒质量,称量。实验中所有提取实验在专门的恒温水浴槽中进行,以控制提取温度的恒定。
1.3.2 果胶提取率计算
1.3.3 单因素试验
1.3.3.1 提取温度对果胶提取率的影响
以料液比1∶40(g/mL),固定超声功率95 W,分别在30、40、50、60、70、80 ℃温度条件下提取30 min。平行提取3 次,考察提取温度对提取率的影响。
1.3.3.2 提取时间对果胶提取率的影响
以料液比1∶40(g/mL),在超声功率95 W、提取温度50 ℃条件下,分别提取10、20、30、40、50、60 min。平行提取3 次,考察超声提取时间对提取率的影响。
1.3.3.3 超声功率对果胶提取率的影响
以料液比1∶40(g/mL),固定提取温度50 ℃,分别在38、66.5、95、123.5、152、180.5 W的超声功率条件下提取30 min。平行提取3 次,考察超声功率对提取率的影响。
1.3.3.4 料液比对果胶提取率的影响
在提取温度50 ℃、超声功率95 W条件下,分别以1∶30、1∶35、1∶40、1∶45、1∶50(g/mL)的料液比提取30 min。平行提取3 次,考察料液比对提取率的影响。
1.3.4 响应面试验设计
在上述单因素试验的基础上,选择提取时间、提取温度、超声功率为自变量,以提取率为响应值,根据Box-Behnken设计原理,采用三因素三水平响应面分析法进行试验设计,优化超声提取黄秋葵花果胶多糖的提取工艺,因素与水平设计见表1。
表1 响应面分析法的因素与水平
Table1 Factors and levels used in response surface methodology

因素水平-101 X 1提取温度/℃506070 X 2提取时间/min203040 X 3超声功率/W66.595123.5
1.3.5 黄秋葵花果胶多糖的抗氧化活性
1.3.5.1 铁离子还原抗氧化力(ferric reducing antioxidant power,FRAP)测定
按照黄海智 [14]的测定方法,取3.9 mL的Fe(Ⅲ)-TPTR复合物溶液,加入100 μL样品,涡旋混合,在37 ℃条件下孵育10 min,检测其593 nm波长处的吸收峰。以Trolox为标准品,测定质量浓度分别为50、100、200、300、400、500 μg/mL的FRAP值,绘制标准曲线,结果表示为每克干物质的Trolox当量(mg Trolox/g)。
1.3.5.2 DPPH自由基清除能力测定
测定方法参考Imjongjaira等 [15]的报道,取300 μL的DPPH溶液(0.2 mmol/L,溶于80%乙醇溶液中),加入300 μL样品并涡旋混合避光室温反应30 min,在517 nm波长处检测其吸收峰。测定不同质量浓度Trolox(2、5、8、10、12.5 μg/mL)对DPPH自由基清除能力,制作出对应的标准曲线,样品的结果表示为每克干物质的Trolox当量(mg Trolox/g)。
1.3.5.3 ABTS +·清除能力测定
根据黄海智 [14]的方法进行测定,由25 mL ABTS储备溶液(7 mmol/L)和440 μL过硫酸钾溶液(140 mmol/L)混合,室温避光反应12~16 h,制备得到ABTS阳离子溶液。ABTS阳离子溶液用磷酸盐缓冲生理盐水(pH 7.4)稀释,直到它在734 nm的吸光度为0.7±0.02。取3.9 mL稀释后的ABTS阳离子溶液,加入100 μL样品并涡旋混合。室温条件下,避光反应10 min,734 nm波长处检测其吸收峰。以不同质量浓度Trolox(50、100、200、300、400 μg/mL)为标准品,绘制标准曲线,结果表示为每克干物质的Trolox当量(mg Trolox/g)。
1.3.5.4 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)测定
ORAC根据先前报道的方法测定 [14]并略作修改。荧光素的溶液用75 mmol/L的磷酸钾缓冲液(pH 7.4)溶解,配成504 nmol/L的终浓度。随后,在黑底96孔板加入25 μL的样品或Trolox溶液和25 μL荧光素钠溶液,将其在37 ℃条件下孵育5 min,再将150 μL AAPH磷酸钾缓冲溶液(17.07 mmol/L)加入到该混合物中。充分振荡5 s后,开始检测,发射波长538 nm、激发波长485 nm,每分钟测定一次,在37 ℃连续测定3 h。结果表示为每克干物质的Trolox当量(mg Trolox/g)。
2.1 单因素试验结果
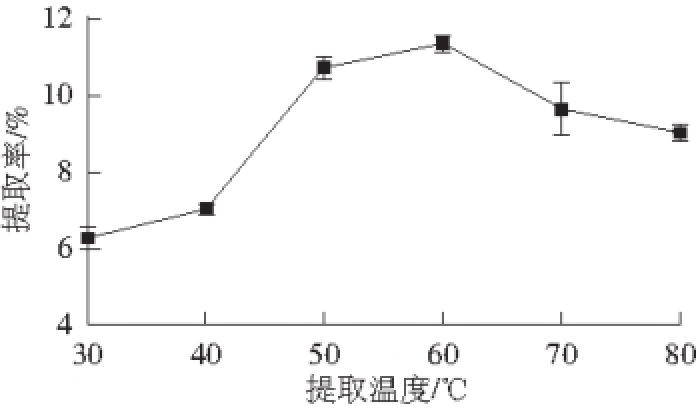
图1 提取温度对果胶多糖提取率的影响
Fig. 1 Effect of extraction temperature on the yield of pectic polysaccharide
2.1.1 提取温度对果胶多糖提取率的影响如图1所示,随温度的升高,果胶多糖的提取率呈先上升后下降的趋势,其中在40~60 ℃之间提取率显著提高,60 ℃时达到最大值。在超声辅助提取过程中,随着温度的升高,体系黏度降低,加速了传质过程。同时,液体介质之间也更容易形成超声空化泡,增加空化泡与物料的接触 [16],促进了大分子物质向外扩散溶出,使得果胶的提取率提高。但过高的温度会引起表面张力的降低和空化泡内的蒸汽压力的增加,造成超声波的阻尼 [10],而且高温还可能使果胶降解,导致提取率下降。因此,提取温度选在60 ℃左右。
2.1.2 提取时间对果胶多糖提取率的影响。

图2 提取时间对果胶多糖提取率的影响
Fig. 2 Effect of extraction time on the yield of pectic polysaccharide
从图2可以看出,在10~30 min的提取时间范围内,提取率明显上升,在30 min时达到最大,之后提取率随时间的增加而下降。这可能是与超声提取过程中会涉及到的两个步骤有关:首先是植物材料在溶剂中浸泡,溶胀和水化的过程,接着是物料中的目标成分通过扩散和渗透作用的传质过程 [17]。因此,随着时间的延长,在超声的作用下,提取液能够更充分地渗入物料,促进果胶从组织中溶出,因此在一定的范围内提取率随时间延长而增加。然而,超声时间过长也会导致果胶的降解,提取率降低 [10]。因此,提取时间应控制在30 min左右。
2.1.3 超声功率对果胶多糖提取率的影响

图3 超声功率对果胶多糖提取率的影响
Fig. 3 Effect of ultrasonic powers on extraction rate of pectic polysaccharide
由图3可知,在一定范围内提取率随着超声功率的增大而明显上升。超声功率的增加能促进对植物组织的破坏 [11]。在一定范围内,超声波能够有效破坏植物结构组织,促进多糖大分子物质溶出,从而使得提取率明显增加。然而,当功率超过95 W后,提取率又明显的下降。在提取过程中果胶的降解也会随着超声强度的增加而增加 [18],也就是当超声功率过大时,果胶会发生降解使提取率降低。因此,超声功率应控制在95 W左右。
2.1.4 料液比对果胶多糖提取率的影响

图4 料液比对果胶多糖提取率的影响
F
ig. 4 Effect of material-to-water ratio on the yield of pectic polysaccharide
由图4可知,在溶剂用量较小时,原料中的多糖不能够全部转移到提取液中,造成提取不完全、提取率较低。增大溶剂用量可以使内部的植物细胞和外部溶剂之间产生更大的浓度差,有利于多糖的扩散更迅速地进行,更多的多糖溶出 [11]。而在溶剂用量过大时,后续的浓缩和沉淀工艺难度加大,说明多糖溶出量已达到饱和,这可能是溶剂用量增加导致原料的物质分子间相互作用减弱 [19]。考虑到节约能源,选择1∶40左右的料液比比较合适。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果及方差分析
表2 Box-Behnken试验设计与结果
Table2 Box-Behnken design with experimental results
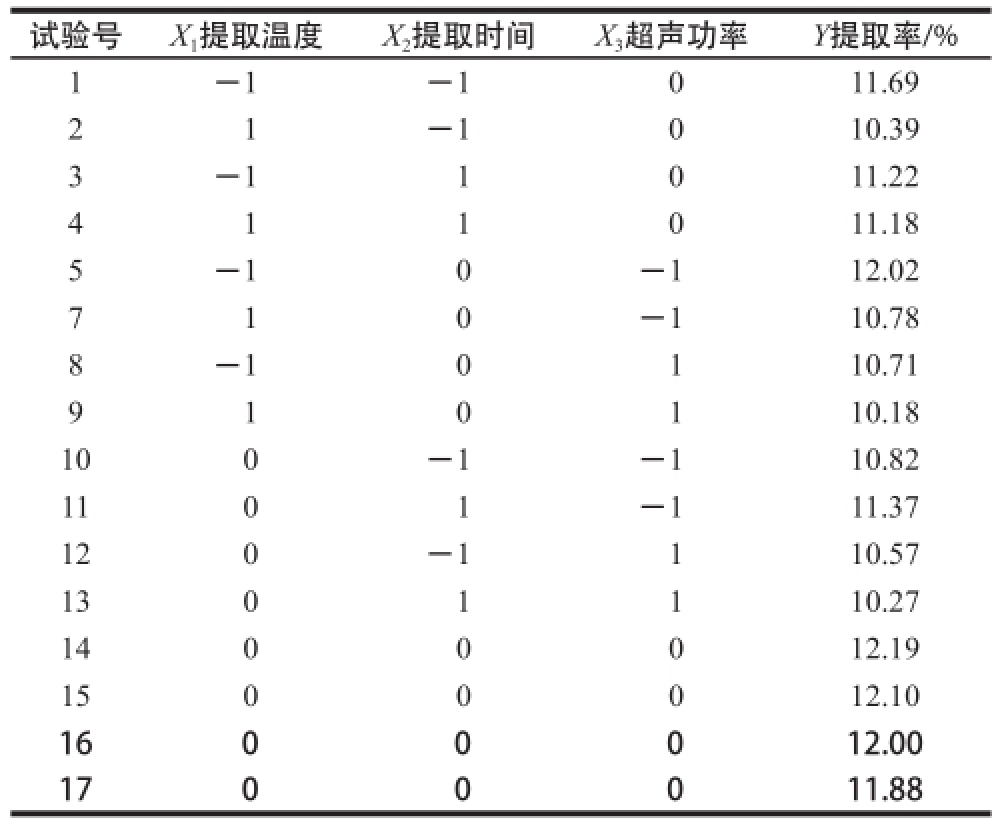
试验号X 1提取温度X 2提取时间X 3超声功率Y提取率/% 1-1-1011.69 2 1-1010.39 3-11011.22 4 1 1 0 11.18 5-10-112.02 7 1 0-110.78 8-10110.71 9 1 0 1 10.18 100-1-110.82 1101-111.37 120-1110.57 1301110.27 1400012.19 1500012.10 1600012.00 1700011.88
响应面分析试验设计结果如表2所示。运用Design-Expert 6.0软件进行二次多元回归拟合,得到二次多元回归方程:
表3 方差分析
Table3 Analysis of variance

注:P<0.01,差异极显著;P<0.05,差异显著。
来源自由度平方和均方F值P值模型8.4890.9428.950.000 1 X 1提取温度1.2211.2237.380.000 5 X 2提取时间0.04010.0401.240.303 0 X 3超声功率1.3311.3340.860.000 4 X 10.7210.7222.210.002 2 X2 2 2.5412.5478.21<0.000 1 X 1X 20.3910.3912.070.010 3 X 1X 30.1310.133.920.088 2 X 2X 30.1810.185.460.052 1残差0.2370.033失拟项0.06430.0210.520.692 6绝对误差0.1640.041总误差8.7116 1.4211.4243.710.000 3 X3 2 2
由表3可知,此模型的P为0.000 1,响应面回归模型十分显著,失拟项(P=0.692 6>0.05)不显著,说明非试验因素对试验结果的影响不大。决定系数R
2为0.973 8,这表明该模型与实际试验拟合较好,97.38%的响应值变化可以通过拟合模型进行解释。校正后的决定系数
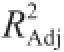 为0.940 2,与R
2接近,说明了模型有充分的准确性和通用性。因此该模型方程在试验范围内,能够适用于预测超声波辅助提取黄秋葵花果胶多糖得率的分析预测。从表3还可以看出,一次项X
1、X
3和二次项X
1
2、X
2
2、X3
2对提取率影响极显著,交互项X
1X
2对提取率影响显著;其他因素的影响不显著。
为0.940 2,与R
2接近,说明了模型有充分的准确性和通用性。因此该模型方程在试验范围内,能够适用于预测超声波辅助提取黄秋葵花果胶多糖得率的分析预测。从表3还可以看出,一次项X
1、X
3和二次项X
1
2、X
2
2、X3
2对提取率影响极显著,交互项X
1X
2对提取率影响显著;其他因素的影响不显著。
2.2.2 响应面分析

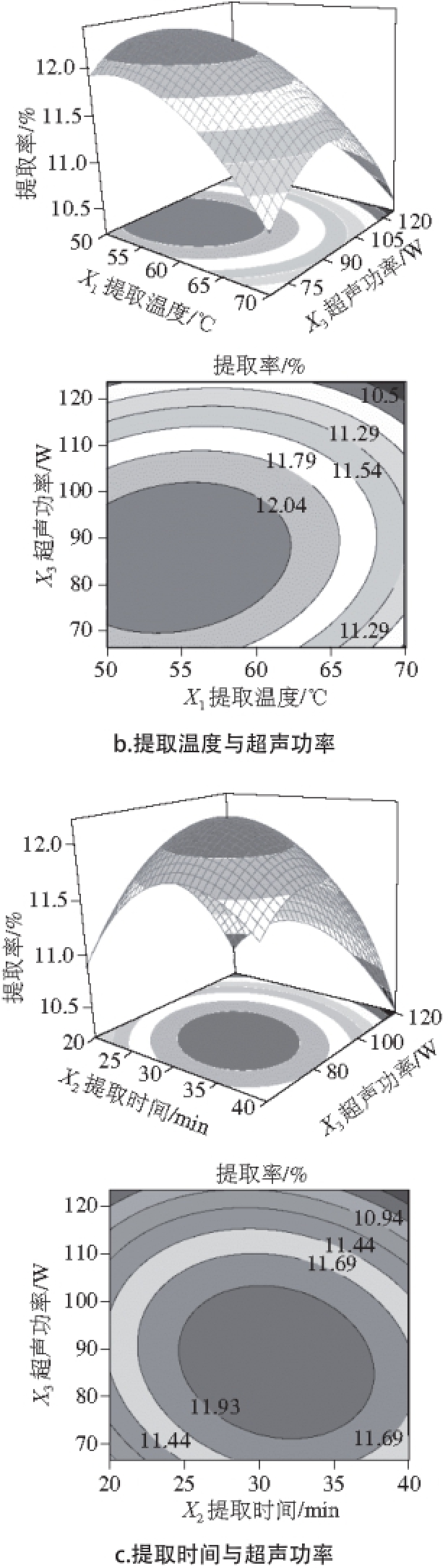
图5 各因素交互作用的响应面和等高线图
Fig. 5 Response surface and contour plots showing the effects of different extraction parameters on the yield of pectic polysaccharide
图5 能反映在试验范围内两因素的交互作用,同时第3个因素固定在零水平。提取温度和提取时间的交互作用是显著的,当超声功率保持在零水平时,其相互关系如图5a所示。这说明提取温度的改变会显著影响提取时间,反之也成立;提取温度和提取时间对提取率的影响存在明显的二次关系。如图5b所示,当提取时间保持在零水平时,超声功率对提取率的影响有显著的二次关系。在提取温度较低的情况下,提取率先随超声功率的增加而增加,随后又降低。图5c的结果表明,在提取温度保持零水平时,当超声功率一定时,黄秋葵花果胶多糖的提取率随提取时间的延长先增大后减小。
2.3 最优提取工艺验证
通过模型预测超声提取黄秋葵花中果胶多糖的最优工艺条件为提取温度54.49 ℃、提取时间29.70 min、超声功率85.88 W,多糖提取率的预测值为12.29%。考虑到实际情况对上述条件进行修正,最终的优化条件为提取温度55 ℃、提取时间30 min、超声功率85.5 W,在此条件下进行3 次平行实验验证,提取率为(12.62±0.21)%,与理论预测值较接近,说明用该模型对黄秋葵花果胶多糖的提取进行工艺优化具有一定的实际可操作性。
2.4 黄秋葵花果胶多糖的抗氧化活性
2.4.1 FRAP测定结果
FRAP分析法用于抗氧化剂和植物提取物的总抗氧化活性的常规分析,反映了抗氧化剂的还原能力的大小 [20]。结果表明超声提取的黄秋葵花果胶多糖具有一定的抗氧化活性,这是因为多糖分子中含有大量的羟基基团,能够作为电子供体,将Fe 3+还原成Fe 2+。赵焕焕 [21]从黄秋葵中提取分离出3种多糖组分,并分析了其Fe 3+还原能力,发现不同组分的黄秋葵多糖都具有一定的Fe 3+还原能力,随着样品质量浓度的增加还原能力增强。
Trolox在一定范围内(50~500 μg/mL)与Fe 3+还原能力呈线性关系,其线性方程为y=0.002x-0.003 6(R 2=0.999 2),带入方程得到黄秋葵花果胶多糖的FRAP值为(65.96±0.14) mg Trolox/g。
2.4.2 DPPH自由基清除能力测定结果
DPPH是一种较为稳定的自由基,在517 nm波长处有特征吸收峰 [20],广泛应用于评价抗氧化成分的自由基清除能力。DPPH自由基清除剂能提供氢并形成稳定的非自由基分子 [22]。研究表明,多糖具有自由基清除能力,可能是由于其属于氢供体物质,可与自由基反应以生成更稳定的产物和终止自由基链反应 [20]。研究发现黄秋葵中提取的多糖有一定的DPPH自由基清除能力,不同组分RPS、RPS-1、RPS-2、RPS-3的IC 50值分别为(4.94±0.27)、(10.21±0.13)、(18.58±0.38)、(12.43±0.28) mg/mL,且具有剂量依赖的关系 [21]。
DPPH自由基清除能力测定实验中,当Trolox质量浓度在2~12.5 μg/mL时,得到的线性方程为y=0.036 6x+0.162 5(R²=0.999 0)。将实验结果带入方程,计算出黄秋葵花果胶多糖的DPPH自由基清除能力为(91.31±1.05) mg Trolox/g。
2.4.3 ABTS +·清除能力测定结果
ABTS +·清除能力评价抗氧化能力,是基于抗氧化剂可以提供电子或氢原子灭活自由基,导致ABTS +·溶液颜色发生变化 [23],再通过分光光度计分析测量的一种方法 [24]。以Trolox质量浓度(50~400 μg/mL)为横坐标,ABTS +·清除率为纵坐标绘制得到标准曲线y=0.225 5x+4.7119(R²=0.999 0),由此得到黄秋葵花果胶多糖的A B T S +·清除能力为(50.05±2.50)mg Trolox/g。
2.4.4 ORAC测定结果
研究表明,活性氧和氧自由基可能会导致多种病理效应,与多种疾病有关 [25]。因此,研究和开发天然的氧自由基清除抗氧化剂受到了广泛关注。氧自由基吸收能力实验是测定抗氧化剂对于活性自由基引起的氧化能力的抑制 [14],测定条件模拟生理条件,是目前抗氧化研究领域中一种公认的抗氧化活性指标,常用于评价果蔬的抗氧化能力。多糖可以通过直接作用于活性氧或间接作用于抗氧化酶,发挥抗氧化作用,还可以螯合产生自由基所必需的金属离子来抑制活性氧 [26]。结果表明,超声提取的黄秋葵花果胶多糖的ORAC为(25.74±1.29)mg Trolox/g。
在本实验中,首先采用单因素试验分析考察不同因素对多糖提取率的影响,确定合适的提取条件;再用响应面分析法优化黄秋葵花果胶多糖的提取工艺。利用Design-Expert软件,对试验结果进行分析,其中提取温度和超声功率对结果影响显著,提取温度和提取时间的交互作用显著,得到最佳提取工艺提取温度54.49 ℃、提取时间29.70 min、超声功率85.88 W,果胶提取率的预测值为12.29%。考虑到实际情况对上述条件进行修正,最终的优化条件为提取温度55 ℃、提取时间30 min、超声功率85.5 W,经验证,得到提取率为12.62%,与理论预测值较接近,说明该模型能较好地预测实际提取率。此外,多糖作为食品功能成分的研究热点,具有复杂的生物功能活性 [26],其抗氧化活性主要取决于其化学组成如蛋白质和糖醛酸含量、分子质量、结构和构象 [16]。研究结果表明黄秋葵花果胶多糖有较好的体外抗氧化活性,DPPH自由基清除能力为(91.31±1.05)mg Trolox/g,ABTS +·清除能力为(50.05±2.50)mg Trolox/g,FRAP值为(65.96±0.14)mg Trolox/g以及ORAC为(25.74±1.29)mg Trolox/g,具有作为功能成分在食品和医药领域进一步发展应用的潜力。
参考文献:
[1] ALBA K, RITZOULIS C, GEORGIADIS N, et al. Okra extracts as emulsif ers for acidic emulsions[J]. Food Research International, 2013, 54(2): 1730-1737. DOI:10.1016/j.foodres.2013.09.051.
[2] 任丹丹. 黄秋葵多糖提取纯化及其体外结合胆酸能力和抑制肿瘤活性分析[D]. 广州: 华南理工大学, 2011.
[3] 王宏. 黄秋葵降血脂的功能与作用机理研究[D]. 广州: 华南理工大学, 2013.
[4] SHEU S C, LAI M H. Composition analysis and immuno-modulatory effect of okra (Abelmoschus esculentus L.) extract[J]. Food Chemistry, 2012, 134(4): 1906-1911. DOI:10.1016/j.foodchem.2012.03.110.
[5] ALBA K, LAWS A P, KONTOGIORGOS V. Isolation and characterization of acetylated LM-pectins extracted from okra pods[J]. Food Hydrocolloids, 2015, 43: 726-735. DOI:10.1016/ j.foodhyd.2014.08.003.
[6] 刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究[D].杭州: 浙江大学, 2014.
[7] ZHENG Wei, ZHAO Ting, FENG Weiwei, et al. Purification, characterization and immunomodulating activity of a polysaccharide from f owers of Abelmoschus esculentus[J]. Carbohydrate Polymers, 2014, 106: 335-342. DOI:10.1016/j.carbpol.2014.02.079.
[8] PENG Xiaoyan, MU Taihua, ZHANG Miao, et al. Optimisation of production yield by ultrasound-/microwave-assisted acid method and functional property of pectin from sugar beet pulp[J]. International Journal of Food Science and Technology, 2015, 50(3): 758-765. DOI:10.1111/ijfs.12678.
[9] CHEN Wei, WANG Weipin, ZHANG Huahsan, et al. Optimization of ultrasonic-assisted extraction of water-soluble polysaccharides from Boletus edulis mycelia using response surface methodology[J]. Carbohydrate Polymers, 2012, 87(1): 614-619. DOI:10.1016/ j.carbpol.2011.08.029.
[10] ZHU Caiping, ZHAI Xichuan, LI Linqiang, et al. Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J]. Food Chemistry, 2015, 177: 139-146. DOI:10.1016/j.foodchem.2015.01.022.
[11] YING Zhi, HAN Xiaoxiang, LI Jianrong. Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J]. Food Chemistry, 2011, 127(3): 1273-1279. DOI:10.1016/j.foodchem.2011.01.083.
[12] LI Jinwei, AI Lianzhong, HANG Feng, et al. Composition and antioxidant activity of polysaccharides from jujuba by classical and ultrasound extraction[J]. International Journal of Biological Macromolecules, 2014, 63: 150-153. DOI:10.1016/ j.ijbiomac.2013.10.043.
[13] EBRINGEROVÁ A, HROMÁDKOVÁ Z. An overview on the application of ultrasound in extraction, separation and purification of plant polysaccharides[J]. Open Chemistry, 2010, 8(2): 243-257. DOI:10.2478/s11532-010-0006-2.
[14] 黄海智. 杨梅酚类化合物抗氧化和抗癌功能及机理研究[D]. 杭州:浙江大学, 2015.
[15] IMJONGJAIRAK S, RATANAKHANOKCHAI K, LAOHAKUNJIT N, et al. Biochemical characteristics and antioxidant activity of crude and purified sulfated polysaccharides from Gracilaria fisheri[J]. Bioscience Biotechnology and Biochemistry, 2016, 80(3): 524-532. DOI:10.1080/09168451.2015.1101334.
[16] YANG Bao, JIANG Yueming, ZHAO Mouming, et al. Effects of ultrasonic extraction on the physical and chemical properties of polysaccharides from longan fruit pericarp[J]. Polymer Degradation and Stability, 2008, 93(1): 268-272. DOI:10.1016/ j.polymdegradstab.2007.09.007.
[17] VINATORU M. Ultrasonically assisted extraction (UAE) of natural products some guidelines for good practice and reporting[J]. Ultrasonics Sonochemistry, 2015, 25: 94-95. DOI:10.1016/ j.ultsonch.2014.10.003.
[18] ZHANG Lifen, YE Xinqian, DING Tian, et al. Ultrasound effects on the degradation kinetics, structure and rheological properties of apple pectin[J]. Ultrasonics Sonochemistry, 2013, 20(1): 222-231. DOI:10.1016/j.polymdegradstab.
[19] 秦德利, 贾坤, 窦珺荣, 等. 茶树花多糖超声波辅助热水浸提工艺优化[J]. 食品工业科技, 2015, 36(4): 215-218.
[20] CHEN Ruizhan, JIN Chenguang, TONG Zhigang, et al. Optimization extraction, characterization and antioxidant activities of pectic polysaccharide from tangerine peels[J]. Carbohydrate Polymers, 2016, 136: 187-197. DOI:10.1016/j.carbpol.2015.09.036.
[21] 赵焕焕. 黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D]. 郑州:郑州大学, 2012.
[22] MATTHAUS B. Antioxidant activity of extracts obtained from residues of different oilseeds[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3444-3452. DOI:10.1021/jf011440s.
[23] HAN Lijuan, SUO Yourui, YANG Yongjing, et al. Optimization, characterization, and biological activity of polysaccharides from Berberis dasystachya Maxim[J]. International Journal of Biological Macromolecules, 2016, 85: 655-666. DOI:10.1016/ j.ijbiomac.2015.10.038.
[24] JEDDOU K B, CHAARI F, MAKTOUF S, et al. Structural, functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels[J]. Food Chemistry, 2016, 205: 97-105. DOI:10.1016/ j.foodchem.2016.02.108.
[25] YOU Lijun, GAO Qing, FENG Mengying, et al. Structural characterisation of polysaccharides from Tricholoma matsutake and their antioxidant and antitumour activities[J]. Food Chemistry, 2013, 138(4): 2242-2249. DOI:10.1016/j.foodchem.2012.11.140.
[26] 俞慧红, 竺巧玲, 戴飞, 等. 多糖抗氧化作用的研究现状[J]. 食品研究与开发, 2008, 29(3): 172-176.
Optimization of Ultrasonic-Assisted Extraction by Response Surface Methodology and Antioxidant Activities of Pectic Polysaccharide from Okra Flowers
SONG Siyuan, SU Ping*, WANG Lijuan, ZOU Mingming, SUN Xin
(College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Abstract:Based on one-factor-at-a-time experiments, response surface methodology was employed to optimize the ultrasound-assisted extraction of pectic polysaccharide from okra flowers. The optimal conditions were determined as follows: extraction temperature, 55 ℃; extraction time, 30 min; ultrasonic power, 85.5 W; and raw material-to-water ratio, 1:40 (g/mL). Under these conditions, the experimental yield of pectic polysaccharide was 12.62%, which was well matched with the value predicted by the developed model. Furthermore, the pectic polysaccharide from okra flowers exhibited significant antioxidant activities in vitro and could be developed as a potential natural antioxidant ingredient in the food industry.
Key words:okra flowers; pectic polysaccharide; ultrasound-assisted extraction; response surface methodology; antioxidant activities
DOI:10.7506/spkx1002-6630-201702044
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)02-0283-07
引文格式:
宋思圆, 苏平, 王丽娟, 等. 响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J]. 食品科学, 2017, 38(2): 283-289. DOI:10.7506/spkx1002-6630-201702044. http://www.spkx.net.cn
SONG Siyuan, SU Ping, WANG Lijuan, et al. Optimization of ultrasonic-assisted extraction by response surface methodology and antioxidant activities of pectic polysaccharide from okra flowers[J]. Food Science, 2017, 38(2): 283-289. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201702044. http://www.spkx.net.cn
收稿日期:2016-05-12
作者简介:宋思圆(1992—),女,硕士研究生,研究方向为果蔬加工。E-mail:yss4180@163.com
*通信作者:苏平(1962—),男,副教授,博士,研究方向为果蔬加工。E-mail:623801545@qq.com