单增李斯特菌nox基因的克隆、表达以及功能
吴 嫚
1,李 森
1,陈国薇
1,罗 勤
2,刘武康
1,丁承超
1,董庆利
1,刘 箐
1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.华中师范大学生命科学学院,湖北 武汉 430079)
摘 要:以GenBank中报道的单增李斯特菌(Listeria monocytogenes,Lm)野生型菌株EGDe的nox基因(GenBank ID:986631)为研究对象,探讨在高等动植物中普遍存在的烟酰胺腺嘌呤二核苷酸磷酸氧化酶在Lm中是否也可以介导产生活性氧(reactive oxygen species,ROS)。首先通过诱导nox基因在BL21中表达产生Nox蛋白,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和Western blot鉴定该蛋白质分子质量;然后构建过表达菌株EGDe-nox,测定ROS产生情况,并使用实时荧光定量-聚合酶链式反应检测nox基因的过表达对Lm毒力基因表达的影响。结果表明,经鉴定Nox蛋白分子质量约为33 kD,过表达菌株EGDe-nox与对照组EGDe的ROS产生量相比并无多大变化,nox基因的过表达会导致与侵袭相关的基因actA、inlA和inlB以及毒力基因prfA的表达上调。由此推测,该Nox蛋白不能独立主导ROS的产量,但其过表达却可以增强毒力基因表达上调。本研究为继续探讨细菌中Nox的作用提供一定的参考依据。
关键词:单增李斯特菌;烟酰胺腺嘌呤二核苷酸磷酸氧化酶;nox基因;活性氧
单核细胞增生性李斯特菌(Listeria monocytogenes,Lm)是革兰氏阳性兼性厌氧菌,能引起多种人畜共患疾病,是公认的具有严重危害的食源性致病菌之一
[1]。Lm可穿透肠道、血脑、胎盘屏障,感染后易造成孕妇死产、流产、脑膜炎和胃肠道疾病等,所引起的死亡率高达20%~30%
[2-3],因此是胞内寄生菌的模式菌株。有研究发现,Lm在面临抗生素、温度、高盐等的胁迫后,可以迅速聚集、形成胞外多糖最后形成菌膜(biofilm,BF)来对应胁迫环境
[4],因此在食品加工过程中可黏附在食品加工设备上难以清除,造成食品加工的二次污染
[5-6]。近年有证据显示,菌膜的形成与活性氧(reactive oxygen species,ROS)有关
[7-9],但细菌中ROS的产生机制尚不完全清晰。
还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NAD(P)H oxidase),简称NAD(P)H氧化酶,是一种高等动植物细胞产生ROS的最主要酶之一。该酶由gp91phox、p22phox、p40phox、p47phox和p67phox 5 个亚基组成,gp91phox和p22phox位于质膜上,当与细胞浆中的另外几种亚基结合则可形成有活性的NAD(P)H氧化酶复合体
[10]。其中gp91phox是关键亚基,共有7 种亚型,分别由7 个基因(nox1、nox2、nox3、nox4、nox5、Duox1和Duox2)编码,统称noxs。NAD(P)H氧化酶有一个共同特点就是对多种环境胁迫敏感并可被瞬时激活,而由其介导产生的ROS则可参与多种细胞信号转导及基因表达调控
[11-13]。其中作为动植物NAD(P)H氧化酶家族中的一员,NADH氧化酶已被证明在多数微生物中存在
[14]。在动植物细胞中NAD(P)H氧化酶的组成及功能已经有很透彻的研究,但在细菌中,和高等动植物功能相近的NADH氧化酶仅有初步研究,按照其底物及所产生ROS的不同,在细菌中将该酶初步统称NOX,而由于尚不清楚该酶是由哪种基因编码,所以在细菌中统称为nox基因。Derr等
[15]在研究变异链球菌nox敲除株在酸环境和氧环境下NADH氧化酶的功能时得出结论,nox的缺失会使氧化应激反应酶超氧化物歧化酶和谷胱甘肽还原酶的活性提高,进而会导致缺失菌株很难适应氧环境;与此相反,nox的缺失会提高菌株在低pH值环境下的生长能力。Liu Juanjuan等
[16]通过加入H
2O
2和鱼藤酮抑制剂来研究ROS对莱氏野村菌微菌核产生的影响,结果发现ROS可以促进微菌核的发展,并且还进一步发现nox基因与胞内H
2O
2的产生有关。1991年Patchett等
[17]在研究单增李斯特菌(NCTC 7973)有氧代谢过程中,通过外源加入呼吸链抑制剂的方法,首次证实单增李斯特菌中存在Noxs酶活性,且其活性部位存在于细胞膜上,但是关于单增李斯特菌中的Noxs后续无更深入的报道。近年来GenBank中报道的不同血清型的nox基因序列多达8 种,但关于这些基因的功能尚无报道。为了进一步研究Lm中Noxs的功能,本研究从NCBI基因库中找到了来自Lm的疑似nox基因的序列(GenBank ID:986631,633 bp),克隆该基因并诱导产生Nox蛋白,利用Western blot来进一步鉴定该重组蛋白,并且构建nox基因过表达菌株来研究该nox基因的过表达对ROS生成的影响,以及nox的过表达对Lm中毒力基因的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
野生型单核细胞增生李斯特菌株EGDe及穿梭载体pERL3(含有红霉素抗生素标记)为华中师范大学生命科学学院罗勤老师馈赠;表达载体pET30a为南京农业大学作物遗传与种质创新国家重点实验室张红生老师馈赠。
1.1.2 培养基与试剂
脑心浸液培养基、酵母浸粉 北京陆桥技术股份有限公司;胰蛋白胨 国药集团化学试剂有限公司。
限制性内切酶XhoⅠ和SalⅠ、rTaq DNA聚合酶、dNTP mix、DNA marker、pMD19-T载体、T4 DNA连接酶TaRaKa公司;抗His-tag兔多克隆抗体、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 生工生物工程(上海)股份有限公司;山羊抗兔抗体 美国LI-COR公司;2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)美国Sigma公司。
1.2 仪器与设备
荧光实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪 美国Applied Biosystems公司;G:BOX凝胶成像系统 英国Syngene公司;琼脂糖凝胶电泳设备、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)设备 美国Bio-Rad公司;SpectraMax M2酶标仪 美国Molecular Devices公司;Odyssey双色红外激光成像系统 美国LI-COR公司。
1.3 方法
1.3.1 EGDe中nox基因的验证
表1 实验中用到的PCR引物
Table1 PCR primers used in this study
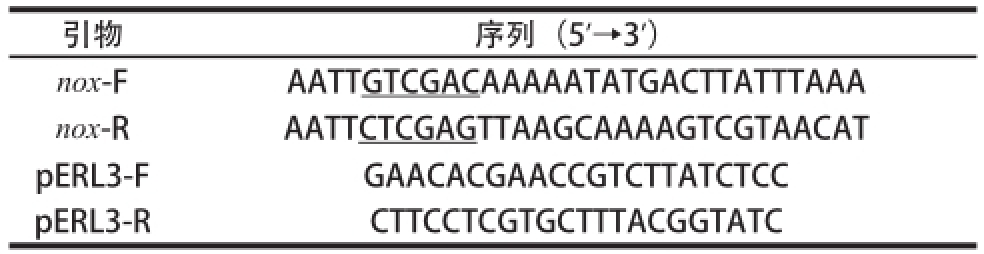
注:下划线为酶切位点。
引物序列(5’→3’)nox-F AATTCTCGAGTTAAGCAAAAGTCGTAACAT pERL3-FGAACACGAACCGTCTTATCTCC pERL3-RCTTCCTCGTGCTTTACGGTATC AATTGTCGACAAAAATATGACTTATTTAAA nox-R
用引物nox-F、nox-R(表1)对Lm野生型菌株EGDe进行nox基因片段扩增,PCR程序为:95 ℃预变性5 min,95 ℃变性45 s,56 ℃退火45 s,72 ℃延伸70 s,35 个循环;72 ℃延伸10 min。然后利用琼脂糖凝胶电泳进行检测,之后进行重组载体T-nox的构建。
1.3.2 重组质粒T-nox的构建
使用pMD-19-T载体与nox基因连接,然后转化大肠杆菌感受态细胞DH5α。挑取单菌落扩大培养后抽提质粒进行PCR(引物nox-F和nox-R)和XhoⅠ、SalⅠ双酶切鉴定。鉴定为阳性的克隆由华大科技公司测序,并将测序正确的阳性克隆命名为T-nox。
1.3.3 表达载体pET30a-nox的构建
以质粒T-nox为模板,用引物nox-F和nox-R扩增nox基因。用XhoⅠ和SalⅠ双酶切nox基因和载体pET30a,然后利用T
4DNA连接酶将目的片段与载体相连接,重组质粒pET30a-nox转化入BL21大肠杆菌感受态细胞。挑取单菌落扩大培养后抽提质粒进行PCR(引物nox-F和nox-R,PCR程序见1.3.1节)和XhoⅠ、SalⅠ双酶切鉴定。鉴定为阳性的克隆由华大科技公司测序,并将测序正确的阳性克隆分别命名为pET30a-nox。
1.3.4 重组蛋白的表达条件下
37 ℃摇床培养100 mL含有重组质粒pET30a-nox的BL21菌,OD值为0.7后,取10 mL作对照,剩下的菌液中加入IPTG诱导,终浓度为0.1 mmol/L,37 ℃、200 r/min条件下继续培养4 h后,对照组和诱导组分别使用低温高速离心机,8 000 r/min离心6 min,收集菌体沉淀。重悬于4 ℃预冷的PBS缓冲液中,混匀,8 000 r/min离心6 min洗涤3 次,收集菌体沉淀于PBS中,冰浴超声破菌,4 ℃条件下8 000×g离心20 min,收集上清液
[18]。
重组蛋白经胶浓度为15%的SDS-PAGE,考马斯亮蓝R-250染色检测蛋白表达。脱色方法:倒入脱色液,恒温振荡仪上摇晃脱色,脱色液颜色变深后,倒掉液体重新加入脱色液,摇晃,重复该步多次,直至胶的颜色接近透明,取出,观察。
1.3.5 Western blot鉴定
重组蛋白经SDS-PAGE后电转移至聚偏二氟乙烯膜(polyvinylidene f uoride,PVDF)上,用10%脱脂奶粉轻摇封闭2 h,TBST(Tris-HCl缓冲盐溶液+吐温)缓冲液冲洗3 次,加入用10 mg/mL 牛血清白蛋白(albumin from bovine serum,BSA)稀释的抗His-tag兔多克隆抗体,于4 ℃条件下轻摇过夜,TBST洗3 次,再加入用BSA稀释的山羊抗兔抗体避光轻摇1 h,避光用TBST洗3 次,扫描观察条带。
1.3.6 nox过表达菌株的构建
按照1.3.3节的方法构建重组质粒pERL3-nox,并电转入Lm野生型菌株EGDe中。通过抗性板子筛选,PCR鉴定(PCR程序见1.3.1节),将阳性克隆命名为EGDe-nox。
1.3.7 过表达菌株EGDe-nox的活性氧测定
由于该过表达菌株在培养时需加红霉素,所以本实验把空载体pERL3电转入EGDe中作对照菌并命名为EGDe-pERL3。菌株EGDe-nox和EGDe-pERL3挑单菌落过夜培养,第2天以1∶100的比例扩大培养,直至OD
600
nm达到0.3,各取1 mL菌液8 000 r/min离心6 min,去上清液,并用PBS(pH 7.4)重悬浮,加入20 μmol/L DCFH-DA混匀,吸取150 μL重悬液加入96 孔细胞培养板中,每种菌6 个平行。密封后置于37 ℃条件下避光保存,0.5 h和1 h后用酶标仪检测每孔菌液的荧光值(λ
488
nm~λ
530
nm)。DCFH-DA本身没有荧光,但是它可以穿透细胞膜,进入细胞内后被酯酶水解生成DCFH,而细胞里的ROS将无荧光的DCFH氧化成有荧光的7’-二氯荧光素(7’-dichlorofluorescein,DCF),因此检测DCF的荧光可间接反映细胞内ROS的水平
[19]。
1.3.8 EGDe过表达nox基因后对其毒力基因的影响
吸取5 mL重悬菌液,静置于37 ℃培养箱中培养3 h后添加1 mL苯酚-乙醇(1∶9,V/V)4 ℃低温混合液,冰上孵育30 min。将样品5 000×g离心5 min,收集沉淀菌体。将沉淀菌体用裂解液(包含50 μL 250 U/mL的变溶菌素和50 μL 25 mg/mL的溶菌酶)进行重悬,超声溶解30 min。采用Trizol法提取裂解液中的RNA。采用PrimeScript
TM1st Strand cDNA Synthesis Kit将RNA反转录成cDNA,以制得的cDNA作为模板进行qRT-PCR实验。
2 结果与分析
2.1 nox基因的克隆与表达
2.1.1 EGDe中nox基因的鉴定结果
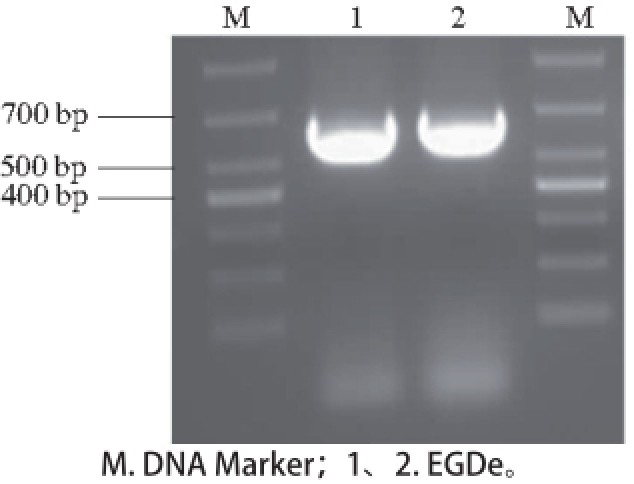
图1 PCR鉴定EGDee中的nnooxx基因结果
Fig. 1 Detection of nox from EGDe by PCR
利用引物nox-F和nox-R对EGDe进行nox基因的扩增,结果如图1所示,泳道1、2为EGDe的nox基因的扩增产物,从图中可看到在633 bp处皆有目的条带出现,说明在EGDe中有nox基因序列存在。
2.1.2 重组载体T-nox的构建结果鉴定
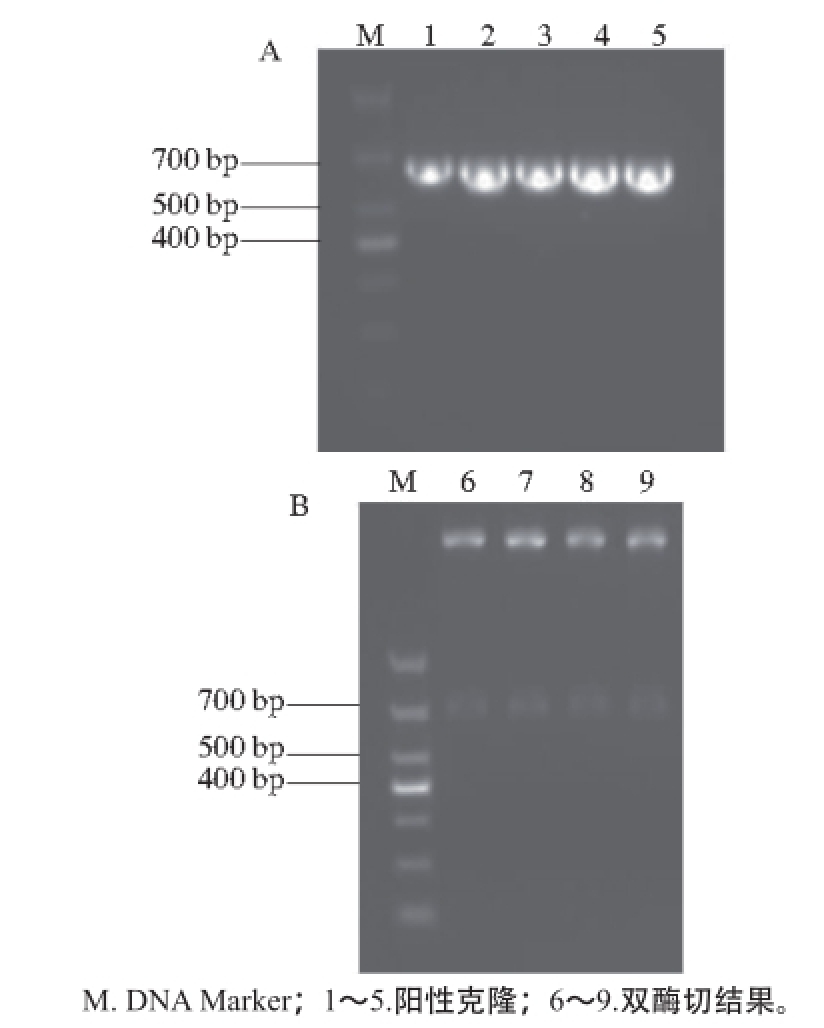
图2 重组载体T-nnooxx的PCR(A)及双酶切(B)鉴定结果
Fig. 2 Detection of recombinant vector T-nox by PCR (A) and identification by double restriction enzyme digestion (B)
利用引物nox-F和nox-R对阳性克隆进行PCR鉴定,结果如图2A所示,得到如预期大小(633 bp)的PCR产物;图2B显示的是用XhoⅠ和SalⅠ双酶切之后的结果,上面的条带是T载体,下面的条带则是嵌合的基因nox。这两种鉴定结果证明nox基因已正确和T载体连接,测序结果正确率达到99%以上,进一步证明连接正确。
2.1.3 重组载体pET30a-nox构建结果鉴定
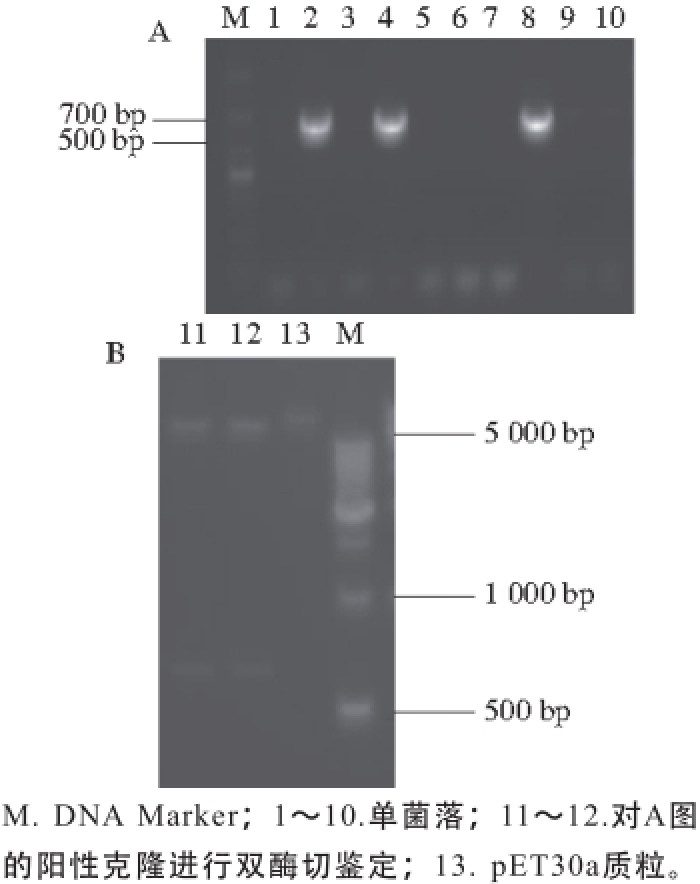
图3 重组质粒pET300aa--nnooxx的PCR(A)和双酶切(B)鉴定结果
Fig. 3 Detection of recombinant plasmid pET30a-nox by PCR (A) and identification by double restriction enzyme digestion (B)
重组质粒pET30a-nox鉴定结果如图3A、B所示,A图是用引物nox-F和nox-R对10 个单克隆进行PCR鉴定,泳道2、4、8在633 bp处出现目的条带,说明这3 个单克隆为阳性克隆;对阳性克隆进行XhoⅠ和SalⅠ双酶切鉴定,结果如图B泳道11~22,在5 000 bp上一点各有一条带为酶切后的pET30a质粒条带,原pET30a大小为5 422 bp,而在633 bp处也各有一条带,为酶切后的nox基因片段。重组质粒pET30a-nox测序结果正确率99%以上,证明该质粒构建成功。
2.1.4 pET30a-nox表达产物SDS-PAGE分析
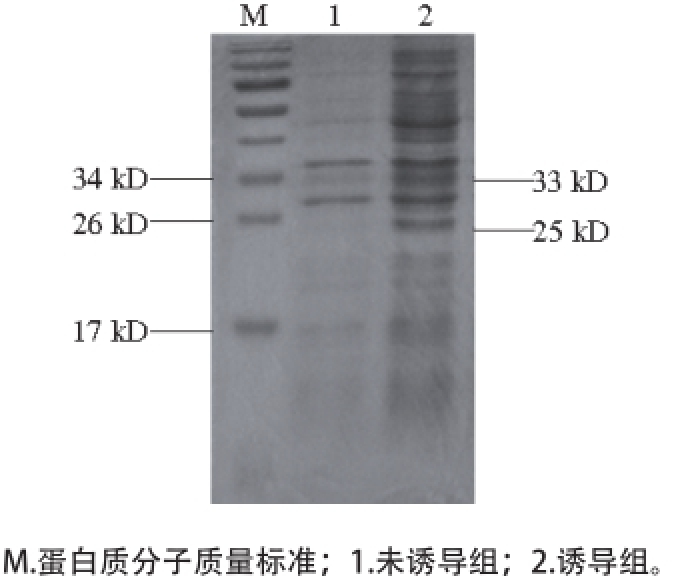
图4 pET300aa--nnooxx表达产物SDS-PAAGGEE分析
Fig. 4 SDS-PAGE analysis of expression products of pET30a-nox
将重组的pET30a-nox转入表达型大肠杆菌BL21诱导表达,经过蛋白电泳并染色脱色后的条带结果如图4所示。对诱导前泳道和诱导后泳道的对比发现,在25 kD和33 kD处的蛋白条带均在诱导后出现了表达升高。泳道1为未诱导组,在33、25 kD处出现的条带比较淡;泳道2为诱导组,和未诱导组相比,诱导后33、25 kD处的条带颜色较深,说明这两个蛋白都极有可能是实验中诱导出来的重组蛋白。
2.1.5 Western blot鉴定结果
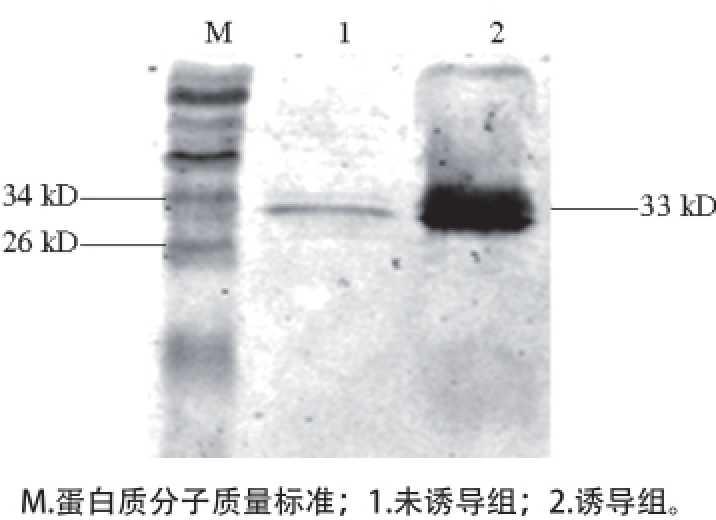
图5 pET30a--nox表达产物Western bloott分析
Fig. 5 Analysis of over-expressed products of pET30a-nox by Western blot
为了识别正确的Nox重组蛋白条带,本实验用Western blot方法进行验证。由于pET30a-nox表达产物中加有组氨酸标签(Histidine-tag,His-tag),所以使用抗His-tag抗体识别正确的Nox重组蛋白。如图5所示,泳道1是没有诱导的上清液,在33 kD处出现很细的条带,泳道2是诱导后的上清液,在33 kD处出现目标条带,颜色较深,宽度大,说明诱导后蛋白表达升高。与SDS-PAGE相比25 kD处无阳性条带,说明重组蛋白Nox的分子质量约为33 kD。根据目的基因片段大小预测的蛋白分子质量约为25 kD,后来从载体pET30a图谱上发现,除去目的基因,载体上的两段His标签之间还夹杂着S标签以及其他碱基,大约7~8 kD,所以Western blot结果图上只有约33 kD的蛋白会有阳性条带。
2.2 nox基因的功能研究
2.2.1 过表达菌株EGDe-nox结果鉴定

图6 PCR鉴定过表达菌株EGDe-nnooxx结果
Fig. 6 Detection of EGDe-nox by PCR
利用引物pERL3-F和pERL3-R对转化子进行PCR鉴定,为了得到更好的鉴定结果,对引物pERL3-F和pERL3-R进行了设计,虽然该对引物起始于质粒pERL3上,但是复制的序列恰好包含了连接的nox基因片段部分,结果如图6所示。泳道1~2为EGDe阴性对照,由于内部不含质粒,无条带出现;3~4为质粒pERL3,由于纯质粒中无nox基因连接部分,所以出现的条带仅仅是扩增质粒上的部分序列,大小约为410 bp;5~6为重组质粒pERL3-nox的阳性对照,由于扩增部分包含nox基因部分,所以条带应比3~4条带大,而又比3~4条带和nox基因片段之和(1 043 bp)小,因为双酶切部分会去掉质粒上小部分片段;而7~10为转化子,扩增得到的条带与6~7阳性对照大小一致,则说明重组质粒pERL3-nox已正确插入EGDe中。此鉴定结果证明过表达菌株EGDe-nox构建成功。
2.2.2 过表达菌株EGDe-nox活性氧测定结果
过表达菌株EGDe-nox活性氧测定结果如图7所示,图中以EGDe-pERL3为对照,将其设定为1.0。从图中可以发现,虽然EGDe-nox在0.5 h和1 h测得的活性氧比对照菌偏高,但是仅仅偏高2.6%和2.5%,并没有太大的变化。
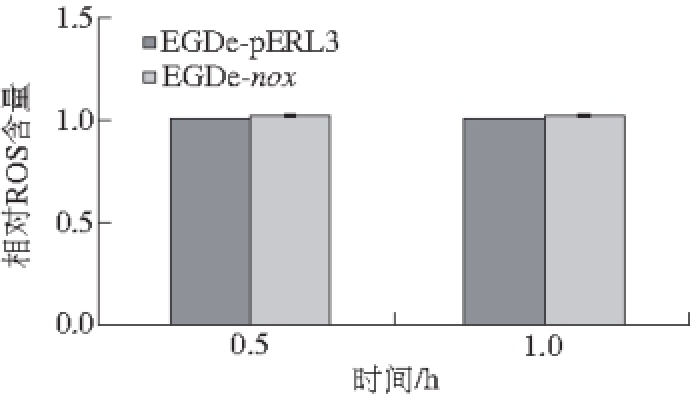
图7 7 noxnox过表达后对EGDe活性氧的影响
Fig. 7 Influence of nox over-expression on ROS production in EGDe
2.2.3 nox基因的过表达对其他毒力基因表达的影响
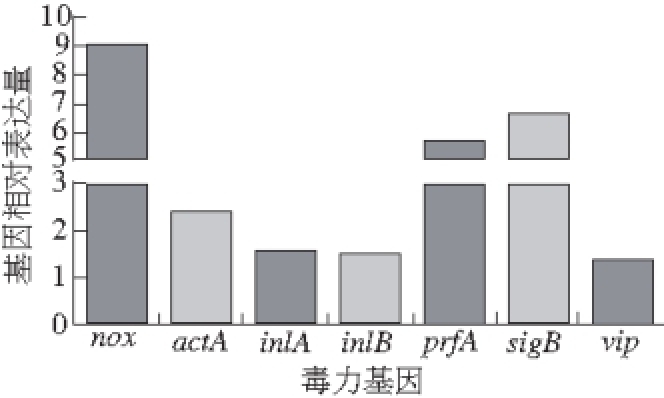
图8 8 noxnox基因的过表达对其他毒力基因表达的影响
Fig. 8 Influence of nox over-expression on the expression of other virulent genes in EGDe
实时荧光定量PCR的结果处理都是以EGDe各相应的基因为对照为1,所以图8中显示的柱状图都是EGDe-nox中的基因的相对表达量,高于1则为表达上调,低于1则为表达下调。从图中可以看出,nox基因过表达了接近9 倍,而因此受影响最大的是sigB和prfA,分别上调了6.5 倍和5.5 倍。sigB是单增李斯特菌对环境胁迫产生应答反应的主要调控因子
[20-21],而prfA是单增李斯特菌的毒力基因,由转录活化因子PrfA调控
[22]。从图中也可以发现,其余基因actA、inlA、inlB以及vip都有上调,而actA、inlA和inlB都是单增李斯特菌中和侵袭相关的基因
[23-24],因此nox基因的过表达也许会导致单增李斯特菌的侵袭能力加强。
3 讨 论
通过以上研究表明,EGDe中nox基因(GenBank ID:986631)可诱导表达33 kD蛋白质,为以后纯化蛋白从蛋白结构上分析该Nox蛋白与Noxs的关系奠定基础。而从nox的过表达对ROS产生影响的实验结果可以看出,该nox基因的过表达对Lm中ROS的产生并没有多大影响,有可能是因为本研究使用的nox基因序列(GenBank ID:986631)单独过表达不足以引起ROS的变化,也许该Nox蛋白不能独立主导ROS的产量;也有可能是由于重组质粒在菌体内表达的过程中,形成包涵体,无法继续发挥其作用。qRT-PCR的数据表明nox的过表达可以导致黏附基因inlA和inlB的表达上调,而Muchnik等
[25]也发现NADH氧化酶在肺炎链球菌(Streptococcus pneumoniae)毒性中的作用类似黏附素,说明nox基因的作用也许和Lm的毒力有关。
noxs基因在高等动植物细胞中的研究已趋于成熟,而在细菌中的研究则少之又少,目前仅在19种细菌中报道了noxs基因
[11]。根据产生ROS功能的不同,noxs基因分为3 种,第1种是需氧菌中专门产生H
2O
2的nox1
[26];第2种是厌氧菌专门产生H
2O的nox2
[27];第3种是专门产生超氧阴离子自由基(O
2
-·)的nox3
[26]。Patchett等
[17]在研究Lm(NCTC 7973)氧化代谢过程中,通过外源加入NADH方法,首次证实Lm中存在Noxs酶活性。但是已报道的19 种菌中却不包含Lm,于是本实验室对该19 种菌的noxs基因进行BLAST、DNAstar等软件比对后发现,嗜热菌(Thermus thermophilus HBB)中的nox1基因所表达的蛋白序列,在L型菌株EGDe中存在高度相似性氨基酸序列。
本实验中所使用的序列正是从EGDe基因组中找到的疑似nox1基因序列(GenBank ID:986631),但是经过同源性对比,发现其和高等动植物的nox1基因同源性较低。至2015年8月,NCBI已公布8 种来自Lm不同血清型的NADH氧化酶序列,但不知这8 种序列在Lm上产生的作用是否和高等动植物的NADH氧化酶一样,也不知不同血清型之间,nox基因有什么区别和联系。本实验使用的来自EGDe的基因序列(Gene ID:986631),但实验结果显示该基因和ROS产生没有明显相关性,而且该基因大小与NADH氧化酶的关键亚基gp91phox的编码基因的大小并不一致,也许其是编码其他亚基的基因,在ROS方面的功能并不突出,但却足以引起其他毒力基因表达水平的改变。至于剩余的7 种来自Lm不同血清型的NADH氧化酶序列及功能,尚需继续探索。
参考文献:
[1] SCHLECH W F, ACHESON D. Foodborne Listeriosis[J]. Clinical Infectious Diseases, 2000, 31(3): 770-775. DOI:10.1086/314008.
[2] ROCOURT J, JACQUET C, REILLY A. Epidemiology of human listeriosis and seafoods[J]. International Journal of Food Microbiology, 2000, 62(3): 197-209. DOI:10.1016/S0168-1605(00)00336-6.
[3] 阮明捷, 游川, 李书明, 等. 1 例单核细胞增生李斯特菌感染引起孕妇的双胎儿死亡的调查报告[J]. 慢性病学杂志, 2015(3): 353-355. DOI:10.16440/j.cnki.1674-8166.2015.03.043.
[4] 吴嫚, 李森, 吴淑燕, 等. 食源性致病菌菌膜形成影响因素研究进展[J].食品科学, 2015, 36(5): 239-243. DOI:10.7506/spkx1002-6630-201505044.
[5] O’TOOLE G, KAPLAN H B, KOLTER R. Biofilm formation as microbial development[J]. Annual Review of Microbiology, 2000, 54(1): 49-79. DOI:10.1146/annurev.micro.54.1.49.
[6] STOODLEY P, WILSON S,HALL-STOODLEY L, et al. Growth and detachment of cell clusters from mature mixed-species biof lms[J]. Applied and Environmental Microbiology, 2001, 67(12): 5608-5613. DOI:10.1128/AEM.67.12.5608-5613.2001.
[7] ROSSETI I B, ROCHA J B, COSTA M S. Diphenyl diselenide (PhSe)2 inhibits biofilm formation by Candida albicans, increasing both ROS production and membrane permeability[J]. Journal of Trace Elements in Medicine and Biology, 2015, 29: 289-295. DOI:10.1016/ j.jtemb.2014.08.001.
[8] BERLUTTI F, MOREA C, BATTISTONI A, et al. Iron availability inf uences aggregation, biof lm, adhesion and invasion of Pseudomonas aeruginosa and Burkholderia cenocepacia[J]. International Journal of Immunopathology and Pharmacology, 2005, 18(4): 661-670. DOI:10.1177/039463200501800407.
[9] KULKARNI R, ANTALA S, WANG A, et al. Cigarette smoke increases Staphylococcus aureus biofilm formation via oxidative stress[J]. Infection and Immunity, 2012, 80(11): 3804-3811. DOI:10.1128/IAI.00689-12.
[10] 冷丽丽, 唐圣松. NADPH氧化酶NOX家族的组织分布及生理功能[J]. 国际病理科学与临床杂志, 2008(1): 19-23. DOI:10.3969/ j.issn.1673-2588.2008.01.005.
[11] 陈国薇, 张超, 董庆利, 等. noxs: 病原菌菌膜形成及毒力调控的潜在靶点[J]. 食品科学, 2014, 35(3): 234-237. DOI:10.7506/spkx1002-6630-201403047.
[12] AHNMAD P, SARWAT M, SHARMA S. Reactive oxygen species, antioxidants and signaling in plants[J]. Journal of Plant Biology, 2008, 51(3): 167-173. DOI:10.1007/BF03030694.
[13] KRESLAVSKI V D, LOS D A, ALLAKHVERDIEV S I, et al. Signaling role of reactive oxygen species in plants under stress[J]. Russian Journal of Plant Physiology, 2012, 59(2): 141-154. DOI:10.1134/S1021443712020057.
[14] 刘娟娟. 莱氏野村菌微菌核形成中NADH氧化酶基因及活性氧的功能研究[D]. 重庆: 重庆大学, 2014: 6-8.
[15] DERR A M, FAUSTOFERRI R C, BETZENHAUSER M J, et al. Mutation of the NADH oxidase gene (nox) reveals an overlap of the oxygen- and acid-mediated stress responses in Streptococcus mutans[J]. Applied and Environmental Microbiology, 2012, 78(4): 1215-1227. DOI:10.1128/AEM.06890-11.
[16] LIU Juanjuan, YIN Youping, SONG Zhangyong, et al. NADH: f avin oxidoreductase/NADH oxidase and ROS regulate microsclerotium development in Nomuraea rileyi[J]. World Journal of Microbiology & Biotechnology, 2014, 30(7): 1927-1935. DOI:10.1007/s11274-014-1610-7.
[17] PATCHETT R A, KELLY A F, KROLL R G. Respiratory activity in Listeria monocytogenes[J]. FEMS Microbiology Letters, 1991, 78(1): 95-98. DOI:10.1111/j.1574-6968.1991.tb04424.x.
[18] 郝海霞. 刚地弓形虫肌动蛋白基因的克隆、表达及重组蛋白的保护性免疫[D]. 太原: 山西医科大学, 2012: 16-26. DOI:10.7666/ d.y2126846.
[19] STEPANOVIĆ S, ĆIRKOVIĆ I, RANIN L, et al. Biof lm formation by Salmonella spp. and Listeria monocytogenes on plastic surface[J]. Letters in Applied Microbiology, 2004, 38(5): 428-432. DOI:10.1111/ j.1472-765X.2004.01513.x.
[20] KAZMIERCZAK M J, MITHOE S C, BOOR K J, et al. Listeria monocytogenes sigmaB regulates stress response and virulence functions[J]. Journal of Bacteriology, 2003, 185(19): 5722-5734. DOI:10.1128/JB.185.19.5722-5734.2003.
[21] KIM H, MARQUIS H, BOOR K J. SigmaB contributes to Listeria monocytogenes invasion by controlling expression of inlA and inlB[J]. Microbiology, 2005, 151(10): 3215-3222. DOI:10.1099/mic.0.28070-0.
[22] DRAMSI S, KOCKS C, FORESTIER C, et al. Internalin-mediated invasion of epithelial cells by Listeria monocytogenes is regulated by the bacterial growth state, temperature and the pleiotropic activator prfA[J]. Molecular Microbiology, 1993, 9(5): 931-941. DOI:10.1111/ j.1365-2958.1993.tb01223.x.
[23] GAILLARD J L, BERCHE P, FREHEL C, et al. Entry of L. monocytogenes into cells is mediated by internalin, a repeat protein reminiscent of surface antigens from gram-positive cocci[J]. Cell, 1991, 65(7): 1127-1141. DOI:10.1016/0092-8674(91)90009-N.
[24] DRAMSI S, BISWAS I, MAGUIN E, et al. Entry of Listeria monocytogenes into hepatocytes requires expression of InlB, a surface protein of the internalin multigene family[J]. Molecular Microbiology, 1995, 16(2): 251-261. DOI:10.1111/j.1365-2958.1995.tb02297.x.
[25] MUCHNIK L, ADAWI A, OHAYON A, et al. NADH oxidase functions as an adhesin in Streptococcus pneumoniae and elicits a protective immune response in mice[J]. PLoS ONE, 2013, 8(6): e61128. DOI:10.1371/annotation/7fbc524a-4035-401e-8cc7-93393afc35fd.
[26] HIGUCHI M, YAMAMOTO Y, KAMIO Y. Molecular biology of oxygen tolerance in lactic acid bacteria: functions of NADH oxidases and Dpr in oxidative stress[J]. Journal of Bioscience and Bioengineering, 2000, 90(5): 484-493. DOI:10.1016/S1389-1723(01)80028-1.
[27] GAO Hui, TIWARI M K, KANG Yunchan, et al. Characterization of H
2O-forming NADH oxidase from Streptococcus pyogenes and its application in L-rare sugar production[J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22(5): 1931-1935. DOI:10.1016/ j.bmcl.2012.01.049.
Gene Cloning, Expression and Functional Charaterization of NAD(P)H Oxidases Gene (nox) from Listeria monoeytogenes
WU Man
1, LI Sen
1, CHEN Guowei
1, LUO Qin
2, LIU Wukang
1, DING Chengchao
1, DONG Qingli
1, LIU Qing
1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. College of Life Sciences, Central China Normal University, Wuhan 430079, China)
Abstract:Nicotinamide adenine dinucleotide phosphate oxidases (Nox) is ubiquitous in higher animals and plants, and it is responsible for generating reactive oxygen species (ROS). The aim of this work was to explore whether the NOX mediates the generation of ROS in Listeria monocytogenes (Lm). The nox gene from the wild-type Listeria monocytogenes EGDe (GenBank ID: 986631) was tested. The gene was induced to express Nox in Escherichia coli BL21 and the molecular weight of the expressed enzyme was measured by using sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) and Western blot. Then the over-expressed strain EGDe-nox was built to detect ROS production and examine the influence of nox gene over-expression on the expression of virulence genes by using quantitative real-time polymerase chain reaction (qRT-qPCR). The results showed that the molecular weight of the recombinant Nox was about 33 kD. Compared with EGDe, the ROS production of EGDe-nox was not changed significantly. The over-expression of nox resulted in up-regulated expression of the invasion-related genes actA, inlA and inlB and the virulence gene prfA. These results suggest that the Nox is unable to dominate ROS production independently but its over-expression can up-regulate the expression of virulence genes.
Key words:Listeria monocytogenes; NADH oxidase; nox; reactive oxygen species (ROS)
DOI:10.7506/spkx1002-6630-201702008
中图分类号:Q935
文献标志码:A
文章编号:1002-6630(2017)02-0046-06
引文格式:
吴嫚, 李森, 陈国薇, 等. 单增李斯特菌nox基因的克隆、表达以及功能[J]. 食品科学, 2017, 38(2): 46-51. DOI:10.7506/ spkx1002-6630-201702008. http://www.spkx.net.cn
WU Man, LI Sen, CHEN Guowei, et al. Gene cloning, expression and functional charaterization of NAD(P)H oxidases gene (nox) from Listeria monoeytogenes[J]. Food Science, 2017, 38(2): 46-51. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702008. http://www.spkx.net.cn
收稿日期:2016-03-18
基金项目:国家自然科学基金面上项目(31371776)
作者简介:吴嫚(1990—),女,硕士研究生,研究方向为食源性致病菌致病机理。E-mail:mandy_wu1247@163.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理、疫苗及快速检测技术。E-mail:liuq@usst.edu.cn








