刘丽莉,李 丹,尹光俊,梁严予,康怀彬
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
摘 要:前期筛选蜡样芽孢杆菌(Bacillus cereus MBL13-U),结合嗜热链球菌(Streptococcus thermophilus,St)、植物乳杆菌(Lactobacillus plantarum,Lp)混合发酵牛骨粉制备血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽,对其发酵动力学进行研究,采用Logistic和Luedeking-Piret等方程对发酵过程进行非线性拟合,建立发酵过程中菌体生长、产物生成、基质消耗动力学模型,拟合度均高于0.97。通过扫描电镜、紫外扫描、差示扫描量热仪对ACE抑制肽进行结构表征。结果表明,由于牛骨ACE抑制肽具有良好的吸湿性,其在扫描电镜下表面出现明显的沟壑痕迹;在222 nm波长处出现强吸收峰,符合胶原多肽的特征吸收;与牛骨胶原蛋白相比,其热变性温度升高,热稳定性较强。同时对其特性分析表明,牛骨ACE抑制肽具有较好的溶解性、较强的耐酸碱性,在0.9 mol/L以内的NaCl浓度条件下耐盐性较强,胃肠道酶对牛骨ACE抑制肽的影响较小。
关键词:蜡样芽孢杆菌;牛骨血管紧张素转化酶抑制肽;发酵动力学;结构表征;特性
高血压是一种慢性疾病,是引发心脑血管疾病的重要危险因素之一,据估计,在2025年,全球超过1.5亿 人将被诊断出患有高血压 [1],高血压的预防和治疗已经成为国内外研究学者共同关注的问题。血管紧张素转化酶(angiotensin converting enzyme,ACE)是一种多功能性的酶,它是肾素-血管紧张素系统和激肽释放酶-激肽系统的主要调节器,在血压的调节方面起着重要的作用 [2-3]。ACE抑制剂是治疗高血压和心血管疾病使用较多的药物,但多数为合成的ACE抑制剂,一些降压药如卡托普利、赖诺普利,会产生咳嗽、皮疹、肾功能损害和血管神经性水肿等副作用 [4],因此研究者在寻求一些来源于天然产物的安全可靠的ACE抑制剂。
资料表明,胶原蛋白经水解后产生的胶原多肽对血管紧张素转化酶起到了有效的抑制作用,在新的治疗和功能性食品领域具有潜在的发展 [5]。目前从食品中制备ACE抑制肽的方法主要为酶解法 [6]。国内外研究学者已经从多种蛋白水解物中成功获得了ACE抑制肽 [7-9],如Mirzaei等 [7]将胰蛋白酶作用在酵母蛋白上,将水解产物经过超滤和色谱分离制备ACE抑制肽并研究其稳定性。近年来随着畜产品需求的增加,骨骼的开发利用受到了极大的关注,骨骼中含有丰富的胶原蛋白,但是由于其特殊的三股螺旋结构很难被机体消化吸收,造成了极大的资源浪费。一些学者对酶解骨骼进行了相关研究,如舒一梅等 [10]将猪骨进行酶解后分离得到的ACE抑制肽具有较好的耐热、耐酸碱和耐盐性,在酸性条件下具有良好的溶解性。Pagán等 [11]对猪骨的酶解动力学及对胶原多肽的分子质量进行分析,探究其降解机理。Zhang Yuhao等 [12]使用6 种不同的蛋白酶作用于牛骨制备ACE抑制肽,并对其氨基酸序列进行分析表明,使用适当的酶处理可以有效提高ACE抑制肽的含量。也有学者将微生物发酵与骨骼相结合进行研究,如宗红等 [13]利用枯草芽孢杆菌和植物乳杆菌(Lactobacillus plantarum,Lp)对猪骨泥进行联合发酵,目的在于提高骨泥中易于吸收且具有功能的小分子蛋白、多肽及可溶性钙的含量,强化发酵骨泥的功能性。
目前发酵骨骼以Lp为主,本课题组前期成功从自然界筛选出蜡样芽孢杆菌Bacillus cereus MBL13-U,并研究了其产酶条件及降解牛骨胶原蛋白的机理 [14-16],发现牛骨是ACE抑制肽可靠无副作用的来源。在此基础上,本研究采用蜡样芽孢杆菌Bacillus cereus MBL13-U,结合嗜热链球菌(Streptococcus thermophilus,St)、Lp混合发酵牛骨制备ACE抑制肽,构建发酵动力学模型,对制备的ACE抑制肽进行结构表征和特性分析,合理利用废弃牛骨资源,增加其附加值,为今后工业化的生产提供一定的参考依据。
1.1 材料与试剂
新鲜牛腿骨 洛阳市老城区农贸市场;蜡样芽孢杆菌Bacillus cereus MBL13-U为本课题组筛选诱变所得未产生肠毒素的菌种;St、Lp为市售光明畅优乳中分离所得。
马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu,HHL)、胃蛋白酶、胰蛋白酶 美国Sigma化学公司;双缩脲、盐酸、氢氧化钠 天津德恩化学试剂有限公司;其他化学试剂均为分析纯。
发酵培养基(100 mL):菌种接种量3%、菌种配比(Bacillus cereus MBL13-U/St/Lp体积比)1∶1∶1、蔗糖2.5 g、骨粉添加量3.5 g。
1.2 仪器与设备
Scout SE电子天平 奥豪斯仪器(常州)有限公司;BBS-V800洁净工作台 济南鑫贝西生物技术有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;高速冷冻离心机 湖南湘仪仪器开发有限公司;紫外-可见光分光光度计 北京普析通用仪器有限责任公司;JMSC300超滤杯、PES-300聚醚砜超滤膜 上海摩速科学器材有限公司;CX21光学显微镜 日本Olympus公司;SM-6480扫描式电子显微镜 日本电子公司;DSC204F1差示扫描量热仪 瑞士Mettler-Toledo公司。
1.3 方法
1.3.1 牛骨ACE抑制肽的制备
1.3.1.1 牛骨ACE抑制肽制备的工艺流程
新鲜牛骨→除杂→切块(5~6 cm)→高压蒸煮(121 ℃,0.1 kPa)→脱脂、脱钙→水洗→烘干→粉碎(40 目筛)→牛骨粉→发酵培养基→灭菌→接种→发酵→紫外杀菌→离心取上清液→超滤分离纯化→真空冷冻干燥→牛骨ACE抑制肽
1.3.1.2 牛骨ACE抑制肽的制备工艺
按本课题组前期实验确立的最佳发酵条件进行 [14]。将牛骨粉在最佳发酵条件为菌种接种量3%、菌种Bacillus cereus MBL13-U/St/Lp体积比1∶1∶1(菌体的细胞浓度均为10 8CFU/mL)、发酵温度37 ℃、发酵时间42 h、初始pH 7.0条件下进行发酵,紫外杀菌(功率25 W,高度60 cm,发酵液厚度1 cm,时间10 min)后取上清液,8 000 r/min、4 ℃离心10 min除去菌体和其他大分子物质,收集上清液调节pH值至7.0,依次过截留分子质量分别为10、5、3 kD的超滤膜得到牛骨ACE抑制肽,真空冷冻干燥后收集备用。
1.3.2 发酵动力学模型的建立
最佳条件下培养的发酵液在0~48 h的连续发酵时间内每隔4 h取样,测定不同时间条件下菌液浓度、牛骨粉含量和ACE抑制肽生成量的变化,选取合适的方程式进行拟合,构建最佳发酵动力学模型,并不定期对混合菌种进行显微镜观察,以确保其发酵过程的稳定性。
1.3.3 牛骨ACE抑制肽的结构表征
1.3.3.1 ACE抑制肽的扫描电镜分析
取少量牛骨ACE抑制肽样品均匀涂抹于扫描电镜样盘双面胶上,进行喷金镀膜处理后置于扫描电镜抽真空,调整电压,放大不同倍数获取清晰扫描图像。
1.3.3.2 ACE抑制肽的紫外光谱分析
室温条件下,取0.5 g分离干燥的牛骨ACE抑制肽溶于30 mL去离子水,样品于紫外-可见光扫描仪上进行200~450 nm波长范围的扫描 [17]。
1.3.3.3 ACE抑制肽的热变性温度分析
采用差示扫描量热法,称取0.02~0.05 g牛骨ACE抑制肽样品置于洁净坩埚中,加盖密封,以空白坩埚作为对照组,放入差示扫描量热仪内,在-10~150 ℃范围内以10 ℃/min升温速率进行扫描。
1.3.4 ACE抑制肽的特性分析
1.3.4.1 ACE抑制肽的溶解性
取0.1 g冷冻干燥的牛骨ACE抑制肽溶于20 mL去离子水,用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液分别调pH值至2.0~10.0,室温条件下搅拌1 h,8 000 r/min、 4 ℃离心10 min,分别取上清液测其蛋白质含量,以考察牛骨ACE抑制肽的溶解性。ACE抑制肽溶解度为清液中蛋白质质量与样品质量比值 [10]。
1.3.4.2 ACE抑制肽的pH值稳定性
取0.1 g冷冻干燥的牛骨ACE抑制肽溶于20 mL去离子水,用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液分别调pH值至2.0~10.0,室温条件下静置1 h,分别测其ACE抑制率 [18]。
1.3.4.3 ACE抑制肽的盐稳定性
取0.1 g冷冻干燥的牛骨ACE抑制肽分别溶于0.1、0.3、0.5、0.7、0.9、1.1、1.3、1.5、1.7 mol/L NaCl溶液,室温条件下静置1 h,分别测其ACE抑制率。
1.3.4.4 ACE抑制肽的体外消化模拟
用邓惠玲 [19]的方法略加修改。将提纯干燥的牛骨ACE抑制肽配成一定质量浓度的溶液,用1 mol/L HCl溶液调pH 2.0,加入2%的胃蛋白酶,37 ℃条件下水解2 h,沸水浴10 min后终止反应,将其pH值用1 mol/L NaOH溶液调至中性,先取部分水解液在8 000 r/min、4 ℃条件下离心10 min,取上清液,测其ACE抑制率;再取部分水解液加入2%的胰蛋白酶,37 ℃水解2 h,沸水浴10 min后终止反应,在8 000 r/min、4 ℃条件下离心10 min,取上清液,测其ACE抑制率。
1.3.5 指标测定
菌液浓度:将混合菌种按3%的接种量接到发酵培养基中连续发酵48 h,每4 h取发酵液,静置20 min取上清液于分光光度计600 nm波长处测定吸光度(A 600 nm),所测数据即可描绘菌体的生长情况。
牛骨粉含量:取发酵液于干燥好的离心管中,5 000 r/min、4 ℃离心20 min,收集骨粉,于恒温干燥箱中105 ℃干燥至恒质量,称其质量,单位g/L。
牛骨ACE抑制肽含量:采用鲁伟等 [20]的方法进行测定。
ACE抑制率:在庄溪 [21]所采用的方法上略加修改:取50 μL 5.0 mmol/L HHL与10 μL发酵上清液混匀,37 ℃水浴中预热5 min,加入10 μL 0.1 U/mL ACE,37 ℃水浴中反应1 h,加入75 μL 1.0 mol/L HCl溶液终止反应。加入0.6 mL乙酸乙酯充分混匀后4 000 r/min、4 ℃离心10 min。取l mL乙酸乙酯层于试管中放入烘箱,110 ℃挥发60 min后用4 mL蒸馏水溶解,充分混合30 s,在波长228 nm处测定其吸光度。ACE抑制率计算如式(1)所示:
式中:A为加入ACE抑制肽的样品吸光度;B为不加ACE抑制肽的样品吸光度;C为不加ACE的样品吸光度。
1.4 数据处理
采用Excel 2007软件对数据进行统计分析,采用Origin 8.5软件对数据进行非线性拟合。
2.1 牛骨ACE抑制肽的发酵动力学模型的构建
2.1.1 微生物发酵过程中代谢变化

图1 混合菌种发酵过程代谢曲线图
Fig. 1 Metabolic curves during mixed culture fermentation
由图1可知,在发酵前12 h内,牛骨粉消耗量很小,相应的混合菌种生长量及牛骨ACE抑制肽生成量均不明显,此阶段处于混合菌种生长的延滞期。在12~32 h阶段,牛骨粉含量从31.97 g/L显著降到17.95 g/L,牛骨ACE抑制肽的生成量也显著增加,混合菌种快速生长,处于生长对数期。当超过32 h后,菌种的生长已经停滞处于稳定期,此时牛骨ACE抑制肽的产量依然增加,但增幅缓慢,因此,牛骨ACE抑制肽的产量与菌体的生长呈部分偶联关系。同时不定期对混合菌种进行显微观察,总体表明发酵过程具有稳定性。
2.1.2 菌体生长动力学模型
由图1可知,混合菌种的生长呈典型的S型走势,因此选择用由Verhulst提出的Logistic方程 [22]建立模型描绘混合菌种的生长情况,Logistic方程的微分形式为:
式中:X为菌体浓度(A 600 nm);X m为最大菌体浓度(A 600 nm);μ为混合菌体的最大比生长速率/h -1;t为时间/h。
对式(2)进行积分,得到:
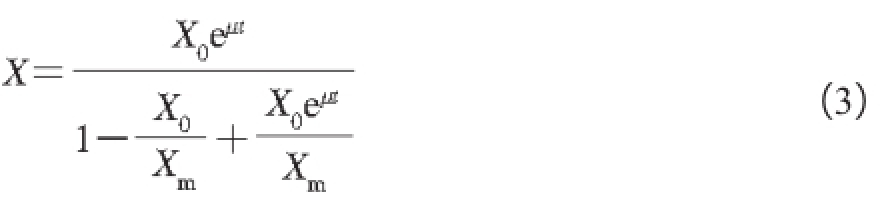
式中:X 0为初始菌体浓度(A 600 nm)。
用Origin 8.5软件按式(3)对菌种浓度进行拟合,结果见图2和表1。
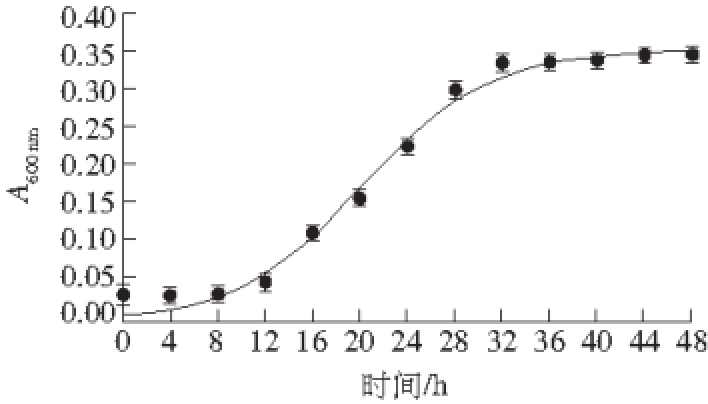
图2 混合菌种生长拟合曲线
Fig. 2 Growth curve of mixed strains
表1 混合菌体生长动力学模型参数
Table1 Parameters estimation for the kinetic model for the growth of mixed straaiinnss

模型参数拟合值标准误差R 2X 00.008 20.002 40.991 0 X m0.353 30.007 2 μ 0.185 10.015 9
得到的拟合方程为:
由图2及表1可知,拟合值与实验值基本相符,拟合的R 2值为0.991 0,拟合情况良好,说明Logistic方程能较好地模拟混合菌种发酵牛骨粉过程中菌体的生长过程。在发酵初期拟合产生误差,其原因在于Logistic方程主要是反应菌种浓度的增加和营养物质的减少对菌种自身生长抑制的影响,在混合菌种生长的延滞期,由于浓度较低,影响效果不明显,因此造成发酵初期拟合效果相对不理想。
2.1.3 产物生成动力学模型
微生物在发酵的动态过程中细胞内的生物合成途径十分复杂,且其代谢调节机制特点各有不同,根据产物生成速率与细胞生长速率之间的关系,将产物的形成与微生物细胞生长关系的动力学模型主要分为以下3 类:Ⅰ生长偶联型;Ⅱ部分生长偶联型或称混合型;Ⅲ非生长偶联型 [23]。因此本实验混合菌种发酵的产物牛骨ACE抑制肽生成模型采用Luedeking-Piret方程 [24],表达式为:
式中:P为发酵产物ACE抑制肽的生成量/(mg/mL);a为与生长偶联的产物形成系数;b为非生长偶联的相关系数。
将式(2)、(3)、(5)积分得:
将式(4)代入式(6)得到:
式中:P 0为初始牛骨ACE抑制肽含量/(mg/mL)。
采用Origin 8.5软件按式(7)对实验测得的发酵产物牛骨ACE抑制肽的生成量数据进行拟合,得到图3和表2。

图3 产物牛骨ACE抑制肽生成的拟合曲线
Fig. 3 Time course for the formation of bovine bone ACE inhibitory peptides
表2 产物牛骨ACE抑制肽生成动力学模型参数
Table 2 Parameters estimation for the kinetic model for the formation of bovine bone ACE inhibitory peptides
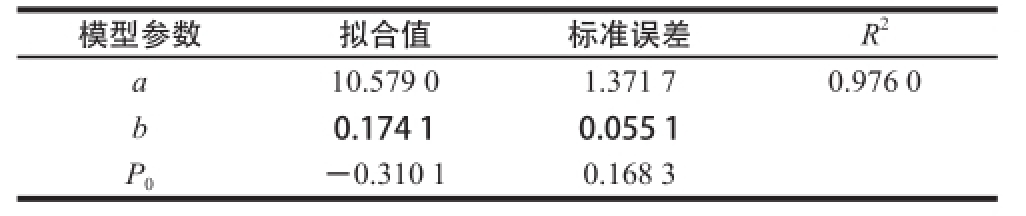
模型参数拟合值标准误差R 2a 10.579 01.371 70.976 0 b 0.174 10.055 1 P 0-0.310 10.168 3
得到拟合后的方程为:
由图3和表2可知,利用Luedeking-Piret方程对实验测得混合菌种发酵过程产物牛骨ACE抑制肽的生成情况进行拟合,拟合度R 2为0.976 0,效果较理想。在发酵后期,菌种自身质量浓度的增大和底物牛骨粉的消耗导致拟合值和实测值出现偏差,说明在发酵后期适当提高底物浓度有利于提高牛骨ACE抑制肽的产量。
2.1.4 底物消耗动力学模型
发酵过程中,认为底物骨粉的消耗主要用于发酵菌体的生长消耗和产物牛骨ACE抑制肽的合成消耗两部分,通常采用以下方程 [25]:
式中:S为骨粉含量/(g/L);Y X/S为菌体细胞得率系数;Y P/S为产物得率系数;m为维持系数。
将式(2)、(3)、(5)代入式(9)得:
令:

将式(11)、(12)代入式(10)得到:
式中:S 0为初始骨粉含量/(g/L)。
将式(4)代入式(13)得到:
采用Origin 8.5软件按式(3)、(13)对测得的骨粉含量数据进行拟合,得到图4和表3。

图4 底物牛骨粉消耗的拟合曲线
Fig. 4 Time course for substrate consumption
表3 底物牛骨粉消耗动力学模型参数
Table3 Parameter estimation for the kinetic model for substrate consumption
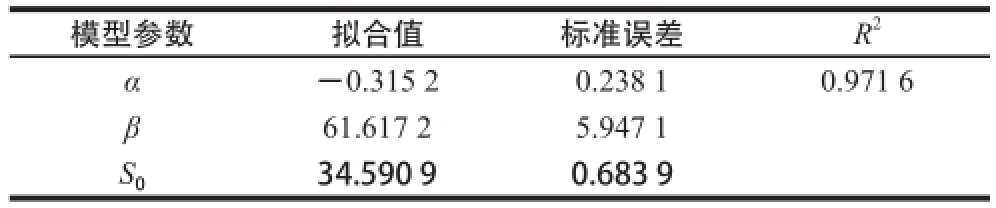
模型参数拟合值标准误差R 2α-0.315 20.238 10.971 6 β 61.617 25.947 1 S 034.590 90.683 9
得到拟合后的方程为:
由图4可看出,发酵过程中,牛骨粉的消耗走势呈现反S型,在菌种处于对数期时消耗量较大,而在菌种分别处于延滞期和稳定期时,消耗量均较平缓。经软件拟合后的曲线与实验测得数据较接近,且拟合决定系数R 2为0.971 6,拟合情况较理想。
2.2 牛骨ACE抑制肽的结构表征
2.2.1 牛骨ACE抑制肽的扫描电镜及紫外光谱分析

图5 牛骨ACE抑制肽的扫描电镜图(×25 000000)
Fig. 5 SEM image of bovine bone ACE inhibitory peptides (× 25 000)

图6 牛骨ACE抑制肽紫外扫描图
Fig. 6 UV absorption spectrum of bovine bone ACE inhibitory peptides
如图5所示,牛骨ACE抑制肽表面出现了明显的沟壑痕迹,可能是由于牛骨ACE抑制肽的亲水区具有较强的吸湿性,接触空气后极易吸水,在扫描过程中的真空环境下失水所造成的。
在波长200~230 nm之间,胶原多肽的羰基及肽键有特征吸收峰 [26]。牛骨ACE抑制肽的紫外扫描结果如图6所示,牛骨ACE抑制肽在波长214~222 nm之间出现强吸收峰,在280 nm处无吸收峰出现,这是因为牛骨胶原蛋白水解后得到的ACE抑制肽链中含有的CO—NH 2、C—O、—COOH都是生色基团,能够在220 nm波长左右产生光吸收 [27]。因此所制备的ACE抑制肽符合胶原多肽的特性吸收。
2.2.2 牛骨ACE抑制肽的热变性温度分析

图7 牛骨ACE抑制肽和牛骨胶原蛋白的差示扫描量热曲线
Fig. 7 DSC curves of bovine bone ACE inhibitory peptides and bovine bone collagen
胶原的热稳定性通常以其热变性温度来表示,牛骨粉蛋白含量中以Ⅰ型胶原蛋白为主,分别对牛骨胶原蛋白和牛骨ACE抑制肽进行热变性温度测定,结果如图7所示,牛骨胶原蛋白的热变性温度为69.93 ℃,此时,胶原特有的三螺旋结构被破坏,转变为无规则的卷曲状,导致胶原丧失部分生物性质,即为胶原的热变性过程。而牛骨ACE抑制肽的热变性温度为87.65 ℃,高于牛骨胶原蛋白,可知胶原蛋白经发酵降解为多肽,随着其分子质量的降低,热变性温度升高,相较于胶原蛋白,牛骨ACE抑制肽的热稳定更强。
2.3 牛骨ACE抑制肽的特性分析
2.3.1 牛骨ACE抑制肽的溶解性和pH值稳定性

图8 ACE抑制肽的溶解性曲线及pH值对ACE抑制肽活性的影响
Fig. 8 Solubility curve and influence of pH on the activity of ACE inhibitory peptides
针对不同pH值情况下ACE抑制肽的溶解性及ACE抑制率的测定结果如图8所示,改变多肽液的pH值,其溶解度始终保持在88 g/100 g左右,变化幅度并不明显,并且牛骨ACE抑制肽的抑制率始终维持在66.3%~67.2%范围内,并不随pH值的变化而变化,说明牛骨ACE抑制肽具有较好的溶解性,且受pH值的影响不显著。与王艳 [28]研究的鱼皮胶原蛋白的溶解性相比,牛骨ACE抑制肽的溶解性较强且对酸碱均较稳定,可能由于胶原蛋白经微生物发酵为短肽后,分子有卷曲状变为伸展状,离子性增强,从而大大提高了其溶解性,并在酸碱情况下具有较好的稳定性。
2.3.2 牛骨ACE抑制肽的盐稳定性
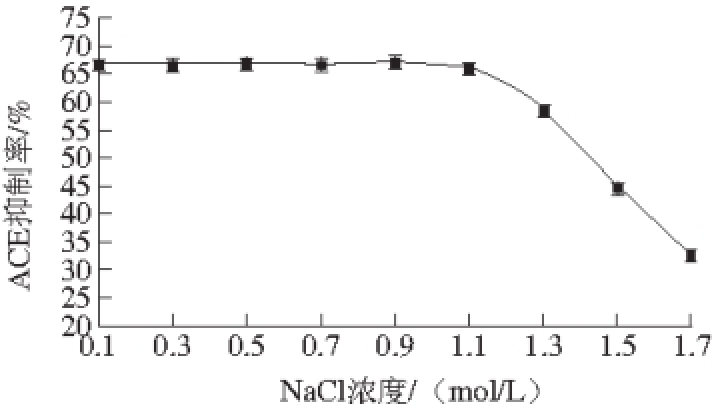
图9 NaCl浓度对ACE抑制肽活性的影响
Fig. 9 Effect of NaCl concentration on the activity of ACE inhibitory peptides
如图9所示,当NaCl溶液浓度在0.1~0.9 mol/L时,牛骨ACE抑制肽的活性波动范围比较小,几乎不受NaCl浓度的影响,当NaCl溶液浓度超过0.9 mol/L时,牛骨ACE抑制肽的活性随NaCl溶液浓度的增加而显著降低。因此,在0.9 mol/L以内的NaCl浓度条件下牛骨ACE抑制肽具有较强的耐盐性。
2.3.3 牛骨ACE抑制肽对胃肠道蛋白酶耐受性
食品来源的ACE抑制剂之所以具有有效降压的作用,是因为它不能被消化道内的酶系降解,可以到达抑制ACE的作用位点。如果其被消化道内的酶系降解,分解成不具有抑制作用的片段,即使在体外具有ACE抑制活性也是毫无意义的,因此研究其抗消化道酶解能力至关重要 [29]。
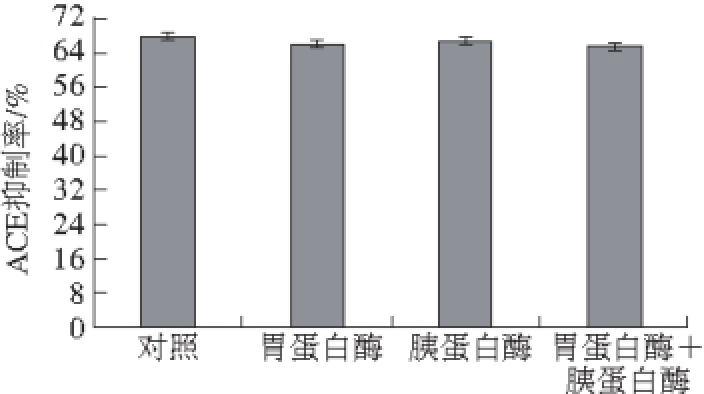
图10 胃肠道酶对牛骨ACE抑制肽的影响
Fig. 10 Effect of gastrointestinal proteases on bovine bone ACE inhibitory peptides
牛骨ACE抑制肽在模拟胃肠道环境下,经胃蛋白酶和胰蛋白酶体外消化后测其ACE抑制率变化情况如图10所示,牛骨ACE抑制肽在分别经胃蛋白酶和胰蛋白酶及两种酶同时消化后ACE抑制率变化不显著,说明该肽对胃肠道环境中胃蛋白酶及胰蛋白酶具有一定的抗性,在体内可通过胃肠道吸收而进入血液,从而发挥降血压作用。
采用Logistic和Luedeking-Piret等方程对混合菌种发酵牛骨粉的过程进行非线性拟合,建立发酵过程中菌体生长、牛骨ACE抑制肽生成、牛骨粉消耗动力学模型。实验数据与预测值拟合良好,其拟合度分别为0.991 0、0.976 0、0.971 6,证明本实验构建的发酵动力学模型能较好模拟混合菌种对牛骨粉的发酵过程。模型的建立可以更直观了解在发酵过程中菌体生长、牛骨ACE抑制肽的生成、牛骨粉消耗的情况,为后期工业化生产提供理论参考依据。
对牛骨ACE抑制肽的结构及特性分析表明:牛骨ACE抑制肽具有较好的吸湿性,在扫描电镜下其表面呈现出沟壑痕迹,与其具有较强的吸湿性有关;牛骨ACE抑制肽的最大峰值在波长222 nm左右,符合胶原多肽的特征吸收;牛骨ACE抑制肽的热变性温度为87.65 ℃,与牛骨胶原蛋白相比,其热变性温度升高,具有较强的热稳定性;同时牛骨ACE抑制肽具有较好且稳定的溶解性和较强的耐酸碱性;在0.9 mol/L以内的NaCl浓度条件下具有较强的耐盐性;耐受胃肠道蛋白酶消化作用,为其在食品及药品工业领域的开发使用提供理论依据。
参考文献:
[1] SHIH Y H, TSAI S F, HUANG S H, et al. Hypertension impairs hippocampus-related adult neurogenesis, CA1 neuron dendritic arborization and long-term memory[J]. Neuroscience, 2016, 322: 346-357. DOI:10.1016/j.neuroscience.2016.02.045.
[2] YAMAMOTO N. Antihypertensive peptides derived from food proteins[J]. Annual Review of Food Science and Technology, 2015, 6(2): 235-262. DOI:10.1146/annurev-food-022814-015520.
[3] NORRIS R, O’KEEFFE M B, POYARKOV A, et al. Peptide
identification and angiotensin converting enzyme (ACE) inhibitory activity in prolyl endoproteinase digests of bovine αs-casein[J]. Food Chemistry, 2015, 188: 210-217. DOI:10.1016/j.foodchem.2015.04.130.
[4] ELAVARASAN K, SHAMASUNDAR B A, FARAHA B, et al. Angiotensin I-converting enzyme (ACE) inhibitory activity and structural properties of oven- and freeze-dried protein hydrolysate from fresh water f sh (Cirrhinus mrigala)[J]. Food Chemistry, 2016, 206: 210-216. DOI:10.1016/j.foodchem.2016.03.047.
[5] FANG H, LUO M, SHENG Y, et al. The antihypertensive effect of peptides: a novel alternative to drugs?[J]. Peptides, 2008, 29(6): 1062-1071. DOI:10.1016/j.peptides.2008.02.005.
[6] ECKERT E, ZAMBROWICA A, POKORA M, et al. Egg-yolk protein by-product as a source of ACE-inhibitory peptides obtained with using unconventional proteinase from Asian pumpkin (Cucurbita f cifolia)[J]. Journal of Proteomics, 2014, 110: 107-116. DOI:10.1016/ j.jprot.2014.08.003.
[7] MIRZAEI M, MIRDAMADI S, EHSANI M R, et al. Purification and identification of antioxidant and ACE-inhibitory peptide from Saccharomyces cerevisiae protein hydrolysate[J]. Journal of Functional Foods, 2015, 19: 259-268. DOI:10.1016/j.jff.2015.09.031.
[8] YU W, GAO J, XUE Z, et al. Radical-scavenging activity, ACE-inhibiting capability and identification of rapeseed albumin hydrolysate[J]. Food Science and Human Wellness, 2013, 2(2): 93-98. DOI:10.1016/j.fshw.2013.05.002.
[9] JIA J, WU Q, YAN H, et al. Purif cation and molecular docking study of a novel angiotensin-І converting enzyme (ACE) inhibitory peptide from alcalase hydrolysate of ultrasonic-pretreated silkworm pupa (Bombyx mori) protein[J]. Process Biochemistry, 2015, 50(5): 876-883. DOI:10.1016/j.procbio.2014.12.030.
[10] 舒一梅, 李诚, 付刚, 等. 凝胶层析法分离猪股骨降血压肽及其体外稳定性[J]. 食品科学, 2014, 35(24): 100-104. DOI:10.7506/spkx1002-6630-201424019.
[11] PAGÁN J, IBARZ A, FALGUERA V, et al. Enzymatic hydrolysis kinetics and nitrogen recovery in the protein hydrolysate production from pig bones[J]. Journal of Food Engineering, 2013, 119(3): 655-659. DOI:10.1016/j.jfoodeng.2013.06.040.
[12] ZHANG Y H, OLSEN K, GROSSI A, et al. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J]. Food Chemistry, 2013, 141(3): 2343-2354. DOI:10.1016/j.foodchem.2013.05.058.
[13] 宗红, 诸葛斌, 秦斌钰, 等. 功能性猪骨泥发酵工艺研究[J]. 中国调味品, 2014, 39(2): 31-35. DOI:10.3969/j.issn.1000-9973.2014.02.008. [14] 刘丽莉, 康怀彬, 任广跃, 等. 微生物发酵牛骨粗胶原蛋白制备胶原多肽[J]. 肉类工业, 2013(6): 23-28. DOI:10.3969/ j.issn.1008-5467.2013.06.008.
[15] LIU L L, MA M H, CAI Z X, et al. Purif cation and properties of a collagenolytic protease produced by Bacillus cereus MBL13 strain[J]. Food Technology and Biotechnology, 2010, 48(2): 151-160.
[16] 刘丽莉, 马美湖, 杨协力. 产骨胶原蛋白酶菌的筛选及发酵条件优化[J]. 食品科学, 2009, 30(增刊1): 49-53. DOI:10.3321/ j.issn:1002-6630.2009.z1.012.
[17] 李振飞. 羊软骨中胶原蛋白肽的提取及其抗氧化性研究[D]. 呼和浩特: 内蒙古农业大学, 2013: 9-17.
[18] 陈飞平. 苋籽ACE抑制的分离纯化及其性质评价[D]. 重庆: 西南大学, 2013: 65-68.
[19] 邓惠玲. 猪血红蛋白ACE抑制肽的制备及其理化性质研究[D]. 重庆: 西南大学, 2013: 35-38.
[20] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7): 169-171. DOI:10.3321/j.issn:1002-6630.2005.07.039.
[21] 庄溪. 酶法制备大越豆芋ACE抑制肽的研究[D]. 杭州: 浙江农林大学, 2013: 32-36.
[22] 王涛, 张书衍, 吴绵斌, 等. 一株产新型水溶性抗真菌化合物的海洋芽胞杆菌发酵动力学的研究[J]. 高校化学工程学报, 2014, 28(6): 1294-1301. DOI:10.3969/j.issn.1003-9015.2014.06.018.
[23] 韦晓菊, 黎继烈, 朱晓媛. 重组大肠杆菌产青霉素酰化酶的发酵动力学研究[J]. 中国酿造, 2014, 33(3): 32-35. DOI:10.3969/ j.issn.0254-5071.2014.03.009.
[24] 张志东, 王玮, 茆军, 等. 低温淀粉酶发酵动力学模型的研究[J]. 食品科学, 2009, 30(3): 137-140. DOI:10.3321/j.iss:1002-6630.2009.03.030.
[25] 徐慧, 刘建军. 枯草芽孢杆菌HB-32产3-羟基丁酮分批发酵动力学[J].食品科学, 2013, 34(13): 209-212. DOI:10.7506/spkx1002-6630-201313044.
[26] 祝德义, 李彦春, 靳丽强. 胶原多肽与钙结合性能的研究[J]. 中国皮革, 2005, 34(3): 26-29. DOI:10.3969/j.issn.1001-6813.2005.03.009.
[27] 杨露, 丁利君, 蓝德安. 马面鱼骨胶原多肽的理化特性及其抗氧化活性[J]. 食品科学, 2013, 34(11): 109-112. DOI:10.7506/spkx1002-6630-201311024.
[28] 王艳. 草鱼皮胶原蛋白的提取、性质研究及膜性能表征[D]. 天津:天津科技大学, 2013: 45-46.
[29] 杨锋, 马千里, 黄永春. 醋蛋中ACE抑制肽的分离及稳定性研究[J]. 食品科学, 2009, 30(24): 77-79. DOI:10.3321/ j.issn:1002-6630.2009.24.014.
Fermentation Kinetics, Structure and Characteristics of Angiotensin Converting Enzyme Inhibitory Peptides Derived from Bovine Bone
LIU Lili, LI Dan, YIN Guangjun, LIANG Yanyu, KANG Huaibin
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
Abstract:In this work, we conducted a kinetic study on the mixed culture fermentation of bovine bone meal with Bacillus cereus MBL13-U, which was isolated in our previous study, Streptococcus thermophilus and Lactobacillus plantarum for preparing angiotensin converting enzyme (ACE) inhibitory peptides. Kinetic models with a determination coefficient greater than 0.97 for cell growth, product formation and substrate consumption were developed through nonlinear fitting using Logistic equation and Luecleking-Piret equation. The model predictions were in good agreement with the measured values. The structural properties of the ACE inhibitory peptides were characterized by scanning electron microscopy (SEM), ultraviolet (UV) spectroscopy and differential scanning calorimetry (DSC). The results showed that gully marks appeared on the surface of bovine bone-derived ACE inhibitory peptides, because they had a strong moisture absorption capacity with the maximum absorption at 222 nm as collagen-derived peptides do. Besides, the ACE inhibitory peptides had an increased thermal denaturation temperature and a better thermal stability than bovine bone collagen, apart from good solubility, acid and alkali resistance, and their salt tolerance was strong when the NaCl concentration was below 0.9 mol/L. Pepsin and trypsin had slight effects on bovine bone ACE inhibitory peptides.
Key words:Bacillus cereus MBL13-U; angiotensin converting enzyme (ACE) inhibitory peptides; fermentation kinetic models; structure characterization; characteristics
DOI:10.7506/spkx1002-6630-201702009
中图分类号:TS253.1
文献标志码:A
文章编号:1002-6630(2017)02-0052-07
引文格式:
刘丽莉, 李丹, 尹光俊, 等. 牛骨血管紧张素转化酶抑制肽发酵动力学及结构与特性分析[J]. 食品科学, 2017, 38(2): 52-58. DOI:10.7506/spkx1002-6630-201702009. http://www.spkx.net.cn
LIU Lili, LI Dan, YIN Guangjun, et al. Fermentation kinetics, structure and characteristics of angiotensin converting enzyme inhibitory peptides derived from bovine bone[J]. Food Science, 2017, 38(2): 52-58. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702009. http://www.spkx.net.cn
收稿日期:2016-04-28
基金项目:国家自然科学基金青年科学基金项目(31401622);公益性行业(农业)科研专项(201303084);河南省重点攻关项目(152102110080);河南科技大学高级别项目培育基金项目(2013ZCX012);河南省教育厅自然科学研究项目(13A550255)
作者简介:刘丽莉(1974—),女,副教授,博士,研究方向为畜产品加工技术。E-mail:yangliuyilang@126.com