
图11 C. glutamiiccuumm ATCC 13032葡萄糖代谢途径
[[2200]]
Fig. 1 Schematic illustration of the glucose metabolic pathways of C. glutamicum ATCC 13032
韩武洋 1,刘金雷 1,杜红燕 1,王北辰 2,仪 宏 1,李天明 1,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.威斯康星大学农业与生命学院,美国 麦迪逊 53706)
摘 要:采用反向代谢工程的策略,以谷氨酸棒杆菌ATCC 13032野生型为出发菌株,利用无抗性标记的同源重组方法,敲除了编码葡萄糖pts系统关键转运蛋白基因ptsG、ptsH-ptsI和葡萄糖转运系统关键转运蛋白基因abc、abc2和iolt1,得到了5 株逐次敲除了相应基因的突变株。结果表明:当以葡萄糖为唯一碳源培养时,CGΔptsG菌株的葡萄糖的消耗是野生型的50%,菌体OD值为1.473;CGΔptsH-ptsI菌株的葡萄糖的消耗是野生型的39.5%,菌体OD值为1.226;CGΔabc菌株的葡萄糖的消耗是野生型的36%,菌体OD值为1.092;CGΔabc2菌株的葡萄糖的消耗是野生型的26.2%,菌体OD值为0.486;CGΔiolt1葡萄糖的消耗和菌体生长OD值为0,实现了谷氨酸棒状杆菌葡萄糖代谢的阻断,说明ptsG、ptsH-ptsI、abc、abc2和iolt1所编码的转运蛋白具有葡萄糖转运功能。
关键词:谷氨酸棒状杆菌;葡萄糖;基因敲除
谷氨酸棒状杆菌(Corynebacterium glutamicum)是重要的工业生产菌之一,在50多年的发展过程中,主要被用于工业生产风味增强剂和动物饲料中的添加剂,如谷氨酸、赖氨酸、谷氨酰胺等 [1-3]。C. glutamicum可利用多种糖类和蜜糖作为原料进行工业发酵生产 [4],葡萄糖是C. glutamicum工业生产氨基酸等产品中使用最多的碳源,虽然关于C. glutamicum葡萄糖代谢及其调控的生理研究已经有了一些报道和进展,但在葡萄糖运输系统及分子水平上调节的研究相对较少 [5]。近年来,C. glutamicum ATCC 13032全基因组测序的完成 [6-7]和其他组学数据的积累 [8],使科研人员可以利用反向代谢工程的技术手段 [9-10],进一步探明葡萄糖运输系统和分子水平上的调节,为利用代谢工程改良菌种提供理论指导,以实现提高葡萄糖的利用效率、促进菌体生长的目标,或者实现不利用葡萄糖与其他利用葡萄糖微生物共发酵生产的目标。
综合目前的国内外研究,认为谷氨酸棒状杆菌中存在着两条不同的葡萄糖转运途径 [11]。一是当谷氨酸棒状杆菌以葡萄糖为唯一碳源生长时,大部分葡萄糖会在磷酸转移酶系统(phosphotransferase system,pts)的作用下磷酸化成6-磷酸葡萄糖,然后进入糖酵解途径 [12];二是少部分的葡萄糖会先以葡萄糖分子的形态进入细胞内,再在葡萄糖磷酸激酶的作用下生成6-磷酸葡萄糖进入糖酵解途径 [13-14]。根据文献及基因组信息,可能的涉及转运相关的基因及运输途径如图1所示,但是对于有些基因的功能还不十分清楚,需要进一步研究确证。

图11 C. glutamiiccuumm ATCC 13032葡萄糖代谢途径
[[2200]]
Fig. 1 Schematic illustration of the glucose metabolic pathways of C. glutamicum ATCC 13032
本实验以C. glutamicum ATCC 13032野生型为出发菌株,利用无抗性标记的同源重组方法,逐个敲除了调控葡萄糖pts和葡萄糖转运系统关键酶基因ptsG、ptsH-ptsI、abc、abc2和iolt1,实现C. glutamicum葡萄糖代谢系统的阻断,为在分子水平研究葡萄糖转运与代谢提供参考依据。同时,也为C. glutamicum与其他葡萄糖利用微生物共发酵提供了基础遗传资源。
1.1 材料
1.1.1 菌株与质粒
本实验所用的菌株、质粒分别如表1所示。
表1 本实验所用的菌株、质粒
Table1 Strains and plasmids used in this study
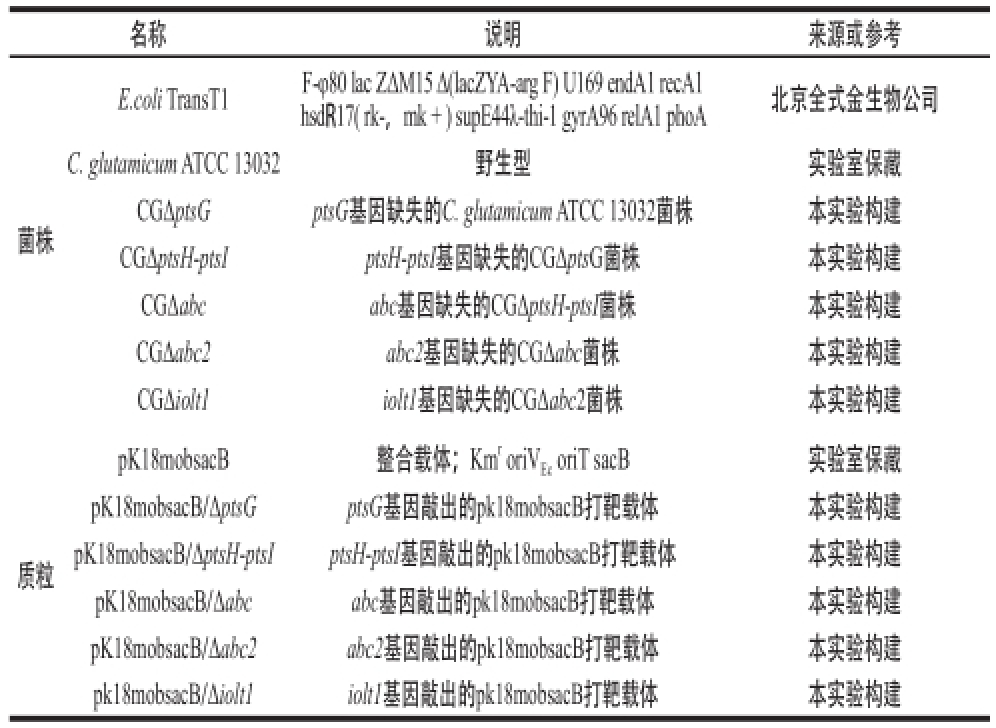
名称说明来源或参考E.coli TransT1 F-φ80 lac ZΔM15 Δ(lacZYA-arg F) U169 endA1 recA1 hsdR17( rk-,mk + ) supE44λ-thi-1 gyrA96 relA1 phoA北京全式金生物公司菌株C. glutamicum ATCC 13032 野生型实验室保藏CGΔptsGptsG基因缺失的C. glutamicum ATCC 13032菌株本实验构建CGΔptsH-ptsIptsH-ptsI基因缺失的CGΔptsG菌株本实验构建CGΔabcabc基因缺失的CGΔptsH-ptsI菌株本实验构建CGΔabc2abc2基因缺失的CGΔabc菌株本实验构建CGΔiolt1iolt1基因缺失的CGΔabc2菌株本实验构建质粒pK18mobsacB整合载体;Km roriV EcoriT sacB实验室保藏pK18mobsacB/ΔptsGptsG基因敲出的pk18mobsacB打靶载体本实验构建pK18mobsacB/ΔptsH-ptsIptsH-ptsI基因敲出的pk18mobsacB打靶载体本实验构建pK18mobsacB/Δabcabc基因敲出的pk18mobsacB打靶载体本实验构建pK18mobsacB/Δabc2abc2基因敲出的pk18mobsacB打靶载体本实验构建pk18mobsacB/Δiolt1iolt1基因敲出的pk18mobsacB打靶载体本实验构建
1.1.2 试剂
表2 本实验所用引物
Table2 PCR primers used in this study

注:下划线处为酶切位点。
CGGAATTCCAAGTTACCTTTTCAAGCCACGG QPTSGYZFTATCCCATTGCTCTACCCATTCT QPTSGYZRAAAGCGTACGCCTTGATGTCG PTSHIUPF CCGCTCGAGGCAGCAGAAGCAGTTGAAGAGTC PTSGUPRCGAATGAAGTCAGCGTCAAAAGTTTATGCGTTTACAGCTGCTTGTTG PTSGUPRCGAATGAAGTCAGCGTCAAAAGTTTATGCGTTTACAGCTGCTTGTTG PTSGDOFCAACAAGCAGCTGTAAACGCATAAACTTTTGACGCTGACTTCATTCG PTSGDOR引物引物序列(5’→3’)PTSGUPF AAGGAAAAAAGCGGCCGCTTATGCGTTTACAGCTGCTTGTTG QPTSHIYZFTTGATGGCAAGGATGTCACTGG QPTSHIYZRCGAGCCGATGAAGCCCG ABCUPF GCTCTAGAGCAGCAGAAGCAGTTGAAGAGTC PTSHIUPRGTTTGGGGTGAATGTGATGATCATGTCAAACCTTTCTAAACGTAGGGTCTGT PTSHIDOFACAGACCCTACGTTTAGAAAGGTTTGACATGATCATCACATTCACCCCAAAC PTSHIDOR CGGAATTCGAATCGTCCTTCGTGACCTTGAG QABC2YZFATGGCAACCGTAACGTTCAAAG QABC2YZRTTAAGGGAGGCGCTTGCCAG IOLT1UPF CCCAAGCTTGCTGCTGAATGTTTAGAAATCAATCG ABCUPRCATAAACATACGATTCGGAGCCAAATGGCTACTGCCAAAGTTCGC ABCDOFGCGAACTTTGGCAGTAGCCATTTGGCTCCGAATCGTATGTTTATG ABCDOR CCCAAGCTTCCTGAAACGGCTTGGAGGAGAGT ABC2UPRCGGGGACATCCTCGCTGGATTACTTCTTGAAGGTGCCTTTAGCTAG ABC2DOFCTAGCTAAAGGCACCTTCAAGAAGTAATCCAGCGAGGATGTCCCCG ABC2DOR CGGAATTCAGTTAATGGCGTAGGCGGTTT QABCYZFTTGATGGCAAGGATGTCACTGG QABCYZRCGAGCCGATGAAGCCCG ABC2UPF GGAATTCCATATGGCAAATACCCACTGCTACTACTCTG QIOLTYZFTTCCACTGTTGTCCCTGTCTACCT QIOLTYZRGACACCCAATCCGATACCTACC CTAGCTAGCCGCAGCAAGACCTGACATACCT IOLT1UPRATCCCACGAAGACCACAACCAGATTAGATCATGGTGCCGACAAAGAAAG IOLT1DOFCTTTCTTTGTCGGCACCATGATCTAATCTGGTTGTGGTCTTCGTGGGAT IOLT1DOR
High-Fidelity DNA聚合酶 北京全式金生物技术有限公司;限制性内切酶XhoⅠ、Hind Ⅲ、BamHⅠ和EcoRⅠ 美国NEB公司;T4 DNA 连接酶 大连宝生物工程公司;基因组提取试剂盒、质粒小提中量试剂盒、超薄DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒 天根生化科技(北京)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物由生工生物工程(上海)股份有限公司合成(表2)。
1.1.3 培养基
LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L,调pH值为6.5左右,需要时加入卡那霉素至终质量浓度30 mg/L。固体培养基则添加琼脂粉至20 g/L。
成分确定(chemical difined,CD)培养基:KH 2PO 41 g/L、(NH 4) 2SO 43 g/L、NH 4NO 31 g/L、MgSO 40.5 g/L、CaCl 20.2 g/L、Fe 2(SO 4) 30.01 g/L、MnSO 40.01 g/L、CuSO 40.002 g/L、ZnSO 40.001 g/L、生物素0.002 g/L,pH 6.5左右。
孵育培养基:CD培养基、乳酸钠50 g/L、乙酸钠50 g/L,pH 6.5左右。
1.2 仪器与设备
HWS型培养箱 宁波江南仪器厂;SW-CJ型超净工作台 苏净集团安泰公司制造;PCR仪、电转仪美国Bio-Rad公司;Neofuge23R冷冻离心机 力新仪器(上海)有限公司;pH211酸度计 意大利Hanna公司;Jl003A型电子天平 常熟双杰测试仪器厂;DZKW-D水浴锅 河北黄骅航天仪器厂;HYG型摇床 上海欣蕊自动化设备有限公司;F1-F2凝胶成像仪上海天能科技有限公司;PoweWave HT酶标仪 美国伯腾仪器有限公司;BCD-191W/HC冰箱 上海海尔股份有限公司;G80W23YCsL-03(RO)微波炉 上海申安医疗器械厂;Finnpipette移液枪 美国Thermo公司。
1.3 方法
1.3.1 菌株培养
C. glutamicum ATCC 13032在30 ℃、200 r/min条件下培养,E. coli TransT1在37 ℃、200 r/min条件下培养。
1.3.2 打靶质粒的构建
ptsG基因敲除打靶质粒构建方法如下:首先以C. glutamicum ATCC 13032野生型菌株基因组为模板,利用PCR扩增出待敲除基因ptsG上游和下游同源臂片段,利用重叠PCR技术将ptsG基因的上下游同源臂融合,将所得片段纯化后与pK18mobsacB空质粒利用XhoⅠ和EcoRⅠ进行双酶切,酶切体系(50 μL)为:XhoⅠ 1.5 μL、EcoRⅠ 1.5 μL、10×buffer 5 μL、模板2 000 ng/μL和超纯水,37 ℃条件下反应3 h。目的片段与pK18mobsacB空质粒酶切产物通过超薄DNA产物回收试剂盒回收,再通过T4连接酶16 ℃过夜连接。连接体系(25 μL)为:目的片段酶切产物5 μL、pK18mobsacB空质粒酶切产物1 μL、10×buffer 1.25 μL、T4连接酶0.5 μL、超纯水17.25 μL。连接过程应在冰上操作并充分混匀。连接产物转化E. coli TransT1感受态中,转化子提取质粒,经酶切验证后获得打靶质粒pK18mobsacB/ΔptsG。构建示意图如图2所示。

图2 pK18mobsaaccBB/ΔppttssGG构建示意图
Fig. 2 Schematic illustration of construction of pK18mobsacB/ΔptsG
本实验所涉及的敲除ptsH-ptsI、abc、abc2和iolt1基因打靶质粒利用类似方法构建,分别获得打靶质粒pK18mobsacB/ΔptsH-ptsI、pK18mobsacB/Δabc、pK18mobsacB/Δabc2和pK18mobsacB/Δiolt1。
1.3.3 C. glutamicum感受态的制备及转化
C. glutamicum感受态细胞制备方法参考Jang等 [15],将过夜培养的菌株按体积分数10%接种于三角瓶中培养,当OD 600 nm达到0.35~0.45时,于4℃条件下4 000 r/min离心5 min收集菌体,4 ℃条件下利用10%甘油吹悬漂洗2 次,取约5 μg打靶质粒与40 μL感受态细胞轻轻混合,转入电击杯,静置5 min后进行电击(电击条件:2.5 kV/cm电压、250 Ω电阻、25 μF电容、2 mm电击杯)。电击完成后,30 ℃、180 r/min条件下孵育培养4 h,涂布于含有卡那霉素抗性的固体培养基上,30 ℃条件下培养约40 h,固体培养基平板上长出均匀单菌落,挑取单菌落进行筛选。
1.3.4 工程菌株的筛选及鉴定
将单菌落扩培至含卡那霉素抗性的LB固体平板上,经菌落PCR验证,确定打靶质粒经同源重组整合到染色体上。选取验证正确的转化子,在无抗性压力条件下振荡培养6 h,稀释涂布于含有10%蔗糖的LB固体平板上,利用蔗糖致死基因sacB反向筛选出发生第2次同源重组的转化子,挑取蔗糖平板上单菌落,分别转接至卡那霉素抗性平板及10%蔗糖平板上,能在蔗糖平板上生长但不能在卡那霉素抗性平板生长的菌株即为发生第2次重组的菌株,但可能是突变菌株和恢复突变菌株两种可能,通过设计相对应的验证引物来进行菌落PCR验证,从而获得阳性工程菌。
1.3.5 工程菌株摇瓶发酵
从新鲜活化的LB固体平板上刮取菌株于种子培养基中,30 ℃条件下培养14 h,将种子液4 000 r/min离心2 min收集菌体,并用0.9%生理盐水洗涤1~2 次,接种于含2%葡萄糖的CD培养基中,转接前后OD 600 nm保持不变。培养温度30 ℃,摇床转速180 r/min,pH 7.0左右,发酵过程中间歇性调节pH值,使发酵液pH值保持在7.0左右,并于不同时间检测菌体浓度并取样保留,利用葡萄糖测定仪测定样品中残留的葡萄糖浓度。
2.1 ptsG基因缺失菌株构建及葡萄糖利用特性
2.1.1 ptsG基因敲除打靶质粒构建
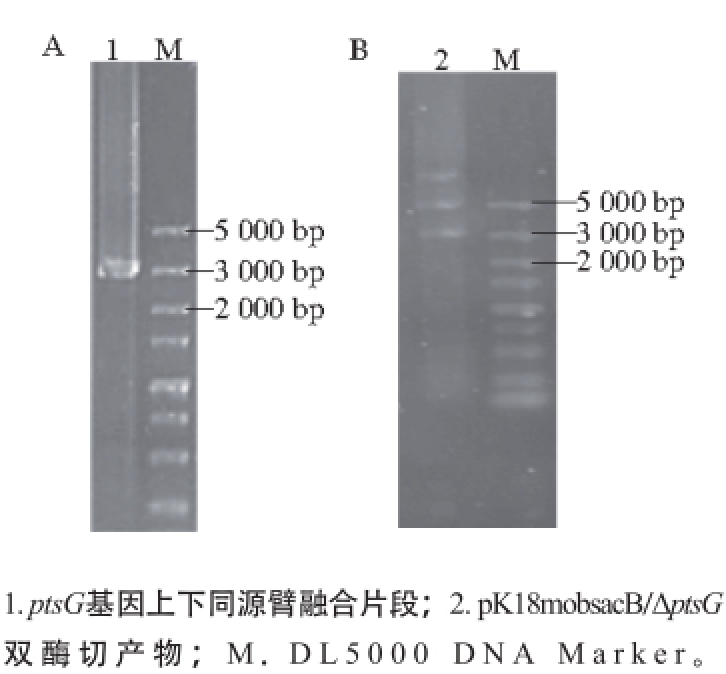
图3 PCR产物(A)和打靶质粒pK18mobsaaccBB/ΔppttssGG酶切验证(BB)
Fig. 3 PCR products (A) and identification of targeting plasmid pK18mobsacB/ΔptsG by enzymatic digestion (B)
ptsG是葡萄糖pts特异酶EⅡ的编码基因。以C. glutamicum ATCC 13032基因组DNA为模板,经PCR扩增获得上下同源臂,利用重叠PCR融合获得目的片段,大小为2 900 bp,结果如图3A所示。将目的片段与空质粒pK18mobsacB连接,获得重组质粒pK18mobsacB/ΔptsG,经酶切验证,得到5 600 bp载体片段和2 900 bp目的片段两条条带,结果如图3B所示,说明重组质粒pK18mobsacB/ΔptsG构建成功。
2.1.2 工程菌株CGΔptsG的筛选及验证

图4 同源交换原理示意图
Fig. 4 Schmatic illustration of the principle of homologous exchange
将重组质粒pK18mobsacB/ΔptsG电转化至C. glutamicum ATCC 13032感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程如图4所示。
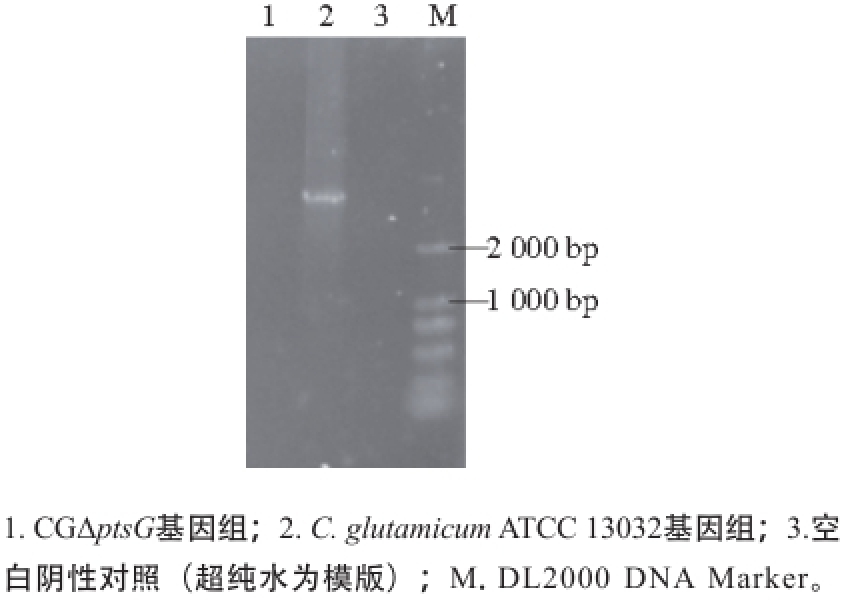
图5 ptsGptsG缺失基因PCR验证PCR
Fig. 5 Identification of deletion of ptsG by PCR
按照C. glutamicum ATCC 13032基因组序列中待敲除基因ptsG的基因序列设计敲除验证引物QPTSGYZF/ QPTSGYZR,分别以CGΔptsG菌株与C. glutamicum ATCC 13032菌株的基因组DNA为模板,进行PCR验证,结果如图5所示,C. glutamicum ATCC 13032菌株基因组能扩增出大小为2 502 bp的ptsG基因片段,与理论值大小一致,而CGΔptsG菌株基因组没有扩增出相应大小的片段,并且空白阴性对照(超纯水为模版)无条带,说明CGΔptsG工程菌基因组中的ptsG基因已被敲除。
2.1.3 工程菌株CGΔptsG的生长状况研究
CGΔptsG和C. glutamicum ATCC 13032在以葡萄糖为唯一碳源的条件下CD培养基中摇瓶发酵48 h,测定生长曲线和葡萄糖浓度,结果如图6所示,敲除ptsG基因的突变株与野生型相比在延滞期生长速率开始降低,生长速率缓慢,而葡萄糖浓度升高,表明敲除ptsG基因使菌株对葡萄糖利用率降低,但仍能利用葡萄糖继续生长。工程菌株CGΔptsG的生长速率、菌液OD 600 nm和葡萄糖利用率分别是野生菌株的74.4%、77.7%和50%。
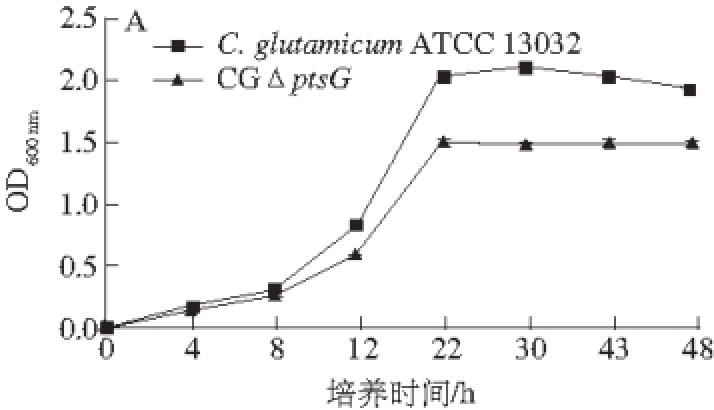
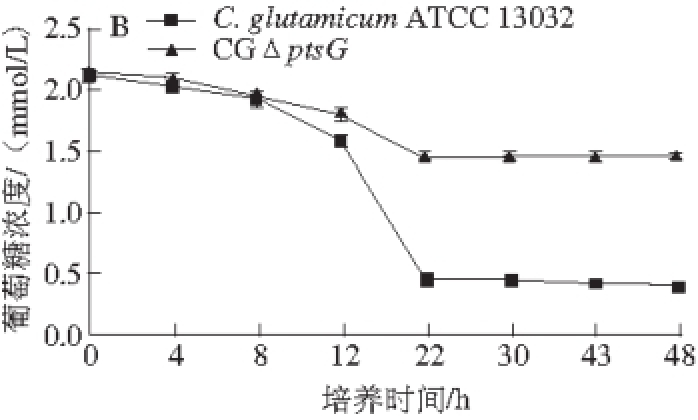
图6 C. glutamicum ATCC 13032 和C GppttssGG在以葡萄糖为碳源培养基上的生长曲线(A)及葡萄糖利用情况(BB)
Fig. 6 Growth curves and glucose consumption of C. glutamicum ATCC 13032 and CGΔptsG on glucose as the sole carbon source
2.2 ptsH、ptsI基因簇缺失菌株构建及葡萄糖利用特性
2.2.1 ptsH-ptsI基因簇敲除打靶质粒构建
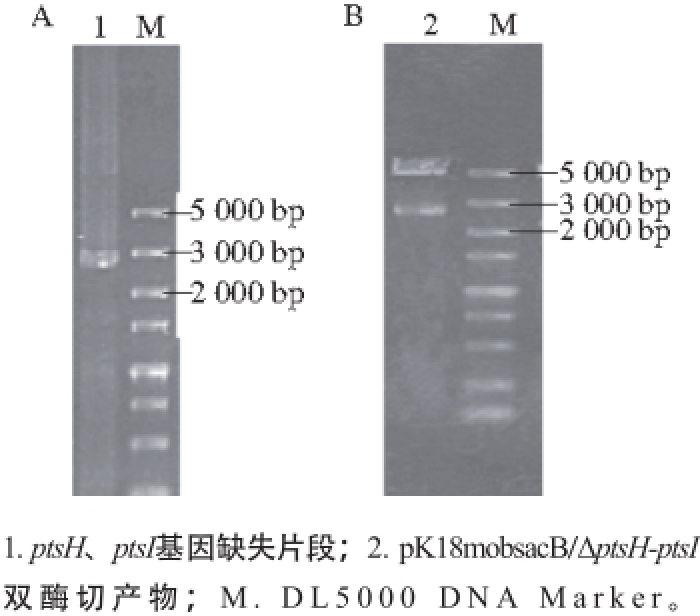
图7 PCR产物(A)和打靶质粒pK18mobsacB/ΔppttssHH-ppttssII酶切验证(BB)
Fig. 7 PCR products (A) and identification of targeting plasmid pK18mobsacB/ΔptsH-ptsI by enzymatic digestion (B)
葡萄糖pts还与特异性蛋白E1(由ptsH编码)和搬运蛋白HPr(由ptsI编码)相关,在C. glutamicum ATCC 13032基因组中,p t s H和p t s I基因是一个基因簇。以C. glutamicum ATCC 13032基因组DNA为模板,分别扩增出ptsH-ptsI基因簇的上下游同源臂,利用重叠PCR融合获得目的片段,大小为2 700 bp,结果如图7A所示。将目的片段与空质粒pK18mobsacB连接,获得重组质粒pK18mobsacB/ΔptsH-ptsI,经酶切验证,得到5 600 bp载体片段和2 700 bp目的片段两条条带,结果如图7B所示,说明重组质粒pK18mobsacB/ΔptsH-ptsI构建成功。
2.2.2 工程菌株CGΔptsH-ptsI的筛选及验证
将重组质粒pK18mobsacB/ΔptsH-ptsI电转化至CGΔptsG感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程与图4相似。
按照C. glutamicum ATCC 13032基因组序列中待敲除基因ptsH-ptsI的基因序列设计敲除验证引物QPTSHIYZF/ QPTSHIYZR,分别以CGΔptsH-ptsI菌株与CGΔptsG菌株的基因组DNA为模板,进行PCR验证,结果如图8所示,CGΔptsG菌株基因组能扩增出大小为1 700 bp的ptsH-ptsI基因片段,与理论值大小一致,而CGΔptsH-ptsI菌株基因组没有扩增出相应大小的片段,并且空白阴性对照(超纯水为模版)无条带,说明CGΔptsH-ptsI工程菌基因组中的ptsH-ptsI基因已被敲除。
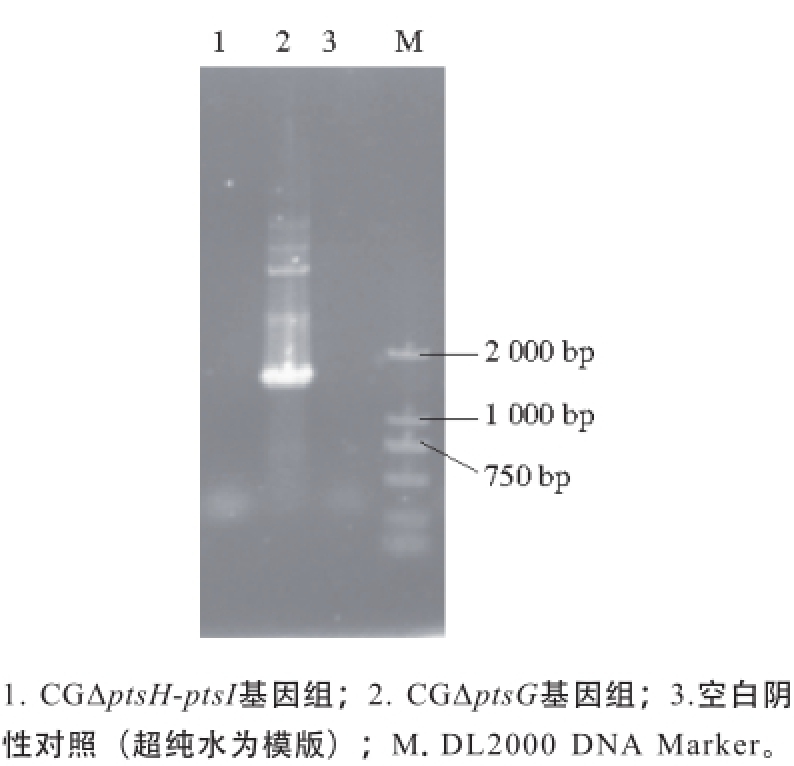
图8 ptsHptsH-ptsIptsI缺失基因PCR验证PCR
Fig. 8 Identification of deletion of ptsH-ptsI by PCR
2.2.3 工程菌株CGΔptsH-ptsI的生长状况研究
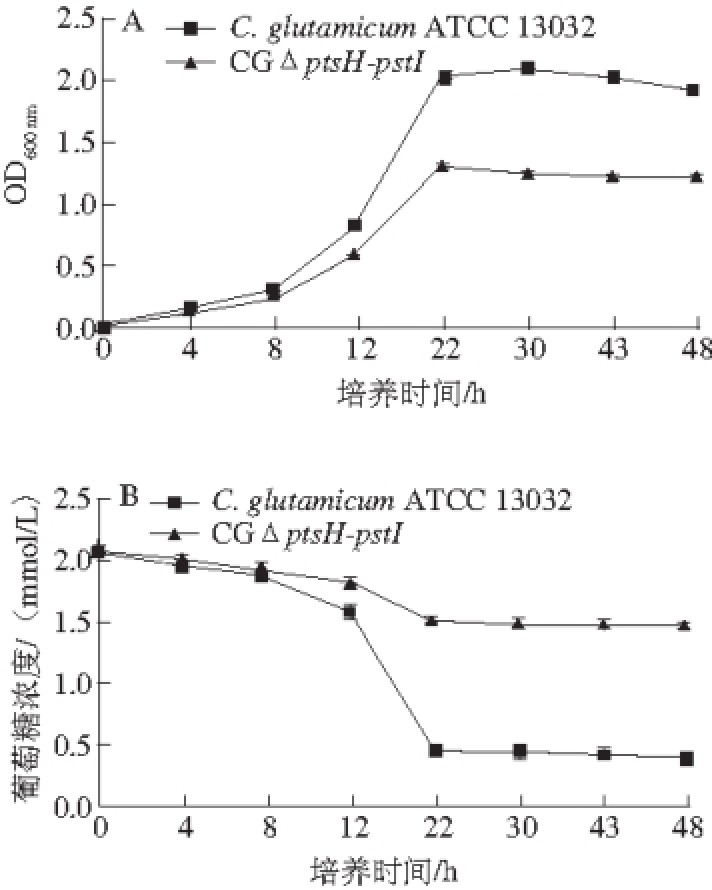
图9 C. glutamicum ATCC 13032和CGptsH--ppttssII在以葡萄糖为碳源培养基上的生长曲线(A)及葡萄糖利用情况(BB)
Fig. 9 Growth curves and glucose consumption of C. glutamicum ATCC 13032 and CGΔptsH-ptsI on glucose as the sole carbon source
CGΔptsH-ptsI和C. glutamicum ATCC 13032在以葡萄糖为唯一碳源的条件下CD培养基中摇瓶发酵48 h,测定菌株生长曲线和残留的葡萄糖,结果如图9所示,敲除ptsH-ptsI基因的突变株与野生型相比在延滞期生长速率开始降低,生长速率缓慢,而葡萄糖残量升高,表明敲除ptsH-ptsI基因使菌株对葡萄糖利用率降低。CGΔptsH-ptsI的生长速率、菌液OD 600 nm和葡萄糖利用率分别是野生型菌株的59.7%、66.8%和39.5%。
2.3 abc基因缺失菌株构建及葡萄糖利用特性
2.3.1 abc基因敲除打靶质粒构建

图10 PCR产物(A)和打靶质粒pK18mobsacB/Δaabbcc酶切验证(BB)
Fig. 10 The PCR products (A) and identification of targeting plasmid pK18mobsacB/Δabc by digestion (B)
2.3.2 工程菌株CGΔabc的筛选及验证

图11 abcabc缺失基因PCR验证PCR
Fig. 11 Identification of deletion of abc by PCR
将重组质粒pK18mobsacB/Δabc电转化至CGΔptsH-ptsI感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程与图4相似。
按照C. glutamicum ATCC 13032基因组序列中待敲除基因abc的基因序列设计敲除验证引物QABCYZF/ QABCYZR,分别以CGΔabc菌株与CGΔptsH-ptsI菌株的基因组DNA为模板,进行PCR验证,结果如图11所示,CGΔptsH-ptsI菌株基因组能扩增出大小为1 000 bp的abc基因片段,与理论值大小一致,而CGΔabc菌株基因组没有扩增出相应大小的片段,并且空白阴性对照(超纯水为模版)无条带,说明CGΔabc工程菌基因组中的abc基因已被敲除。
2.3.3 工程菌株CGΔabc的生长状况研究
CGΔabc和C. glutamicum ATCC 13032在以葡萄糖为唯一碳源的条件下CD培养基中摇瓶发酵48 h,测定菌株生长曲线和残留的葡萄糖,结果如图12所示,CGΔabc的生长速率、菌液OD 600 nm和葡萄糖利用率分别是野生型菌株的53.6%、60%和36%,说明敲除abc基因后,工程菌株对葡萄糖的利用率进一步降低。
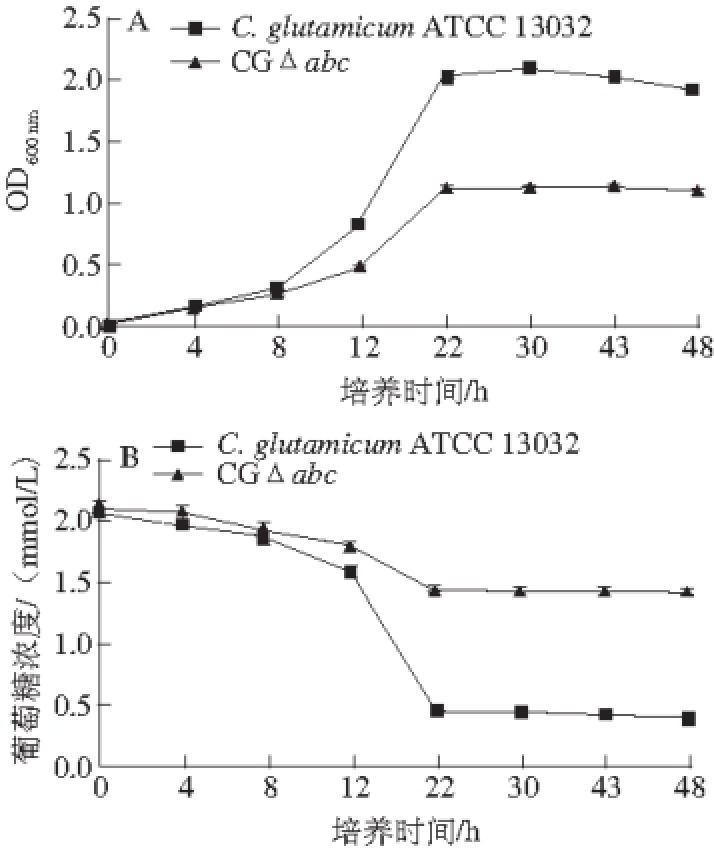
图12 C. glutamiiccuumm ATCC 13032和CCGGΔaabbcc在以葡萄糖为碳源培养基上的生长曲线(A)及葡萄糖利用情况(BB)
Fig. 12 Growth curves and glucose consumption of C. glutamicum ATCC 13032 and CGΔabc on glucose as the sole carbon source
2.4 abc2基因缺失菌株构建及葡萄糖利用特性
2.4.1 abc2基因敲除打靶质粒构建

图13 PCR产物(A)和打靶质粒pK18mobsacB/Δabc2abc2酶切验证(B)
Fig. 13 PCR products (A) and identification of targeting plasmid pK18mobsacB/Δabc2 by enzymatic digestion (B)
abc2基因是C. glutamicum ATCC 13032另一个abc型糖转运系统的相关基因。以C. glutamicum ATCC 13032基因组DNA为模板,分别扩增出abc基因的上下游同源臂基因片段,利用重叠PCR融合获得目的片段,大小为2 600 bp,结果如图13A所示。将目的片段与空质粒pK18mobsacB连接,获得重组质粒pK18mobsacB/Δabc2,经酶切验证,得到5 600 bp载体片段和2 600 bp目的片段两条条带,结果如图13B所示,说明重组质粒pK18mobsacB/Δabc2构建成功。
2.4.2 工程菌株CGΔabc2的筛选及验证

图14 ptsabc2sabc2缺失基因PCR验证PCR
Fig. 14 Identification of deletion of ptsabc2 by PCR
将重组质粒pK18mobsacB/Δabc2电转化至CGΔabc感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程与图4相似。
按照C. glutamicum ATCC 13032基因组序列中待敲除基因abc2的基因序列设计敲除验证引物QABC2YZF/ QABC2YZR,分别以CGΔabc2菌株与CGΔabc菌株的基因组DNA为模板,进行PCR验证,结果如图14所示,CGΔabc菌株基因组能扩增出大小为1 130 bp的abc2基因片段,与理论值大小一致,而CGΔabc2菌株基因组没有扩增出相应大小的片段,并且空白阴性对照(超纯水为模版)无条带,说明CGΔabc2工程菌基因组中的abc2基因已被敲除。
2.4.3 工程菌株CGΔabc2的生长状况研究
CGΔabc2和C. glutamicum ATCC 13032在以葡萄糖为唯一碳源的条件下CD培养基中摇瓶发酵48 h,测定菌株生长曲线和残留的葡萄糖,结果如图15所示,CGΔabc2的生长速率、菌液OD 600 nm和葡萄糖利用率分别是野生型菌株的10.3%、30.1%和26.2%,说明abc2基因对于调控葡萄糖转运有重要作用,敲除abc2基因后,工程菌株对葡萄糖的利用率大大降低。
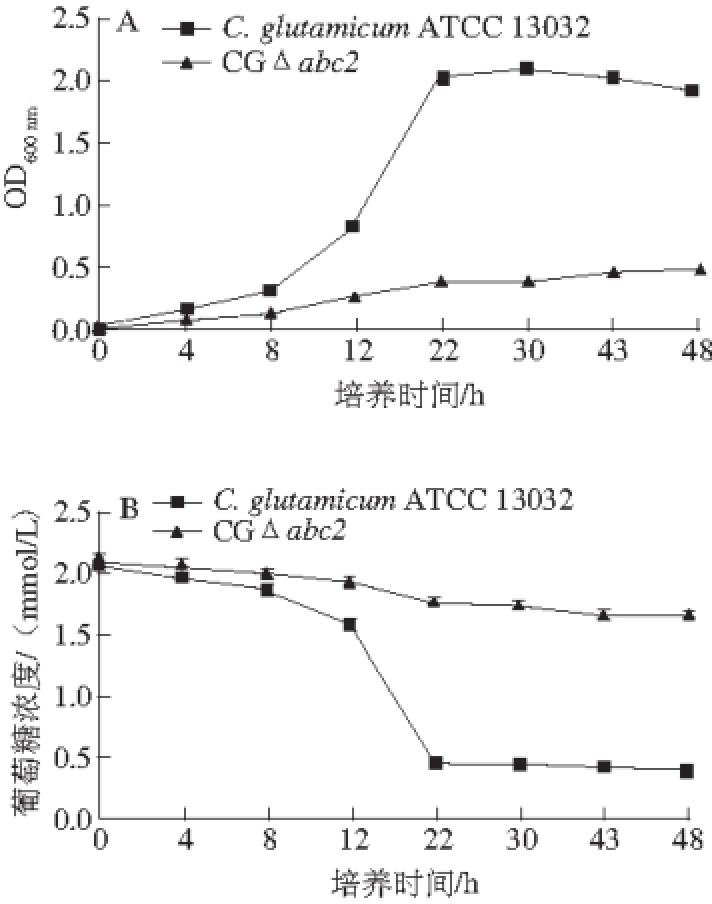
图15 C. glutamicum ATCC 13032和CGaabbcc22在以葡萄糖为碳源培养基上的生长曲线(A)及葡萄糖利用情况(BB)
Fig. 15 Growth curves and glucose consumption of C. glutamicum ATCC 13032 and CGΔabc2 on glucose as the sole carbon source
2.5 iolt1基因缺失菌株构建及葡萄糖利用特性
2.5.1 iolt1基因敲除打靶质粒构建
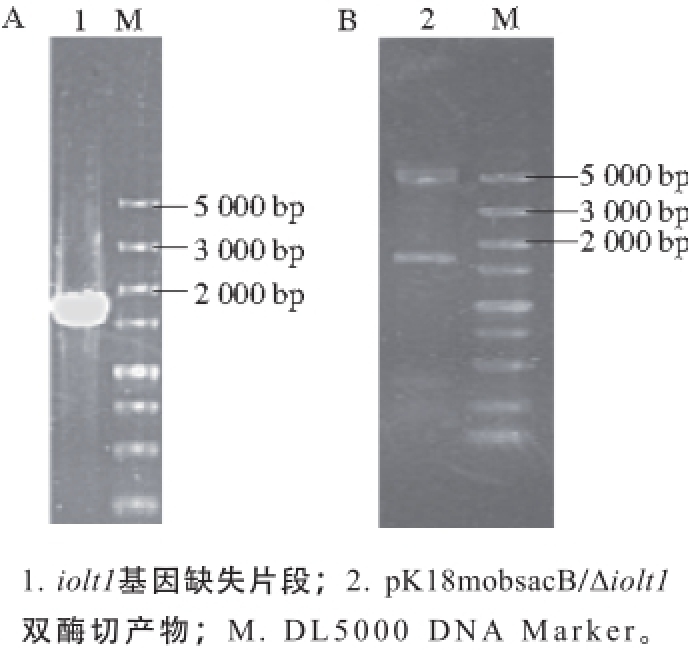
图16 PCR产物(A)和打靶质粒pK18mobsacB/Δiioolltt11酶切验证(BB)
Fig. 16 PCR products (A) and identification of targeting plasmid pK18mobsacB/Δiolt1 by enzymatic digestion (B)
在基因组中iolt1基因是编码肌醇转运的基因,但在Krings等 [16]报道中,其可以转运葡萄糖。以C. glutamicum ATCC 13032基因组DNA为模板,分别扩增出abc基因的上下游同源臂基因片段,利用重叠PCR融合获得目的片段,大小为1 800 bp,结果如图16A所示。将目的片段与空质粒pK18mobsacB连接,获得重组质粒pK18mobsacB/ Δiolt1,经酶切验证,得到5 600 bp载体片段和1 800 bp目的片段两条条带,结果如图16B所示,说明重组质粒pK18mobsacB/Δiolt1构建成功。
2.5.2 工程菌株CGΔiolt1的筛选及验证
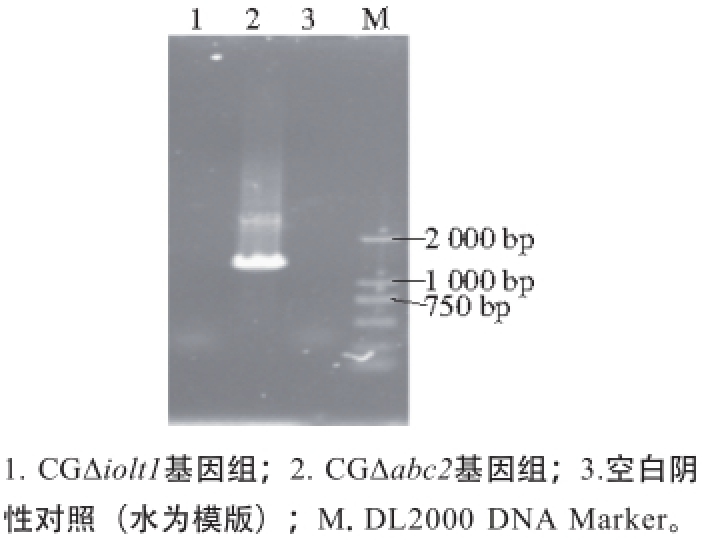
图17 ptsGptsG缺失基因PCR验证PCR
Fig. 17 Identification of deletion of ptsGptsG by PCR
将重组质粒pK18mobsacB/Δiolt1电转化至CGΔabc2感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程与图4相似。
按照C. glutamicum ATCC 13032基因组序列中待敲除基因iolt1的基因序列设计敲除验证引物QIOLT1YZF/ QIOLT1YZR,分别以CGΔiolt1菌株与CGΔabc2菌株的基因组DNA为模板,进行PCR验证,结果如图17所示,CGΔabc2菌株基因组能扩增出大小为1 480 bp的iolt1基因片段,与理论值大小一致,而CGΔiolt1菌株基因组没有扩增出相应大小的片段,并且空白阴性对照(超纯水为模版)无条带,说明CGΔiolt1工程菌基因组中的iolt1基因已被敲除。
2.5.3 工程菌株CGΔiolt1在以葡萄糖为碳源培养基上的生长情况
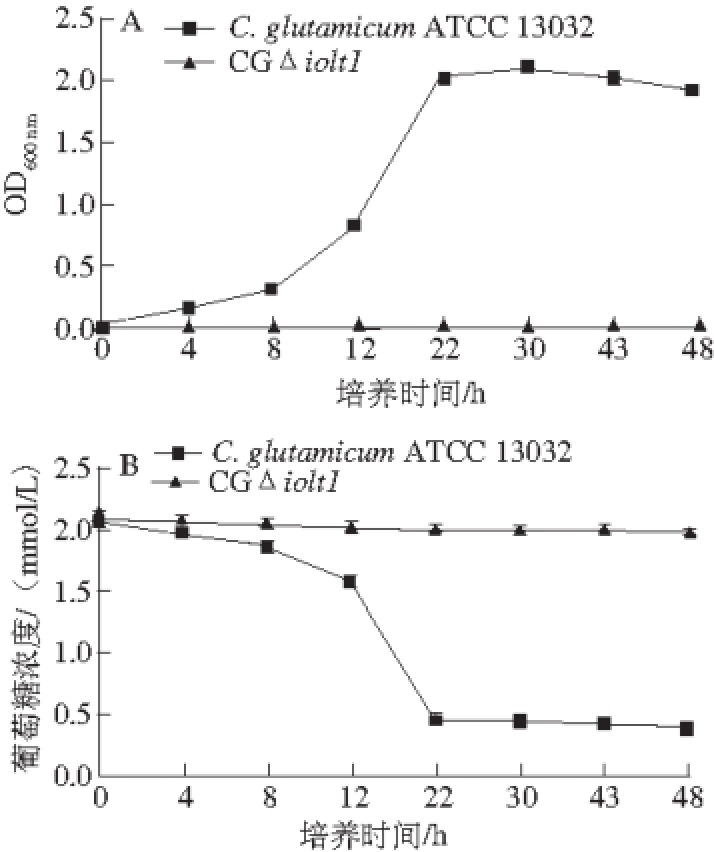
图18 C. glutamicum ATCC 13032和CGiioolltt11在以葡萄糖为碳源培养基上的生长曲线(A)及葡萄糖利用情况(BB)
Fig. 18 Growth curves and glucose consumption of C. glutamicum ATCC 13032 and CGΔiolt1 on glucose as the sole carbon source
CGΔiolt1和C. glutamicum ATCC 13032在以葡萄糖为唯一碳源的条件下CD培养基中摇瓶发酵48 h,测定菌株生长曲线和残留的葡萄糖,结果如图18所示,CGΔiolt1几乎无法利用葡萄糖生长,生长速率和残留葡萄糖量接近于0。
2.6 工程菌株CGΔptsG、CGΔptsH-ptsI、CGΔabc、CGΔabc2、CGΔiolt1与野生型菌株在以葡萄糖为碳源培养基的生长情况

图19 固体培养基上生长情况
Fig. 19 Growth of C. glutamicum ATCC 13032 and engineered strains on glucose-containing solid minimal medium
将工程菌株CGΔptsG、CGΔptsH-ptsI、CGΔabc、CGΔabc2、CGΔiolt1与野生型菌株依次接种于在仅以葡萄糖为碳源的固体CD培养基上,生长情况如图19所示,原始菌株生长良好,随着葡萄糖转运系统的相关基因ptsG、ptsH-ptsI、abc、abc2的依次敲除,菌株生长越来越弱,直至基因iolt1敲除后,工程菌株不生长。

图20 8 h和24 h菌液ODD
60000
nnmm
Fig. 20 OD
600
nmof fermentation broths at 8 and 24 h
工程菌株与野生型菌株同时接种于液体CD培养基中进行发酵培养,培养过程中,分别在8、24 h取样测OD 600 nm,结果如图20所示,基因ptsG和ptsH、ptsI基因簇敲除后OD 600 nm降低,生长速率下降,但并没有完全阻断葡萄糖代谢,说明在C. glutamicum ATCC 13032中除葡萄糖转运除了pts,还存在其他方式的转运系统。基因abc和abc2敲除后OD 600 nm降低幅度大,生长速率下降幅度大;基因iolt1敲除后,菌株不生长,在敲除pts的基础上,abc、abc2和iolt1 3个基因的敲除,完全阻断了葡萄糖代谢,说明C. glutamicum ATCC 13032中,abc、abc2和iolt1 3个基因是负责葡萄糖分子转运的关键基因。
据报道,C. glutamicum ATCC 13032中含有4 组pts,包括葡萄糖pts、果糖pts、蔗糖pts和一个未知pts [17-20]。葡萄糖pts由特异性蛋白E1(由ptsH编码)、搬运蛋白HPr(由ptsI编码)和酶Ⅱ(EⅡs)组成 [21]。与C. glutamicum ATCC 13032不同,另一株野生型菌株C. glutamicum R含有两组β-葡糖苷pts,他们负责β-葡糖苷的摄取,例如水杨苷、熊果苷和葡萄糖 [22]。本研究获得的ptsG和ptsI-ptsH基因缺失突变株,在以葡萄糖为唯一碳源培养基上的生长和葡萄糖的消耗都受到影响,说明在C. glutamicum ATCC 13032中,葡萄糖转运的pts除了ptsG编码的蛋白EⅡ Glc,还包括特异性蛋白E1(由ptsH编码)和搬运蛋白HPr(由ptsI编码),与现有的文献报道一致 [21]。但是突变株仍保留了运输葡萄糖糖的能力,说明葡萄糖的转运除了pts外还存在其他转运系统。
据报道C. glutamicum能够有效的使用葡萄糖酸和核糖作为唯一碳源,但他们的摄取是由非pts介导。葡萄糖酸由gntP编码的特定葡萄糖酸透酶GntP调控吸收,再经gntK编码的葡萄糖酸激酶GntK磷酸化成6-磷酸葡萄糖酸进入戊糖磷酸途径。基因gntP或gntK的缺失都会影响在葡萄糖上的生长 [22]。还有报道,核糖先通过rbsACBD基因编码的特定转运系统RbsACBD转运到细胞内,再通过rbsK1和rbsK2基因编码的核糖激酶RbsK1和RbsK2磷酸化形成5-磷酸核糖进入戊糖磷酸途径,rbsK1和rbsK2双基因缺失会影响在核糖上的生长的 [24-25],但没有文献具体报道负责葡萄糖原型转运的基因。本研究根据C. glutamicum ATCC 13032的KEGG数据库,找到了类似葡萄糖酸透酶和abc型糖转运系统的相关基因abc1和abc2基因(图1)。为了确认这两个基因对葡萄糖分子的转运作用,实验组利用两次重组技术,逐次删除了abc1和abc2基因,得到工程菌株CGΔabc1和CGΔabc2。葡萄糖的消耗速率和菌体的生长速率都大幅度下降,首次发现abc1和abc2基因编码的糖类蛋白对葡萄糖的转运起到重要作用。
Ikeda等 [1]发现C. glutamicum中编码肌醇转运的两个基因iolt1和iolt2可能介导葡萄糖的摄取,负责编码葡萄糖通透酶。鉴于本研究得到的4 个葡萄糖转运相关基因缺失的突变株仍具有葡萄糖代谢功能,本研究参考Ikeda等 [1]的研究,在CGΔabc2突变株基础上,敲除了iolt1基因,得到的工程菌株CGΔiolt1在葡萄糖为唯一碳源的培养基中不再生长,表明C. glutamicum ATCC 13032的葡萄糖代谢途径已经被完全阻断,说明在基因组中标注为编码肌醇转运的蛋白质,同样负责葡萄糖的转运,与其报道一致,但iolt2对葡糖糖转运的作用还有待进一步的研究。
参考文献:
[1] IKEDA M, TAKENO S. Amino acid production by Corynebacterium glutamicum[M]//Corynebacterium glutamicum. Berlin: Springer, 2013: 107-147. DOI:10.1007/978-3-642-29857-8_4.
[2] BLOMBACH B, SEIBOLD G M. Carbohydrate metabolism in Corynebacterium glutamicum and applications for the metabolic engineering of L-lysine production strains[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1313-1322. DOI:10.1007/s00253-010-2537-z.
[3] HOU Xiaohu, CHEN Xinde, ZHANG Yue, et al. L-Valine production with minimization of by-products’ synthesis in Corynebacterium glutamicum and Brevibacterium favum[J]. Amino Acids, 2012, 43(6): 2301-2311. DOI:10.1007/s00726-012-1308-9.
[4] XU J, ZHANG J, GUO Y, et al. Improvement of cell growth and L-lysine production by genetically modified Corynebacterium glutamicum during growth on molasses[J]. Journal of Industrial Microbiology and Biotechnology, 2013, 40(12): 1423-1432. DOI:10.1007/s10295-013-1329-8.
[5] KIEFER P, HEINZLE E, ZELDER O, et al. Comparative metabolic flux analysis of lysine-producing Corynebacterium glutamicum cultured on glucose or fructose[J]. Applied and Environmental Microbiology, 2004, 70(1): 229-239. DOI:10.1128/AEM.70.1.229-239.2004.
[6] KALINOWSKI J, BATHE B, BARTELS D, et al. The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J]. Journal of Biotechnology, 2003, 104: 5-25. DOI:10.1016/ S0168-1656(03)00154-8.
[7] MENTZ A, NESHAT A, PFEIFER-SANCAR K, et al. Comprehensive discovery and characterization of small RNAs in Corynebacterium glutamicum ATCC 13032[J]. BMC genomics, 2013, 14: 714. DOI:10.1186/1471-2164-14-714.
[8] WENDISCH V F, POLEN T. Transcriptome/proteome analysis of Corynebacterium glutamicum[M]//Corynebacterium glutamicum. Berlin: Springer, 2013: 173-216. DOI:10.1007/978-3-642-29857-8_6.
[9] 罗玉常, 窦文芳, 张晓梅, 等. 谷氨酸棒杆菌ilvE基因的敲除对相关氨基酸合成的影响[J]. 生物技术通报, 2012(11): 185-191.
[10] LU Dongmei, LIU Jianzhong, MAO Zongwan. Engineering of Corynebacterium glutamicum to enhance L-ornithine production by gene knockout and comparative proteomic analysis[J]. Chinese Journal of Chemical Engineering, 2012, 20(4): 731-739. DOI:10.1016/S1004-9541(11)60242-5.
[11] TERAM OTO H, INUI M. Regulation of sugar uptake, glycolysis, and the pentose phosphate pathway in Corynebacterium glutamicum[M]// Corynebacterium glutamicum. Berlin: Springer, 2013: 263-279. DOI:10.1007/978-3-642-29857-8_9.
[12] PARCHE S, BURKOVSKI A, SPRENGER G A, et al. Corynebacterium glutamicum: a dissection of the PTS[J]. Journal of Molecular Microbiology and Biotechnology, 2001, 3(3): 423-428.
[13] SHI F, LI K, HUAN X J, et al. Expression of NAD(H) kinase and glucose-6-phosphate dehydrogenase improve NADPH supply and L-isoleucine biosynthesis in Corynebacterium glutamicum ssp. lactofermentum[J]. Applied Biochemistry and Biotechnology, 2013, 171(2): 504-521. DOI:10.1007/s12010-013-0389-6.
[14] PARK S Y, KIM H K, YOO S K, et al. Characterization of glk, a gene coding for glucose kinase of Corynebacterium glutamicum[J]. FEMS Microbiology Letters, 2000, 188(2): 209-215. DOI:10.1111/j.1574-6968.2000.tb09195.x.
[15] JANG K, BRITZ M. Improved electrotransformation frequencies of Corynebacterium glutamicum using cell-surface mutants[J]. Biotechnology Letters, 2000, 22(7): 539-545. DOI:10.1023/ A:1005629224109.
[16] KRINGS E, KRUMBACH K, BATHE B, et al. Characterization of myo-inositol utilization by Corynebacterium glutamicum: the stimulon, identification of transporters, and influence on L-lysine formation[J]. Journal of Bacteriology, 2006, 188(23): 8054-8061. DOI:10.1128/ JB.00935-06.
[17] MOON M W, PARK S Y, CJOI S K, et al. The phosphotransferase system of Corynebacterium glutamicum: features of sugar transport and carbon regulation[J]. Journal of Molecular Microbiology and Biotechnology, 2007, 12(1/2): 43-50. DOI:10.1159/000096458.
[18] ZHOU Z H, WANG C, XU H T, et al. Increasing succinic acid production using the PTS-independent glucose transport system in a Corynebacterium glutamicum PTS-defective mutant[J]. Journal of Industrial Microbiology and Biotechnology, 2015, 42(7): 1073-1082. DOI:10.1159/S10295-015-1630-9.
[19] DOMINGUEZ H, ROLLIN C, GUYONVARCH A, et al. Carbon-flux distribution in the central metabolic pathways of Corynebacterium glutamicum during growth on fructose[J]. European Journal of Biochemistry, 1998, 254(1): 96-102. DOI:10.1046/j.1432-1327.
[20] WITTMANN C, KIEFER P, ZELDER O. Metabolic fluxes in Corynebacterium glutamicum during lysine production with sucrose as carbon source[J]. Applied and Environmental Microbiology, 2004, 70(12): 7277-7287. DOI:10.1128/AEM.70.12.7277-7287.2004.
[21] IKEDA M. Sugar transport systems in Corynebacterium glutamicum: features and applications to strain development[J]. Applied Microbiology and Biotechnology, 2012, 96(5): 1191-1200. DOI:10.1007/S00253-012-4488-z.
[22] KOTRBA P, INUI M, YUKAWA H. A single V317A or V317M substitution in enzyme Ⅱ of a newly identified β-glucoside phosphotransferase and utilization system of Corynebacterium glutamicum R extends its specificity towards cellobiose[J]. Microbiology, 2003, 149: 1569-1580. DOI:10.1099/mic.0.26053-0.
[23] LETEK M, VALBUENA N, RAMOS A, et al. Characterization and use of catabolite-repressed promoters from gluconate genes in Corynebacterium glutamicum[J]. Journal of Bacteriology, 2006, 188(2): 409-423. DOI:10.1128/JB.188.2.409-423.2006.
[24] NENTWICH S S, BRINKROLF K, GAIGALAT L, et al. Characterization of the LacI-type transcriptional repressor RbsR controlling ribose transport in Corynebacterium glutamicum ATCC 13032[J]. Microbiology, 2009, 155(1): 150-164. DOI:10.1099/ mic.0.020388-0.
[25] BRINKROLF K, PL☒GER S, SOLLE S, et al. The LacI/GalR family transcriptional regulator UriR negatively controls uridine utilization of Corynebacterium glutamicum by binding to catabolite-responsive element (CRE)-like sequences[J]. Microbiology, 2008, 154: 1068-1081. DOI:10.1099/mic.0.2007/014001-0.
Construction of Engineered Strain Blocking Glucose Metabolism in Corynebacterium glutamicum
HAN Wuyang
1, LIU Jinlei
1, DU Hongyan
1, WANG Beichen
2, YI Hong
1, LI Tianming
1,*
(1. College of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. College of Agriculture and Life Science, University of Wisconsin, Madison 53706, USA)
Abstract:In this study, we used the wild-type Corynebacterium glutamicum strain ATCC 13032 as a starting strain to obtain f ve mutants with knockout of the ptsG and ptsH-ptsI genes as well as the abc, abc2 and iolt1 genes by homologous recombination without resistance marker using reverse metabolic engineering strategies. Our experimental results showed that compared to the wild-type strain, the glucose consumption of the mutant CGΔptsG was 50% using glucose as the sole carbon source, giving an OD value of 1.473, the glucose consumption of the mutant CGΔptsH-ptsI was 39.5%, giving an OD value of 1.226, the glucose consumption of the mutant CGΔabc was 36%, giving an OD value of 1.09, and the glucose consumption of CGΔabc2 was 26.2%, giving an OD value of 0.486, while the mutant CGΔiolt1 could not utilize glucose to grow, suggesting that glucose metabolism of C. glutamicum was blocked. It turned out that the glucose transporter function was controlled by the ptsG, ptsH-ptsI, abc, abc2 and iolt1 genes, encoding transporter proteins.
Key words:Corynebacterium glutamicum; glucose; gene knockout
DOI:10.7506/spkx1002-6630-201702011
中图分类号:Q789
文献标志码:A
文章编号:1002-6630(2017)02-0065-10
引文格式:
韩武洋, 刘金雷, 杜红燕, 等. 谷氨酸棒状杆菌葡萄糖代谢阻断工程菌的构建[J]. 食品科学, 2017, 38(2): 65-74. DOI:10.7506/spkx1002-6630-201702011. http://www.spkx.net.cn
HAN Wuyang, LIU Jinlei, DU Hongyan, et al. Construction of engineered strain blocking glucose metabolism in Corynebacterium glutamicum[J]. Food Science, 2017, 38(2): 65-74. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702011. http://www.spkx.net.cn
收稿日期:2016-03-28
基金项目:国家高技术研究发展计划(863计划)项目(2014AA022102)
作者简介:韩武洋(1991—),男,硕士研究生,研究方向为合成生物学与代谢工程。E-mail:924084885@qq.com
*通信作者:李天明(1986—),男,助理研究员,硕士,研究方向为合成生物学与代谢工程。E-mail:iamltm2000@hotmail.com