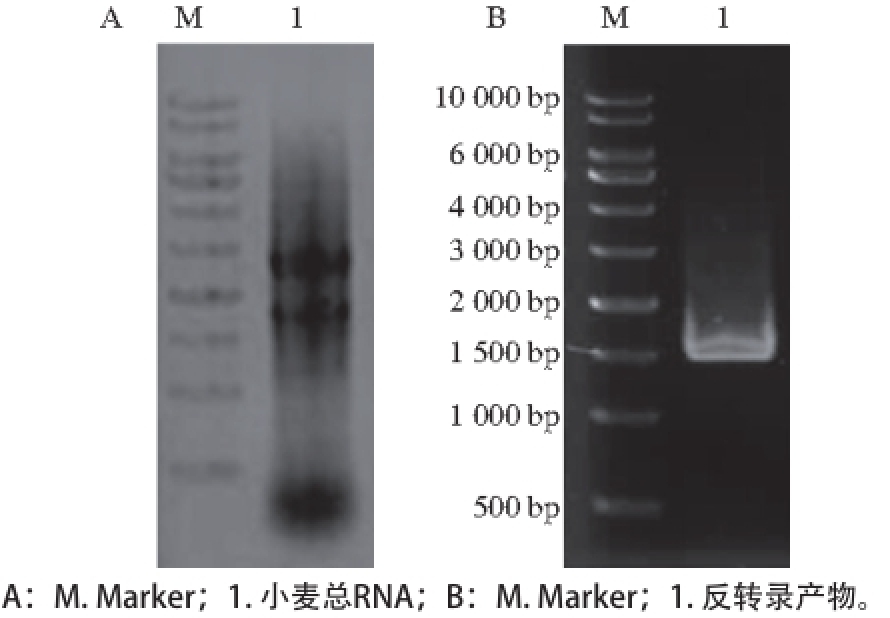
图1 小麦黄化苗叶片总RNA提取(A)和反转录PCR产物(B)
Fig. 1 Electrophoresis of total RNA extracted from etiolated wheat leaves (A) and reverse transcription-PCR amplified product (B)
刘 光 1,2,胡松青 1,2,张婷婷 1,2,王敬敬 1,2,李 琳 1,2,侯 轶 1,*
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640)
摘 要:目的:克隆小麦蛋白质二硫键异构酶(wheat protein disulfide isomerase,wPDI)基因,实现其在大肠杆菌中的表达并探究其酶学性质。方法:以小麦种子总RNA为模板,逆转录并扩增得到wpdi,并以pET-30b为表达载体、大肠杆菌BL21(DE3)为宿主菌进行原核表达,表达产物经金属螯合层析纯化后进行了酶学性质研究。结果:克隆的基因全长1 548 bp,与“Wyuna”品种小麦wpdi基因相似性达99%。构建了pET-30b-wpdi表达载体,获得wPDI的最佳表达条件为:诱导温度22 ℃,诱导时间6 h,诱导剂浓度0.5 mmol/L。该酶含4 个硫氧还蛋白结构域,分子质量约为66.2 kD,具有二硫键的还原酶和异构酶活性以及分子伴侣活性。结论:对重组wPDI的表达和酶学性质研究,为wPDI在面制品加工及其他方面的应用提供参考依据。
关键词:小麦蛋白质二硫键异构酶;克隆;表达;酶学性质
蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是一种位于真核生物细胞内质网中的巯基/二硫键氧化还原酶,对催化内质网中新生肽链氧化折叠、维持蛋白以及细胞功能具有重要作用 [1]。PDI主要由4 个硫氧还蛋白结构域组成,以a、b、b′和a′的顺序排列。其中,a和a′含有独立的催化巯基/二硫键交换的活性位点,不同物种间活性位点高度保守,皆为CXXC基序 [2]。PDI具有酶学活性和分子伴侣活性。酶学活性包括二硫键的氧化、还原和异构酶活性;PDI的分子伴侣活性指PDI能帮助新生肽链正确折叠并抑制因错误折叠引起的蛋白凝沉作用 [2-3]。
自从Anfinsen发现PDI以来,动物和真菌来源PDI的功能和结构得到了较为深入的研究,如人和酵母PDI的立体结构已被解析,相关生理机制已被阐明 [4-5]。相比之下,植物来源PDI的研究较局限,主要聚焦于基因序列的克隆、转录调控以及细胞定位等方面 [6-8],对功能、性质以及结构的研究较缺乏。
小麦PDI(wheat PDI,wPDI)参与了面筋蛋白中二硫键的生物合成,因此,其被认为是一种潜在的面粉改良剂 [9]。Watanabe等 [10]的研究指出牛来源PDI在面粉改良中的作用类似于溴酸钾。Every等 [11]的研究发现,小麦PDI在抗坏血酸协同下能够提高面包质量。因此,鉴于wPDI潜在的面制品工业应用价值,臧闻等 [12]利用大肠杆菌BL21(DE3)表达了重组wPDI,但目的蛋白表达量低且作者未对重组蛋白做进一步研究。
本研究将从小麦幼苗中克隆的wpdi基因连到表达载体pET-30b上,在大肠杆菌BL21(DE3)中实现了重组蛋白的大量可溶表达。酶活性研究发现,wPDI具有酶学活性和分子伴侣活性。这些结果为wPDI在面制品加工及其他方面的应用提供参考依据。
1.1 材料与试剂
1.1.1 宿主菌株与质粒
“中优9507”小麦种子,由中国农业科学院提供;克隆菌株E.coli DH5α、表达菌株E.coli BL21(DE3)、pMD19-T和pET-30b载体 宝生物工程有限公司。
1.1.2 试剂
胰蛋白胨和酵母提取粉 广东环凯微生物科技有限公司;高保真DNA聚合酶和超螺旋DNA定量Marker宝生物工程有限公司;限制性内切酶XhoⅠ、BamHⅠ和T4连接酶 赛默飞世尔科技(中国)有限公司;反转录酶M-MLV 普洛麦格(北京)生物技术有限公司;通用型RNA提取试剂盒和DNA凝胶回收试剂盒 广州东盛生物有限公司;DNA小提试剂盒 天根生物科技有限公司;胞苷2’,3’-环-磷酸单钠盐(cytidine 2’,3’-cyclic monophosphate,2’,3’-cCMP) 西格玛奥德里奇(上海)贸易有限公司。β-巯基乙醇、异丙基硫代-β-D-半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)、丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等(均为分析纯) 健阳生物科技有限公司。
1.2 仪器与设备
EDC-80聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪 东胜创新生物科技有限公司;Nanovue Plus超微量紫外分光光度计 美国通用电气公司。
1.3 方法
1.3.1 小麦总RNA提取
“中优9507”小麦种子于30 ℃和相对湿度85%条件下避光培养8~9 d后,取10 cm叶片剪成小段,置于液氮中研磨成粉末,并按照通用型RNA提取试剂盒操作方法,提取小麦黄化苗叶片总RNA。琼脂糖凝胶电泳检测其完整性,紫外分光光度计测定总RNA的浓度与纯度后,用于反转录扩增基因产物。
1.3.2 wpdi基因克隆
以提取得到的总RNA为模板,在反转录酶M-MLV作用下先进行反转录,反应条件为:42 ℃反转录60 min后,于70 ℃温育5 min终止反应。反转录产物cDNA随后进行PCR扩增,获得wpdi基因。PCR扩增引物是根据NCBI上提供的wpdi基因序列为模板,利用Primer Premier 3.0 设计而出,上、下游引物分别为:F1:5’-ATGGCGATCTGCAAGGTCTGG-3’和R1:5’-TCAGAGCTCGTCCTTCAGAGGC-3’。反应条件如下:94 ℃预变性5 min后,按以下的参数进行35 次循环:98 ℃变性10 s,57 ℃退火15 s,72 ℃延伸120 s。最后72 ℃延伸5 min扩增结束后,利用琼脂糖凝胶电泳检测扩增产物,并用DNA凝胶回收试剂盒回收wpdi基因。纯化后的wpdi基因优先连接到pMD19-T载体上保存。随后,从pMD19-T载体上,按照上述相同条件扩增出不含信号肽序列的wpdi基因,扩增引物分别为:F2:5’-CGGATCCAGAGGAAGCCGCAGCCG-3’和R2:5’-CCTCGAGGAGCTCGTCCTTCAGAG-3’。其中,下划线部分分别为BamHⅠ和XhoⅠ酶切位点。扩增后的产物,经电泳检测、回收纯化后于-20 ℃保存。
1.3.3 wPDI表达载体构建与鉴定
对wpdi基因回收产物和表达载体pET-30b质粒进行BamHⅠ和XhoⅠ双酶切处理,回收纯化后得到wpdi基因和表达载体pET-30b的双黏性末端DNA片段,加入T4 DNA连接酶,22 ℃连接30 min后,将连接产物转化到E.coli DH5α感受态细胞中,并涂布至含有硫酸卡那霉素(kanamycin,Kan)的LB平板培养基上于37 ℃培养过夜。菌落长成后,随机挑选单克隆菌落进行菌落PCR和重组质粒双酶切鉴定。将经双酶切和电泳验证结果为阳性的重组质粒pET-30b-wpdi送样测序。测序结果与GenBank上wpdi基因mRNA进行序列比对,确认重组质粒序列信息。
1.3.4 wPDI的诱导表达和可溶性分析
将测试无误的pET-30b-wpdi重组质粒转化至BL21(DE3)和C43(DE3)中,涂布在含Kan的LB平板培养基上。培养过夜后,挑取形态饱满的单克隆接种到含有Kan的LB培养基中,37 ℃、200 r/min培养过夜。将培养过夜的菌液以1∶100(V/V)的比例转接到新的LB培养基中,相同条件下再培养2~3 h,至菌液OD 600 nm为0.5~0.6后,吸取200 μL菌液,作为0 h非诱导对照样品,向剩余菌液加入IPTG诱导剂至终浓度为0.3 mmol/L,继续诱导培养3 h后吸取200 μL菌液。剩下菌液离心收集菌体细胞,加入0.02 mol/L磷酸盐缓冲液(pH 7.5)重悬样品,在冰浴中超声波破碎,超声条件:功率200 W,占空比0.4∶0.6,超声时间15 min。菌液破碎后于4 ℃、8 000 r/min离心15 min,分别收集上清液和沉淀,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electropheresis,SDS-PAGE)分析重组蛋白的表达和可溶性形式。
1.3.5 Western-blot分析
将wpdi基因的诱导表达产物经SDS-PAGE分析后,转移至硝酸纤维素膜上,进行Western-blot分析 [13-14]。一抗为鼠抗His单克隆抗体,工作浓度为1∶5 000(V/V)。二抗为羊抗鼠IgG单克隆抗体,工作浓度为1∶10 000(V/V),最后使用二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色。
1.3.6 wPDI的表达条件优化
含重组质粒pET-30b-wpdi的工程菌BL21(DE3)接种于含有Kan的LB液体培养基中,优化诱导表达时间(4、5、6、7 h)、表达温度(37、22 ℃)以及IPTG浓度(0.3、0.4、0.5、0.6、0.7 mmol/L)对重组蛋白表达水平的影响。收集200 μL菌液,离心去上清液,对沉淀进行SDS-PAGE分析,确定最适表达条件。
1.3.7 重组wPDI分离纯化
大量发酵后获得的菌体按照每g菌体加入5 mL平衡缓冲液(20 mmol/L Tris,20 mmol/L咪唑,0.5 mol/L NaCl,pH 8.0)重悬,按1.2.4节所述条件超声破碎菌体至澄清透明。4 ℃、8 000 r/min离心15 min,获得的上清液过0.45 μm的微滤膜,进一步去除微小颗粒,防止堵塞色谱柱。
过滤后的上清液载入到预平衡的Ni-NTA亲和柱中,先用平衡缓冲液洗去未与柱子结合的蛋白,然后再用洗脱缓冲液(20 mmol/L Tris,500 mmol/L咪唑,0.5 mol/L NaCl,pH 8.0)按照梯度洗脱方式洗脱柱子,流速为2 mL/min,收集洗脱峰流出液,分别取10 μL洗脱液作SDS-PAGE分析,并用微量紫外分光光度计测定蛋白浓度(ε wPDI=0.729 mL/(mg·cm)) [15]。
1.3.8 重组wPDI活性测定
二硫键还原酶活性:wPDI能将以二硫键交联的胰岛素还原成A、B单链,B链随后发生聚集沉淀,通过测定特定波长吸光度变化可以反映wPDI的还原酶活性 [16]。反应体系为:0.1 mol/L磷酸盐缓冲液,2 mmol/L EDTA,30 μmol/L胰岛素,不同质量浓度(25、50、75、100 μg/mL和125 μg/mL)wPDI,加入3.3 mmol/L二硫苏糖醇启动反应,测定波长630 nm处吸光度变化。以添加相同浓度的牛血清白蛋白(bovine serum albumin,BSA)为阳性对照,无任何蛋白添加为阴性对照。
二硫键异构酶活性:wPDI能够纠正蛋白质因错误折叠导致的二硫键错配,恢复其天然配对方式。以错误二硫键折叠的变性RNA酶(scrambled RNase,sRNase)为底物,探究wPDI的异构活性。sRNase的制备参照Walker等 [17]的方法。反应体系如下:0.1 mol/L Tris,1.2 mmol/L还原型谷胱甘肽(reduced glutathione,GSH),0.2 mmol/L氧化型谷胱甘肽(oxidized glutathione,GSSG),8.4 μmol/L sRNase,1.4 μmol/L wPDI,4.5 μmol/L 2’,3’-cCMP。测定296 nm波长处吸光度变化。
分子伴侣活性:wPDI的分子伴侣活性表现为抑制变性蛋白的凝沉,并恢复其天然构象的性质 [18]。以盐酸胍变性的三磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为底物,稀释作用下,探究不同浓度wPDI(10、20、30 μmol/L和40 μmol/L)对其聚集抑制率的影响。盐酸胍变性的GAPDH的制备参照Cai等 [19]的方法。反应体系如下:2.5 mmol/L EDTA,0.1 mol/L磷酸盐缓冲液(pH 7.5),wPDI(10、20、30 μmol/L和40 μmol/L),最后加入2.8 μmol/L变性的GAPDH,于488 nm波长处测定吸光度变化。以添加相同浓度的BSA为阳性对照,无任何蛋白质添加为阴性对照。
2.1 总RNA的提取和wpdi基因的扩增
用植物RNA提取试剂盒提取“中优9507”小麦黄化苗叶片总RNA,由图1A可见,小麦总RNA在图中显示3个条带,从上到下分别为28S、18S和5S条带,其中28S的RNA条带粗于18S的RNA。5S的RNA条带轻微弥散,说明总RNA存在少量降解。紫外分光光度计测得总RNA的质量浓度约为525.6 ng/μL,A 260 nm/A 280 nm为2.04。该结果表明,总RNA的完整性良好,符合反转录实验要求。
以提取的总RNA为模板,反转录获得cDNA,并进一步以此为模板,PCR扩增得到wpdi基因产物。经琼脂糖凝胶电泳分析,在1 500 bp左右的位置出现一条明亮的条带,与wpdi基因全长1 548 bp基本一致(图1B)。

图1 小麦黄化苗叶片总RNA提取(A)和反转录PCR产物(B)
Fig. 1 Electrophoresis of total RNA extracted from etiolated wheat leaves (A) and reverse transcription-PCR amplified product (B)
2.2 wpdi基因的克隆载体构建
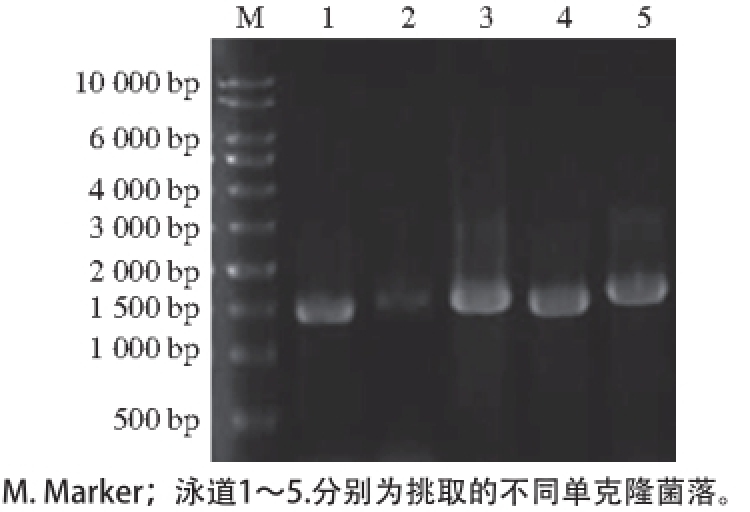
图2 菌落PCR分析
Fig. 2 Electrophoresis of PCR amplified products of monoclonal colonies
wpdi基因的PCR产物经纯化后连接至克隆载体pMD19-T上,并转化至E.coli DH5α中。挑取单克隆进行菌落PCR鉴定。如图2所示,阳性菌落扩增条带较亮,且位置正确,在1 500 bp左右,与预计大小基本相同;阴性菌落扩增的条带则较暗。将3、4和5条带对应的单克隆送华大基因公司测序。测序结果显示,3号和4号基因序列不全,存在碱基缺失。5号的基因序列完整,且与NCBI上品种为“Wyuna”(序列号:AF262979.1)的小麦PDI序列相似性最高,达99%,仅一个碱基不同,且这个碱基位于信号肽部位。说明品种“中优9507”的小麦与品种为“Wyuna”的小麦编码PDI的基因无差别。
2.3 wpdi基因的生物信息学分析
利用DNAstar软件分析,wpdi基因编码蛋白质全长515 个氨基酸,理论蛋白分子质量为56.7 kD,理论等电点为4.9。NCBI显示wPDI的4 个结构域分布如下:第42~145位氨基酸为a结构域,第153~246位氨基酸为b结构域,第263~363位氨基酸为b’结构域,第383~484位氨基酸为a’结构域。
wPDI氨基酸序列和已公开报道物种(包括大麦、柠檬、甘薯、酵母和人)的PDI氨基酸序列进行比对,结果如图3所示。4 种植物来源的PDI高度同源,小麦与大麦、柠檬和甘薯的相似性分别达96.7%、60.9%和58.6%。而wPDI与人和酵母来源的PDI相比,相似性较低,只有30%左右。通过NetNGlyc 1.0 Server在线软件(http:// www.cbs.dtu.dk/services/NetNGlyc/)预测N-糖基化位点发现,4 种植物PDI上只有一个N-糖基化位点,且位置相同(绿色阴影标示),酵母PDI有5 处(橙色阴影标示),人PDI有2 处(紫色阴影标示)。对不同来源wPDI保守区预测发现,催化活性位点和内质网驻留信号肽仍是高度保守的。6 个物种的活性位点都含CGHC序列,而人PDI a′结构域活性位点(CTHC)除外(红色框标示)。4 种植物PDI的内质网驻留信号肽都为KDEL,酵母PDI为HDEL,人PDI的为KEEL(浅蓝色阴影标示)。
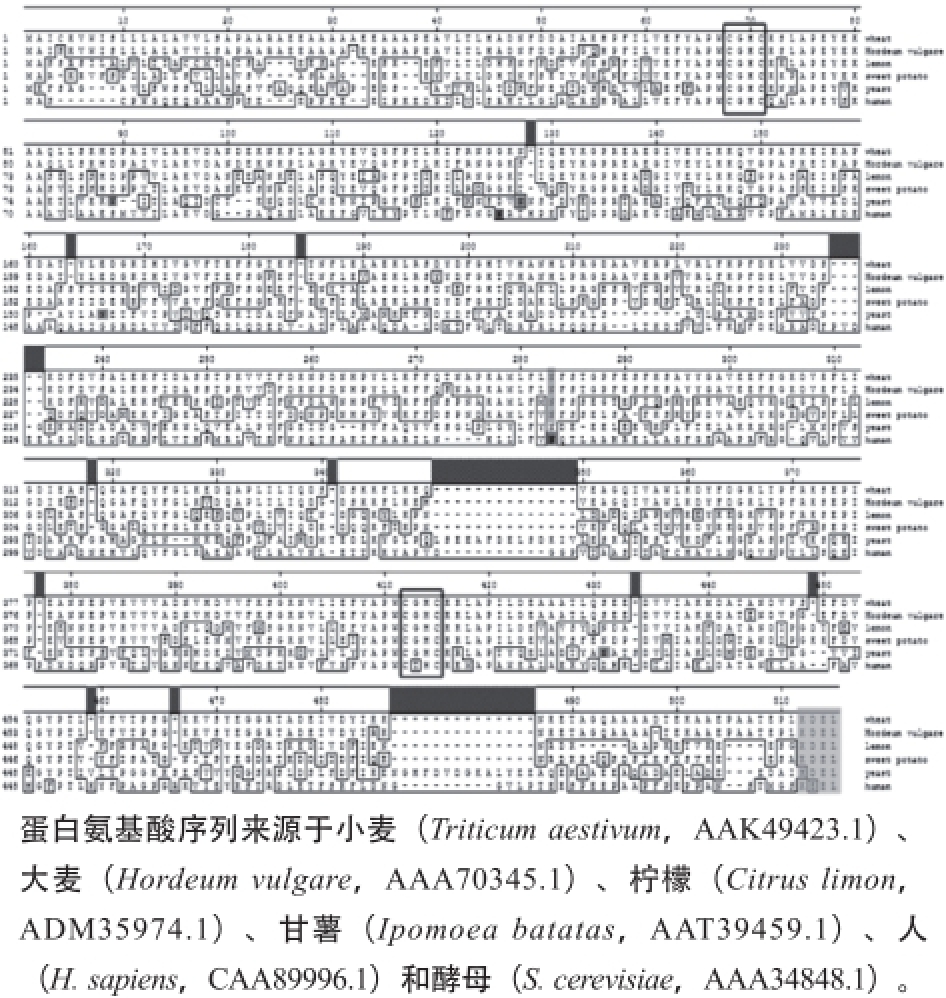
图3 PDI氨基酸序列比对
Fig. 3 Alignment of the deduced amino acid sequences of PDI from different species
2.4 wpdi基因的表达载体构建
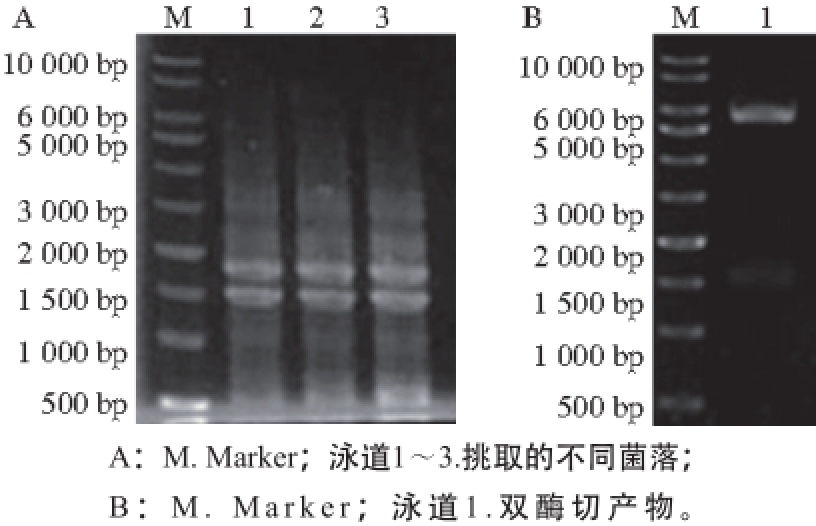
图4 菌落PCR(A)和双酶切鉴定(B)
Fig. 4 PCR Analysis of positive monoclonal colonies (A) and identification of recombinant plasmid (B) by double restriction enzyme digestion
从pMD19-T-wpdi上亚克隆不含信号肽序列的wpdi基因,连接至pET-30b表达载体上。所选酶切位点分别为BamHⅠ和XhoⅠ。转化至大肠杆菌DH5α中,菌落长成后进行菌落PCR鉴定和双酶切鉴定。由图4A可见,挑取的单克隆皆为阳性,虽然有拖带和非特异性扩增,但目的基因位置明确。双酶切结果表明,外源基因已正确插入到pET-30b载体内,成功构建重组表达载体pET-30b-wpdi(图4B)。
2.5 wPDI的重组表达和Western-blot分析
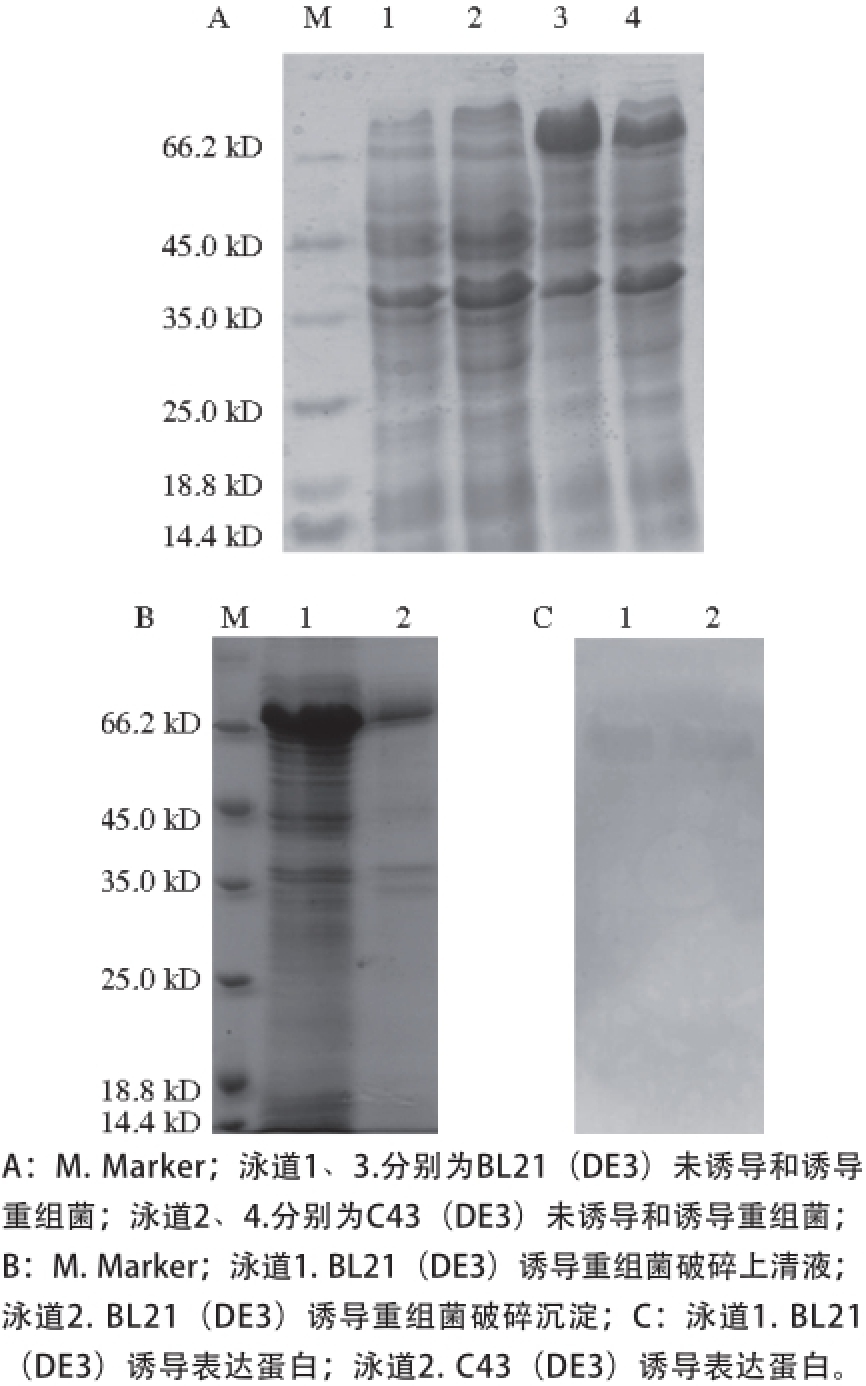
图5 wPDI表达检测(A)、可溶性(B)和Western-blot分析(C)
Fig. 5 SDS-PAGE (A), soluble expression (B) and Western-blot (C) analysis of recombinant wPDI protein
将构建好的重组表达质粒pET-30b-wpdi分别转入到大肠杆菌BL21(DE3)和C43(DE3)中,进行小量诱导表达,结果如图5A所示。wPDI在两种表达菌中都有表达,表达产物在凝胶上的分子质量约为66.2 kD,比理论值60.5 kD(含表达标签)偏高。有研究报道,重组蛋白所带的His融合标签可能是引起这种偏差的原因 [20]。wPDI的C-和N-端都带有His融合标签,该标签中的碱性氨基酸能够造成重组蛋白在SDS-PAGE中迁移变慢,从而引起测定分子质量比理论分子质量偏大。相比于大肠杆菌C43(DE3),BL21(DE3)表达菌株表达目的蛋白水平更高,且呈可溶表达(图5B),因此后续实验选择BL21(DE3)为表达宿主菌。
为验证诱导表达的蛋白为带His标签的目的蛋白,采用Western-blot实验进行分析。由图5B所示,Western-blot采用DAB显影,背景颜色深,显色虽不明显但仍能看到相关的特异性条带,表明BL21(DE3)和C43(DE3)这两种宿主菌所表达的蛋白确为带His标签的目的蛋白,能够用于镍离子螯合层析进行分离纯化。
2.6 wPDI的表达条件优化

图6 wPDI的表达条件优化
Fig. 6 Optimization of expression conditions for wPDI
2.6.1 诱导剂浓度
在确定了最佳表达宿主菌为BL21(DE3)后,优先考察诱导剂IPTG浓度对重组wPDI表达量的影响。在相同诱导温度(37 ℃)和时间(6 h)条件下,0.5 mmol/L的IPTG浓度能够诱导表达最大量的wPDI,提高IPTG浓度对表达量影响不明显(图6A),但是过高的IPTG浓度容易杀死大肠杆菌细胞以及导致包涵体的产生 [21]。因此,选择0.5 mmol/L IPTG为最适诱导剂浓度。
2.6.2 诱导温度
在IPTG浓度0.5 mmol/L,诱导时间6 h条件下,考察诱导温度(37、22 ℃)对wPDI表达量的影响。结果如图6B所示,在相同诱导条件下,选择的两个诱导温度对目的蛋白wPDI的表达量无显著差别,但是在后续的纯化实验中发现,低温22 ℃诱导产生的目的蛋白,对亲和层析柱的结合能力较强,易于分离出较高纯度的目的蛋白,因此选择温度22 ℃进行诱导。究其原因可能是低温诱导下降低了大肠杆菌生长速率和重组蛋白的合成速率,有利于重组蛋白的正确折叠,减少因蛋白错误折叠引起的His标签包埋,从而提高了分离纯化效率 [22]。因此,本实验选择温度22 ℃进行重组蛋白的诱导。
2.6.3 诱导时间
在IPTG浓度0.5 mmol/L,诱导温度37 ℃或22 ℃条件下,考察诱导时间对重组wPDI表达量的影响。如图6C、D所示,两个温度条件下,目的蛋白的表达量在诱导时间6 h时最高,在7 h时有所下降,可能是由于过高的IPTG浓度对大肠杆菌产生了一定的毒性,抑制了大肠杆菌的生长。因此,确定IPTG最适诱导时间为6 h。
2.7 wPDI的亲和纯化

图7 wPDI亲和纯化电泳分析
Fig. 7 SDS-PAGE analysis of wPDI after affini ty chromatography
重组蛋白wPDI的C-和N-端都带有His标签,容易与Ni 2+螯合,利用金属螯合层析可以较方便地分离纯化蛋白。如图7所示,在所选的层析条件下,依靠镍离子与重组蛋白His标签的特异性螯合作用,一步纯化即得到电泳纯目的蛋白。在咪唑浓度为150 mmol/L的洗脱液洗脱下,虽有少量目的蛋白开始流出,但是该洗脱峰中杂蛋白含量高;在咪唑浓度为200 mmol/L的洗脱液洗脱下,大部分目的蛋白流出,且杂蛋白含量较少,达到了电泳纯,可用于wPDI酶学性质的研究。
2.8 wPDI的酶学性质研究
2.8.1 wPDI的二硫键还原酶活性
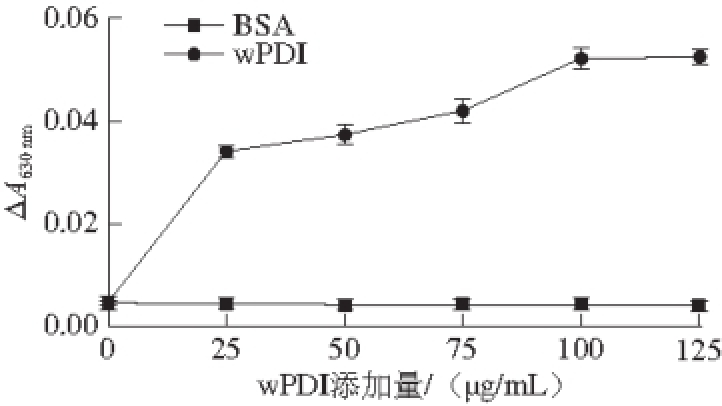
图8 不同重组wPDI添加量对胰岛素还原的影响
Fig. 8 Effect of different amounts of recombinant wPDI on reduction of insulin
wPDI能够还原胰岛素A-B两条链间的二硫键,引起B链的聚集。如图8所示,以30 μmol/L胰岛素为底物,考察了不同质量浓度wPDI对胰岛素还原的最佳比例。结果显示,随着重组wPDI添加量的增大,吸光度显著增加,表明胰岛 素被还原的量增大。当wPDI添加量达到100 μg/mL时,吸光度不再增加,表明酶反应趋于平衡。因此,在实验所选条件下,wPDI还原胰岛素的质量比为1∶1.73。
2.8.2 wPDI的异构酶活性
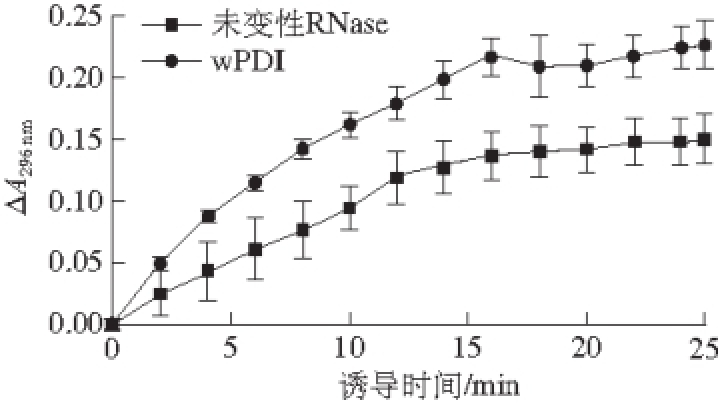
图9 重组wPDI异构酶活性测定
Fig.9 Isomerase assay of recombinant wPDI
在真核细胞内质网腔中,wPDI参与了新生肽链的折叠以及二硫键的形成。因错误折叠误配的二硫键能够通过wPDI的二硫键异构酶活性恢复成天然二硫键配对形式。体外考察wPDI的异构酶活性所用底物为sRNase。如图9所示,相比于未变性的RNase,wPDI能够使部分sRNase复性,从而具有催化底物2′,3′-cCMP水解的能力。25 min时,等量未变性RNase组在296 nm波长处的吸光度变化值为0.21,重组wPDI催化sRNase复性后,吸光度变化值为0.13。因此,wPDI能使sRNase恢复约60%的活性,表明重组wPDI具有良好的异构酶活性。
2.8.3 wPDI的分子伴侣活性

图10 重组wPDI的分子伴侣活性
Fig. 10 Chaperone activity of recombinant wPDI
分子伴侣是细胞中一大类蛋白质,它们氨基酸序列没有相关性但具有相同功能,能够介导其他蛋白质的正确装配,但自身不会成为功能结构中的组分 [23]。热休克蛋白是最常见的一大类分子伴侣蛋白。PDI的分子伴侣假说最早由王志珍 [24]通过复性不含二硫键的GAPDH和硫氰酸酶提出的,现已被广泛接受。PDI的伴侣活性指PDI能帮助新生肽链正确折叠并抑制因错误折叠引起的蛋白凝沉作用 [2-3]。测定PDI伴侣活性的常用底物为盐酸胍变性的GAPDH,稀释后的变性GAPDH易发生沉淀,通过测定GAPDH的聚集程度来衡量其伴侣活性的大小 [25]。图10显示了不同浓度的重组wPDI对变性GAPDH聚集的抑制率影响。结果表明,随着wPDI浓度的增加,对变性GAPDH聚集的抑制率显著提高,30 μmol/L的wPDI对聚集的抑制率最高,达到35%左右。Cai等 [19]研究发现,在一定范围内,wPDI对变性GAPDH的聚集抑制率越高,其酶学活性恢复的比例越大。因此说明,本研究获得的重组wPDI也具有分子伴侣活性。
从品种为“中优9507”小麦叶片中克隆了蛋白质二硫键异构酶wpdi基因,全长1 548 bp,与“Wyuna”小麦编码PDI的基因相似性达99%;多重序列分析发现,wPDI与植物来源PDI亲缘关系近,与人或酵母来源PDI关系远。但不同物种PDI的催化活性位点和内质网驻留信号序列仍高度保守;构建了pET-30b-wpdi表达载体,并在最佳表达菌株大肠杆菌BL21(DE3)得到了大量可溶表达,最适表达条件为:诱导温度22 ℃、诱导时间6 h,诱导剂浓度0.5 mmol/L。Western-blot结果证实了表达产物带有重组His标签。经镍离子螯合层析,一步纯化得到电泳纯重组wPDI;酶学性质表明,重组wPDI具有二硫键的还原酶和异构酶活性以及分子伴侣活性。该研究结果为wPDI在面制品加工以及其他方面的应用提供参考依据。
参考文献:
[1] WILKINSON B, GILBERT H F. Protein disulfide isomerase[J]. Biochimica et Biophysica Acta, 2004, 1699(1/2): 35-44. DOI:10.1016/ j.bbapap.2004.02.017.
[2] HATAHET F, RUDDOCK L W. Protein disulf de isomerase: a critical evaluation of its function in disulf de bond formation[J]. Antioxidants & Redox Signaling, 2009, 11(11): 2807-2850. DOI:10.1089/ ars.2009.2466.
[3] WANG L, WANG X, WANG C C. Protein disulfide-isomerase, a folding catalyst and a redox-regulated chaperone[J]. Free Radical Biology and Medicine, 2015, 83: 305-313. DOI:10.1016/ j.freeradbiomed.2015.02.007.
[4] TIAN G, XIANG S, NOIVA R, et al. The crystal structure of yeast protein disulf de isomerase suggests cooperativity between its active sites[J]. Cell, 2006, 124(1): 61-73. DOI:10.1016/j.cell.2005.10.044.
[5] WANG C, LI W, REN J, et al. Structural insights into the redoxregulated dynamic conformations of human protein disulfide isomerase[J]. Antioxidants & Redox Signaling, 2013, 19(1): 36-45. DOI:10.1089/ars.2012.4630.
[6] d’ALOISIO E, PAOLACCI A R, DHANAPAL A P, et al. The Protein Disulfide Isomerase gene family in bread wheat (T. aestivum L.)[J]. BMC Plant Biology, 2010, 10: 101. DOI:10.1186/1471-2229-10-101.
[7] XU Z J, UEDA K, MASUDA K, et al. Molecular characterization of a novel protein disulf de isomerase in carrot[J]. Gene, 2002, 284(1/2): 225-231. DOI:10.1016/S0378-1119(01)00889-7.
[8] HUANG D J, CHEN H J, LIN Y H. Isolation and expression of protein disulfide isomerase cDNA from sweet potato (Ipomoea batatas[L.] Lam ‘Tainong 57’) storage roots[J]. Plant Science, 2005, 169(4): 776-784. DOI:10.1016/j.plantsci.2005.05.034.
[9] JOYE I J, LAGRAIN B, DELCOUR J A. Endogenous redox agents and enzymes that affect protein network formation during breadmaking-a review[J]. Journal of Cereal Science, 2009, 50(1): 1-10. DOI:10.1016/j.jcs.2009.04.002.
[10] WATANABE E, BELL A E, BROCKWAY B E. The effect of protein disulphide isomerase on dough rheology assessed by fundamental and empirical testing[J]. Food Chemistry, 1998, 61(4): 481-486. DOI:10.1016/S0308-8146(97)00095-2.
[11] EVERY D, SIMMONS L D, ROSS A P. Distribution of redox enzymes in millstreams and relationships to chemical and baking properties of f our[J]. Cereal Chemistry, 2006, 83(3): 315. DOI:10.1094/cc-83-0062.
[12] 臧闻, 董剑, 高翔, 等. 小麦品种“陕253”PDI基因的克隆、原核表达及蛋白纯化[J]. 麦类作物学报, 2011, 31(5): 799-804. DOI:10.7606/ j.issn.1009-1041.2011.05.002.
[13] 陈明, 徐幸莲, 周光宏, 等. 鼠伤寒沙门氏菌鞭毛蛋白FliC的原核表达、纯化及其多克隆抗体的制备[J]. 食品科学, 2013, 34(9): 180-184. DOI:10.7506/spkx1002-6630-201309037.
[14] 刘光明, 梁银龙, 苏文金, 等. 鲤鱼小清蛋白的纯化及其过敏原性鉴定[J]. 食品科学, 2009, 30(3): 188-191. DOI:10.3321/ j.issn:1002-6630.2009.03.042.
[15] MAITY H, WEI A, CHEN E, et al. Comparison of predicted extinction coefficients of monoclonal antibodies with experimental values as measured by the Edelhoch method[J]. International Journal of Biological Macromolecules, 2015, 77: 260-265. DOI:10.1016/ j.ijbiomac.2015.03.027.
[16] NORGAARD P, WINTHER J R. Mutation of yeast Eug1p CXXS active sites to CXXC results in a dramatic increase in protein disulphide isomerase activity[J]. Biochemical Journal, 2001, 358(1): 269-274. DOI:10.1042/bj3580269.
[17] WALKER K W, LYLES M M, GILBERT H F. Catalysis of oxidative protein folding by mutants of protein disulfide isomerase with a single active-site cysteine[J]. Biochemistry, 1996, 35(6): 1972-1980. DOI:10.1021/bi952157n.
[18] NOIVA R. Protein disulfide isomerase: the multifunctional redox chaperone of the endoplasmic reticulum[J]. Seminars in Cell & Developmental Biology, 1999, 10(5): 481-493. DOI:10.1006/ scdb.1999.0319.
[19] CAI H, WANG C C, TSOU C L. Chaperone-like activity of protein disulf de isomerase in the refolding of a protein with no disulf de bonds[J]. Journal of Biological Chemistry, 1994, 269(40): 24550-24552.
[20] 唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J]. 植物生理学报, 2000, 26(1): 65-69. DOI:10.3321/j.issn:1671-3877.2000.01.012.
[21] 杨海麟, 王长城, 张玲, 等. 产胆固醇氧化酶重组大肠杆菌的发酵培养基和诱导条件的优化[J]. 食品与生物技术学报, 2009, 28(5): 670-674. DOI:10.3321/j.issn:1673-1689.2009.05.018.
[22] 林凡, 秦松. 乳糖诱导重组别藻蓝蛋白基因在大肠杆菌中的表达[J]. 海洋科学, 2005(11): 22-27. DOI:10.3969/ j.issn.1000-3096.2005.11.006.
[23] FEDER M E, HOFMANN G E. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61: 243-282. DOI:10.1146/annurev.physiol.61.1.243.
[24] 王志珍. 蛋白质二硫键异构酶既是酶又是分子伴侣[J]. 科学通报, 1998(13): 1345-1353. DOI:10.3321/j.issn:0023-074X.1998.13.002.
[25] SONG J L, QUAN H, WANG C C. Dependence of the anti-chaperone activity of protein disulphide isomerase on its chaperone activity[J]. Biochemical Journal, 1997, 328(3): 841-846. DOI:10.1042/bj3280841.
Gene Cloning, Expression and Characterization of Protein Disulfide Isomerase from Wheat (Triticum aestivum L.)
LIU Guang
1,2, HU Songqing
1,2, ZHANG Tingting
1,2, WANG Jingjing
1,2, LI Lin
1,2, HOU Yi
1,*
(1. School of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China; 2. Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety, Guangzhou 510640, China)
Abstract:Purpose: The gene encoding wheat protein disulf de isomerase (wPDI) was cloned and expressed in Escherichia coli, and its enzymatic properties were investigated. Methods: The wpdi gene was obtained by reverse transcription polymerase chain reaction amplif cation using the total RNA from wheat seeds as template. The recombinant plasmid pET-30b-wpdi was constructed and transformed into E. coli BL21 (DE3). After metal chelating chromatography, the enzymatic properties of the purif ed wPDI were determined. Results: A 1 548 bp gene fragment was amplif ed and sequenced as wpdi gene that had 99% identity with that of the wheat cultivar Wyuna. The optimized conditions for wPDI expression were determined as follows: induction at 22 ℃ using isopropyl β-D-1-thiogalactopyranoside at a concentration of 0.5 mmol/L for 6 h. The recombinant wPDI consisted of four thioredoxin-like domains and had a molecular weight of 66.2 kD. The enzyme exhibited enzymatic activities (including reductase activity and isomerase activity of disulf de bonds) and chaperone activity. Conclusions: The expression of wPDI and its enzymatic properties can provide the foundation for its application in the f our processing industry.
Key words:wheat protein disulf de isomerase; cloning; expression; enzymatic activities
DOI:10.7506/spkx1002-6630-201702002
中图分类号:Q816
文献标志码:A
文章编号:1002-6630(2017)02-0007-08
引文格式:
刘光, 胡松青, 张婷婷, 等. 小麦蛋白质二硫键异构酶基因的克隆、表达及重组酶性质[J]. 食品科学, 2017, 38(2): 7-14. DOI:10.7506/spkx1002-6630-201702002. http://www.spkx.net.cn
LIU Guang, HU Songqing, ZHANG Tingting, et al. Gene cloning, expression and characterization of protein disulfide isomerase from wheat (Triticum aestivum L.)[J]. Food Science, 2017, 38(2): 7-14. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201702002. http://www.spkx.net.cn
收稿日期:2016-03-04
基金项目:国家自然科学基金面上项目(31471691;31130042);高等学校博士学科点专项科研基金项目(20130172110018);广东省科技计划项目(2014A010107002);佛山市科技计划项目(2015AG10011)
作者简介:刘光(1988—),男,博士研究生,研究方向为谷物化学与蛋白质工程。E-mail:liuguang033@126.com
*通信作者:侯轶(1973—),女,高级工程师,博士,研究方向为工业废水的生物处理。E-mail:ceyhou@scut.edu.cn