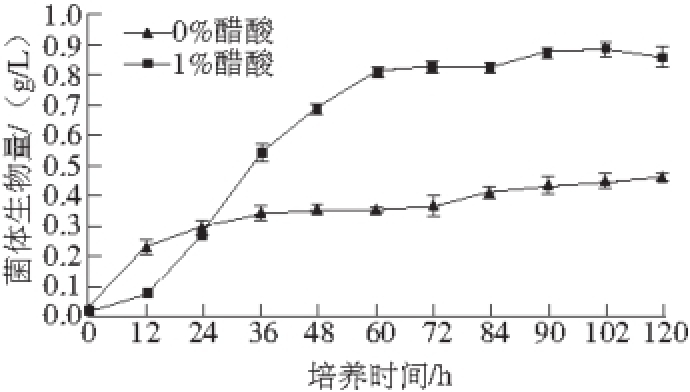
图1 醋酸对巴氏醋杆菌菌体生长的影响
Fig. 1 Effect of acetic acid on the growth of Acetobacter pasteurianus
殷海松 1,2,张仁宽 1,常燕钢 1,郑 宇 1,王 敏 1,*
(1.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2.天津现代职业技术学院生物工程学院,天津 300350)
摘 要:巴氏醋杆菌是醋酸发酵常用微生物,通过添加醋酸、三羧酸(tricarboxylic acid,TCA)循环抑制剂和中间产物干扰TCA循环能量代谢,研究其对菌体生长和醋酸发酵的影响。研究结果发现,添加质量分数1%的醋酸,胞内TCA代谢关键酶的表达量出现上调,胞内ATP含量增加了125%,表明能够强化TCA循环能量代谢,促进菌体生长。添加TCA循环抑制剂抑制TCA循环能量代谢,巴氏醋杆菌菌体生长和产酸受到显著抑制,菌体生物量分别降低了90%和87%,产酸量分别降低了90%和94%。添加0.05%草酰乙酸、琥珀酸、苹果酸等TCA中间产物,巴氏醋杆菌胞内ATP含量分别提高了202%、185%和165%,表明添加草酰乙酸等中间物质能够显著提高TCA循环偶联呼吸链产能,发酵72 h时,菌体生物量分别提高了92%、106%和104%,菌体产酸量分别提高了30%、33%和31%。实验结果表明,TCA循环能量代谢对巴氏醋杆菌菌体生长和产酸产生显著影响,TCA能量代谢的强化对醋酸发酵产生正向作用。
关键词:巴氏醋酸杆菌;TCA循环;能量代谢;醋酸;ATP含量
醋酸是一种常见的有机酸,在食品、生物和医药领域具有广泛应用。醋酸菌是指能将乙醇氧化成醋酸的一类细菌的总称 [1-2],基于16S rRNA基因序列同源性分析,将醋酸菌分为10 个属 [3-6],其中醋酸杆菌(Acetobacter)属的一些细菌由于具有很强的乙醇氧化能力并且能在发酵过程中积累大量乙酸,被广泛应用于醋酸发酵 [7-10]。
在醋酸发酵过程中,胞内能量对于菌体醋酸耐受性有重要影响,其中,醋酸分子的泵出机制以及ATP依赖型的转运蛋白,如AatA和ClpB均与菌体的能量代谢直接相关 [11-14],因此能量供应对于保障巴氏醋酸杆菌(Acetobacter pasteurianus)在高酸环境下的正常代谢非常重要 [15]。巴氏醋酸杆菌能量代谢途径主要有乙醇呼吸链产能途径、三羧酸(tricarboxylic acid,TCA)循环偶联有氧呼吸产能途径等 [15]。其中,TCA循环作为细菌重要的代谢途径,不仅产生许多重要物质生物合成的前体,并且是菌体获得能量的最有效方式 [16-17]。前期研究发现,醋酸菌在以乙醇为底物发酵生产醋酸的过程中可以促进TCA循环代谢,从而提高发酵效率 [18]。
本实验通过添加TCA循环抑制剂和草酰乙酸、苹果酸、琥珀酸等TCA循环中间产物,研究巴氏醋酸杆菌TCA循环对菌体生长和醋酸发酵的影响,研究成果将有利于指导醋酸发酵工艺优化与调控。
1.1 材料与试剂
1.1.1 菌种
巴氏醋杆菌AC2005由中国微生物菌种保藏管理委员会普通微生物中心保藏(保藏编号:CGMCC3089)。
1.1.2 培养基
斜面培养基:葡萄糖20 g/L、酵母膏15 g/L、碳酸钙20 g/L、琼脂17 g/L,pH值自然;生长培养基:葡萄糖30 g/L、酵母膏10 g/L、蛋白胨10 g/L,pH值自然。接种前添加醋酸至所需要的质量分数;种子培养基:葡萄糖20 g/L、酵母膏15 g/L,pH值自然,接种前加入无水乙醇至28 g/L;发酵培养基:葡萄糖20 g/L、蛋白胨5 g/L,pH值自然,接种前加入无水乙醇至56 g/L。
1.1.3 试剂
无水葡萄糖(分析纯) 天津福晨化学试剂厂;蛋白胨 英国Oxiod公司;酵母膏 北京奥博星生物技术有限责任公司;丙二酸、三氟乙酸(均为分析纯) 天津市科密欧化学试剂有限公司;醋酸(分析纯) 天津市北方天医化学试剂厂;柠檬酸、草酰乙酸、琥珀酸、苹果酸 美国Amresco公司;α-酮戊二酸 美国Biotopped公司;微生物细胞活性检测试剂盒 美国Promega公司。
1.2 仪器与设备
UVmini-1250紫外-可见分光光度计 日本岛津公司;HYG-W1摇床 上海欣蕊自动化设备有限公司;YJ-875S医用超净台 苏州净化设备厂;Multiskan Ascet酶标仪、Dionex Ultimate 3000液相色谱-LTQ Orbitrap Velos Pro质谱联用仪 美国Thermo公司;TGL-16B高速离心机 上海安亭科学仪器。
1.3 方法
1.3.1 培养方法
1.3.1.1 种子培养
在种子培养基(40 mL培养基/250 mL摇瓶)中接入斜面菌种1 环,在30 ℃、摇床转速180 r/min的条件下培养27 h,至OD 610 nm为1.38±0.12。
1.3.1.2 摇瓶醋酸发酵
在发酵培养基(100 mL培养基/500 mL摇瓶)中,按体积分数10%接种量接入种子液,在发酵温度30 ℃、摇床转速180 r/min的条件下进行醋酸发酵。
1.3.2 醋酸对巴氏醋杆菌菌体生长及胞内ATP含量的影响
按体积分数10%的接种量将种子液转接到分别添加质量分数0%和1.0%醋酸的生长培养基中,研究醋酸对菌体生长及胞内ATP含量的影响。
1.3.3 醋酸对巴氏醋杆菌TCA循环代谢的影响
以体积分数10%的接种量将种子液转接到分别添加质量分数0%和1%醋酸的生长培养基中,培养至对数期中期,收集菌体,利用蛋白质谱的方法分析菌体蛋白表达差异,重点分析其中TCA循环相关蛋白质表达差异。
1.3.4 TCA循环抑制剂对巴氏醋杆菌醋酸发酵的影响
以发酵培养基作为空白对照,向发酵培养基中分别添加50 mmol/L丙二酸和三氟乙酸,进行醋酸发酵,检测发酵过程菌体和醋酸含量。
1.3.5 能量代谢中间产物对巴氏醋杆菌TCA循环能量代谢的强化及醋酸发酵的影响
以发酵培养基作为空白对照,向发酵培养基中分别添加0.05%柠檬酸、α-酮戊二酸、苹果酸、琥珀酸、草酰乙酸,进行醋酸发酵,检测发酵过程菌体和醋酸含量。收集菌体,分析其胞内ATP含量。
1.3.6 分析检测方法
1.3.6.1 菌体生物量
将发酵液于6 000 r/min离心10 min,除去上清液,将菌体细胞置于干燥箱中,37 ℃条件下恒温烘干至恒质量,称量,根据标准曲线计算菌体生物量。
1.3.6.2 醋酸含量
采用酸碱滴定法,取1 mL发酵液于250 mL三角瓶中,加入蒸馏水15 mL,以酚酞作指示剂,用0.1 mol/L的氢氧化钠溶液将发酵液滴定至粉红色,测得醋酸含量。
1.3.6.3 菌体胞内ATP含量的测定
收集菌体,利用微生物细胞活性检测试剂盒测定菌体胞内ATP含量,结果以ng/g(以细胞干质量计)表示。
1.3.6.4 蛋白质谱分析
收集对数中后期菌体,PBS洗涤后超声破碎,4 ℃条件下12 000 r/min离心10 min,取上清液,加入4 倍体积预冷的丙酮,-20 ℃条件下过夜沉淀;4 ℃条件下12 000 r/min离心10 min,得到胞内总蛋白 [13]。蛋白样品委托瀚盟生物技术(天津)有限公司进行蛋白质谱分析。
检测软件:Proteomics Discovery 1.2;检索算法:Sequest算法;比对数据库:Acetobacter pasteurianus IFO 32831-01蛋白质组(NCBI登录号:PRJNA59279) [19]。
1.4 数据处理
每个实验共设3 个平行,图表生成采用Origin 7.5软件进行数据分析。
2.1 醋酸对巴氏醋杆菌菌体生长及TCA循环代谢的影响

图1 醋酸对巴氏醋杆菌菌体生长的影响
Fig. 1 Effect of acetic acid on the growth of Acetobacter pasteurianus
由图1可知,添加1%的醋酸能显著促进菌体生长,培养72 h时,生物量与不添加醋酸相比增加了120%。
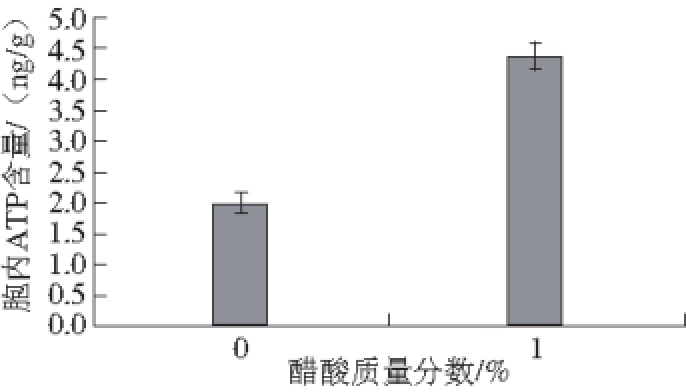
图2 醋酸对巴氏醋杆菌胞内ATP含量的影响
Fig. 2 Effect of acetic acid concentrations on the intracellular ATP concentration of Acetobacter pasteurianus
分析胞内ATP含量发现(图2),与对照相比,初始培养基中添加1.0%醋酸,胞内ATP含量增加了125%。
表1 醋酸对巴氏醋酸杆菌TCA循环代谢途径关键酶表达量的影响
Table1 Effect of acetic acid on the expression levels of the key enzymes related to TCA cycle energy metabolism ofAcetobacter pasteurianus
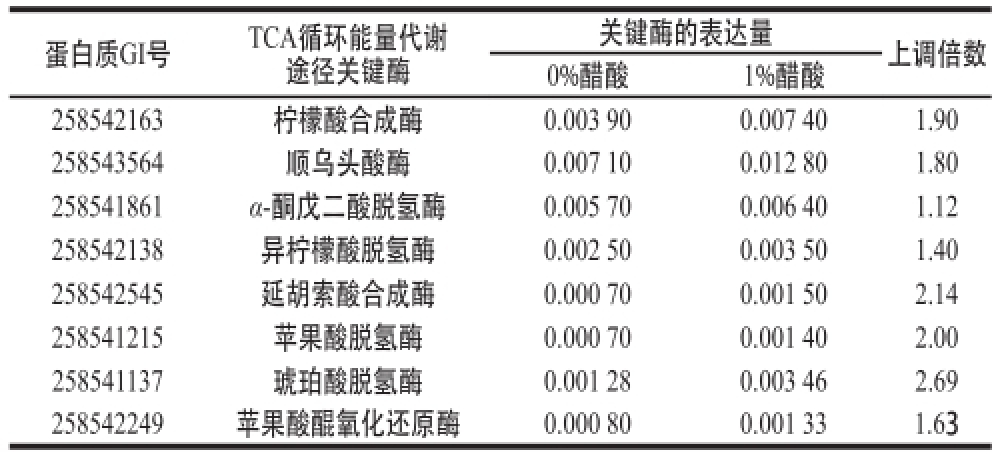
蛋白质GI号TCA循环能量代谢途径关键酶关键酶的表达量上调倍数0%醋酸1%醋酸258542163柠檬酸合成酶0.003 900.007 401.90 258543564顺乌头酸酶0.007 100.012 801.80 258541861α-酮戊二酸脱氢酶0.005 700.006 401.12 258542138异柠檬酸脱氢酶0.002 500.003 501.40 258542545延胡索酸合成酶0.000 700.001 502.14 258541215苹果酸脱氢酶0.000 700.001 402.00 258541137琥珀酸脱氢酶0.001 280.003 46 2.69 258542249苹果酸醌氧化还原酶0.000 800.001 33 1.63
进一步利用蛋白质谱的方法分析了醋酸对菌体TCA循环代谢途径关键酶表达量的影响,从表1可知,当添加1%醋酸时,胞内TCA循环代谢关键酶的表达量出现上调,尤其是顺乌头酸酶、柠檬酸合成酶、延胡索酸合成酶、苹果酸脱氢酶、琥珀酸脱氢酶和苹果酸醌氧化还原酶表达量分别上调至不添加醋酸表达量的1.80、1.90、2.14、2.00、2.69 倍和1.63 倍。
该研究结果与本课题组前期利用生长培养基研究醋酸对菌体生长和代谢的影响结果一致 [12]。醋酸可能通过琥珀酸辅酶A途径 [12,20-21],利用琥珀酸辅酶A将胞内的醋酸转化为乙酰辅酶A,进一步进入TCA循环,强化胞内TCA循环能量代谢,使巴氏醋酸杆菌产生更多的烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)和ATP,满足菌体生长过程中对能量的需求。
2.2 TCA循环抑制剂对巴氏醋杆菌醋酸发酵的影响

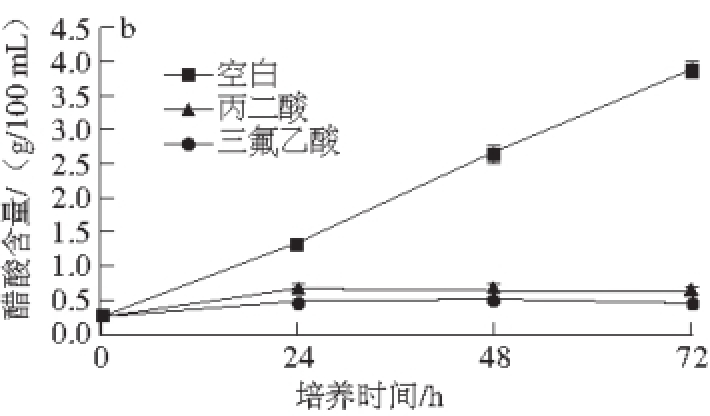
图3 TCA循环抑制剂对巴氏醋酸杆菌醋酸发酵菌体生物量(a)和醋酸含量(b)的影响
Fig. 3 Effect of TCA cycle inhibitors on acetic acid fermentation of Acetobacter pasteurianus
三氟乙酸可以使柠檬酸合成酶失活,它是TCA循环的强抑制剂 [22]。丙二酸作为琥珀酸脱氢酶的竞争性抑制剂抑制TCA循环过程 [23-24]。丙二酸和三氟乙酸对巴氏醋杆菌醋酸发酵的影响如图3所示,巴氏醋杆菌菌体生长和产酸受到显著抑制,菌体生物量分别降低了90%和87%,产酸量分别降低了90%和94%。这是由于丙二酸抑制TCA循环中琥珀酸脱氢酶的活性,阻断延胡索酸和苹果酸的合成;三氟乙酸抑制TCA循环中柠檬酸合成酶的活性,阻断柠檬酸的合成,使TCA循环代谢提供的能量减少,从而使菌体生长和产酸受到抑制。
2.3 能量代谢中间产物对巴氏醋杆菌TCA循环能量代谢的强化及醋酸发酵的影响
由图4可知,添加草酰乙酸、琥珀酸、苹果酸能显著促进菌体生长和产酸,发酵72 h时,菌体生物量分别比空白提高了92%、106%和104%,菌体产酸分别比空白组提高了30%、33%和31%;添加α-酮戊二酸后菌体生物量比空白组提高了51%;添加柠檬酸对菌体生长和产酸均没有影响。
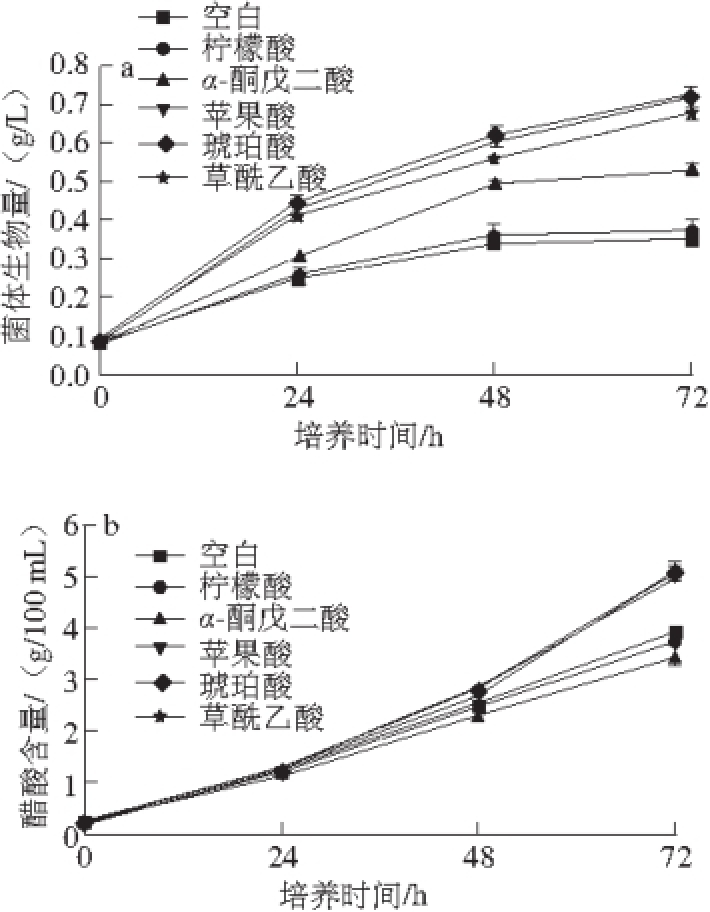

图4 添加能量代谢中间产物对巴氏醋杆菌菌体生长(a)、产酸(b)和胞内ATP含量(c)的影响
Fig. 4 Effect of intermediate metabolites on the cell growth (a), acetic acid accumulation (b) and intracellular ATP concentration (c) of Acetobacter pasteurianus
进一步分析胞内ATP含量发现,发酵24 h时,添加草酰乙酸、琥珀酸、苹果酸后,胞内ATP含量分别比空白组提高了202%、185%和165%;添加α-酮戊二酸后,胞内ATP含量比空白提高了20%;添加柠檬酸对胞内ATP含量没有影响。结果表明添加草酰乙酸、琥珀酸、苹果酸等TCA循环代谢中间产物能够显著提高TCA循环偶联呼吸链产能。添加草酰乙酸可能强化草酰乙酸与乙酰辅酶A在柠檬酸合成酶催化下缩合为柠檬酸的反应,并释放更多辅酶A;添加琥珀酸可能强化了琥珀酸氧化脱氢生成延胡索酸的反应,并释放更多的还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH),经过呼吸链传递最终生成更多的ATP;添加苹果酸可能强化了苹果酸脱氢生成草酰乙酸的反应,并释放更多的NADH,经过呼吸链传递最终生成更多的ATP;添加α-酮戊二酸可能强化了α-酮戊二酸脱羧生成琥珀酰辅酶A,并释放少量的NADH;添加柠檬酸未能提高TCA循环产能,推测原因是TCA循环对柠檬酸的需求量比较少,并且柠檬酸生成顺乌头酸反应未产生NADH [16]。通过TCA循环偶联呼吸链产能的强化,为巴氏醋杆菌菌体生长和产酸提供更多的能量 [15],满足菌体快速生长和适应高酸生存环境对能量的需求,提高菌体对醋酸耐受性 [25],从而提高菌体生物量,进一步提高醋酸发酵效率。
通过添加醋酸、TCA循环抑制剂和中间产物,干扰醋酸菌TCA循环能量代谢,研究巴氏醋杆菌能量代谢对醋酸发酵的影响。添加1%醋酸,巴氏醋杆菌胞内TCA循环代谢关键酶的表达量出现上调,胞内ATP含量增加了125%,表明添加1%醋酸能够强化胞内TCA能量代谢,促进菌体生长。添加丙二酸和三氟乙酸抑制TCA循环能量代谢,减少TCA循环代谢能量供给,巴氏醋杆菌菌体生长和产酸受到显著抑制,菌体生物量分别降低了90%和87%,产酸分别降低了90%和94%。添加0.05%草酰乙酸、琥珀酸、苹果酸,巴氏醋杆菌胞内ATP含量分别提高了202%、185%和165%,表明添加草酰乙酸等中间物质能够显著提高TCA循环偶联呼吸链产能,发酵72 h时,菌体生物量分别提高了92%、106%和104%,菌体产酸分别提高了30%、33%和31%,表明TCA循环能量代谢对巴氏醋杆菌菌体生长和产酸具有显著影响,TCA循环能量代谢的强化对醋酸发酵产生正向作用。
参考文献:
[1] GONZÁLEZ A, MAS A. Differentiation of acetic acid bacteria based on sequence analysis of 16S-23S rRNA gene internal transcribed spacer sequences[J]. International Journal of Food Microbiology, 2011, 147(3): 217-222. DOI:10.1016/j.ijfoodmicro.2011.04.005.
[2] SAICHANA N, MATSUSHITA K, ADACHI O, et al. Acetic acid bacteria: a group of bacteria with versatile biotechnological applications[J]. Biotechnology Advances, 2015, 33: 1260-1271. DOI:10.1016/j.biotechadv.2014.12.001.
[3] CLEENWERCK I, VANDEMEULEBROECKE K, JANSSENS D, et al. Re-examination of the genus Acetobacter, with descriptions of Acetobacter cerevisiae sp. nov and Acetobacter malorum sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52: 1551-1558. DOI:10.1099/ijs.0.02064-0.
[4] CLEENWERCK I, de VOS P. Polyphasic taxonomy of acetic acid bacteria: an overview of the currently applied methodology[J]. International Journal of Food Microbiology, 2008, 125(1): 2-14. DOI:10.1016/j.ijfoodmicro.2007.04.017.
[5] GULLO M, CAGGIA C, de VERO L, et al. Characterization of acetic acid bacteria in “traditional balsamic vinegar”[J]. International Journal of Food Microbiology, 2006, 106(2): 209-212. DOI:10.1016/ j.ijfoodmicro.2005.06.024.
[6] YAMADA Y, YUKPHAN P. Genera and species in acetic acid bacteria[J]. International Journal of Food Microbiology, 2008, 125: 15-24. DOI:10.1016/j.ijfoodmicro.2007.11.077.
[7] ZHENG Yu, ZHANG Keping, WANG Chunxia, et al. Improving acetic acid production of Acetobacter pasteurianus AC2005 in hawthorn vinegar fermentation by using beer for seed culture[J]. International Journal of Food Science and Technology, 2010, 45(11): 2394-2399. DOI:10.1111/j.1365-2621.2010.02413.
[8] 郑宇, 董爱静, 殷海松, 等. 苹果醋发酵营养盐的开发及应用[J]. 中国食品学报, 2014, 15(3): 74-81. DOI:10.16429/j.1009-7848.2015.03.010.
[9] SENGUN I Y, KARABIYIKLI S. Importance of acetic acid bacteria in food industry[J]. Food Control, 2011, 22(5): 647-656. DOI:10.1016/ j.foodcont.2010.11.008.
[10] GULLO M, VERZELLONI E, CANONICO M. Aerobic submerged fermentation by acetic acid bacteria for vinegar production: process and biotechnological aspects[J]. Process Biochemistry, 2014, 49: 1571-1579. DOI:10.1016/j.procbio.2014.07.003.
[11] SAEKI A, TANIGUCHI M, MATSUSHITA K, et al. Microbiological aspects of acetate oxidation by acetic acid bacteria, unfavorable phenomena in vinegar fermentation[J]. Bioscience Biotechnology and Biochemistry, 1997, 61: 317-323. DOI:10.1007/s11626.008.9154.5.
[12] 郑宇, 姜春悦, 陈兴京, 等. 酸对巴氏醋杆菌生长和代谢活性的影响[J]. 现代食品科技, 2014, 30(9): 49-153. DOI:10.13982/ j.mfst.1673-9078.2014.09.025.
[13] NAKANO S, FUKAYA M, HORINOUCHI S. Putative ABC transporter responsible for acetic acid resistance in Acetobacter aceti[J]. Applied and Environmental Microbiology, 2006, 72(1): 497-505. DOI:10.1128/AEM.72.1.497-505.2006.
[14] 王金丹, 张宝善, 李亚武, 等. 醋酸菌耐酸机制的研究进展[J]. 中国酿造, 2014, 33(11): 10-13. DOI:10.11882/ j.issn.0254-5071.2014.11.003.
[15] 亓正良, 杨海麟, 夏小乐, 等. 巴氏醋杆菌高酸度醋发酵过程的能量代谢分析[J]. 微生物学通报, 2013, 40(12): 2171-2181. DOI:10.13344/j.microbiol.china.2013.12.002.
[16] 王镜岩, 朱圣庚, 徐长法. 生物化学: 下[M]. 北京: 高等教育出版社, 2002: 93-113.
[17] 李明达, 赵睿, 姜晓雷, 等. TCA循环中间产物对酿酒酵母胞内代谢关键酶活性的影响[J]. 微生物学通报, 2010, 37(3): 331-335. DOI:10.13344/j.microbiol.china.2010.03.016.
[18] 亓正良, 杨海麟, 夏小乐, 等. 巴氏醋酸杆菌对发酵中醋酸胁迫的生理应答[J]. 微生物学报, 2014, 54(3): 299-308. DOI:10.13343/j.cnki. wsxb.2014.03.007.
[19] WICKRAMASEKARA S, NEILSON J, PATEL N, et al. Proteomics analyses of the opportunistic pathogen Burkholderia vietnamiensis using protein fractionations and mass spectrometry[J]. Journal of Biomedicine and Biotechnology, 2011, 27: 1-10. DOI:10.1155/2011/701928.
[20] MULLINS E A, FRANCOIS J A, KAPPOCK J. A specialized citric acid cycle requiring succinyl-coenzyme A (CoA): acetate CoA-transferase (AarC) confers acetic acid resistance on the acidophile Acetobacter aceti[J]. Journal of Bacteriology, 2008, 190(14): 4933-4940. DOI:10.1128/JB.00405-08.
[21] FUKAYA M, TAKEMURA H, TAYAMA K, et al. The aarC gene responsible for acetic-acid assimilation confers acetic-acid resistance on Acetobacter aceti[J]. Journal of Fermentation and Bioengineering, 1993, 76: 270-275. DOI:10.1016/0922-338X(93)90192-B.
[22] LIU Shuangjiang, STEINBUECHEL A. Production of poly (malic acid) from different carbon sources and its regulation in Aureobasidium pullulans[J]. Biotechnology Letters, 1997, 19(1): 11-14. DOI:10.1023/ A:1018346516211.
[23] LEE B S, MAURER T, KALBITZERH R, et al. β-Poly (L-malate) production by Physarum polycephalum[J]. Applied Microbiology and Biotechnology, 1999, 52(3): 415-420. DOI:10.1007/s002530051540.
[24] 乔长晟, 郑志达, 孟迪, 等. 出芽短梗霉发酵生产聚苹果酸的代谢通量及关键酶活性分析[J]. 现代食品科技, 2014, 30(7): 74-81. DOI:10.13982/j.mfst.1673-9078.2014.07.002.
[25] FUKAYA M, TAKEMURA H, OKUMURA H, et al. Cloning of genes responsible for acetic acid resistance in Acetobacter aceti[J]. Journal of Bacteriology, 1990, 172(4): 2096-2104.
Effects of TCA Cycle Metabolism on the Acetic Acid Fermentation of Acetobacter pasteurianus
YIN Haisong
1,2, ZHANG Renkuan
1, CHANG Yangang
1, ZHENG Yu
1, WANG Min
1,*
(1. Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2. School of Bioengineering, Tianjin Modern Vocational Technology College, Tianjin 300350, China)
Abstract:The most commonly used microorganism for acetic acid fermentation is Acetobacter pasteurianus. In this investigaton, tricarboxylic acid cycle (TCA cycle) energy metabolism in Acetobacter pasteurianus was interfered by adding acetic acid, TCA cycle inhibitors, and intermediate metabolites. The effects of energy metabolism on the cell growth and acetic acid fermentation of Acetobacter pasteurianus were studied. Results showed that addition of 1% acetic acid obviously strengthened intracellular TCA cycle energy metabolism. The expression levels of the key enzymes involved in the intracellular TCA cycle were significantly up-regulated, and intracellular ATP concentration was increased by 125% compared with that without adding acetic acid. TCA cycle energy metabolism was inhibited by adding TCA cycle inhibitors, the cell growth and acetic acid concentration were signif cantly inhibited and bacterial biomass was reduced by 90% and 87%, respectively. Acetic acid concentration was reduced by 90% and 94%, respectively. Addition of 0.05% intermediates metabolites (oxaloacetic acid, malic acid, and succinic acid) increased intracellular ATP concentration by 202%, 185% and 165%, respectively, suggesting signif cantly enhanced TCA cycle-coupled respiratory chain energy metabolism. Bacterial biomass was increased by 92%, 106% and 104% respectively, and acetic acid concentration was increased by 30%, 33% and 31%, respectively, after fermentation for 72 h. Our f ndings show that TCA cycle energy metabolism has a signif cant impact on the bacterial growth and acetic acid production of Acetobacter pasteurianus and that strengthening TCA energy metabolism has a positive effect on acetic acid fermentation.
Key words:Acetobacter pasteurianus; tricarboxylic acid cycle; energy metabolism; acetic acid; ATP concentration
DOI:10.7506/spkx1002-6630-201702013
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2017)02-0082-05
收稿日期:2016-04-01
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102106);“十三五”国家重点研发计划重点专项(2016YFD0400505);教育部“长江学者和创新团队发展计划”项目(RT15R49);国家自然科学基金面上项目(31671851;31471722);天津市科技支撑计划项目(16YFZCNC00650);天津市应用基础及前沿技术研究计划项目(13JCQNJC10000)
作者简介:殷海松(1980—),男,副教授,博士,研究方向为食品发酵技术。E-mail:yinhaisong1980@163.com
*通信作者:王敏(1971—),女,教授,博士,研究方向为食品发酵微生物功能分析与发酵技术。E-mail:minw@tust.edu.cn
引文格式:
殷海松, 张仁宽, 常燕钢, 等. 巴氏醋杆菌TCA循环代谢对醋酸发酵的影响[J]. 食品科学, 2017, 38(2): 82-86.DOI:10.7506/spkx1002-6630-201702013. http://www.spkx.net.cn
YIN Haisong, ZHANG Renkuan, CHANG Yangang, et al. Effects of TCA cycle metabolism on the acetic acid fermentation of Acetobacter pasteurianus[J]. Food Science, 2017, 38(2): 82-86. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702013. http://www.spkx.net.cn