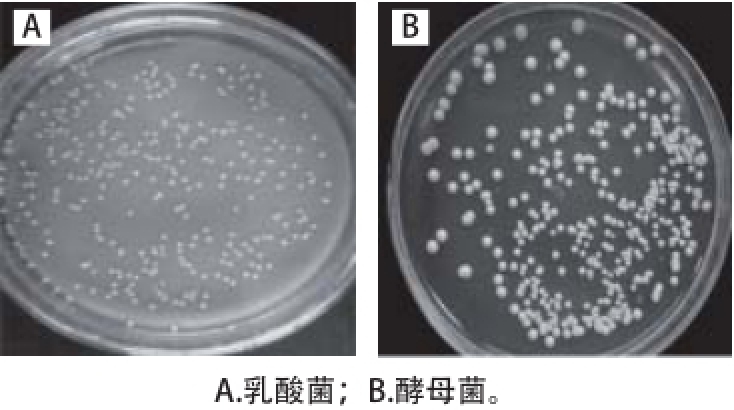
图1 菌落形态
Fig. 1 Colony morphology
曾 林 1,2,刘 波 1,许小艳 1,张 庆 1,2,*,杨 颖 3,卢倩文 1,2,赵婷婷 1,2,唐 洁 1
(1.西华大学食品与生物工程学院,四川省食品生物技术重点实验室,四川 成都 610039;2.西华大学古法发酵(酿造)生物技术研究所,四川 成都 610039;3.山东省食品药品检验研究院,山东 济南 250101)
摘 要:为拓展产γ-氨基丁酸(γ-aminobutyric,GABA)微生物资源,以四川泡菜为分离源,从中分离产GABA的乳酸菌和酵母,并对其GABA表达能力进行评估。通过分离纯化,从四川泡菜中获得了338 株乳酸菌和67 株酵母。采用纸色谱测定,筛选获得12 株乳酸菌和3 株酵母菌具有产GABA的能力。生理生化和系统发育研究揭示12 株乳酸菌分别被鉴定为Lactobacillus acidophilus(占比8.3%)、Lactobacillus fermentum(8.3%)、Lactobacillus kimchii(8.3%)、Lactobacillus suebicus(8.3%)、Lactobacillus brevis(16.7%)、Lactobacillus parafarraginis(8.3%)、Lactobacillus similis(8.3%)、Lactobacillus plantarum(25.2%)和Lactobacillus pentosus(8.3%);3 株酵母中,2 株被鉴定为Saccharomyces cerevisiae;1 株被鉴定为Candida tanzawaensis。进一步采用高效液相色谱对菌株GABA的表达能力评估发现,乳酸菌Lactobacillus plantarum BC114和Lactobacillus brevis BC237发酵产GABA的能力较强,分别达1 720 mg/L和1 080 mg/L;酵母菌Saccharomyces cerevisiae JM037发酵产GABA的能力较强,达670 mg/L。
关键词:γ-氨基丁酸;四川泡菜;微生物;系统发育;表达能力
γ-氨基丁酸(γ-aminobutyric,GABA)是由谷氨酸脱羧生成的一种非蛋白质类氨基酸,广泛存在于微生物、植物和动物中 [1-3]。在脊椎动物中,GABA以一种重要的抑制性神经递质存在于中枢神经系统中 [4-5],具有降低血压、利尿、增强记忆等多种生理功能 [6-8]。目前,获得GABA的方法主要有化学合成、植物富集法和微生物发酵法三大类 [9]。相比而言,化学合成GABA法反应条件复杂、污染大;植物富集法产GABA难度大、含量低;而微生物发酵法产GABA条件温和、安全性好 [10],成为了目前GABA生产的理想方法。然而,优良菌株的缺乏制约了GABA发酵法的进一步发展。因此,如何获取优良菌株成为了开发GABA微生物发酵法的重要任务。
四川泡菜风味独特、营养丰富,具有开胃、健脾、预防高血压等保健功效,是一种深受消费者喜爱的传统蔬菜发酵食品 [11]。在已有报道中,田伟等 [12]利用16S rRNA分析传统四川发酵泡菜中的细菌多样性,Lactobacillus属占88.4%;张先琴等 [13]利用变性梯度凝胶电泳分析四川泡菜中微生物的多样性,细菌中Lactobacillus为优势菌种,真菌中主要为季也蒙毕赤酵母(Meyerozyma guilliermondii)和奥默柯达酵母(Kodamaea ohmeri)的近缘种。这些结果揭示了四川泡菜中主要微生物为乳酸菌和酵母菌,但只关注了四川泡菜中的益生菌对泡菜营养价值的影响,而对其代谢产物在泡菜中的功能性未关注。乳酸菌和酵母是发酵食品中重要的发酵剂,且其中的谷氨酸脱羧酶活性高,具有发酵生产GABA能力 [14]。徐冬云等 [15]从土壤、泡菜、酸奶等样品中分离筛选的一株嗜酸乳酸菌,发酵液中GABA质量浓度达463 mg/L;Diana等 [16]从西班牙奶酪中分离的L. brevis CECT8183,产GABA质量浓度为100 mg/L;但以四川泡菜为源,对产GABA微生物进行系统发育树的构建与表达能力的评估尚未报道。
本实验以四川泡菜为原料,对分离、筛选产GABA的微生物进行生理生化实验及系统发育树的构建,并利用高效液相色谱(high performance liquid chromatography,HPLC)对微生物发酵产GABA的能力进行评估。以期为筛选高产GABA微生物、拓宽产GABA菌种资源提供有效依据,而且对功能性四川泡菜的开发具有重要意义。
1.1 材料与试剂
泡菜液 四川新繁食品有限公司。
L-谷氨酸钠(L-monosodium glutamate,L-MSG,含量≥98.5%) 成都市科龙化工试剂厂;GABA(含量≥99%) 上海金穗生物科技有限公司;丹磺酰氯(dansyl chloride,DNS-Cl),含量≥98%) 成都华夏化学试剂有限公司;其他试剂为分析纯级试剂。
培养基:MRS肉汤和改良MRS琼脂培养基(含0.75 g/100 mL的CaCO 3)均按文献[17]配制,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。
1.2 仪器与设备
Heraues Multifuge X1R冷冻高速离心机 美国Thermo Fisher公司;BHC-1300ⅡA2生物安全柜苏州安泰空气技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿分析仪器有限公司;2695型HPLC仪(配有2998紫外检测器)美国沃特世公司。
1.3 方法
1.3.1 微生物的分离纯化
取泡菜样液25 mL,加入225 mL无菌生理盐水的均质袋中,用拍击式均质器均质5 min。取适量均质液用无菌生理盐水10 倍梯度稀释后涂布于改良MRS培养基和PDA培养基进行分离,于改良MRS培养基中37 ℃条件下倒置培养48 h,于PDA培养基中28 ℃条件下培养72 h。分别挑取单菌落划线纯化3 次。
1.3.2 产GABA微生物的初筛
采用纸色谱定性分析法初筛产GABA微生物。展开剂组分为正丁醇-冰乙酸-水(5∶3∶2,V/V),再添加1.2 g/100 mL茚三酮。以L-MSG标品溶液(5 g/L)和GABA标品溶液(5 g/L)为对照,吸取2 μL发酵液,在滤纸上逐个点样,并编号。再将滤纸在30 ℃恒温条件下展开,展开后将滤纸放入70 ℃烘箱中显色10 min [18]。
1.3.3 生化特征分析
按照《酵母菌的特征与鉴定手册》 [19]和《乳酸细菌分类鉴定及试验方法》 [20]中的鉴定方法进行。
1.3.4 系统发育树的构建
根据X i a n g W e n l i a n g等 [2 1]的方法提取细菌D N A。1 6 S r R N A扩增引物为E u 2 7 F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。扩增条件:95 ℃预变性5 min,95 ℃变性1 min、50 ℃退火1 min、72 ℃延伸2 min,30 个循环后72 ℃延伸10 min。
根据李可 [22]的方法提取真菌DNA。18S rRNA扩增引物:18S-F(5’-AACCTGGTTGATCCTGCCAGT-3’)和18S-R(5’-TGATCCTTCTGCAGGTTCACCTAC-3’)。扩增条件:94 ℃预变性5 min,94 ℃变性1 min、55 ℃退火1 min、72 ℃延伸55 s,36 个循环后72 ℃延伸10 min。
扩增产物连接到pGM-T载体后克隆入感受态细胞大肠杆菌DH5α中,提取重组质粒并对16S rRNA和18S rRNA测序。所得序列提交至NCBI进行BLAST比对,利用MEGA 5.0软件构建系统发育树。
1.3.5 GABA发酵液的制备
纸色谱法初筛得到的产GABA乳酸菌菌株,将其接种到MRS肉汤(含10 g/L L-MSG)中30 ℃条件下静置发酵48 h,将真菌菌株接种到PDA培养基(含10 g/L L-MSG),28 ℃、120 r/min发酵72 h。发酵液于8 000 r/min条件下离心5 min,取上清液,备用。
1.3.6 GABA表达能力评估
利用HPLC对上述菌株产GABA能力进行评估。参照张术聪 [23]的方法对发酵液中GABA进行柱前衍生。HPLC分析条件:色谱柱为岛津-GL INERTSIL ODS-3(4.6 mm×150 mm,5 μm);紫外检测波长254 nm;柱温30 ℃;进样量20 μL;流动相A为甲醇,流动相B为醋酸钠(pH 6.2)-甲醇-四氢呋喃(420∶75∶5,V/V);流速1 mL/min;梯度洗脱时,流动相B比例为:0~6 min,80%~50%;6~9 min,50%~20%;9~10 min,20%~0%;10~11 min,维持0%;11~15 min,返回80%。
2.1 菌株的分离纯化

图1 菌落形态
Fig. 1 Colony morphology
从传统四川泡菜样品中共筛选出338 株乳酸菌菌株,67 株真菌菌株。乳酸菌菌落形态(图1A)多数是圆形或椭圆形,表面光滑,直径多数在1~2 mm。显微镜观察乳酸菌菌体形态为杆状或短杆状,革兰氏染色阳性。真菌菌落形态(图1B)菌落多为乳白色,表面光滑、湿润、黏稠、容易挑起,质地均匀,直径多数为2~5 mm。
2.2 产GABA微生物的初筛结果

图2 菌株发酵液纸色谱图
Fig. 2 Chromatography of the fermentation broths of 15 GABA-producing strains
由图2可知,根据茚三酮显色反应的颜色深度初步判断,利用纸层析方法从获得的338 株乳酸菌和67 株真菌中筛选出12 株乳酸菌和3 株真菌,且发酵底物中L-MSG消耗明显。真菌JM037和乳酸菌BC114发酵液中GABA含量较高。
2.3 菌株的生理生化及系统发育树的构建
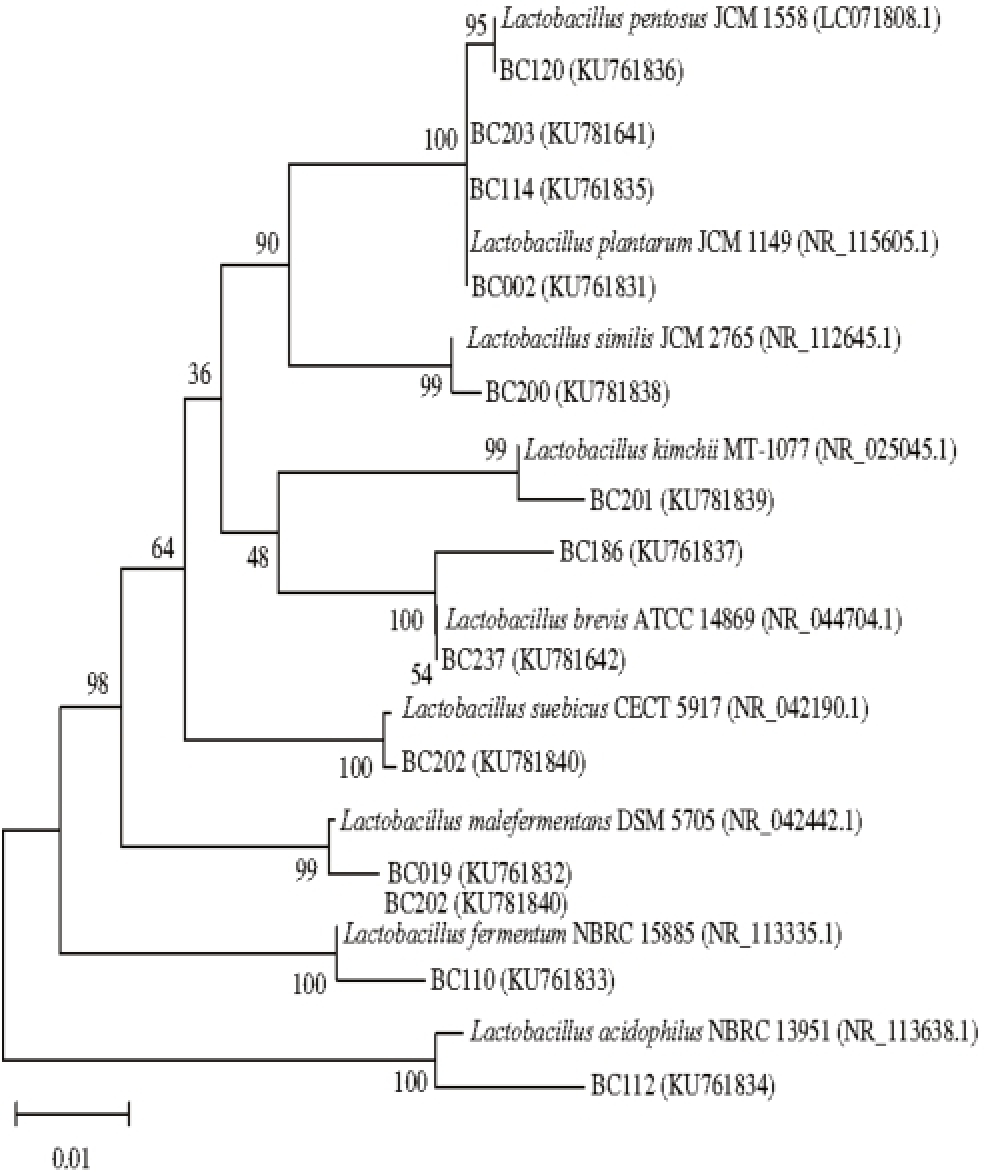
图3 基于乳酸菌16S rRNA基因序列构建的系统发育树
Fig. 3 Phylogenetic tree of lactic acid bacteria based on their 16S rRNA gene sequences

图4 基于酵母菌18S rRNA基因序列构建的系统发育树
Fig. 4 Phylogenetic tree of yeast based on their 18S rRNA gene sequence s
对筛选出的15 株产GABA菌株进行生理生化实验,结果见表1。将产GABA的15 株菌株全部进行测序,测得序列经Mallard 1.02软件检测后,再通过BioEdit 7.0软件检测,无异常序列。Stackbrandt等 [24]认为细菌16S rRNA序列同源性不低于97%可以认为是一个种(真菌序列比对目前无明确判断标准,参照细菌16S rRNA序列比对标准)。因此,15 株菌株分别被鉴定为Lactobacillus acidophilus(1 株)、Lactobacillus fermentum(1 株)、Lactobacillus malefermentans(1 株)、Lactobacillus suebicus(1 株)、Lactobacillus brevis(2 株)、Lactobacillus kimchii(1 株)、Lactobacillus similis(1 株)、Lactobacillus plantarum(3 株)、Lactobacillus pentosus(1 株)、Saccharomyces cerevisiae(2 株)、Candida tanzawaensis(1 株)。这与生理生化实验中糖和醇的利用结果相符。
为了更明确显示各菌株的分类学地位和系统发育关系,选取相似菌株和代表菌株序列,用MEGA 5.0软件以邻接法(Neighbor-Joining)构建系统发育树,结果见图3、4。乳酸菌菌株在系统发育树中基本分为8 个分支:1)菌株BC120、BC203、BC114和BC002与L. pentosus和L. plantarum聚为一个分支,其中BC120与L. pentosus相似度为100%,BC203、BC114、BC002与L. plantarum的相似度为100%;2)菌株BC200与L. similis聚为一个分支,相似度为99%;3)BC201与L. kimchii聚为一个分支,相似度为99%;4)BC186和BC237与L. brevis聚为一个分支,相似度为100%;5)BC202与L. suebicus聚为一个分支,相似度为100%;6)BC019与L. malefermentans聚为一个分支,相似度为99%;7)BC110与L. fermentum聚为一个分支,相似度为99%;8)BC112与L. acidophilus聚为一个分支,相似度为99%。图4显示了所筛选的3 株真菌的分类学地位,JM009和JM037与S. cerevisiae聚为一分支,相似度为100%;JM024与C. tanzawaensis聚为一分支,相似度为99%。
表1 生理生化实验结果
Table1 Results of physiological and biochemical tests

注:+.阳性概率大于等于90%;-.阴性概率大于等于90%;d.阳性概率为11%~89%;N.未检测。
生化特征BC002 BC019 BC110 BC112 BC114 BC120BC186BC200BC201BC202BC203BC237JM009JM024JM037阿拉伯糖d-d-d++d++d+NNN纤维二糖+-d+++-d+d+-NNN果糖+-+++++++-++NNN半乳糖+-++++d+d++d+-+葡糖糖+++++++++++++++乳糖+-++++d---+d+++麦芽糖++++++++++++-+-甘露醇+---++----+----甘露糖+-++++-++-+-NNN蜜二糖+-+d++++--++NNN棉籽糖+-+d++dd--+d+-+鼠李糖-----d------+++核糖+++-+++-+-++NNN山梨醇+---++----+----蔗糖+-++++d++-++-+-海藻糖+-dd++-++-+-+++木糖d-d-d+dd+-dd--d
2.4 GABA表达能力评估

图5 菌株发酵液中GABA质量浓度
Fig. 5 GABA concentrations in the fermentation supernatants of the 15 isolates
利用HPLC对菌株产GABA能力进行评估。其标准曲线为Y=9×10 6X-18 007(R 2=0.999 2),可用于菌株发酵液中的GABA定量分析。15 株菌株GABA高效液相定量结果如图5所示。菌株发酵液中GABA质量浓度为280~1 720 mg/L,其中乳酸菌中菌株BC114(L. plantarum)和菌株BC237(L. brevis)发酵产GABA质量浓度较高,分别达1 720 mg/L和1 080 mg/L。周青等 [25]从泡菜中筛选到一株植物乳杆菌,发酵液中GABA质量浓度达1 261 mg/L,并通过正交试验优化发酵条件及其培养基成分,发酵液中GABA产量提高了79%。因此,菌株BC114发酵生产GABA更具有优势,下一步可对其进行发酵条件及其培养基成分的优化,提高该菌株产GABA的能力。真菌中菌株JM037(S. cerevisiae)发酵产GABA质量浓度最高,达670 mg/L,是在四川泡菜中首次分离筛到具有产GABA能力的酿酒酵母菌株,可进一步通过酒精发酵能力实验探讨其在功能性果酒酿造中的应用。
从传统四川泡菜中分离筛选出338 株乳酸菌、67 株真菌,利用纸色谱分析法初筛得到具有产GABA能力的12 株乳酸菌和3 株真菌。经鉴定12 株乳酸菌为Lactobacillus属,分别被鉴定为L. acidophilus(占比8.3%)、L. fermentum(8.3%)、L. kimchii(8.3%)、L. suebicus(8.3%)、L. brevis(16.7%)、L. parafarraginis(8.3%)、L. similis(8.3%)、L. plantarum(25.2%)和L. pentosus(8.3%),3 株真菌中2 株为S. cerevisiae、1 株为C. tanzawaensis。并对其GABA表达能力进行了评估,结果显示,菌株发酵液中GABA质量浓度为280~1 720 mg/L。其中,菌株BC114(L. plantarum)发酵液中GABA质量浓度高达1 720 mg/L。该研究结果不仅扩宽了产GABA菌株资源,为高产GABA微生物的筛选提供有效依据,而且对指导富含GABA功能性泡菜的生产具有重要的理论和实践意义。
参考文献:
[1] DIANA M, QUILEZ J, RAFECAS M. Gamma-aminobutyric acid as a bioactive compound in foods: a review[J]. Journal of Functional Foods, 2014, 10: 407-420. DOI:10.1016/j.jff.2014.07.004.
[2] SHIMAJIRI Y, OZAKI K, KAINOU K, et al. Differential subcellular localization, enzymatic properties and expression patterns of γ-aminobutyric acid transaminases (GABA-Ts) in rice (Oryza sativa)[J]. Journal of Plant Physiology, 2013, 170: 196-201. DOI:10.1016/ j.jplph.2012.09.007.
[3] LEE B J, KIM J S, KANG Y M, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122: 271-276. DOI:10.1016/ j.foodchem.2010.02071.
[4] ROSA S G, QUINES C B, STANGHERLIN E C, et al. Diphenyl diselenide ameliorates monosodium glutamate induced anxiety-like behavior in rats by modulating hippocampal BDNF-Aktath way and uptake of GABA and serotonin neurotransmitters[J]. Physiology and Behavior, 2016, 155(1): 1-8. DOI:10.1016/j.physbeh.2015.11.038.
[5] van DUNG PHAM, LEE S H, PARK S J, et al. Production of gamma-aminobutyric acid from glucose by introduction of synthetic scaffolds between isocitrate dehydrogenase, glutamate synthase and glutamate decarboxylase in recombinant Escherichia coli[J]. Journal of Biotechnology, 2015, 207(10): 52-57. DOI:10.1016/ j.jbiotec.2015.04.028.
[6] UNICHENKO P, KIRISCHUK S, LUHMANN H J. GABA transporters control GABAergic neurotransmission in the mouse subplate[J]. Neuroscience, 2015, 304: 217-227. DOI:10.1016/ j.neuroscience.2015.07.067.
[7] CALIXTO E. GABA withdrawal syndrome: GABA Areceptor synapse, neurobiological implications and analogies with other abstinences[J]. Neuroscience, 2016, 313: 57-72. DOI:10.1016/ j.neuroscience.2015.11.021.
[8] PAINE T A, COOKE E K, LOWES D C. Effects of chronic inhibition of GABA synthesis on attention and impulse control[J]. Pharmacology, Biochemistry and Behavior, 2015, 135: 97-104. DOI:10.1016/ j.pbb.2015.05.019.
[9] 刘佳荣. 微生物发酵合成γ-氨基丁酸(GABA)的研究[D]. 哈尔滨: 哈尔滨商业大学. 2015: 3-5.
[10] 何梦秀, 陈芳艳, 钟杨生, 等. γ-氨基丁酸富集方法的研究进展[J]. 安徽农业科学, 2015, 43(15): 15-17. DOI:10.3969/ j.issn.0517-6611.2015.15.007.
[11] 张良, 向文良, 曾泽生, 等. 四川泡菜乳酸发酵菌剂的研究[J]. 食品科学, 2013, 34(19): 200-206. DOI:10.7506/spkx1002-6630-201319042.
[12] 田伟, 张琪, 刘森, 等. 利用16S rRNA分析传统四川发酵泡菜中的细菌多样性[J]. 食品科学, 2013, 34(17): 215-218. DOI:10.7506/ spkx1002-6630-201317046.
[13] 张先琴, 张小平, 敖晓琳, 等. PCR-DGGE分析四川地区家庭制作泡菜中微生物多样性[J]. 食品科学, 2013, 34(12): 129-134. DOI:10.7506/spkx1002-6630-201312027.
[14] 李海星. 短乳杆菌CCTCCM 208054生物转化制备γ-氨基丁酸及其GAD系统关键基因分析[D]. 南昌: 南昌大学, 2012: 9.
[15] 徐冬云, 周立平, 童振宇, 等. 产γ-氨基丁酸乳酸菌的分离筛选[J]. 现代食品科技, 2006, 22(3): 59-64. DOI:10.3969/j.issn.1673-9078.2006.03.018. [16] DIANA M, TRES A, QUILEZ J, et al. Spanish cheese screening and selection of lactic acid bacteria with high gamma-aminobutyric acid production[J]. Journal of Food Science and Technology, 2014, 56(2): 351-355. DOI:10.1016/j.lwt.2013.11.027.
[17] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 85-86.
[18] 黄俊. 利用短乳杆菌制备γ-氨基丁酸相关过程研究[D]. 杭州: 浙江大学, 2006: 26-37.
[19] BARNETT J A, PAYNE R W, YARROW D, et al. Yeasts: characteristics and identification[M]. 2nd ed. Cambridge: Cambridge University Press, 1990: 426-476.
[20] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 289-292.
[21] XIANG Wenliang, LIANG Huazhong, LIU Sen, et al. Isolation and performance evaluation of halo tolerant phosphate solubilizing bacteria from the rhizospheric soils of historic Dagong Brine Well in China[J]. World Journal of Microbiology and Biotechnology, 2011, 27(11): 2629-2637. DOI:10.1007/s11274-011-0736-0.
[22] 李可. 中国浓香型白酒发酵黄水中微生物群落结构及多样性解析[D].成都: 西华大学, 2014: 14-22.
[23] 张术聪. 因定化植物乳杆菌合成γ-氨基丁酸及分离纯化的初步研究[D].无锡: 江南大学, 2010: 8-21.
[24] STACKEBRANDT E, GEBEL B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. International Journal of Systematic Bacteriology, 1994, 44(4): 846-849. DOI:10.1099/00207713-44-4-846.
[25] 周青, 魏春, 应向贤, 等. 产γ-氨基丁酸乳酸菌的筛选及发酵过程研究[J]. 食品与发酵工业, 2011, 37(5): 26-31. DOI:10.13995/ j.cnki.11-1802/ts.2011.05.023.
Phylogeny and Performance Assessment of γ-Aminobutyric Acid-Producing Microorganisms from Sichuan Pickles
ZENG Lin
1,2, LIU Bo
1, XU Xiaoyan
1, ZHANG Qing
1,2,*, YANG Ying
3, LU Qianwen
1,2, ZHAO Tingting
1,2, TANG Jie
1
(1. Provincial Key Laboratory of Food Biotechnology of Sichuan, College of Food and Bioengineering, Xihua University, Chengdu 610039, China; 2. Biotechnology Institute of Ancient Brewing, Xihua University, Chengdu 610039, China; 3. Shandong Institute for Food and Drug, Jinan 250101, China)
Abstract:In order to broaden and evaluate microbial resources for producing γ-aminobutyric acid (GABA), lactic acid bacteria and yeast strains with the ability to produce GABA were isolated, screened and identif ed from Sichuan pickles. A total of 338 strains of lactic acid bacteria and 67 strains of yeast were initially isolated from Sichuan pickles. Further, 12 strains of lactic acid bacteria (LAB) and 3 strains of yeast which could produce GABA were screened out by paper chromatography. Then the 12 LAB strains were identif ed as Lactobacillus acidophilus (8.3%), Lactobacillus fermentum (8.3%), Lactobacillus kimchii (8.3%), Lactobacillus suebicus (8.3%), Lactobacillus longer (16.7%), Lactobacillus parafarraginis (8.3%), Lactobacillus similis (8.3%), Lactobacillus plantarum (25.2%) and Lactobacillus pentosus (8.3%), while the 3 yeast strains were identif ed as two strains of Saccharomyces cerevisiae and one strain of Candida tanzawaensis using physiological and biochemical tests and phylogenetic analysis. The GABA-producing ability of these selected strains was further assessed by high-performance liquid chromatography (HPLC). Our results indicated that Lactobacillus plantarum BC114, Lactobacillus brevis BC237 and Saccharomyces cerevisiae JM037 showed higher GABA-producing capability, and the cultured broth supernatants contained 1 720, 1 080 and 670 mg/L GABA, respectively.
Key words:γ-aminobutyric acid; Sichuan pickles; microorganism; phylogeny; performance assessment
DOI:10.7506/spkx1002-6630-201702014
中图分类号:TQ920.6
文献标志码:A
文章编号:1002-6630(2017)02-0087-05
收稿日期:2016-03-01
基金项目:教育部春晖计划项目(Z2014060);四川省应用基础项目(2016JY0253);四川省大学生创新训练项目(201510623081);西华大学研究生创新基金项目(YCJJ2016048)
作者简介:曾林(1992—),男,硕士研究生,研究方向为食品微生物技术。E-mail:18202837933@163.com
*通信作者:张庆(1979—),男,副教授,博士,研究方向为食品微生物技术。E-mail:biozhangq@163.com
引文格式:
曾林, 刘波, 许小艳, 等. 四川泡菜中产γ-氨基丁酸微生物的系统发育与表达能力评估[J]. 食品科学, 2017, 38(2): 87-91.DOI:10.7506/spkx1002-6630-201702014. http://www.spkx.net.cn
ZENG Lin, LIU Bo, XU Xiaoyan, et al. Phylogeny and performance assessment of γ-aminobutyric acid-producing microorganisms from Sichuan pickles[J]. Food Science, 2017, 38(2): 87-91. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201702014. http://www.spkx.net.cn