表 1 Plackett-Burman试验设计因素与水平
Table 1 Coded and actural values of independent variables used in Plackett-Burman design
韦 涛,周启静,陆兆新,吕凤霞,别小妹,张 充,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:为提高小米糠蛋白资源的利用率,为小 米糠的深加工提供参考,采用纳豆芽孢杆菌对小米糠进行固态发酵以获得小米糠抗氧化肽。在单因素试验的基础上以小米糠发酵后水提液的总抗氧化能力(total antioxidant capacity,T-AOC)为指标,使用Plackett-Burman试验对发酵条件进行筛选,然后使用响应面法对发酵条件进行优化,并测定优化后小米糠水提液的多肽含量和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力。结果显示最适发酵条件为:小米糠平均粒径0.22 mm(60~80 目)、菌液接种量0.4 mL(约108CFU/mL)、初始pH 6.7、发酵时间26 h、发酵温度35 ℃。此条件下小米糠固态发酵后提取液的T-AOC实际值为(344.51±8.02)U/g小米糠,多肽提取量为(68.37±0.92)mg/g小米糠,清除DPPH自由基IC50为0.12 mg/mL。该研究表明,小米糠固态发酵条件经过优化后能够获得具有较高抗氧化能力的生物活性肽。
小米糠是小米加工过程中的副产物,由谷壳、种皮、糊粉层和胚芽组成。我国有丰富的小米糠资源,据农业部统计,2012年全国小米的种植面积约140万 hm2,小米糠年产量约为40万 t。小米糠中蛋白质含量为13%左右,且小米糠蛋白质具有低过敏性和必需氨基酸种类多等特点,是一种营养价值较高的蛋白质[1]。
近年来,对大米糠的研究逐渐增多,但对小米糠的基础研究还处于起步阶段,主要集中在小米糠油脂[2-3]、膳食纤维[4]、植酸[5]、蛋白[6-7]和多肽[8-9]等方面,其中小米糠多肽的制备大多为酶法制备,对于固态发酵法制备小米糠多肽还十分罕见。固态发酵法是指利用自然底物做碳源及能源,在没有或基本没有游离水的固态基质上的发酵方式。此法具有占用空间小、用水量少、能耗低和不易染杂菌等优点[10]。目前,固态发酵法已成为生物活性肽制备的常用方法,如Coda[11]、He Rong[12]、彭惠惠[13]、Amadou[14]、Wu Wanxing[15]等分别通过固态发酵谷物粉、菜籽粕、芝麻粕、小米粉和核桃粕等得到了具有抗氧化能力的多肽。大量文献[16-19]报道,大米糠生物活性肽具有较佳的抗氧化能力,主要表现在还原能力和自由基清除能力等方面。根据郭利娜等[8]研究发现,小米糠生物活性肽也具有较佳的抗氧化能力。鉴于固态发酵法的优点,将固态发酵法应用于小米糠抗氧化肽的制备,对提高小米糠蛋白资源的利用率十分有意义。
固态发酵培养基中添加一定的营养物质可以给菌体提供一个合适的生长环境,促进次级代谢产物的合成[10]。周建新等[20]研究了培养基组成对黑曲霉固态发酵陈化籼稻谷生产柠檬酸过程的影响,发现在培养基中添加适量麸皮、碳酸钙和硝酸铵有助于柠檬酸的产生。本实验所用固态发酵培养基中的组成成分均为预实验所得最佳添加量,有利于提高小米糠提取液的抗氧化能力。除培养基组成外,在固态发酵过程中,还存在很多其他影响因素,其中pH值和发酵时间对发酵过程中微生物的生长和酶的活力具有显著影响[21]。Schmidt等[22]研究了米糠平均粒径和硫酸铵添加量对米糠固态发酵的影响,米糠平均粒径为0.18 mm,盐溶液中硫酸铵质量浓度为8 g/L时,与没有发酵的米糠相比,蛋白和酚类物质的含量分别提高了53%和65%。Wu Wanxing等[15]研究发现发酵时间和接种量对核桃粕的固态发酵产抗氧化肽具有显著影响,且两因素之间交互作用非常显著(P<0.01)。
本研究拟以纳豆芽孢杆菌NattoD-3为发酵菌株,利用廉价且营养丰富的小米糠作为基本基质进行固态发酵,重点考察菌液接种量、发酵时间、发酵温度、初始pH值和发酵基质粒径5 个因素对发酵后小米糠水提液的总抗氧化能力的影响规律。在单因素试验的基础上,以总抗氧化能力(total antioxidant capacity,T-AOC)为评价指标,设计了Plackett-Burman试验和响应面试验对固态发酵条件进行优化,并测定优化后多肽提取量和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力。提高小米糠蛋白资源的利用率,为小米糠深加工、保健食品或天然抗氧化剂的开发提供参考。
1.1 材料与试剂
纳豆芽孢杆菌NattoD-3,由南京农业大学食品科技学院酶工程实验室保存;新鲜米糠购于山西省,正己烷脱脂处理,-18 ℃保存;DPPH 美国Sigma公司;T-AOC测定试剂盒 南京建成生物技术公司;福林-酚试剂和培养基均为分析纯由国药集团提供。
1.2 仪器与设备
AY120电子天平、UV-2450紫外-可见分光光度计日本Shimadzu公司;SX-700高压灭菌锅 日本Tomy公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;DRP-9162型电热恒温培养箱 上海森信实验仪器有限公司;GZX-9240MBE电热鼓风干燥箱上海博讯实业有限公司医疗设备厂;SB-5200DT超声波清洗机 宁波新芝生物科技股份有限公司;5804R冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 培养基、菌种活化和抗氧化肽粗提液的制备
NA培养基:牛肉浸膏3.00 g/L、鱼粉蛋白胨10.00 g/L、NaCl 5.00 g/L,pH 7.0,121 ℃灭菌20 min。
固态发酵培养基:脱脂小米糠5.0 0 g、NH2CONH20.10 g、K2HPO4·3H2O 0.02 g、蒸馏水6.00 mL,自然pH值。115 ℃灭菌30 min。
将安瓿管中菌种接入装有100 mL NA培养 基的锥形瓶中,八层纱布封口,置于空气摇床中扩大培养,37 ℃、180 r/min培养20 h,使菌种活化。将在NA培养基中活化好的菌悬液接入已灭菌固态发酵培养基中,混合均匀,放入37 ℃电热恒温培养箱,每 隔12 h摇晃锥形瓶通气,培养24 h后,将小米糠转移至培养皿,放入60 ℃电热鼓风干燥箱烘干至质量恒定,冷却至室温,精确称取烘干后小米糠1.000 g置于25 mL试管中,加入10 mL蒸馏水,于30 ℃超声波清洗仪中超声提取30 min,然后转移上清液至离心管中10 000×g离心10 min,取上清液,通过0.45 μm滤膜,即得到抗氧化肽粗提液,待测,各实验重复3 次。
1.3.2 小米糠固态发酵条件的单因素试验
分别研究接种量(0、0.2、0.4、0.6、0.8、1.0 mL)(约108CFU/mL)、初始pH值(5.0、6.0、7.0、8.0、9.0、10.0)、发酵温度(25、28、30、34、37、40 ℃)、发酵时间(0、12、24、36、48、60、72 h)、平均粒径(0.17、0.22、0.34、0.64、1.43 mm)对小米糠固态发酵的影响。根据小米糠抗氧化肽粗提液的T-AOC确定较佳的发酵条件。各实验重复3 次,取平均值。
1.3.3 Plackett-Burman试验设计
使用Design-Expert v8.0.6软件设计N12的Plackett-Burman试验。以T-AOC为评价指标,对影响发酵的5 个因素进行筛选,即接种量(X1)、初始pH值(X3)、发酵温度(X5)、发酵时间(X7)、平均粒径(X9),另外添加6 个虚拟因素(X2、X4、X6、X8、X10、X11),每个因素分别设有高水平和低水平两个水平,分别用1、-1表示,高水平为单因素试验的最佳值,且高水平约为低水平的1.33 倍。试验设计因素与水平见表1。
表 1 Plackett-Burman试验设计因素与水平
Table 1 Coded and actural values of independent variables used in Plackett-Burman design

1.3.4 响应面优化试验设计
根据Box-Behnken设计原理,综合单因素试验和Plackett-Burman试验的结果,以T-AOC为响应值,选取对固态发酵产抗氧化物影响较为显著的初始pH值、发酵温度和发酵时间3 个因素设计三因素三水平的Box-Behnken响应面试验,分别以1、0、-1代表自变量的高、中、低3 个水平,对自变量进行编码。响应面分析试验共17 个试验点,其中析因部分试验次数为12 次,中心点重复试验5 次。固定其他条件:培养基中小米糠5.00 g(平均粒径0.22 mm)、NH2CONH20.10 g、K2HPO4·3H2O 0.02 g、蒸馏水6.00 mL、菌液接种量0.4 mL。
1.3.5 多肽含量测定
取3 mL样品溶液,加入3 mL 10 g/100 mL三氯乙酸(trichloroacetic acid,TCA)溶液,混合均匀,室温静置30 min,10 000×g离心10 min,取上清液备用。根据池宁娟等[23]报道的福林-酚法测定,取上清液1 mL,加入1 mL碱性铜溶液和4 mL福林-酚试剂,混合均匀后,于55 ℃水浴5 min,取出冷水浴10 min,然后测定650 nm波长处吸光度。各实验重复3 次,取平均值。
精确配制0、0.1、0.2、0.3、0.4 mg/mL和0.5 mg/mL的牛血清白蛋白标准品溶液,按照福林-酚法测定反应后的吸光度。以牛血清白蛋白标准品的质量浓度为横坐标,650 nm波长处的吸光度为纵坐标,以0 mg/mL样品反应液调零,制作标准曲线,获得回归方程y=0.620 6x-0.003 9(R2=0.994 8)。
1.3.6 抗氧化活力测定
1.3.6.1 T-AOC测定
根据T-AOC试剂盒的方法测定。抗氧化物质能将Fe3+还原为Fe2+,而Fe2+能与菲啉类物质形成稳固的络合物,在520 nm波长处通过比色测出其抗氧化能力的高低。定义37 ℃为每分钟每毫升抗氧化物质使反应体系的吸光度(A)每增加0.01时,为一个总抗氧化活性单位(U)。各实验重复3 次,取平均值。计算公式(1)如下:
式中:A1为样品吸光度;A0为对照吸光度;V1为反应液总体积,3.7 mL;V0为取样量,0.1 mL;m为稀释倍数,本实验中为10,表示每克小米糠加入10 mL蒸馏水提取。
1.3.6.2 DPPH自由基清除能力的测定
根据Torres-Fuentes等[24]的方法稍作修改测定,取样品溶液2 mL,加入2 mL 0.1 mmol/L DPPH的95%乙醇溶液,混合摇匀,室温避光反应30 min。用紫外分光光度计在517 nm波长处测定吸光度。各实验重复3 次,取平均值。样品对DPPH自由基清除能力计算公式(2)如下:
式中:Aa为样品吸光度;Ab为空白组(用等量的95%乙醇溶液代替DPPH溶液)吸光度;Ac为对照组(用等量的95%乙醇溶液代替样品)吸光度。
IC50表示DPPH自由基清除率为50%时抗氧化肽的质量浓度(mg/mL)。调整发酵液中小米糠多肽为0、0.1、0.2、0.3、0.4、0.5 mg/mL和0.6 mg/mL,分别测定其DPPH自由基清除率,通过Microsoft Excel 2007软件拟合得到小米糠抗氧化肽质量浓度和DPPH清除率关系的多项式,即可求得IC50值。
1.4 数据处理
全部数据采用Microsoft Excel 2007软件进行统计,计算平均值和标准差,单因素试验中Duncans多重差异显著性分析使用SPSS Statistics 17.0软件,作图使用OriginPro 8.5软件,Plackett-Burman试验设计和响应面优化试验设计、分析及作图使用Design-Expert v8.0.6软件。
2.1 小米糠固态发酵条件的单因素试验结果
2.1.1 接种量对T-AOC的影响
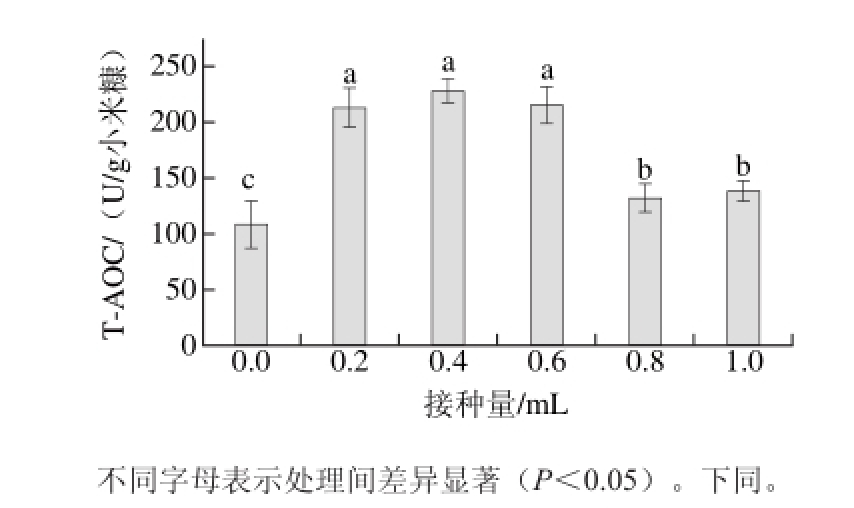
图 1 接种量对T-AOC的影响
Fig. 1 Effect of inoculum size on T-AOC
自然pH值、发酵温度37 ℃、发酵时间24 h条件下测定接种量的影响,从图1可知,发酵后的小米糠提取液T-AOC显著高于未发酵(接种量为0 mL)的小米糠提取液(P<0.05)。随着接种量的增加,T-AOC呈现出先增加,后降低的趋势,接种量为0.4 mL时,T-AOC最大为(227.90±11.30)U/g小米糠。接种量的大小对发酵产物的生产效率具有显著影响,接种量过大会导致供氧不足,影响产物合成;过小会延长培养时间,降低发酵的生产率。本研究中由于发酵时间较短,接种量小于
0.4 mL时,菌体数量较少,分泌的蛋白酶不足,对小米糠基质中蛋白质的分解不充分,产生的抗氧化肽较少,接种量大于0.4 mL时,随着接种量的增加,抗氧化能力逐渐降低,可能是因为菌浓度过大,供氧不足,产酶量减少,故在本研究发酵时间较短的条件下,选择接种量为0.4 mL比较合理。武万兴等[25]研究接种量对核桃粕固态发酵产抗氧化肽的影响时,发现随着接种量的增高,多肽提取量先增加后降低,接种量为5.5%时有最大值,与本研究变化趋势一致。
2.1.2 初始pH值对T-AOC的影响
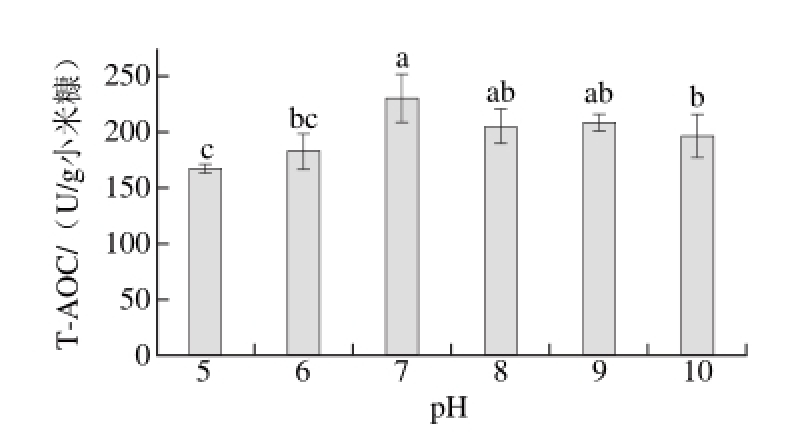
图 2 初始pH值对T-AOC的影响
Fig. 2 Effect of initial pH on T-AOC
pH值主要通过影响菌体膜渗透性以及物质离子化程度,以至 于影响纳豆芽孢杆菌对养分的吸收和蛋白酶的产生[26]。调节菌液接种量0.4 mL,其他条件同2.1.1节,发酵后测定T-AOC。从图2可知,随着盐溶液pH值的逐渐升高,T-AOC呈现出先增加后降低的趋势,pH 7.0时最大,此时,T-AOC为(230.37±20.5)U/g小米糠。发酵培养基的自然pH值约为9左右,而纳豆芽孢杆菌的最适生长pH值为7.0左右,强酸强碱条件都不利于菌体的生长和代谢,影响酶的合成,从而影 响产物的抗氧化能力。本研究结果与祁红兵等[26]以用纳豆芽孢杆菌固态发酵麸皮产抗氧化物类似,最适初始pH值均为7.0。
2.1.3 发酵温度对T-AOC的影响
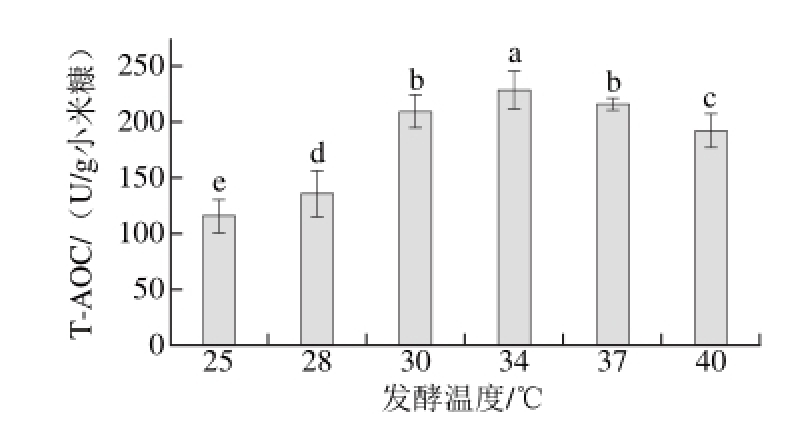
图 3 发酵温度对T-AOC的影响
Fig. 3 Effect of fermentation temperature on T-AOC
温度对纳豆芽孢杆菌的生长代谢产生显著影响,在适宜的发酵温度条件下,微生物生长代谢活跃,产酶量高,从而有利于抗氧化肽的产生。调节初始pH 7.0,其他条件同2.1.2节,发酵后测定T-AOC。从图3可知,随着发酵温度的逐渐升高,T-AOC呈先增加后下降的趋势,34 ℃时最高,此时T-AOC为(228.58±16.79)U/g小米糠,34 ℃为较佳发酵温度。根据纳豆芽孢杆菌的生长特性可知,纳豆芽孢杆菌的最适生长温度为37 ℃左右。但有研究显示菌体的最适生长温度与最适发酵温度不一定相同[10]。例如,Mahanama等[27]通过响应面法优化纳豆芽孢杆菌固态发酵大豆粉后得到的最佳发酵温度为35 ℃。温度过低时,纳豆芽孢杆菌生长和代谢均比较缓慢,短时间内分泌的蛋白酶少,导致抗氧化肽含量少,抗氧化能力低。随着温度的升高,菌体的生长代谢均逐渐增加,分泌的蛋白酶也逐渐增加,抗氧化肽含量也随之增多,抗氧化能力上升。但温度过高时,并不利于菌体的生长代谢,反而导致菌体衰老快,发酵产物抗氧化能力降低。本研究发酵时间较短,34 ℃表现为纳豆芽孢杆菌在短时间内生长与发酵产生抗氧化肽的最适温度,与吴永沛等[28]报道的枯草芽孢杆菌固态发酵大豆粕产抗氧化肽的最适温度33.7 ℃相似。
2.1.4 发酵时间对T-AOC的影响
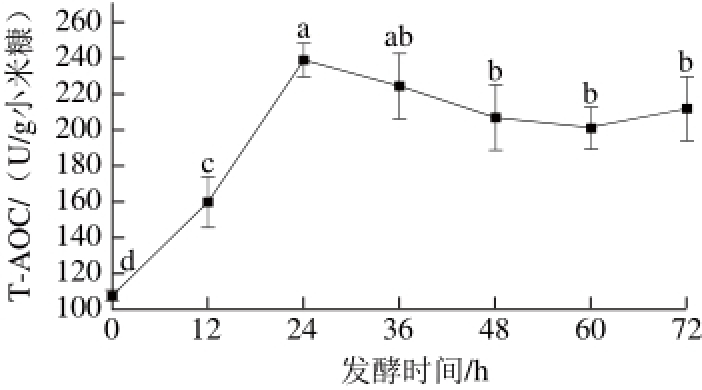
图 4 发酵时间对T-AOC的影响
Fig. 4 Effect of fermentation time on T-AOC
发酵时间的长短对纳豆芽孢杆菌的数量影响十分显著,进而影响小米糠蛋白的分解。设置发酵温度为34 ℃,其他条件同2.1.3节,发酵后测定T-AOC。从图4可知,随着发酵时间的延长,T-AOC呈现先增加后降低的趋势,发酵24 h时T-AOC最大为(239.68±9.25)U/g小米糠。发酵开始时,随着发酵时间的延长,菌体数量逐渐增多,分泌的蛋白酶也逐渐增多,小米糠蛋白被分解为抗氧化肽,故抗氧化能力逐渐增强,发酵时间超过24 h后,抗氧化能力出现降低的趋势,可能是由于菌体数量过多,产生的蛋白酶也逐渐增多,抗氧化肽被进一步的分解为更小的肽或氨基酸[8]。其变化趋势与武万兴等[25]研究核桃粕固态发酵产抗氧化肽类似,但最佳发酵时间24 h比核桃粕发酵所用时间短,这可能是由于小米糠中蛋白质含量比核桃粕低导致。
2.1.5 平均粒径对T-AOC的影响
固态发酵基质的粒径对菌体发酵有显著影响,用于固态发酵的小米糠粒径需要控制在一个合适的范围。为了优化固态发酵所使用小米糠的平均粒径,通过使用10、20、40、60、80、100 目的筛网分别筛分出平均粒径为0.17、0.22、0.34、0.64、1.43 mm的小米糠用于发酵,筛网的孔径和小米糠的平均粒径如表2所示。固态发酵的时间为24 h,其他条件同2.1.4节,发酵后测定T-AOC。
表 2 筛网的孔径和小米糠的平均粒径
Table 2 Mesh size and corresponding average particle size of millet bran
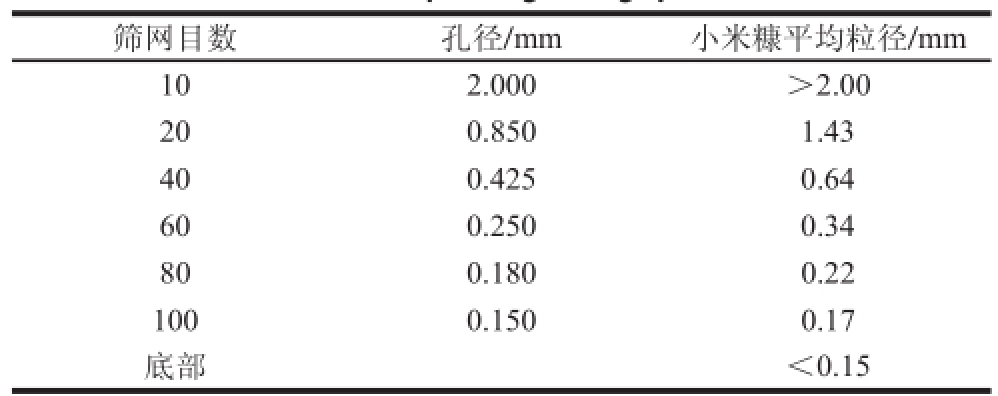
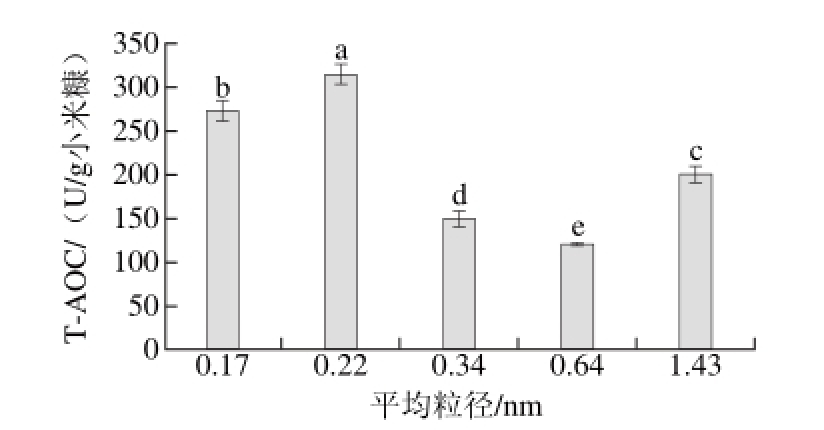
图 5 平均粒径对T-AOC的影响
Fig. 5 Effect of average particle diameter on T-AOC
从图5可以看出,随着平均粒径的逐渐增加,T-AOC先增加后降低,平均粒径为0.22 mm时最大,T-AOC为(313.68±11.45) U/g小米糠,即60~80 目筛网之间的颗粒度最适宜。小的粒径可以提供一个相对大的表面积,有助于发酵过程中热量传递与气体的流通,也有利于菌体对小米糠中营养物质的充分利用,但粒径过小,容易导致小米糠结团,不利于发酵过程中热量传递与气体的流通;粒径过大,导致相对表面积偏小,不利于纳豆芽孢杆菌对小米糠中营养物质的充分利用[10]。国外学者Asadi等[29]阐述了影响霉菌固态发酵产单细胞油脂中脂肪酸组成的因素,包括培养基和培养条件两个方面,其中发酵基质粒径就是影响因素之一。Schmidt等[22]的研究报道,米糠粒径的大小对菌体的生长有显著影响,发现平均粒径为0.28 mm的米糠用于发酵时,得到的生物量较大。
2.2 Plackett-Burman试验结果及方差分析
表 3 Plackett-Burman试验设计及结果
Table 3 Plackett-Burman design with experimental results

表 4 Plackett-Burman设计试验结果方差分析
Table 4 Analysis of variance of the experiment results from Plackett-Burman design
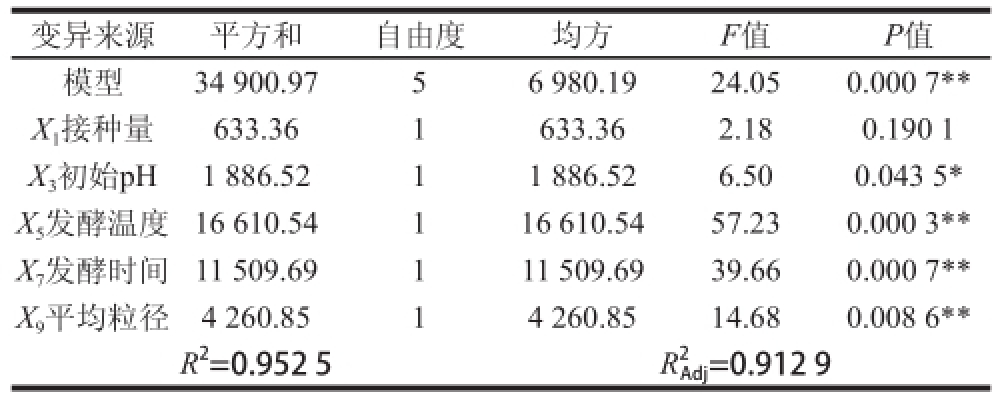
注:*.显著,P<0.05;**.极显著,P<0.01。下同。
Plackett-Burman试验设计及结果见表3,方差分析见表4,方差分析表明模型极显著(P<0.01),发酵温度、发酵时间、初始pH值和平均粒径在95%水平对T-AOC影响显著(P<0.05),接种量不显著(P>0.05)。各因素对响应值影响的重要性依次为:发酵温度>发酵时间>平均粒径>初始pH值>接种量。结合实际生产,由于受筛网规格的限制,平均粒径难以做到精确控制,故而选择发酵温度、发酵时间和初始pH值作为建立响应面模型考察的因素,小米糠的平均粒径仍然控制为0.22 mm(60~80 目)。
2.3 响应面试验结果
2.3.1 响应面试验优化结果及回归方程方差分析
Box-Behnken试验结果见表5,采用Design-Expertv8.0.6软件对试验数据进行响应面分析,回归方程的方差分析结果如表6所示。
表 5 响应面优化试验Box-Behnken设计及结果
Table 5 Box-Behnken design with experimental and predicted T-AOC values
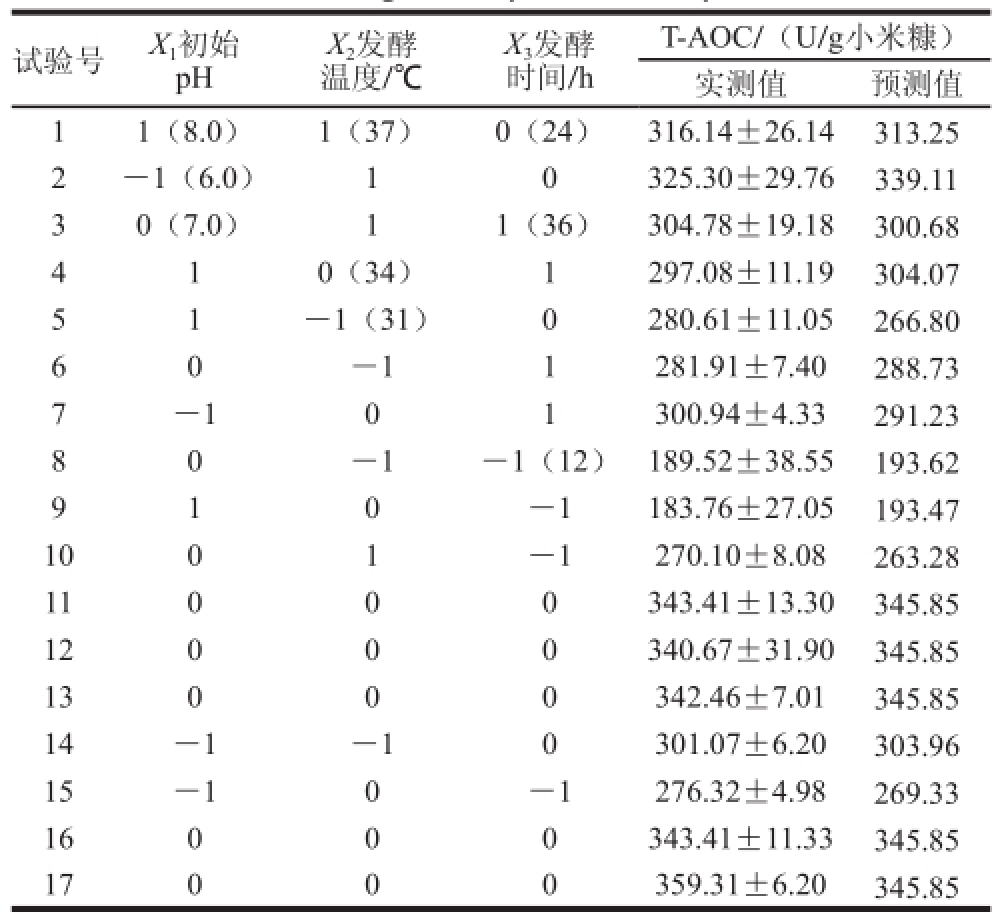
表 6 回归方程各项方差分析
Table 6 Analysis of variance for the response surface quadratic model

将所有数据进行多元回归拟合,得到X1(初始pH值)、X2(发酵温度)、X3(发酵时间)与T-AOC之间二次多项式模型方程为:

由表3可知,拟合的二次多项模型极显著(P=0.000 1),失拟项不显著(P=0.085 2>0.05),复相关系数R20.973 6,表明预测值和实测值之间具有很高的相关性;调整性决定系数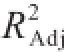 0.939 6,表明有93.96%的总抗氧化能力变化能由此模型进行解释,软件建立的模型能较好反映发酵条件对发酵提取液总抗氧化能力的影响。并且可以看出,X、X、X、XX、
0.939 6,表明有93.96%的总抗氧化能力变化能由此模型进行解释,软件建立的模型能较好反映发酵条件对发酵提取液总抗氧化能力的影响。并且可以看出,X、X、X、XX、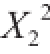 和
和
12313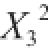 对小米糠固态发酵后提取液的总抗氧化能力有极显著的影响,
对小米糠固态发酵后提取液的总抗氧化能力有极显著的影响, 有显著影响。
有显著影响。
2.3.2 响应面分析
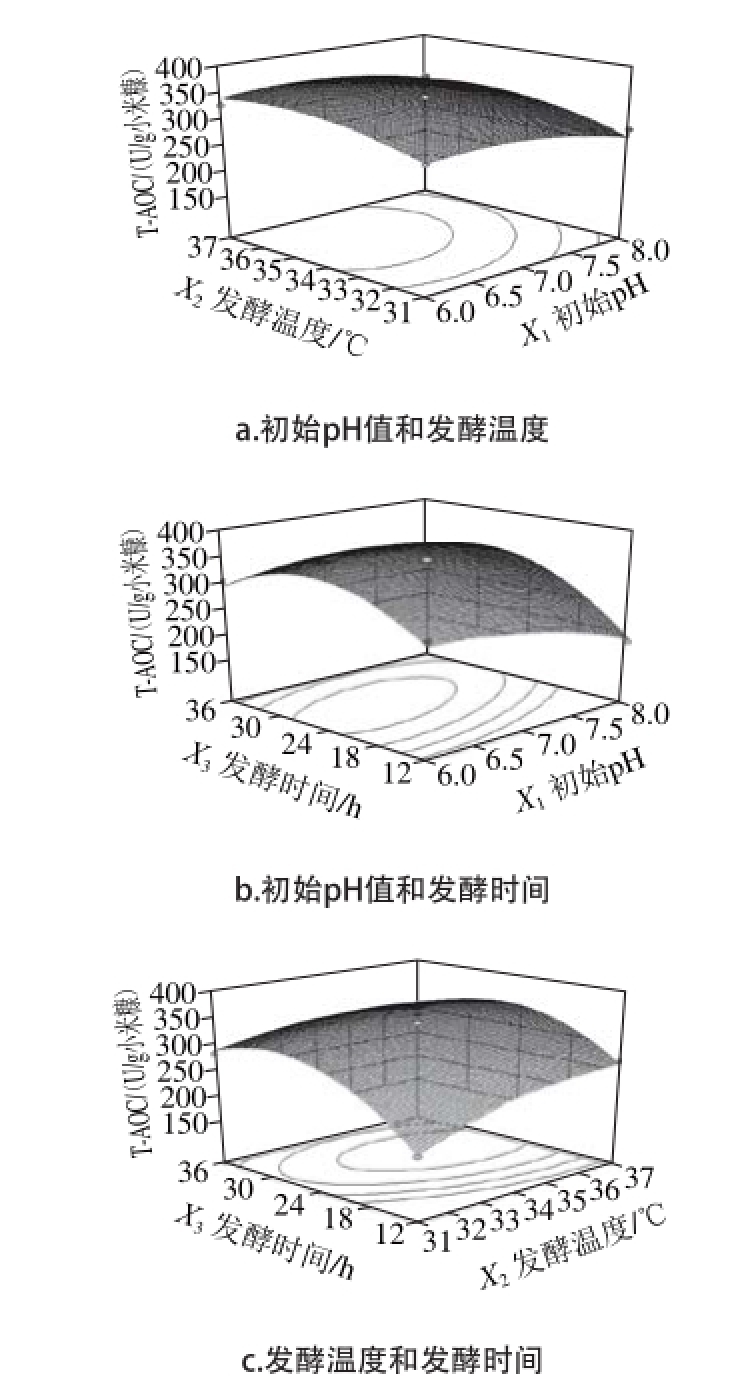
图 6 各因素对T-AOC影响的响应面图
Fig. 6 Response surface plots showing the effect of the independent variables on T-AOC
图6 a为发酵时间处于零水平时,发酵温度与初始pH值之间的交互作用图,当初始pH值为较低水平时,随着发酵温度的升高,T-AOC先增加后降低,当发酵温度处于较低水平时,随着pH值的增高,T-AOC先增加后降低,初始pH 6.5~7.5、发酵温度34~37 ℃时,T-AOC有最大值。图6b为发酵温度处于零水平时,发酵时间与初始pH值之间的交互作用图,可以看出随着发酵时间和初始pH值水平的增加,T-AOC都是先增加后降低,与单因素试验结果一致。由等高线图呈椭圆形可看出发酵时间与初始pH值之间的交互作用极显著。发酵时间18~30 h、初始pH 6.5~7.5时,T-AOC有最大值。图6c为初始pH值处于零水平时,发酵时间与发酵温度之间的交互作用图,发酵时间处于较低水平时,随着发酵温度的升高,T-AOC先增加后趋于平缓,发酵温度处于较低水平时,随着发酵时间的延长,T-AOC先增加后降低,发酵温度34~37 ℃、发酵时间24~36 h时,T-AOC有最大值。
响应面优化后通过Design-Expert v8.0.6软件计算得到的最适条件为初始pH 6.71、发酵时间26.04 h、发酵温度35.2 ℃,在此条件下,小米糠固态发酵后提取液的T-AOC预测值为354.995 U/g小米糠。为了检验响应面设计试验的可靠性,根据实际的操作条件对小米糠固态发酵工艺的条件进行调整结果为初始pH 6.7、发酵时间26 h、发酵温度35 ℃。在此条件下,小米糠固态发酵后提取液的T-AOC实际值为(344.51±8.02)U/g小米糠,与预测值相比,相对误差约为2.95%,比未发酵小米糠提取液的T-AOC((108.12±3.10)U/g小米糠)提高了约2.18 倍,此时多肽提取量为(68.37±0.92)mg/g小米糠。郭利娜等[8]通过纳豆芽孢杆菌液态发酵小米糠,多肽提取量为71.33 mg/g小米糠,与本研究固态发酵法的结果基本一致。
2.3.3 多肽对DPPH自由基的清除能力
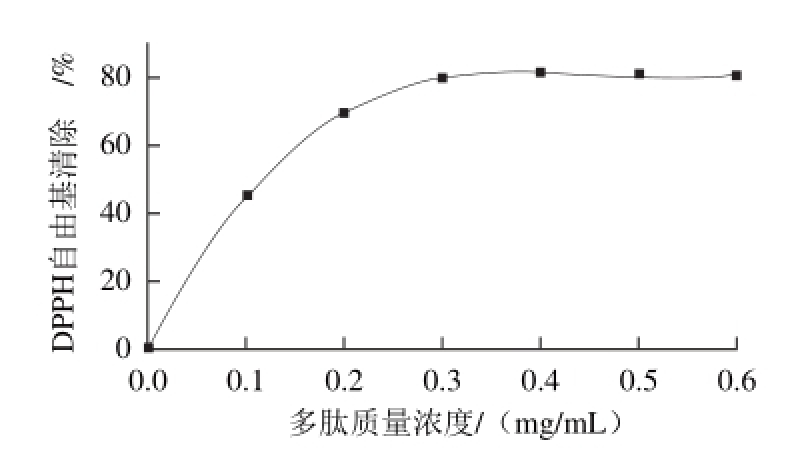
图 7 生物活性肽的DPPH自由基清除率
Fig. 7 DPPH radical scavenging capacity of the bioactive peptides
从图7可以看出,随着小米糠多肽质量浓度的增加,DPPH自由基的清除能力逐渐增强,当多肽浓度为0.2 mg/mL时,DPPH自由基清除率达到了69.26%,随后清除能力变化减缓。小米糠多肽质量浓度与DPPH自由基清除能力之间呈多项式关系(y=922.22x3-1268.7x2+ 563.24x+0.250 2,R2=0.999 8),通过拟合方程计算得到DPPH自由基IC50为0.12 mg/mL。He Rong等[12]利用枯草芽孢杆菌固态发酵菜籽粕制备了菜籽肽,肽含量为165 μg/mL时即可清除50%的DPPH自由基;武万兴等[25]通过固态发酵核桃粕制备了抗氧化肽,其DPPH自由基IC50为0.15 mg/mL;Jin Duxin等[30]采用复合酶水解玉米蛋白后分离到一种新的抗氧化肽,其氨基酸序列为Cys-Ser-Gln-Ala-Pro-Leu-Ala,DPPH自由基IC50为0.116 mg/mL。本实验所得小米糠抗氧化肽的DPPH自由基IC50值略低于菜籽肽和核桃肽,与玉米肽相似,说明小米糠生物活性肽具有较高的研究价值。
以纳豆芽孢杆菌为发酵菌株,采用固态发酵的方法,制备了小米糠抗氧化肽粗提物。对影响纳豆芽孢杆菌固态发酵小米糠产抗氧化肽的菌液接种量、发酵时间、发酵温度、初始pH值和发酵基质平均粒径5 个因素进行了单因素试验,在单因素试验的基础上设计了Plackett-Burman试验,筛选出初始pH值、发酵时间和发酵温度3 个影响显著的因素进行响应面法优化,得到了最适的固态发酵条件。此条件下小米糠发酵后获得的提取液总抗氧化能力比未发酵提取液提高了2.18 倍,且具有较高的多肽提取量和DPPH自由基清除能力。小米糠抗氧化肽是一种天然抗氧化剂,安全无毒副作用,有待于进一步分离纯化,并对其抗氧化性质进行研究。
参考文献:
[1] 杜亚军. 小米糠深加工研究进展[J]. 粮食与饲料工业, 2016(3): 31-39. DOI:10.7633/j.issn.1003-6202.2016.03.009.
[2] PANG Min, HE Shujian, CAO Lili, et al. Optimization and evaluation of foxtail millet (Setaria italica) bran oil by supercritical carbon dioxide extraction[J]. Grasas y Aceites, 2015, 66(4): 107-110. DOI:10.3989/gya.0239151.
[3] DEVITTORI C, GUMY D, KUSY A, et al. Supercriticaluid extraction of oil from millet bran[J]. Journal of the American Oil Chemists Society, 2000, 77(6): 573-579. DOI:10.1007/s11746-000-0092-7.
[4] 朱玉, 郭利娜, 楚佳希, 等. 酶法改性对小米糠膳食纤维体外胆固醇吸附活性的影响[J]. 食品科学, 2015, 36(19): 211-216. DOI:10.7506/ spkx1002-6630-201519038.
[5] 陈蓓颖, 沈群. 小米麸皮植酸的提取及植酸含量初步分析[J].食品工业科技, 2013, 34(9): 202-205. DOI:10.13386/ j.issn1002-0306.2013.09.072.
[6] 顾镍. 小米糠蛋白的酶法提取及性质研究[D]. 南京: 南京农业大学, 2013: 1-10.
[7] SHAN Shuhua, LI Zongwei, NEWTON I P, et al. A novel protein extracted from foxtail millet bran displays anti-carcinogenic effects in human colon cancer cells[J]. Toxicology Letters, 2014, 227(2): 129-138. DOI:10.1016/j.toxlet.2014.03.008.
[8] 郭利娜, 朱玉, 刁明明, 等. 枯草芽孢杆菌发酵小米糠对其抗氧化肽含量与抗氧化活性的影响[J]. 食品科学, 2015, 36(13): 196-201. DOI:10.7506/spkx1002-6630-201513036.
[9] 于书佳, 王常青, 原敏, 等. 小米谷糠多肽对肝损伤及癌前病变的抑制作用[J]. 食品科学, 2014, 35(5): 213-217. DOI:10.7506/spkx1002-6630-201405042.
[10] NIGAM P S N, PANDEY A. Biotechnology for agro-industrial residues utilisation[M]. Springer Netherlands, 2009: 197-221. DOI:10.1007/978-1-4020-9942-7_10.
[11] CODA R, RIZZELLO C G, PINTO D, et al. Selected lactic acid bacteria synthesize antioxidant peptides during sourdough fermentation of cereal flours[J]. Applied and Environmental Microbiology, 2012, 78(4): 1087-1096. DOI:10.1128/AEM.06837-11.
[12] HE Rong, JU Xingrong, YUAN Jian, et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J]. Food Research International, 2012, 49(1): 432-438. DOI:10.1016/ j.foodres.2012.08.023.
[13] 彭惠惠, 李吕木, 钱坤, 等. 发酵芝麻粕中芝麻小肽的分离纯化及其体外抗氧化活性[J]. 食品科学, 2013, 34(9): 66-69. DOI:10.7506/ spkx1002-6630-201309015.
[14] AMADOU I, LE Guowei, SHI Yonghui. Evaluation of antimicrobial, antioxidant activities, and nutritional values of fermented foxtail millet extracts by Lactobacillus paracasei FN032[J]. International Journal of Food Properties, 2013, 16(6): 1179-1190. DOI:10.1080/10942912.201 1.579673.
[15] WU Wanxing, ZHAO Shenglan, CHEN Chaoyin, et al. Optimization of production conditions for antioxidant peptides from walnut protein meal using solid-state fermentation[J]. Food Science and Biotechnology, 2014, 23(6): 1941-1949. DOI:10.1007/s10068-014-0265-3.
[16] 张强, 周正义, 王松华. 从米糠中制备抗氧化肽的研究[J]. 食品工业科技, 2007, 28(7): 145-147. DOI:10.13386/j.issn1002-0306.2007.07.040.
[17] CHANPUT W, THEERAKULKAIT C, NAKAI S. Antioxidative properties of partially purified barley hordein, rice bran protein fractions and their hydrolysates[J]. Journal of Cereal Science, 2009, 49(3): 422-428. DOI:10.1016/j.jcs.2009.02.001.
[18] 樊金娟, 罗霞, 董智. 米糠抗氧化肽的提取和纯化工艺研究[J]. 食品科技, 2008, 33(12): 169-173. DOI:10.13684/j.cnki.spkj.2008.12.056.
[19] W A T T A N A S I R I T H A M L, T H E E R A K U L K A I T C, WICKRAMASEKARA S, et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J]. Food Chemistry, 2016, 192: 156-162. DOI:10.1016/ j.foodchem.2015.06.057.
[20] 周建新, 吴定, 姚明兰, 等. 陈化籼稻谷固态发酵法生产柠檬酸的培养基优化[J]. 食品科学, 2006, 27(12): 283-286. DOI:10.3321/ j.issn:1002-6630.2006.12.065.
[21] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014, 160: 346-356. DOI:10.1016/j.foodchem.2014.03.112.
[22] SCHMIDT C G, FURLONG E B. Effect of particle size and ammonium sulfate concentration on rice bran fermentation with the fungus Rhizopus oryzae[J]. Bioresource Technology, 2012, 123: 36-41. DOI:10.1016/j.biortech.2012.07.081.
[23] 池宁娟, 周虹, 高苏莉, 等. 福林酚比色法测定转移因子胶囊中多肽的含量[J]. 中国药房, 2014, 25(17): 1617-1618. DOI:10.6039/ j.issn.1001-0408.2014.17.26.
[24] TORRES-FUENTES C, MAR CONTRERAS M, RECIO I, et al. Identification and characterization of antioxidant peptides from chickpea protein hydrolysates[J]. Food Chemistry, 2015, 180: 194-202. DOI:10.1016/j.foodchem.2015.02.046.
[25] 武万兴, 陈朝银, 赵声兰, 等. 固态发酵核桃粕制备活性肽及其抗氧化活性的研究[J]. 食品工业科技, 2013, 34(16): 266-271. DOI:10.13386/j.issn1002-0306.2013.16.044.
[26] 祁红兵, 宋军霞, 张卫. 纳豆芽孢杆菌固体发酵麸皮的抗氧化功能研究[J]. 粮食与饲料工业, 2014(5): 51-53. DOI:10.7633/ j.issn.1003-6202.2014.05.013.
[27] MAHANAMA R, BERENJIAN A, VALTCHEV P, et al. Enhanced production of menaquinone 7 via solid substrate fermentation from Bacillus subtilis[J]. International Journal of Food Engineering, 2011, 7(5): 1-2. DOI:10.2202/1556-3758.2314.
[28] 吴永沛, 刘明, 倪辉. 大豆抗氧化活性肽固态发酵工艺优化[J]. 中国食品学报, 2007, 7(6): 52-57. DOI:10.3969/ j.issn.1009-7848.2007.06.009.
[29] ASADI S Z, KHOSRAVI-DARANI K, NIKOOPOUR H, et al. Evaluation of the effect of process variables on the fatty acid profile of single cell oil produced by Mortierella using solid-state fermentation[J]. Critical Reviews in Biotechnology, 2015, 35(1): 94-102. DOI:10.3109/07388551.2013.804805.
[30] JIN Duxin, LIU Xiaolan, ZHENG Xiqun, et al. Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant peptides[J]. Food Chemistry, 2016, 204: 427-436. DOI:10.1016/j.foodchem.2016.02.119.
Optimization of Solid State Fermentation Conditions for Production of Antioxidant Peptides from Millet Bran by Bacillus natto
WEI Tao, ZHOU Qijing, LU Zhaoxin, L☒ Fengxia, BIE Xiaomei, ZHANG Chong, ZHAO Haizhen*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:In order to improve the utilization rate of millet bran as a protein source and to provide references for the intensive processing of millet bran, solid state fermentation of millet bran by Bacillus natto was optimized for increased production of antioxidant peptides. Firstly, one-factor-at-a-time experiments were carried out. Secondly, the fermentation conditions with a signi cant effect on the total antioxidant capacity (T-AOC) of aqueous extracts from fermented millet bran were selected using Plackett-Burman design for further optimization using response surface methodology (RSM). The polypeptide content and 1,1-diphenyl-2-trinitrobenzene hydrazine (DPPH) radical scavenging ability of the aqueous extract from millet bran fermented under optimized conditions were determined. Results showed that the optimum fermentation conditions were as follows: average particle diameter of millet bran, 0.22 mm (between 60 and 80 mesh); inoculum size, 0.4 mL; initial pH, 6.7; fermentation time, 26 h; and fermentation temperature, 35 ℃. Experiments conducted under these conditions yielded an extract with a T-AOC of (344.51 ± 8.02) U/g, and a polypeptide yield of (68.37 ± 0.92) mg/g millet bran. The results also showed that the bioactive peptides had strong DPPH free radical scavenging activity with an IC50value of 0.12 mg/mL. Therefore, this study proves that bioactive peptides obtained from fermented millet bran have a high antioxidant capacity.
Key words:millet bran; Bacillus natto; solid state fermentation; r esponse surface methodology; antioxidant peptides
DOI:10.7506/spkx1002-6630-201710012
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)10-0066-08
引文格式:
韦涛, 周启静, 陆兆新, 等. 纳豆芽孢杆菌固态发酵小米糠产抗氧化肽工艺优化[J]. 食品科学, 2017, 38(10): 66-73.
DOI:10.7506/spkx1002-6630-201710012. http://www.spkx.net.cn
WEI Tao, ZHOU Qijing, LU Zhaoxin, et al. Optimization of solid state fermentation conditions for production of antioxidant peptides from millet bran by Bacillus natto[J]. Food Science, 2017, 38(10): 66-73. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710012. http://www.spkx.net.cn
收稿日期:2016-06-19
基金项目:中央高校基本科研业务费重点项目(kyz201118)
作者简介:韦涛(1990—),男,硕士研究生,主要从事食品生物技术研究。E-mail:2014108076@njau.edu.cn
*通信作者:赵海珍(1975—),女,教授,博士,主要从事食品生物技术研究。E-mail:zhaohz@njau.edu.cn
小米糠;纳豆芽孢杆菌;固态发酵;响应面法;抗氧化肽