王 卉1,尚庆茂2,张志刚2,张 莹1,李平兰1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业科学院蔬菜花卉研究所,北京 100081)
摘 要:植物根际促生菌可以分解转化土壤中的有机质和矿物质,预防和控制农作物病害,减少农药和化肥的使用,将其应用于农业被认为是一种提高农作物产量的新型方法。实验室分离筛选到一株优良的解淀粉芽孢杆菌L-H15,通过前期L-H15全基因组测序的提示,考察L-H15能够产生的促生物质,并优化其发酵工艺,开发出高活性的固态菌剂。结果表明:解淀粉芽孢杆菌L-H15能够产生相对表达量为65.53%的铁载体;其产1-氨基环丙烷-1-羧酸脱氨酶的能力也较强,比活力测定结果为0.401 U/mg;采用酶联免疫吸附法检测到该菌株亦能产生植物激素吲哚乙酸和细胞分裂素,产细胞分裂素的能力尤为显著,可达到2.157 7×10-10mol/L;运用气相色谱-质谱检测出L-H15产生的挥发性物质中含有乙酰甲基原醇。这些因素均可有效刺激植物的生长发育。采用Box-Behnken响应面试验优化解淀粉芽孢杆菌L-H15的发酵工艺,L-H15的最佳发酵条件为:接种量8%、装液量67.8%、发酵时间11.5 h、发酵温度32 ℃、转速196 r/min。此时,解淀粉芽孢杆菌L-H15活菌数最高可达到1.21×109CFU/mL。综合评定,解淀粉芽孢杆菌L-H15是一株优良的植物根际促生菌,具有广阔的开发成生物肥料的前景。
关键词:解淀粉芽孢杆菌L-H15;促生物质;发酵工艺
随着化肥、农药等的过量使用甚至滥用,造成了一系列的环境污染、土壤多样性破坏、食品安全性降低等问题。与此同时,植物根际促生菌以高效、环保、安全等诸多优点受到人们的关注,根际促生菌可以分解转化土壤中的有机质和矿物质,预防和控制农作物病害,减少农药和化肥的使用,应用根际促生菌被普遍认为是一种发展绿色食品的有效手段[1-2]。随着人们对根际促生菌研究的逐渐重视,越来越多的促生菌被运用到科研中,并逐步深入到对促生菌作用机制、生理效应的研究及制剂产品的开发和应用。
植物根际促生菌L-H15,由实验室从草炭土育苗基质中分离获得并保存,经鉴定其为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。对其进行筛选时发现该菌株的固氮、溶磷、解钾能力均很强,前期实验室对解淀粉芽孢杆菌L-H15的研究主要集中于L-H15可以产生抗菌脂肽来有效抑制植物病原菌,从而达到生物防治的目的。之后实验室对该菌株进行了全基因组测序,发现L-H15存在其他促生长因子有待进一步研究,并具有开发成微生物肥料广泛应用的潜力。本研究旨在探究解淀粉芽孢杆菌L-H15促生的特性,通过研究其能否产生对植物生长具有促进作用的因子,如铁载体、植物激素、1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)脱氨酶和挥发性有机物质(volatile organic compounds,VOCs),来揭示菌株L-H15的促生机制,并通过响应面分析优化该菌株的发酵工艺,为今后将其应用于工厂化育苗和生物肥料生产提供理论依据。
1.1 材料与试剂
解淀粉芽孢杆菌L-H15(Bacillus amyloliquefaciens L-H15)由中国农业大学食品科学与营养工程学院应用微生物研究室提供,分离于中国农业大学草坪育苗基质,专利保藏号为CGMCC No.8230。
铬天青S(chrome azurol S,CAS)、2,4-二硝基苯肼国药集团化学试剂有限公司;十六烷基三甲基溴化铵、1-氨基环丙烷-1-羧酸 美国Sigma公司;聚合酶链式反应植物激素酶联免疫试剂盒 宝如亿生物技术有限公司;Tris、考马斯亮蓝 美国Amresco公司。
1.2 仪器与设备
SCL-1300型垂直流洁净工作台 北京赛伯乐实验仪器有限公司;DNP-9162型电热恒温培养箱 上海精宏实验设备有限公司;UV-1800紫外分光光度计 上海美谱达仪器有限公司;QP2010 plus型气相色谱-质谱联用仪日本岛津公司。
1.3 方法
1.3.1 L-H15促生特性
1.3.1.1 L-H15产铁载体测定
CAS检测液配制参照Schwyn等[3]的方法,采用双层平板法培养菌株。下层平板将CAS检测液在65 ℃水浴30 min,在该温度按照5 mL CAS检测液/100 mL 1%琼脂的比例混合均匀;待下层平板完全凝固后,在其上覆盖一层LB固体培养基作为上层平板。将活化好的解淀粉芽孢杆菌L-H15以10 μL/点接种,于28 ℃培养箱倒置培养72 h。观察菌落的生长情况及培养基颜色的变化。
采用CAS液体检测法测定解淀粉芽孢杆菌L-H15产铁载体产量。将L-H15菌液接种于MKB液体培养基,28 ℃、150 r/min振荡培养48 h。将上述摇床培养物在3 500 r/min离心15 min,取3 mL上清液与3 mL CAS检测液混合均匀,室温反应1 h,以去离子水作为对照调零,测定630 nm波长处的吸光度,记为As;以未接菌的MKB液体培养基上清液同法测定吸光度,记为Ar。铁载体相对表达量计算如式(1)所示:
1.3.1.2 L-H15产植物激素测定
采用双抗夹心酶联免疫吸附法测定解淀粉芽孢杆菌L-H15分泌吲哚乙酸(indole acetic acid,IAA)和细胞分裂素(cytokinin,CTK)的能力。按照IAA、CTK、赤霉素酶联免疫试剂盒的说明书进行操作。
1.3.1.3 L-H15产ACC脱氨酶测定
ACC脱氨酶测定参照Adams等[4]的方法,将L-H15菌液悬浮于ADF培养液,28 ℃、200 r/min培养24 h,以诱导产生ACC脱氨酶,离心去除上清液,用0.1 mol/L Tris-HCl缓冲液(pH 7.6)洗涤菌体2 次。将菌体沉淀重新悬浮于600 μL的0.1 mol/L Tris-HCl缓冲液(pH 8.5)中,加入30 μL甲苯,高速振荡30 s破碎细胞。将甲苯化菌液分为两组各取200 μL,其中一组加入20 μL 0.5 mol/LACC,30℃水浴反应15 min。在两组处理中均加入1 mL 0.56 mol/L HCl,10 000 r/min离心2 min,吸取1 mL上清液,依次加入800 μL 0.56 mol/L HCl和300 μL 0.2% 2,4-二硝基苯肼,混合均匀后30 ℃反应30 min,最后加入2 mL的2 mol/L NaOH用于显色苯腙。以只含甲苯化菌液的处理组作为空白对照,以ACC-甲苯化菌液的处理组作为待测样本,测定540 nm波长处的吸光度。ACC脱氨酶活力(U)为反应体系中1 min形成1 μmol α-丁酮酸的酶量,蛋白质量浓度采用Bradford比色法测定,比活力计算如式(2)所示:
1.3.1.4 L-H15产VOCs测定
将培养好的1 mL解淀粉芽孢杆菌L-H15置于20 mL顶空瓶内,采用65 μm PDMS/DVB萃取头,样品置于40 ℃条件下平衡40 min后,将萃取头插入顶空瓶中萃取30 min,最后将萃取头拔出并置于250 ℃的进样口中解吸2 min。色谱柱型号DB-WAX(30 m×0.25 mm,0.25 μm),柱温箱初始温度40 ℃,进样口温度250 ℃,不分流进样,载气流速1 mL/min,柱温箱升温程序为40 ℃保持3 min,5 ℃/min升至120 ℃,10 ℃/min升至200 ℃,保持5 min。离子源温度200 ℃,传输线温度250 ℃,采用Scan模式采集信号,扫描范围m/z 35~500。
1.3.2 L-H15的液态发酵
1.3.2.1 培养条件单因素试验
挑取新鲜解淀粉芽孢杆菌L-H15单菌落,接种于LB液体培养基,37 ℃、200 r/min振荡培养过夜;8 000 r/min离心10 min,所得菌体用0.85%的NaCl溶液漂洗3 次,并将菌液调至107CFU/mL备用。装液量:按照500 mL容量瓶的20%、30%、40%、50%、60%、70%和80%装液;接种量:接种上述处理好的107CFU/mL的L-H15菌悬液,接种量设定为2%、4%、6%、8%和10%;发酵时间:设定每隔6、9、12、15、18 h测定L-H15的活菌数;发酵温度:将L-H15发酵温度调节为28、32、36、40、44 ℃;转速:调节转速为120、150、180、210、240 r/min。
1.3.2.2 Plackett-Burman试验
根据单因素试验结果,从各因素的最大响应区间中选择高低两个水平,利用Design-Expert 8.0软件设计Plackett-Burman试验,对装液量、接种量、发酵时间、发酵温度、转速5 个因素进行考察,响应值为OD600nm。
1.3.2.3 最陡爬坡试验
根据Plackett-Burman试验所得显著因素及效应值,设计最陡爬坡试验的方向和步长。所选择的显著因素若效应值为正,则梯度方向增加;若效应值为负,则梯度方向减少。步长根据单因素试验的结果分析确定,以此达到快速、经济逼近最佳区域的目的。
1.3.2.4 Box-Behnken响应面试验
由最陡爬坡试验的拐点确定响应中心点及接近响应值区域因素的取值范围,设计Box-Behnken响应面试验。以装液量、发酵时间、转速3 个因素为自变量,以OD600nm为响应值,生成等高线图和响应面图,获得最优的发酵参数。
1.4 统计分析
本研究所得数据用Excel 2010和SPSS 17.0软件进行数据统计分析,置信度为95%(α=0.05)。
2.1 L-H15促生特性
2.1.1 产铁载体能力
将解淀粉芽孢杆菌L-H15在CAS固体双层平板上进行检测,培养48 h后,如图1所示,待测菌株在上层LB培养基上生长良好,并在下层的CAS检测平板上产生了橘黄色显色圈,此为典型的铁载体螯合晕圈;空白对照仍保持蓝色。结果说明,解淀粉芽孢杆菌L-H15可以分泌铁载体,且根据晕圈直径的大小可以推测L-H15产生的铁载体含量较高。

图 1 铁载体双层平板显色
Fig. 1 Coloration of siderophore on double-layer plate
将解淀粉芽孢杆菌L-H15在MKB液体培养基中培养48 h,空白对照和L-H15处理组的OD630nm分别为0.879和0.303,计算得到菌株L-H15产铁载体相对表达量为65.53%。
2.1.2 L-H15产植物激素能力

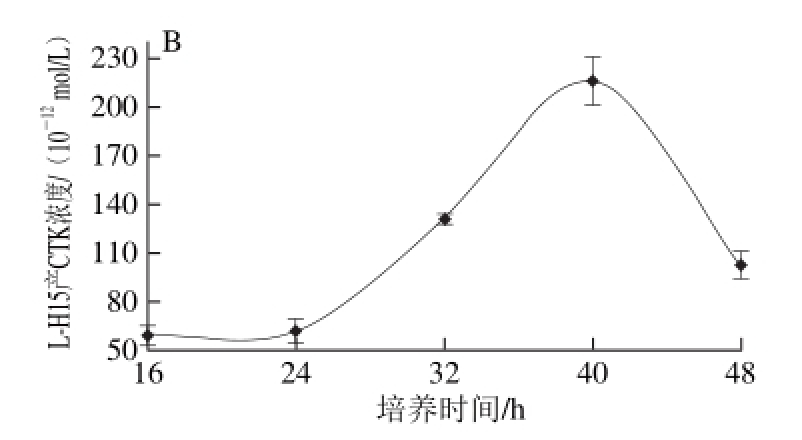
图 2 L-H15产IAA(A)和CTK(B)能力
Fig. 2 Capacity of L-H15 to produce IAA (A) and CTK (B)
如图2A所示,L-H15分泌IAA浓度随着时间的延长呈S形趋势,先快速增长,后趋于平缓。培养16 h时,解淀粉芽孢杆菌L-H15开始缓慢分泌IAA;24~40 h,IAA产量快速累积增长,在40 h时浓度达到6.698× 10-11mol/L,之后增长趋势趋于平缓,48 h的产量与40 h相比几乎无差别。如图2B所示,L-H15分泌CTK浓度随着时间的延长呈抛物线型,先经过平稳期后快速增长,又快速下降。培养16 h时,解淀粉芽孢杆菌L-H15开始缓慢产生CTK,24 h后进入快速增长期,在40 h时分泌量达到最大值2.157 7×10-10mol/L;此后CTK产量下降,在48 h时降至1.024 6×10-10mol/L。总体来看,菌株L-H15产CTK的能力很强。
2.1.3 L-H15产ACC脱氨酶能力
ACC脱氨酶活力为反应体系中1 min形成1 μmol α-丁酮酸的酶量,解淀粉芽孢杆菌L-H15产ACC脱氨酶活力为0.049 1 U/mL;通过测定得总蛋白质量浓度为0.125 mg/mL;ACC脱氨酶比活力为0.401 U/mg,即24.06 μmol/(mg·h)。
2.1.4 L-H15产VOCs能力
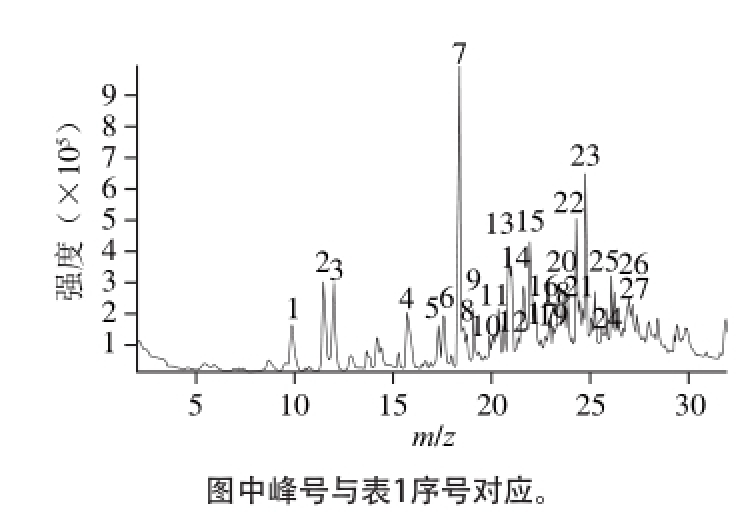
图 3 L-H15产VOCs质谱
Fig. 3 Mass spectrum of VOCs produced by L-H15
L-H15产VOCs质谱见图3。本实验使用NIST11数据库对未知挥发性化合物谱图进行比对,相似度达85%以上。
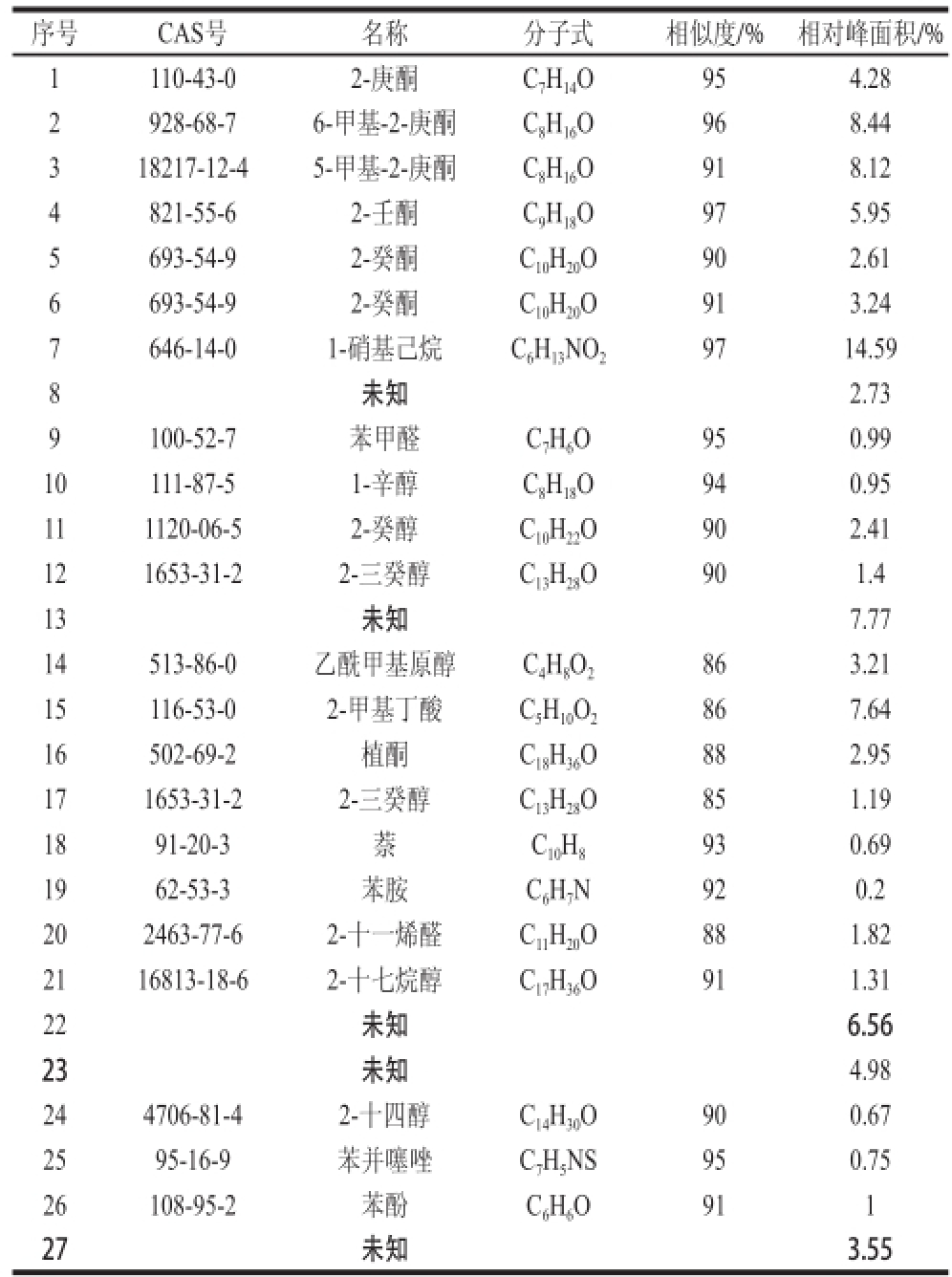
由表1可以看出,解淀粉芽孢杆菌L-H15产生的VOCs主要是酸类、醛酮类和醇类物质。各种物质混杂在一起,形成了L-H15独特的气味。编号14挥发性物质可能为乙酰甲基原醇,相似度达到86%。Ryu等[5]报道枯草芽孢杆菌GB03和解淀粉芽孢杆菌IN937a产生的2,3-丁二醇和乙酰甲基原醇能促进拟南芥的生长,本实验发现了乙酰甲基原醇,表明解淀粉芽孢杆菌L-H15产生的VOCs能够对植物的生长起到调控作用。
表 1 L-H15产VOCs质谱分析
Table 1 Mass spectral analysis of VOCs produced by L-H15
2.2 L-H15的液态发酵
2.2.1 培养条件单因素试验结果


图 4 发酵条件单因素试验结果
Fig. 4 Optimization of fermentation conditions
如图4所示,活菌数随着装液量的增加呈先增加后减小的趋势,响应区间为50%~80%,装液量为60%时活菌数达最大值1.09×108CFU/mL。接种量在2%~6%范围时,活菌数随接种量增加而增大;接种量超过6%时,活菌数随接种量的增加而减少。响应区间为4%~8%,接种量为6%时活菌数达最大值1.38×108CFU/mL。随着发酵时间的延长,活菌数呈现先增加后减少的趋势,响应区间为9~15 h,当发酵时间为9 h,活菌数达到最大值3.07×108CFU/mL。当发酵温度在28~32 ℃时,活菌数呈增加趋势;当温度在32~44 ℃范围内,活菌数逐渐减少。响应区间为32~40 ℃,当温度为32 ℃时,活菌数达最大值9.93×108CFU/mL。随着转速的增加,活菌数先增加后减少。响应区间为180~240 r/min,当转速为180 r/min时,活菌数最大达1.09×109CFU/mL。
2.2.2 Plackett-Burman试验结果
表 2 Plackett-Burman试验效应分析
Table 2 Effect analysis of Plackett-Burman design
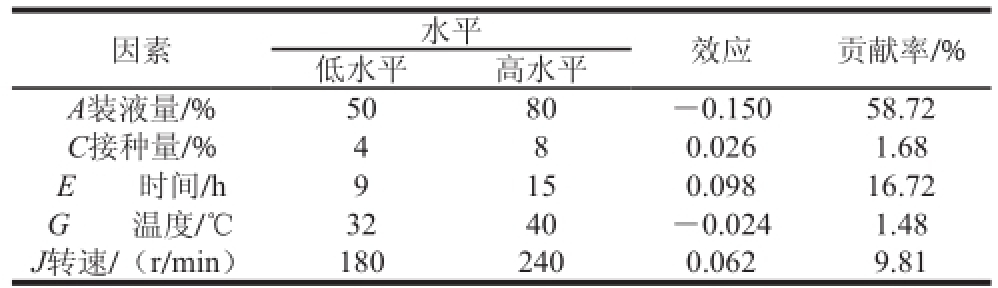
本试验选用N12的Plackett-Burman试验设计,考察液量(A)、接种量(C)、发酵时间(E)、发酵温度(G)、转速(J)5 个因素对OD600nm的影响,对结果进行效应分析。由表2看出,装液量、发酵温度为负效应;而接种量、发酵时间、转速为正效应。效应值的大小表示该因素对试验结果影响的强弱,该值与因素的贡献率呈正相关。由此可得,5 个因素对模型影响的贡献率依次为:装液量>发酵时间>转速>接种量>发酵温度。对贡献率较大的三因素进行最陡爬坡试验,其他因素根据效应值取值,表现为正效应的因素取高水平,表现为负效应的因素取低水平。
2.2.3 最陡爬坡试验结果
由Plackett-Burman试验结果设计主要因素的最陡爬坡路径,装液量、发酵时间、转速为显著模型,装液量为负效应,应减少;发酵时间、转速为正效应,应增加。根据试验号1~5,依次取装液量为80%、70%、60%、50%和40%;发酵时间为9、11、13、15 h和17 h,转速为180、200、220、240 r/min和260 r/min。
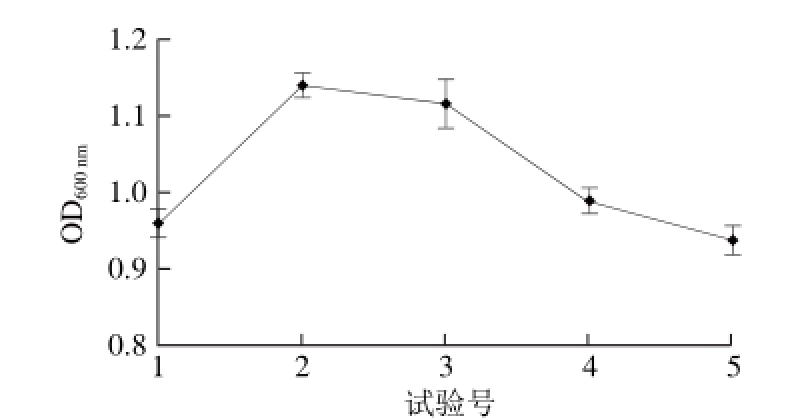
图 5 最陡爬坡试验结果
Fig. 5 Results of steepest grade test
由图5可以看出,所设计的最陡爬坡试验结果出现理想的先增高后降低的趋势,并且在2号试验点处出现最高点,即装液量70%、发酵时间11 h、转速200 r/min时,OD600nm值达到最大,该点即为最陡爬坡试验的拐点,也是下一步Box-Behnken试验设计的中心点。
2.2.4 Box-Behnken响应面试验结果
表 3 Box-Behnken试验设计及结果
Table 3 Box-Behnken design with experimental results

设计三水平三因素的Box-Behnken试验,对Plackett-Burman试验筛选出的显著因素装液量、发酵时间、转速进行响应面优化,具体试验方案及结果如表3所示。
根据Box-Behnken试验结果建立回归模型并进行方差分析,如表4所示。
表 4 Box-Behnken试验回归模型方差分析
Table 4 Analysis of variance (ANOVA) of Box-Behnken design regression model
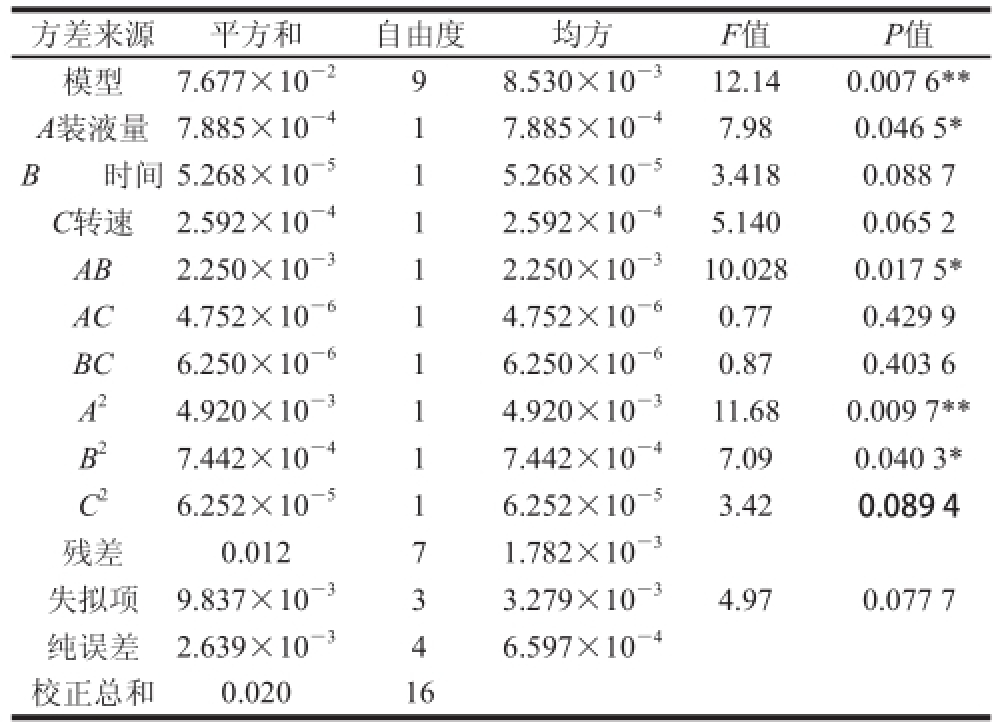
注:*.影响显著(P<0.05);**.影响极显著(P<0.01)。
由表4可知,所选模型极显著(P=0.007 6<0.01),说明模型具有可信度;失拟项不显著(P=0.077 7>0.05),说明未知因素对试验结果干扰小。因此确定本模型可靠,利用Design-Expert 8.0软件对模型进行响应面分析,得到等高线图和响应面三维图,如图6所示。
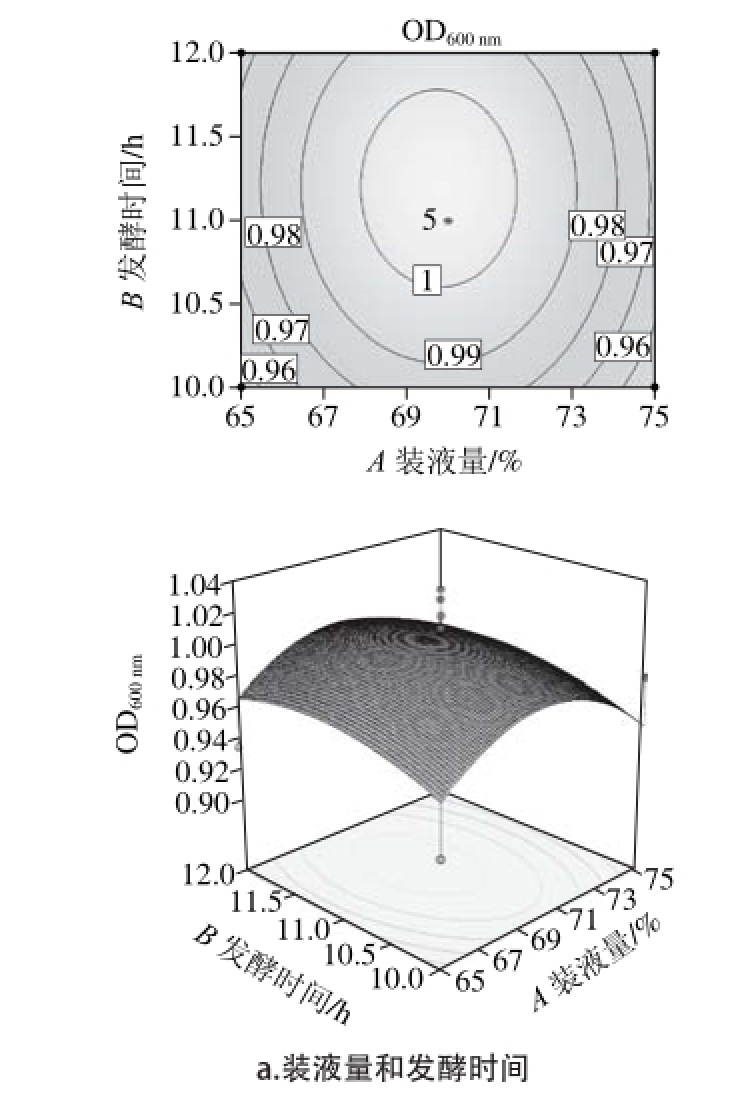
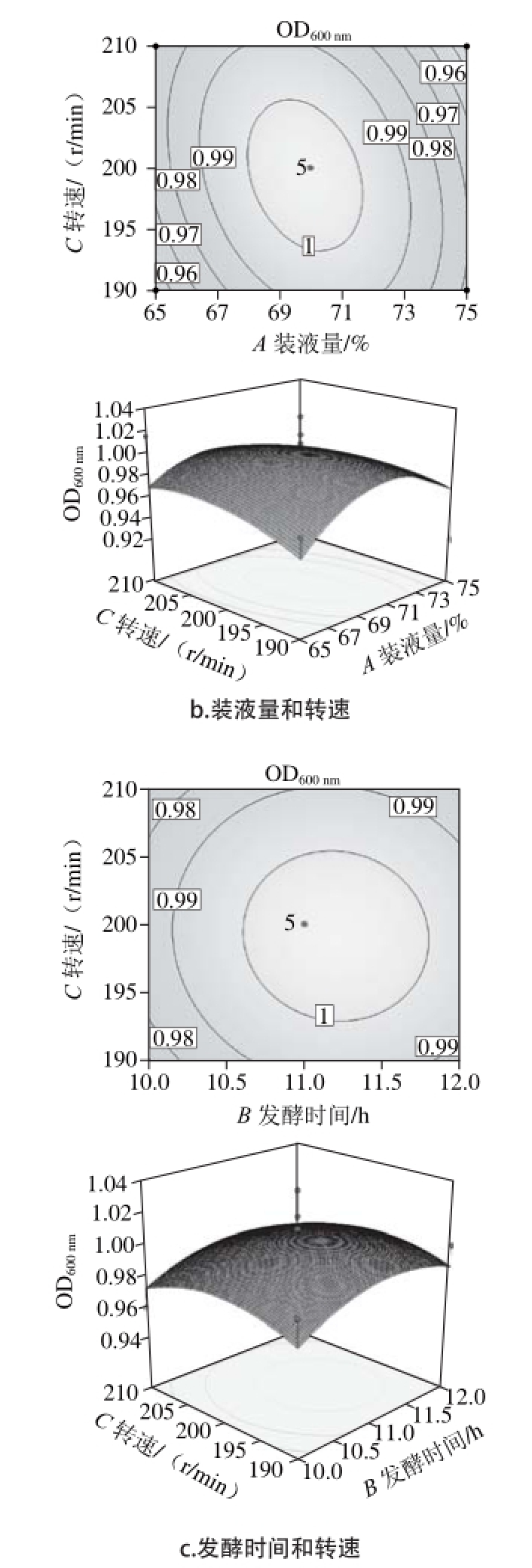
图 6 Box-Behnken等高线和响应面图
Fig. 6 Response surface and contour plots showing the effects on various culture conditions on the viable cell count
由图6可以看出,等高线图均为椭圆形,响应面三维图均有稳定点,且为极大值。利用Design-Expert 8.0对表5中所显示的结果进行二次多元回归拟合处理,得到解淀粉芽孢杆菌L-H15的OD600nm(R)对装液量(A)、发酵时间(B)、转速(C)的二次多元回归方程为:
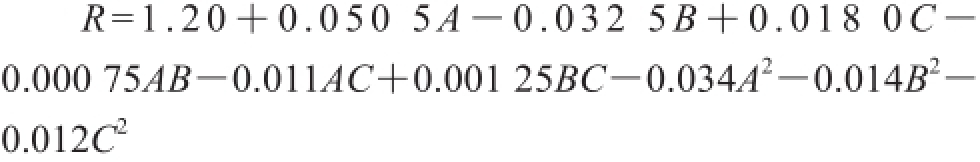
Design-Expert 8.0软件预测出以OD600nm为响应值时,装液量、发酵时间、转速的最优参数分别为67.8%、11.5 h、196 r/min,此时预测最大OD600nm为1.28;验证实验的条件参照Box-Behnken试验和Plackett-Burman试验的优化结果,实际所得解淀粉芽孢杆菌L-H15的OD600nm为1.31,该值与模型的预测值基本吻合,此时活菌数为1.21×109CFU/mL。
本研究对解淀粉芽孢杆菌L-H15可能具有的促生长因子进行了定性和定量的分析。根际促生菌产生的铁载体一方面可与病原微生物争夺有限的铁营养而抑制病原菌的侵染能力[6-9];另一方面其所形成的铁-铁载体复合物具有可溶性,能被植物细胞外膜上的特异性受体识别和吸收,直接参与植物的代谢过程[10-12]。本实验得到解淀粉芽孢杆菌L-H15的铁载体相对表达量为65.53%。查阅相关文献,蒙渊[13]筛选的一株产铁载体的氢氧化细菌表达量为16.2%;孙红启[14]筛选的27株铁载体高表达量的丝状真菌产量范围为10.2%~74.3%,由此可以看出解淀粉芽孢杆菌L-H15产铁载体的能力相对较强。
根际促生菌可以通过干扰植物内源激素或提供外源激素两种方式对植物的生长发育产生影响。现已知能促进幼苗生长的植物激素主要有IAA和CTK。本实验研究了L-H15产IAA和CTK的能力,发现其能够产生6.698×10-11mol/L的IAA和2.157 7×10-10mol/L的CTK,产CTK的能力尤为显著。观察到IAA的含量随时间延长渐趋稳定,说明菌株L-H15自身不会吸收分解IAA,IAA能够促进植物根系统的发育,使植物根部伸展到更大的土壤范围。由此推测,解淀粉芽孢杆菌L-H15产生IAA的原因可能是为了刺激植物释放出大量的单糖和低聚糖,为菌株自身附生于植物表面,获取充足的营养创造有利的条件。菌株L-H15分泌的CTK含量在40 h达到顶峰后开始下降,说明菌株L-H15自身可能对CTK有消耗需求[15]。CTK能促进细胞的分裂,并延缓细胞的衰老。推测L-H15进入衰亡期时,通过吸收CTK来延缓细胞的衰老,并刺激菌体细胞继续分裂,而其产生的CTK也能够直接被植物吸收利用,协助幼苗根系吸收系统的迅速
建立[16-17]。
乙烯对植物生长的影响,取决于乙烯的含量和植物对乙烯的敏感程度。在成熟的果实中乙烯浓度会显著提高[18-19];遇到不良环境胁迫也会大量积累乙烯[20]。“逆境乙烯”的产生在某种意义上来说是植物自身的一种应激反应,能够起到自我保护的作用,但高于正常浓度的乙烯也会导致植物生长发育受阻或死亡[21]。Adams等[4]发现ACC是乙烯生物合成的前体,而根际促生菌分泌的ACC脱氨酶可将ACC分解成α-丁酮酸和氨,从而抑制乙烯的生成。解淀粉芽孢杆菌L-H15产ACC脱氨酶比活力为0.401 U/mg,即24.06 μmol/(mg·h)。查阅相关文献,马嘉敏[22]分离得到11株苜蓿根际促生菌,其分泌的A C C脱氨酶活性在1.1 7~29.78 μmol/(mg·h)范围内;龚凤娟[23]从杜仲内生细菌分离得到Pseudomonas koreensi JDM-2的ACC脱氨酶具有0.178 U/mg的最高酶活,绞股蓝内生细菌Pseudomonas sp. JDG-7的酶活性最高,为0.870 U/mg;周仲强[24]筛选的植物根际促生菌产ACC脱氨酶活力范围为0.315~0.461 U/mg。可以看出菌株L-H15产ACC脱氨酶的活力较强。
近年发现植物根际促生菌产生的VOCs对植物的生长调控有不容小觑的作用[25]。关于根际促生菌挥发性物质对植物生长最具影响力的报道是Ryu等[5]发表的枯草芽孢杆菌GB03和解淀粉芽孢杆菌IN937a产生的2,3-丁二醇和乙酰甲基原醇能促进拟南芥的生长,本研究中解淀粉芽孢杆菌L-H15能产生乙酰甲基原醇,这与Ryu等[5]的报道相一致,说明菌株L-H15能够产生对植物有促生作用的挥发性物质。
由于解淀粉芽孢杆菌L-H15有开发成生物肥料的潜力,使用液体发酵能使其周期缩短、产量增加、质量稳定,具有很高的经济效益。解淀粉芽孢杆菌发酵条件主要影响因素有装液量、接种量、发酵时间、发酵温度和转速。装液量过少,发酵液相应的碳氮源和营养成分少,不够支持活菌的持续增长;装液量过多,溶氧含量降低,影响微生物的有氧呼吸,导致活菌数下降。在发酵工业中,合适的接种量不仅有利于菌株发酵的快速启动,更能提高菌株对发酵培养基的利用率。当接种量较小时,初始菌株生长缓慢而导致杂菌污染的机率增大,影响发酵产品的质量[26];但接种量过大,会加速培养基的消耗,菌体产生大量的次级代谢产物也可能对菌体的繁殖产生抑制作用。细菌生长曲线分为迟滞期、对数生长期、稳定生长期和衰亡期,发酵时间一般控制在稳定期。发酵时间过短,细菌菌体没有充分形成;发酵时间过长,培养基被大量消耗,导致微生物生长所需物质匮乏,不仅菌体活力会降低,菌体细胞也会自溶死亡。发酵温度是影响菌株发酵水平的重要因素之一,温度升高,细菌细胞中蛋白质和酶活性增强,生物化学反应加快,生长与繁殖速率提高;但温度上升超过一定阈值后,细菌细胞中对温度较敏感的组成成分(如蛋白质、核酸等)会受到不可逆的破坏,进而抑制菌体生长与繁殖。转速对发酵的影响主要是对通气量的调节,解淀粉芽孢杆菌L-H15为好氧菌,故转速越高,通气量越大,菌株生长越旺盛。本研究通过Plackett-Burman试验、最陡爬坡试验和Box-Behnken响应面试验优化了因素间的交互影响,最终菌落数达到了较高的水平,这为今后开发微生物肥料提供了很好的理论依据。
参考文献:
[1] 刘淑琮, 冯断, 于洁. 植物根际促生菌的研究进展及其环境作用[J]. 湖北农业科学, 2009, 48(11): 2882-2887. DOI:10.3969/ j.issn.0439-8114.2009.11.081.
[2] Abd HALIM M R, SINNIAH U R, TORABI M, et al. Influence of salinity on the germination of Iranian alfalfa ecotypes[J]. African Journal of Agricultural Research, 2011, 6(19): 4624-4630.
[3] SCHWYN B, NEILANDS J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9.
[4] ADAMS D, YANG S F. Ethylene biosynthesis: identification of 1-aminocyclopropane-1-carboxylic acid as an intermediate in the conversion of methionine to ethylene[J]. Proceeding of National Academy Science of the USA, 1979, 76(1): 170-174. DOI:10.1073/pnas.76.1.170.
[5] RYU C M, FARAG M A, HU C H. Bacterial volatiles promote growth in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4927-4932.
[6] KUKLINSKY-SOBRAL J, ARAÚJO W L, MENDES R, et al. Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion[J]. Environmental Microbiology, 2005, 6(12): 1244-1251. DOI:10.1111/j.1462-2920.2004.00658.x.
[7] FARIA D C, DIAS A F, MELO I S, et al. Endophytic bacteria isolated from orchid and their potential to promote plant growth[J]. World Journal of Microbiology & Biotechnology, 2013, 29(2): 217-221.
[8] BOUTARD-HUNT C, SMART C D, THALER J, et al. Impact of plant growth-promoting rhizobacteria and natural enemies on myzus persicae infestations in pepper[J]. Journal of Economic Entomology, 2009, 102(6): 2183-2191.
[9] VACHERON J, DESBROSSES G, BOUFFAUD M L, et al. Plant growth-promoting rhizobacteria and root system functioning[J]. Frontiers in Plant Science, 2013, 4(9): 356-357. DOI:10.3389/ fpls.2013.00356.
[10] VOLOVA T G, KISELEV E G, SHISHATSKAYA E I, et al. Cell growth and accumulation of polyhydroxyalkanoates CO2and H2of a hydrogen-oxidizing bacterium, Cupriavidus eutrophus B-10646[J]. Bioresource Technology, 2013, 146(10): 215-222.
[11] FISHER K, NEWTON W E. Nitrogenase proteins from Gluconacetobacter diazotrophicus, a sugarcane-colonizing bacterium[J]. Biochimica Et Biophysica Acta, 2005, 1750(2): 154-165. DOI:10.1016/j.bbapap.2005.04.010.
[12] WANG Z, LIU Z, YU F, et al. Siderophore-modified Fenton-like system for the degradation of propranolol in aqueous solutions at near neutral pH values[J]. Chemical Engineering Journal, 2013, 229(8): 177-182. DOI:10.1016/j.cej.2013.05.118.
[13] 蒙渊. 产铁载体和ACC脱氨酶的氢氧化细菌筛选及促生作用研究[D].西安: 西北大学, 2011.
[14] 孙红启. 黑曲霉An76铁载体研究[D]. 济南: 山东大学, 2005.
[15] 席琳乔, 李德峰, 王静芳, 等. 棉花根际促生菌固氮和分泌生长激素能力的测定[J]. 干旱区研究, 2008, 5(5): 690-694.
[16] O RT Í Z C A S T R O R, C O N T R E R A S C O R N E J O H A, MACÍASRODRÍGUEZ L. The role of microbial signals in plant growth and development[J]. Plant Signaling & Behavior, 2009, 4(8): 701-712.
[17] MIYAKAWA T, FUJITA Y, YAMAGUCHISHINOZAKI K, et al. Structure and function of abscisic acid receptors[J]. Trends in Plant Science, 2013, 18(5): 259-266.
[18] ZHANG J, LIU J, MENG L, et al. Isolation and characterization of plant growth-promoting rhizobacteria from wheat roots by wheat germ agglutinin labeled with fluorescein isothiocyanate[J]. Journal of Microbiology, 2012, 50(2): 191-198. DOI:10.1007/s12275-012-1472-3.
[19] DAMMES E V, FOUQUAERT E, LANNOO N, et al. Novel concepts about the role of lectins in the plant cell[J]. Advances in Experimental Medicine & Biology, 2011, 705: 271-294.
[20] 王海滨, 王平, 陈永华. 脱氨酶的作用机理和转基因的应用[J]. 生物技术通报, 2009, 4(2): 40-43.
[21] RIBEIRO C M. Isolation, selection and characterization of rootassociated growth promoting bacteria in Brazil Pine (Araucaria angustifolia)[J]. Microbiological Research, 2012, 167(2): 69-78. DOI:10.1016/j.micres.2011.03.003.
[22] 马嘉敏. 苜蓿根际促生菌的分离及促生作用研究[D]. 哈尔滨: 哈尔滨师范大学, 2013.
[23] 龚凤娟. 具有ACC脱氨酶活性的内生细菌及根际细菌的分离鉴定及其植物促生作用[D]. 吉首: 吉首大学, 2012.
[24] 周仲强. 植物根际促生细菌功能菌株的筛选[D]. 长春: 吉林大学, 2007.
[25] GUERRERO-RODRÍGUEZ J D, REVELL D K, BELLOTTI W D. Mineral composition of Lucerne (Medicago sativa) and white melilot (Melilotus albus) is affected by NaCl salinity of the irrigation water[J]. Fuel & Energy Abstracts, 2011, 170(12): 97-104. DOI:10.1016/ j.anifeedsci.2011.07.011.
[26] 杨柳, 郑华张, 邑帆, 等. 凝结芽孢杆菌芽孢高产固体发酵的研究[J]. 家畜生态学报, 2013, 34(7): 49-53. DOI:10.3969/ j.issn.1673-1182.2013.07.011.
Plant Growth Promoting Characteristics of Bacillus amyloliquefaciens L-H15 and Optimization of Its Culture Conditions
WANG Hui1, SHANG Qingmao2, ZHANG Zhigang2, ZHANG Ying1, LI Pinglan1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract:Plant growth promoting rhizobacteria (PGPR) c an decompose and transform organic substances and minerals in soil, prevent and control plant diseases and reduce the use of pesticides and fertilizers. Thus, PGPR are considered to be used as a new strategy to improve agricultural production. Bacillus amyloliquefaciens L-H15 is an excellent plant growth promoting rhizobacterium. Based on the results of previous studies of its full-length genomic sequence, we investigated the plant growth promoting properties of B. amyloliquefaciens L-H15 and optimized its culture conditions in order to develop a highly active solid starter culture. Our results indicated that B. amyloliquefaciens L-H15 produced a high level of siderophore (65.53%) and strong activity of 1-aminocyclopropane-1-carboxylate (ACC) deaminase showing a speci c activity of 0.401 U/mg. This strain could also produce indole-3-acetic (IAA) and cytokinins (CTK). The abilityto produce CTK was particularly signi cant, which was as high as 2.157 7 × 10-10mol/L. Acetyl methyl alcohol, which can promote plant growth, was also detected in the volatiles generated by L-H15. These factors were able to effectively stimulate plant growth. We used response surface methodology based on Box-Behnken design to optimize the culture conditions of B. amyloliquefaciens L-H15 as follows: an inoculum size of 8%, a proportion of medium in a 500-mL volumetrica sk of 67.8%, a culture temperature of 32 ℃, a culture time of 11.5 h, and a rotational speed of 196 r/min. Under these conditions, the viable cell count of B. amyloliquefaciens L-H15 was 1.21 × 109CFU/mL. In conclusion, B. amyloliquefaciens L-H15 is an excellent PGPR, which has a broad prospect of development and utilization as a biofertilizer.
Key words:Bacillus amyloliquefaciens L-H15; plant growth promoting factors; fermentation process
DOI:10.7506/spkx10 02-6630-201710013
中图分类号:S482.292
文献标志码:A
文章编号:1002-6630(2017)10-0074-08
收稿日期:2016-06-06
基金项目:公益性行业(农业)科研专项(20130314-04)
作者简介:王卉(1990—),女,硕士研究生,研究方向为应用微生物。E-mai l:wanghui31240@163.com
*通信作者:李平兰(1964—),女,教授,博士,研究方向为应用微生物。E-mail:lipinglan@cau.edu.cn
引文格式:
王卉, 尚庆茂, 张志刚, 等. 解淀粉芽孢杆菌L-H15产促生物质分析及发酵工艺优化[J]. 食品科学, 2017, 38(10): 74-81. DOI:10.7506/spkx1002-6630-201710013. http://www.spkx.net.cn
WANG Hui, SHANG Qingmao, ZHANG Zhigang, et al. Plant growth promoting characteristics of Bacillus amyloliquefaciens L-H15 and optimization of its culture conditions[J]. Food Science, 2017, 38(10): 74-81. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710013. http://www.spkx.net.cn