表 1 不同窖底泥理化性质的单因素方差分析
Table 1 One-way analysis of variance (ANOVA) of physicochemical characteristics in different bottom pit muds
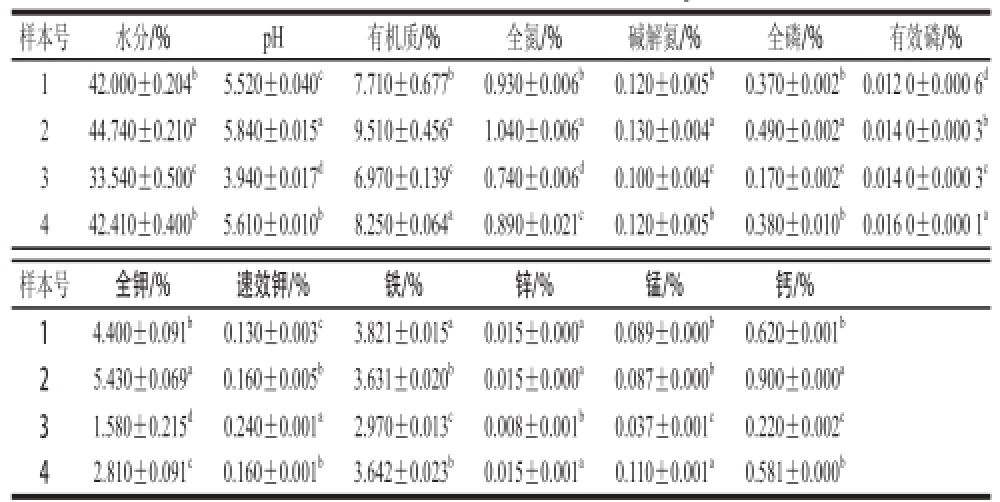
注:同列数据小写字母不同表示差异显著(P<0.05)。
蔡雪梅1,蒋英丽2,吴联海2,徐 延1,陈 剑1,高 鸿1,罗爱民1,*
(1.四川大学轻纺与食品学院,四川 成都 610064;2.四川省古蔺郎酒厂有限公司,四川 古蔺 646500)
摘 要:为探讨酱香型白酒人工窖底泥中细菌的多样性及其影响因子,应用高通量测序技术,比较4 种不同区域人工窖底泥的细菌多样性,并结合理化指标进行了相关性分析。结果表明,不同区域的窖底泥理化性质及细菌群落结构都存在一定差异,且距离越远细菌群落结构差异越大。聚类结果显示区域相近的二郎镇、习酒镇和茅台镇的窖底泥细菌群落结构类似,其主要菌群包括Aminicenantes、绿弯菌门和变形菌门;而泸州市的窖底泥与这3 个区域的有明显差异,其主要菌群是厚壁菌门。影响窖底泥细菌群落结构与多样性的主要理化因子有pH值、速效钾和水分,受这3 种理化因子影响较为显著的菌群有Aminicenantes、厚壁菌门、放线菌门、装甲菌门。
关键词:高通量测序;细菌多样性;酱香型白酒
酱香型白酒是中国白酒的五大香型之一[1],具有酱香突出、酒体醇厚、幽雅细腻、回味悠长的风格特点[2-4],酱香型酒的典型代表有国酒茅台和四川郎酒。酱香型白酒有3 种典型体:“酱香型”、“醇甜型”及“窖底香型”,成品酱香型白酒是以此3 种典型体为主勾兑而成。酱香型白酒发酵容器是泥底条石窖,发酵时窖底酒醅与窖底泥接触;“窖底香型”酒在实际生产中采用“双轮底”生产技术,在“三、四、五、六”轮次进行生产,其品质与窖底泥质量有密切关系。窖底泥中富集了大量的微生物及生物营养(包括氮、磷、钾等元素和多种化合物),不仅对窖底香型白酒中微量香味成分的形成及其量比关系的协调起着重要的作用,也在白酒酿造过程中起到接种微生物和提供发酵环境的重要作用,为酿酒提供丰富的风味物质[5-9]。“窖底香型”白酒成分主要包括已酸、已酸乙酯、乳酸乙酯等为主的香味香气,浓烈且凸显柔和,它是由品质好的窖池,经过较长时间的发酵取窖底酒醅蒸馏,贮存而得,里面的微量成分丰富,常作为调味酒使用,在酱香型白酒产品质量中发挥着重要的作用。
近年来,对浓香型白酒窖泥研究较多,而对酱香型白酒窖泥,尤其是窖底泥研究则较为少见。陶勇等[10]利用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)技术研究了不同窖龄的窖泥微生物与环境因子的相关性,得出有效磷、氨氮、pH值对微生物群落结构的影响较大,其次是腐殖质;黄治国等[11]利用PCRDGGE研究了不同区域浓香型白酒窖池窖泥细菌群落结构差异及其与理化因子的关系,得出不同区域的窖泥样本细菌多样性有明显差异,且其多样性与总酸呈负相关、与pH值呈正相关;韩光等[12]研究了窖泥微生物、窖泥酶活与窖泥养分的相关性,得出速效磷、水解氮、蔗糖酶和过氧化氢酶是影响微生物总数量的主要因子。酱香型白酒中“窖底香型”白酒与窖底泥的质量关系重大,但酱香型白酒窖底泥研究较为少见,特别是关于酱香型人工窖底泥的细菌多样性及其与理化因子的相关分析研究报道较少,酱香白酒窖底泥是否与浓香型白酒窖泥具有相似的特性,这是一个值得进一步探讨的问题。
利用分子生物学方法研究获得微生物遗传信息多样性的方法是目前研究微生物多样性的主要方法,主要包括末端限制性片段长度多态性分析、DGGE、16S rDNA克隆文库、高通量测序技术等分子生物学技术,这些方法避免了传统微生物多样性分析方法局限性[13-14],在分析复杂环境微生物群落结构中具有重要优势,能更可靠、更直接地反映细菌的群落构成及多样性[15]。但大多数方法主要基于传统测序技术及芯片技术来开展,测序通量有限且只能检测环境中部分高丰度菌株的微生物信息,无法全面获得整个环境中微生物的多样性及功能基因信息[16]。随着高通量测序技术的发展,第2代的高通量测序技术如Roche454、Illumina HiSeq2000/2500/4000及MiSeq,Ion Torrent以及PacBio等,相比基因文库、DGGE等菌群分析方法的数据量更大、分辨率更高,且免去大量人工操作,可有效用于各种酒类微生物多样性研究[13,17]。
本实验利用MiSeq高通量测序技术探讨不同区域酱香型白酒窖底泥细菌群落结构和多样性,并探索其与理化特征之间的相关性,为今后制定判断酱香型窖底泥质量标准提供基础,同时也为人工窖底泥的培养提供参考。
1.1 样本采集
人工窖底泥样本分别采自习酒镇、二郎镇、泸州市和茅台镇地区4 家酱香型白酒厂,用取样器转移至无菌聚乙烯袋[18],密封保存,迅速置于冰盒运回,分别编号为1、2、3、4号,置于-20 ℃条件下保藏。
1.2 试剂
AxyPrepDNA凝胶回收试剂盒 美国Axygen公司;QuantiFluor-ST蓝色荧光定量系统 美国Promega公司;牛血清白蛋白(bovine serum albumin,BSA) 盐城赛宝生物科技有限公司;其他试剂均为国产分析纯。
1.3 仪器与设备
IKA VORTEX1振荡仪 莱贝(上海)科学仪器有限公司;JA1203分析天平 上海楚定分析仪器有限公司;TGL20M-Ⅱ冷冻离心机 西安禾普生物科技有限公司;火焰分光光度计 上海傲谱分析仪器有限公司;ABI GeneAmp® 9700 PCR仪 上海赛默生物科技有限公司;核酸蛋白微量检测仪 芯起点基因科研(北京)有限公司。
1.4 方法
1.4.1 窖底泥理化性质的测定
窖底泥理化性质参考文献[19],其中水分:常压烘干法;pH值:电位法;有机质:K2Cr2O7容量法;全氮:半微量开氏法;碱解氮:碱解扩散法;全磷:HClO4-H2SO4消煮法;有效磷:NaHCO3浸提-钼锑抗比色法;全钾:火焰光度法;速效钾:NH4OAC浸提-火焰光度法;铁、锌、锰、钙:原子吸收分光光度法。
1.4.2 窖底泥总DNA的提取与测序
使用MIBIO Ultra Clean Soil DNA Isolation Kit[18]试剂盒提取窖底泥中微生物的总DNA,然后用核酸蛋白微量检测仪检测DNA的质量浓度和纯度,置于-20 ℃条件下备用。PCR扩增以338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)为引物,20 μL反应体系:5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、正向及反向引物(5 μmol/L)各0.8 μL、FastPfu聚合酶0.4 μL、BSA 0.2 μL、模板DNA 10 ng,补ddH2O至20 μL。反应参数:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27 个循环;72 ℃ 10 min;10 ℃保存。每个样取3 μL用2%琼脂糖凝胶电泳检测PCR产物,使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱。之后将PCR产物用QuantiFluor-ST蓝色荧光定量系统进行检测定量,再进行Miseq文库构建及测序。
1.4.3 数据分析
采用SPSS 19.0对窖底泥理化性质的数据进行方差分析以及对窖底泥细菌多样性和理化进行相关性分析;采用Mothur软件对测序得到的数据进行操作分类单元(optical transform unit,OTU)聚类以及多样性分析。
2.1 不同区域人工窖底泥的理化特性
表 1 不同窖底泥理化性质的单因素方差分析
Table 1 One-way analysis of variance (ANOVA) of physicochemical characteristics in different bottom pit muds

注:同列数据小写字母不同表示差异显著(P<0.05)。
窖泥生物营养是构成其微生态系统的重要组成成分,窖池中所有微生物和理化特性相互作用、相互联系共同构成具有协调性和机能性的统一体[20-22]。共测定分析了窖底泥的11 个理化指标,结果表明,2号样本的水分、pH值、有机质、全氮、全磷、全钾均显著高于其他3 个样本(P<0.05);3号样本的水分、pH值、有机质、全氮、碱解氮、全磷、全钾、铁锰锌钙含量均显著低于其他样本,而其有效钾含量显著高于其他样本(P<0.05);1号和4号样本除有效磷和金属元素外,其他指标值均介于2号与3号样本之间,且1号和4号样本的pH值、有机质、全氮、有效磷、全钾、速效钾以及铁锰含量均存在显著差异(P<0.05)(表1)。分析可知,不同区域的窖底泥理化性质存在一定的差异,除了区域差异而导致的环境因素外,还可能是由于工艺上存在的不同以及窖龄没有绝对的一致[11]。
2.2 窖底泥细菌多样性
2.2.1 测序数据合理性分析
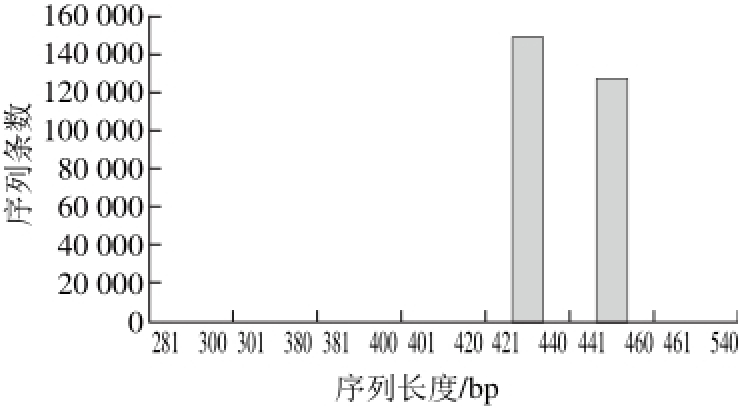
图 1 有效序列长度分布图
Fig. 1 Effective sequence length distribution
通过Miseq高通量测序,将序列优化后最终得到优化序列25 5797 条,其中有效序列99.88%分布在421~460 bp,其中421~440 bp的碱基占总序列数的58.06%,441~460 bp的碱基占49.55%(图1)。

图 2 各窖底泥细菌稀释性曲线
Fig. 2 Rarefaction curves for bacteria in different pit bottom muds
根据相似度水平对所有优化序列进行OTU划分,对97%相似水平下的OTU进行生物信息统计[23],共聚类形成822 个OTU。采用对测序序列随机抽样的方法,以抽到的序列数与其所代表的OTU的数目构建稀释性曲线(图2)。4 个样本的稀释性曲线均趋于平坦,说明测序数据量合理,已反映样本中绝大部分细菌的丰度及多样性,更多的数据量只会产生少量新的OTU。
2.2.2 细菌群落结构分析

图 3 群落结构组分图
Fig. 3 Bacterial community components
4 个样本共检测到35 个细菌门,其中1号样本检测到33 个,2号样本检测到30 个,3号样本检测到24 个,4号样本检测到28 个。1号样本的优势菌群有绿弯菌门(Chloroflexi,34.48%)、Aminicenantes(29.04%)、变形菌门(Proteobacteria,12.15%);2号样本的优势菌群有Aminicenantes(32.28%)、Chloroflexi(19.52%)、Proteobacteria(15.03%);3号样本的优势菌群有厚壁菌门(Firmicutes,86.98%);4号样本的优势菌群有Chloroflexi(61.82%)、Aminicenantes(20.72%)(图3)。Chloroflexi、Proteobacteria和Firmicutes在浓香型白酒窖泥中都有发现,但Aminicenantes未曾被报道,其在酱香型窖底泥中的作用机制有待进一步研究。3号样本中的微生物主要组成与其他3 个样本相比有明显差异,其主要菌群Firmicutes一般在浓香型窖泥中含量较高[24],此菌门中的乳球菌属和芽孢杆菌属对窖泥呈味生香贡献较大[25],且窖泥的主要产酸功能菌己酸菌主要分布在芽孢杆菌属[26]。根据样本的细菌丰度,使用SPSS 19.0计算其欧几里德距离,当欧几里德距离小于5时,1、2、4号样本可以归为一类,表明赤水河流域一带的习酒镇、二郎镇和茅台镇的3 个酒厂的窖底泥细菌群落结构相似,其中习酒镇酒厂和二郎镇酒厂的窖底泥更为相近,泸州市窖底泥与其他3 种差异较大(图4)。这说明区域越相近的窖底泥的微生物群落结构越相似,王莉等[27]已证实酱香型白酒生产地域周边土壤对于窖底泥的形成具有重要的影响,区域越相近土壤结构越相似,这进一步说明环境因素是导致不同区域窖底泥存在差异的重要原因之一。

图 4 聚类分析树状图
Fig. 4 Cluster analysis dendrogram
2.2.3 细菌群落结构多样性分析通过样本的多样性分析计算出一系列统计学多样性指数[28],进而估计窖底泥细菌群落的物种丰度和多样性。由表2可知,2号样本OTU种类最多,物种多样性最丰富,其次是1号样本,4号样本的物种多样性最少。理化结果分析发现,2号样本物种最丰富且其水分、pH值、有机质、全氮、全磷、全钾均显著高于其他3 个样本,张强等[29]曾指出营养物质的富集有助于酿酒微生物的生长,这说明良好的理化环境能够提高窖底泥细菌的多样性。
表 2 不同窖底泥细菌群落的多样性分析
Table 2 Diversity index for bacterial community of different pit muds

注:相似度为97%;Ace指数.样本OTU数目的种类;Chao指数.样本微生物物种总数;Simpson、Shannon指数.衡量微生物物种的多样性,Shannon指数值越高,Simpson指数值越低,物种多样性越丰富,反之物种多样性越少。下同。
2.2.4 细菌群落结构的多样性与理化性质的关系利用SPSS 19.0分析计算窖底泥理化性质与细菌多样性的相关性。由表3可知,有机质、速效钾与Chao指数、
表 3 窖底泥细菌多样性与理化的相关性分析
Table 3 Correlation analysis between bacterial diversity and physicochemical properties

注:**.在0.01水平(双侧)上显著相关;*.在0.05水平(双侧)上显著相关。表4同。
Ace指数呈显著负相关,全氮、全钾、水分、pH值、锌与Chao指数、Ace指数在不同水平上呈显著正相关。水分在0.01水平上与Shannon指数呈显著正相关;速效钾在0.05
水平上与Shannon指数呈显著负相关,与Simpson指数呈显著正相关;pH值在0.01水平上与Shannon指数呈显著正相关,与Simpson指数呈显著负相关。这说明pH值、速效钾和水分与窖底泥细菌群落多样性有显著相关性,其中pH值最为显著,pH值影响微生物的代谢活动,从而引起有机质、矿物元素以及金属元素的变化,而这些变化会进一步影响窖泥的细菌群落结构,在浓香型窖泥相关研究报道中也有指出pH值对微生物群落结构的影响较大[10-11]。
2.2.5 细菌群落结构与窖底泥理化性质的关系
表 4 窖底泥细菌群落结构与理化的相关性分析
Table 4 Correlation analysis between bacterial community structure and physicochemical properties

相关性分析表明,在0.05水平上,Aminicenantes与速效钾呈显著负相关,与水分、pH值、锌元素呈显著正相关;Firmicutes与水分、pH值以及铁锌呈显著负相关,与速效钾呈显著正相关;Actinobacteria与pH值呈显著负相关;Armatimonadetes与速效钾呈显著负相关(表4)。分析表明,对细菌群落结构影响较为显著的理化因子有:pH值、速效钾、水分,受这些因子影响较为显著的菌群有:Aminicenantes、Firmicutes、Actinobacteria、Armatimonadetes。
通过高通量测序方法研究远近距离不同区域的窖底泥微生物群落结构,清晰全面地揭示了微生物组成的差异,并结合理化性质分析了细菌群落结构及多样性与理化特征之间的关系。所选取的远近不一的4 个区域的酱香型窖底泥具有一定的区域代表性,因为在窖泥的制作过程中,黄泥占了主要部分,一般窖泥生产时就地取材,所以推测同一区域的窖泥具有一定的相似性,同时由于不同厂家的窖泥生产工艺具有一定差异,也造成了窖泥的差异性,因此假设同一区域的窖泥具有很强的相似性,这对于取样来讲,即可减少研究样本的数量,又具有一定的代表性。
通过4 个样本的比较分析,发现不同区域的窖底泥理化性质和细菌群落结构都存在一定的差异,且区域距离越远差异越大。二郎镇窖底泥的水分、pH值、有机质、全氮、全磷、全钾均显著高于其他3 种窖底泥,且其细菌物种总数最多,细菌多样性最丰富;而距赤水河流域一带较远的泸州窖底泥水分、pH值、全氮、碱解氮、全磷、有效磷、全钾、铁锰锌钙均显著偏低,且其细菌多样性也较低。赤水河流域一带的3 个区域(习酒镇、二郎镇、茅台镇)的窖底泥细菌群落结构相似,其中距离较近的习酒镇和二郎镇的窖底泥更为相近。导致这些差异性存在的原因除了工艺和取样点的不完全一致性,可能更重要的是地理环境因素,黄泥和黄水作为制作人工窖底泥的主要原辅料,携带着丰富的微生物,是窖底泥重要的微生物来源,而不同区域的土壤和水资源存在差异,其具体形成差异性的原因有待进一步探讨。
通过相关性分析,发现窖底泥细菌群落结构及多样性主要受pH值、速效钾、水分的影响。在一定范围类,窖底泥细菌多样性与速效钾呈负相关,与pH值和水分含量呈正相关,受这3 种理化因子影响较为显著的菌群有:Aminicenantes、Firmicutes、Actinobacteria、Armatimonadetes,其具体影响机制有待后续研究。
参考文献:
[1] 李习, 方尚玲, 刘超, 等. 酱香型白酒风味物质主体成分研究进展[J].酿酒, 2012, 39(3): 19-23. DOI:10.3969/j.issn.1002-8110.2012.03.008.
[2] 朱德文, 蒋英丽, 高鸿, 等. 酱香型大曲中一株产香芽孢杆菌的分离鉴定[J]. 酿酒科技, 2014(6): 43-46. DOI:10.13746/j.njkj.2014.0051.
[3] 陈剑, 蒋英丽, 程伟, 等. 酱香型白酒酒糟中耐酸产酯香细菌的筛选[J].酿酒科技, 2016(2): 61-64. DOI:10.13746/j.njkj.2015413.
[4] 王婧, 王晓丹, 罗晓叶, 等. 酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J]. 中国酿造, 2015, 34(10): 43-46. DOI:10.11882/ j.issn.0254-5071.2015.10.010.
[5] 任道群, 刘茂柯, 唐玉明, 等. 浓香型酒窖泥理化特性的研究[J]. 中国酿造, 2014, 33(10): 55-57. DOI:10.11882/j.issn.0254-5071.2014.10.013.
[6] 刘淼, 姚万春, 唐玉明, 等. 功能性人工窖泥的培养和应用[J]. 酿酒科技, 2014(6): 80-83. DOI:10.13746/j.njkj.2014.0060.
[7] 郭富祥, 侯建光, 张俊峰. 人工窖泥培养工艺探析[J]. 酿酒科技, 2013(11): 47-49. DOI:10.13746/j.njkj.2013.11.031.
[8] 谢玉球, 林洋, 周二干, 等. 人工窖泥的制作和养护[J]. 酿酒科技, 2013(2): 67-69. DOI:10.13746/j.njkj.2013.02.033.
[9] 徐开成, 徐希望, 夏培禹, 等. 人工窖泥在北方浓香型曲酒生产中的应用[J]. 酿酒科技, 2005(1): 50-51. DOI:10.13746/j.njkj.2005.01.014.
[10] 陶勇, 徐占成, 李东讯, 等. 窖泥细菌群落结构演替及其与环境因子的相关性[J]. 酿酒科技, 2011(9): 42-46. DOI:10.13746/ j.njkj.2011.09.002.
[11] 黄治国, 王艳丽, 卫春会, 等. 不同地域窖泥细菌群落结构差异及其与理化因子相关分析[J]. 酿酒科技, 2015(11): 18-25. DOI:10.13746/ j.njkj.2015097.
[12] 韩光, 张宿义, 卢中明, 等. 窖泥微生物,窖泥酶活性与窖泥养分相关性研究[J]. 酿酒科技, 2011(3): 49-52. DOI:10.13746/ j.njkj.2011.03.023.
[13] 叶光斌, 罗惠波, 杨晓东, 等. 基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J]. 食品科学, 2013, 34(17): 176-181. DOI:10.7506/spkx1002-6630-201317038.
[14] YANG F, ZENG X W, NING K, et al. Saliva microbiomes distinguish caries-active from healthy human populations[J]. The ISME Journal, 2012, 6(1): 1-10. DOI:10.1038/ismej.2011.71.
[15] NOGALES B, MOORE E R B, LLOBE-BROSSA E, et al. Combined use of 16S ribosomal DNA and 16S rRNA to study the bacterial community of polychlorinated biphenyl-polluted soil[J]. Applied and Environmental Microbiology, 2001, 67(4): 1874-1884. DOI:10.1128/ AEM.67.4.1874-1884.2001.
[16] 陈玲, 袁玉菊, 曾丽云, 等. 16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J]. 酿酒科技, 2015(12): 33-36. DOI:10.13746/j.njkj.2015145.
[17] MACCALLUM I, PRZYBYLSKI D, GNERRE S, et al. Small genomes assembled accurately and with high continuity from short paired reads[J]. Genome Biology, 2009, 10(10): R103. DOI:10.1186/ gb-2009-10-10-r103.
[18] DENG B, SHEN C H, SHAN X H, et al. PCR-DGGE analysis on microbial communities in pit mud of cellars used for different periods of time[J]. The Institute of Brewing and Distilling, 2012, 118(1): 120-126. DOI:10.1002/jib.2.
[19] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2005.
[20] 李海峰, 沈才洪, 卢忠明, 等. 人工窖泥的研究进展[J]. 酿酒, 2012, 39(2): 33-38. DOI:10.3969/j.issn.1002-8110.2012.02.033.
[21] 姚继承, 殷成浩, 屈光伟, 等. 窖池养护的基本原理与实践[J]. 酿酒科技, 2014(6): 74-76. DOI:10.13746/j.njkj.2014.0082.
[22] 李祖明, 张洪远, 王于广, 等. 酱香型窖泥理化指标的研究[J]. 食品科技, 2011, 36(9): 79-82. DOI:10.13684/j.cnki.spkj.2011.09.044.
[23] OBERAUNER L, ZACHOW C, LACKNER S, et al. The ignored diversity: complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J]. Scienti c Reports, 2013, 3: 1413. DOI:10.1038/srep01413.
[24] 陶勇, 芮俊鹏, 徐占成, 等. 浓香型白酒窖泥中细菌和古菌的组成与多样性[J]. 化工学报, 2014, 65(5): 1800-1806. DOI:10.13746/ j.njkj.2011.09.002.
[25] 侯小歌, 王俊英, 李学思, 等. 浓香型白酒糟醅及窖泥产香功能菌的研究进展[J]. 微生物学通报, 2013, 40(7): 1257-1265. DOI:10.13344/ j.microbiol.china.2013.07.011.
[26] 杨菁谨, 唐雪, 杨先超, 等. 泸州老窖不同窖龄窖泥中己酸菌遗传多样性及系统发育[J]. 四川农业大学学报, 2016(2): 182-188. DOI:10.16036/j.issn.1000-2650.2015.02.010.
[27] 王莉, 王亚玉, 王和玉, 等. 酱香型白酒窖底泥微生物组成分析[J].酿酒科技, 2015(1): 12-15. DOI:10.13746/j.njkj.2014513.
[28] 乔晓梅, 赵景龙, 杜小威, 等. 高通量测序法对清香大曲真菌群落结构的分析[J]. 酿酒科技, 2015(4): 28-31. DOI:10.13746/ j.njkj.2015076.
[29] 张强, 沈才洪, 刘清斌, 等. 窖泥质量评价研究进展[J]. 酿酒科技, 2013(7): 45-48. DOI:10.13746/j.njkj.2013.07.051.
Diversity of Bacteria and Its Influencing Factors in Bottom Pit Mud from Artificial Cellars Used for the Production Maotai-Flavor Liquor in Different Regions
CAI Xuemei1, JIANG Yingli2, WU Lianhai2, XU Yan1, CHEN Jian1, GAO Hong1, LUO Aimin1,*
(1. College of Light Industry, Textile and Food Engineering, Sichuan University, Chengdu 610064, China; 2. Sichuan Gulin Langjiu Group Co. Ltd., Guli n 646500, China)
Abstract:The purpose of this study was to investigate the bacterial diversity and its influencing factors in bottom pit mud from artificial cellars used for the production of Maotai-flavor liquor. A high-throughput sequencing technique was used to analyze the bacterial diversity of four pit mud samples from different liquor producing regions and its correlations with physicochemical factors. The results showed that there was a significant difference in physicochemical characteristics and bacterial community among bottom pit muds from different regions and the longer the geographic distance was, the greater the difference in bacterial community structure was, the greater in differences was. Cluster analysis showed that the bacterial co mmunity structure of bottom pit muds from Erlang, Xijiu and Maotai, which were closer to each other, was similar, with Aminicenantes, Chloroflexi, and Proteobacteria being predominant. However, the bacterial flora of bottom pit mud from a liquor producer in Luzhou was dominated by Firmicutes, which was significantly different from that of bottom pit mud from the above three regions. Correlation analysis showed that available K, pH, and moisture content were the main factors that had significant effects on the structure and diversity of bacterial community in bottom pit muds, especially for Aminicenantes, Firmicutes, Actinobacteria, and Armatimonadetes.
Key words:high-throughput sequencing; bacterial diversity; Maotai-flavor liquor
DOI:10.7506/spkx1002-6630-201710015
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)10-0087-05
引文格式:
蔡雪梅, 蒋英丽, 吴联海, 等. 不同区域酱香型白酒人工窖底泥细菌多样性及其影响因子[J]. 食品科学, 2017, 38(10): 87-91. DOI:10.7506/spkx1002-6630-201710015. http://www.spkx.net.cn
CAI Xuemei, JIANG Yingli, WU Lianhai, et al. Diversity of bacteria and its influencing factors in bottom pit mud from artificial cellars used for the production Maotai-flavor liquor in different regions[J]. Food Science, 2017, 38(10): 87-91. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710015. http://www.spkx.net.cn
收稿日期:2016-07-22
基金项目:白酒质量安全可追溯系统的发展现状对策研究基金项目(2015ZR0181);四川省战略性新兴产品专项(2015GZX0079)
作者简介:蔡雪梅(1994—),女,硕士研究生,研究方向为发酵工程。E-mail:cxm121517@163.com
*通信作者:罗爱民(1971—),男,副教授,博士,研究方向为发酵工程。E-mail:599159632@qq.com