不同盐质量分数泡白菜发酵过程中乳酸菌群落结构的变化
申文熹1,陈 功1,2,唐 垚1,汪冬冬1,王 勇1,伍亚龙1,张红梅1,张 伟1,朱 翔1,李 恒1,2,张其圣1,2,*
(1.四川东坡中国泡菜产业技术研究院,四川 眉山 620000;2.四川省食品发酵工业 研究设计院,四川 温江 611130)
摘 要:设计3 种不同盐质量分数的泡白菜,包括低盐(2%)、中盐(5%)、高盐(8%),利用可培养方法结合多种分子生物学手段研究其发酵过程中乳酸菌的群落结构。结果表明:盐质量分数越低,乳酸菌增长速率越快。本研究从3 种不同盐质量分数泡白菜发酵过程中分离筛选得到了563 株乳酸菌,并采 用16S rDNA测序、多重聚合酶链式反应、聚合酶链反应-限制性片段长度多态性、API 50CH等多种不同的鉴定方法进行鉴 定,鉴定结果表明这563 株乳酸菌属于5 个属11 个种。结果表明,低盐泡白菜发酵前期的优势菌为Lactococcus lactis、Lactobacillus pentosus和Leuconostoc,发酵后期则由Lactobacillus pentosus主导;中高盐泡白菜发酵前期由Lactobacillus pentosus和Weissella主导,发酵后期主要由Lactobacillus pentosus完成。
关键词:泡白菜;盐质量分数;乳酸菌;群落结构
中国泡菜历史悠久,传承千年,是我国典型的传统发酵食品。泡菜以新鲜蔬菜为原料,在不同浓度食盐水中泡渍,利用蔬菜表面自带的微生物厌氧或兼性厌氧发酵而成[1]。我国泡菜种类繁多,不同类型泡菜的用盐量差异很大,但因保藏的需要,泡菜的食盐浓度一般较高,因此长期食用泡菜可能会导致人体食盐摄入量增高。据统计,我国人均食盐量摄入远高于世界卫生组织推荐的标准(5 g/d)[2],而摄入食盐过量,则可能会增加人体患心血管、高血压等疾病的风险[3]。因此低盐化泡菜越来越受到人们的青睐。然而众所周知,食盐作为泡菜的基本原料之一,不仅是赋予泡菜滋味的重要物质,而且还会直接影响泡菜发酵过程中微生物的群落结构;同时,也与泡菜微生物间的消长、底物消耗及代谢产物等有关,继而直接或间接地影响泡菜的风味和品质[1]。
大量研究表明乳酸菌主导泡菜发酵[4],研究泡菜发酵过程中乳酸菌的数量变化以及群落构成,有利于揭示泡菜发酵规律,发现潜在的有益微生物,是控制泡菜发酵品质和安全性的重要基础工作。盐度对泡菜发酵过程中乳酸菌的生长具有重要的影响,低盐条件下乳酸菌快速生长繁殖,而高盐条件对乳酸菌的生长有所抑制[1],不同类型的乳酸菌其耐盐性也不同,已有相关研究表明我国泡菜主要优势菌属包括Leuconostoc、Lactobacillus等,而这些优势乳酸菌的耐盐性具有较大差异,甚至同种不同株之间也有明显差异[5-7],这种耐盐性的差异可能是导致发酵食品在发酵过程中的细菌群落结构差异的最直接原因,也可能是导致发酵品质差异的最主要影响因素之一[8-9]。
目前针对盐度对泡菜发酵过程中乳酸菌群落结构的影响还少见报道。本研究模拟传统泡白菜发酵,分别研究低盐、中盐和高盐泡菜发酵过程中乳酸菌群落结构,采用可培养方法分离鉴定泡菜发酵过程中的乳酸菌,结合聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)、PCR[10-12]和API 50CH鉴定系统等多种方法对乳酸菌进行鉴定,对过去采用传统16S rDNA[13-15]方法不易于区分的泡菜常见微生物菌种进行区分。本研究将为深入了解和控制泡菜发酵过程、并制备低盐高活性的健康泡菜产品提供理论参考依据。
1 材料与方法
1.1 材料与菌株
卷心白菜、食盐购自眉山当地市场。
模式菌株Lactobacillus pentosus(1.2437)、Lactobacillus plantarum(1.2439)、Leuconostoc pseudomesenteroides(1.2503)、Leuconostoc mesenteroides subsp. mesenteroides(1.2138),购自中国普通微生物菌种保藏管理中心。
1.2 培养基与试剂
MRS液体培养基:蛋白胨10.0 g、牛肉粉5.0 g、酵母粉4.0 g、葡萄糖20.0 g、吐温-80 1.0 mL、磷酸氢二钾2.0 g、乙酸钠5.0 g、柠檬酸三铵2.0 g、硫酸镁0.2 g、硫酸锰0.05 g、蒸馏水1 000 mL,pH 6.2,121 ℃灭菌15 min;MRS固体培养基:在MRS液体培养基中加入琼脂粉15.0 g、纳他霉素0.1 g。
Bacterial DNA Isolation Kit、2×PCR Mix(Foregene Taq DNA聚合酶、dNTPs、Tris-HCl、KCl、MgCl2、胶回收试剂盒 成都福际生物技术公司;PCR引物(表1)成都擎科梓熙生物技术有限公司;无水乙醇 成都市科龙化工有限公司;琼脂糖、Tasl酶 北京索莱宝科技有限公司。
表 1 PCR引物表
Table 1 List of PCR primers
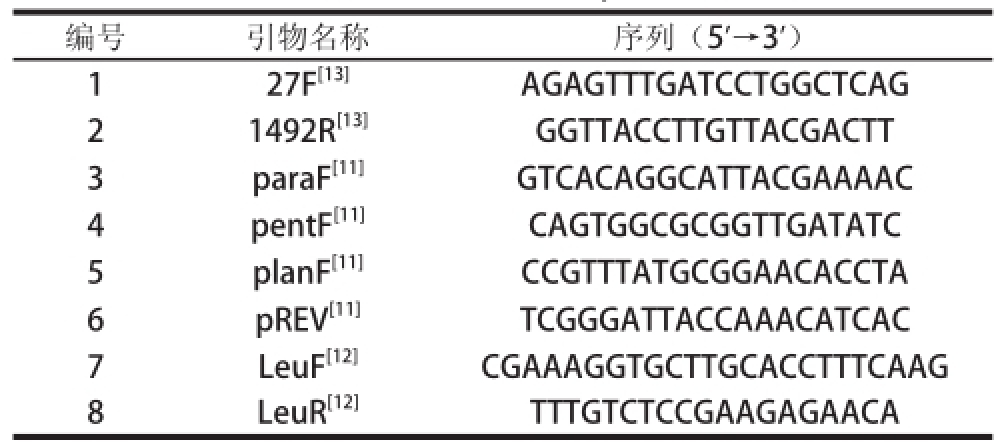
编号引物名称序列(5’→3’)1 27F[13]AGAGTTTGATCCTGGCTCAG 2 1492R[13]GGTTACCTTGTTACGACTT 3 paraF[11]GTCACAGGCATTACGAAAAC 4 pentF[11]CAGTGGCGCGGTTGATATC 5 planF[11]CCGTTTATGCG GAACACCTA 6 pREV[11]TCGGGATTACCAAACATCAC 7 LeuF[12]CGAAAGGTGCTTGCACCTTTCAAG 8 LeuR[12]TTTGTCTCCGAAGAGAACA
1.3 仪器与设备
手动单道移液器、DW-86W100超低温冰箱、TGL-20BR台式冷冻离心机、T960梯度PCR热循环仪、IY04S-3E型凝胶成像分析系统 成都一科仪器设备有限公司;DHP-9080B恒温培养箱、SW-CJ-1FD超净工作台、YM75Z75L不锈钢立式压力蒸汽灭菌器、DYCP-31DN琼脂糖水平电泳仪、HH-4恒温水浴锅 成都智诚科灵仪器仪表有限责任公司;QL-901旋涡混合器 海门市其林贝尔仪器制造有限公司。
1.4 方法
1.4.1 泡白菜制作方法及取样
纯净水烧开冷却,将泡菜坛和新鲜卷心白菜清洗干净,卷心白菜切好备用,称取1 500 g切好的卷心白菜放入泡菜坛中,加入备好的纯净水1 500 mL,按平衡后低盐(NaCl质量分数2%,下同)、中盐(5%)、高盐(8%)泡制,25 ℃恒温发酵。分别于0、1、3、5、7 d和10 d取泡菜发酵液进行分析,取样时先将泡菜轻轻摇匀,取周边4 个点和中间2 个样进行混合。
1.4.2 pH值与总酸含量的测定
采用pH计测定泡菜发酵液的pH值,总酸含量采用酸碱滴定法,总酸含量以乳酸计。
1.4.3 乳酸菌活菌计数
采用微量移液器吸取1 mL发酵液至9 mL含0.85%NaCl的无菌生理盐水中,梯度稀释;选取3 个适宜稀释度,吸取0.1 mL的稀释液加入MRS平板中,涂布棒均匀涂布平板,每个稀释度3 个平行;37 ℃培养48 h后选取菌落数在30~300之间的平板记录菌落数。
1.4.4 乳酸菌分离与鉴定
1.4.4.1 乳酸菌分离纯化与保存
按菌落形态差异(形态、颜色、大小、凸起度、干湿度、透明度、边缘)挑选菌落于MRS平板上划线(三区划线),并记录该菌株与平板上的相似菌株数量;将菌株反复纯化3~4 次后,进行革兰氏染色与接触酶实验,筛选出革兰氏阳性、接触酶阴性的无芽孢纯培养物;将筛选出的菌株于MRS液体培养基中置于37 ℃恒温培养箱里活化18~24 h,与甘油溶液1∶1(V/V)的比例添加到甘油管中(甘油最终体积分数20%),并于-80 ℃超低温冰箱中保存。
1.4.4.2 乳酸菌16S rDNA测序
采用试剂盒提取乳酸菌DNA,-20 ℃保存备用。PCR体系(50 μL):2×PCR Mix 25 μL、模板DNA 1.5 μL、引物27F(10 μmol/L)和1492R(10 μmol/L)各2 μL,加双重蒸馏水补充至50 μL。反应条件:95 ℃预热10 min;93 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,循环10 个周期;接着93 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,循环10 个周期;然后,93 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环10 个周期;最后72 ℃复延伸5 min。PCR扩增产物用2%琼脂糖凝胶电泳检测,目标条带为1 500 bp左右。将符合16S rDNA片段大小(1 500 bp左右)的PCR扩增产物送成都擎科梓熙生物技术有限公司测序,测序结果利用BLAST软件在GenBank数据库中进行比对,下载相似度较高的模式菌株序列,用MEGA 5.05软件中的Neighbor-Joining法进行1 000 次步长计算构建系统发育树。
1.4.4.3 多重PCR
以提取的乳酸菌总D N A为模板,使用引物paraF、pentF、planF和pREV进行多重PCR扩增。PCR体系(50 μL):引物paraF、pentF和pREV终浓度0.25 μmol/L,planF终浓度0.12 μmol/L,DNA模板3 μL,2×PCR Mix 25 μL,加双重蒸馏水补充至50 μL。反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30 个循环;最后72 ℃延伸5 min。将PCR产物于2%琼脂糖凝胶上电泳,凝胶成像系统拍照。目标条带为318 、218 bp或107 bp左右。采用胶回收试剂盒对目标条带进行回收,纯化后的PCR产物采用2%琼脂糖电泳检测,凝胶成像系统拍照,根据电泳条带判别:植物乳酸菌318 bp、戊糖乳杆菌218 bp、类植物乳杆菌107 bp。 1.4.4.4 乳杆菌鉴定
API 50CH试剂条用于鉴定区分乳杆菌。
1.4.4.5 PCR-RFLR鉴定
用于区分Leuconostoc mesenteroides和Leuconostoc pseudomesenteroides,使用引物LeuF、LeuR进行PCR扩增。PCR体系:引物各2.5 μL(10 μmol/L),2×PCR Mix 25 μL,总DNA 1.5 μL,加双重蒸馏水补充至50 μL。反应条件:94 ℃预热5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃复延伸7 min。PCR扩增产物用2%琼脂糖凝胶电泳检测,目标条带为976 bp左右。
RFLR采用Tasl酶进行酶切反应。酶切反应体系:PCR产物10 μL,10×Buffer B 2 μL,Tasl酶2 μL,ddH2O 18 μL。反应条件:65 ℃水浴2 h。产物采用2%琼脂糖电泳检测,凝胶成像系统拍照。
2 结果与分析
2.1 不同盐质量分数泡白菜发酵过程中pH值和总酸变化规律
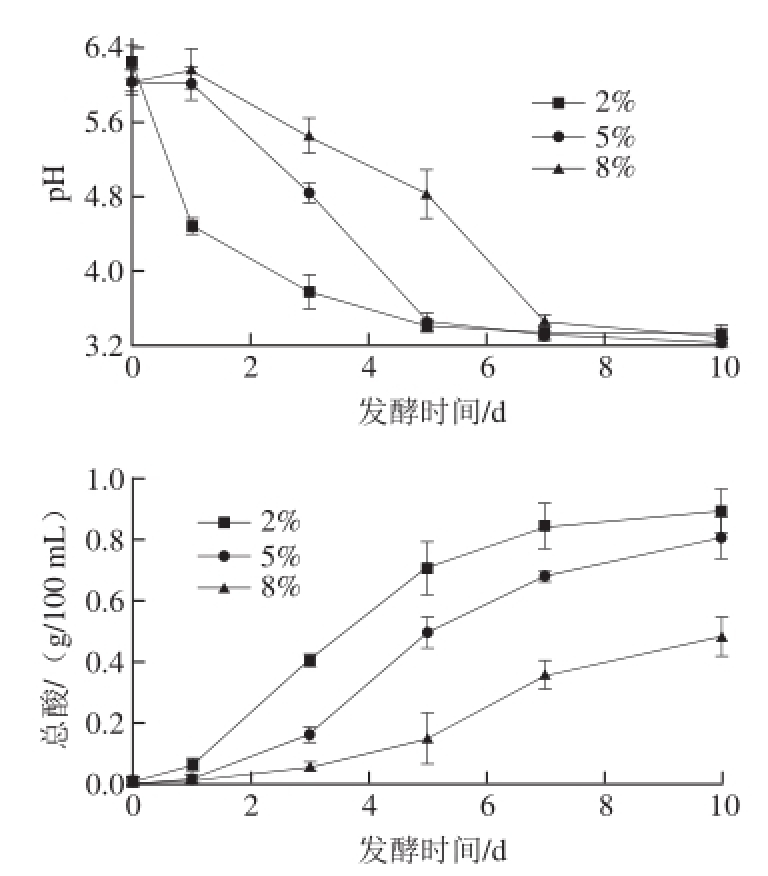
图 1 不同盐质量分数泡白菜发酵过程中pH值和总酸变化
Fig. 1 Dynamic changes in pH and acidity during Paocai fermentation with different salt concentrations
发酵过程中pH值是微生物在特定的环境下代谢活动的综合指标,是一项重要的发酵参数,它对微生物的生长和代谢产物的形成有重要的影响[3]。一般将泡菜总酸积累达到0.4~0.8 g/100 mL时,即认为泡菜成熟,风味最佳,可食用。不同盐质量分数泡白菜发酵过程中pH值和总酸变化规律如图1所示。泡白菜发酵10 d的过程中,低盐与高盐相比,pH值下降速率更快,总酸上升速率也更快,且含量更高。若以总酸0.4 g/100 mL认定为泡白菜成熟,则低盐(2%)、中盐(5%)、高盐(8%)泡白菜成熟期分别为3、5、7 d。这种现象可能是由于食盐溶液具有较高的渗透压,能抑制一些有害微生物的活动,但乳酸菌在此种状态下也会受到一定程度的抑制[14],盐质量分数越高,这种抑制作用越大,从而导致盐质量分数较高的泡白菜发酵速率缓慢,总酸较低盐质量分数泡白菜低。
2.2 不同盐质量分数泡白菜发酵过程中乳酸菌数量变化

图 2 不同盐质量分数泡白菜发酵过程中乳酸菌的菌体浓度变化
Fig. 2 Dynamic changes in of lactic acid bacteria counts during Paocai fermentation with different salt concentrations
泡菜发酵由乳酸菌主导,乳酸菌菌体浓度和种类对泡菜的成熟期与风味物质 的形成有重要影响。不同盐质量分数泡白菜发酵过程中乳酸菌数量的变化规律如图2所示。乳酸菌呈先上升后略有下降趋于平稳的趋势;低盐(2%)泡白菜乳酸菌从第0天开始迅速增多,在第3天达到最大值(7.88±0.04)(lg(CFU/mL)),逐渐趋于平稳;中高盐(5%、8%)泡白菜在0~1 d处于延滞期,其后开始快速增殖;5%盐质量分数泡白菜在第3天达到最大值(7.67±0.04)(lg(CFU/mL)),8%盐质量分数泡白菜在第7天达到最大值(7.26±0.06)(lg(CFU/mL));泡白菜发酵过程中,盐质量分数越低,乳酸菌的生长速率越快,尤其在第1天,2%盐质量分数泡白菜乳酸菌菌体浓度与5%、8%盐质量分数具有极显著差异(P<0.01),这可能是由于高盐高渗透压环境对乳酸菌的存活率有一定抑制作用。熊涛等[1]的研究也显示了相似的规律。
2.3 不同盐质量分数泡白菜发酵过程中乳酸菌的分离鉴定
本研究从不同盐质量分数、不同发酵阶段泡白菜样品中共分离到563 株革兰氏阳性,接触酶阴性和无芽孢的乳酸菌;采用16S rDNA测序方法进行初步鉴定,测序结果通过BLAST软件在NCBI数据库中比对,下载同源性高的模式菌株,使用软件Mega5.05构建系统发育树。Devereux等[16]认为当16S rDNA的序列同源性不低于97%时可以认为是同一属,同源性不低于98%时则可以认为是同一个种。如图3所示,563 株乳酸菌被鉴定为5 个属,分别是明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)和肠球菌属(Enterococcus)。其中1R2等菌株与乳酸乳球菌(Lactococcus lactis)的几个亚种的模式菌株序列同源性高于99%,故认定为Lactococcus lactis;肠球菌属中分离鉴定出2 个种,其中0R14鉴定为Enterococcus gallinarym,3R9鉴定为海氏肠球菌(Enterococcus hirae);乳杆菌属中7R11等2 株乳酸菌鉴定为短乳杆菌(Lactobacillus brevis);魏斯氏菌属中1S2R2等菌株被鉴定为食窦魏斯氏菌(Weissella cibaria),5R13等菌株鉴定为赫伦魏斯氏菌(Weissella hellenica),5R9等菌株鉴定为类肠膜魏斯氏菌(Weissella paramesenteroides);3R2等菌株鉴定为柠檬明串珠菌(Leuconostoc citreum)。
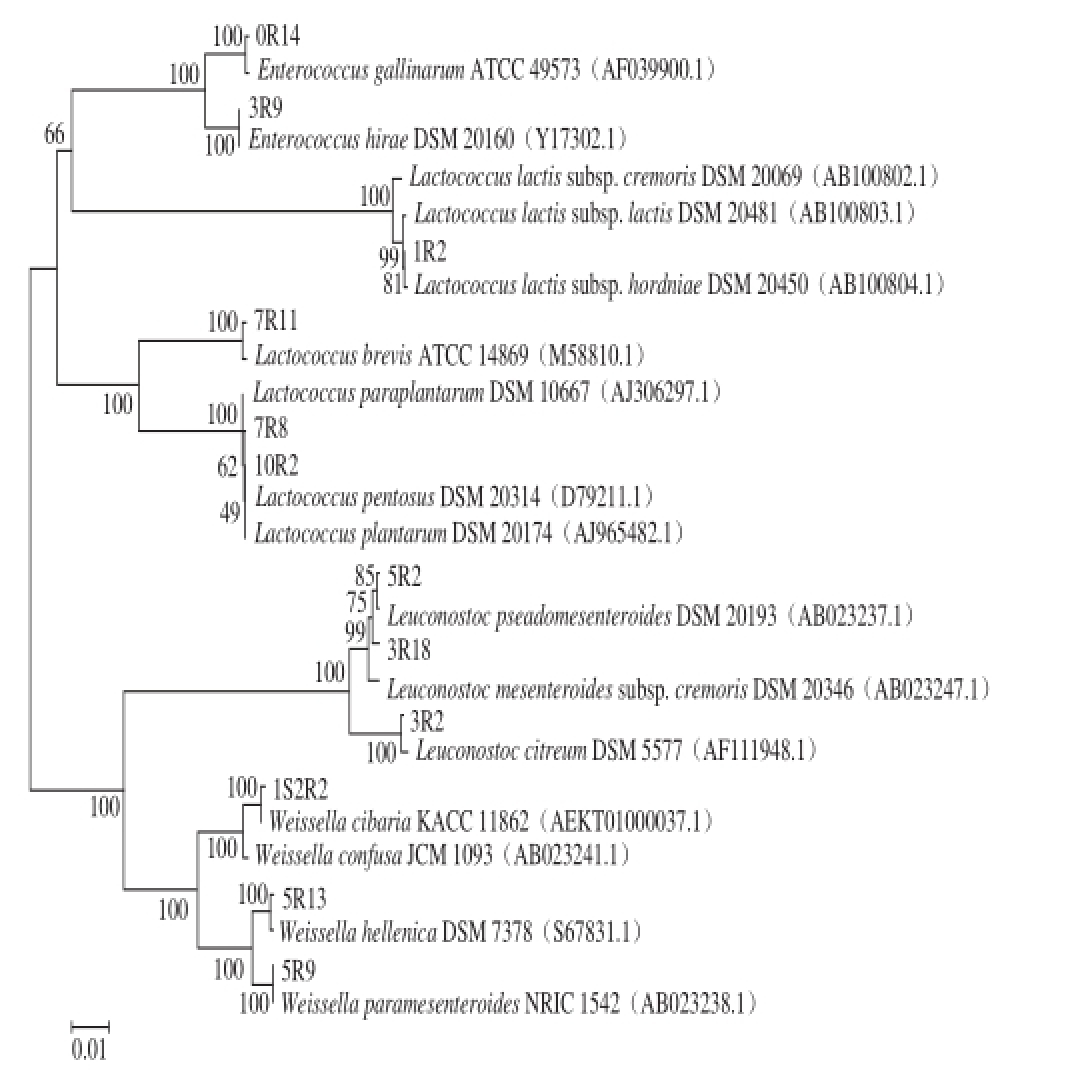
图 3 不同盐质量分数泡白菜中乳酸菌系统发育树
Fig. 3 Phylogenetic tree for lactic acid bacteria isolated from Paocai prepared with different salt concentrations

图 4 多重PCR琼脂糖凝胶电泳图
Fig. 4 Agarose gel electrophoresis of multiplex PCR products
从系统发育树中可以发现,7R8等菌株与戊糖乳杆菌(Lactobacillus pentosus)、植物乳杆菌(Lactobacillus p l a n t a r u m)和类植物乳杆菌(L a c t o b a c i l l u s paraplantarum)模式菌株的序列同源性均很高,16S rDNA测序方法无法鉴定到种。因此,本实验采用多重PCR方法将其区分开,即使用引物paraF、pentF、planF和pREV进行多 重PCR扩增[10-11]。琼脂糖凝胶电泳检测结果如图4所示,泳道1为模式菌株Lactobacillus plantarum CGMCC 1.2439,PCR目标产物长度为318 bp;而泳道2为模式菌株Lactobacillus pentosus CGMCC 1.2437,PCR目标产物长度218 bp;泳道3~7为待测菌株,目标产物长度均为218 bp,因而可以将这几株菌鉴定为Lactobacillus pentosus。本研究进一步采用API 50CH糖发酵实验对上述结果进行验证,并得到了同样的结果。

图 5 PCR-RFLR琼脂糖凝胶电泳图
Fig. 5 Agarose gel electrophoresis for PCR-RFLR analysis
通过16S rDNA序列比对和构建系统发育树发现 ,5R2、3R18等菌株与肠膜明串珠菌(Leuconostoc mesenteroides),假肠膜明串珠菌(Leuconostoc pseudomesenteroides)区分不开,因此,本实验采用PCRRFLR[12]方法将其鉴定到种。实验结果如图5所示,泳道1为模式菌株Leuconostoc pseudomesenteroides CGMCC 1.2503,泳道2为模式菌株CGMCC 1.2138,泳道3~5为待鉴定样品,其条带与泳道2一致,故将其鉴定为Leuconostoc mesenteroides。
2.4 不同盐质量分数泡白菜发酵过程中乳酸菌群落结构的变化
不同盐质量分数泡白菜发酵过程中乳酸菌菌群的相对丰度如图6所示,发酵前期乳酸菌种类较丰富,随着发酵的进行,后期乳酸菌种类减少,发酵7 d以后仅存在Lactobacillus;本实验结果表明,盐质量分数对泡白菜发酵过程中的乳酸菌群落结构有显著影响,盐质量分数低的泡白菜中,乳酸菌菌群多样性与高盐度泡白菜相比较为丰富;Lactobacillus pentosus作为优势菌,出现在3 种不同盐质量分数泡白菜发酵的各个阶段(0~10 d);此外,Lactococcus lactis、Leuconostoc、Weissella等均出现在发酵前期阶段,而后期阶段主要由Lactobacillus主导,其中Lactobacillus pentosus相对丰度较高。2%盐质量分数泡白菜分离鉴定出5 个属,即8 种乳酸菌,分别为Lactobacillus pentosus、Lactobacillus plantarum、Lactococcus lactis、Leuconostoc mesenteroides、Leuconostoc citreum、Weissella paramesenteroides、Weissella cibaria、E. gallinarym;5%盐质量分数泡白菜也分离到5 个属的乳酸菌:Lactobacillus pentosus、Lactobacillus plantarum、Lactococcus lactis、Leuconostoc citreum、Weissella hellenica、Weissella paramesenteroides、Weissella cibaria、Lactobacillus brevis、Enterococcus hirae;而8%盐质量分数的泡白菜仅分离到2 个属的5 种乳酸菌,分别为Lactobacillus pentosus、Weissella hellenica、Weissella paramesenteroides、Weissella cibaria、Lactobacillus brevis。
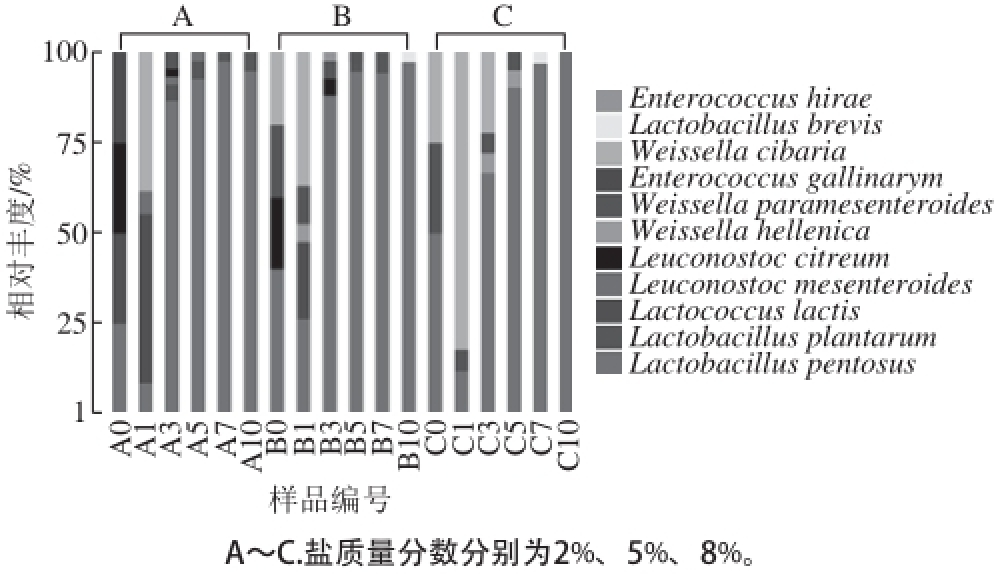
图 6 不同盐质量分数泡白菜发酵液样品中分离的乳酸菌群落构成
Fig. 6 Abundance of lactic acid bacteria isolated from Paocai prepared with different salt concentrations
2.5 不同盐质量分数泡白菜发酵过程中优势乳酸菌的数量变化
不同盐质量分数对泡白菜发酵过程中乳酸菌的种类和数量有很大影响,将乳酸菌鉴定结果根据相似菌株数进行溯源,分析盐质量分数对泡白菜发酵过程中优势乳酸菌数量变化的影响(图7)。在2%盐质量分数泡白菜发酵过程中,占优势的乳酸菌主要有4 类,由图7A可知,Lactobacillus pentosus变化趋势与乳酸菌总数的变化趋势相近。发酵0~1 d,由Lactobacillus pentosus、Leuconostoc和Lactococcus lactis主导,且Lactococcus lactis菌落总数上升速率最快,在发酵1 d时数量达到最大,但在1 d后菌落总数迅速下降。在发酵1~5 d时,优势乳酸菌有Lactobacillus和Leuconostoc,其中Lactobacillus pentosus占主导,而Leuconostoc在发酵5 d后消失。在发酵5~10 d,仅存在Lactobacillus pentosus和Lactobacillus plantarum,而Lactobacillus pentosus的菌落总数始终比Lactobacillus plantarum高一个数量级。在5%(图7B)和8%(图7C)盐质量分数泡菜发酵过程中的优势乳酸菌有两类,均为Lactobacillus pentosus和Weissella,而Weissella在发酵5 d之后消失;5%盐质量分数泡菜发酵0~1 d时,Weissella菌落总数略高于Lactobacillus pentosus,而发酵1 d以后由Lactobacillus pentosus占主导;当8%盐质量分数泡菜发酵0~3 d时,Weissella菌落总数达到最高,之后的发酵过程由Lactobacillus pentosus主导。本实验表明,2%盐质量分数泡白菜的前期发酵主要由Lactococcus lactis、Lactobacillus pentosus和Leuconostoc启动并完成,发酵后期由Lactobacillus pentosus主导;而5%和8%盐质量分数泡白菜发酵前期由Lactobacillus pentosus和Weissella共同主导,发酵后期则主要由Lactobacillus pentosus完成。

图 7 不同盐质量分数泡白菜发酵过程中优势乳酸菌的数量变化
Fig. 7 Microbial counts of dominant lactic acid bacteria isolated from Paocai prepared with different salt concentrations
3 结 论
本研究通过解析低盐(2%)、中盐(5%)、高盐(8%)3 种不同盐质量分数条件下发酵的泡白菜中乳酸菌的群落结构,采用多种分子生物学和生化鉴定手段(16S rDNA测序、多重PCR、PCR-RFLR、API鉴定系统)将乳酸菌鉴定至种水平。本研究结果表明,食盐用量对泡白菜自然发酵过程中乳酸菌的数量以及菌群结构都具有较显著的影响。盐质量分数低的泡白菜,其发酵过程中乳酸菌快速启动发酵,菌落总数迅速增长,表现出更快的总酸积累以及pH值下降。若以总酸含量0.4%认定为泡白菜成熟,则低盐(2%)、中盐(5%)、高盐(8%)泡白菜成熟期分别为3、5、7 d,说明食盐对乳酸菌的存活率有一定抑制作用。盐质量分数低的泡白菜中,乳酸菌的种类也比高盐发酵泡白菜中的乳酸菌更为丰富,2%、5%盐质量分数泡白菜分 离到5 个属的乳酸菌,而8%盐质量分数泡白菜仅分离到2 个属的乳酸菌。菌株Lactococcuslactis和Leuconostoc未能在高盐(8%)泡白菜中分离到,可能与菌株的耐盐性有关。低盐泡白菜由Lactococcus lactis、Lactobacillus pentosus和Leuconostoc启动 发酵,发酵后期由Lactobacillus pentosus主导;中高盐泡白菜由Lactobacillus pentosus和Weissella启动发酵 ,发酵后期则由Lactobacillus pentosus主导。
参考文献:
[1] 熊涛, 李军波, 彭飞, 等. 盐浓度对传统自然发酵圆白菜的菌系结构和代谢的影响[J]. 食品科学, 2015, 36(11): 172-176. DOI:10.7506/ spkx1002-6630-201511033.
[2] DU S, BATIS C, WANG H, et al. Understanding the patterns and trends of sodium intake, potassium intake, and sodium to potassium ratio and their effect on hypertension in China[J]. The American Journal of Clinical Nutrition, 2014, 99(2): 334-343. DOI:10.3945/ ajcn.113.059121.
[3] DOYLE M E, GLASS K A. Sodium reduction and its effect on food safety, food quality, and human health[J]. Comprehensive Reviews in Food Science andFood Safety, 2010, 9(1): 44-56. DOI:10.1111/ j.1541-4337.2009.00096.x.
[4] 付莎莉, 陈安均, 蒲彪, 等. 食盐浓度对传统四川泡菜发酵过 程中乳酸菌菌相的影响[J]. 食品与发酵工业, 2013, 39(8): 102-107.
[5] SO M, LEE Y, KIM H, et al. An influence of salt concentrations on growth rates of lactic acid bacteria isolated from Kimchi[J]. Journal of the Korean Society of Food Science and Nutrition, 1996, 9(9): 341-347. DOI:10.4315/0362-028X-64.8.1145.
[6] BAUTISTA-GALLEGO J, ARROYO-L☒PEZ F, DUR☒NQUINTANA M, et al. Individual effects of sodium, potassium, calcium, and magnesium chloride salts on Lactobacillus pentosus and Saccharomyces cerevisiae growth[J]. Journal of Food Protection, 2008, 71(7): 1412-1421. DOI:10.4315/0362-028X-71.7.1412.
[7] ROMERO-GIL V, BAUTISTA-GALLEGO J, RODR☒GUEZ-G☒MEZ F, et al. Evaluating the individual effects of temperature and salt on table olive related microorganisms[J]. Food Microbiology, 2013, 33(2): 178-184. DOI:10.1016/j.fm.2012.09.015.
[8] LEE S H, JUNG J Y, JEON C O. Microbial successions and metabolite changes during fermentation of salted shrimp (saeu-jeot) with different salt concentrations[J]. PLoS ONE, 2014, 9(2): 90-115. DOI:10.1016/ j.fm.2013.01.009.
[9] JUNG J Y, LEE S H, JEON C O. Kimchi microflora: history, current status, and perspectives for industrial kimchi production[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2385-2393. DOI:10.1007/s00253-014-5513-1.
[10] LUCENA-PADR☒S H, CABALLERO-GUERRERO B, MALDONADO-BARRAG☒N A, et al. Microbial diversity and dynamics of Spanish-style green table-olive fermentations in large manufacturing companies through culture-dependent techniques[J]. Food Microbiology, 2014, 42: 154-165. DOI:10.1016/ j.fm.2014.03.020.
[11] TORRIANI S, FELIS G E, DELLAGLIO F. Differentiation of Lactobacillus plantarum, L. pentosus, and L. paraplantarum by recA gene sequence analysis and multiplex PCR assay with recA genederived primers[J]. Applied and Environmental Microbiology, 2001, 67: 3450-3454. DOI:10.1128/AEM.67.8.3450-3454.2001.
[12] JANG J, KIM B, LEE J, et al. A rapid method for identification of typical Leuconostoc species by 16S rDNA PCR-RFLP analysis[J]. Journal of Microbiological Methods, 2003, 55(1): 295-302. DOI:10.1016/S0167-7012(03)00162-3.
[13] HARUTA S, KONDO M, NAKAMURA K, et al. Microbial community changes during organic solid waste treatment analyzed by double gradient-denaturing gradient gel electrophoresis and fluorescence in situ hybridization[J]. Applied Microbiology and Biotechnology, 2002, 60(1/2): 224-231. DOI:10.1007/s00253-002-1074-9.
[14] 陈希. 蔬菜低盐腌制微生物群落多样性的分析[D]. 宁波: 宁波大学, 2011: 1-53.
[15] LANE D. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics[M]. New York: John Wiley and Sons, 1991: 125-175.
[16] DEVEREUX R, HE S H, DOYLE C L, et al. Diversity and origin of Desulfovibrio species: phylogenetic definition of a family[J]. Journal of Bacteriology, 1990, 172(7): 3609-3619. DOI:10.1128/ jb.172.7.3609-3619.1990.
[17] 杨瑞鹏, 赵学慧. 酸泡菜发酵过程中乳酸菌区系的研究[J]. 中国调味品, 1991(1): 8-10.
[18] 翁佩芳, 陈希, 沈锡权, 等. 榨菜低盐腌制细菌群落多样性的分析[J]. 中国农业科学, 2011, 45(2): 338-345. DOI:10.3864/ j.issn.0578-1752.2012.02.016.
[19] YAN P M, XUE W D, TAN S S, et al. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control, 2008, 19(1): 50-55. DOI:10.1016/ j.foogcont.2007.02.008.
[20] 田伟, 张琦, 邓珍珍, 等. 利用 16S rRNA分析传统四川发酵泡菜中的细菌多样性[J]. 食品科学, 2013, 34(17): 215-218. DOI:10.7506/ spkx1002-6630-201317046.
[21] YU J, GAO W, QING M J, et al. Identification and characterization of lactic acid bacteria isolated from traditional pickles in Sichuan, China[J]. The Journal of General and Applied Microbiology, 2012, 58(3): 163-172. DOI:10.2323/jgam.58.163.
[22] ZHOU J Z, JIANG Y H, DENG Y, et al. Random sampling process leads to overestimation of β-diversity of microbial communities[J]. mBio, 2013, 4(3): 50-55. DOI:10.1128/mBio.00324-13.
[23] 关倩倩. 我国传统发酵泡菜菌系结构及其消长规律研究[D]. 南昌:南昌大学, 2012: 1-30.
[24] STACKEBRANDT E, GOEBEL B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. International Journal of Systematic Bacteriology, 1994, 44(4): 846-849. DOI:10.1099/00207713-44-4-846.
[25] HELENA L P, JOSE R B. Diversity and enumeration of halophilic a nd alkaliphilic bacteria in Spanish-style green table-olive fermentations[J]. Applied Microbiology and Biotechnology, 2016, 53: 53-62. DOI:10.1016/j.fm.2015.09.006.
[26] 杨瑞, 张伟, 徐小会. 泡菜发酵过程中主要化学成分变化规律的研究[J]. 食品工业科技, 2005, 26(2): 95-98. DOI:1002-03 06(2005)02-0095-04.
[27] 鄯晋晓. 四川泡菜菌系分离、筛选及发酵剂的研究[D]. 重庆: 西南大学, 2008: 1-44.
[28] 何玲, 李勤振. 浆水芹菜发酵过程中优势菌群的分离、鉴定及变化[J].食品科技, 2010, 35(5): 36-40. DOI:1005-9989(2010)05-0036-05.
[29] XIONG T, GUAN Q Q, SONG S H, et al. Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentatio n[J]. Food Control, 2012, 26(1): 178-181. DOI:10.1016/j.foodcont.2012.01.027. [30] PLENGVIDHYA V, BREIDT F, LU Z J, et al. DNA fingerprinting of lactic acid bacteria in sauerkraut fermentations[J]. Applied and Environmental Microbiology, 2007, 73(23): 7697-7702. DOI:10.1128/ AEM.01342-07.
Community Dynamics of Lactic Acid Bacteria during the Fermentation Process of Chinese Paocai with Different Salt Concentrations
SHEN Wenxi1, CHEN Gong1,2, TANG Yao1, WANG Dongdong1, WANG Yong1, WU Yalong1, ZHANG Hongmei1, ZHANG Wei1, ZHU Xiang1, LI Heng1,2, ZHANG Qisheng1,2,*
(1. Sichuan Dongpo Chinese Paocai Industrial Technology Research Institute, Meishan 620000, China; 2. Sichuan Academy of Food and Fermentation Industries, Wenjiang 611130, China)
Abstract:The microbial community of lactic acid bacteria isolated from Chinese Paocai prepared with different salt concentrations (2%, moderate 5% and 8%), was assessed by cultivable methods and various molecular biology methods. The results showed that lactic acid bacteria in Paocai brine exhibited faster growth rate at lower salt concentration during the fermentation process. A total of 563 lactic acid bacteria were isolated from Paocai brines fermented with different salt concentrations and identified by 16S rDNA sequencing analysis, multiplex-PCR method, and PCR-FRLP analyses. The i solates were identified to belong to 11 species of 5 genera respectively. Lactococcus lactis, Lactobacillus pentosus and Leuconostoc were found to be the dominant flora in Paocai samples during the early stage of fermentation with lower salt concentration (2%) while Lactobacillus pentosus dominated the late fermentation stage. Furthermore, Lactobacillus pentosus and Weissella were the most abundant isolates from Paocai brine during the early stage of fermentation with 5% and 8% salt concentrations, but the major microbes involved in the late fermentation stage were still Lactobacillus pentosus.
Key words:Chinese Paocai; salt concentration; lactic acid bacteria; microbial community
DOI:10.7506/spkx1002-6630-201710018
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)10-0105-07
引文格式:
申文熹, 陈功, 唐垚, 等. 不同盐质量分数泡白菜发酵过程中乳酸菌群落结构的变化[J]. 食品科学, 2017, 38(10): 104-110.
DOI:10.7506/spkx1002-6630-201710018. http://www.spkx.net.cn
SHEN Wenxi, CHEN Gong, TANG Yao, et al. Community dynamics of lactic acid bacteria during the fermentation process of Chinese Paocai with different salt concentrations[J]. Food Science, 2017, 38(10): 104-110. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710018. http://www.spkx.net.cn
收稿日期:2016-08-09
基金项目:四川省重大科技支撑项目(NZ20160007;2013NZ0055);“十二五”国家科技支撑计划项目(2012BAD31B04)
作者简介:申文熹(1992—),女,助理工程师,本科,研究方向为食品微生物。E-mail:1053037646@qq.com
*通信作者:张其圣(1983—),男,高级工程师,博士,研究方向为发酵工程。E-mail:bigbeastone@163.com







