朱孟峰1,2,3,许 伟2,3,*,邵 荣2,3,韦 萍1,*
(1.南京工业大学药学院,江苏 南京 211816;2.盐城工学院海洋与生物工程学院,江苏 盐城 224051;3.江苏省海洋滩涂生物化学与生物技术重点建设实验室,江苏 盐城 224051)
摘 要:从桑叶中筛选出一株糖尿病潜在治疗药物(α-葡萄糖苷酶抑制剂)产生菌,为进一步提高抑制剂量,采用常压室温等离子体(atmospheric and room temperature plasma,ARTP)技术进行了诱变育种,并初步研究其理化性质及稳定性。在分离得到的188 株桑叶内生菌中,以4-硝基苯-α-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG)法筛选α-葡萄糖苷酶抑制剂,筛选到一株细菌XuW-LB-188,其发酵上清液对α-葡萄糖苷酶抑制率达52.67%。根据菌株形态特性及16S rDNA序列,初步鉴定为萎缩芽孢杆菌。对此菌株进行ARTP诱变,高通量筛选880 株突变株,其中突变株T-690抑制活性较出发菌株提高了40.61%,抑制率高达73.25%。实验结果表明,该α-葡萄糖苷酶抑制剂主要存在于发酵液中,是一种极性较大的水溶性胞外产物,且具有良好的热稳定性。
关键词:α-葡萄糖苷酶抑制剂;桑叶;内生菌;筛选;常压室温等离子体诱变;萎缩芽孢杆菌
α-葡萄糖苷酶抑制剂[1]是一类用于治疗Ⅱ型糖尿病的口服降糖药物,其通过可逆性地与小肠刷状绒毛上的α-葡萄糖苷酶结合,从而减缓双糖和寡糖的分解吸收,进而降低餐后高血糖,作用温和、毒副作用小。阿卡波糖和米格列醇为已上市的2 种α-葡萄糖苷酶抑制剂,前者来源于游动放线菌(Actinopanes sp.)[2],后者也存在于浅紫灰链霉菌(Streptomyces lavendulae)[3]发酵液。从早期短叶红豆杉中分离出产紫杉醇的共生菌[4],到近期从长春花中分离出产长春碱的共生菌[5],证明某些内生菌的代谢产物具有与宿主植物相同或相似的活性结构及功能。桑叶、桑白皮等作为传统中药,具有良好的降血糖功能[6],郑丽屏等[7]就从桑树中分离出一株内生真菌,对α-葡萄糖苷酶具有一定的抑制活性。
微生物是α-葡萄糖苷酶抑制剂较为理想有效的来源,菌种的诱变选育则是改良菌种的重要手段之一。其中,基于大气压射频辉光放电的常压室温等离子体(atmospheric and room temperature plasma,ARTP)菌种选育技术,具有条件温和、安全性高、操作简单、诱变迅速、突变率高等特点[8-9],获得普遍认可和广泛应用。其产生的中能活性粒子不仅可直接改变核苷酸水平的分子结构[10],还可通过作用于细胞而间接影响胞内遗传物质[11],阿维菌素[12]、奥利万星中间体[13]等产生菌经ARTP诱变后,产量均大幅提高。本实验以桑叶为材料,进行产α-葡萄糖苷酶抑制剂菌株的分离与鉴定,对筛选到的菌株进行ARTP诱变以提高抑制剂产量,并对抑制剂理化性质进行初步分析,同时为α-葡萄糖苷酶抑制剂的发酵条件优化及分离纯化提供支持。
1.1 材料与试剂
1.1.1 材料
新鲜桑叶采自江苏、浙江、安徽、云南、广东等13 省,包括野生桑叶及种植桑叶,共计41 份样品。
1.1.2 试剂与培养基
酵母粉、蛋白胨 英国Oxoid公司;α-葡萄糖苷酶(EC3.2.1.20,来源于酿酒酵母) 美国Sigma-Aldrich公司;4-硝基苯-α-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG) 上海晶纯生化科技股份有限公司。
0.01 mol/L磷酸缓冲盐溶液(phosphate buffer saline,PBS):NaCl 8.00 g/L、KCl 0.20 g/L、Na2HPO41.44 g/L、KH2PO40.24 g/L,调pH 7.2;甘油-氯化钠溶液:每升含甘油50 mL、NaCl 8.00 g。
LB培养基:酵母粉5.00 g、蛋白胨10.00 g、NaCl 10.00 g、蒸馏水1 000 mL,调pH 7.0~7.2,固体培养基时加入琼脂15.00~18.00 g;马铃薯-蔗糖培养基:马铃薯200.00 g、蔗糖20.00 g、蒸馏水1 000 mL,自然pH值,固体培养基时加入琼脂15.00~18.00 g。所有培养基及溶液均121 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ-1D超净工作台 苏州净化设备有限公司;MLS-3751全自动高压灭菌锅 日本Sanyo公司;JY92-ⅡN超声波细胞粉碎机 宁波新芝生物科技福分有限公司;SpecraMax 190酶标仪 美国Molecular Devices公司;Allegra X-30R高速冷冻离心机 美国贝克曼库尔特有限公司;HZQ-F160全温振荡培养箱 太仓实验设备厂;PB-10酸度计 德国Sartorius公司;常压室温等离子体育种机无锡思清源生物科技公司;旋涡混合仪 海门市其林贝尔仪器制造有限公司;24深孔板 常州英德生物科技有限公司;250D培养箱 国华电器有限公司。
1.3 方法
1.3.1 内生菌的分离
取桑树的茎、叶组织,用自来水反复冲洗至表面无异物,擦干并用无菌水清洗3 次,在75%酒精中浸泡3~5 min,将其取出转入到体积分数为3%的次氯酸钠溶液中浸泡5 min,无菌水冲洗3 次,备用。
将处理后的桑叶放入无菌研钵中,加PBS研磨,上清液梯度稀释后涂布于LB和马铃薯-蔗糖平板,重复3 次,分别置于35 ℃和28 ℃的恒温箱中培养48 h。其中LB平板用于内生细菌的分离,马铃薯-蔗糖平板用于内生真菌的分离。最后一次冲洗的无菌水也进行上述操作,用于表面无菌的验证[14]。
1.3.2 菌落纯化及发酵培养
通过平板划线进一步纯化菌落,挑取纯化后单菌落接入LB或马铃薯-蔗糖液体培养基中(250 mL锥形瓶内含50 mL培养基),分别于35 ℃和28 ℃摇床中100 r/min培养48 h。
1.3.3 菌体胞内及胞外产物提取
摇瓶发酵结束后,4 ℃、12 000 r/min离 心10 min,分成上清液及菌丝体,上清液即为微生物胞外产物,冷冻保存,用于α-葡萄糖苷酶抑制活性测定。收集菌体沉淀,用PBS(0.01 mol/L,pH 7.2)洗涤3 次后,制成菌悬液,于冰水浴中超声波破碎[15],将破碎液4 ℃、12 000 r/min离心10 min,所得上清液即为微生物胞内提取物,冷冻保存,用于α-葡萄糖苷酶抑制活性测定。
1.3.4 α-葡萄糖苷酶抑制活性测定
以PNPG法[16]筛选α-葡萄糖苷酶抑制剂是一种快速经典有效的筛选方法。该方法基于PNPG在α-葡萄糖苷酶催化下生成具有特定光吸收的对硝基苯酚(p-nitrophenol,PNP)这一反应,其吸光度的变化可用于酶活力及抑制剂活力测试。
具体操作步骤[17]:在96 孔酶标板中加入10 μL,1 U/mL(酶活力定义:pH 6.8,37 ℃条件下1 min内生成1 μmol葡萄糖的酶量)α-葡萄糖苷酶(缓冲溶液溶解),80 μL,0.1 mol/L磷酸二氢钾-磷酸氢二钾(pH 6.8),20 μL测试样品(阴性对照孔加入空白培养基),37 ℃保温10 min后,加入40 μL,2 mg/mL PNPG,用酶标仪于405 nm波长处分别测定反应零时间OD值(OD1)与反应20 min后的OD值(OD2)。抑制率根据公式(1)计算。
1.3.5 菌种鉴定
依据《伯杰细菌鉴定手册》[18]与《真菌鉴定手册》[19],通过菌落形态及简单染色对微生物进行初步分类。对筛选出的高抑制率菌株,以引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)、1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增细菌16S rDNA,以NS1(5’-GTAGTCATATGCTTGTCTC-3’)、NS8(5’-TCCGCAGGTTCACCTACGGA-3’)扩增真菌18S rDNA,克隆测序后,利用GenBank基因数据库的BLAST进行序列同源性比较分析,并构建系统发育进化树。
1.3.6 ARTP诱变操作
菌悬液的制备:取1 mL对数生长期的出发菌株培养液,8 000 r/min离心10 min,弃上清液 ,用无菌PBS洗涤2 次以去除培养基,最后菌体重悬于甘油-氯化钠溶液中,细胞终浓度为106~107CFU/mL,用于ARTP处理。
ARTP处理预实验[20]:为保证突变的有效性,放电射流区温度不应高于40 ℃,输出功率、辐照距离、气流量等参数设定一般推荐为120 W、2 mm、10 L/min[8]。按上述参数处理样品载片,分别考察辐照时间0(对照)、10、20、30、40、50、60 s对细菌致死率的影响,每个时间梯度进行3 次平行实验。处理过的样品稀释涂平板,计数菌落数,根据公式(2)计算致死率,并获得致死率曲线。
ARTP具体操作:取10 μL菌悬液均匀涂于无菌样品载片,在设定的系统参数及选取的处理时间下进行样品诱变,样品处理完毕后,用无菌镊子将载片放至装有1 mL无菌PBS的EP管中。充分振荡,使附着在菌物载片上的微生物洗脱至液体中,形成新的菌悬液。对新的菌悬液进行适当稀释后涂布,35 ℃条件下培养24 h。
1.3.7 高通量筛选方法
24深孔板培养结合96 孔酶标板抑制率检测可实现突变菌株的高通量筛选。根据菌落生长的大小和丰度,用无菌牙签挑取单菌落接种于装有培养基的24深孔板(2 mL/孔),35 ℃、100 r/min培养48 h。菌液一部分用于菌种保藏,另一部分8 000 r/min离心10 min,取上清液,测定α-葡萄糖苷酶抑制率,每个样品进行3 次平行实验。
1.3.8 突变株遗传稳定性分析
将经过筛选得到的正突变幅度最大(抑制活性最高) 的菌株接种至固体培养基上传代培养10 代,并将各代菌体分别接种于液体培养基中,35 ℃、100 r/min培养72 h,测其抑制活性,检测所选突变株的遗传稳定性。
1.3.9 活性物质的早期鉴定
活性成分在发酵液中的分布:分别测定胞内产物及发酵上清液对α-葡萄糖苷酶的抑制活性。
热稳定性测试:取发酵上清液50 mL分装于5 支试管(50 mL)中,于沸水浴中分别保温5、10、30、60、120 min,冷却后用蒸馏水补至原体积,测定原始发酵液及沸水浴不同时间后的发酵液活性,重复测定3 次。
活性物质的极性测试[17]:取4 支试管,每管装入5 mL发酵上清液,分别加入5 mL的正丁醇、乙酸乙酯、氯仿、石油醚,多次混匀充分萃取。以原始发酵上清液为对照,分别检测各管水相的抑制活性。
2.1 内生菌的分离
通过对13 个省41 份桑叶样品进行筛选,总计获得共生菌189 株,初步鉴定细菌143 株,真菌46 株,经纯化后,分别保存于固体斜面。植物中一般都有共生菌的存在,无论是内生真菌还是内生细菌,多能使植物获益,如内生固氮、植物促生长和生物防治等作用[21]。此外,越来越多的功能性次级代谢产物从内生菌中发现并得以利用[22]。
2.2 产α-葡萄糖苷酶抑制剂内生菌的筛选
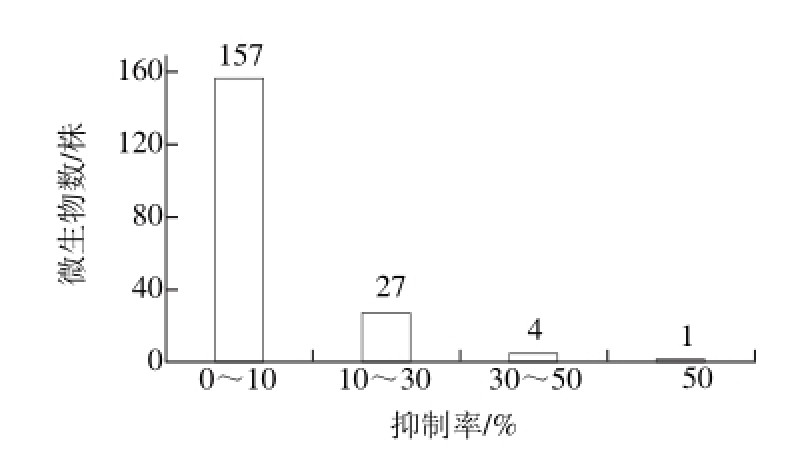
图 1 抑制率分布图
Fig. 1 Distribution of α-glucosidase inhibitory activity of 189 isolates
经过对189 株微生物胞外产物及胞内提取物的α-葡萄糖苷酶抑制活性进行测试,抑制率小于10%的共157 株,抑制率为10%~30%的共27 株,抑制率为30%~50%的共4 株,分别为XuW-PSA-06、XuWLB-76、XuW-LB-79(胞内)、XuW-LB-91,另有一株共生菌XuW-LB-188发酵液抑制率高达52.67%。共生菌抑制率分布情况如图1所示。本实验中,抑制α-葡萄糖苷酶活性物质多富集于胞外,胞内提取物一般无抑制活性,即便有也较低。这与已报道的产α-葡萄糖苷酶抑制剂微生物中,所产抑制剂多为胞外次级代谢产物相符[23-25]。
2.3 XuW-LB-188菌落及形态观察
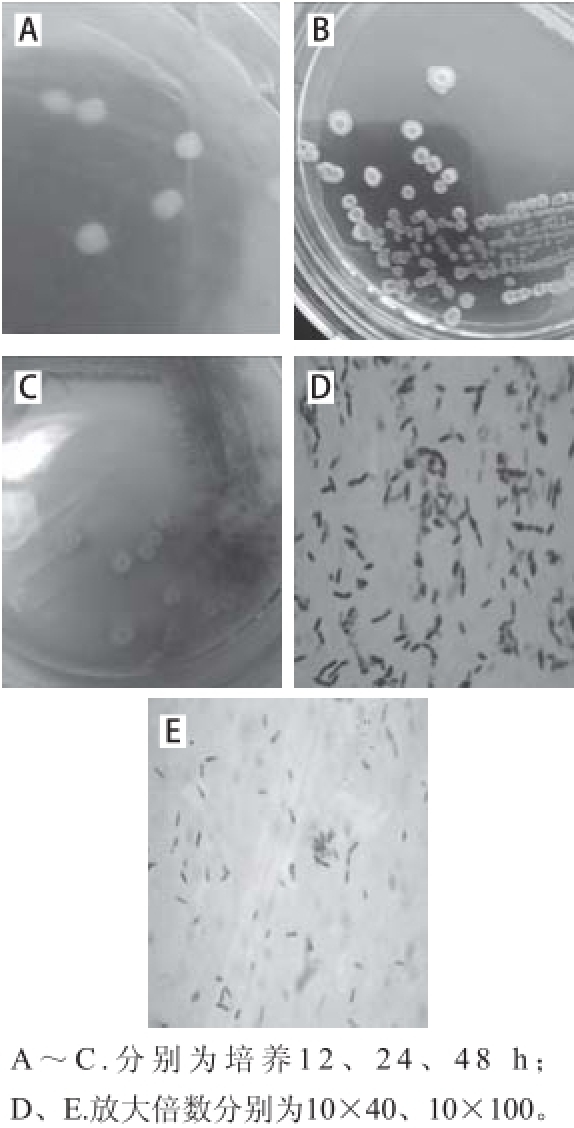
图 2 XuW-LB-188菌落形态(A~C)、革兰氏染色(D)及芽孢染色(E )
)
Fig. 2 Colony, Gram staining and spore staining of strain XuW-LB-188
如图2所示,LB平板上接种XuW-LB-188,35 ℃培养12 h即可见明显菌落,菌落圆形、不透明、光滑、湿润,24 h后菌落呈不规格圆形、乳白色、形成褶皱,48 h后菌落密集处开始产生棕褐色色素,与萎缩芽孢杆菌(Bacillus atrophaeus)[26]菌落形态十分相近。经鉴定,XuW-LB-188为革兰氏阳性菌,细胞呈杆状,芽孢呈椭圆形。
2.4 16S rDNA序列测定及系统发育树
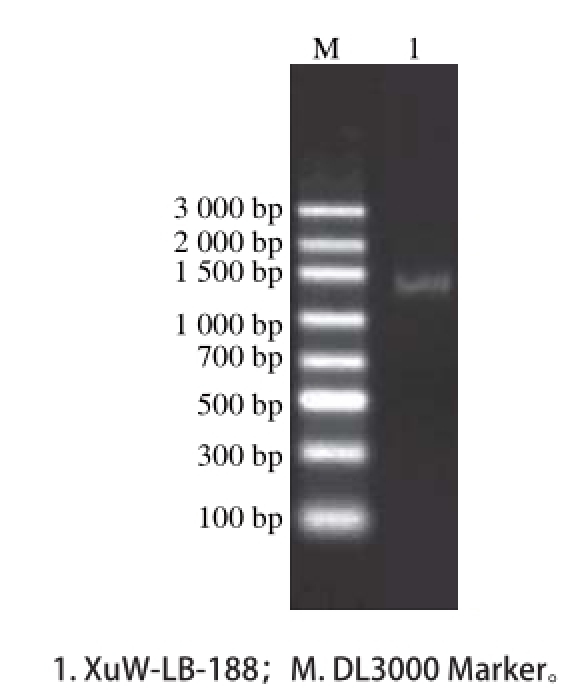
图 3 XuW-LB-188菌株16S rDNA PCR扩增结果
Fig. 3 PCR amplification of 16S rDNA gene of strain XuW-LB-188
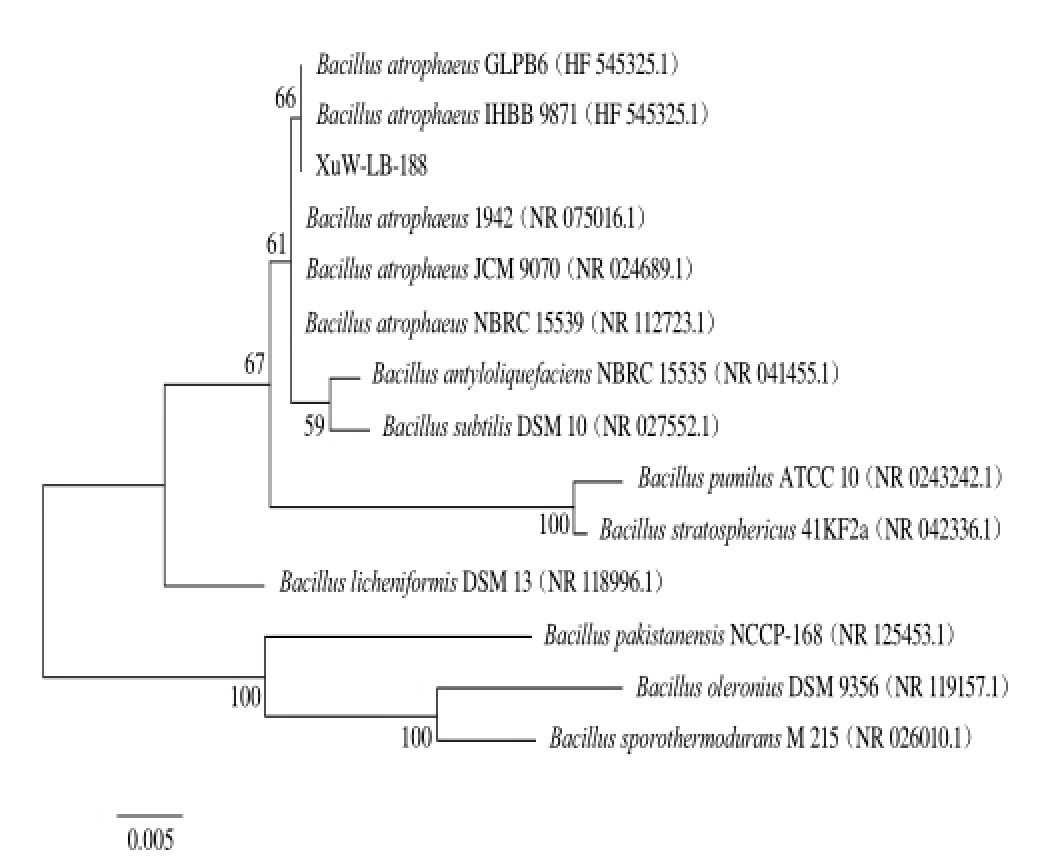
图 4 XuW-LB-188菌株基于16S rDNA的系统发育树
Fig. 4 Phylogenetic tree for strain XuW-LB-188 based on 16S rDNA sequence
以引物27F、1492R,扩增16S rDNA全序列,获得一条1 392 bp的DNA片段,条带清晰、与实验设计相符(图3)。在NCBI的GenBank数据库中进行BLAST比对,并构建系统发育树(图4),结果表明XuW-LB-188与萎缩芽孢杆菌同属于一个分支,初步确定XuW-LB-188为萎缩芽孢杆菌。产α-葡萄萄糖苷酶抑制剂的微生物种属分布较广,现已报道的包括曲霉(Aspergillus terreus)[24]、青霉( Penicillium citreonigrum)[27]、链霉菌属(Streptomyces)[28]、乳酸菌属(Lactobacillus)[23]、芽孢杆菌属(Bacillus)[29-30]等。
2.5 ARTP诱变选育
2.5.1 ARTP致死率曲线测定
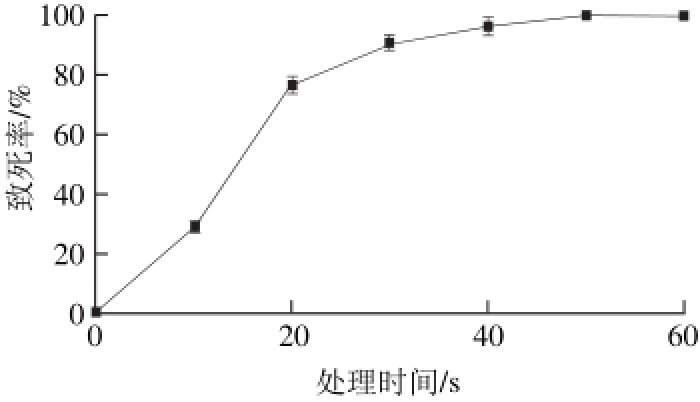
图 5 ARTP诱变致死率曲线
Fig. 5 Mortality rate curve from ARTP mutation
根据1.3.6节中方法测试并绘制致死率曲线,如图5所示。ARTP照射时间与XuW-LB-188的致死率存在着明显的剂量效应关系,与王兴吉等[31]诱变枯草芽孢杆菌(Bacillus subtilis)的致死率曲线相近。在0~30 s,致死率随照射时间迅速上升至90%,30 s后,致死率随照射时间缓慢升高,50 s后致死率高达99%以上。有报道称[32]较高致死率可提高突变及正突变比例,因此后续实验诱变处理时间选用50 s。
2.5.2 诱变菌株的筛选
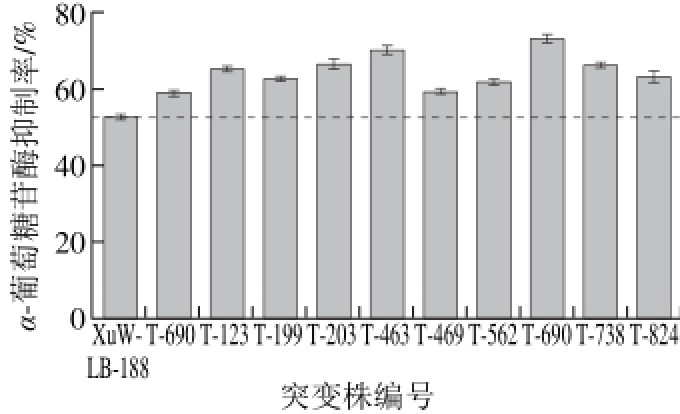
图 6 正突变株及原始菌株抑制活性
Fig. 6 α-Glucosidase inhibitory activity of the original and positive mutant strains
以筛选出抑制活性最高的XuW-LB-188为出发菌株,在输出功率120 W、辐照距离2 mm、气流量10 L/min、载样量10 μL、辐照时间50 s的条件下,利用24深孔板培养联合96 孔酶标板检测,实现了诱变菌种的高通量筛选。每次实验筛选88 株突变菌(共4 板,每板设1 孔接种原始菌种作为对照,1 孔未接种作为空白),先后进行10 次实验,筛选突变菌株880 株,正突变菌株26 株。选取10 株正突变量较高的菌株示于图6,其中T-690突变株抑制率高达73.25%,相较于出发菌株提高了40.61%,说明ARTP诱变对于提高菌株α-葡萄糖苷酶抑制剂产量具有较好的效果。
近年来,科研工作者以PNPG法获得了一批潜在的α-葡萄糖苷酶抑制剂产生菌。此法中以抑制率作为前期筛选及优化的参考指标行之有效,操作简单快捷。本实验中,突变株T-690抑制活性远高于枯草芽孢杆菌B2[29],与萎缩芽孢杆菌S-J-X-4[14]相当。
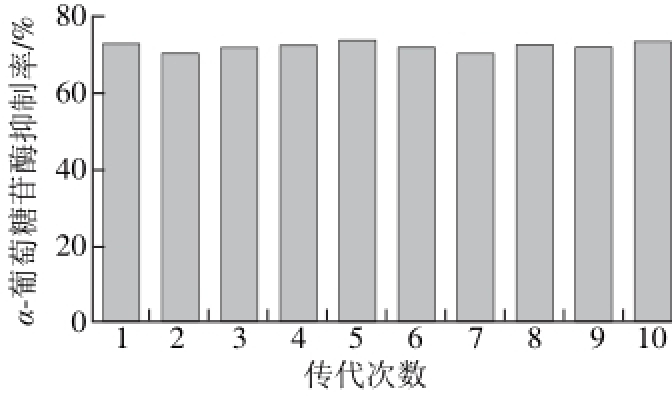
图 7 T-690遗传稳定性
Fig. 7 Genetic stability of strain T-690
2.6 突变菌遗传稳定性研究对突变菌株T-690进行固体平板10 次传代培养,并测试每代的抑制活性,由图7可知,发酵上清液对α-葡萄糖苷酶的抑制率变化甚微,说明突变株T-690遗传稳定性良好,活性物质产量稳定。突变株T-690的高抑制活性及遗传稳定性,为后续α-葡萄糖苷酶抑制剂的工业发酵及分离提供了优良的菌种。
2.7 活性物质初步分析

图 8 沸水浴处理时间对抑制率的影响
Fig. 8 Effect of boiling water bath treatment time on α-glucosidase inhibitory activity
胞内产物及发酵上清液对α-葡萄糖苷酶的抑制活性分别为2.10%和72.83%,说明抑制剂主要存在于发酵上清液中,为一种胞外产物。发酵上清液经不同时间热处理后,抑制率变化如图8所示。随着沸水浴时间的延长,抑制活性变化幅度较小。由此可知,发酵液中活性组分具有良好的热稳定性,同时说明此物质为非蛋白质等易热变性的组分。在后期分离过程中,可通过热处理去除发酵液中的蛋白质,也可通过减压蒸馏的方式进行浓缩。
选用正丁醇、乙酸乙酯、氯仿、石油醚等不同极性的有机溶剂对发酵上清液中的活性物质进行萃取分离,发现活性物质仍主要保留在水相中。结果表明,潜在的α-葡萄糖苷酶抑制剂是一种极性较大的胞外产物。已知极性对于分离纯化有着重要意义,有助于分离方法的选择及分离方案的设计。
桑叶中已知具有降糖活性的物质包括黄酮(芸香苷、槲皮素等)、多糖、生物碱(1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)、N-甲基-1-DNJ等)等[33],根据内生菌次生代谢产物和宿主植物次生代谢产物结构及活性的相似性,以及其极性和热稳定性推断,T-690所产活性物质很有可能为DNJ或其结构类似物。
从13 个省41 份桑叶样品中,总计获得共生菌189 株,以PNPG法筛选α-葡萄糖苷酶抑制剂,其中XuWLB-188发酵上清液抑制率高达52.67%,是一株具有潜在药用价值的微生物。16S rDNA序列分析结果表明,该菌株为萎缩芽孢杆菌。
以XuW-LB-188为出发菌株,通过ARTP诱变实验,绘制致死率曲线并确定了最佳诱变时间为50 s。高通量筛选880 株突变菌株,共获得26 株正突变菌株,其中突变株T-690抑制率最高,为73.25%,相较于出发菌株提高了40.61%。同时,10 次传代培养实验验证了其遗传稳定性。
α-葡萄糖苷酶抑制剂分布、热稳定性及极性实验结果表明:活性物质为胞外产物,主要存在于发酵液中,具有很好的热稳定性,是一种极性较大的水溶性物质。
后续研究工作将对此活性物质进行分离提纯及结构鉴定,并利用响应面方法优化菌株T-690的发酵条件,以期提高抑制剂的产量。
参考文献:
[1] RITHOLZ M D, BEVERLY E A, WEINGER K. Digging deeper: the role of qualitative research in behavioral diabetes[J]. Current Diabetes Reports, 2011, 11(6): 494-502. DOI:10.1007/s11892-011-0226-7.
[2] CAMPBELL R K, CAMPBELL L K, WHITE J R. Insulin lispro: its role in the treatment of diabetes mellitus[J]. Annals of Pharmacotherapy, 1996, 30(11): 1263-1271. DOI:10.1177/106002809603001111.
[3] BALITZ D M, BUSH J A, BRADNER W T, et al. Isolation of lavendamycin, a new antibiotic from Streptomyces lavendulae[J]. The Journal of Antibiotics, 1982, 35(3): 259-265. DOI:10.7164/ antibiotics.35.259.
[4] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260: 214-216. DOI:10.1126/science.8097061.
[5] PALEM P P, KURIAKOSE G C, JAYABASKARAN C. Correction: an endophytic fungus, Talaromyces radicus, isolated from Catharanthus roseus, produces vincristine and vinblastine, which induce apoptotic cell death[J]. PLoS ONE, 2016, 10(12): e0144476. DOI:10.1371/ journal.pone.0153111.
[6] 马丽丽, 邹欣蓉, 刘琼, 等. 桑树资源在预防和治疗2型糖尿病中的作用[J]. 中草药, 2014, 45(22): 3337-3342. DOI:10.7501/ j.issn.0253-2670.2014.22.023.
[7] 郑丽屏, 马燕军, 张雨青. 一株桑树内生真菌的鉴定及菌丝多糖对α-葡萄糖苷酶活性的抑制作用[J]. 蚕业科学, 2015, 41(6): 1062-1066. DOI:10.13441/j.cnki.cykx.2015.06.014.
[8] 张雪, 张晓菲, 王立言, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7): 2676-2684. DOI:10.3969/ j.issn.0438-1157.2014.07.027.
[9] ZHANG X, ZHANG C, ZHOU Q Q, et al. Quantitative evaluation of DNA damage and mutation rate by atmospheric and roomtemperature plasma (ARTP) and conventional mutagenesis[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5639-5646. DOI:10.1007/s00253-015-6678-y.
[10] LI H P, SUN W T, WANG H B, et al. Electrical features of radiofrequency, atmospheric-pressure, bare-metallic-electrode glow discharges[J]. Plasma Chemistry and Plasma Processing, 2007, 27(5): 529-545. DOI:10.1007/s11090-007-9079-x.
[11] LI G, LI H P, WANG L Y, et al. Genetic effects of radio-frequency, atmospheric-pressure glow discharges with helium[J]. Applied Physics Letters, 2008, 92(22): 221504. DOI:10.1063/1.2938692.
[12] WANG L Y, HUANG Z L, LI G, et al. Novel mutation breeding method for Streptomyces avermitilis, using an atmospheric pressure glow discharge plasma[J]. Journal of Applied Microbiology, 2010, 108(3): 851-858. DOI:10.1111/j.1365-2672.2009.04483.x.
[13] 郑玲辉, 洪云, 陈晓静, 等. 奥利万星中间体A82846B的菌种选育与培养基优化[J]. 中国医药工业杂志, 2015, 46(5): 462-466. DOI:10.16522/j.cnki.cjph.2015.05.008.
[14] 武婷婷, 刘万振, 生吉萍, 等. 产α-葡萄糖苷酶抑制剂的桑树内生细菌分离及鉴定[J]. 食品科学, 2011, 32(13): 205-208.
[15] 张玲, 刘平怀, 罗宁, 等. 小球藻Chlorella sorokiniana C74营养素分析[J]. 食品研究与开发 , 2016, 37(10): 10-14. DOI:10.3969/ j.issn.1005-6521.2016.10.003.
[16] YAMAKI K, MORI Y. Evaluation of alpha-glucosidase inhibitory activity in colored foods: a trial using slope factors of regression curves[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2006, 53(4): 229-231. DOI:10.3136/nskkk.53.229.
[17] 郎国竣. 微生物源α-葡萄糖苷酶抑制剂的筛选、分离纯化及产生菌的鉴定[D]. 上海: 上海师范大学, 2007: 25-27.
[18] 布坎南. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984: 729-795.
[19] 魏景超. 真菌鉴定手 册[M]. 上海: 上海科学技术出版社, 1979: 129-135.
[20] 袁军, 赵犇, 孙梦玉, 等. 常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J]. 生物技术通报, 2015, 31(10): 199-204. DOI:10.13560/j.cnki.biotech.bull.1985.2015.10.030.
[21] 张旗, 周志娟, 杨冬月, 等. 植物内生菌的作用研究[J]. 现代农业科技, 2010(9): 36-37. DOI:10.3969/j.issn.1007-5739.2010.09.012.
[22] 牛丽丽, 袁肖寒, 顾成波, 等. 内生真菌产植物次生代谢产物研究进展[J]. 安徽农业科学, 2016, 44(11): 12-16. DOI:10.13989/ j.cnki.0517-6611.2016.11.005.
[23] PANWAR H, CALDERWOOD D, GRANT I R, et al. Lactobacillus, strains isolated from infant faeces possess potent inhibitory activity against intestinal alpha- and beta-glucosidases suggesting anti-diabetic potential[J]. European Journal of Nutrition, 2014, 53(7): 1465-1474. DOI:10.1007/s00394-013-0649-9.
[24] DEWI R T, TACHIBANA S, FAJRIAH S, et al. α-Glucosidase inhibitor compounds from Aspergillus terreus, RCC1and their antioxidant activity[J]. Medicinal Chemistry Research, 2014, 24(2): 737-743. DOI:10.1007/s00044-014-1164-0.
[25] KUMAR P P, RAJ J P P, CHRISTHUDAS I V S N, et al. α-Glucosidase inhibition and antioxidant properties of Streptomyces sp.: in vitro[J]. Applied Biochemistry & Biotechnology, 2014, 172(3): 1687-1698. DOI:10.1007/s12010-013-0650-z.
[26] 马顶虹, 龚海燕, 李萌萌, 等. 萎缩芽孢杆菌生理生化特征与检测鉴定[J]. 安徽农学通报, 2014, 20(7): 33-35.
[27] YUAN W H, WEI Z W, DAI P, et al. Halogenated metabolites isolated from Penicillium citreonigrum[J]. Chemistry and Biodiversity, 2014, 11(7): 1078-1087. DOI:10.1002/cbdv.201300349.
[28] MENG P, ZHOU X X. α-Glucosidase inhibitory effect of a bioactivity guided fraction GIB-638 from Streptomyces fradiae PWH638[J]. Medicinal Chemistry Research, 2012, 21(12): 4422-4429. DOI:10.1007/s00044-012-9984-2.
[29] ZHU Y P, LI X T, TENG C, et al. Enhanced production of α-glucosidase inhibitor by a newly isolated strain of Bacillus subtilis B2 using response surface methodology[J]. Food and Bioproducts Processing, 2013, 91(3): 264-270. DOI:10.1016/j.fbp.2012.09.010.
[30] 白豆, 龙玲, 朱乃硕. 一株产1-脱氧野尻霉素(DNJ)枯草芽孢杆菌黑色变种的诱变育种研究[J]. 复旦学报(自然科学版), 2016, 55(1): 104-111. DOI:10.15943/j.cnki.fdxb-jns.2016.01.014.
[31] 王兴吉, 刘文龙, 钱娟娟. ARTP诱变选育中温α-淀粉酶高产菌株及其发酵条件优化[J]. 中国酿造, 2016, 35(1): 78-81. DOI:10.11882/ j.issn.0254-5071.2016.01.017.
[32] LU Y, WANG L Y, MA K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes, mutant generated by a new atmospheric and room temperature plasma (ARTP)[J]. Biochemical Engineering Journal, 2011, 55(1): 17-22. DOI:10.1016/j.bej.2011.02.020.
[33] 苏方华. 桑叶的化学成分及临床应用研究进展[J]. 中国医药导报, 2010, 7(14): 9-12. DOI:10.3969/j.issn.1673-7210.2010.14.007.
Isolation, Identification and Mutation Breeding of an Endophytic Strain Producing α-Glucosidase Inhibitor from Mulberry Leaf
ZHU Mengfeng1,2,3, XU Wei2,3,*, SHAO Rong2,3, WEI Ping1,*
(1. School o f Pharmaceutical S ciences, Nanjing Tech University, Nanjing 211816, China; 2. School of Marine and Biology Engineering, Yancheng Institute of Technology, Yancheng 224051, China; 3. Jiangsu Key Laboratory of Biochemistry and Biotechnology of Marine Wetland, Yancheng Institute of Technology, Yancheng 224051, China)
Abstract:A strain capable of producing α-glucosidase inhibitor as a potential antidiabetic agent from mulberry leaf was isolated. Subsequently, atmospheric and room temperature plasma (ARTP) was applied to mutagenize the isolated strain for improved production of α-glucosidase inhibitors. At the same time, the physicochemical properties and stability were investigated preliminarily. Out of the 188 isolated strains, a bacterial strain named XuW-LB-188 was selected after examination of α-glucosidase inhibitory activity using 4-nitrophenyl-α-D-glucopyranoside(PNPG) as a substrate, giving an inhibition percentage of 52.67% in the fermentation supernatant. On the basis of its morphological characteristics and 16S rDNA gene sequence, the strain was preliminarily identi ed as Bacillus atrophaeus. After ARTP mutation breeding and subsequent high-throughput screening, T-690 was selected out of 880 mutant strains, whose inhibition rate (73.25%) against α-glucosidase was increased by 40.61% compared with that of the original strain. The experiment results indicated that the α-glucosidase inhibitor mainly existed in the fermentation broth. Consequently, the inhibitor was an extracellular product. Moreover, it had high polarity and good thermostability.
Key words:α-glucosidase inhibitor; mulberry leaf; endophytes; screening; atmospheric and room temperature plasma (ARTP); Bacillus atrophaeus
DOI:10.7506/spkx1002-6630-201710019
中图分类号:Q939.97
文献标志码:A
文章编号:1002-6630(2017)10-0111-06
收稿日期:2016-08-18
基金项目:江苏省产学研前瞻性项目(BY2015057-29)
作者简介:朱孟峰(1991—),男,硕士研究生,研究方向为药用微生物筛选及发酵。E-mail:278378538@qq.com
*通信作者:许伟(1976—),女,教授,博士,研究方向为工业微生物和酶工程。E-mail:xuweiyc@163.com韦萍(1961—),女,教授,博士,研究方向为微生物代谢调控及天然产物提取。E-mail:weiping@njtech.edu.cn
引文格式:
朱孟峰, 许伟, 邵荣, 等. 桑叶中α-葡萄糖苷酶抑制剂产生菌的分离鉴定及诱变选育[J]. 食品科学, 2017, 38(10): 111-116. DOI:10.7506/spkx1002-6630-201710019. http://www.spkx.net.cn
ZHU Mengfeng, XU Wei, SHAO Rong, et al. Isolation, identification and mutation breeding of an endophytic strain producing α-glucosidase inhibitor from mulberry leaf[J]. Food Science, 2017, 38(10): 111-116. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710019. http://www.spkx.net.cn