表 1 L9(34)正交试验因素与水平
Table 1 Factors and levels used in L9(34) orthogonal array design
陈国忠,郭秋翠,谭其秀,武硕军,刘炼强,冯志彬*
(鲁东大学生命科学学院,山东 烟台 264025)
摘 要:利用96 孔板和紫外显影相结合的定向快速筛选方法,从烟台渤海湾采集的腐败鱼尸上分离筛选得到1 株高产烟酸羟基化酶的菌株H9,通过形态、生理生化特征和16S rDNA系统发育分析鉴定为恶臭假单胞菌(Pseudomonas putida),对其产酶培养条件进行优化,最适培养基和培养条件为:可溶性淀粉15 g/L、玉米浆15 g/L、烟酸10 g/L、K2HPO41.0 g/L、初始pH 7.0、培养温度25 ℃、接种量7%、500 mL三角瓶装液量50 mL。优化后烟酸羟基化酶活力达到0.37 U/mL,比优化前提高了68%,采用静息细胞转化生产6-羟基烟酸产率达到124.77 g/L,具有工业化生产6-羟基烟酸的应用前景。
关键词:烟酸;6-羟基烟酸;恶臭假单胞菌;烟酸羟基化酶;培养条件优化
6-羟基烟酸(6-hydroxynicotinic acid,6-HNA)是一种合成农药、医药和其他化学药品的重要中间体[1-3],它可以用于生产以吡虫啉为代表的吡啶甲胺类农药[4-6],也可以和氯反应生成5,6-二氯烟酸,后者可作为一种减肥药。国内6-HNA的生产多采用化学法[7],存在副产物多、产量低、成本高、污染重等缺陷,从国外进口则价格昂贵,无法满足国内需求。早在1955年研究者发现荧光假单胞菌(Pseudomonas fluorescens)可将烟酸氧化为6-HNA[8],随后催化该反应的烟酸羟基化酶获得纯化[9]随着生物转化技术的发展,通过微生物酶催化转化烟酸生产6-HNA的方法成为研究热点[10-15],该法工艺简单、副产物少、环境友好。Kulla等[16]筛选到2 株木糖氧化无色杆菌(Achromobacter xylosoxidans DSM2402 & DSM2783)能够转化烟酸成为6-HNA,为此瑞士的Lonza公司申请了专利,目前已经开始进行6-HNA的生产。Nagasawa等[17]报道的荧光假单胞菌TN5菌株(Pseudomonasuorescens TN5)、Hurh等[18]报道的黏质沙雷氏菌株(Serratia marcescens IFO12648)均具有转化生产6-HNA的活性。陆宏伟等[19-20]报道了1 株恶臭假单胞菌(Pseudomonas putida NA-1),罗晖等[21-22]筛选得到2 株假单胞菌(Pseudomonas sp. BK-1 & BKC4),杨瑶等[23]报道了1 株睾酮丛毛单胞菌JA1(Comamonas testosterone JA1),均表现出较高的活性。国内对微生物法生产6-HNA的研究起步较晚,与国外的研究水平相比尚有较大差距,距离工业化生产应用仍然需要时间,因此烟酸羟基化酶高产菌株的筛选及其培养条件研究对实现6-HNA的微生物转化生产具有重要意义。
烟酸羟基化酶产生菌的筛选往往需要广泛采样、大量筛选,具有较大的随机性和盲目性,工作量大,筛选效率低,有必要提高目标菌株的筛选效率,建立快速、准确、便捷的筛选方法。通过调研,笔者发现高产烟酸羟基化酶的菌多为假单胞菌属菌种,而假单胞菌多见于腐败鱼尸上,故而产生了从腐败鱼尸采样筛选菌种的思路。本研究借鉴并改进了杨瑶等[24]的微孔板高通量筛选方法以及罗晖等[22]的紫外显影法,进一步提高筛选效率,从渤海湾腐败鱼尸上分离筛选烟酸羟基化酶产生菌,对分离得到的1 株高产烟酸羟基化酶的菌株进行了分类鉴定和产酶培养条件优化。
1.1 材料
1.1.1 样品
腐败鱼尸采自烟台渤海湾沙滩。
1.1.2 试剂
烟酸、6-HNA 百灵威科技有限公司;细菌基因组DNA快速抽提试剂盒 生工生物工程(上海)股份有限公司;其他所用试剂均为分析纯,购自西亚试剂公司。
1.1.3 培养基
培养基参考文献[22]并改良。富集培养基:酵母粉5 g/L,蛋白胨10 g/L,烟酸10 g/L,NaCl 10 g/L,pH 7.0。选择培养基:烟酸10 g/L,(NH4)2SO42.0 g/L,MgSO4·7H2O 0.2 g/L,CaCl2·H2O 0.5 g/L,K2HPO40.5 g/L,pH 7.0。分离培养基:酵母粉0.5 g/L,NaCl 10 g/L,烟酸15 g/L,琼脂18 g/L,pH 7.0。产酶培养基:蛋白胨10 g/L,酵母粉2 g/L,烟酸10 g/L,K2HPO41 g/L,pH 7.0。斜面培养基:蛋白胨10 g/L,酵母粉2 g/L,烟酸10 g/L,琼脂18 g/L,pH 7.0。种子培养基:蛋白胨10 g/L,酵母粉2 g/L,烟酸10 g/L,NaCl 10 g/L,K2HPO41 g/L,pH 7.0。发酵培养基:碳源10 g/L,氮源10 g/L,烟酸10 g/L,K2HPO41 g/L,pH 7.0。
1.2 仪器与设备
SPX-150B-Z生化培养箱 广东省医疗器械厂;TDL-60B高速离心机 上海安亭科学仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;QYC-211全温度恒温培养振荡器 金坛盛蓝仪器有限公司;LDZX-75KB高压灭菌锅 上海申安医疗器械厂;1100型高效液相色谱仪 美国Agilent公司;MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;BGZ-5自控发酵罐上海保兴生物设备公司。
1.3 方法
1.3.1 菌种筛选
用50 mL无菌水清洗腐败鱼尸体表,取10 mL洗液接入装有100 mL富集培养基的500 mL三角瓶中,30 ℃、200 r/min振荡培养18 h,吸取菌液10 mL转接至装有100 mL选择培养基的500 mL三角瓶中,30 ℃、200 r/min振荡培养2 d,将培养液梯度稀释,取0.1 mL涂布于分离培养基,30 ℃培养2 d。将分离培养基上长出的单菌落分别挑到含1 mL产酶培养基的96 孔板中,用8 层纱布覆盖,30 ℃、200 r/min 振荡培养20 h,分别取培养液2 μL点样于滤纸上,用吹风机吹干,在254 nm波长紫外灯下观察,若菌液显紫色荧光则可能含有6-HNA,推测该菌可能产生烟酸羟基化酶。取初筛菌株显色的菌液200 μL转接至含2 mL产酶培养基的24 孔板中,用8层纱布覆盖,30 ℃、200 r/min振荡培养24 h,测发酵液酶活力,将酶活力较高的菌株接种于斜面培养基上,30 ℃培养24 h,保藏备用。
保藏菌种转接斜面培养基活化12 h后接入种子培养基中,50 mL装液量/500 mL三角瓶,30 ℃、200 r/min振荡培养12 h,以10%接种量接入发酵培养基中,100 mL装液量/500 mL三角瓶,30 ℃、200 r/min振荡培养18 h,测酶活力。
1.3.2 酶活力测定
取1 mL发酵液经5 000 r/min离心10 min后,将收集到的菌体用1 mL 20 mmol/L磷酸缓冲液(pH 7.0)洗涤2 次,加入1 mL用20 mmol/L磷酸缓冲液(pH 7.0)配制的1%烟酸溶液,30 ℃、200 r/min振荡反应120 min。反应完成后,5 000 r/min离心10 min,取上清液适当稀释,用高效液相色谱法[17]测定酶催化反应生成的6-HNA含量,并计算烟酸羟基化酶的活力[21]。将1 min催化烟酸生成1 μmol 6-HNA所需的酶量定义为一个酶活单位(U)。
1.3.3 产物检测
采用高效液相色谱仪,反相色谱柱ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流动相为V(10 mmol/L KH2PO4-H3PO4(pH 2.5))∶V(乙腈)=98∶2,流速为1 mL/min,检测波长为260 nm,对供试样液(根据具体情况决定稀释倍数)中6-HNA的含量进行测定,用外标法定量,所有实验均重复3 次,每次均设置3 个平行。同时对6-HNA的吸收峰进行紫外全波长扫描。
1.3.4 菌种鉴定
1.3.4.1 菌体形态观察、培养特征和生理生化特征的测定
用革兰氏染色法,在光学显微镜下观察菌体形态、大小,固体培养基培养24 h后观察菌落形态。
1.3.4.2 系统发育分析
将目的菌株接种在种子培养基30 ℃、200 r/min振荡培养24 h,离心收集菌体,利用细菌基因组DNA提取试剂盒提取基因组DNA,以此为模板采用16S rDNA基因的通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。反应条件为:95 ℃预变性5 min,93 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,30 个循环;72 ℃延伸10 min。PCR产物利用1.0%琼脂糖凝胶电泳分离纯化并回收,交由北京六合华大基因科技股份有限公司测序。测序结果在GenBank利用BLAST程序进行相似性比对,利用MEGA5.0的Neighbor-Joining(NJ)方法构建系统发育树。1.3.5 培养条件优化
1.3.5.1 培养基组成单因素试验设计
在其他培养条件不变的情况下,以10 g/L的比例分别用葡萄糖、糊精、蔗糖、甘油、柠檬酸钠、乙醇、乙酸、酒石酸钾钠、可溶性淀粉、苹果酸作为发酵培养基的碳源;以10 g/L的比例分别用牛肉膏、酵母浸粉、蛋白胨、胰蛋白胨、大豆蛋白胨、尿素、硫酸铵、氯化铵、玉米浆、豆浓、谷氨酸钠作为发酵培养基的氮源;以最适碳、氮源为基础,设置不同质量浓度梯度的K2HPO4;在最优碳、氮源和K2HPO4质量浓度的发酵培养基中分别添加不同质量浓度的烟酸,优化诱导物烟酸用量。
1.3.5.2 培养基组成的正交试验
选择最适碳源(可溶性淀粉)用量、最适氮源(玉米浆)用量、烟酸用量和K2HPO4用量共4 个因素,设置3 个水平,以酶活力为指标,进行正交试验,试验设计如表1所示。
表 1 L9(34)正交试验因素与水平
Table 1 Factors and levels used in L9(34) orthogonal array design

1.3.5.3 培养条件优化
在其他培养条件一致的情况下,将培养基的初始pH值分别调至5.5、6.0、6.5、7.0、7.5、8.0,接种后30 ℃、200 r/min振荡培养16 h,检测烟酸羟基化酶活力,确定最适初始pH值;在其他培养条件一致的情况下,分别在20、25、28、30、33、35、37、40、42 ℃振荡培养16 h,检测酶活力,确定最适培养温度;在其他培养条件一致的情况下,分别按1%、3%、5%、7%、10%接种量进行接种,发酵结束后检测酶活力,确定最适接种量;在其他培养条件一致的情况下,在500 mL三角瓶中分别装50、100、200、300、400、500 mL发酵培养基进行摇瓶培养,检测酶活力,确定最适装液量。全部测定数据均重复3 次取平均值。
1.3.5.4 静息细胞转化生产6-HNA
取优化培养条件下获得的发酵液1 0 0 m L,5 000 r/min离心10 min收集菌体,用20 mmol/L磷酸缓冲液(pH 7.0)洗涤2 次,加入100 mL用20 mmol/L磷酸缓冲液(pH 7.0)配制的1%烟酸溶液,30 ℃、200 r/min振荡反应48 h,转化过程中流加烟酸饱和溶液以维持反应体系中10 g/L烟酸质量浓度,反应结束检测6-HNA含量并计算产率。
1.4 数据分析
实验数据以3个平行组数据的平均值表示,并计算标准偏差。用Origin 8.0作图,SPSS 19.0对数据进行统计分析,采用ANOVA进行Duncans差异分析,以P<0.05为差异显著。
2.1 菌种筛选结果
利用烟酸羟基化产物6-HNA在紫外灯下荧光显色特性,以烟酸为诱导物和底物,对样本进行分离,分离到12 株紫色荧光明亮的菌株,分离纯化后进行摇瓶发酵复筛,发现编号H9的菌株产烟酸羟基化酶活力较高,初始酶活力达到0.22 U/mL(表2),且产酶稳定,以此菌为进一步实验的菌株。
表 2 筛选菌株的酶活力
Table 2 Screening of the isolated strains for nicotinic acid hydroxylase activity

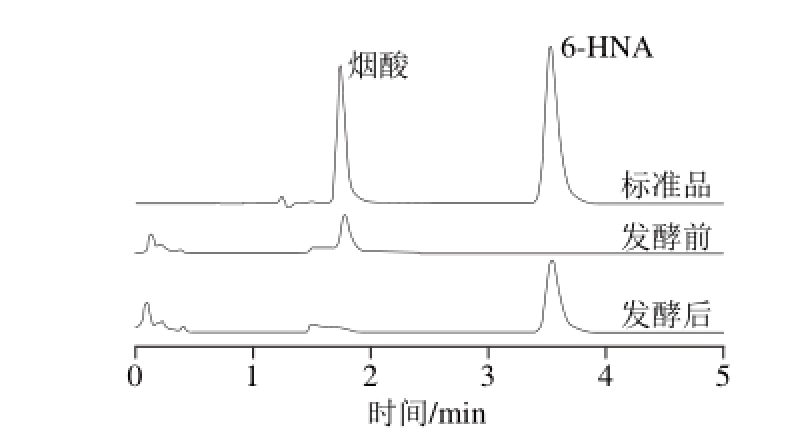
图 1 菌株H9发酵前后的高效液相色谱图
Fig. 1 HPLC chromatograms for 6-HNA standard, medium and fermented broth
2.2 产物鉴定结果对菌株H9发酵前后的醪液进行了高效液相色谱分析,如图1所示,底物烟酸在发酵后其吸收峰消失,出现了1 个新的吸收峰,与6-HNA标准品的保留时间一致,表明菌株H9具有转化烟酸生成6-HNA的能力。
2.3 菌种鉴定结果
2.3.1 菌体形态和培养特征
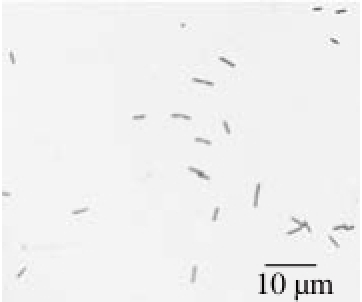
图 2 菌株H9显微照片
Fig. 2 Micrograph of strain H9
菌株H9在LB平板上30 ℃培养24 h,菌落直径2~4 mm,白色、圆形、扁平、光滑、湿润、不透明、边缘整齐、易挑取;显微观察(图2),菌体呈杆状,单个不成链、少数两两对生,无芽孢,具有运动性,革兰氏阴性。在血琼脂平板上生长时可以见到在菌落的周围有溶血环,在液体培养基中培养呈浑浊,有臭味。
2.3.2 生理生化特征
菌株H9氧化酶和接触酶阳性,不能积累聚-β-羟丁酸(poly-β-hydroxybutyrate,PHB),不产生果聚糖,不水解吐温80,不进行反硝化,专性好氧,4 ℃生长,41 ℃不生长,详见表3。综合菌体形态和生理生化特征,依据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》,将菌株H9初步鉴定为假单胞菌属(Pseudomonas sp.)。
表 3 菌株H9的生理生化特征
Table 3 Physiological and biochemical characteristics of strain H9
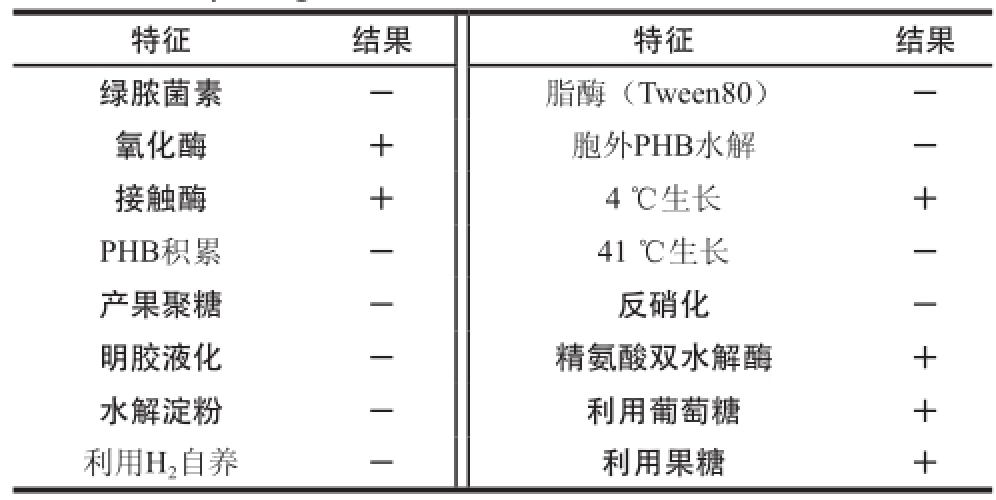
注:+.阳性;-.阴性。
2.3.3 系统发育分析

图 3 基于16S rDNA构建的系统发育树
Fig. 3 Phylogenetic tree based on 16S rDNA sequences of selected strains
菌株H9经DNA提取、PCR扩增和测序,获得16S rDNA基因序列长度为1 440 bp,将此序列提交到GenBank,获得登录号KX369582,在GenBank中BLAST,显示与假单胞菌属有较高的同源性,选取与之同源性较高且有效命名的菌株的相关序列,构建系统发育树(图3)。结果表明,菌株H9与恶臭假单胞菌(Pseudomonas putida)聚在一个类群,同源性达到99%,结合形态特征和生理生化特性,将菌株H9菌株鉴定为恶臭假单胞菌(Pseudomonas putida),该菌株已保藏在中国药学微生物菌种保藏管理中心,保藏号:CPCC 204164。
2.4 培养基配方优化结果
2.4.1 单因素试验结果
恶臭假单胞菌的营养非常多样化,能利用60~80 种不同的碳源[25]。从图4A可以看出,菌株H9以可溶性淀粉、柠檬酸钠、甘油或苹果酸为碳源时其烟酸羟基化酶活力较高且无显著差异,综合考虑成本因素,选择可溶性淀粉作为碳源。在以淀粉为碳源的发酵培养基中添加11 种不同的氮源,分别检测恶臭假单胞菌H9菌株的烟酸羟基化酶活力,结果(图4B)表明,玉米浆作为氮源时酶活力最高,且显著高于其他氮源,这和文献报道的黏质沙雷氏菌Serratia marcescens IFO 12648[18]和Pseudomonas sp. BK-1[21]的最适氮源一致。在以淀粉为碳源、玉米浆为氮源的发酵培养基中分别添加不同用量的K2HPO4作为磷酸盐,如图4C所示,在较低用量时酶活力随K2HPO4用量升高而显著升高,1.0 g/L时达到最高,继续增加K2HPO4用量则酶活降低,由此确定发酵培养基中最适磷酸盐用量为1.0 g/L。在培养体系中,烟酸既是底物也是诱导物,其用量对酶活力有显著影响(图4D),在用量10 g/L以下酶活力随着烟酸用量增大而提高,继续增加烟酸用量则酶活降低,因此最适烟酸用量为10 g/L,与文献报道[17-18,20-21,23]一致。

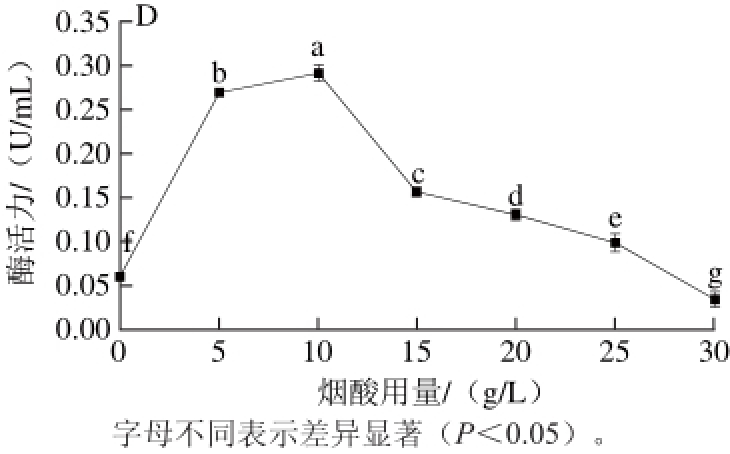
图 4 碳源(A)、氮源(B)、K2HPO4(C)和烟酸(D)用量对H9产酶的影响
Fig. 4 Effects of carbon source (A), nitrogen source (B), K2HPO4(C) and nicotinic acid (D) on the production of nicotinic acid hydroxylase by H9
2.4.2 正交试验结果
表 4 菌株H9产酶培养条件正交试验结果
Table 4 Orthogonal experiment design in terms of coded values with response variable

如表4所示,各因素影响大小顺序为A>D>C>B,最佳水平组合为A3B3C2D1。方差分析结果表明,因素A对菌株H9产酶的影响最显著(表4)。因此,确定培养基配方为:可溶性淀粉15 g/L、玉米浆15 g/L、烟酸10 g/L和K2HPO41.0 g/L。2.5 培养条件优化结果
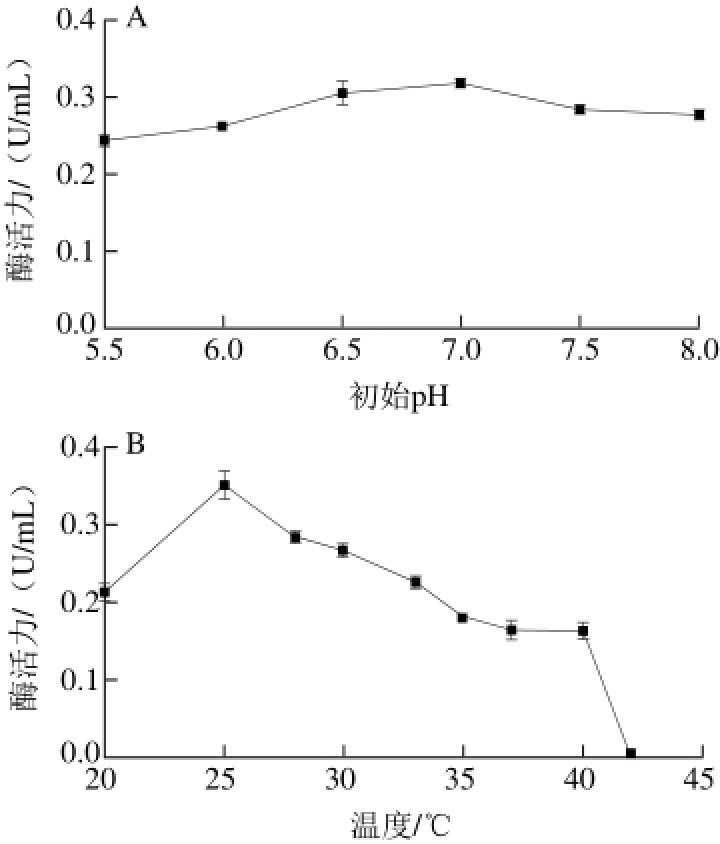
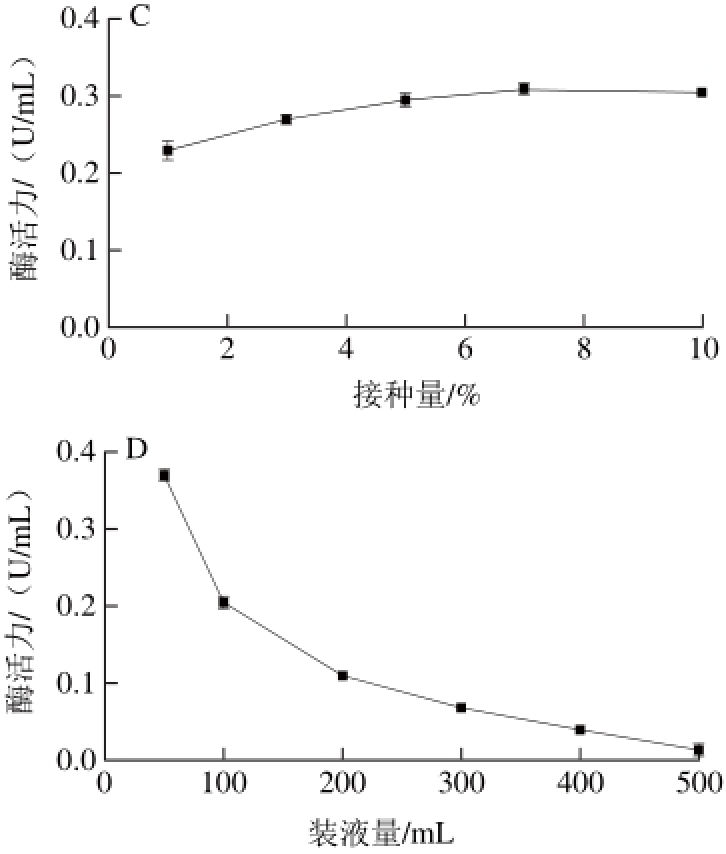
图 5 初始pH值(A)、温度(B)、接种量(C)、装液量(D)对H9产酶的影响
Fig. 5 Effects of initial pH (A), temperature (B), inoculum amount (C) and medium volume (D) on the production of nicotinic acid hydroxylase by H9
图5 A表明在pH 6.5~7.0条件下酶活力最高,过酸或过碱都会造成酶活力降低,但在低于pH 6.5酸性条件下仍然保持了较高的酶活力,显然不同于文献报道pH 5.5~6.0的酸性环境中微生物几乎不生长、酶活力极低的结果[20-21,23],说明菌株H9具有较强的酸耐受性。从图5B可见,25 ℃时酶活力最高,随着温度进一步升高酶活力呈现下降趋势,超过40 ℃则不产酶。如图5C所示,酶活力随着接种量增加而提高,7%接种量时酶活力最高,继续增加接种量酶活力变化不大。装液量对菌株H9产酶的影响极大(图5D),装液量越少酶活力越高,这是因为菌株H9为恶臭假单胞菌,属专性好氧菌,培养过程中要提供充足的溶氧才能保证菌体生长和产酶,这与文献报道一致[17,20-21]。
2.6 验证实验结果
利用确定的发酵培养基配方和优化后的发酵条件,对菌株H9发酵,重复3 次,测定发酵液中烟酸羟基化酶活力。结果表明,优化后恶臭假单胞菌H9所产烟酸羟基化酶活力达到0.37 U/mL,明显高于优化前利用基础发酵培养基所产生的酶活力0.22 U/mL,酶活力提高了68%,表明此优化的发酵培养基和培养条件有利于烟酸羟基化酶活力的提高。采用静息细胞转化生产,6-HNA产率达到124.77 g/L。
据文献报道,产烟酸羟基化酶的菌株多为假单胞菌属,该属菌株表现出酶活力高、易培养等优良性状,而假单胞菌常从腐败鱼尸中检出[26-30]。结合上述信息,笔者从烟台渤海湾采集腐败鱼尸,共分离46 个单菌落,初筛12 株紫外荧光显影的菌株,摇瓶复筛选出4 株产烟酸羟基化酶的菌株,其中H9酶活最高,经鉴定为恶臭假单胞菌,命名为Pseudomonas putida H9,保藏在中国药学微生物菌种保藏管理中心(保藏号:CPCC 204164)。
通过培养条件优化,发现菌株H9的培养特性与已报到的同类产酶菌株有较大差异,主要表现为:最适碳源有多种选择,包括可溶性淀粉、柠檬酸钠、甘油和苹果酸,有利于降低生产成本;具有较宽的pH值耐受范围,更容易控制发酵过程;最适培养温度为25 ℃,明显区别于已报道相关菌株的最适培养温度28 ℃和30 ℃。造成上述差异的原因可能是因为菌株H9分离自海洋死亡腐烂鱼尸而非土样。优化后培养条件为:可溶性淀粉15 g/L、玉米浆15 g/L、烟酸10 g/L、K2HPO41.0 g/L、初始pH 7.0、培养温度25 ℃、接种量7%、500 mL三角瓶装液量50 mL。在此条件下菌株H9的烟酸羟基化酶活力达到0.37 U/mL,采用流加烟酸,静息细胞转化生产实验,6-HNA产率达到124.77 g/L,此产率高于陆伟宏等[20]报道的恶臭假单胞菌Pseudomonas putida NA_1(108.39 g/L),但低于Nagasawa等[17]报道的荧光假单胞菌Psudomonasuorescens TN5(191 g/L)和Hurh等[18]报道的黏质沙雷氏菌Serratia marcescens IFO12648(301 g/L)。与上述菌株相比,菌株H9是首次报道的海洋来源的产烟酸羟基化酶的细菌,具有培养基组成简单、原料廉价易得、耐酸性较强等优点,具有工业化生产6-HNA的应用前景。通过诱变育种及优化转化条件,仍有进一步提高菌株H9酶活和转化产率的可能,相关研究工作正在进行中。
参考文献:
[1] KAGABU S, MORIYA K, SHIBUYA K, et al. 1-(6-Halonicotinyl)-2-nitromethylene-imidazolidines as potential new insecticides[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(2): 362-363. DOI:10.1271/bbb.56.362.
[2] MORIYA K, SHIBUYA K, HATTORI Y, et al. 1-(6-Chloronicotinyl)-2-nitroimino-imidazolidines and related compounds as potential new insecticides[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(2): 364-365. DOI:10.1271/bbb.56.364.
[3] TSAI W L, HUANG K Y, HSUEH C Y, et al. Synthesis and liquid crystal properties of chiral compounds containing the core structure of 6-hydroxynicotinic acid or 4-hydroxyphenylacetic acid[J]. Journal of the Chinese Chemical Society, 2006, 53(6): 1385-1390. DOI:10.1002/ jccs.200600183.
[4] JESCHKE P, NAUEN R. Neonicotinoids-from zero to hero in insecticide chemistry[J]. Pest Management Science, 2008, 64(11): 1084-1098. DOI:10.1002/ps.1631.
[5] 包来仓. 氟虫腈·吡虫啉(35%悬浮种衣剂)防治玉米蛴螬效果及最佳用药量[J]. 河南农业, 2016(28): 31-32. DOI:10.15904/j.cnki. hnny.2016.28.019.
[6] 刘中良, 郑建利, 高俊杰, 等. 吡虫啉对番茄的逆境屏蔽效应及对温室白粉虱的防控效果[J]. 北方农业学报, 2017(1): 65-69.
[7] BOYER J H, SCHOEN W. 6-Hydroxynicotinic acid[M]//Organic Syntheses. John Wiley & Sons, Inc. 2003: 44.
[8] HUGHES D E. 6-Hydroxynicotinic acid as an intermediate in the oxidation of nicotinic acid by Pseudomonas fluorescens[J]. Biochemical Journal, 1955, 60(2): 303-310. DOI:10.1042/bj0600303.
[9] HUNT A L. Puri cation of the nicotinic acid hydroxylase system of Pseudomonasuorescens KB1[J]. Biochemical Journal, 1959, 72(1): 1-7. DOI:10.1042/bj0720001.
[10] DILWORTH G L. Properties of the selenium-containing moiety of nicotinic acid hydroxylase from Clostridium barkeri[J]. Archives of Biochemistry and Biophysics, 1982, 219(1): 30-38. DOI:10.1016/0003-9861(82)90130-8.
[11] DILWORTH G L. Occurrence of molybdenum in the nicotinic acid hydroxylase from Clostridium barkeri[J]. Archives of Biochemistry and Biophysics, 1983, 221(2): 565-569. DOI:10.1016/0003-9861(83)90176-5.
[12] GLADYSHEV V N, KHANGULOV S V, STADTMAN T C. Nicotinic acid hydroxylase from Clostridium barkeri: electron paramagnetic resonance studies show that selenium is coordinated with molybdenum in the catalytically active selenium-dependent enzyme[J]. Proceedings of the National Academy of Sciences, 1994, 91(1): 232-236. DOI:10.1073/pnas.91.1.232.
[13] GLADYSHEV V N, KHANGULOV S V, STADTMAN T C. Properties of the selenium-and molybdenum-containing nicotinic acid hydroxylase from Clostridium barkeri[J]. Biochemistry, 1996, 35(1): 212-223. DOI:10.1021/bi951793i.
[14] SCHMID A, DORDICK J S, HAUER B, et al. Industrial biocatalysis today and tomorrow[J]. Nature, 2001, 409: 258-268. DOI:10.1038/35051736.
[15] 尹祖建, 罗晖, 常雁红, 等. 一株高效催化烟酸羟化反应菌株的筛选及鉴定[J]. 工业微生物, 2008, 38(5): 50-54. DOI:10.3969/ j.issn.1001-6678.2008.05.010.
[16] KULLA H G. Enzymatic hydroxylations in industrial application[J]. CHIMIA International Journal for Chemistry, 1991, 45(3): 81-85. DOI:10.1002/chin.199135327.
[17] NAGASAWA T, HURH B, YAMANE T. Production of 6-hydroxynicotinic acid from nicotinic acid by resting cells of Pseudomonas fluorescens TN5[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(4): 665-668. DOI:10.1271/bbb.58.665.
[18] HURH B, OHSHIMA M, YAMANE T, et al. Microbial production of 6-hydroxynicotinic acid, an important building block for the synthesis of modern insecticides[J]. Journal of Fermentation and Bioengineering, 1994, 77(4): 382-385. DOI:10.1016/0922-338X(94)90008-6.
[19] 陆伟宏, 徐莉, 戴亦军, 等. 一株烟酸羟基化转化菌株的筛选和鉴定[J]. 微生物学报, 2005, 45(1): 6-9. DOI:10.3321/ j.issn:0001-6209.2005.01.002.
[20] 陆伟宏, 王鑫, 徐莉, 等. 恶臭假单胞菌NA-1菌株烟酸羟基化酶活性的诱导和转化条件的研究[J]. 微生物学报, 2005, 45(4): 551-555. DOI:10.3321/j.issn:0001-6209.2005.04.014.
[21] 罗晖, 尹祖建, 常雁红, 等. 产烟酸羟化酶菌株Pseudomonas sp BK-1培养条件的研究[J]. 北京科技大学学报, 2007, 29(增刊2): 216-220.
[22] 罗晖, 冀春苗, 常雁红, 等. 烟酸羟基化酶产生菌的快速筛选及催化条件[J]. 过程工程学报, 2010, 10(3): 576-581.
[23] 杨瑶, 袁生, 戴亦军. 睾酮丛毛单胞菌JA1菌株羟基化烟酸产生6-HNA的发酵产酶条件研究[J]. 工业微生物, 2007, 37(4): 55-59.
[24] 杨瑶, 袁生, 戴亦军, 等. 基于微孔板的高通量筛选6-HNA转化菌方法的建立[J]. 微生物学报, 2008, 48(1): 112-115. DOI:10.3321/ j.issn:0001-6209.2008.01.020.
[25] BUCHANAN R, GIBBENS N. Bergeys manual of systematic bacteriology[M]. 8th. Beijing: Science Press, 1984: 274-280.
[26] 沈锦玉, 余旭平, 潘晓艺, 等. 网箱养殖大黄鱼假单胞菌病病原的分离与鉴定[J]. 海洋水产研究, 2008, 29(1): 1-6. DOI:10.3969/ j.issn.1000-7075.2008.01.001.
[27] LÓPEZ J R, DIÉGUEZ A L, DOCE A, et al. Pseudomonas baetica sp. nov., ash pathogen isolated from wedge sole, Dicologlossa cuneata (Moreau)[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(4): 874-882. DOI:10.1099/ijs.0.030601-0.
[28] ALTINOK I, KAYIS S, CAPKIN E. Pseudomonas putida infection in rainbow trout[J]. Aquaculture, 2006, 261(3): 850-855. DOI:10.1016/ j.aquaculture.2006.09.009.
[29] KUMARAN S, DEIVASIGAMANI B, ALAGAPPAN K M, et al. Isolation and characterization of Pseudomonas sp. KUMS3 from Asian sea bass (Lates calcarifer) with fin rot[J]. World Journal of Microbiology and Biotechnology, 2010, 26(2): 359-363. DOI:10.1007/ s11274-009-0158-4.
[30] 樊海平. 恶臭假单胞菌引起的欧洲鳗鲡烂鳃病[J]. 水产学报, 2001, 25(2): 147-150. DOI:10.3321/j.issn:1000-0615.2001.02.011.
Isolation, Identification and Culture Optimization of Pseudomonas putida H9, a Marine Bacterium Producing Nicotinic Acid Hydroxylase
CHEN Guozhong, GUO Qiucui, TAN Qixiu, WU Shuojun, LIU Lianqiang, FENG Zhibin*
(School of Life Science, Ludong University, Yantai 264025, China)
Abstract:A nicotinic acid hydroxylase- producing strain from spoiled fish from Bohai Bay in Yantai, designated H9, was rapidly and directionally screened using a 96-well microplate and ultraviolet imaging. Strain H9 was identified as Pseudomonas putida based on its morphological, physiological and biochemical characteristics, and 16S rDNA sequence. Our results showed that the highest activity of nicotinic acid hydroxylase of 0.37 U/mL was obtained by culturing strain H9 with 50 mL of a medium consisting of 15 g/L soluble starch, 15 g/L corn steep liquor, 10 g/L nicotinic acid and, 1.0 g/L K2HPO4at an initial pH of 7.0 in a 500-mL flask at 25 ℃ with an inoculum amount of 7%, which was increased by 68% as compared to that before optimization. The yield of 6-hydroxynicotinic acid (6-HNA) produced by resting cell biotransformation reached 124.77 g/L. Accordingly, strain H9 had a promising application potential in the industrial production of 6-hydroxynicotinic acid.
Key words:nicotinic acid; 6-hydroxynicotinic acid; Pseudomonas putida; nicotinic acid hydroxylase; optimization of culture conditions
DOI:10.7506/spkx1002-6630-201710022
中图分类号:Q93
文献标志码:A
文章编号:1002-6630(2017)10-0130-07
引文格式:
陈国忠, 郭秋翠, 谭其秀, 等. 1 株产烟酸羟基化酶海洋细菌H9的分离鉴定及培养条件优化[J]. 食品科学, 2017, 38(10): 130-136. DOI:10.7506/spkx1002-6630-201710022. http://www.spkx.net.cn
CHEN Guozhong, GUO Qiucui, TAN Qixiu, et al. Isolation, identification and culture optimization of Pseudomonas putida H9, a marine bacterium producing nicotinic acid hydroxylase[J]. Food Science, 2017, 38(10): 130-136. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710022. http://www.spkx.net.cn
收稿日期:2016-06-27
基金项目:山东省现代农业产业技术体系家禽产业创新项目(SDAIT-11-10);城新创新基金项目(CXJ-06);鲁东大学科研基金项目(27710301)
作者简介:陈国忠(1980—),男,讲师,博士,研究方向为生物化工。E-mail:guozhongch@126.com
*通信作者:冯志彬(1977—),男,讲师,硕士,研究方向为发酵工程。E-mail:zhibinfeng@126.com