胡艺伟1,加亚玲1,张光先2,*,张凤秀1,*
(1.西南大学化学化工学院,生物有机与药物化学研究所,重庆 400715;2.西南大学纺织服装学院,重庆 400715)
摘 要:用乙烯利释放出乙烯,研究其对α-淀粉酶活力、动力学及微环境的影响。结果表明:与对照组比较,低浓度乙烯提高α-淀粉酶活力,而高浓度乙烯抑制α-淀粉酶活力;乙烯对α-淀粉酶的最适pH值(pH 6.0)几乎没有影响,但对其最适温度改变,向高温方向偏移5 ℃。用高浓度和低浓度的乙烯处理α-淀粉酶,探讨乙烯对α-淀粉酶的反应机理,其水解动力学符合一级动力学方程(Michaelis-Menten),其对应的双倒数曲线(Lineweaver-Burk)拟合度较好。紫外、荧光光谱分析表明:随着乙烯浓度增加,α-淀粉酶紫外吸光度和荧光发射强度明显增强。与对照组相比,紫外吸收光谱在波长229 nm红移1 nm。α-淀粉酶溶液的黏度随着乙烯浓度的增加而下降,导致酶的微环境改变。目前,乙烯利已广泛应用于各种蔬菜、水果,本研究对乙烯的食品安全有非常重要的意义。
关键词:乙烯;影响;α-淀粉酶;活力;微环境;动力学
α-淀粉酶(EC3.2.1.1)全称为1,4-α-D-葡聚糖-4-葡聚糖水解酶[1],广泛存在于植物、动物和微生物中[2],如发芽的水稻、大麦和小麦等[3]。在人和动物的唾液、胰腺中α-淀粉酶含量非常高。α-淀粉酶能切开淀粉分子内部的α-1,4-糖苷键,生成糊精和还原糖[4]。目前,工业生产上用微生物发酵法大规模生产α-淀粉酶[5],它广泛被应用于纺织工业、制药工业和食品工业,如食品加工、酿造、发酵工业等[6-7]。已有较多研究报道酶活性受到多种因素的影响,如pH值、温度、金属离子、溶剂、二氧化碳、甲醇、硫化氢等[8-12]。
乙烯利作为催熟剂被广泛用于喷水果和蔬菜中,它所释放的乙烯对作物催熟。在日本和中国,乙烯利对玉米最大残留量被设定为0.5 mg/kg;在英格兰和欧洲联盟为0.05 mg/kg[13]。然而,中国在1~180 d的存储中,乙烯残留量在新鲜和干玉米中分别为0.43~0.657 mg/kg和0.657~0.609 mg/kg,这超出了乙烯利残留量的最大限度[14]。此外,多余的乙烯利将破坏环境(土壤、水和空气)和伤害非目标生物(植物和动物原料)[15],例如急性毒性、慢性中毒和突变等[16]。
乙烯是最简单的烯烃,也是一种植物激素[17]。在植物的生长和发育中起着非常重要的作用,如种子萌发、叶子衰老与脱落、木材形成、应对环境压力[18-20]等。目前,较多文献报道乙烯在植物体内合成并影响植物的生理和生化反应[21],这些研究表明乙烯参与植物一系列的生理生化反应,如通过乙烯受体途径调节植物的基因表达[22],这是乙烯和乙烯受体的结合产生乙烯受体反应从而提高或抑制植物体内各种酶的活力[23]。因此,乙烯在植物体内的生理生化调控机理已清晰,但对人体和动物体内各种酶的活力是否有影响还不清楚。基于过量乙烯利在水果、蔬菜甚至作物的广泛使用,过量乙烯利释放出的乙烯对动物和人类是否存在食品安全隐患的研究报道极少。笔者已报道乙烯对体外脂肪酶的水解活力的影响和机理[24],但乙烯对体外其他酶活力的影响目前还鲜有相关报道。因此,本实验以广泛存在的米曲霉α-淀粉酶为例,进一步研究乙烯对体外α-淀粉酶活力、动力学和微环境的影响,以期得到更多的实验证据。这对乙烯的食品安全有非常重要的意义。
1.1 材料与试剂
α-淀粉酶(来自于米曲霉,粉末,活力≥150 000 U/g)美国Sigma-Aldrich公司;乙烯利水剂(纯度40%) 四川省精细化工研究设计院;可溶性淀粉(来自于土豆,分析纯,相对分子质量342.294 8)、碘化钾(纯度≥98.5%)、碘(纯度≥99.8%) 成都市科龙化工试剂厂;柠檬酸(纯度≥99.5%)、磷酸氢二钠(Na2HPO4·12H2O,纯度≥99.0%) 重庆东方试剂厂;盐酸(纯度36%~38%,1.18 g/mL) 重庆川东化工有限公司化学试剂厂。
1.2 仪器与设备
TU-1810-PC紫外分光光度计 北京浦西通用仪器有限公司;F-4600-FL荧光分光光度计 日本日立公司;乌氏黏度计 北京天创尚邦仪器设备有限公司;6890气相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 乙烯的制备和浓度的计算
称取5.0 g氢氧化钠转入盛有5 mL蒸馏水的250 mL三颈烧瓶中。加入10 mL的乙烯利于恒压滴液漏斗中,以30 drop/min的速率滴加到三颈烧瓶中。用排水吸气法收集乙烯,在-20 ℃条件下冷冻干燥[23]。
精确移取5 mL蒸馏水到盛有2 mL磷酸缓冲溶液(pH 6.0)的60 mL玻璃瓶中,用橡胶塞密封。用常量或微量注射器注入适当体积的乙烯,恒温水浴振荡加热一定时间以达气-液平衡,冷却至室温。用气相色谱测定乙烯浓度。色谱条件:氢离子火焰检测器,cyclodex-β毛细管柱(30 m×0.25 mm,0.25 μm),载气为N2(纯度99.999%),进样口温度150 ℃,柱温10~80 ℃,检测器温度200 ℃。拟合乙烯体积计算公式(1)如下:
y=25.865x+3.457 (1)
式中:x为注射乙烯的体积/mL;y为溶液中乙烯浓度/(μmol/L)。
1.3.2 α-淀粉酶活力计算
按照文献[6,25]方法测定α-淀粉酶活力。量取5 mL一定浓度的可溶性淀粉溶液和2 mL一定pH值磷酸盐缓冲溶液到60 mL的带橡胶塞玻璃瓶中,混合均匀。在恒温水浴锅中加热5 min后,精确移取0.5 mL的一定质量浓度的α-淀粉酶,用橡胶塞密封。然后将适当浓度的乙烯气体注入到玻璃瓶中,对照组不加乙烯,摇匀后放入恒温水浴锅中反应5 min。反应结束后,移取1 mL混合溶液于盛有5 mL 88 mg/L的碘和0.5 mL 0.1 g/L的稀盐酸溶液的试管中终止酶反应,摇匀。立即在660 nm波长处测定该溶液的吸光度,实验重复3 次。酶活力定义:α-淀粉酶1 min水解1 mg淀粉的量为1 U。α-淀粉酶活力按公式(2)计算:
式中:M0为初始的淀粉质量/mg;M1为残留淀粉质量/mg;M2为酶质量/g;t为反应时间/min。
1.3.3 α-淀粉酶溶液的黏度、紫外和荧光光谱测定
精确移取10 mL质量浓度1 mg/mL、pH 6.0的α-淀粉酶溶液,放入60 mL带橡胶塞的玻璃中。然后加入不同浓度的乙烯,用橡胶塞塞住。对照组不加乙烯。用手不停地摇动,让乙烯充分溶解到α-淀粉酶溶液中。在40 ℃恒温水浴中加热30 min,冷却到室温(24 ℃)以达到气-液平衡。在24 ℃测定其紫外、荧光光谱和黏度,在190~400 nm的波长范围内测定紫外光谱。荧光光谱在激发波长279 nm和发射波长270~400 nm条件下测定,激发和发射宽度为5 nm。实验均重复3 次。
以去离子水作为对照,用乌氏黏度计来测量黏度。α-淀粉酶黏度的计算如公式(3)所示[26]:
式中:t1和t2分别为对照组和乙烯处理组液体流经时间/s;η为去离子水在24 ℃条件下的黏度系数,0.914 2 mPa·s;ρ1为去离子水的密度/(g/cm3);ρ2为酶溶液的密度/(g/cm3)。
2.1 乙烯浓度对α-淀粉酶活力的影响
在磷酸缓冲溶液pH 6.0、淀粉浓度58.429 mmol/L、α-淀粉酶质量浓度0.2 mg/mL和55 ℃条件下,实验组加入不同体积乙烯,对照组不加乙烯。测定不同浓度乙烯对α-淀粉酶催化水解活力的影响,结果见图1。
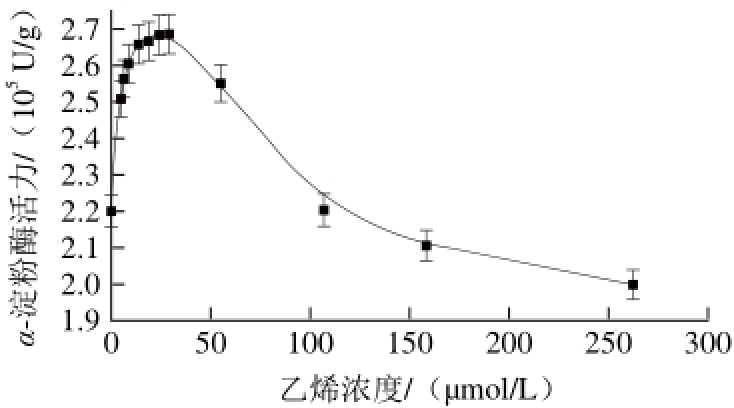
图 1 乙烯浓度对α-淀粉酶活力的影响
Fig. 1 Effects of different ethylene concentrations on α-amylase activity
由图1可见,与对照组相比,乙烯浓度在6.04~29.32 μmol/L的范围内,α-淀粉酶活力随乙烯浓度的增加而增加,然后随着乙烯浓度的增加而降低。当乙烯浓度为29.32 μmol/L,α-淀粉酶活力达到最大值,该结果与乙烯在植物体中的生理效应一致[13],即较低乙烯浓度促进α-淀粉酶活力,而较高浓度抑制α-淀粉酶活力。这可能是在反应条件下,酶分子热运动导致其构象发生涨落[27],结构简单的疏水乙烯小分子容易渗入疏水性的α-淀粉酶内部,直接影响α-淀粉酶分子的微观结构,因而调控α-淀粉酶活力。
2.2 不同反应时间的α-淀粉酶活力
在淀粉浓度58.429 mmol/L、α-淀粉酶质量浓度0.2 mg/mL、pH 6.0和55 ℃条件下,探讨反应时间对乙烯浓度为29.32 μmol/L的实验组和未加乙烯对照组的α-淀粉酶活力的影响,结果见图2。
由图2可以看出,实验组与对照组α-淀粉酶活力均随着反应时间的升高而下降,并在反应时间超过25 min以后逐渐达到平衡。但对于同一反应时间,实验组的α-淀粉酶活力比对照组高。结果表明,乙烯提高了α-淀粉酶活力。可能的原因是,乙烯溶解到反应溶液中,改变了酶的微环境,进一步改变了酶的空间构象[24,27]。
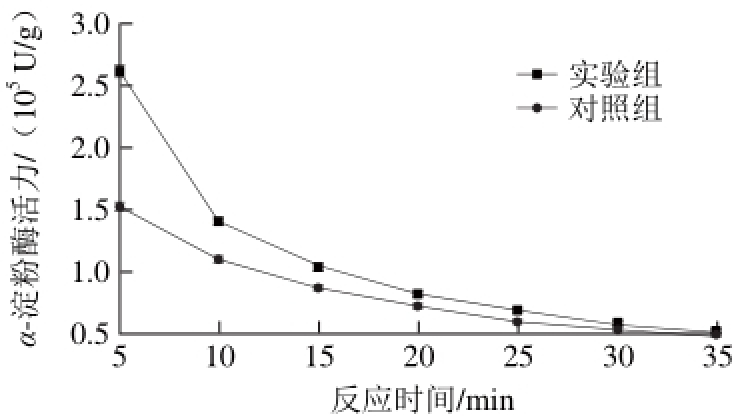
图 2 乙烯对不同反应时间α-淀粉酶活力的影响
Fig. 2 Effects of ethylene on α-amylase reaction rate
2.3 乙烯对α-淀粉酶最适pH值的影响
在不同pH值的磷酸缓冲液中,实验组加入乙烯浓度为29.32 μmol/L,对照组不加乙烯。在淀粉浓度58.429 mmol/L、α-淀粉酶质量浓度0.2 mg/mL和55 ℃恒温水浴中条件下,测定不同pH值条件下α-淀粉酶催化水解淀粉的活力,结果见图3。
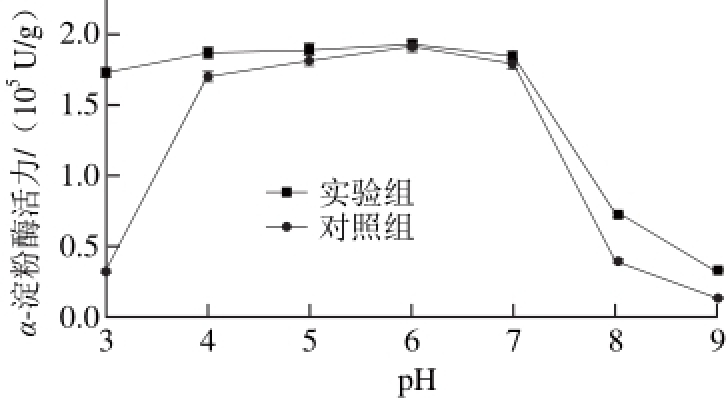
图 3 乙烯对α-淀粉酶最适pH值的影响
Fig. 3 Effects of ethylene on optimum pH for α-amylase
如图3所示,实验组和对照组在pH 3~9的范围内,α-淀粉酶活力的变化呈“钟形”,且最适pH值均为6。但对于对照组,当pH值小于4或大于7,则α-淀粉酶活力改变更为明显。对于实验组,在pH 3~6范围内α-淀粉酶活力逐渐增加,而在pH 7~9范围内其活性逐渐降低。在同一pH值条件下,实验组的活性总是高于对照组,尤其是在pH 3,实验组α-淀粉酶活力比对照组提高了约5 倍。在pH 3~7范围内实验组均保持了较高的活性,这表明乙烯没有改变酶的最佳pH值,意味着乙烯没有影响α-淀粉酶的二级或三级结构,而是使酶的四级结构有一定程度的变化。在乙烯作用下α-淀粉酶的热稳定性增加,且保留或增加了α-淀粉酶的反应活性位点[27]。
2.4 乙烯对α-淀粉酶最适温度的影响
在磷酸缓冲液pH 6.0、淀粉浓度58.429 mmol/L、α-淀粉酶质量浓度0.2 mg/mL和不同温度条件下,实验组加入浓度为29.32 μmol/L乙烯,对照组无乙烯,酶催化活力随温度变化的影响规律见图4。

图 4 乙烯对α-淀粉酶最适温度的影响
Fig. 4 Effects of ethylene on optimum temperature for α-amylase
如图4所示,在相同温度条件下实验组的α-淀粉酶活力比对照组高。在25~40 ℃,实验组和对照组α-淀粉酶活力随温度的升高而逐渐增加。当实验组和对照组的最适温度分别为60 ℃和55 ℃时,α-淀粉酶活力最高。与对照组相比,实验组最适温度向高温方向偏移了5 ℃。其可能原因是乙烯溶解在酶溶液中明显改变了酶溶液的黏度和α-淀粉酶大分子的构象。随着温度继续升高,两组的α-淀粉酶活力都降低,但是实验组下降幅度比对照组慢。这一结果进一步证实乙烯有助于增强α-淀粉酶大分子的热稳定性,使其在高温条件下有较好的活性。
2.5 乙烯对α-淀粉酶催化可溶性淀粉溶液水解动力学的影响
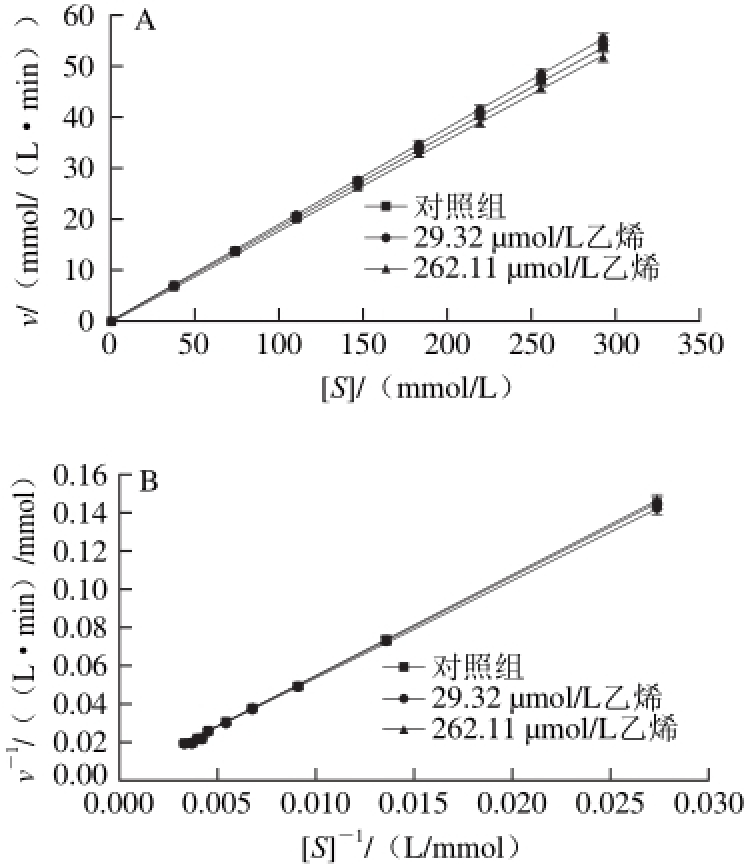
图 5 反应速率与底物浓度的Miehaelis-Menten曲线(A)及Lineweaver-Burk双倒数拟合曲线(B)
Fig. 5 Michaelis-Menten curves reaction velocity against substrate concentration (A) and Lineweaver-Burk double-reciprocal curves (B)
在α-淀粉酶质量浓度0.4 mg/mL、55 ℃和磷酸缓冲溶液pH 6.0的条件下,乙烯浓度分别为0、29.32 μmol/L和262.11 μmol/L,从图5A可见,3 组的水解反应速率都随着底物浓度的增加而增加。在相同的底物浓度条件下,低浓度的乙烯实验组反应速率高于高浓度的乙烯组。表明低浓度乙烯提高α-淀粉酶催化活力,高浓度的乙烯降低α-淀粉酶的催化活力。当底物浓度小于73.04 mmol/L,实验组和对照组水解反应速率之间的差别不大。然而,当底物浓度高于73.04 mmol/L后,随着底物的增加对照组和实验组的初始速率的差异变得更加明显。从图5A得知对照组和实验组的酶促反应符合米氏 方程(Michaelis-Menten)一级动力学,米氏方程及其动力学参数进行拟合结果见表1。
表 1 米氏方程和动力学参数
Table 1 Michaelis-Menten equations and kinetics parameters
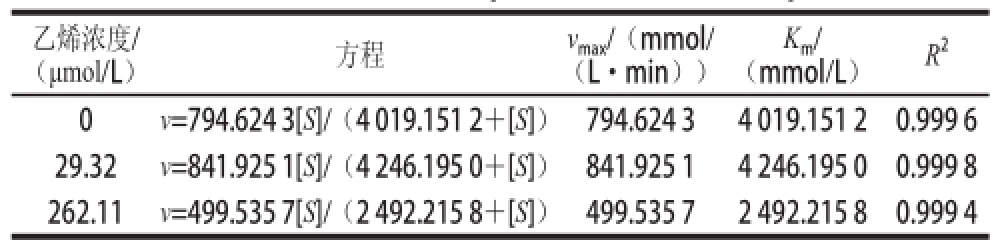
从表1可看出,与对照组相比,用乙烯浓度为2 9.32 μmol/L处理的实验组vmax和Km值均大于比对照组,并且也高于262.11 μmol/L乙烯浓度处理的实验组,但262.11 μmol/L乙烯浓度处理的vmax和Km值低于对照组,这说明高浓度的乙烯对α-淀粉酶活力有抑制作用,低浓度的乙烯对酶活力有促进作用,所有的R2值拟合很好,分别为0.999 6、0.999 8和0.999 4。此外,在底物浓度和反应速率的对应双倒数曲线,如图5B所示。其拟合方程如下:
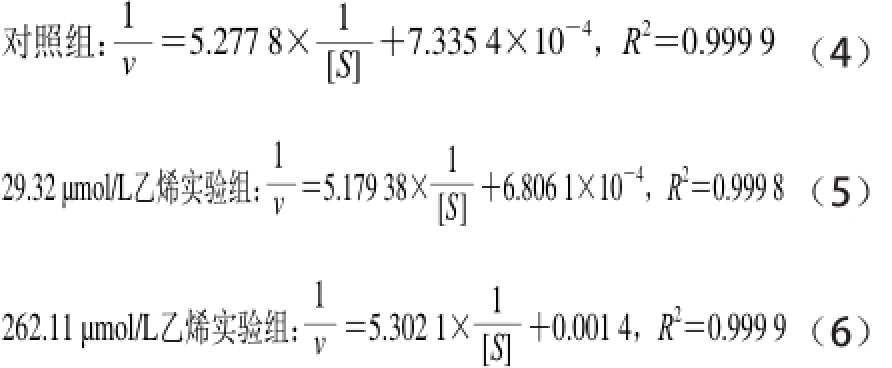
从图5B和拟合方程(4)、(6)可以看出,对照组和262.11 μmol/L乙烯处理的实验组Lineweaver-Burk双倒数拟合曲线的斜率相近,但它们的截距不同,因此262.11 μmol/L乙烯处理的实验组酶反应机理属于反竞争性抑制[28]。而方程(4)和(5)中,对照组和乙烯浓度为29.32 μmol/L的实验组Lineweaver-Burk双倒数拟合曲线的斜率和截距均相差较大,因此乙烯浓度为29.32 μmol/L处理的酶反应机理属于简单的线性非竞争性抑制[28]。表1中Km值等于反应初速率达到最大反应速率一半时的底物浓度,即酶活性部位数的一半为底物占据时所需的底物浓度[27]。表1的Km数据表明:低浓度乙烯处理的实验组酶的活性位点数比对照组多;而高浓度乙烯处理的实验组活性位点数低于对照组。这表明低浓度的乙烯分子被吸附到酶大分子的表面和疏水内部,使酶分子的柔性增加,导致活性位点数大于对照,因此有激活作用。而高浓度的乙烯分子占据了较多的酶活性位点,导致较大程度的破坏了酶原有的构象,因此起抑制作用[27-28]。这两种不同的水解动力学机制表明乙烯在反应体系中可能有两种途径如图6所示。一种途径是乙烯先与α-淀粉酶结合形成反应性中间体,然后该中间体与底物结合发生水解反应。另一种途径是,α-淀粉酶和底物的结合形成一种中间体,乙烯再与这种中间体结合成复合中间体水解淀粉。在水解反应中这两个途径可能同时存在[27]。
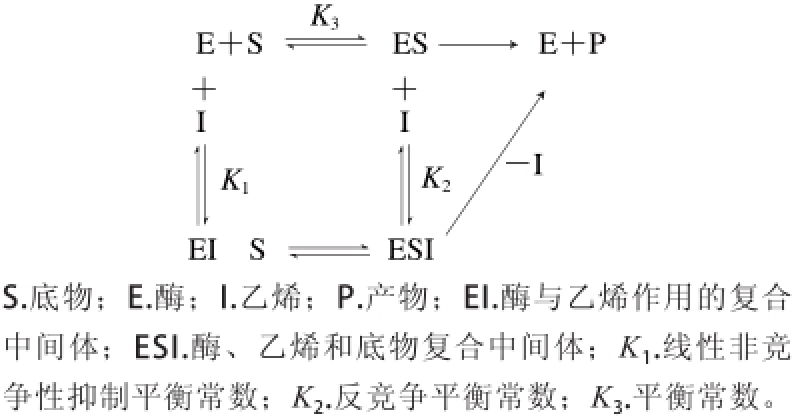
图 6 乙烯酶催化反应机理
Fig. 6 Reaction mechanism of α-amylase hydrolysis in the presence of ethylene
2.6 乙烯对α-淀粉酶黏度的影响
为了证实乙烯对α-淀粉酶微环境的影响,在24 ℃(室温)测定不同乙烯浓度条件下的α-淀粉酶溶液黏度,结果如图7所示。
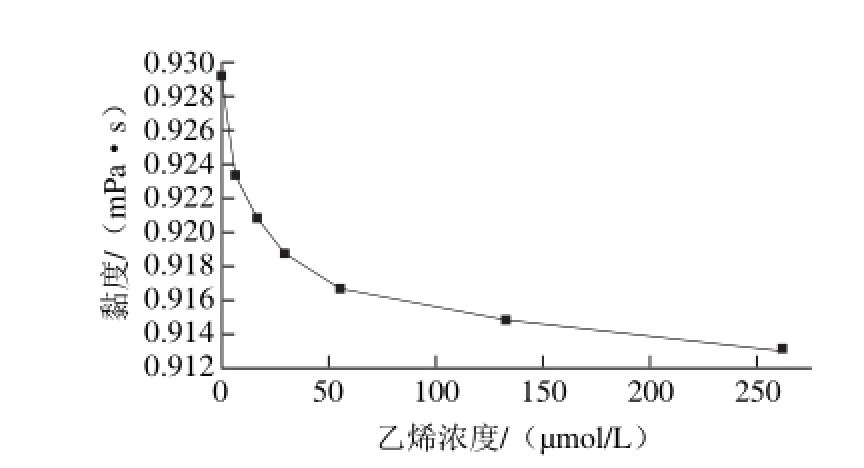
图 7 不同浓度乙烯对α-淀粉酶溶液黏度的影响
Fig. 7 Effects of ethylene concentration on viscosity of α-amylase solution
由图7可见,经乙烯处理后的α-淀粉酶溶液的黏度低于对照组,并且随着乙烯的浓度的增加而降低,然后逐渐达到一个平衡。这个结果表明,乙烯浓度对α-淀粉酶的微环境有显著影响,可能是由于乙烯部分地溶解在酶溶液中,提高了α-淀粉酶微环境的疏水性和酶溶液的流动性,从而导致α-淀粉酶分子的伸展性和柔韧性增加[27]。
2.7 乙烯对α-淀粉酶溶液紫外吸收光谱的影响
在α-淀粉酶质量浓度1.0 mg/mL、24 ℃和磷酸缓冲溶液pH 6.0条件下,不同浓度乙烯对紫外线吸收的影响结果如图8所示。
从图8可知,实验组的峰强度随着乙烯浓度的增加而增加,并且高于对照组。对照组和实验组均在约229 nm和276 nm波长处有两个明显的吸收峰。但对照组和实验组强的吸收峰分别出现在229 nm和230 nm,实验组吸收波长红移了1 nm,这可能是CO肽键的n→P3电子跃迁所致。此外,在276 nm波长处出现了弱吸收峰,这主要归功于α-淀粉酶中的色氨酸和酪氨酸芳环杂原子的n→P3电子跃迁[29]。可能原因是乙烯增加了酶溶液的疏水性,使α-淀粉酶内部的色氨酸和酪氨酸基团被暴露在酶分子表面上。

图 8 乙烯对α-淀粉酶溶液紫外光谱的影响
Fig. 8 Effects of ethylene concentration on the UV absorption spectrum of α-amylase
2.8 乙烯对α-淀粉酶溶液荧光光谱的影响

图 9 乙烯对α-淀粉酶溶液荧光光谱的影响Fig. 9 Effect of ethylene concentrations on the fluorescence spectrum of α-amylase solution
如图9所示,在283 nm和342 nm波长处α-淀粉酶溶液的峰强度随着乙烯浓度的增加而增加,且均高于对照组。在342 nm波长处强发射峰是色氨酸残基引发所致[30]。这表明乙烯改变了酶的微环境,使α-淀粉酶的构象从紧凑状态向松弛状态改变,导致α-淀粉酶分子内的芳香族氨基酸残基很容易暴露到的表面上,增加了酶分子的柔韧性,从而增强了其荧光强度。
乙烯可以直接在体外影响α-淀粉酶活力,低浓度乙烯提高α-淀粉酶催化活力,高浓度乙烯降低α-淀粉酶催化活力。当乙烯浓度为29.32 μmol/L时,α-淀粉酶活力达到最大值。相比对照组,乙烯对α-淀粉酶的最适pH值(pH 6.0)无影响,而α-淀粉酶的最适温度上升5℃。随着α-淀粉酶质量浓度的增加,反应速率增加;且实验组的反应速率比对照组快。有、无乙烯存在条件下,α-淀粉酶水解动力学均符合一级米氏动力学方程;并且其双倒数曲线很好拟合。29.32 μmol/L乙烯处理的实验组酶反应机理属于简单的线性非竞争性抑制,262.11 μmol/L乙烯处理的实验组酶反应机理属于反竞争性抑制。加入乙烯后,α-淀粉酶溶液的黏度明显下降,α-淀粉酶溶液的紫外吸收光谱和荧光发射光谱增强,表明α-淀粉酶的微环境和构象受到乙烯的直接影响。
参考文献:
[1] ROMAN B, ULRIKE W, VOLKER H, et al. Stability and catalytic activity of α-amylase from Barley Malt at different pressuretemperature conditions[J]. Biotechnology and Bioengineering, 2007, 97(1): 1-11. DOI:10.1002/bit.
[2] 罗志刚, 杨景峰, 罗发兴. α-淀粉酶的性质及应用[J].食品研究与开发, 2007, 28(8): 163-166. DOI:10.3969/ j.issn.1005-6521.2007.08.053.
[3] 李珊. 啤酒大麦制麦过程中淀粉酶系及其酶活力的研究[D]. 青岛:中国海洋大学, 2009. DOI:10.7666/d.y1502804.
[4] 徐颖. 高产α-淀粉酶生产菌的筛选鉴定及其酶学性质研究[D].成都: 四川大学, 2007. DOI:10.7666/d.y1212120.
[5] 张永帅, 孙俊良, 梁新红, 等. 测定枯草芽孢杆菌生产中温α-淀粉酶方法的研究[J]. 农产品加工, 2014(8): 1671-9646. DOI:10.3969/ jissn.1671-9646(X).2014.08.001.
[6] GUPTA R, GIGRAS P, MOHAPATRO H, et al. Microbial α-amylases: a biotechnological perspective[J]. Process Bioch emistry, 2003, 38(11): 1599-1616. DOI:10.1016/S0032-9592(03)00053-0.
[7] LILI K. α-Amylases of medical and industrial importance[J]. Journal of Molecular Structure: THEOCHEM, 2003, 666/667: 487-498. DOI:10.1016/j.theochem.2003.08.073.
[8] CHI Z X, LIU R T, ZHANG H. Noncovalent interaction of oxytetracycline with the enzyme Trypsin[J]. Biomacromolecules, 2010, 11(9): 2454-2459. DOI:10.1021/bm100633h.
[9] BUTR C I, SFORZA S, WIERENGA P A, et al. Determination of the influence of the pH of hydrolysis on enzyme selectivity of Bacillus licheniformis protease towards whey protein isolate[J]. International Dairy Journal, 2015, 44: 44-53. DOI:10.1016/j.idairyj.2014.12.007.
[10] ZHAI Z H, YANG T, ZHANG B Y, et al. Effects of metal ions on the catalytic degradation of dicofol by cellulose[J]. Journal of Environmental Science, 2015, 33: 163-168. DOI:10.1016/ j.jes.2014.12.023.
[11] HASHEM M Y, ISMAIL I I, LUTFALLAH A F, et al. Effects of carbon dioxide on Sitotroga cerealella (Olivier) larvae and their enzyme activity[J]. Journal of Stored Products Research, 2014, 59: 17-23. DOI:10.1016/j.jspr.2014.04.002.
[12] POOR N Z, BANIASADI L, OMIDI M, et al. An inhibitory enzym e electrode for hydrogen sulfide detection[J]. Enzyme and Microbial Technology, 2014, 63: 7-12. DOI:10.1016/j.enzmictec.2014.04.016.
[13] 杨治峰. 乙烯利对雄性小鼠生殖毒性和免疫毒性作用的研究[D].济南: 济南大学, 2014.
[14] DONG J N, MA Y Q, LIU F M, et al. Dissipation and residue of ethephon in maize field[J]. Journal of Integrative Agriculture, 2015, 14(1): 106-113. DOI:10.1016/S2095-3119(14)60768-1.
[15] ROYER A, LAPORTE F, BOUCHONNET S, et al. Determination of ethephon residues in water by gas chromatography with cubic mass spectrometry after ion-exchange purification and derivatisationwith N-(tert-butyldimethylsilyl)-N-methyltrifluoroacetamide[J]. Journal of Chr omatography A, 2006, 1108: 129-135. DOI:10.1016/ j.chroma.2005.12.078.
[16] 于文辉, 高永泉, 赵文, 等. 乙烯利体内致突变性研究[J]. 农药学学报, 2006, 8(2): 184-186. DOI:10.3321/j.issn:1008-7303.2006.02.019.
[17] ALBUNIA A R, MINUCCI T, GUERRA G. Ethylene removal by sorption from polymeric crystalline frameworks[J]. Journal of Mater Chemistry, 2008, 18: 1046-1050. DOI:10.1039/b715144f.
[18] GERGOFF G, CHAVES A, BARTOLI C G. Ethylene regulates ascorbic acid content during dark-induced leaf senescence[J]. Plant Science, 2010, 178: 207-212. DOI:10.1016/j.plantsci.2009.12.003.
[19] ZHANG Q, HUANG J Q, ZHAO M Q, et al. Radial growth of vertically aligned carbon nanotube arrays from ethylene on ceramic spheres[J]. Carbon, 2008, 46: 1152-1158. DOI:10.1016/ j.carbon.2008.04.017.
[20] GHANTAS, DATTA R, BHATTACHARYYA D, et al. Multistep involvement of glutathione with salicylic acid and ethylene to combat environmental stress[J]. Journal of Plant Physiological, 2014, 171: 940-950. DOI:10.1016/j.jplph.2014.03.002.
[21] ARCHAMBAULT D J, LI X M, FOSTER K R, et al. A screening test for the determination of ethylene sensitivity[J]. Environmental Monitoring and Assessment, 2006, 115: 509-530. DOI:10.1007/ s10661-006-7227-z.
[22] JOO S, KIM W T. A gaseous plant hormone ethylene: the signaling pathway[J]. Journal of Plant Biological, 2007, 50(2): 109-116. DOI:10.1007/BF03030618.
[23] ZAREMBINSKI T I, THEOLOGIS A. Ethylene biosynthesis and action: a case of conservation[J]. Plant Molecular Biological, 1994, 26: 1579-1597. DOI:10.1007/BF00016491.
[24] 张凤秀, 张光先, 魏世强. 乙烯对脂肪酶活力的直接作用及其机理初探[J]. 化学学报, 2008, 66(6): 639-646. D OI:10.3321/ j.issn:0567-7351.2008.06.009.
[25] 史永昶, 姜涌明, 樊飚, 等. 蛋白酶对解淀粉芽抱杆菌α-淀粉酶活力的影响[J]. 微生物学通报, 1995, 22(1): 23-24.
[26] 陈德万, 李光林. 普通物理学实验[M]. 北京: 中国农业出版社, 2004: 33.
[27] 邹承鲁, 周筠梅, 周海梦. 酶活性部位的柔性[M]. 济南: 山东科技出版社, 2004: 32-85.
[28] 袁勤生. 应用酶学[M]. 上海: 华东理工大学出版社, 1994: 109-110.
[29] 周向军, 高义霞, 郑晓惠, 等. 高乌甲素对α-淀粉酶及其光谱性质的影响[J]. 时珍国医国药, 2013, 24(3): 550-551. DOI:10.3969/ j.issn.1008-0805.2013.03.015.
Effect of Ethylene on the Activity, Kinetics and Microenvironment of α-Amylase in Vitro
HU Yiwei1, JIA Yaling1, ZHANG Guangxian2,*, ZHANG Fengxiu1,*
(1. Institute ofBioorganic and Medicinal Chemistry, College of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China; 2. College of Textiles and Garments, Southwest University, Chongqing 400715, China)
Abstract:The effects of ethylene on α-a mylase activity, kinetics and micr oenvironment were investigated. Compared with the controlgroup, α-amylase activity was enhanced by ethylene at low concentration but inhibited at high concentration. However, ethylene hardly affected the optimum pH (6.0) for α-amylase, whereas it resulted in an increase in the optimum temperature by 5 ℃. The hydrolysis kinetics of α-amylase in the presence of low and high concentrations of ethylene followed a first-order kinetic equation (Michaelis-Menten), and the Lineweaver-Burk double-reciprocal curves were well fitted. The mechanism of action of ethylene in this respect was investigated. The ultraviolet (UV) absorption and fluorescence emission intensity of α-amylase were obviously enhanced with increasing ethylene concentration, and the absorption peak of α-amylase at 229 nm showed a red shift by 1 nm. After ethylene was added, the viscos ity of α-amylase solution declined obviously compared with the control group, leading to a change in the microenvironment of α-amylase. This research is of great significance for supporting the safe application of ethylene in fruits and vegetables.
Key words:ethylene; effect; α-amylase; activity; microenvironment; kinetics
DOI:杨娟. 胰α-淀粉酶的部分性质研究[D]. 成都: 四川大学, 2007.
DOI:10.7666/d.y1212651.
DOI:10.7506/spkx1002-6630-201710024
中图分类号:Q5-33
文献标志码:A
文章编号:1002-6630(2017)10-0143-06
引文格式:
胡艺伟, 加亚玲, 张光先, 等. 乙烯对α-淀粉酶活力、动力学和微环境的影响[J]. 食品科学, 2017, 38(10): 143-148.
DOI:10.7506/spkx1002-6630-201710024. http://www.spkx.net.cn
HU Yiwei, JIA Yaling, ZHANG Guangxian, et al. Effect of ethylene on the activity, kinetics and microenvironment of α-amylase in vitro[J]. Food Science, 2017, 38(10): 143-148. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710024. http://www.spkx.net.cn
收稿日期:2016-05-27
作者简介:胡艺伟(1988—),女,硕士研究生,研究方向为生物有机化学。E-mail:805756023@qq.com
*通信作者:张光先(1965—),男,教授,博士,研究方向为应用化学。E-mail:zgxzfx@swu.com.cn
张凤秀(1965—),女,副教授,博士,研究方向为生物有机催化。E-mail:zhangfx656472@sina.com.cn