表 1 L9(34)正交试验因素与水平
Table 1 Factors and levels used in L9(34) orthogonal array design
蒋雪薇1,岳希洁1,陈代文2,周志明2,罗晓明1,*,叶 菁1,李晓文1
(1.长沙理工大学化学与生物工程学院,湖南 长沙 410004;2.连南瑶族自治县奇乡生物科技有限公司,广东 清远 513300)
摘 要:为了获得一株发酵性能优良的高核酸酵母,以产朊假丝酵母(Candida utilis)CL1501为出发菌株,采用紫外-亚硝基胍复合诱变,筛选获得一株高核酸含量的突变株CL15013,经测定其核酸含量占菌体干质量的16.8%,高于出发菌47.8%。对比研究其流加及分批培养工艺,流加培养细胞收获量为16.9 g/L,比分批培养提高94.3%;正交试验设计优化流加培养条件后,CL15013的收获量达21.3 g/L,比分批培养提高144.8%,具有良好的生产应用潜力。
关键词:产朊假丝酵母;复合诱变;核酸;流加培养
高核酸酵母是指一类核糖核酸、蛋白质含量相对较高的食用酵母,常用于生产高品质的酵母抽提物,特别是高核酸酵母抽提物[1-2]。高核酸酵母抽提物是采用生物技术,将高核酸酵母细胞内的蛋白质、核酸等进行降解后精制而成的天然调味料。酵母抽提物的主要成分为多肽、氨基酸、呈味核苷酸、B族维生素及微量元素等,具有纯天然、营养丰富、味道鲜美醇厚等优点,已在食品工业中广泛应用[3-6]。
我国是酵母生产大国之一,酵母工业也成为我国食品发酵工程领域的核心支柱产业之一[7]。近10年,我国酵母平均年增长率一直保持在10%~20%。随着食品加工业的发展,基于酵母产业发展的酵母抽提物产业平均年增长率20%以上。我国酵母产业规模虽然较大,但主要存在着两个问题,一是高核酸酵母培养的细胞收获量不高,目前国内的细胞收获量水平为15~18 g/L[8],而国外利用高密度培养技术可获得50.4 g/L的细胞收获量[9];二是高核酸酵母抽提物的I+G含量不高,除少数大企业能达到18%的世界先进水平外,多数企业仅为12%~16%[10-11]。其主要原因是由于国内生产菌种性能及抽提工艺与发达国家还有较大差距[12-14]。范云峰[15]在研究高核酸酵母生产技术时发现制备高质量的核酸酵母摇瓶菌种是提高产品产量和质量的前提。王媛媛等[8]发现延长高核酸酵母生长的对数期,有利于提高其细胞收获量,菌体干质量可达15.4 g/L。可以看出,提高核酸酵母细胞收获量及核酸含量是非常重要的,而菌种选育及发酵条件优化是提高上述指标的有效途径。本研究以产朊假丝酵母CL1501为出发菌株,采用理化结合的复合诱变方法,选育出高核酸含量的突变株,研究并优化其培养方法,获得较高细胞收获量的高核酸酵母,为生产应用提供一定的参考依据。
1.1 材料与试剂
1.1.1 菌种
产朊假丝酵母Candida utilis CL1501,长沙理工大学食品与发酵研究所分离并保藏。
1.1.2 试剂与培养基
亚硝基胍(nitrosoguanidine,NTG) 中国医药集团上海化学试剂公司;葡萄糖、酵母膏、Na2S2O3、K2HPO4、MgSO4、FeSO4、ZnSO4、NaCl 国药集团化学试剂有限公司;琼脂粉 广东环凯微生物科技有限公司;玉米浆 上海方畦仪器有限公司。
分离纯化培养基:麦芽汁培养基;初筛培养基:葡萄糖40 g/L、玉米浆15 g/L、K2HPO43 g/L、MgSO41.2 g/L、pH 6.5;复筛及发酵培养基:葡萄糖50 g/L、酵母膏10 g/L、玉米浆10 g/L、K2HPO43 g/L、MgSO41.2 g/L、FeSO41.2 g/L、ZnSO41.0 g/L、pH 6.5;流加碳源为200 g/L葡萄糖溶液;流加氮源为200 mL/L玉米浆溶液。以上培养基均采用121 ℃、20 min湿热灭菌。
1.2 仪器与设备
UV1800紫外-可见分光光度计 日本岛津公司;HZQ-X300C恒温振荡培养箱 上海一恒科技有限公司;FE28酸度计 瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 菌悬液的制备
将CL1501培养至对数期,无菌生理盐水离心洗涤3 次,制成108CFU/mL的菌悬液备用。
1.3.2 培养方法
分批培养:将菌悬液接种于装有100 mL液体发酵培养基的锥形瓶中,接种量为体积分数5%,28 ℃、200 r/min培养18 h。
流加培养:将菌悬液接种于装有100 mL液体发酵培养基的锥形瓶中,接种量为体积分数5%,28 ℃、200 r/min培养26 h,期间每隔4 h分别流加葡萄糖溶液4 mL、玉米浆溶液4 mL,Na2CO3-NaHCO3溶液(pH 9)调节培养基pH值至6。
1.3.3 生长曲线的测定
将菌种接种于液体发酵培养基中,2 8 ℃、200 r/min,每间隔2 h取样测细胞收获量,并绘制CL1501的生长曲线。
1.3.4 紫外诱变致死率曲线的测定
取10 mL菌悬液于无菌皿中,搅拌状态下,进行不同剂量的紫外照射[16],紫外照射条件:紫外灯15 W、垂直照射距离30 cm,分别照射30、60、90、120、150、180 s。统计致死率并确定最佳的诱变剂量。
1.3.5 NTG处理致死率曲线的测定
取7 支装有1 mL菌液的试管,分别加入1 mL质量浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4 g/L的NTG溶液,置于30 ℃恒温水浴中分别反应20 min,18 mL硫代硫酸钠溶液终止反应[17]。统计致死率并确定最佳的诱变剂量。
1.3.6 流加培养基的优化
采用L9(34)的正交表,优化流加培养基中的葡萄糖、玉米浆及K2HPO4流加量,摇瓶流加培养26 h(流加条件见1.3.2节)之后以细胞收获量为考察指标,其因素水平见表1。
表 1 L9(34)正交试验因素与水平
Table 1 Factors and levels used in L9(34) orthogonal array design

1.3.7 分析方法
1.3.7.1 菌体干质量及蛋白质含量的测定
取定量发酵液离心洗涤3 次,将湿菌体于105 ℃鼓风干燥箱中烘干至恒质量[13],测菌体干质量;蛋白质含量采用凯氏定氮法[18]。
1.3.7.2 核酸含量的测定
取2 份5 mL发酵液,4 000 r/min离心洗涤菌体3 遍,一份收集菌体烘干测菌体干质量,另一份重悬于90 mL蒸馏水中,冰浴,置于超声波破碎仪中进行破碎,12 000 r/min离心5 min,取5 mL上清液于紫外分光光度计260 nm波长处测吸光度,以蒸馏水做空白对照[19]。
式中:A为260 nm波长处吸光度;md为菌体干质量/(g/L);n为稀释倍数;0.024为1 μg/mL核酸溶液的OD260nm。
2.1 出发菌株性能从表2可以看出,产朊假丝酵母CL1501蛋白质质量浓度较高,作为呈味酵母抽提物原料的高核酸酵母除需要有较高的核酸质量浓度外,蛋白质质量浓度高也是比较重要的,因此,CL1501适合作为选育高核酸酵母的出发菌株。
表 2 出发菌株的性能测定
Table 2 Properties of CL1501
2.2 复合诱变条件的确定

图 1 CL1501的生长曲线
Fig. 1 Growth curve of strain CL1501
当细胞进入对数期时,菌体大量繁殖、DNA等遗传物质也进行大量复制,许多碱基类似物在DNA复制过程中整合到DNA中[20],此时是诱变处理的最佳状态。测定CL1501的生长曲线,其结果见图1。从图1可以看出,5~15 h时,CL1501进入对数期,15 h时对数期结束。选取培养至对数期中后期的菌种(培养时间12 h)进行诱变,既可保证菌种活力又可保证菌种数量。
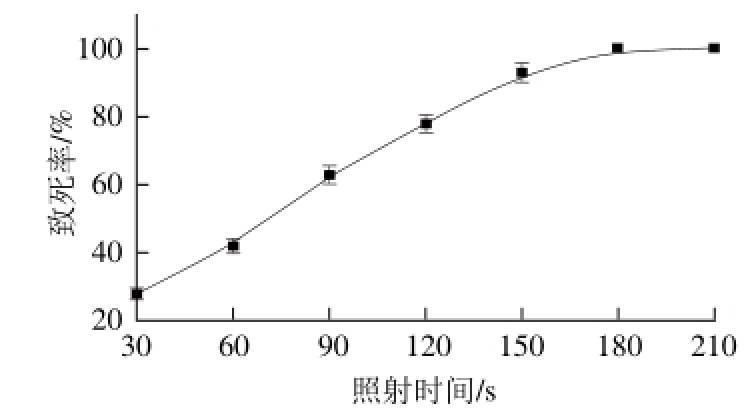
图 2 紫外诱变致死率曲线
Fig. 2 Lethality rate of UV light mutagenesis
紫外是一种应用广泛、效果明显的物理诱变剂,因其具有诱变频率高、且不易回复突变等优点,所以成为工业微生物育种上最常用和有效的诱变剂之一[21]。NTG是一种烷化剂,有超诱变剂之称,能使细胞发生一次或多次突变,诱变效果好[20]。实验选取紫外-NTG复合诱变,首先测定紫外照射时间对出发菌的诱变致死率曲线,结果见图2。由图2可知,当照射时间为90 s,致死率为63%,选择紫外处理90 s先对菌悬液进行处理,再用不同浓度的NTG对菌悬液继续进行诱变处理,其致死率曲线见图3。由图3可知,NTG处理的质量浓度为0.6 g/L时,致死率达到80%。致死率为70%~80%时,诱变效果较好且易筛选[22],故确定复合诱变处理方式为:紫外照射90 s后0.6 g/L的NTG处理20 min。复合诱变后平板筛选获得200 株生长良好的突变株进行摇瓶初筛。
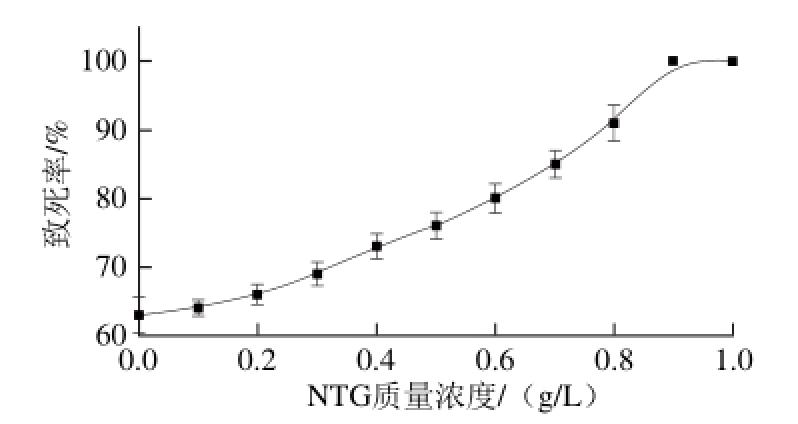
图 3 紫外-NTG诱变致死率曲线
Fig. 3 Lethality rate of UV-NTG mutagenesis
2.3 高核酸酵母筛选

图 4 复筛结果
Fig. 4 Results of secondary screening
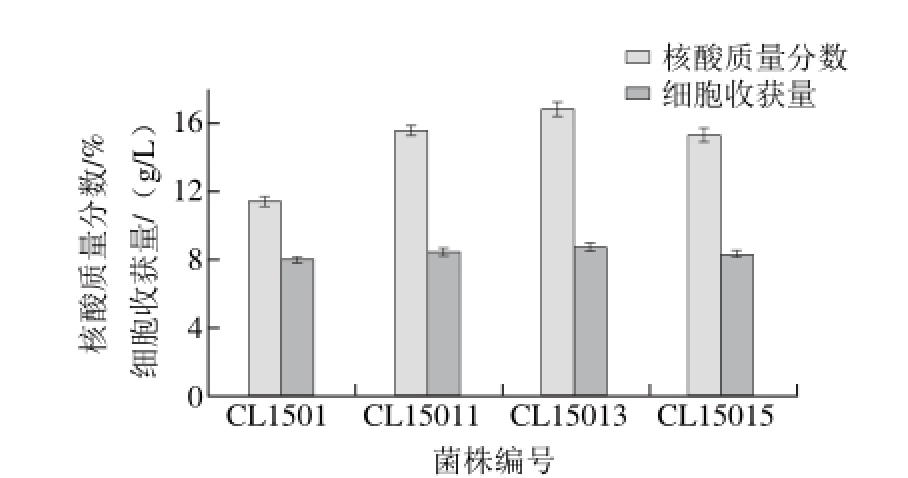
图 5 高产菌株发酵实验对比
Fig. 5 Comparison of fermentation characteristics of the original and mutant strains
以细胞收获量为指标摇瓶初筛诱变获得的200 株突变株,得到50 株生长良好的菌株进入摇瓶复筛,超声波破碎并测定其核酸含量,挑选出15 株核酸含量较高的突变株(图4)。突变株11、13、15号菌核酸质量分数明显高于出发菌株及其他突变株,将这3 株菌依次命名为CL15011、CL15013、CL15015,发酵实验测定其细胞收获量及核酸含量,其结果见图5。由图5可知,CL15013的核酸含量及细胞收获量最高,经测定其核酸含量、细胞收获量较原始菌株分别提高了47.8%、28.9%,多次传代及冰箱保存实验证明该菌株具有较好的遗传稳定性,因此选择CL15013进行发酵性能研究。
2.4 分批、流加培养方法对比
酵母培养中核酸的收获量一方面与酵母核酸含量有关,另一方面,在稳定的核酸含量下,与酵母细胞的收获量有关,可以说,具有工业应用潜力的高核酸酵母除具备核酸含量高以外,还应具备细胞收获量高的优点。优良的培养方法是获得高细胞收获量的重要途径之一,也能有效地提高核酸收获量。分批培养是传统的酵母培养方法,在培养过程中,随着发酵时间的延长,营养物质逐渐消耗,加上代谢物质不断产生,微生物的生长环境随之逐步恶化,对于有持续发酵能力的菌株来说,其细胞收获量将大大减少。而流加培养[23-26]由于不断补充营养物质并调节发酵环境,将有效克服上述问题,因此,流加培养对于高核酸酵母的生产具有较大的优势。
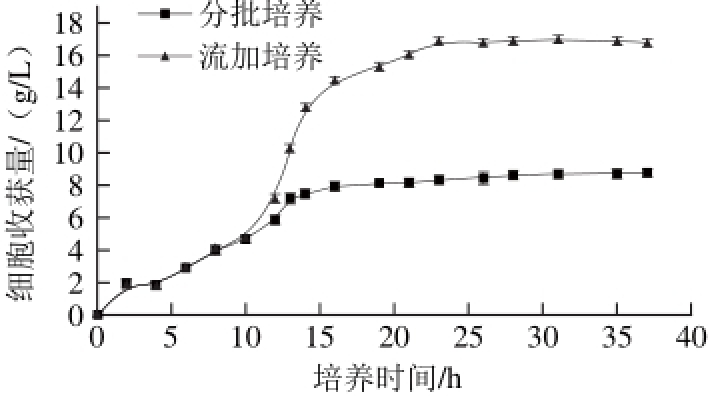
图 6 分批、流加培养酵母的生长曲线
Fig. 6 Growth curves of yeast in batch and fed-batch culture
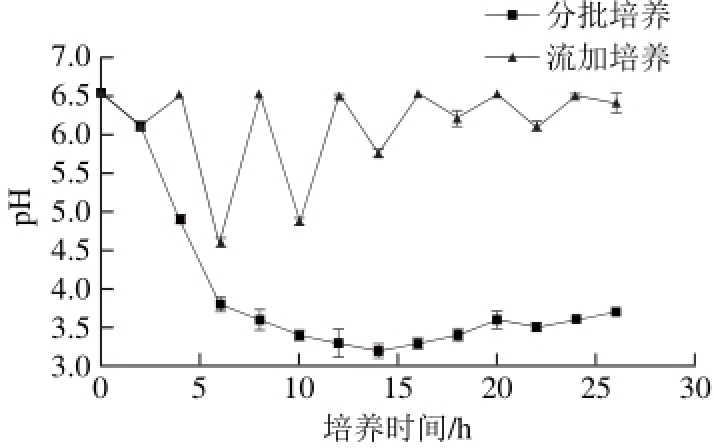
图 7 分批、流加培养发酵液的pH值
Fig. 7 Changes in pH during batch and fed-batch culture
对突变株CL15013分别进行分批、流加培养并测定培养过程中细胞收获量及发酵液的pH值,结果见图6、7。从图6可以看出,突变株经流加培养后,对数期延长了约6 h,且流加培养细胞收获量为16.9 g/L,为分批培养的1.93倍。由图7可知,分批培养过程中,发酵液的pH值在迟滞期及对数期早期迅速降低,可以判断,在发酵初期,产朊假丝酵母发酵产酸导致培养基pH值下降到3左右,严重抑制菌体繁殖,菌体收获量也逐减。流加培养时,由于不断补充新鲜培养基并调节pH值,发酵环境保持适于产朊假丝酵母生长的状态,其细胞收获量相较分批培养大幅提高,因此,产朊假丝酵母进行高核酸酵母发酵更适合采用流加培养。
2.5 流加培养基的优化
2.5.1 流加培养基的单因素试验结果
在预备实验的基础上,选取对细胞产率影响较大的4 种因素:葡萄糖流加量、玉米浆流加量、K2HPO4流加量、流加培养基pH值进行单因素试验,单因素考察外的其他变量条件为:葡萄糖流加量40 g/L、玉米浆流加量40 mL/L、K2HPO4流加量5 g/L,pH 6.5。
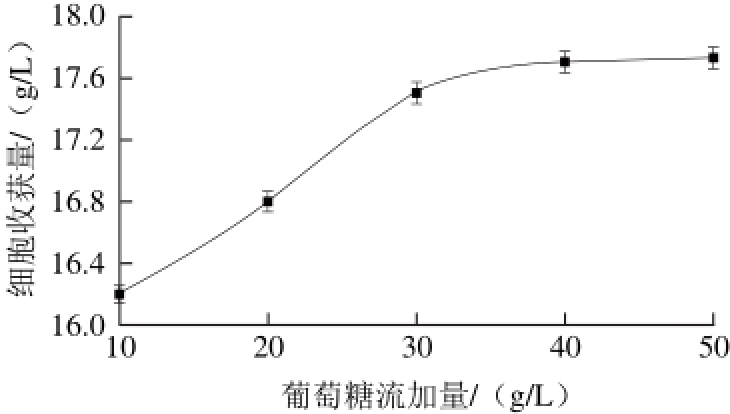
图 8 葡萄糖流加量对细胞收获量的影响
Fig. 8 Effect of glucose addition on cell yield
由图8可知,细胞收获量随葡萄糖流加量的增多而提高,葡萄糖流加量对细胞收获量影响显著(P=0.005<0.01),当葡萄糖流加量超过40 g/L后,细胞收获量随葡萄糖流加量的变化趋势较为缓慢,细胞收获量无显著变化,因此选择40 g/L为较优葡萄糖流加量。

图 9 玉米浆流加量对细胞收获量的影响
Fig. 9 Effect of corn steep liquor addition on cell yield
由图9可知,当玉米浆流加量在30~40 mL/L范围内,细胞收获量随玉米浆流加量的增多而迅速提高,玉米浆流加量对细胞收获量影响显著(P=0.003<0.01),继续增加玉米浆流加量对细胞收获量无显著影响,因此选择40 mL/L为较优玉米浆流加量。
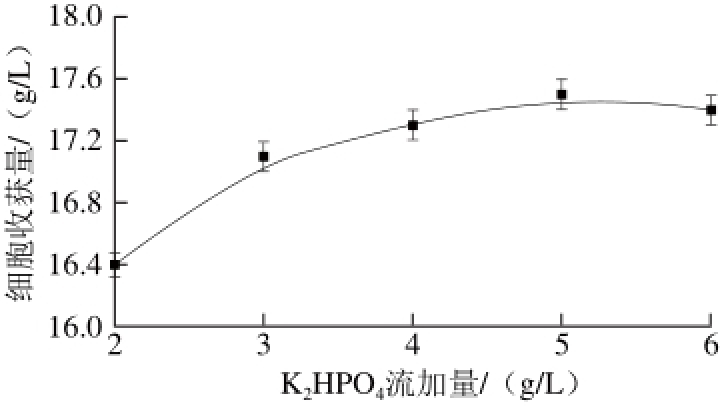
图 10 K2HPO4流加量对细胞收获量的影响
Fig. 10 Effect of K2HPO4addition on cell yield
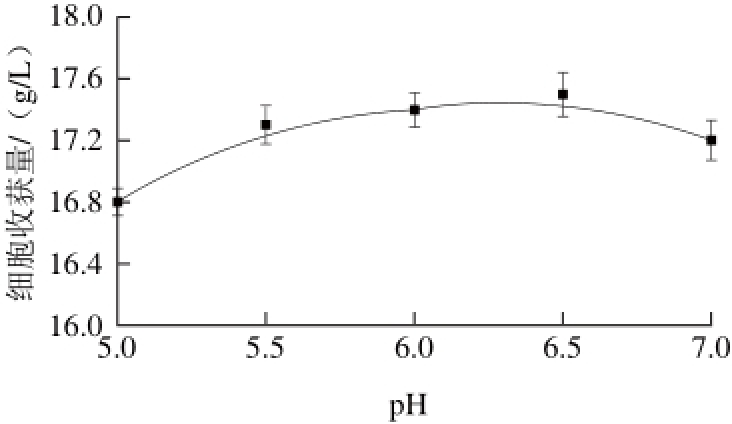
图 11 不同pH值对细胞收获量的影响
Fig. 11 Effect of pH on cell yield
由图10、11可知,K2HPO4流加量对细胞收获量影响不显著(P=0.078>0.05)且较优K2HPO4流加量为5 g/L;发酵过程pH值通过流加维持5~7,此范围内pH值变化对细胞收获量影响不够显著,较优pH值为6.5。
2.5.2 流加培养基正交试验优化结果
表 3 正交试验结果及极差分析
Table 3 Orthogonal array design with range analysis of experimental results
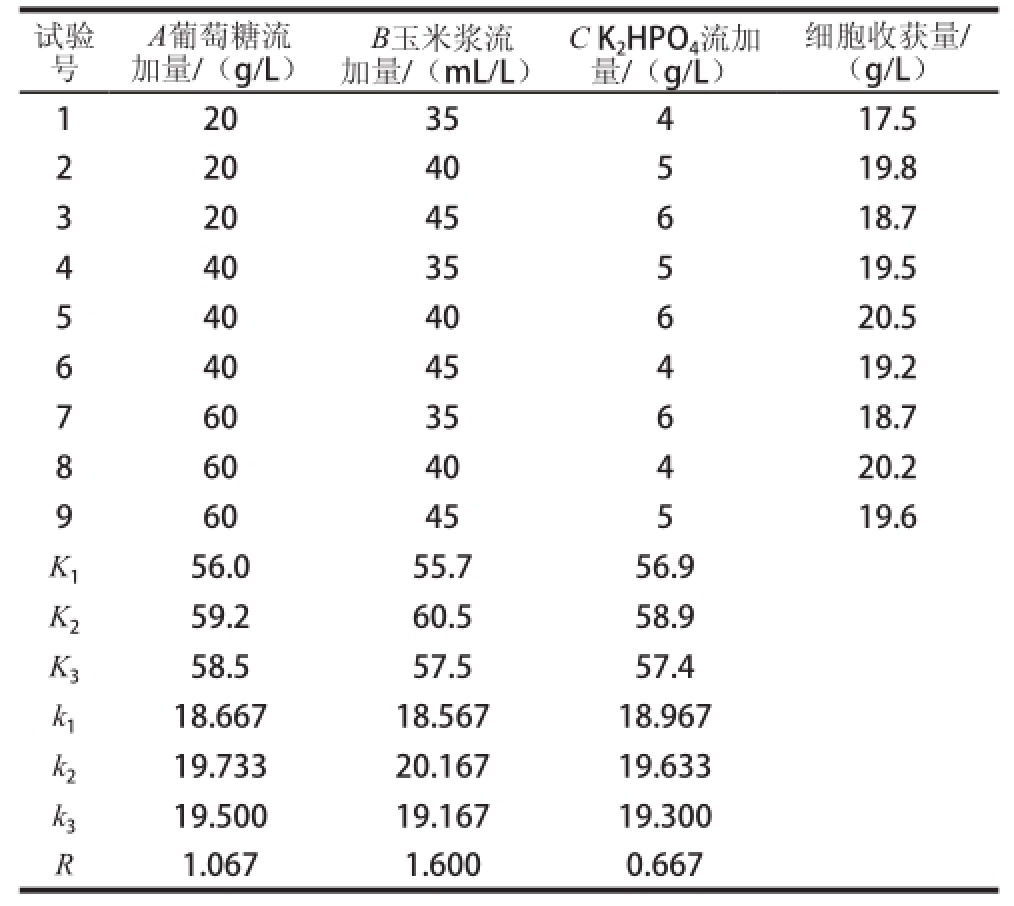
根据单因素试验结果,以流加的葡萄糖、玉米浆、K2HPO4三个影响显著的因素按L9(34) 正交设计表(表1)进行正交试验,结果及数据分析见表3,方差分析见表4。正交试验极差分析结果显示:流加培养基正交试验各因素对细胞收获量影响的主次顺序为B>A>C,其最佳条件组合为B2A2C2,即葡萄糖流加量40 g/L、玉米浆流加量40 mL/L、K2HPO4流加量5 g/L。方差分析显示玉米浆流加量对细胞收获量的影响达到了显著水平,这是因为玉米浆不仅为细胞提供氮源,还提供其生长所必需的生长因子。因此,适当质量浓度的玉米浆对于细胞的大量积累具有显著影响。
表 4 正交试验方差分析结果
Table 4 Analysis of variance for the orthogonal array design

对正交试验所得的最优条件进行重复性验证实验,结果菌体收获量平均为21.3 g/L、其核酸质量占菌体干质量的16.8%。突变株CL15013经流加优化后培养,其胞内核酸质量分数无明显变化,而细胞收获量出现了较大幅度提高,这说明该菌在其对数生长期内转录水平已达到了最大,但由于细胞收获量的提升,核酸收获量也随之提升,使其具有较好的工业应用潜力。对比国内其他研究,如陈文明等[27]高产RNA酿酒酵母的细胞收获量12.2 g/L、核酸质量分数12.6%,可以发现,CL15013细胞收获量及核酸质量分数有较大幅度提高。根据正交试验及其方差分析结果,确定流加培养基最佳条件为葡萄糖流加量40 g/L、玉米浆流加量40 mL/L、K2HPO4流加量5 g/L。
性能良好的高核酸酵母是生产高品质酵母抽提物的关键。实验发现,通过诱变处理后可以筛选出核酸含量较大提高的突变株,且方法简单高效。以产朊假丝酵母CL1501为出发菌株,经紫外-NTG复合诱变后,筛选出突变株CL15013,其核酸质量占菌体干质量的16.8%,比出发菌提高47.8%,且具有良好的遗传稳定性,适合用于生产高核酸酵母抽提物。进一步对比研究其分批和流加两种培养方式,发现流加培养能有效延长菌株的对数期,获得较高的细胞收获量。分析原因发现在分批培养中,菌株在延滞期及对数期生长的同时产生了一定量的酸,导致培养体系过酸,从而阻止了细胞在对数期的快速繁殖,导致细胞收获量不高;通过流加新鲜的培养基,保持了pH值的稳定,使得细胞生长状态良好、对数期延长,提高了细胞收获量,从而提高了核酸收获量。正交试验优化流加培养基,结果显示玉米浆流加量对细胞收获量影响最显著,流加培养基的最优添加量为:葡萄糖40 g/L、玉米浆40 mL/L、K2HPO45 g/L。利用优化的流加培养基流加培养产朊假丝酵母CL15013,其细胞收获量达21.3 g/L,较分批培养提高144.8%;其核酸质量分数为16.8%,保持相对稳定。具有良好生产应用潜力的高核酸酵母应具备核酸含量高及细胞收获量大的优点,这两个优点都需要菌株在培养中有较长的对数期,因此,如何构建并完善高核酸酵母培养体系,获得较高的细胞收获量及核酸含量,是今后的研究重点。
参考文献:
[1] 张子健, 江建梅, 舒媛, 等. 高核糖核酸啤酒酵母菌QH633菌体制备工艺优化[J]. 食品工业科技, 2015, 36(3): 178-181. DOI:10.13386/ i.issnl002-0306.20l5.03.028.
[2] CHUWATTANAKUL V, KIM Y H, MINETAKA S, et al. Construction of a Saccharomyces cerevisiae strain with a high level of RNA[J]. Journal of Bioscience and Bioengineering, 2011, 112(1): 1-7. DOI:10.1016/j.jbiosc.2011.03.011.
[3] 莫湘筠. 中国酵母抽提物(YE)发展历程及趋势[J]. 中国调味品, 2009, 34(11): 41-43. DOI:10.3969/j.issn.1000-9973.2009.11.006. [4] 熊建. 高呈味核苷酸型酵母抽提物产品特性研究[C]//2013年中国生物发酵产业年会论文集. 上海: 中国生物发酵产业协会, 2013: 435-441.
[5] 卫生部. 食品添加剂使用标准: GB/T 2760—2011[S]. 北京: 中国标准出版社, 2011.
[6] BOONYEUN P, SHOTIPRUK A, PROMMUAK C, et al. Enhancement of amino acid production by two-step autolysis of spent brewers yeast[J]. Chemical Engineering Communications, 2011, 198(12): 1594-1602. DOI:10.1080/00986445.2011.560219.
[7] 大连兴和酵母有限公司. 酵母的主要成分及其在食品工业中的应用[J]. 食品安全导刊, 2010(10): 45-46.
[8] 王媛媛, 曹春红, 杨旭, 等. 糖蜜原料培养高核酸酵母NY-1培养条件优化[J]. 食品与发酵工业, 2012, 38(1): 62-65.
[9] RYU B G, KIM J, KIM K, et al. High-cell-density cultivation of oleaginous yeast Cryptococcus curvatus for biodiesel production using organic waste from the brewery industry[J]. Bioresource Technology, 2013, 135: 357-364. DOI:10.1016/j.biortech.2012.09.054.
[10] 徐耀文, 马信亮, 王丹萍. 利用啤酒废酵母制备高核酸酵母抽提物的应用研究[J]. 中国调味品, 2013, 38(7): 47-49. DOI:10.3969/ j.issn.1000-9973.2013.07.012.
[11] 郭永, 庞宏建. 酵母抽提物的研究进展[J]. 中国调味品, 2010, 35(12): 24-34. DOI:10.3969/j.issn.1000-9973.2010.12.001.
[12] PELINSKI R, CERRUTTI P, PONSONE M L, et al. Statistical optimization of simple culture conditions to produce biomass of an ochratoxigenic mould biocontrol yeast strain[J]. Letters in Applied Microbiology, 2012, 54(5): 377-382. DOI:10.1111/j.1472-765X.2012.03217.x.
[13] SHANG F, WEN S, WANG X, et al. High-cell-density fermentation for ergosterol production by Saccharomyces cerevisiae[J]. Journal of Bioscience and Bioengineering, 2006, 101(1): 38-41. DOI:10.1263/ jbb.101.38.
[14] LI Y, ZHAO Z K, BAI F. High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture[J]. Enzyme and Microbial Technology, 2007, 41(3): 312-317. DOI:10.1016/ j.enzmictec.2007.02.008.
[15] 范云峰. K-79高核酸酵母菌种制备应注意的问题及其对核酸酵母生产的影响[J]. 甘蔗糖业, 1999(6): 33-39.
[16] 张莉, 王婧, 杨婷, 等. 产β-葡萄糖苷酶酿酒酵母菌株紫外诱变选育及酶学性质分析[J]. 食品工业科技, 2015, 36(20): 220-224. DOI:10.13386/j.issnl002-0306.2015.20.038.
[17] 李旭媛, 王刚, 费卓群, 等. 紫外-亚硝基胍复合诱变筛选高产淀粉酶菌株[J]. 中国生物制品学杂志, 2012, 25(11): 1543-1546.
[18] 王永华. 食品分析[M]. 2版. 北京: 中国轻工业出版社, 2012: 119-123. [19] 李艳, 阮南, 杨翠竹. 不同破壁方法对提取废啤酒酵母RNA的影响[J]. 食品科学, 2008, 29(3): 204-206. DOI:10.3321/ j.issn:1002-6630.2008.03.038.
[20] 施巧琴, 吴松刚. 工业微生物育种学[M]. 4版. 北京: 科学出版社, 2013: 96.
[21] 苗兰兰, 张东杰, 王颖. 复合诱变高产金属硫蛋白酵母菌株的筛选[J].食品科学, 2013, 34(19): 261-264. DOI:10.7506/spkx1002-6630-201319053.
[22] 刘晨, 张丽萍. 亚硝基胍-紫外复合诱变筛选高产苯乳酸菌株[J].中国食品学报, 2015, 15(9): 41-46. DOI:10.16429/j.1009-7848.2015.09.006.
[23] 荣博涵, 甄玉国, 赵小丽, 等. 不同补料方式对酿酒酵母高密度发酵的影响[J]. 中国酿造, 2015, 34(2): 72-75. DOI:10.11882ij.issn.0254-5071.2015.02.017.
[24] 武婕, 张晓雪, 余河水, 等. 毕赤酵母工程菌高密度发酵研究与进展[J]. 中国生物工程杂志, 2016, 36(1): 108-114. DOI:10.13523/ j.cb.20160115.
[25] RAFAEL M T, CESAR-ARTURO A, CARINE B. Optimization of lipid production by oleaginous yeast in continuous culture[J]. IFAC Proceedings Volumes, 2014, 47(3): 6210-6215.
[26] 孙文敬, 刘长峰, 周延政, 等. 半连续发酵及其应用研究进展[J].食品科学, 2013, 34(1): 345-350.
[27] 陈文明, 郑国斌, 姚娟, 等. 高产RNA酿酒酵母培养条件及发酵培养基的优化[J]. 中国调味品, 2015, 40(11): 28-32. DOI:10.3969/ j.issn.1000-9973.2015.11.007.
Breeding of a Candida utilis Mutant for Efficient Nucleic Acid Production and its Fermentation Performance
JIANG Xuewei1, YUE Xijie1, CHEN Daiwen2, ZHOU Zhiming2, LUO Xiaoming1,*, YE Jing1, LI Xiaowen1
(1. College of Chemical and Biological Engineering, Changsha University of Science & Technology, Changsha 410004, China; 2. Liannan Yao Autonomous County Qixiang Bio-Sci Co. Ltd., Qingyuan 513300, China)
Abstract:Candida utilis CL1501 was mutagenized with a combination of UV irradiation and nitrosoguanidine treatment. An excellent mutant with high ability to produce nucleic acid, named as CL15013, was obtained. Its nucleic acid content was 16.8% on a dry cell weight basis, which was 47.8% higher than that of CL1501. The dry biomass yield of the mutant was 16.9 g/L in fed-batch culture, which was 94.3% higher than that from batch culture. Under optimized fed-batch culture conditions obtained by orthogonal array design, the biomass yield was up to 21.3 g/L, which was 144.8% higher than that from batch cultivation. These results indicated that mutant CL15013 has a great application potential in industrial production.
Key words:Candida utilis; combined mutation; nucleic acid; fed-batch culture
DOI:10.7506/spkx1002-6630-201710025
中图分类号:TQ926.1
文献标志码:A
文章编号:1002-6630(2017)10-0149-06
引文格式:
蒋雪薇, 岳希洁, 陈代文, 等. 产朊假丝酵母核酸高产株的选育及其发酵性能研究[J]. 食品科学,2017, 38(10): 149-154.
DOI:10.7506/spkx1002-6630-201710025. http://www.spkx.net.cn
JIANG Xuewei, YUE Xijie, CHEN Daiwen, et al. Breeding of a Candida utilis mutant for efficient nucleic acid production and its fermentation performance[J]. Food Science, 2017, 38(10): 149-154. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201710025. http://www.spkx.net.cn
收稿日期:2016-07-18
基金项目:清远市科技计划项目(2013A024;2014A023);长沙市科技计划重大专项(kq1601013)
作者简介:蒋雪薇(1972—),女,副教授,博士,研究方向为工业微生物发酵及食品生物技术。E-mail:jxw_72@sina.com
*通信作者:罗晓明(1968—),男,副教授,硕士,研究方向为生物化工。E-mail:csluoxm@sina.com