
图 1 1-苯基-3-甲基-5-唑啉酮与寡糖的衍生化反应原理
Fig. 1 Derivatization reaction mechanism of oligosaccharides with PMP
陈新新1,2,芦 晶2,刘 鹭2,逄晓阳2,张书文2,李 诚1,*,吕加平2
(1.四川农业大学食品学院,四川 雅安 625014;2.中国农业科学院农产品加工研究所,北京 100193)
摘 要:利用Sep-Pak C18柱和石墨化碳柱对已脱脂和除去蛋白质的牛乳进行分离纯化,并采用1-苯基-3-甲基-5-唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)和2-氨基吖啶酮(2-aminoacridone,AMAC),2 种衍生化试剂对其进行衍生化处理,通过高效液相色谱进行优化,AMAC衍生化的结果(约有67 个峰)明显优于PMP衍生化的结果(约20 个峰),最终确定AMAC为最佳衍生化试剂,并利用最终优化好的高效液相色谱条件,采用高效液相色谱-串联离子阱飞行时间质谱对牛乳中寡糖进行测定,最终测得7 种乳寡糖并获得该7 种乳寡糖的单糖组成。
关键词:牛乳寡糖;1-苯基-3-甲基-5-唑啉酮;2-氨基吖啶酮;高效液相色谱-串联离子阱飞行时间质谱
牛乳中含有4.5%的碳水化合物,其中乳糖的含量超过80%,寡糖含量约占总糖含量的4%。研究发现游离寡糖是哺乳动物乳汁中除乳糖和脂肪外种类最为丰富的固形化合物[1]。乳寡糖是由3~10个单糖通过糖苷键共价连接的碳水化合物聚糖,构成牛乳寡糖的单糖包括葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、N-乙酰葡糖胺(N-acetylglusamine,GlcNAc)、岩藻糖(fucose,Fuc)、N-乙酰神经氨酸(N-acetylneuraminic acid,NeuAc)和N-羟乙酰神经氨酸(N-glycolylneuraminic acid,NeuGc),大多数的牛乳寡糖都有一个乳糖核心(Gal(β1-4)Glc)[2-3]。乳制品特别是婴儿配方奶粉、食品工业及功能食品制造商确定为牛奶中的低聚糖是一种新颖、有高潜力的生物活性食品配料。研究发现,乳寡糖作为益生元可以刺激肠道有益细菌的生长如新生儿肠道内双歧杆菌,改善微生态,从而降低婴幼儿患病风险,如腹泻,脑膜炎和中耳炎等[4-8]。鉴于乳寡糖特定的生理功能,人们开始关注乳寡糖的研究。由于牛乳寡糖种类繁多且结构复杂,目前对牛乳寡糖结构的解析较少,且国内对牛乳寡糖的测定方法鲜有报道。高效液相色谱、生物质谱以及液相色谱-质谱联用技术是目前分析寡糖的有效的工具[9-11]。
寡糖衍生化可有效改善寡糖光学吸收及质谱检测的离子化效率,提高其分析的灵敏度[12-14]。本实验对分析牛乳寡糖的衍生化试剂及高效液相色谱分析条件进行优化,通过最佳衍生化试剂2-氨基吖啶酮的柱前衍生化法进行高效液相色谱-串联离子阱飞行时间质谱分析,以期建立牛乳寡糖结构解析及含量测定的可行方法。
1.1 材料与试剂
牛乳采自北京市某牛场初次泌乳且泌乳4 个月的荷斯坦牛;乙腈、甲醇(均为色谱纯) 美国Fisher公司;二甲基亚砜(色谱纯) 美国Corning公司;硼氰化钠(色谱纯) 美国阿拉丁公司;冰醋酸、无水乙醇、三氟乙酸(trifluoroacetic acid,TFA)等其他试剂均为国产分析纯。
1.2 仪器与设备
Xbridge氨基色谱柱(4.6 mm×150 mm,3.5 μm)、Sep-Pak C18柱(500 mg/4 mL) 美国Waters公司;石墨碳柱(150 mg/4 mL) 美国Grace公司;MVS-1涡旋混合器 北京金北德工贸有限公司;3K15离心机 美国Sigma公司;ZLS-4真空旋转蒸发仪 湖南赫西仪器装备有限公司;20AD高效液相色谱-串联离子阱飞行时间质谱仪日本岛津公司;ULUP-IV-10T超纯水装置 西安优普仪器设备有限公司;PHS-3C型pH计 成都世纪方舟科技有限公司。
1.3 方法
1.3.1 牛乳寡糖的提取
取10 mL牛乳,于10 ℃、105×g超高速离心90 min,除去底部的酪蛋白和上层的脂肪,取5 mL中间水层加入10 mL无水乙醇,4 ℃放置2 h,于4 ℃、1 503×g离心30 min(重复2 遍)后取上清液,然后用浓缩仪浓缩干燥,即为牛乳寡糖粗品[4]。
1.3.2 牛乳寡糖的纯化及富集
分别采用Sep-Pak C18柱和石墨化柱对浓缩后的液体进行分离纯化,具体操作:用5 mL甲醇平衡Sep-Pak C18柱,然后用10 mL 0.1% TFA溶液洗Sep-Pak C18柱[15]。
将干燥的牛乳寡糖粗品溶于200 μL 0.1% TFA溶液,然后上样到Sep-Pak C18柱。收集过柱液体,用200 μL 0.1% TFA溶液润洗收集试管,将收集的液体加入Sep-Pak C18中,收集过柱液体,此步骤重复2 次。最后用3 mL 0.1% TFA溶液冲洗Sep-Pak C18,收集过柱液体,所得到收集液体为牛乳寡糖样品。
牛乳寡糖的除盐富集采用石墨化柱,除盐步骤也分为活化、平衡、载样过柱、脱盐、洗脱等,依次用3 倍柱体积的80%乙腈溶液(含0.1% TFA)和纯水通过柱体;将上一步的收集液上样,控制流速约0.5~1.0 mL/min(重复此步骤);用3 倍柱体积的纯水通过柱体,为吸附于柱底PGC填料上的寡糖除盐;最后用0.5 mL 10%乙腈溶液(含0.1% TFA)、20%乙腈溶液(含0.1% TFA)、40%乙腈溶液(含0.1% TFA)将寡糖分步洗脱,收集洗脱液浓缩冻干用于衍生化。
1.3.3 牛乳寡糖衍生化试剂的选择及高效液相色谱条件的优化
1.3.3.1 牛乳寡糖1-苯基-3-甲基-5-唑啉酮的衍生化
将上一步干燥后的样品溶于50 μL氨水,加入50 μL 1-苯基-3-甲基-5-唑啉酮-甲醇溶液(0.5 mol/L),70 ℃条件下反应35 min,反应后冷却到室温,然后加入1 mL的超纯水进行真空干燥(此步骤重复2 次),向干燥的物质中分别加入1 mL的超纯水和1 mL的氯仿,用涡旋仪充分混合后静置,除去有机相(此步骤重复3 次),将最后得到的水相15 493×g离心2 min,抽取上清液用超纯水稀释10 倍后用于高效液相色谱优化分析[17]。
1.3.3.2 牛乳寡糖2-氨基吖啶酮的衍生化
2-氨基吖啶酮是公认的荧光疏水性的标记分子,被成功地用于衍生和分离各种复杂的寡糖[16-17]。干燥后的样品用2-氨基吖啶酮衍生化,即将纯化后干燥的牛乳寡糖溶于50 μL 0.1 mol/L 2-氨基吖啶酮(用冰醋酸和二甲基亚砜按3∶17的体积比溶解),2-氨基吖啶酮的氨基与糖的还原端(醛基)发生亲核反应,生成Schiff碱,其次加入50 μL新鲜配制的1 mol/L硼氰化钠溶液,上一步生成的Schiff碱随即被硼氰化钠专一地还原成稳定的二级胺。反应后经11 000×g离心3 min,然后在45 ℃温度条件下反应4 h,最后加入150 μL 50%二甲基亚砜溶液直接用于高效液相色谱优化分析[18]。
1.3.3.3 高相液相色谱条件
XBridge氨基柱(250 mm×4.6 mm,3.5 μm);流动相A:乙腈,流动相B:10 mmol/L的甲酸铵(pH 4.5)溶液;流速0.5 mL/min;柱温35 ℃;检测波长254 nm(采用紫外检测器);梯度洗脱条件为:0~27 min,95%~85% A;27~29 min,85% A;29~31 min,85%~84% A;31~33 min,84% A;33~37 min,84%~83% A;37~48 min,83%~79% A;48~64 min,79%~73% A;64~66 min,73% A;66~74 min,73%~69% A;74~78 min,69%~68% A;78~85 min,68%~65% A。
1.3.3.4 质谱条件
电喷雾离子源,正离子模式;喷雾电压为4.5 kV;负离子模式喷雾电压为-3.5 kV。一级、二级离子质量扫描设为m/z 300~1 000和m/z 1 000~2 000。加热模块和曲形脱溶剂管温度均为200 ℃,氮气流速为1.5 L/min,离子累计时间为10 ms。高纯度氩气作为碰撞诱导解离及冷却气,检测器电压为1.58 kV。离子阱真空度1.1×10-2Pa,飞行时间真空度1.2×10-4Pa。检测模式正、负离子切换检测[19]。
2.1 衍生化产物的结构
2.1.1 1-苯基-3-甲基-5-唑啉酮试剂的衍生化
一分子的1-苯基-3-甲基-5-唑啉酮和糖类物质的还原端发生缩合反应,在加热条件下失水生成不饱和的单分子衍生物,然后继续与另一分子的1-苯基-3-甲基-5-唑啉酮发生Micheal 1,4加成,最终使糖物质加上2分子的1-苯基-3-甲基-5-唑啉酮,反应式如图1所示[20]。

图 1 1-苯基-3-甲基-5-唑啉酮与寡糖的衍生化反应原理
Fig. 1 Derivatization reaction mechanism of oligosaccharides with PMP
2.1.2 2-氨基吖啶酮试剂的衍生化还原胺化法是在糖链的还原端上引入发色基团的最通用方法。先是2-氨基吖啶酮的氨基与糖的还原端发生亲核反应,消除一分子水后生成Schiff碱,然后Schiff碱随即被硼氰化钠专一地还原成二级胺,在众多衍生化方法中,还原胺化法由于产物稳定,是常用的衍生化方法之一,该衍生化方法稳定、衍生后可提高糖的检测灵敏度,反应过程如图2所示[21]。
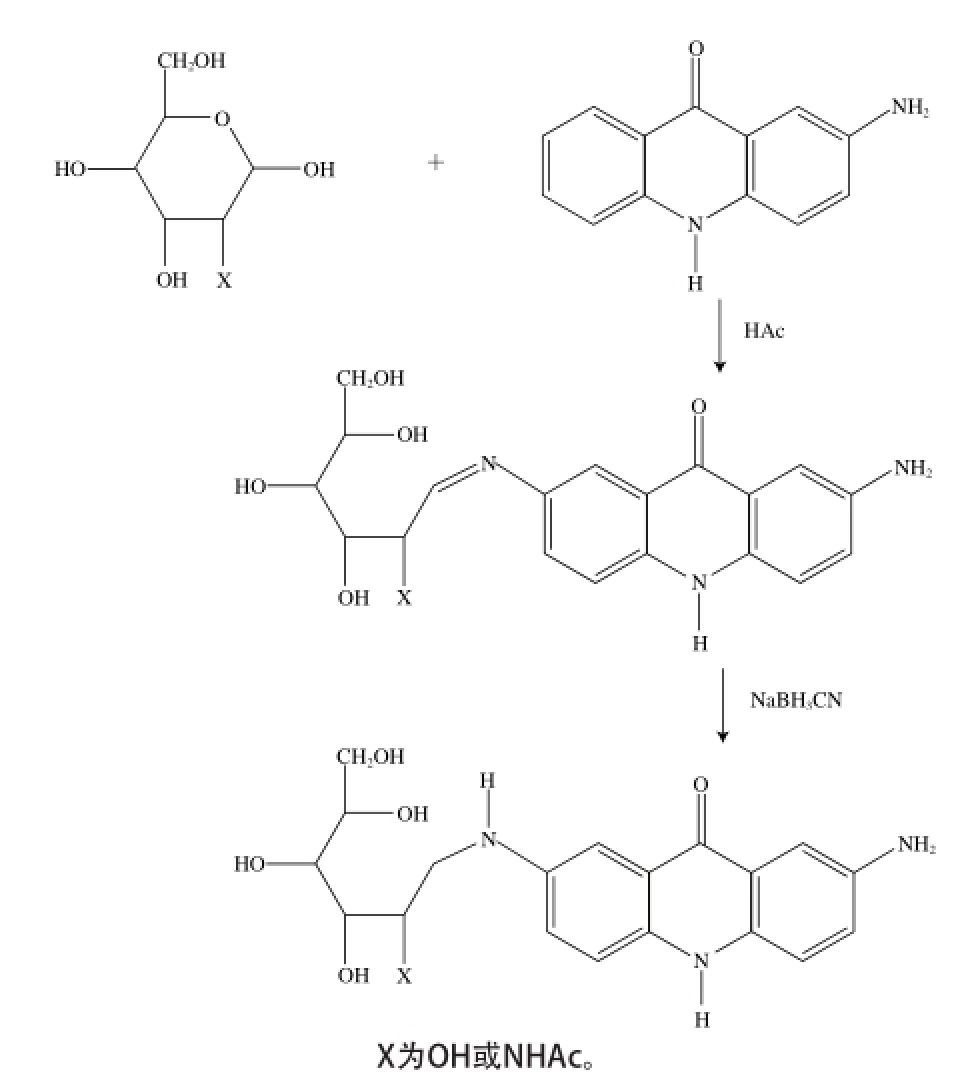
图 2 2-氨基吖啶酮与寡糖的衍生化反应原理
Fig. 2 Derivatization reaction mechanism of oligosaccharides with 2-AMAC
2.2 衍生化试剂及高效液相色谱条件的确定
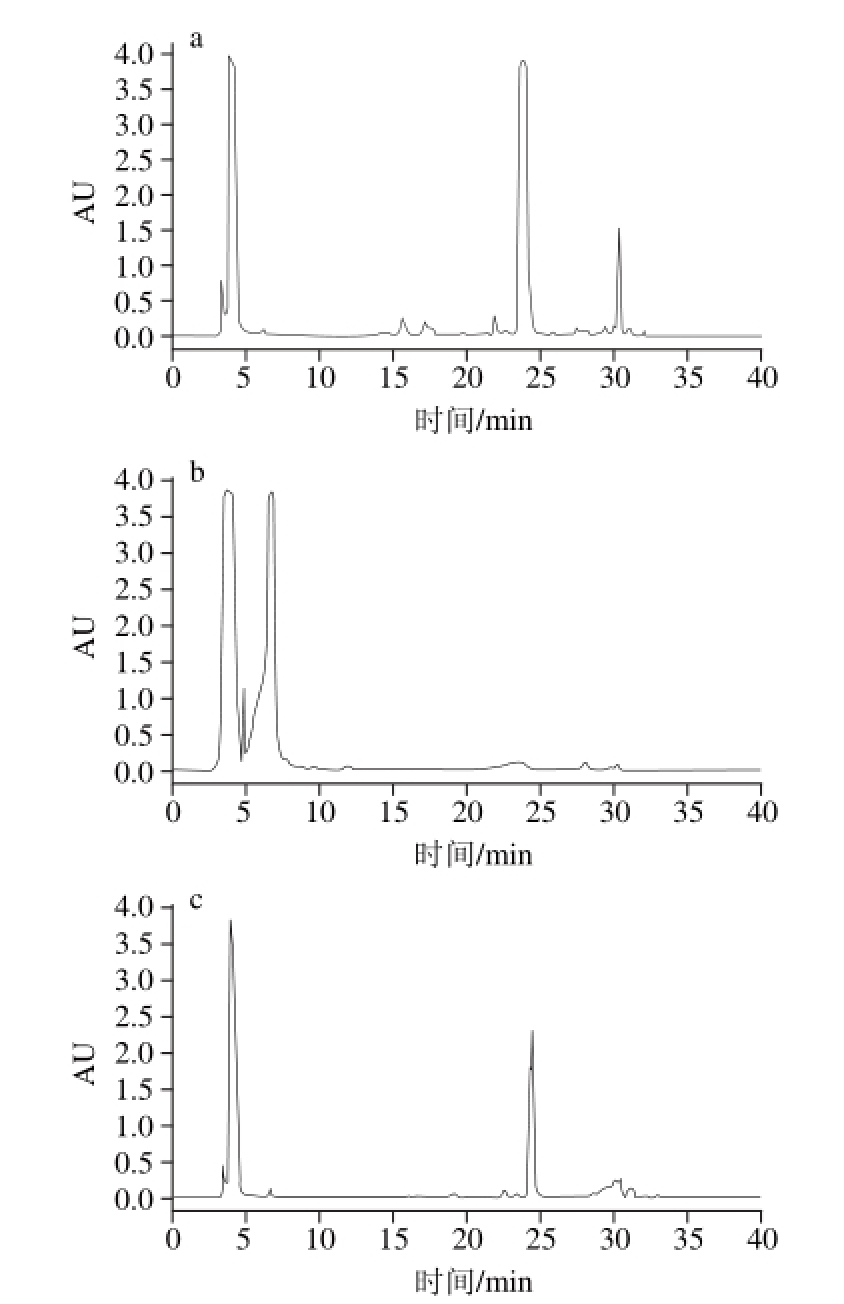
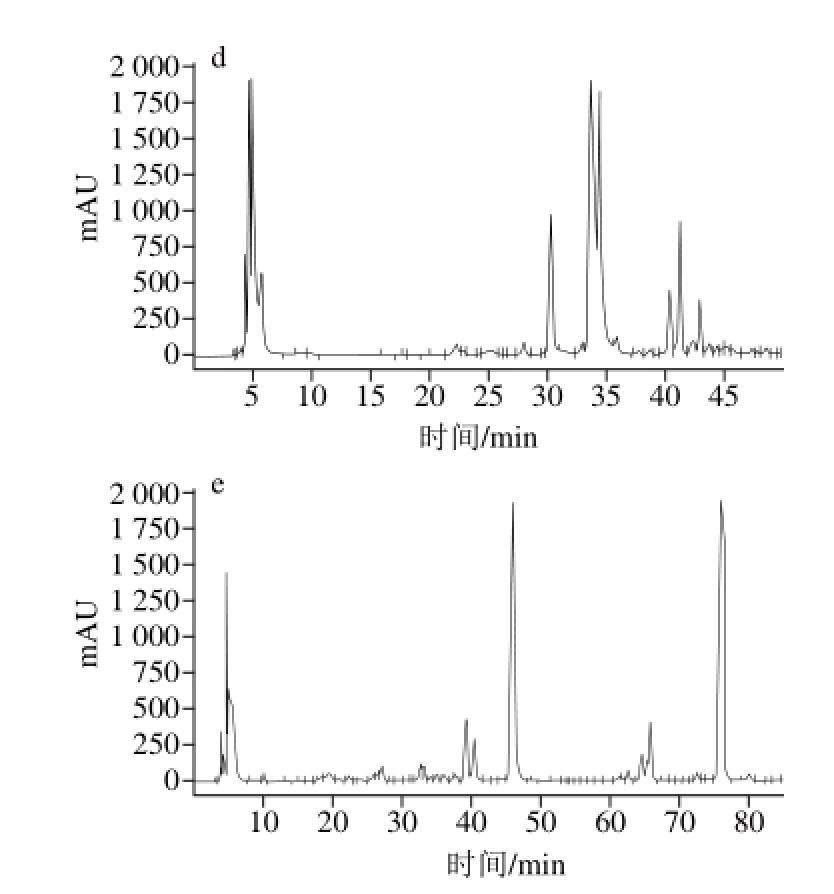
图 3 1-苯基-3-甲基-5-唑啉酮衍生化(a~c)和2-氨基吖啶酮衍生化(d、e)牛乳寡糖高效液相分离图谱
Fig. 3 HPLC profiles of PMP- (a, b and c) and AMAC- (d and e) derivatized milk oligosaccharides under different conditions
对牛乳寡糖进行1-苯基-3-甲基-5-唑啉酮衍生化后进行高效液相色谱条件的优化,根据XBridge氨基柱的特性,初次设定流动相条件为:梯度洗脱0~40 min,95%~65% A,如图3a所示。根据图3a并参照高效液相色谱分离的原则和XBridge氨基柱的特点进行后续的高效液相色谱条件的优化,选取部分优化结果见图3b,梯度洗脱条件为0~10 min,90%~70% A;20~40 min,70%~60% A,图3c梯度洗脱条件为20~40 min,70%~65% A。从部分优化结果来看,图3a峰形较标准且大小峰有20 个左右,故将图3a流动相条件设为最佳色谱条件,即梯度洗脱0~40 min,95%~65% A。
对牛乳寡糖进行2-氨基吖啶酮衍生化后进行高效液相色谱条件的优化,根据XBridge氨基柱的特性,初次设定流动相条件为:梯度洗脱0~50 min,95%~65% A,结果见图3d。根据图3d参照高效液相色谱分离的原则和XBridge氨基柱的特点进行后续的高效液相色谱条件的优化,最终获得最优高效液相色谱条件为:梯度洗脱0~27 min,95%~85% A;27~29 min,85% A;29~31 min,85%~84% A;31~33 min,84% A;33~37 min,84%~83% A;37~48 min,83%~79% A;48~64 min,79%~73% A;64~66 min,73% A;66~74 min,73%~69% A;74~78 min,69%~68% A;78~85 min,68%~65% A。由图3e可知,所得各峰相对规则,分离效果较优,约有67 个峰,达到了尽可能多的鉴定出牛乳寡糖成分的条件。
从2 种衍生化试剂所得的最佳色谱图谱来看2-氨基吖啶酮衍生化效果比较好,且1-苯基-3-甲基-5-唑啉酮在衍生化过程中反应程度难以控制[22],并没有2-氨基吖啶酮衍生化产物稳定,故将2-氨基吖啶酮作为本实验的衍生化试剂。
2.3 质谱分析
将衍生化后的牛乳寡糖用优化好的流动相条件通过高效液相色谱-串联离子阱飞行时间质谱测定,由于寡糖质量扫描范围为m/z 300~2 000,为获得更好的精确度,将其分为两部分进行正负离子模式扫描,分别为质量扫描范围为m/z 300~1 000(图4a)和m/z 1 000~2 000(图4b)。
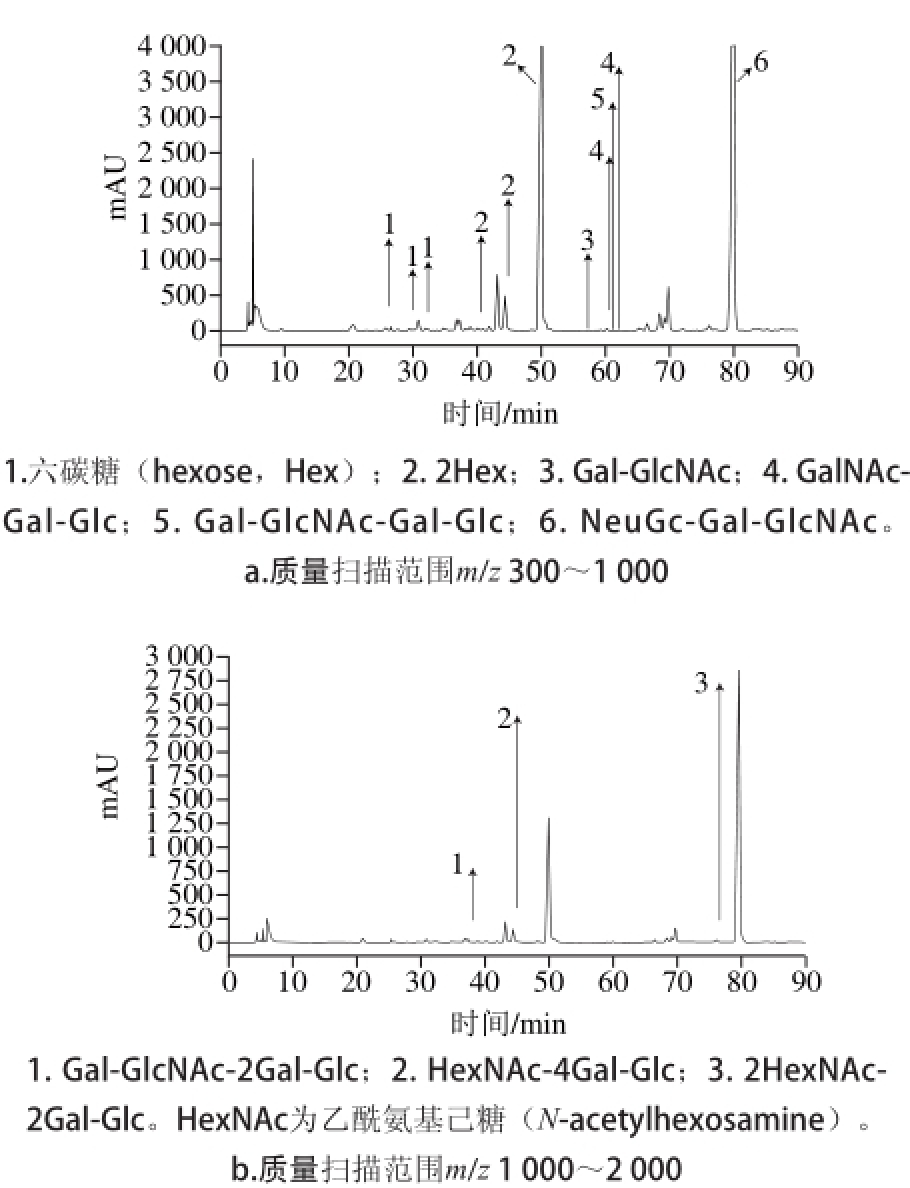
图 4 不同质量扫描范围高效液相色谱图
Fig. 4 HPLC profiles in different m/z ranges
在质量扫描范围为m/z 300~1 000的质谱测定中共鉴定6 种糖成分,其中4 种为寡糖,其余为单糖和双糖;质量扫描范围为m/z 1 000~2 000的质谱测定中鉴定出3 种乳寡糖。2个扫描段共测定出7 种乳寡糖;本实验正负离子模式同时进行,寡糖大部分在负离子模式下电离出峰,其中正离子模式下共测到3 种乳寡糖,负离子模式测到4 种,寡糖在负离子模式下测定结果相对较好。实验所测得的7 种乳寡糖结构如表1所示。
随后,通过电喷雾离子-串联质谱对分析出的寡糖进行糖单元组成的确定。构成牛乳寡糖的单糖包括Glc、Gal、GlcNAc、Fuc、NeuAc和NeuGc。根据断裂碎片的质荷比(m/z)可以判断寡糖的单糖组成[23-25]。用二级质谱分析2-氨基吖啶酮标记的牛乳寡糖时,质荷比相差162的碎片表示存在Hex,质荷比相差146的碎片表示存在Fuc,质荷比相差203和291的碎片表示存在HexNAc和NeuAc[26-27]。6’-NeuGcLacNAc是牛乳中酸性寡糖,图5a为正离子模式下的6’-NeuGcLacNAc(m/z 885.294 8,保留时间79.503 min)的一级图谱。可以看出其准分子为m/z 885.294 8[M+H]+峰。为确证其结构组成对其进行电喷雾离子-串联质谱分析,碰撞能量为32 eV,得到的二级图谱如图5b所示。
表 1 7 种牛乳寡糖的结构
Table 1 Structural analysis of 7 milk oligosaccharides

注:*.负离子模式下检测到的乳寡糖;N/A.无具体名称。
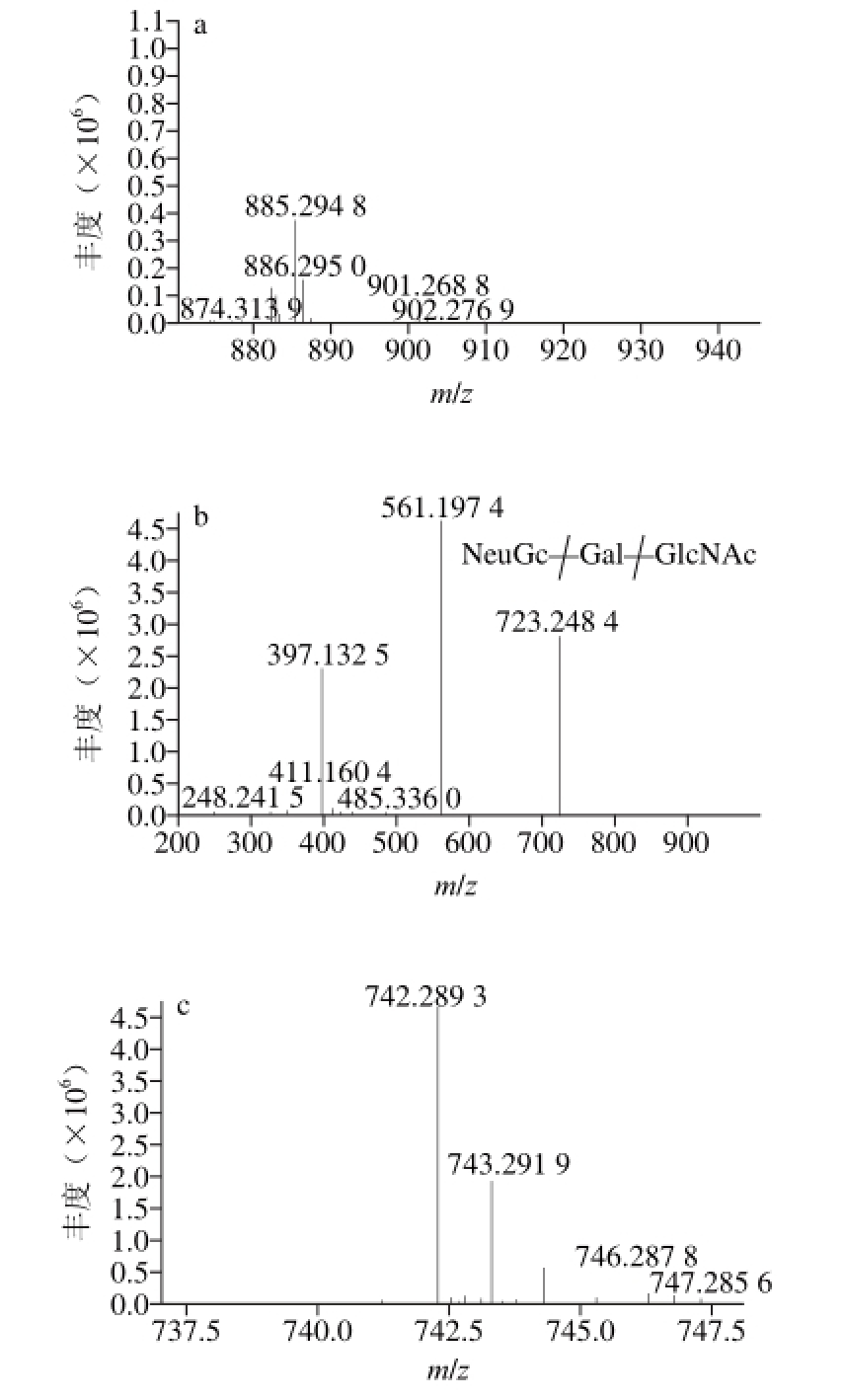
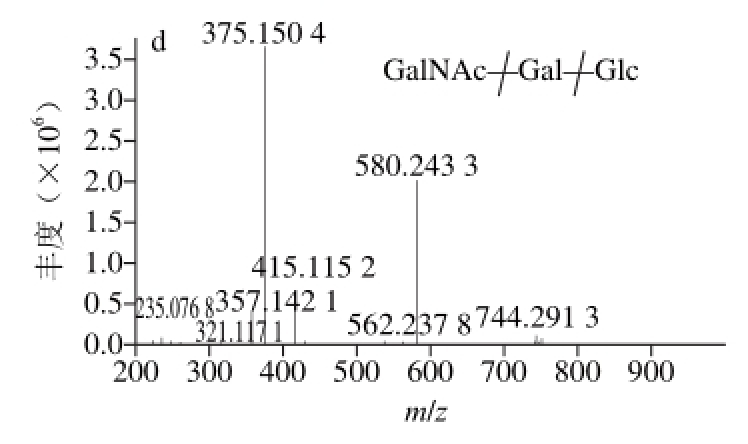
图 5 6’-NeuGcLacNAc(a、b)和α3’-GalNAcL(c、d)在正离子模式下质谱图
Fig. 5 Mass spectra in positive ion mode of 6’-NeuGcLacNAc (a and b) and α3’-GalNAcL (c and d)
由图5 a、b可见,在正离子模式下,6’-NeuGcLacNAc产生2 种碎片离子,分别是m/z 561.197 4和m/z 397.132 5。m/z 561.197 4是由母离子m/z 885.294 8断裂一分子的NeuGc(质量数324)形成,m/z 397.132 5(一分子的GlcNAc加一分子2-氨基吖啶酮)是离子m/z 561.197 4失去一分子的Gal和2 个氢离子产生的,由此可知6’-NeuGcLacNAc由一分子的NeuGc、一分子的Gal和一分子的GlcNAc组成(断裂方式见图5b)。
根据文献报道α3’-GalNAcL存在3 个同分异构体,分别为β3’-GalNAcL、β6’-GalNAcL和β-GlcNAclactose。图5c为α3’-GalNAcL(β3’-GalNAcL或β6’-GalNAcL或β-GlcNAclactose m/z 742.289 2,保留时间62.313 min)正离子模式下的一级图谱。可以看出其准分子为m/z 742.289 2 [M+H]+峰。为确证其结构组成对其进行电喷雾离子-串联质谱分析,碰撞能量为30 eV,得到的二级图谱如图5d所示。在正离子模式下,α3’-GalNAcL(β3’’-GalNAcL、β6’-GalNAcL和β-GlcNAclactose)产生4 种碎片离子,分别是m/z 580.243 3、562.237 8、415.115 2、235.076 8。m/z 580.243 3是母离子断裂一分子的Glc产生的,m/z 562.237 8是由m/z 742.289 2失去一分子的Glc和一分子的H2O(质量数162+18)得到的。m/z 415.115 2是一分子的HexNAc加上一分子的2-氨基吖啶酮得到的(即由母离子断裂2 个Hex得到)。m/z 235.076 8是由m/z 415.115 2断裂一分子的Gal产生。由此可以得出α3’-GalNAcL(β3’-GalNAcL、β6’-GalNAcL和β-GlcNAclactose)由一分子的Gal、一分子的Glc和一分子的HexNAc组成,断裂方式见图5d,如果需要区分同分异构体需要进一步的实验确定。采用类似的质谱解析技术,通过二级质谱分析确定了其余5 种寡糖的结构。由于乳寡糖含量极低使对其的测定分析存在极大挑战。采用该方法可以快速鉴定出牛乳中含量较丰富的寡糖成分,该实验结果与Dallasd[28]、Sundekilde[29]等实验结果一致,为鉴定其他的未知峰以便测定更多的乳寡糖成分,可以将其他峰分别收集进行基质辅助激光解吸离子化-傅里叶变换离子回旋共振质谱和高效液相色谱-芯片/四极杆-飞行时间质谱分析[2,30]。
采用分段质谱扫描分析可以准确鉴定牛乳中寡糖成分,并达到了预期的测定结果。二级质谱的分析也进一步确定了寡糖的单糖组成。由于本实验只做到电喷雾离子-串联质谱,并不能更好区分同分异构体和获得寡糖单糖组成的键位结构,如需具体的结构信息需要后续的测定分析。
综上所述,通过对原料乳脱脂、除蛋白,分离纯化后进行2-氨基吖啶酮衍生化并采用高效液相色谱技术实现了对牛乳寡糖的有效分离。采用高效液相色谱-串联离子阱飞行时间质谱对牛乳中寡糖进行测定,鉴定了7 种牛乳寡糖并实现了对该7 种牛乳寡糖结构组成的分析。结果表明,本实验方法简单可行、可用于牛乳寡糖的分离和测定。
参考文献:
[1] FONG B, MA K, MCJARROW P. Quantification of bovine milk oligosaccharides using liquid chromatography-selected reaction monitoring-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 9788-9795. DOI:10.1021/jf202035m.
[2] ALDREDGE D L, GERONIMO M R, HUA S, et al. Annotation and structural elucidation of bovine milk oligosaccharides and determination of novel fucosylated structures[J]. Glycobiology, 2013, 23(6): 664-676. DOI:10.1093/glycob/cwt007.
[3] MEHRA R, KELLY P. Milk oligosaccharides: structural and technological aspects[J]. International Dairy Journal, 2006, 16(11): 1334-1340. DOI:10.1016/j.idairyj.2006.06008.
[4] NWOSU C C, ALDREDGE D L, LEE H, et al. Comparison of the human and bovine milk N-glycome via high-performance microfluidic chip liquid chromatography and tandem mass spectrometry[J]. Journal of Proteome Research, 2012, 11(5): 2912-2924. DOI:10.1021/ pr300008u.
[5] MORROW A L, RUIZ-PALACIOS G M, ALTAYE M, et al. Human milk oligosaccharides are associated with protection against diarrhea in breast-fed infants[J]. The Journal of Pediatrics, 2004, 145(3): 297-303. DOI:10.1016/j.jpeds.2004.04.054.
[6] JIANG X, HUANG P, ZHONG W, et al. Human milk contains elements that block binding of noroviruses to histo-blood group antigens in saliva[M]//Protecting Infants through Human Milk. Springer US, 2004: 447-450.
[7] 狄维, 王林, 王升启. 寡糖及其衍生物的生物活性研究进展[J].中国药物化学杂志, 2002, 12(4): 243-248. DOI:10.3969/ j.issn.1005-0108.2002.04.015.
[8] 刘晗, 白雪芳, 杜昱光, 等. 寡糖的生物活性[J]. 精细与专用化学品, 2005, 13(13): 15-18.
[9] 韩欢欢, 马岩, 王璐, 等. 寡糖衍生化及基质辅助激光解吸电离飞行时间质谱分析方法研究[J]. 分析化学, 2010, 38(3): 307-312. DOI:10.3724/SP.J.1096.2010.00307.
[10] 许艳婷, 王秀娟, 苏小玲, 等. 液相色谱-电喷雾-四极杆-飞行时间质谱法分析琼胶寡糖[J]. 分析化学, 2011, 39(12): 1798-1804. DOI:10.3724/SP.J.1096.2011.01798.
[11] 孙玉姣, 王承建, 耿腾飞, 等. κ-卡拉胶寡糖AEC柱前衍生物的LCESI-MS/MSn分离分析[J]. 化学学报, 2011, 69(14): 1697-1704.
[12] 王仲孚, 贺建宇, 尉亚辉, 等. 用于寡糖链分析的HPLC柱前衍生化方法研究进展[J]. 有机化学, 2006, 26(5): 592-598. DOI:10.3321/ j.issn:0253-2786.2006.05.002.
[13] 王仲孚, 张英, 林雪, 等. 1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化寡糖链的HPLC分离及其激光解吸电离质谱分析[J]. 化学学报, 2007, 65(23): 2761-2764. DOI:10.3321/j.issn.0567-7351.2007.23.019.
[14] LAMARI F N, KUHN R, KARAMANOS N K. Derivatization of carbohydrates for chromatographic, electrophoretic and mass spectrometric structure analysis[J]. Journal of Chromatography B, 2003, 793(1): 15-36. DOI:10.1016/S1570-0232(03)00362-3.
[15] CHU C S, NINONUEVO M R, CLOWERS B H, et al. Profile of native N-linked glycan structures from human serum using high performance liquid chromatography on a microfluidic chip and timeof-flight mass spectrometry[J]. Proteomics, 2009, 9(7): 1939-1951. DOI:10.1002/pmic.200800249.
[16] BABU P, KUBERAN B. Fluorescent-tagged heparan sulfate precursor oligosaccharides to probe the enzymatic action of heparitinase I[J]. Analytical Biochemistry, 2010, 396(1): 124-132. DOI:10.1016/ j.ab.2009.08.036.
[17] VOLPI N. High-performance liquid chromatography and on-line mass spectrometry detection for the analysis of chondroitin sulfates/ hyaluronan disaccharides derivatized with 2-aminoacridone[J]. Analytical Biochemistry, 2010, 397(1): 12-23. DOI:10.1016/ j.ab.2009.09.030.
[18] GALEOTTI F, COPPA G V, ZAMPINI L, et al. On-line highperformance liquid chromatography-fluorescence detectionelectrospray ionization-mass spectrometry profiling of human milk oligosaccharides derivatized with 2-aminoacridone[J]. Analytical Biochemistry, 2012, 430(1): 97-104. DOI:10.1016/j.ab.2012.07.027.
[19] 张萍, 王仲孚, 黄琳娟. 高效液相色谱-电喷雾质谱联用分析PPMP衍生化的壳寡糖[J]. 分析试验室, 2012(8): 6-11.
[20] 车发云, 刘正宇. 毛细管电泳分析常见单糖的2-氨基吖啶酮衍生物[J].生物化学与生物物理学报: 英文版, 1998, 30(3): 251-256.
[21] 张璐瑶, 赵峡, 陈欢欢. 糖类化合物PMP衍生分析进展[J]. 分析测试学报, 2016, 35(3): 367-372.
[22] 范万翠. O-糖链的非还原性解离及同时PMP衍生化的方法研究[D].西安: 西北大学, 2010.
[23] REMOROZA C, CORD-LANDWEHR S, LEIJDEKKERS A G M, et al. Combined HILIC-ELSD/ESI-MSnenables the separation, identification and quantification of sugar beet pectin derived oligomers[J]. Carbohydrate Polymers, 2012, 90(1): 41-48. DOI:10.1016/j.carbpol.2012.04.058.
[24] YU G, ZHAO X, YANG B, et al. Sequence determination of sulfated carrageenan-derived oligosaccharides by high-sensitivity negativeion electrospray tandem mass spectrometry[J]. Analytical Chemistry, 2006, 78(24): 8499-8505. DOI:10.1021/ac061416j.
[25] 潘丽英, 王承健, 袁江北, 等. 基于电喷雾电离质谱的人肝癌细胞HepG2与正常肝细胞L02的N-糖链的定性定量比较[J]. 高等学校化学学报, 2013, 35(2): 237-243. DOI:10.7503/cjcu20130960.
[26] CHARLWOOD J, TOLSOND, DWEK M, et al. A detailed analysis of neutral and acidic carbohydrates in human milk[J]. Analytical biochemistry, 1999, 273(2): 261-277. DOI:10.1006/abio.1999.4232.
[27] 陈欢欢, 赵峡, 栾晓红, 等. 电喷雾质谱在寡糖序列分析中的应用[J].高等学校化学学报, 2014, 36(1): 1-8.
[28] DALLASD C, MEYRAND M, BARILE D. Production and bioactivity of bovine milk oligosaccharides[M]//Food oligosaccharides: production, analysis and bioactivity. Wiley Blackwell, 2014: 21-34. [29] SUNDEKILDE U K, BARILE D, MEYRAND M, et al. Natural variability in bovine milk oligosaccharides from Danish Jersey and Holstein-Friesian breeds[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24): 6188-6196.
[30] WU S, TAO N, GERMAN J B, et al. Development of an annotated library of neutral human milk oligosaccharides[J]. Journal of Proteome Research, 2010, 9(8): 4138-4151.
Comparative Analysis of Oligosaccharides in Milk Based on Two Different Derivatization Methods by HPLC-Tandem Mass Spectrometry
CHEN Xinxin1,2, LU Jing2, LIU Lu2, PANG Xiaoyang2, ZHANG Shuwen2, LI Cheng1,*, LÜ Jiaping2
(1. College of Food Science, Sichuan Agricultural University, Yaan 625014, China; 2. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract:In the present study, Sep-Pak C18and porous graphitized carbon column chromatographies were sequentially used to separate and purify oligosaccharides f rom defatted and deproteinated milk. After derivatization w ith phenyl-3-methyl-5-pyrazolone (PMP) or 2-aminoacridone (AMAC), the oligosaccharides were analyzed by high-performance liquid chromatography ion trap time of flight tandem mass spectrometry (HPLC-IT-TOF-MS). AMAC was a better derivatization agent than PMP, since they produced about 67 and 20 chromatographic peaks, respectively. Finally, seven lacto-oligosaccharides were identified under optimized HPLC conditions, and their monosaccharide compositions were determined.
Key words:milk oligosaccharides; 3-methyl-1-phenyl-2-pyrazolin-5-one; 2-aminoacridone; high-performance liquid chromatography ion trap time of flight tandem mass spectrometry (HPLC-IT-TOF-MS)
DOI:10.7506/spkx1002-6630-201710027
中图分类号:O629.1
文献标志码:A
文章编号:1002-6630(2017)10-0162-06
引文格式:
陈新新, 芦晶, 刘鹭, 等. 基于2 种衍生化方法对牛乳中寡糖的高效液相色谱-质谱联用分析[J]. 食品科学, 2017, 38(10): 162-167. DOI:10.7506/spkx1002-6630-201710027. http://www.spkx.net.cn
CHEN Xinxin, LU Jing, LIU Lu, et al. Comparative analysis of oligosaccharides in milk based on two different derivatization methods by HPLC-tandem mass spectrometry[J]. Food Science, 2017, 38(10): 162-167. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710027.http://www.spkx.net.cn
收稿日期:2016-08-23
基金项目:国家自然科学基金青年科学基金项目(1401514);“十二五”国家科技支撑计划项目(2013BAD18B10);公益性行业(农业)科研专项(201303085)
作者简介:陈新新(1990—),女,硕士研究生,研究方向为食品科学。E-mail:xinxin1190@163.com
*通信作者:李诚(1964—),男,教授,硕士,研究方向为畜产品加工与质量安全控制。E-mail:lichenglcp@163.com