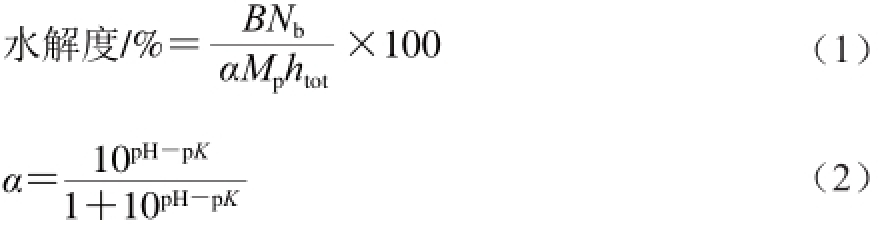
丁媛媛,王 莉*,张新霞,王 韧,罗小虎,李亚男,李永富,李 娟,陈正行*
(江南大学食品学院,粮食发酵工艺与技术国家工程实验室,食品科学与技术国家重点实验室,江苏 无锡 214122)
摘 要:为减少小麦胚芽的资源浪费,提高其附加值,同时解决居民缺钙的问题,对麦胚多肽与钙离子螯合的工艺进行研究。以小麦胚芽为原料,以螯合率为考察指标,设计单因素试验和正交试验,考察温度、麦胚多肽与钙离子物质的量比、时间、pH值对螯合率影响。结果表明,在温度65 ℃、麦胚多肽与钙离子物质的量比3∶1、时间60 min、pH 9.5的条件下,螯合率达到最大,为86.21%。对最佳条件下制备的麦胚多肽-钙螯合物进行结构分析,红外光谱表明麦胚多肽的氨基和羧基都参与了螯合反应;圆二色谱表明螯合物的二级结构由原来的无序结构向有序、紧密的结构转变;扫描电子显微镜表明螯合物的分子有明显的聚集现象。
关键词:麦胚多肽;螯合钙;结构表征
小麦胚芽是面粉加工业的副产物,含有丰富的淀粉、蛋白质、不饱和脂肪、维生素以及矿物元素,被营养学家誉为“人类天然的营养宝库”[1]。其中,碳水化合物含量占45%左右[2],蛋白质含量占30%左右[3]。麦胚蛋白是一种完全蛋白,含有8 种人体所需的必需氨基酸[4],尤其富含其他谷物缺乏的赖氨酸、甲硫氨酸、苏氨酸[5]。而且,必需氨基酸配比与世界卫生组织/联合国粮农组织推荐的模式值基本接近[6],营养价值可与鸡蛋蛋白媲美。除此之外,麦胚中还富含生理活性物质,如谷胱甘肽[7]、黄酮类物质[8]、麦胚凝集素[9]、二十八烷醇[10]等。尽管如此,小麦胚芽并没有得到有效利用,常常被作为下脚料处理,造成资源浪费,环境污染。
目前,小麦胚芽的蕴藏量达到200~300万 t,有很大的开发空间。相关学者为了节粮减损,对麦胚资源进行深入研究,以期增加其附加值。例如,通过酶解的方式释放多种生物活性的肽段,其中抗氧化活性肽[11-13]、降血压活性肽[14]以及金属螯合活性肽[15-16]都有相关的报道。目前,国内外的学者对锌螯合肽[17-19]、铁螯合肽[20-21]研究较多,但是钙螯合肽的研究主要集中于动物蛋白[22-23]中,由于动物蛋白存在潜在的过敏源,所以迫切需要新的蛋白源,而麦胚蛋白作为来源广、成本低、质优的植物蛋白,成为钙螯合肽很有开发前景的原料来源。
市面上的补钙剂主要有无机钙、有机钙和氨基酸钙[24]:1)无机钙,如磷酸钙、碳酸钙、氯化钙等,这类补钙剂溶解性差,吸收率低,对胃有刺激作用;2)有机钙,如葡萄糖酸钙、乳酸钙、柠檬酸钙等,这类补钙剂钙含量低,总体利用率不高;3)氨基酸钙,如甘氨酸钙、谷氨酸钙等,这类补钙剂钙吸收率显著提高,但易被植酸以及磷酸沉淀。肽钙作为新型的补钙剂,如酪蛋白肽钙,这类补钙剂中钙离子与小肽结合,借助小肽的转运、吸收机制以配合物的形式被小肠吸收,能显著促进钙的利用率[25]。因此,以麦胚蛋白源为原料,使钙离子与麦胚多肽螯合,借助小肽吸收理论,促进钙离子和多肽的吸收利用具有重要的现实意义。
本研究以小麦胚芽为原料,麦胚分离蛋白经碱性蛋白酶酶解获得麦胚多肽,向其加入钙源,制备麦胚多肽-钙螯合物。通过单因素试验和正交试验,确定最佳的螯合条件;利用傅里叶红外光谱、圆二色谱、扫描电子显微镜对多肽及其螯合物进行分析,旨在为补钙剂的研发提供理论依据。
1.1 材料与试剂
脱脂小麦胚芽 河南安阳漫天雪食品有限公司;碱性蛋白酶(200 000 U/g) 广西南宁庞博生物工程有限公司;HCl、NaOH、CaCl2、无水乙醇、NaCl、茚三酮、钙红指示剂(均为分析纯) 国药集团上海化学试剂有限公司。
1.2 仪器与设备
MP-501A超级恒温循环槽 上海一恒科学仪器有限公司;COULTER Avanti J-26XP冷冻离心机 美国贝克曼公司;Beta 2-8LDplus CHRIST冻干机 德国Marin Christ公司;FEI Quanta™ 200扫描电子显微镜 美国FEI公司;FTIR傅里叶红外光谱 美国Thermo Electron公司;MOS-450圆二色光谱仪 法国生物公司。
1.3 方法
1.3.1 麦胚多肽制备
1.3.1.1 麦胚分离蛋白提取及酶解
麦胚分离蛋白提取根据碱溶酸沉[26]的方法,脱脂小麦胚芽粉分散于去离子水中(料液比1∶10(g/mL)),用1 mol/L NaOH溶液将悬浊液调至并稳定在pH 9.5,40 ℃搅拌2 h,5 000 r/min离心10 min,去除沉淀。收集上清液,用1 mol/L HCl溶液调到pH 4.0,静置60 min,使蛋白絮凝沉淀,5 000 r/min离心10 min,收集蛋白沉淀,沉淀水洗两次,将蛋白调回pH 7.0。提取的麦胚分离蛋白于冷冻干燥机中冷冻干燥备用。
麦胚分离蛋白用碱性蛋白酶水解,水解条件[26]:蛋白质量分数5%、酶-底物质量比1∶50、温度50 ℃、pH 8.0,连续水解300 min,水解结束后沸水浴中灭酶10 min,5 000 r/min离心10 min,收集上清液冷冻干燥备用。
1.3.1.2 麦胚分离蛋白酶解多肽水解度和分子质量的测定
水解度的测定根据pH-Stat法[27],计算如式(1)、(2)所示:
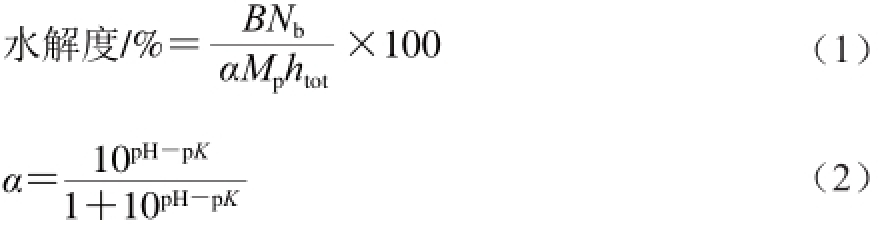
式中:α为α-NH2的平均解离度;B为水解过程中消耗的NaOH的体积/mL;Nb为NaOH浓度/(mol/L);Mp为参与水解的蛋白质量/g;htot表示每克原料蛋白质的总肽键数,8.3 mmol/g。
多肽分子质量分布的测定:在Agilent 1100高效液相色谱系统上采用凝胶过滤色谱柱TSK G2000 SWXL(7.8 mm×300 nm)测定。测定条件:流动相为V(乙腈)∶V(水)=3∶7,流速0.5 mL/min,紫外检测波长220 nm。标准蛋白:GGG(189 D)、GGYR(451 D)、杆菌肽(1 450 D)、抑肽酶(6 500 D)、细胞色素C(12.5 kD)。
1.3.2 麦胚多肽与钙离子的螯合工艺流程
麦胚多肽→调节螯合条件(温度、pH值、麦胚多肽与钙离子物质的量比、时间)→螯合→3 倍冷无水乙醇沉淀螯合物→10 000×g离心15 min,收集沉淀→用无水乙醇洗涤至上清液加入钙指示剂不变色,加入茚三酮指示剂加热后不变紫[28]→测定螯合物中钙的含量。
钙含量的测定采用原子吸收分光光度法[29],螯合率计算如式(3)所示:
1.3.3 单因素试验
将麦胚多肽溶于20 mmol/L的Tris-HCl溶液中,配制成不同浓度的多肽溶液,添加一定量的50 mmol/L的CaCl2溶液,恒温水浴一定时间。溶液分别以多肽与钙离子物质的量比(0.3∶1、2∶1、3∶1、6∶1、9∶1、12∶1)、反应液pH值(3、4、5、6、7、8、9、10)、温度(10、20、30、40、50、60、70 ℃)、时间(10、30、60、90、120 min)为影响因素,以螯合率为指标,考察各因素对螯合反应的影响。反应基本条件为:pH 7.8、温度40 ℃、时间60 min、多肽与钙离子物质的量比3∶1。
1.3.4 正交试验
根据单因素试验结果,选取合适的因素水平,以钙螯合率为指标,设计四因素三水平正交试验。
表 1 正交试验设计因素与水平
Table 1 Factors and levels used in orthogonal array experiments

1.3.5 麦胚多肽-钙螯合物的表征
1.3.5.1 傅里叶红外光谱分析
在最佳螯合条件下,制备麦胚多肽-钙螯合物,取适量麦胚多肽和螯合物分别与光谱纯级KBr混合并研磨,压制成透明薄片,在4 000~400 cm-1波段内对样品进行扫描,分辨率0.1 cm-1,分析特征峰。
1.3.5.2 圆二色谱分析
将在最佳条件下制备的螯合物以及麦胚多肽分别溶解于去离子水中,多肽和螯合物的溶液在远紫外区域(190~250 nm)进行观察。二级结构(包括α-螺旋、β-折叠、β-转角、无规则卷曲)由圆二色谱程序软件分析。
1.3.5.3 扫描电子显微镜观察
在最佳螯合条件下,制备麦胚多肽-钙螯合物,取适量麦胚多肽和螯合物分别均匀涂抹于样盘,喷金镀膜处理,处理好的样品放入扫描电子显微镜观察。
1.4 数据处理
实验结果利用SPSS进行数据处理与分析,Origin 8.5进行绘图。
2.1 水解度、螯合率及多肽分子质量变化
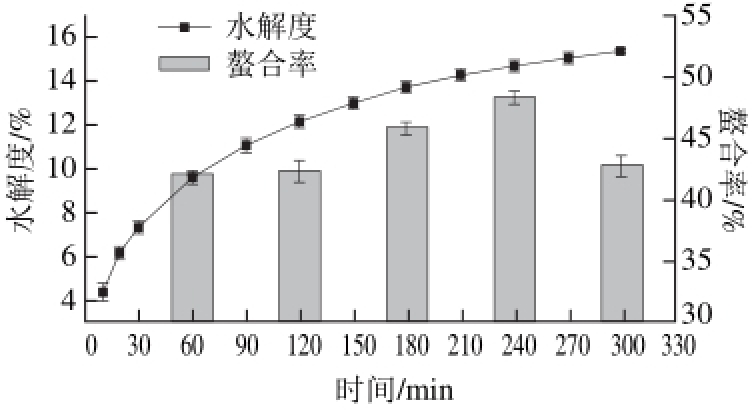
图 1 水解度和螯合率随水解时间的变化
Fig. 1 Effect of hydrolysis time on degree of hydrolysis and metal chelating activity
由图1可知,在整个水解过程中,随着水解时间的延长,水解度不断增大,在300 min时水解度达到最大值(15.35±0.19)%。前60 min是水解快速反应的阶段,在此阶段内肽键大量断裂,水解度快速升高,之后由于可水解的催化位点变少,水解速度放缓。另一方面,随着水解时间的延长,螯合率先增加后减少,在240 min时达到最大值(48.26±0.53)%,此时水解度为(14.70±0.27)%。这说明在碱性蛋白酶的作用下,麦胚分离蛋白随着水解时间的延长释放出越来越多的多肽片段,这些多肽由于暴露出更多的螯合位点所以比大分子的蛋白更有利于螯合。但是,过度水解形成的游离氨基酸并不利于螯合[30]。为了进一步验证该结论,对不同水解时间的多肽组分进行分子质量的分析。
表 2 不同水解时间酶解液中多肽分子质量分布
Table 2 Molecular weight distribution of wheat germ polypeptides at different hydrolysis times
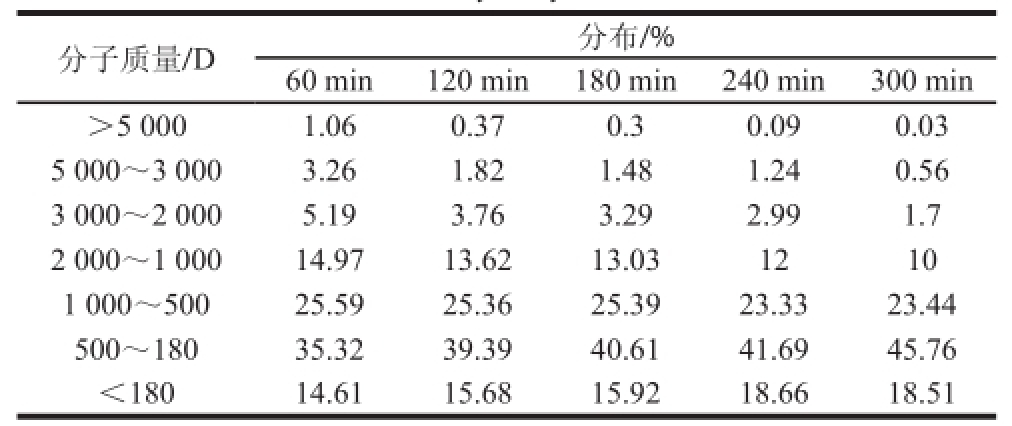
分别对水解60~300 min的麦胚多肽的分子质量分布进行测定(表2)。水解240 min时,螯合率最高,此时的多肽混合物的组成成分与水解60、120、180 min相比较,大分子的多肽(大于1 000 D)较少,小分子的多肽(小于1000 D)较多,说明大分子的多肽并不利于螯合;然而水解300 min时钙螯合率下降,与240 min相比,300 min的组成成分中小肽或氨基酸(小于500 D)所占比例提高,说明过度水解形成的小分子也不利于螯合。总之,要达到较好的螯合效果,要求水解形成的多肽分子质量不能太大或太小,本研究中选择240 min作为制备多肽的最佳水解时间,该结论与相关的研究[15]一致。
2.2 单因素试验结果

图 2 麦胚多肽与钙离子物质的量比对螯合率的影响
Fig. 2 Effect of ratio of wheat germ polypeptide to Ca2+on chelation efficiency
2.2.1 麦胚多肽与钙离子物质的量比对螯合率的影响从图2可以分析出,当麦胚多肽与钙离子物质的量比为0.3∶1时,螯合率较低,说明此时的钙离子过量,大量的钙离子未参与螯合;提高二者比值,螯合率成直线上升,当麦胚多肽与钙离子物质的量比超过2∶1后,螯合率增速减缓,说明此时多肽的添加量已经接近饱和,继续添加多肽对螯合率影响不大,但多肽的有效利用率下降。最终确定多肽与钙离子物质的量比范围2∶1~6∶1。这与氨基酸-金属离子螯合物略有差别,可能由于麦胚分离蛋白水解物的组成成分复杂,既有氨基酸,又有分子质量不同大小的多肽,所以,发生螯合反应时不像氨基酸反应那样单一,不是严格的按照2∶1的比例。
2.2.2 pH值对螯合率的影响
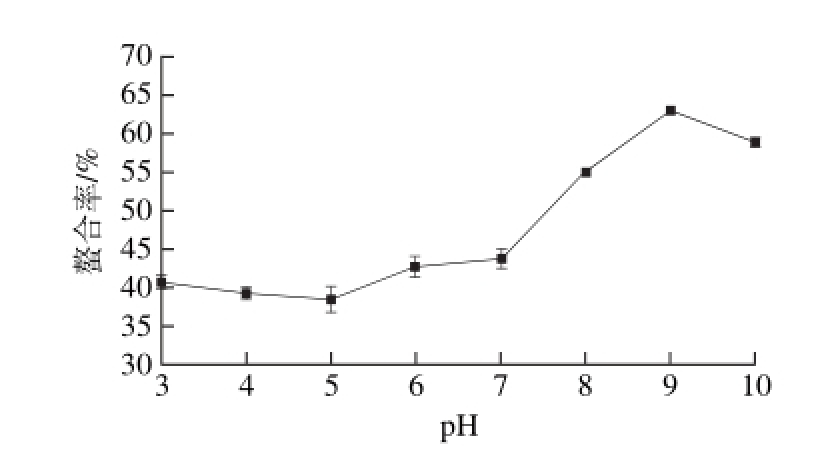
图 3 pH值对螯合率的影响
Fig. 3 Effect of pH on chelation efficiency
由图3可知,pH值对于螯合率有较大影响,在pH 3~10的范围内,螯合率先下降后上升,在强碱性条件下又下降。可能的原因是在强酸性条件下,多肽分子完全展开,暴露出供电基团(如—C=O、—NH2),这些供电基团有一定的吸引钙离子的能力。在弱酸环境,H+结合在多肽分子表面,使某些基团带上正电,从而对钙离子形成排斥作用,不利于螯合物的形成[28]。在弱碱性条件下,—COOH电离失去H+带负电,—NH2也能吸引带正电的离子,这些都也有利于螯合反应的进行,使螯合率升高[31]。在强碱性条件下,OH-与多肽中的供电子基团争夺钙离子,生成了氢氧化钙沉淀,螯合率降低。适宜的反应pH值范围是8~10。
2.2.3 温度对螯合率的影响
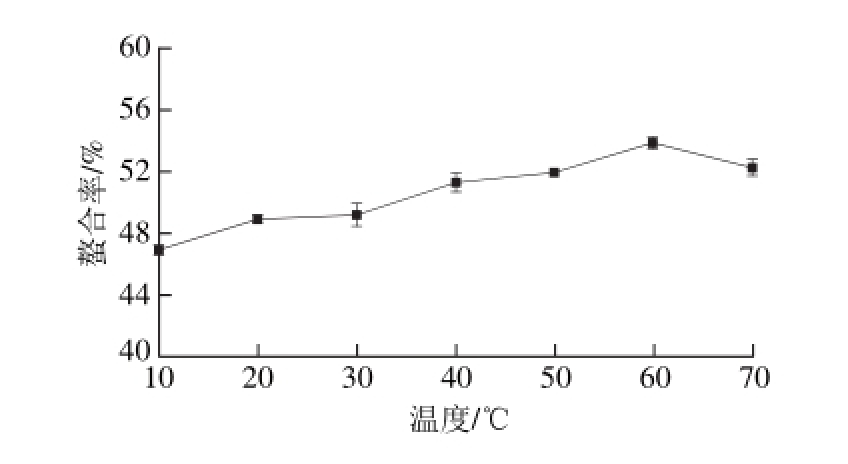
图 4 温度对螯合率的影响
Fig. 4 Effect of temperature on chelation efficiency
从图4可知,随温度的升高,螯合率先增加后减少,在60 ℃附近达到最大值。这是因为适当提高反应温度有利于增加多肽与钙离子碰撞的次数,使螯合反应顺利进行。但是,温度过高,多肽易发生羰氨反应[31],减少了钙离子的螯合位点,而且氨基酸或小肽与金属离子的螯合为放热反应[32],过高的温度不利于螯合。适宜的温度范围是50~70 ℃。
2.2.4 时间对螯合率的影响
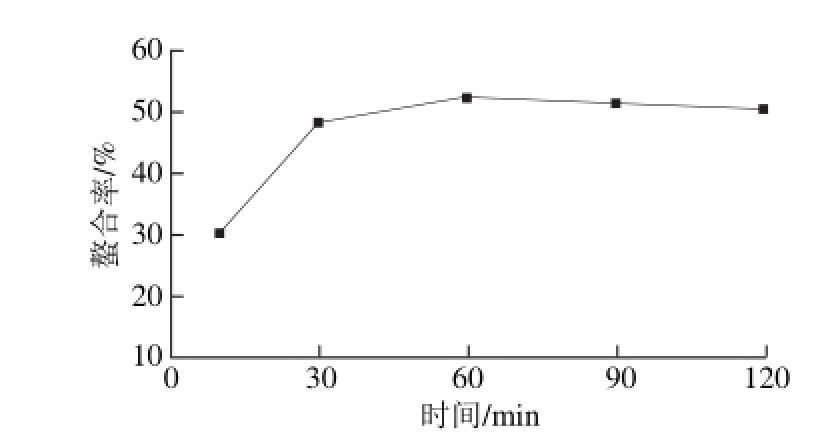
图 5 时间对螯合率的影响
Fig. 5 Effect of reaction time on chelation efficiency
从图5可以看出,螯合率随反应时间的延长先增加后基本维持不变。在30 min时,螯合率已经达到较高的值,30 min之后螯合率上升缓慢,说明螯合反应是快速的反应。适宜的时间范围是30~90 min。
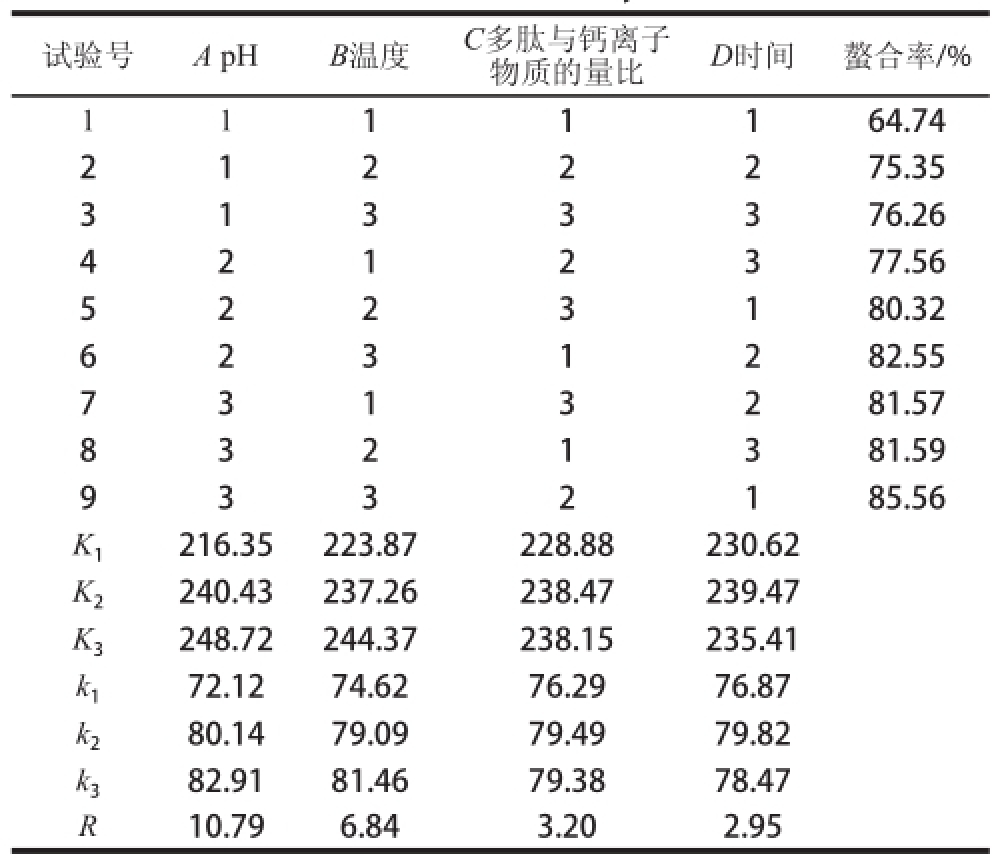
2.3 正交试验结果
表3显示,各因素对螯合率的主次影响顺序为:pH值>温度>麦胚多肽与钙离子物质的量比>时间;优化后的最优组合为A3B3C2D2,即pH 9.5、温度65 ℃、多肽与钙离子物质的量比3∶1、时间60 min。对优化得到的最佳的螯合条件进行验证,在此条件下钙螯合率为86.21%。
表 3 麦胚多肽与钙离子螯合的正交试验
Table 3 Orthogonal array design with experimental values of chelation efficiency
2.4 麦胚多肽-钙螯合物的表征
2.4.1 麦胚多肽及其螯合物的红外光谱分析
3 399.88 cm-1主要由N—H的伸缩振动所致;1 652.63 cm-1属于酰胺Ⅰ带,主要由C=O的伸缩振动引起;1 400.08 cm-1属于氨基酸残基侧链基团—COO-的吸收峰。由图6可以看出,特征区—NH2的N—H吸收峰由3 399.88 cm-1移动到3 419.51 cm-1;酰胺Ⅰ带C=O吸收峰由1 652.63 cm-1移动到1 648.40 cm-1;—COO-吸收峰由1 400.08 cm-1移动到1 409.75 cm-1,麦胚多肽-钙螯合物的红外光谱发生了明显的变化,说明多肽中氨基和羧基均参与了钙的螯合反应[33]。
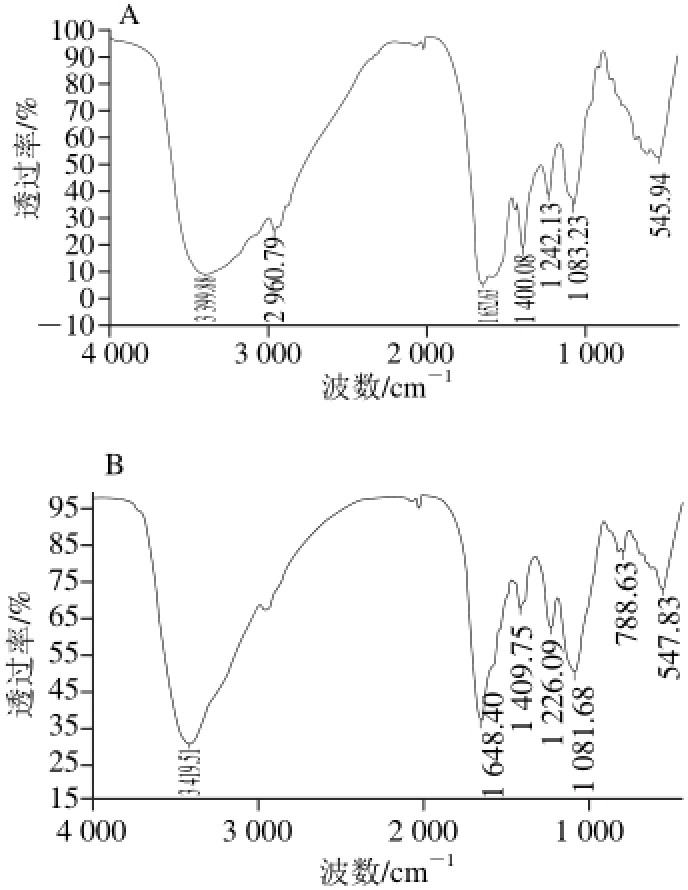
图 6 麦胚多肽(A)及其螯合物(B)的红外光谱
Fig. 6 Infrared spectra of wheat germ polypeptides (A) and calciumchelating wheat germ polypeptides (B)
2.4.2 麦胚多肽及其螯合物的二级结构分析
蛋白质多肽链之间可形成α-螺旋、β-折叠、β-转角及无规则卷曲等立体结构,外界条件可引起这些二级结构的改变。麦胚多肽及其螯合物的二级结构用圆二色谱仪进行分析(图7和表4)。麦胚多肽的二级结构主要以无规则卷曲(97.8%)为主,以无序的形式存在;而螯合物的二级结构α-螺旋、β-折叠、β-转角所占的比例明显上升,无规则卷曲所占的比例明显降低。说明螯合反应改变了麦胚多肽原有的二级结构,由原来的无序结构(柔性结构)向更加有序、规则、紧密的结构(刚性结构)转变。
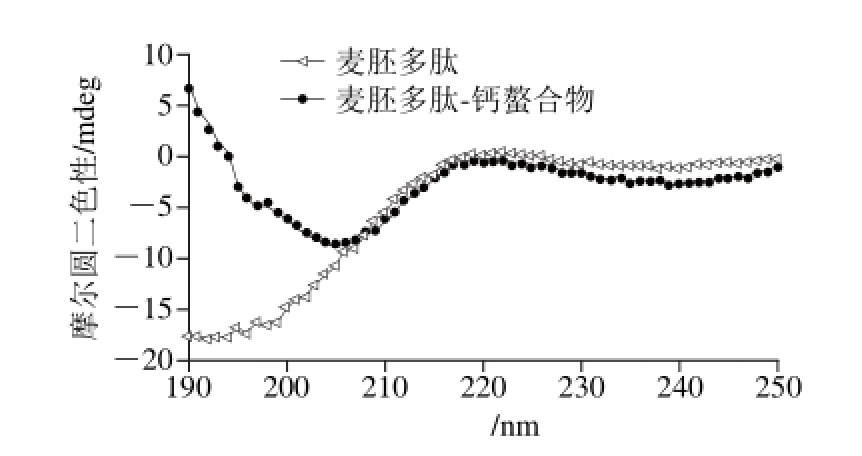
图 7 麦胚多肽及其螯合物的圆二色谱
Fig. 7 Far-UV circular dichroism spectra of wheat germ polypeptides and calcium-chelating wheat germ polypeptides
表 4 麦胚多肽及其螯合物的二级结构
Table 4 Secondary structure contents of wheat germ polypeptides and calcium-chelating wheat germ polypeptides

2.4.3 扫描电子显微镜分析

图 8 麦胚多肽(A)及螯合物(B)的扫描电子显微镜图
Fig. 8 Scanning electron micrographs of wheat germ polypeptides (A) and calcium-chelating wheat germ polypeptides (B)
多肽的微观结构反映其分子的聚集情况,由图8可见,麦胚多肽呈疏松多孔的小颗粒状,而螯合物呈大的不均匀的团状结构,这表明螯合反应能破坏多肽的结构,使之发生聚集。这种聚集主要由于钙离子与多肽分子的羧基氧原子和氨基氮原子发生作用产生的(图9),多肽之间通过钙离子连接发生交联,形成较大的颗粒,而且这些颗粒之间相互吸引进而发生聚集。
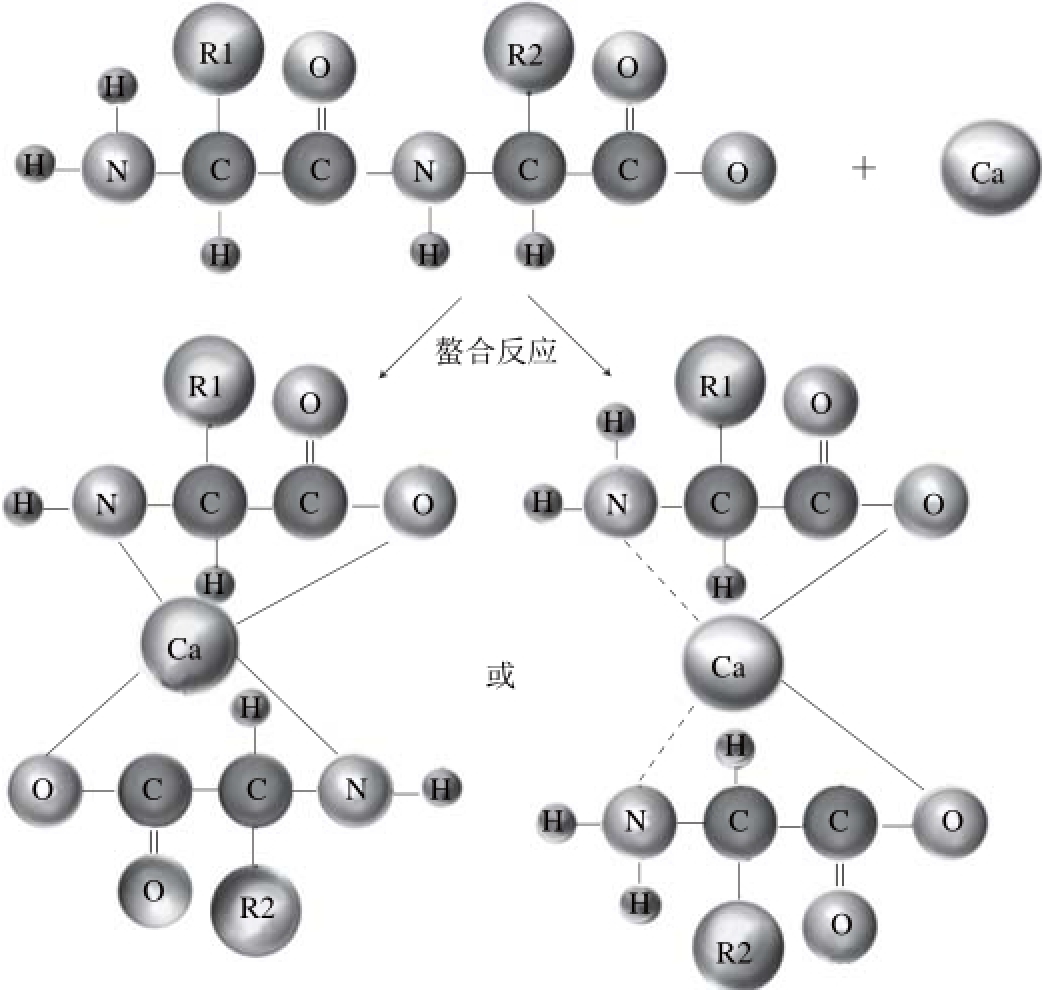
图 9 麦胚多肽与钙离子结合机理推测图
Fig. 9 Predicted mechanism of complexation of wheat germ polypeptides with calcium ion
本实验以小麦胚芽为原料,利用碱性蛋白酶水解麦胚分离蛋白产生麦胚多肽,将多肽与钙离子进行螯合。通过单因素试验和正交试验优化出最佳的螯合条件为pH 9.5、温度65 ℃、麦胚多肽与钙离子物质的量比3∶1、时间60 min,此条件下的螯合率为86.21%。该螯合率较猪皮胶原多肽螯合钙[34]、白鲢鱼骨胶原多肽螯合钙[31]等要高,对提高钙的利用率有重要意义。对螯合物的结构进行分析,红外光谱说明麦胚多肽的氨基和羧基都参与了螯合反应;圆二色谱表明螯合物的二级结构与原来的多肽相比由无序结构(柔性结构)向有序、紧密的结构转变(刚性结构);扫描电子显微镜则说明螯合物较原来多肽分子有聚集现象。总之,本研究对提高小麦胚芽的附加值,具有重要的经济和理论意义。
参考文献:
[1] GE Y Q, SUN A D, NI Y Y, et al. Some nutritional and functional properties of defatted wheat germ protein[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 6215-6218. DOI:10.1021/ jf000478m.
[2] ADEBOWALE K, LAWAL O. Foaming, gelation and electrophoretic characteristics of mucuna bean (Mucuna pruriens) protein concentrates[J]. Food Chemistry, 2003, 83(2): 237-246. DOI:10.1016/ S0308-8146(03)00086-4.
[3] ARSHAD M U, ANJUM F M, ZAHOOR T. Nutritional assessment of cookies supplemented with defatted wheat germ[J]. Food Chemistry, 2007, 102(1): 123-128. DOI:10.1016/j.foodchem.2006.04.040.
[4] 蔡秋声. 小麦胚芽油: 四[J]. 粮食与油脂, 1993(4): 52-56.
[5] ZHU K X, ZHOU H M, QIAN H F. Proteins extracted from defatted wheat germ: nutritional and structural properties[J]. Cereal Chemistry, 2006, 83(1): 69-75. DOI:10.1094/CC-83-0069.
[6] 程云辉, 王璋, 许时婴. 麦胚蛋白的研究进展[J]. 食品与机械, 2006, 22(2): 105-108. DOI:10.3969/j.issn.1003-5788.2006.02.032.
[7] SATO M, HOSOKAWA T, YAMAGUCHI T, et al. Angiotensin I-converting enzyme inhibitory peptides derived from wakame (Undaria pinnatifida) and their antihypertensive effect in spontaneously hypertensive rats[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6245-6252. DOI:10.1021/jf020482t.
[8] 于长青, 张东杰, 牟光庆, 等. 麦胚黄酮类提取物对血脂和抗氧化的影响[J]. 营养学报, 2001, 23(4): 390-392. DOI:10.3321/ j.issn:0512-7955.2001.04.045.
[9] MATSUI T, LI C, OSAJIMA Y. Preparation and characterization of novel bioactive peptides responsible for angiotensinⅠ-converting enzyme inhibition from wheat germ[J]. Journal of Peptide Science, 1999, 5(7): 289-297. DOI:10.1002/(SICI)1099-1387(199907)5:7<289::AID-PSC196>3.0.CO;2-6.
[10] RAND N T, COLLINS V K. Improving cereals with defatted wheat germ[J]. Food Technology, 1958, 12(11): 586-589.
[11] 刘振家, 朱科学, 周惠明. 超声波辅助酶解脱脂小麦胚芽制备抗氧化肽的研究[J]. 中国油脂, 2009, 34(5): 38-41. DOI:10.3321/ j.issn:1003-7969.2009.05.011.
[12] 王丹丹, 胡蓉. 脱脂小麦胚芽酶解及其水解物抗氧化性研究[J]. 现代面粉工业, 2009, 23(5): 44-47. DOI:10.3969/ j.issn.1674-5280.2009.05.016.
[13] ZHU K, ZHOU H, QIAN H. Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates (WGPH) prepared with alcalase[J]. Process Biochemistry, 2006, 41(6): 1296-1302. DOI:10.1016/j.procbio.2005.12.029.
[14] ZHOU C, MA H, YU X, et al. Pretreatment of defatted wheat germ proteins (by-products ofour mill industry) using ultrasonic horn and bath reactors: effect on structure and preparation of ACE-inhibitory peptides[J]. Ultrasonics Sonochemistry, 2013, 20(6): 1390-1400. DOI:10.1016/j.ultsonch.2013.04.005.
[15] LIU F R, WANG L, WANG R, et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptidecalcium complex[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7537-7544. DOI:10.1021/jf401868z.
[16] ZHU K X, WANG X P, GUO X N. Isolation and characterization of zinc-chelating peptides from wheat germ protein hydrolysates[J]. Journal of Functional Foods, 2015, 12: 23-32. DOI:10.1016/ j.jff.2014.10.030.
[17] CHEN D, LIU Z, HUANG W, et al. Puri cation and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J]. Journal of Functional Foods, 2013, 5(2): 689-697. DOI:10.1016/j.jff.2013.01.012. [18] WANG C, LI B, LI H. Zn (Ⅱ) chelating with peptides found in sesame protein hydrolysates: identification of the binding sites of complexes[J]. Food Chemistry, 2014, 165: 594-602. DOI:10.1016/ j.foodchem.2014.05.146.
[19] XIE N, HUANG J, LI B, et al. Af nity puri cation and characterisation of zinc chelating peptides from rapeseed protein hydrolysates: possible contribution of characteristic amino acid residues[J]. Food Chemistry, 2015, 173: 210-217. DOI:10.1016/j.foodchem.2014.10.030.
[20] 段秀, 杨成涛, 孙云, 等. 罗非鱼皮胶原蛋白肽亚铁螯合修饰及螯合物性质的研究[J]. 食品工业科技, 2014, 35(18): 157-160. DOI:10.13386/j.issn1002-0306.2014.18.025.
[21] 黄赛博, 林慧敏, 邓尚贵. 响应面法优化带鱼蛋白多肽螯合亚铁制备工艺[J]. 食品工业科技, 2016, 37(4): 266-270; 277. DOI:10.13386/ j.issn1002-0306.2016.04.045.
[22] CHEN D, MU X, HUANG H, et al. Isolation of a calcium-binding peptide from tilapia scale protein hydrolysate and its calcium bioavailability in rats[J]. Journal of Functional Foods, 2014, 6: 575-584. DOI:10.1016/j.jff.2013.12.001.
[23] ZHAO L, HUANG Q, HUANG S, et al. Novel peptide with a specific calcium-binding capacity from whey protein hydrolysate and the possible chelating mode[J]. Journal of Agricultural and Food Chemistry, 2014, 62(42): 10274-10282. DOI:10.1021/jf502412f.
[24] 黄海. 鲤鱼卵钙离子结合活性肽的制备及钙结合机制的研究[D].青岛: 中国海洋大学, 2014.
[25] 苏纯阳, 董仲华, 香红星. 微量元素氨基酸(小肽)螯合物的研究应用进展[J]. 饲料工业, 2002, 23(1): 15-18. DOI:10.3969/j.issn.1001-991X.2002.01.007.
[26] LIU F, CHEN Z, WANG L, et al. Effects of protein solubilisation and precipitation pH values on the functional properties of defatted wheat germ protein isolates[J]. International Journal of Food Science & Technology, 2013, 48(7): 1490-1497. DOI:10.1111/ijfs.12117.
[27] ADLER-NISSEN J, ERIKSEN S, OLSEN H S. Improvement of the functionality of vegetable proteins by controlled enzymatic hydrolysis[J]. Plant Foods for Human Nutrition, 1983, 32(3/4): 411-423. DOI:10.1007/BF01091198.
[28] 肖珊, 黄立新, 赵璧秋. 乳清多肽螯合钙的制备与结构表征[J]. 食品工业科技, 2013, 34(24): 253-257. DOI:10.13386/j.issn1002-0306.2013.24.073.
[29] 卫生部, 国家标准化管理委员会. 食品中钙的测定: GB/T 5009.92—2003[S]. 北京: 中国标准出版社, 2003.
[30] WANG C, LI B, AO J. Separation and identi cation of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+and LCMS/MS[J]. Food Chemistry, 2012, 134(2): 1231-1238. DOI:10.1016/ j.foodchem.2012.02.204.
[31] 刘闪, 刘良忠, 李小娜, 等. 白鲢鱼骨胶原多肽螯合钙的工艺优化[J].食品科学, 2014, 35(10): 76-81. DOI:10.7506/spkx1002-6630-201410014.
[32] 崔潇, 江虹锐, 刘小玲, 等. 响应面法优化罗非鱼鱼皮胶原多肽螯合镁的工艺条件的研究[J]. 食品工业科技, 2013, 34(15): 238-241. DOI:10.13386/j.issn1002-0306.2013.15.024.
[33] 付文雯. 牛骨胶原多肽螯合钙的制备及其结构表征[D]. 武汉: 华中农业大学, 2010. DOI:10.7666/d.Y1799742.
[34] 许先猛, 董文宾, 孙皎皎. 猪皮胶原多肽螯合钙的制备及其结构表征[J]. 食品工业科技, 2015, 36(20): 309-313. DOI:10.13386/ j.issn1002-0306.2015.20.055.
Optimized Preparation and Structural Characterization of Calcium-Chelating Polypeptides from Wheat Germ Protein Hydrolysate
DING Yuanyuan, WANG Li*, ZHANG Xinxia, WANG Ren, LUO Xiaohu, LI Yanan, LI Yongfu, LI Juan, CHEN Zhengxing*
(National Engineering Laboratory for Cereal Fermentation Technology, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract:This study aimed to reduce the waste of wheat germ resource and simultaneously achieve its value-added utilization for the purpose of solving the problem of calcium deficiency in some populations. Wheat germ protein hydrolysates was prepared by enzymatic hydrolysis using alkaline protease and then chelated with calcium ions to obtain calcium-chelating polypeptides. One-factor-at-a-time and orthogonal array experiments were devised to investigate the in uence of reaction temperature, molar ratio between polypeptides and calcium ions, reaction time and pH on the chelation efficiency. The optimal conditions that provided maximum chelation efficiency (86.21%) were determined as follows: reaction at 65 ℃ and pH 9.5 for 60 min with a molar ratio of polypeptide to calcium of 3:1. Infrared spectroscopic analysis con rmed the coordination reaction between calcium and carboxyl/amino groups in the polypeptides. Circular dichroism spectra indicated that the calcium-chelating polypeptides lost their disordered secondary structure and formed compact and ordered conformations compared to the control group. Scanning electron microscopy observation con rmed significant aggregation of calcium-chelating polypeptides.
Key words:wheat germ polypeptides; chelated calcium; structural characterization
DOI:10.7506/spkx1002-6630-201710036
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)10-0215-07引文格式:
丁媛媛, 王莉, 张新霞, 等. 麦胚多肽-钙螯合物制备工艺优化及其结构表征[J]. 食品科学, 2017, 38(10): 215-221.
DOI:10.7506/spkx1002-6630-20171036. http://www.spkx.net.cn
DING Yuanyuan, WANG Li, ZHANG Xinxia, et al. Optimized preparation and structural characterization of calciumchelating polypeptides from wheat germ protein hydrolysate[J]. Food Science, 2017, 38(10): 215-221. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710036. http://www.spkx.net.cn
收稿日期:2016-08-08
基金项目:国家自然科学基金面上项目(31471616);江苏省研究生培养创新工程项目(SJZZ15-0143);全国粮食行业青年拔尖人才服务行业需求自主选题项目(LQ2016301)
作者简介:丁媛媛(1991—),女,硕士研究生,研究方向为粮食精深加工。E-mail:1048327395@qq.com
*通信作者:王莉(1981—),女,副教授,博士,研究方向为粮食精深加工。E-mail:legend0318@hotmail.com陈正行(1960—),男,教授,博士,研究方向为粮食精深加工。E-mail:zxchen2007@126.com