花生油和玉米油中多组分真菌毒素高效
液相色谱-串联质谱检测方法的建立
刘 丹1,2,韩小敏3,李凤琴3,王 畅4,罗晓林4,卢大新1,2,*
(1.北京农学院食品科学与工程学院,北京 102206;2.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206;3.国家食品安全风险评估中心,卫生部食品安全风险评估重点实验室,北京 100021;4.中山大学公共卫生学院,广东 广州 510080)
摘 要:建立花生油和玉米油中黄曲霉毒素、玉米赤霉烯酮、单端孢霉烯族化合物等13 种真菌毒素的高效液相色谱-串联质谱检测方法。样品经乙腈-水提取、MultiSep 226多功能净化柱净化后,分别用电喷雾正离子模式和负离子模式检测。经优化,正离子模式流动相为含2 mmol/L甲酸铵的0.1%甲酸-甲醇溶液,负离子模式流动相为0.1%氨水-乙腈溶液。该方法对花生油和玉米油中13 种真菌毒素的检出限为0.05~3.00 μg/kg,定量限为0.10~10.00 μg/kg,平均加标回收率为66.6%~114.9%。所建方法操作简单、灵敏度高、重复性好,可用于花生油和玉米油中多组分真菌毒素的协同测定。
关键词:真菌毒素;花生油;玉米油;高效液相色谱-串联质谱
Abstract: A high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) method was developed for the simultaneous detection of 13 mycotoxins including aflatoxins, zearalenone, and trichothecenes in peanut and corn oils. Samples were extracted with acetonitrile-water, followed by clean-up with a MultiSep 226 multifunctional column. The positive electrospray ionization mode (ESI+) and negative electrospray ionization mode (ESI-) were respectively employed to acquire signals. The mobile phase for ESI+was composed of 0.1% formic acid containing 2 mmol/L ammonium formate (solvent A) and methanol (solvent B), while that for ESI-consisted of 0.1% ammonia water (solvent A) and acetonitrile (solvent B). The limits of detections (LODs) for 13 mycotoxins in peanut and corn oils ranged from 0.05 to 3.00 μg/kg and the limits of quantification (LOQ) ranged from 0.10 to 10.00 μg/kg. The mean recoveries ranged from 66.6% to 114.9%. The method developed in the present study had the advantages of simple operation, high sensitivity and good reproducibility, and so it could be used for the detection of multi-mycotoxins in peanut and corn oils.
Key words: mycotoxin; peanut oil; corn oil; high performance liquid chromatography-tandem mass spectrometry
真菌毒素是由某些真菌在特定条件下产生的有毒代谢产物,人畜摄入后可导致中毒[1-3]。目前国际上普遍关注的真菌毒素包括黄曲霉毒素(aflatoxin,AF)、单端孢霉烯族化合物、玉米赤霉烯酮(zearalenone,ZEN)等。其中单端孢霉烯族化合物中的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)及其衍生物和T-2毒素等尤为引人关注[4-6]。大豆油、菜籽油、花生油和玉米油等是我国消费量最大的植物油。据报道,花生油和玉米油由于其原料在田间、收获和贮存过程中极易受到真菌及其毒素的污染,而后期的压榨、碱炼和脱臭等加工工艺虽可除去部分毒素但不完全,导致目前我国食用植物油中真菌毒素污染现象普遍[7-8]。虽然GB 2761—2011《食品中真菌毒素限量》中规定了花生油、玉米油等植物油中AFB1的限量标准[9],但食用植物油中AFB1污染依然严重[10-11],且目前尚无食用玉米油中ZEN的限量标准。刘展华等[12]于2014年对广西城乡183 份食用植物油AFB1的污染调查发现,AFB1的总体超标率为25.14%。吴振兴等[13]的研究结果显示,玉米油中ZEN的含量高达1 160.1 μg/kg。鉴于我国大部分食用油主产区气候条件适于各种真菌的生长繁殖和产毒,导致我国食用植物油不可避免地会受到多种真菌毒素的协同污染,而目前已有的检测植物油中AF、ZEN和单端孢霉烯族化合物的方法存在耗时费力、成本较高、仅检测某一类毒素、不能对多种真菌毒素协同检测的缺点,亟待建立植物油中多组分真菌毒素协同检测的方法。
高效液相色谱-串联质谱法[14]因具有灵敏度高、特异性强、定性及定量同时进行、可实现多种毒素同时检测、并可筛查未知毒素等优点,是目前检测食品中多组分真菌毒素的优选方法[15-17]。本研究在优化样品前处理条件的基础上,建立适于花生油和玉米油中13 种真菌毒素的高效液相色谱-串联质谱检测方法。
1 材料与方法
1.1 材料与试剂
花生油、玉米油样品 市购。
AF标准溶液(AFB1、AFB2、AFG1、AFG2质量浓度分别为1.00、0.30、0.98、0.31 μg/mL) 美国Supelco公司;3-乙酰脱氧雪腐镰刀菌烯醇(3-acetyledeoxynivalenol,3-ADON,100.7 μg/mL)、15-乙酰脱氧雪腐镰刀茵烯醇(15-acetyle-deoxynivalenol,15-ADON,101.1 μg/mL)、雪腐镰刀菌烯醇(nivalenol,NIV,104.4 μg/mL)、T-2毒素(100.5 μg/mL)、HT-2毒素(100.4 μg/mL)、镰刀菌烯酮-X(fusarenon X,FX,100.3 μg/mL)、二乙酰藨草镰刀菌烯醇(diacetoxyscirpenol,DAS,100.8 μg/mL),DON、 ZEN、伏马菌素B1(fumonisin B1,FB1)和FB2固体标准品 奥地利Romer Labs公司;甲醇、乙腈(均为色谱纯) 美国Fisher公司;甲酸、乙酸、甲酸铵、乙酸铵、氨水(均为色谱纯) 美国Sigma公司;冰醋酸(分析纯) 北京化学试剂公司。
1.2 仪器与设备
MultiSep 226多功能净化柱 奥地利Romer Labs公司;0.22 μm聚丙烯滤膜 美国Waters公司;0.22 μm尼龙滤膜天津津腾实验设备有限公司;Prominence LC-20A高效液相色谱仪 日本岛津公司;Triple QuadTM3500仪美国AB Sciex公司;BK-3600A超声波清洗器 无锡超声电子设备厂;MS3基本型涡旋混合器 德国IKA公司;Millipore-Elix-QE-QG纯水仪 美国Millipore公司;N-EVAPTM112氮吹仪 美国Organomation公司;HY-3多功能振荡器 江苏金坛医疗仪器厂。
1.3 方法
1.3.1 真菌毒素标准溶液的配制
真菌毒素混合标准储备液:取一定量真菌毒素标准溶液于棕色小瓶中,用乙腈稀释后,制备成混合标准储备溶液,使各毒素的质量浓度分别为AFB1、AFG11 μg/mL,AFB2、AFG20.3 μg/mL,3-ADON、15-ADON、NIV、DAS、FB1、FB2、T-2、FX 10 μg/mL,ZEN 5 μg/mL,HT-2、DON 30 μg/mL,-18 ℃避光保存备用。
使用前将混合标准储备液用乙腈-水(50∶50,V/V)溶液或空白植物油提取液逐级稀释,配制成不同质量浓度的毒素标准工作液和基质匹配毒素标准工作液。
1.3.2 样品前处理
参考于钏钏等[18]建立的方法并进行适当改进。称取10 g(精确到0.01 g)植物油样品,加入40 mL乙腈-水(84∶16,V/V)溶液,150 r/min振荡提取30 min,静置10 min,待分层后,取上清液经定性滤纸过滤,取8 mL滤液,加入40 μL冰醋酸(相当于添加0.5%冰醋酸),混匀后过MycoSep 226净化柱,弃掉先流出的2 mL净化液,取随后的4 mL净化液,于40 ℃水浴中氮吹至近干,加入少许乙腈-水(50∶50,V/V)溶液超声5 min、涡旋1 min溶解并定容至1 mL,最后经0.22 μm聚丙烯滤膜过滤后备用。
1.3.3 仪器条件
1.3.3.1 质谱条件
电喷雾正离子模式(electrospray positive ionization mode,ESI+)和电喷雾负离子模式(electrospray negative ionization mode,ESI-)的离子化电压分别为5 500 V和-4 500 V。ESI+与ESI-的气帘气压力、离子源温度、喷雾气压力、辅助加热气压力、碰撞气压力、驻留时间等参数均相同,分别为35 psi、550 ℃、55 psi、50 psi、6 psi、20 ms。采用电喷雾多反应监测(multiple reaction monitoring,MRM)模式进行信号采集,经过优化后各真菌毒素检测的主要质谱参数见表1。
表 1 检测15 种真菌毒素的主要质谱参数
Table 1 Mass spectrometric parameters for detection of 15 mycotoxins

毒素母离子母离子/定量子离子(m/z)碰撞能量/eV母离子/定性子离子(m/z)碰撞能量/eV离子源AFB1[M+H]+313/28531313/240.948ESI+AFB2[M+H]+315/287.236315/258.836ESI+AFG1[M+H]+329.1/242.935329.1/215.141ESI+AFG2[M+H]+331/28537331/244.930ESI+T-2[M+Na]+489.2/38730489.2/244.930ESI+HT-2[M+Na]+447.2/34525447.2/28528ESI+DAS[M+NH4]+384.1/30714384.1/24720ESI+DON[M-H]-294.9/265-14294.9/137.9-22ESI-3-ADON[M-H]-337.1/306.9-14337.1/172.9-14ESI-15-ADON[M-H]-337.2/150-20337.2/219-14ESINIV[M-H]-311.1/281-14311.1/190.9-27ESIFX[M-H]-353.1/262.9-15353.1/186.9-29ESIZEN[M-H]-317/174.9-32317/131-36ESIFB1[M+H]+722.4/334.253722.4/352.248ESI+FB2[M+H]+706.4/336.349706.4/354.244ESI+
本研究对15 种真菌毒素进行检测条件的优化,包括FB1和FB2。但在样品前处理过程中发现MycoSep 226多功能净化柱可以吸附样品中的FB1和FB2而无法测定伏马菌素,因此本方法适用于除FB1和FB2外的13 种真菌毒素的测定。
1.3.3.2 色谱条件
色谱柱:Wa t e r s A C Q U I T Y B E H C18柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;样品室温度4 ℃;进样体积5 μL;流速0.3 mL/min。ESI+条件下的流动相A为含2 mmol/L甲酸铵的0.1%甲酸溶液,流动相B为甲醇;ESI-条件下的流动相A为0.1%氨水溶液,流动相B为乙腈。
ESI+洗脱程序:0~0.5 min,55% A;0.5~6 min,55%~20% A;6~8 min,20%~5% A;8~11 min,5% A;11~11.1 min,5%~55% A;11.1~14 min,55% A。
ESI-洗脱程序:0~0.5 min,95% A;0.5~5 min,95%~35% A;5~6 min,35%~5% A;6~7 min,5% A;7~7.5 min,5%~95% A;7.5~11.5 min,95% A。
ESI+条件下,分别考察0.1%甲酸溶液、0.1%乙酸溶液、2 mmol/L乙酸铵溶液、2 mmol/L甲酸铵溶液、含2 mmol/L甲酸铵的0.1%甲酸溶液作为流动相A和甲醇或乙腈作为流动相B;ESI-条件下,分别考察0.1%氨水溶液、0.1%甲酸溶液和水作为流动相A和甲醇或乙腈作为流动相B,对待测13 种真菌毒素的保留时间和质谱信号响应的影响。
2 结果与分析
2.1 质谱条件的优化
考虑到各真菌毒素在ESI+和ESI-条件下的响应值,本研究将15 种真菌毒素分为两组分别进行检测,结果显示,ESI+条件下AFB1、AFB2、AFG1、AFG2、FB1、FB2的母离子峰均以[M+H]+最优,T-2、HT-2和DAS的母离子峰分别以[M+Na]+和[M+NH4]+最优。ESI-条件下DON、3-ADON、15-ADON、NIV、FX、ZEN均以[MH]-最优,其中NIV、DON、3-ADON子离子峰为环氧基团断裂峰,其m/z分别为281、265、306.9。经过优化,AFB1、AFB2、AFG1、AFG2、T-2、HT-2、DAS、FB1和FB2共9 种真菌毒素采用ESI+模式进行检测,而DON、3-ADON、15-ADON、NIV、FX和ZEN共6 种真菌毒素采用ESI-模式进行分析,具体见表1。
2.2 色谱条件的优化
根据2.1节质谱条件优化的结果,将15 种毒素分成两组分别进行ESI+和ESI-条件的优化。ESI+条件下,分别考察甲醇、乙腈作为流动相B和0.1%甲酸溶液、0.1%乙酸溶液、2 mmol/L乙酸铵溶液、2 mmol/L甲酸铵溶液、含2 mmol/L甲酸铵的0.1%甲酸溶液作为流动相A对待测真菌毒素色谱峰的影响。结果显示,甲醇作为流动相B时,9 种真菌毒素的信号响应强度是乙腈作为流动相时的2 倍多,且各毒素色谱峰的峰形更对称,噪音更低(图1a、b)。用0.1%甲酸溶液、0.1%乙酸溶液、2 mmol/L乙酸铵溶液和2 mmol/L甲酸铵溶液作为流动相A时发现,0.1%甲酸溶液比0.1%乙酸溶液更易促进真菌毒素的电离并使4 种黄曲霉毒素出现更窄的色谱峰(图1a、c);用2 mmol/L甲酸铵溶液作为流动相A时,各真菌毒素的色谱峰信号强度明显提高,且是2 mmol/L乙酸铵溶液的2 倍多(图1d、e),且随着甲酸铵浓度的增高(1、2 mmol/L和5 mmol/L),9 种毒素色谱峰信号强度逐渐增强,考虑到甲酸铵浓度过高会影响色谱柱寿命[18],因此后续实验中甲酸铵的浓度选择2 mmol/L。鉴于采用甲酸铵溶液作为流动相时不能使FB1和FB2有效分离[19-20],因此选择在2 mmol/L甲酸铵溶液中添加0.1%甲酸溶液,发现该条件下9 种毒素既可得到较高的离子化,又可使2 种伏马菌素出峰(图1f),因此,本研究选择含2 mmol/L甲酸铵的0.1%甲酸-甲醇溶液作为ESI+的流动相。
ESI-条件下,分别考察了甲醇、乙腈作为流动相B和0.1%氨水溶液、0.1%甲酸溶液和水作为流动相A对5 种B类单端孢霉烯族化合物和ZEN的保留时间和质谱信号响应差异的影响。结果表明,乙腈作为流动相B时可明显缩短各毒素的保留时间、提高各毒素的色谱峰响应值(图2a、b)。与水和0.1%甲酸溶液相比,0.1%氨水溶液作为流动相A时可显著提高6 种毒素的离子化效率,并改善色谱峰的峰形(图2a、c、d)。因此选择0.1%氨水-乙腈溶液作为ESI-的流动相,该条件下各毒素信号响应值较高且以ZEN响应强度为最高,峰形较好,3-ADON和15-ADON单纯通过液相色谱方式无法完全分离,但可经质谱选择不同的子离子予以区分。2.3 提取物残渣定容溶剂及滤膜的优化
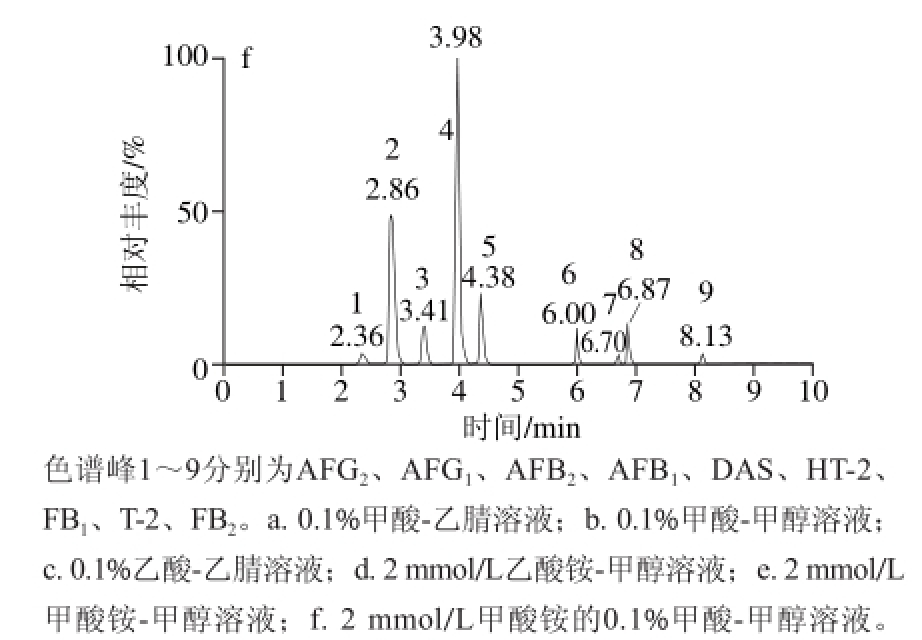
图 1 ESI+ 条件下9 种真菌毒素在不同流动相中的总离子流图
条件下9 种真菌毒素在不同流动相中的总离子流图
Fig. 1 Total ion chromatograms (TIC) of 9 mycotoxins using different mobile phases under the ESI+mode

图 2 ESI-条件下6 种真菌毒素在不同流动相中的总离子流图
Fig. 2 TICs of 6 mycotoxins using different mobile phases under the ESI-mode
分别选用乙腈-水(V/V)溶液30∶70、50∶50作为定容溶剂进行测定发现,乙腈-水(50∶50,V/V)溶液作为定容溶剂时ZEN的响应强度较高,但DON的峰形略宽,如图3所示,其他真菌毒素的响应值和峰形无明显差别。考虑真菌毒素极性的差异,为使13 种真菌毒素有较高溶解度和较好的分离,本研究采用乙腈-水(50∶50,V/V)溶液作为定容溶剂。实验同时对比了样品提取液上机前用尼龙滤膜与聚丙烯滤膜过滤对色谱峰峰形、毒素吸附差异和杂质的影响。结果发现,2 种滤膜过滤均未出现对真菌毒素明显的吸附效应,考虑到尼龙滤膜可带入杂质并出现杂质峰,且杂质峰与ZEN的色谱峰保留时间相近会影响到ZEN的检测,因此,本研究选择聚丙烯滤膜进行实验。
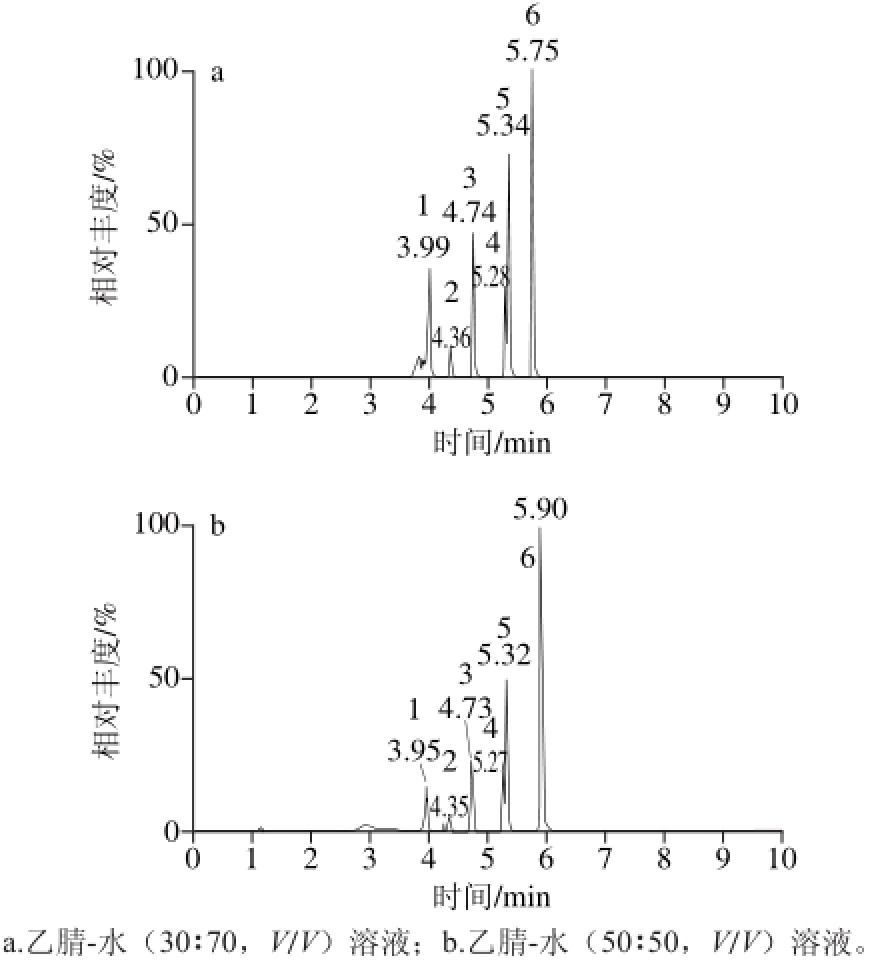
图 3 ESI-条件下真菌毒素在不同定容溶剂的总离子流图
Fig. 3 TICs of mycotoxins in different solvents under the ESI-mode
2.4 样品前处理条件的优化
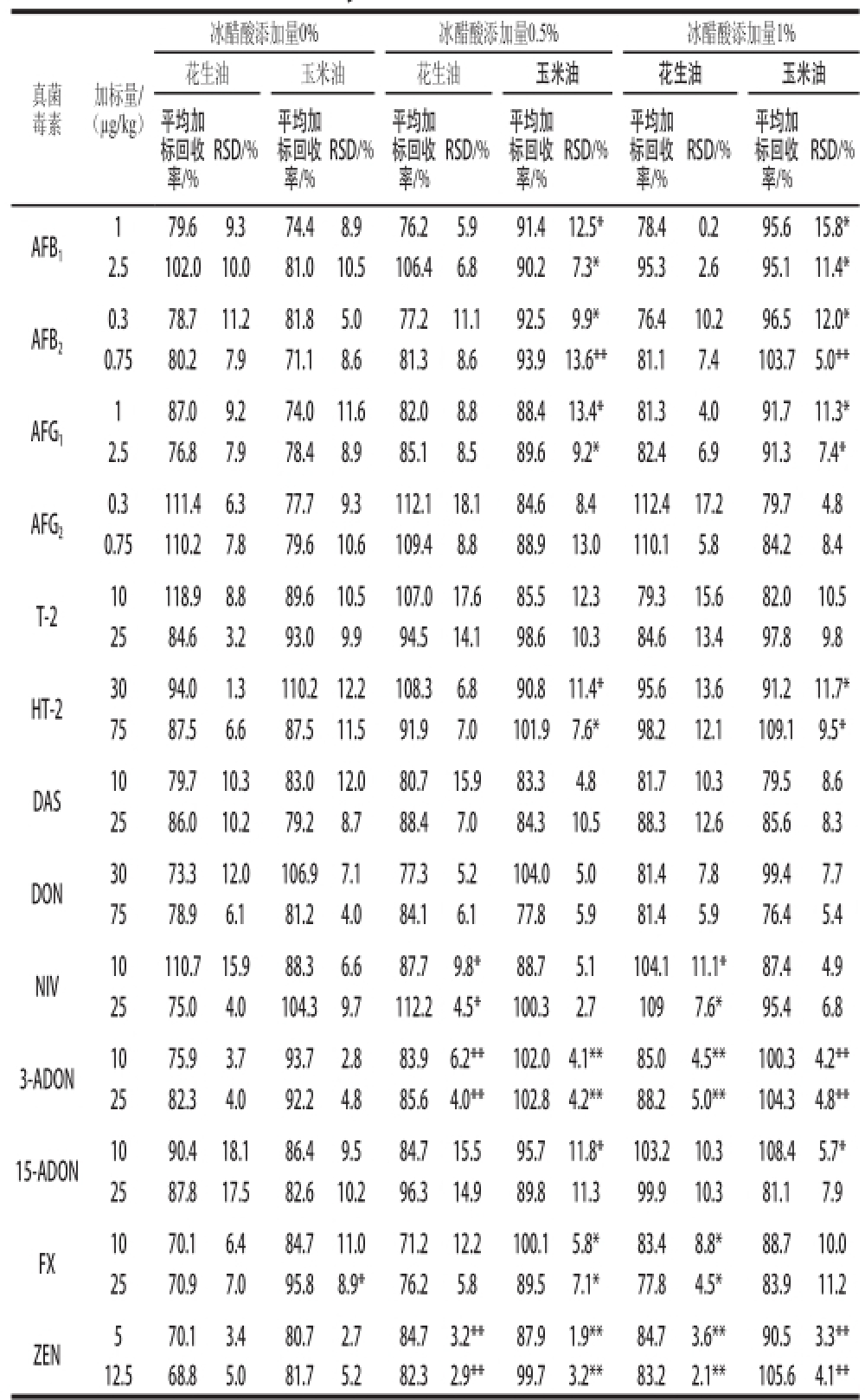
本研究考察了在样品提取液中添加体积分数为0.5%或1%冰醋酸溶液对毒素提取效果的影响。结果发现,花生油中添加0.5%或1%冰醋酸溶液均可显著提高ZEN、3-ADON、FX与NIV的回收率,且差异均具有统计学意义;但对其他真菌毒素的平均回收率无显著性差异。与不添加冰醋酸相比,玉米油中添加0.5%或1%冰醋酸溶液均可显著提高AFB1、AFG1、AFB2、15-ADON、3-ADON、HT-2、FX和ZEN的平均回收率,差异均具有统计学意义,而对其他真菌毒素的平均回收率无显著性差异,如表2所示。综上所述,添加0.5%或1%冰醋酸溶液虽然均可提高部分毒素的加标回收率,但考虑到添加过多冰醋酸会影响毒素的稳定性[21],因此后续实验选择在样品前处理过程中添加0.5%冰醋酸溶液。
表 2 冰醋酸对13 种真菌毒素平均加标回收率的影响(n=6)Table 2 Effects of glacial acetic acid on mean recoveries of 13 mycotoxins (n = 6)
真菌毒素加标量/(μg/kg)冰醋酸添加量0%冰醋酸添加量0.5%冰醋酸添加量1%花生油玉米油花生油玉米油花生油玉米油平均加标回收率/% RSD/%平均加标回收率/% RSD/%平均加标回收率/% RSD/%平均加标回收率/% RSD/%平均加标回收率/% RSD/%平均加标回收率/% RSD/% AFB1179.69.374.48.976.25.991.412.5*78.40.295.615.8*2.5102.010.081.010.5106.46.890.27.3*95.32.695.111.4*AFB20.378.711.281.85.077.211.192.59.9*76.410.296.512.0*0.7580.27.971.18.681.38.693.913.6**81.17.4103.75.0**AFG1187.09.274.011.682.08.888.413.4*81.34.091.711.3*2.576.87.978.48.985.18.589.69.2*82.46.991.37.4*AFG20.3111.46.377.79.3112.118.184.68.4112.417.279.74.8 0.75110.27.879.610.6109.48.888.913.0110.15.884.28.4 T-210118.98.889.610.5107.017.685.512.379.315.682.010.5 2584.63.293.09.994.514.198.610.384.613.497.89.8 HT-23094.01.3110.212.2108.36.890.811.4*95.613.691.211.7*7587.56.687.511.591.97.0101.97.6*98.212.1109.19.5*DAS1079.710.383.012.080.715.983.34.881.710.379.58.6 2586.010.279.28.788.47.084.310.588.312.685.68.3 3073.312.0106.97.177.35.2104.05.081.47.899.47.7 7578.96.181.24.084.16.177.85.981.45.976.45.4 NIV10110.715.988.36.687.79.8*88.75.1104.111.1*87.44.9 2575.04.0104.39.7112.24.5*100.32.71097.6*95.46.8 3-ADON1075.93.793.72.883.96.2**102.04.1**85.04.5**100.34.2**2582.34.092.24.885.64.0**102.84.2**88.25.0**104.34.8**15-ADON1090.418.186.49.584.715.595.711.8*103.210.3108.45.7*2587.817.582.610.296.314.989.811.399.910.381.17.9 FX1070.16.484.711.071.212.2100.15.8*83.48.8*88.710.0 2570.97.095.88.9*76.25.889.57.1*77.84.5*83.911.2 ZEN570.13.480.72.784.73.2**87.91.9**84.73.6**90.53.3**12.568.85.081.75.282.32.9**99.73.2**83.22.1**105.64.1**DON
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
2.5 基质效应测定结果
表 3 不同文献中内标校正法和基质匹配校正法的比较
Table 3 Comparison between internal calibration method and matrixmatched calibration method reported in different references
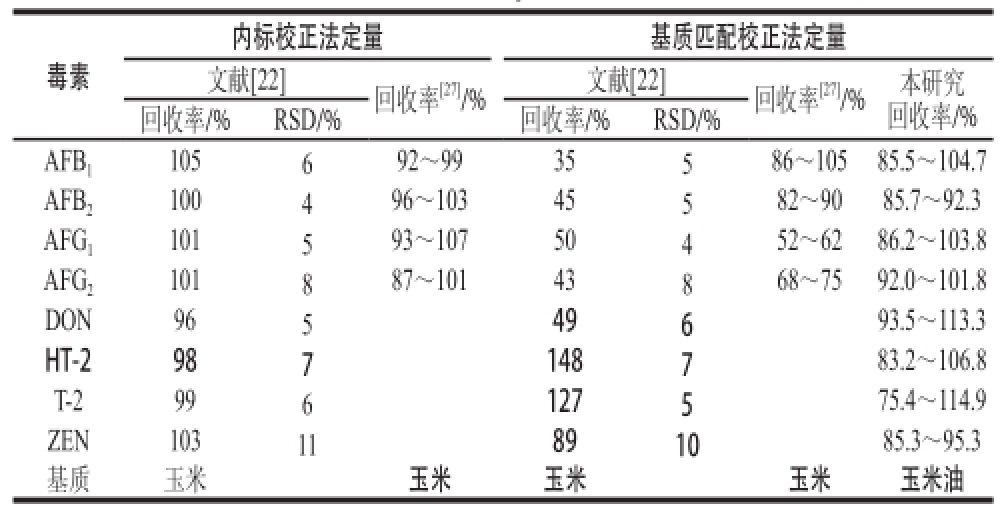
内标校正法定量基质匹配校正法定量文献[22]回收率[27]/%文献[22]回收率[27]/%本研究回收率/%回收率/%RSD/%回收率/%RSD/% AFB1105692~9935586~10585.5~104.7 AFB2100496~10345582~9085.7~92.3 AFG1101593~10750452~6286.2~103.8 AFG2101887~10143868~7592.0~101.8 DON96549693.5~113.3 HT-2987148783.2~106.8 T-2996127575.4~114.9 ZEN10311891085.3~95.3基质玉米玉米玉米玉米玉米油毒素
基质效应是由目标化合物在离子化过程中引起的信号增强或抑制[22-24],主要与色谱峰信号强度和噪音高低相关,净化过程并不能彻底消除,且同一种基质的不同样品间基质效应也有不同[25]。本研究将毒素的混合标准储备液用空白样品经1.3.2节处理所得提取液和乙腈-水(50∶50,V/V)溶液分别稀释,制得一定质量浓度的2 种标准工作液,二者对应毒素的峰面积比值乘以100来计算基质效应[21]。花生油和玉米油均有不同程度的基质效应,二者对不同毒素的基质效应范围分别为60.00%~103.85%和50.00%~95.45%。目前降低基质效应的方法主要有样品稀释法、内标校正法、基质匹配校正法等[22,26]。其中,内标校正法和基质匹配校正法应用较广。由表3可知,文献[22,27]对玉米研究发现基质匹配校正法所得回收率低于内标校正法,表明其定量准确度相对较低。考虑到多组分分析中,内标校正法需找到每种目标待测物所对应的内标物,操作较复杂,且成本较高[28]。而基质匹配校正法成本低廉,适合批量检测[29]。对此,有些研究将二者结合,当基质匹配校正法无法满足分析需要时,采用内标校正法定量[17,30]。而本研究采用基质匹配校正法所得回收率已达到定量要求[31],因此,本实验采用基质匹配校正曲线对样品中的毒素水平进行定量。
表 4 花生油和玉米油中13 种毒素的相关技术指标
Table 4 Figures of merit of the developed method for detection of 13 mycotoxins in peanut and corn oils

花生油基质效应/% AFB1Y=19 700X-1 0400.1~1000.999 80.050.1094.44 Y=32 800X+9800.1~1000.999 10.050.1094.44 AFB2Y=864X+53.20.15~300.998 80.050.1566.67 Y=19 000X-2080.15~300.999 40.050.1580.95 AFG1Y=1 000X+1000.5~1000.998 10.100.50102.27 Y=19 800X-7140.1~1000.998 80.050.1095.45 AFG2Y=448X-71.90.15~300.997 10.050.15103.85 Y=7 660X-47.40.5~300.998 10.150.5076.92 T-2Y=254X+21.31~1 0000.997 20.200.7065.71 Y=509X-7.140.5~1 0000.999 60.150.3065.71 HT-2Y=72.6X+1560.75~1 5000.998 50.300.75100.00 Y=260X+60.20.75~1 5000.997 70.300.7595.24 DASY=352X-1750.5~1 0000.997 90.100.3083.94 Y=9 290X-1 5800.5~1 0000.997 40.100.3091.24 DONY=247X-10110~1 5000.999 63.009.0060.00 Y=208X+0.20710~1 5000.998 73.0010.0050.00 3-ADONY=944X+1891~1 0000.998 40.501.0076.12 Y=726X+1055~1 0000.999 11.005.0050.17 15-ADONY=47.6X-1545~1 0000.999 21.005.0083.84 Y=34.3X+1185~1 0000.998 61.005.0052.53 NIVY=884X+6112~1 0000.998 70.502.0076.92 Y=759X+2125~1 0000.997 01.005.0064.10 FXY=549X+1662~1 0000.999 00.502.0085.00 Y=450X+0.631~1 0000.999 00.501.0052.50 ZENY=10 200X-1 3900.5~5000.999 00.250.5088.24 Y=8 250X+3 6600.25~5000.999 20.050.2558.82毒素玉米油线性方程线性范围/(μg/kg)相关系数LOD/(μg/kg)LOQ/(μg/kg)效应/%线性方程线性范围/(μg/kg)基质相关系数LOD/(μg/kg)LOQ/(μg/kg)
2.6 方法验证结果
2.6.1 方法的线性范围、检出限和定量限结果
从表4可知,花生油和玉米油中AF、A类单端孢霉烯族化合物(HT-2、T-2和DAS)、B类单端孢霉烯族化合物(DON、3-ADON、15-ADON、NIV、FX)的线性范围均为0.1~100、0.5~1 500、1~1 500 μg/kg,ZEN的线性范围分别为0.5~500 μg/kg和0.25~500 μg/kg。花生油中AF、A类单端孢霉烯族化合物、B类单端孢霉烯族化合物和ZEN的检出限(limit of determination,LOD,RSN≥3)和定量限(limit of quantification,LOQ,RSN≥10)范围分别为0.05~0.10 μg/kg和0.10~0.50 μg/kg、0.10~0.30 μg/kg和0.30~0.75 μg/kg、0.50~3.00 μg/kg和1.00~9.00 μg/kg、0.25 μg/kg和0.50 μg/kg;玉米油中AF、A类单端孢霉烯族化合物、B类单端孢霉烯族化合物和ZEN的LOD和LOQ范围分别为0.05~0.15 μg/kg和
0.10 ~0.50 μg/kg、0.10~0.30 μg/kg和0.30~0.75 μg/kg、0.50~3.00 μg/kg和1.00~10.00 μg/kg、0.05 μg/kg和0.25 μg/kg。且13 种真菌毒素的线性相关系数均大于0.99,线性关系良好,可满足花生油和玉米油中真菌毒素定量检测的要求。
2.6.2 方法的加标回收率结果
表 5 花生油和玉米油中13 种毒素的加标回收率和RSD(n=6)
Table 5 Recoveries and relative standard deviations of 13 mycotoxins in peanut and corn oils (n=6)

毒素加标量/(μg/kg)花生油玉米油回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%花生油玉米油毒素加标量/(μg/kg)3086.84.796.111.8 590.02.6104.74.8 15086.34.7100.69.4 2092.51.996.94.0 60088.25.1113.37.6 5096.15.293.04.1 1 50092.63.893.55.6 190.81.285.512.6 AFB1DON 0.388.67.189.210.4 1094.57.692.88.7 1.5100.08.592.32.4 5089.66.081.214.9 6.095.23.789.74.7 20088.15.693.74.9 1595.03.485.73.6 50094.87.880.24.8 AFB23-ADON 1090.19.681.213.4 5101.65.786.94.2 5095.57.676.512.5 2094.95.186.26.2 20098.85.5104.96.5 50101.03.6103.83.3 50093.92.889.97.2 194.65.0100.410.1 AFG115-ADON 0.383.21.995.412.6 585.23.495.34.0 1.5100.76.7101.311.0 2596.37.785.39.8 6.091.56.1101.88.8 10092.92.093.72.1 1582.814.292.02.0 25089.45.892.51.9 AFG2ZEN 1083.26.671.56.8 5077.24.987.03.2 5092.88.166.65.7 20083.74.185.03.0 20088.37.181.86.1 50088.98.188.67.0 50088.25.085.98.2 1071.09.4106.62.9 DAS NIV 1080.713.374.615.5 15079.39.296.58.1 5079.46.378.47.7 60084.85.394.45.5 20080.61.990.07.4 1 50086.513.483.21.5 50087.99.089.911.7 3082.913.9106.817.9 HT-2 FX 1082.19.6114.96.9 5082.47.880.810.7 20079.48.075.411.8 50086.65.176.32.0 T-2
取真菌毒素阴性的花生油及玉米油样品,分别添加4 个质量浓度的13 种真菌毒素混合标准溶液,每个加标水平进行6 次重复实验,按1.3.2节进行样品的前处理,如表5所示。花生油和玉米油中13 种真菌毒素的平均加标回收率范围分别为71.0%~101.6%和66.6%~114.9%,相对标准偏差(relative standard deviation,RSD)分别为1.2%~14.2%和1.5%~17.9%,符合欧盟Commission Regulation (EC) No. 401-2006对食品中AFB1、AFB2、AFG1、AFG2、T-2、HT-2、DON、ZEN等真菌毒素的回收率及RSD定量测定的要求[28]。
2.6.3 方法的精密度结果
表 6 13 种真菌毒素的日内和日间精密度
Table 6 Intra- and inter-day precision for 13 mycotoxins

花生油玉米油日内RSD/%花生油玉米油毒素加标量/(μg/kg)日间RSD/%日内RSD/%日间RSD/%毒素加标量/(μg/kg)日内RSD/%日间RSD/%日内RSD/%日间RSD/% 0.50.3 1.0 11.0 9.1 154.7 3.8 6.6 4.4 21.9 3.7 4.8 4.1 603.3 3.4 3.1 2.1 51.9 2.4 2.2 3.9 150 1.4 1.5 4.6 2.0 AFB1DON 0.15 6.9 13.2 12.2 11.6 511.5 12.6 12.3 11.4 0.63.9 7.9 8.8 9.7 206.5 1.9 3.8 8.6 1.56.2 0.7 7.1 7.1 502.0 2.2 8.8 7.7 AFB23-ADON 0.56.1 2.1 8.9 5.4 51.7 2.6 9.2 4.1 22.2 7.8 2.8 3.9 202.9 2.4 6.2 4.5 52.0 1.8 10.5 4.4 504.3 5.5 4.4 5.1 AFG115-ADON 0.15 6.0 3.1 10.4 12.5 2.55.3 6.1 7.6 7.8 0.63.5 4.0 10.6 12.4 106.6 6.4 7.0 10.0 1.5 3.2 2.8 9.1 7.0 253.1 6.8 5.5 3.3 AFG2ZEN 55.3 4.2 7.5 2.3 207.3 3.3 2.9 3.9 202.2 4.0 8.1 4.0 504.0 2.9 5.2 4.8 503.4 5.3 3.8 2.6 50.4 0.1 4.9 3.3 DAS NIV 50.3 0.3 8.3 4.6 601.5 13.6 2.0 3.5 202.1 2.5 8.3 5.1 1508.1 9.0 3.2 2.1 503.0 0.8 8.7 8.1 152.4 0.8 10.3 3.2 HT-2FX 52.2 4.3 9.2 7.3 206.8 6.7 7.1 4.6 501.5 2.4 5.1 4.1 T-2
本实验采用添加低、中和高3 个梯度真菌毒素的花生油和玉米油样品,按照1.3.2节的实验流程提取净化,进行日内、日间实验,同一天不同时间点测定5 次,连续测定5 d。从表6可知,花生油的日内和日间RSD范围分别为0.3%~11.5%和0.1%~13.6%,玉米油的日内和日间RSD范围分别为2.0%~12.3%和2.0%~12.5%,表明所建方法具有良好的精密度。
3 结 论
本研究建立了花生油和玉米油中AF、单端孢霉烯族化合物和ZEN共13 种真菌毒素的高效液相色谱-串联质谱检测方法,优化出液相色谱条件、质谱条件、样品前处理方法、提取物溶解定容溶剂等条件。ESI+和ESI-条件下的流动相分别为含2 mmol/L甲酸铵的0.1%甲酸-甲醇溶液和0.1%氨水-乙腈溶液;前处理过程中添加0.5%冰醋酸可显著提高ZEN和3-ADON等毒素的回收率;乙腈-水(50∶50,V/V)溶液作为定容溶剂可使13 种真菌毒素得到较高的响应值;花生油和玉米油均有不同程度的基质效应,为保证检测结果的准确性,本实验均采用基质匹配校正曲线进行定量。研究表明,所建方法检出限低、回收率高、稳定性好、灵敏度高、准确可靠,可满足花生油和玉米油中真菌毒素的测定。
利用本方法对实际样品进行检测,ESI+和ESI-条件下的真菌毒素均可在9 min内出峰,可满足批量样品检测要求。此外,所建方法具有较低的检出限和定量限,可满足我国[9]及欧盟[32]对花生油和玉米油中黄曲霉毒素和玉米赤霉烯酮等毒素的限量要求。综上所述,本方法可用于花生油和玉米油中13 种真菌毒素的测定,从而为食品安全监管提供一定的技术支持。
参考文献:
[1] 郑翠梅. 高效液相色谱-四极杆-飞行时间质谱法同时测定粮食中13种真菌毒素[D]. 泰安: 山东农业大学, 2012.
[2] 宫小明, 任一平, 董静, 等. 超高效液相色谱串联质谱法测定花生、粮油中18 种真菌毒素[J]. 分析测试学报, 2011, 30(1): 6-12. DOI:10.3969/j.issn.1004-4957.2011.01.002.
[3] LATTANZIO V M T, SOLFRIZZO M, POWERS S, et al. Simultaneous determination of aflatoxins, ochratoxin A and fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J]. Rapid Communications in Mass Spectrometry, 2007, 21: 3253-3261. DOI:10.1002/rcm.3210. [4] BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1128/CMR.16.3.497-516.2003.
[5] RAHMANI A, JINAP S, SOLEIMANY E. Qualitative and quantitative analysis of mycotoxins[J]. Comprehensive Reviews in Food Science and Food Safety, 2009, 8(3): 202-251. DOI:10.1111/ j.1541-4337.2009.00079.x.
[6] BERTHILLER F, SCHUHMACHER R, BUTTINGER G, et al. Rapid simultaneous determination of major type A- and B-trichothecenes as well as zearalenone in maize by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2005, 1062: 209-216. DOI:10.1016/ j.chroma.2004.11.011.
[7] 王月华, 孙冬梅, 温江涛, 等. 玉米油生产过程中对玉米赤霉烯酮及呕吐毒素的影响[J]. 粮食与食品工业, 2015, 22(4): 19-22. DOI:10.3969/j.issn.1672-5026.2015.04.004.
[8] 马治良, 徐同城, 刘丽娜, 等. 食用油及油料作物中真菌毒素研究进展[J]. 农产品加工, 2014(2): 45-48. DOI:10.3969/jissn.1671-9646(X).2014.02.045.
[9] 卫生部. 食品中真菌毒素限量: GB 2761—2011[S]. 北京: 中国标准出版社, 2011: 1-2.
[10] 刘晓莉, 曹悦, 陈世琼, 等. 2011-2012年食用植物油中黄曲霉毒素B1的调查[J]. 中国食品工业, 2012(12): 68-69. DOI:10.3969/ j.issn.1006-6195.2012.12.045.
[11] 叶盛群, 谌刚, 韩秀山. 食用油吸附脱色剂对植物油中黄曲霉毒素含量的影响[J]. 精细与专用化学品, 2013, 21(7): 20-22. DOI:10.3969/j.issn.1008-1100.2013.07.006.
[12] 刘展华, 唐振柱, 钟延旭, 等. 2014年广西城乡食用植物油黄曲霉毒素B1污染水平调查[J]. 应用预防医学, 2015, 21(6): 377-380. DOI:10.3969/j.issn.1673-758X.2015.06.004.
[13] 吴振兴, 鲍蕾, 吕宁, 等. 植物油中多种真菌毒素的液相色谱-串联质谱检测方法建立及污染调查分析[J]. 分析测试学报, 2012, 31(12): 106-110.
[14] OFITSEROVA M, NERKAR S, PICKERING M, et al. Multiresidue mycotoxin analysis in corn grain by column high-perfermance liquid chromatography with postcolumn photochemical and chemical derivatization: single-laboratory validation[J]. Journal of AOAC International, 2009, 92(1): 15-25.
[15] 辛媛媛, 张艳, 王松雪, 等. UPLC-MS/MS法测定玉米中13 种真菌毒素[J]. 中国粮油学报, 2015, 30(12): 126-130. DOI:10.3969/ j.issn.1003-0174.2015.12.023.
[16] TANG Y Y, LIN H Y, CHEN Y C, et al. Development of a quantitative multi-mycotoxin method in rice, maize, wheat and peanut using UPLC-MS/MS[J]. Food Analytical Methods, 2013, 6: 727-736. DOI:10.1007/s12161-012-9473-8.
[17] REN Y P, ZHANG Y, SHAO S L, et al. Simultaneous determination of multi-component mycotoxin contaminants in foods and feeds by ultraperformance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2007, 1143: 48-64. DOI:10.1016/ j.chroma.2006.12.064.
[18] 于钏钏, 邵兵, 李凤琴, 等. 粮食中隐蔽型脱氧雪腐镰刀菌烯醇等多组分真菌毒素协同检测技术[J]. 中华预防医学杂志, 2010, 44(8): 736-740. DOI:10.3760/cma.j.issn.0253-9624.2010.08.013.
[19] BERTHILLER F, SULYOK M, KRSKA R, et a1. Chromatographic methods for the simultaneous determination of mycotoxins and their conjugates in cereals[J]. International Journal of Food Microbiology, 2007, 119(12): 33-37. DOI:10.1016/j.ijfoodmicro.2007.07.022.
[20] BELTRAN E, IBANEZ M, SANCHO J V, et al. Determination of mycotoxins in different food commodities by ultra-high-pressure liquid chromatography coupled to triple quadruple mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2009, 23: 1801-1809. DOI:10.1002/rcm.4077.
[21] 韩铮. 中药材中常见真菌毒素分析方法学及代谢动力学研究[D].杭州: 浙江大学, 2011: 28-29.
[22] ELISABETH V, THOMAS G, ROBERT K. Stable isotope dilution assay for the accurate determination of mycotoxins in maize by UHPLC-MS/MS[J]. Analytical and Bioanalytical Chemistry, 2012, 402: 2675-2686. DOI:10.1007/s00216-012-5757-5.
[23] HUANG L C, ZHENG N, ZHENG B Q, et al. Simultaneous determination of aflatoxin M1, ochratoxin A, zearalenone and α-zearalenol in milk by UHPLC-MS/MS[J]. Food Chemistry, 2014, 146: 242-249. DOI:10.1016/j.foodchem.2013.09.047.
[24] NATHANAIL A V, SYVÄHUOKO J, MALACHOVÁ A, et al. Simultaneous determination of major type A and B trichothecenes, zearalenone and certain modi ed metabolites in Finnish cereal grains with a novel liquid chromatography-tandem mass spectrometric method[J]. Analytical and Bioanalytical Chemistry, 2015, 407(16): 4745-4755. DOI:10.1007/s00216-015-8676-4.
[25] SULYOK M, KRSKA R, SCHUHMACHER R. Application of a liquid chromatography-tandem mass spectrometric method in multimycotoxin determination in raw cereals and evaluation of matrix effects[J]. Food Additives and Contaminants, 2007, 24: 1184-1195. DOI:10.1080/02652030701510004.
[26] GOSETTI F, MAZZUCCO E, ZAMPIERI D, et al. Signal suppression/ enhancement in high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217: 3929-3937. DOI:10.1016/j.chroma.2009.11.060.
[27] 王秀嫔, 李培武, 杨扬, 等. 液相色谱-三重串联四极杆质谱测定粮油中的黄曲霉毒素[J]. 色谱, 2011, 29(6): 517-522. DOI:10.3724/ SP.J.1123.2011.00517.
[28] 胡贝贞. 粮谷中氨基甲酸酯类农药残留的高效液相色谱-串联质谱测定方法研究[D]. 杭州: 浙江大学, 2006: 15-54.
[29] WANG Y H, XU D M, CHEN C H, et al. Beware of pseudo matrix-matched standard calibration curve due to matrix effect on sulfonamide residue in honey[J]. Advanced Materials Research, 2013, 781/782/783/784: 120-126. DOI:10.4028/www.scienti c.net/AMR.781-784.120.
[30] de BOEVRE M, di MAVUNGU J D, MAENE P, et al. Development and validation of an LC-MS/MS method for the simultaneous determination of deoxynivalenol, zearalenone, T-2-toxin and some masked metabolites in different cereals and cereal-derived food[J]. Food Additives and Contaminants. Part A: Chemistry, Analysis, Control, Exposure and Risk Assessment, 2012, 29(5): 819-835. DOI:10.1080/19440049.2012.656707.
[31] Commission Regulation(EC) No. 401/2006 of 23 February 2006. Laying down the methods of sampling and analysis for the official control of the levels of mycotoxins in foodstuffs[S].
[32] Commission Regulation (EC) No. 1881/2006 of 19 December 2006. Setting maximum levels for certain contaminants in foodstuffs[S].
Development of High Performance Liquid Chromatography-Tandem Mass Spectrometry for Detection of Multi-Mycotoxins in Peanut Oil and Corn Oil
LIU Dan1,2, HAN Xiaomin3, LI Fengqin3, WANG Chang4, LUO Xiaolin4, LU Daxin1,2,*
(1. College of Food Science and Engineering, Beijing University of Agriculture, Beijing 102206, China; 2. Beijing Key Laboratory of Agricultural Product Detection and Control for Spoilage Organisms and Pesticides, Beijing 102206, China; 3. Key Laboratory of Food Safety Risk Assessment, Ministry of Health, China National Centre for Food Safety Risk Assessment, Beijing 100021, China; 4. School of Public Health, Sun Yat-Sen University, Guangzhou 510080, China)
DOI:10.7506/spkx1002-6630-201710048
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)10-0297-08
引文格式:
刘丹, 韩小敏, 李凤琴, 等. 花生油和玉米油中多组分真菌毒素高效液相色谱-串联质谱检测方法的建立[J]. 食品科学, 2017, 38(10): 297-304. DOI:10.7506/spkx1002-6630-201710048. http://www.spkx.net.cn
LIU Dan, HAN Xiaomin, LI Fengqin, et al. Development of high performance liquid chromatography-tandem mass spectrometry for detection of multi-mycotoxins in peanut oil and corn oil[J]. Food Science, 2017, 38(10): 297-304. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710048. http://www.spkx.net.cn
收稿日期:2016-08-03
基金项目:国家自然科学基金青年科学基金项目(31301489);北京市自然科学基金项目(7163235)
作者简介:刘丹(1991—),女,硕士研究生,研究方向为食品中有害物质残留检测。E-mail:liudaidainame@foxmail.com*
通信作者:卢大新(1961—),男,教授,博士,研究方向为农产品加工工程。E-mail:dx.lu@126.com



 条件下9 种真菌毒素在不同流动相中的总离子流图
条件下9 种真菌毒素在不同流动相中的总离子流图





