
图 1 羊抗鼠磁珠偶联物用量对化学发光值的影响
Fig. 1 Effect of different amounts of conjugate on chemiluminescence value
王 玲1,管 笛2,周 欣1,高书涛1,臧晓欢1,魏 颖2
(1.河北农业大学理学院,河北 保定 071001;2.北京市理化分析测试中心,北京 100089)
摘 要:建立以磁性微球为固定相的化学发光酶免疫法,定量检测猪肉中的氯霉素含量。此方法为在微孔中加入羊抗鼠磁性微球、样品和抗体,反应一定时间,之后补加酶标抗原,继续反应一定时间后清洗磁珠,加入发光液反应10 min后分析测定。通过磁珠用量、酶标抗原量、抗体量和反应模式的优化,成功建立了一种高灵 敏度、高准确度的检测猪肉中氯霉素的磁性化学发光酶免疫方法。该方法的检出限为0.013 μg/kg,线性范围在0.060~2.421 μg/kg之间,回收率在85.24%~93.57%之间,相对标准偏差小于11.5%。
关键词:化学发光酶免疫法;氯霉素;磁性微球;猪肉
氯霉素是一类廉价高效的广谱抗生素,最初于20世纪中叶从南美委内瑞拉链丝菌中提取制得,现可用化学合成的方法大量生产[1-2]。氯霉素可作用于细菌核糖核蛋白体的50S亚基,它可以阻挠蛋白质的合成,对革兰氏阳性、革兰氏阴性细菌均有抑制作用[3]。由于氯霉素具有价格低廉、抗菌性优良、药性稳定的特点,一度广泛用于农牧业和细菌性治疗用药[4-5]。但随着研究的深入,发现氯霉素对人骨髓和新生儿有较大的毒性。人体长期摄入含有氯霉素药物残留的动物源性食品,可引发多种疾病。轻者破坏人体内菌群的平衡,产生耐药菌珠,危及健康[6-7],严重时可干扰骨髓细胞蛋白的合成,并抑制幼稚细胞DNA合成,导致粒细胞减少,引发再生障碍性贫血、溶血、紫癜等恶性疾病[8-9]。基于以上问题,世界许多国家对氯霉素的使用问题高度重视,欧美等发达国家均对氯霉素残留限量标准做出严格规定[10-11]。我国农业部在2001年规定在马肝和鸡肉等中氯霉素的残留限量为不得检出,在2002年进一步要求氯霉素及其盐、酯在所有食品动物的所有可食组织中不得检出[12]。
目前氯霉素的检测方法主要有仪器分析法和免疫学分析法。仪器分析法主要包括气相色谱-质谱法[13-15]、高效液相色谱法[16-18]、高效液相色谱-串联质谱法[19-21]、毛细管电泳法[22-23]。以上方法主要用于确证与仲裁检测,具有检测灵敏度高、准确性好的优点。但是也存在检测步骤复杂,依赖昂贵设备支撑和对人员操作要求高等缺点。免疫学分析法包括酶联免疫吸附法[24-27]、化学发光检测法[28-30]和免疫层析方法[31-35]等。
化学发光检测技术因其既具有免疫反应的特异性又具有化学发光反应的高灵敏性,而被广泛应用。自免疫检测技术问世及在其迅速发展过程中,固相载体的选择始终是研究热点之一。近年来,在新型固相载体中,磁性微球不仅可以作为反应的固定相又可作为分离载体,与传统的酶标板载体相比,具有更大的比表面积,可使免疫反应从二维到三维立体反应,从而提高抗体与抗原的反应效率,同时具有可自动化操作等优势。本实验将磁微粒替代酶标板作固定相,应用到化学发光技术中检测氯霉素以期获得灵敏高效的检测技术,同时也为实现自动化化学发光检测技术进行前期研究。
1.1 材料与试剂
氯霉素标准溶液、牛血清白蛋白(bovine serum albumin,BSA)、Tween-20、2-(N-吗啡啉)乙磺酸(2-(N-morpholino)ethanesulfonic acid monohydrate,MES)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride crystalline,EDC)、羊抗鼠抗体美国S i g m a-A l d r i c h公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 美国Pierce公司;氯霉素单克隆抗体 上海杰一生物技术有限公司;氯霉素-辣根过氧化物酶(horseradish peroxidase,HRP)偶联物 美国Beacon公司;300 nm羧基磁微粒 美国Quantum量子科学仪器公司;96 孔可拆卸化学发光用微孔板 美国Corning公司;化学发光底物液(主要成分为鲁米诺) 湖州英创生物科技有限公司;其他化学试剂均为分析纯;实验用水均为超纯水。
1.2 仪器与设备
Varioskan Flash多功能酶标仪 美国Thermo公司;THZ-C恒温振荡器 太仓市实验设备厂;DHG-9070A电热恒温水浴箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 羊抗鼠磁珠偶联物的制备
以p H 4.7、0.1 m o l/L的M E S溶液(称取1.066 g MES,0.45 g NaCl溶于50 mL纯水,调pH 4.7)作为活化缓冲溶液,取100 μL磁微粒溶液于2 mL离心管中,利用磁铁吸附,待完全吸附后,弃去液体,加入500 μL活化缓冲溶液,旋涡振荡器上混匀;磁铁吸附,待完全吸附后,弃去液体,重复洗涤两遍后,向磁微粒中加入0.96 mg EDC、1.15 mg NHS和200 μL活化缓冲溶液,37 ℃,120 r/min,摇床振荡30 min;用活化缓冲溶液洗涤两遍,除去未反应的活化剂,并更换新的2 mL离心管。将pH 8.5,浓度为50 mmol/L的硼酸缓冲液作为偶联缓冲液。用500 μL的偶联缓冲液洗涤磁珠两遍,加入50 μg羊抗鼠抗体至偶联缓冲液终体积为400 μL,37 ℃,120 r/min,摇床振荡3 h。
封闭加入100 μL的BSA溶液(BSA事先溶解在偶联缓冲液中)至BSA终质量浓度为5 mg/mL,对免疫磁微粒表面没有偶联抗体的活化基团进行封闭,并且通过BSA的物理吸附,封闭其他空间位点,降低在之后实验中可能发生的非特异性吸附。37 ℃、120 r/min,摇床振荡30 min。利用磁铁吸附,弃去溶液;用含0.5% BSA的磷酸缓冲溶液(phosphate buffer saline,PBS)洗涤两次,加入330 μL 0.5% BSA的PBS,4 ℃保存待用。
1.3.2 基于磁微粒的氯霉素直接竞争化学发光法
基于氯霉素单克隆抗体的化学发光法在测定前需要对化学发光微孔板进行封闭处理,防止非特异性吸附。向96 孔板每孔中加入300 μL 1.5% BSA溶液,37 ℃孵育2 h,PBST溶液洗板3 次后,拍干板子,4 ℃保存备用。基于磁微粒的化学发光法采用两种反应模式。
反应模式1:每孔加入100 μL样品/标准品溶液,50 μL氯霉素-HRP偶联物,50 μL氯霉素单克隆抗体溶液,1 μL羊抗鼠抗体-300 nm磁微粒偶联物,37 ℃反应20 min。然后用PBST清洗磁微粒3次,清洗方法同文献[21]。每孔加入100 μL化学发光底物,37 ℃反应10 min后进行发光测量。
反应模式2:每孔加入100 μL样品/标准品溶液,50 μL氯霉素单克隆抗体溶液,1 μL羊抗鼠抗体-300 nm磁微粒偶联物,37 ℃反应10 min后,再加入50 μL氯霉素-HRP偶联物,37 ℃反应10 min。然后用PBST清洗磁微粒3 次。每孔加入100 μL化学发光底物,37 ℃反应10 min后进行化学发光值测量。
1.3.3 标准曲线建立
取氯霉素标准品溶液进行梯度稀释,利用以上方法分别建立标准曲线。化学发光值通过多功能酶标仪测定,并作图。横坐标为氯霉素质量浓度,纵坐标用抑制率表示(抑制率/%=B/B0×100,式中,B为含有氯霉素时的发光值,B0为质量浓度为0 μg/L时的发光值)。测定结果用非线性四参数逻辑斯蒂拟合。方法的检出限定义为90%抑制率时所对应氯霉素质量浓度。检测的线性范围定义为抑制率在80%~20%之间所对应的氯霉素质量浓度。
1.3.4 猪肉样品中氯霉素提取与回收率的测定
用均质器均质猪肉样本,称取3.0 g均质物至50 mL离心管中,添加氯霉素标准品至添加量为0.1、0.5 μg/kg和1 μg/kg,加入6 mL乙酸乙酯,用振荡器振荡10 min,3 000×g以上、室温(20~25 ℃)离心10 min;移取4 mL上层有机相(约相当于2 g的样本)至10 mL干净的玻璃试管中,于50~60 ℃水浴氮气流下吹干;加入1 mL正己烷,用涡旋仪涡动30 s,再加1 mL PBS复溶,用涡旋仪涡动1 min后,3 000×g以上、室温(20~25 ℃)离心15 min;除去上层有机相,取下层100 μL用于分析。
2.1 羊抗鼠磁珠偶联物用量的优化
羊抗鼠磁珠偶联物用量对检测结果的稳定性和准确性有较大的影响。用量少,有利于降低成本,可是在洗涤过程中会损失部分的偶联物,存在实验系统误差大以及稳定性差的缺陷;偶联物用量过多,不仅会增加使用成本,而且由于磁珠的吸光效应,造成灵敏度及重复性差。因此合适的羊抗鼠磁珠偶联物用量对于磁性化学发光酶免疫法来说非常重要。本研究选取添加0.2、0.5、1.0、1.5、2.5 μL羊抗鼠磁珠偶联物进行比较研究。加入50 μL稀释度为1∶3 000的抗体,50 μL氯霉素-HRP,100 μL空白样品和磁珠后,37 ℃反应20 min。然后用PBST清洗磁微粒3 次。每孔加入100 μL化学发光底物,37 ℃反应10 min后进行发光测量。由图1可知,当磁珠偶联物用量为0.5 μL时化学发光值最高,随后1.0 μL以上的偶联物的化学发光值有所降低,但相对平稳。虽然磁珠偶联物用量0.5 μL时的偶联物化学发光值最高,但是此时的标准偏差较大,结果稳定性相对较差,因此选取1.0 μL为最佳磁珠偶联物用量。

图 1 羊抗鼠磁珠偶联物用量对化学发光值的影响
Fig. 1 Effect of different amounts of conjugate on chemiluminescence value
2.2 抗体与酶标物用量的优化
抗体用量对检测方法的灵敏度有较大的影响。抗体用量过多,会影响待测物的竞争效果,降低检测灵敏度;抗体用量过少,会使化学发光值过低,影响检测结果的稳定性。酶标抗原(即氯霉素-HRP)作为免疫反应中的竞争物,其用量多少对检测灵敏度也影响较大。与抗体类似,酶标抗原用量过多,而检测较低含量的待测物时,会造成竞争效果不明显,从而降低检测灵敏度;而酶标抗原用量过少的,也会使化学发光值过低,检测结果稳定性也较差。因此本研究分别对抗体和酶标抗原的用量进行了优化。
反应模式1与反应模式2的氯霉素-HRP量的优化,分别添加50 μL稀释度为1∶5、2∶5、3∶5的氯霉素-HRP;抗体添加50 μL,稀释度均为1∶10 000。结果见表1,在反应模式1中,当氯霉素-HRP的稀释度为2∶5时,氯霉素添加量为0.5 μg/kg时具有最低抑制率,为47.3%。表明此时竞争反应效果最好,具有更高的检测灵敏度,选用此稀释度为最佳。在反应模式2中,氯霉素-HRP的稀释度为1∶5时,竞争效果最好,灵敏度最高,选用此稀释度为最佳。
表 1 氯霉素-HRP用量的优化
Table 1 Optimization of the amount of chloramphenicol-HRP

反应模式1抗体量的优化,为分别添加50 μL稀释度为1∶20 000、1∶10 000、1∶5 000的抗体;氯霉素-HRP添加50 μL,稀释度均为1∶5。反应模式2抗体量的优化,为分别添加50 μL稀释度为1∶40 000、1∶20 000、1∶10 000的抗体;氯霉素-HRP添加50 μL,稀释度均为1∶5。由表2可知,在反应模式1中,当氯霉素抗体的稀释度为1∶10 000时,氯霉素添加量为0.5 μg/kg时具有最低抑制率,为47.3%。表明此时竞争反应效果最好,具有更好的检测灵敏度,选用此稀释度为最佳。在反应模式2中,氯霉素抗体的稀释度为1∶40 000时,竞争效果最好,抑制率为30.5%,灵敏度最高,因此选用此稀释度为最佳。2.3 反应模式1与反应模式2化学发光的比较
表 2 氯霉素抗体用量的优化Table 2 Optimization of the amount of anti-chloramphenicol antibody

将300 nm磁微粒作为承载体,取代酶标板引入化学发光检测中,建立标准曲线。反应模式1的反应条件为:依次加入羊抗鼠300 nm磁珠,用量为1 μL;氯霉素单克隆抗体稀释度为1∶10 000,用量为50 μL;酶标抗原氯霉素-HRP稀释度为2∶5,用量为50 μL;标准品体积为100 μL;反应时间为20 min;PBST洗磁珠3 次后,加入发光底物液,10 min后测量。反应模式2的反应条件为:先加入羊抗鼠300 nm磁珠,用量为1 μL;氯霉素单克隆抗体稀释度为1∶40 000,用量为50 μL;标准品体积为100 μL后,37 ℃反应10 min;再加入稀释度为2∶5的氯霉素-HRP,用量为50 μL;反应时间为10 min;PBST洗磁珠3 次后,加入发光底物液,10 min后测量。两种反应模式作标准曲线,并对结果进行比较,见图2。
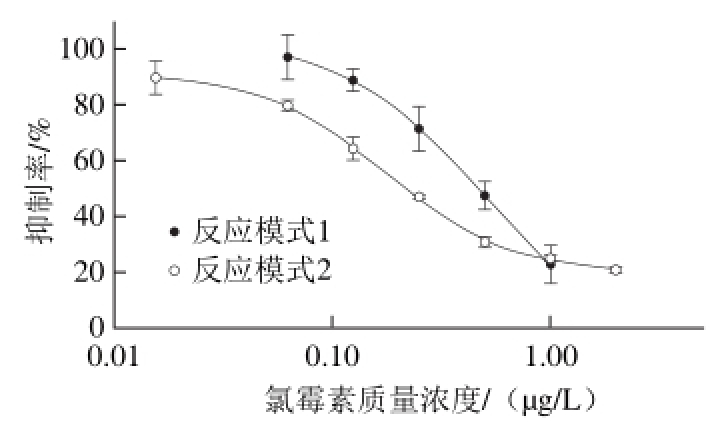
图 2 两种方式的氯霉素标准曲线
Fig. 2 Standard curves for chloramphenicol
由图2可知,采用反应模式2的磁性化学发光酶免疫法的标准曲线相比反应模式1的标准曲线更靠近Y轴,拥有更高的检测灵敏度。反应模式2的检出限为0.013 μg/kg,方程为:

线性范围在0.060~2.421 μg/L之间,标准曲线的R2为0.999 4;反应模式1的检出限为0.114 μg/kg,方程为:
线性范围在0.186~1.107 μg/L之间,标准曲线的R2为0.999 3。反应模式2较反应模式1降低检出限近8.5 倍。反应模式2与反应模式1的不同之处在于先让抗体与样品液中的标准品充分反应后,再加入氯霉素-HRP进行反应;而不是同时加入氯霉素和氯霉素-HRP进行竞争反应,因此能够显著提高检测灵敏度。
2.4 猪肉样品中氯霉素添加回收率的测定
向空白猪肉样品中添加一定量的氯霉素标准品,添加量分别为0.1、0.5、1.0 μg/kg。经过提取回收,利用上述建立的磁性直接竞争化学发光法进行检测。结果见表3,实验回收率范围在85.24%~93.57%之间,相对标准偏差小于11.5%。由此可见,本实验建立的磁性化学发光酶免疫法具有良好的回收率,并证明磁珠作为承载体能够应用于猪肉样品中氯霉素的化学发光检测。
表 3 猪肉样品中氯霉素添加回收率测定
Table 3 Recoveries of chloramphenicol residues in spiked pork

本实验建立了磁性化学发光酶免疫法检测猪肉样品中的氯霉素,该研究使用磁珠替代酶标板作为固定相,降低了空间位阻,使免疫反应进行的更加充分。通过磁珠用量、氯霉素-HRP量、抗体量和反应模式的优化,最终建立方法的检出限为0.013 μg/kg,线性范围为0.060~2.421 μg/L。猪肉样品添加回收实验表明,方法的回收率为85.24%~93.57%,相对标准偏差小于11.5%。综上,磁性化学发光酶免疫法应用于猪肉中氯霉素含量的检测,具备灵敏度高、准确度高、检测速度快等特点,可为自动化学发光检测技术研究提供科学的参考依据。
参考文献:
[1] 郝俊虎, 王仙琴, 闫永利, 等. 氯霉素残留对出口畜产品的危害[J].饲料研究, 2005(5): 8-10. DOI:10.3969/j.issn.1002-2813.2005.05.003.
[2] 马玲, 关忠谊, 吴健敏, 等. 氯霉素残留一步式化学发光酶免疫法的建立[J]. 南方农业学报, 2011, 42(2): 205-208. DOI:10.3969/ j.issn.2095-1191.2011.02.024.
[3] 陈杖榴. 兽医药理学[M]. 北京: 中国农业出版社, 2010: 252-253.
[4] 陈鹏, 罗晓琴. 氯霉素残留状况及检测方法[J]. 动物保健, 2006(10): 41-42. DOI:10.3969/j.issn.1673-8586.2006.10.017.
[5] TAN Z J, XU H, LI G, et al. Fluorescence quenching for chloramphenicol detection in milk based on protein-stabilized Au nanoclusters[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 149: 615-620.
[6] 王自良, 赵坤, 张改平. 氯霉素的毒性及其在动物性食品中的残留与检测[J]. 河南科技学院学报, 2005, 33(2): 101-105.
[7] 吴宇伉, 梅勇, 张鑫, 等. 高效液相色谱-质谱/质谱联用法快速检测牛奶中的氯霉素[J]. 中国卫生检验杂志, 2015, 25(1): 29-31.
[8] 吴晓丰, 杨鹭花. 氯霉素残留的危害及其检测方法[J]. 动物医学进展, 2004, 25(3): 41-43. DOI:10.3969/j.issn.1007-5038.2004.03.014.
[9] 曹巧玲, 杨凯, 武泽新. 氯霉素的毒性作用和检测方法研究进展[J].职业与健康, 2013, 29(16): 2095-2097.
[10] SHAKILA R J, SARAVANAKUMAR R, SAP V, et al. An improved microbial assay for the detection of chloramphenicol residues in shrimp tissues[J]. Innovative Food Science & Emerging Technologies, 2007, 8(4): 515-518. DOI:10.1016/j.ifset.2007.03.002.
[11] Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin[S]. Official Journal of the European Union, 2010: L15.
[12] 农业部. 动物性食品中兽药最高残留限量: 中华人民共和国农业部公告第235号文件[S]. 2002. 北京: 中国标准出版社.
[13] 宋宏娟. 气相色谱-串联质谱法检测水产品中氯霉素残留量[J]. 食品安全质量检测学报, 2015(6): 2373-2378.
[14] 胡红美, 郭远明, 雷科, 等. 分散固相萃取净化-气相色谱法测定水产品中氯霉素和氟苯尼考[J]. 食品科学, 2014, 35(8): 231-235. DOI:10.7506/spkx1002-6630-201408046.
[15] 高洁. 气相色谱-串联质谱法同时测定肉制品中氯霉素、甲砜霉素残留[J]. 中国酿造, 2014, 33(8): 153-155. DOI:10.11882/ j.issn.0254-5071.2014.08.035.
[16] MAMANI M C V, REYES F G R, RATH S. Multiresidue determination of tetracyclines, sulphonamides and chloramphenicol in bovine milk using HPLC-DAD[J]. Food Chemistry, 2009, 117(3): 545-552. DOI:10.1016/j.foodchem.2009.04.032.
[17] ALI I, ABOULENEIN H Y, GUPTA V K, et al. Analyses of chloramphenicol in biological samples by HPLC[J]. Analytical Letters, 2009, 42(10): 1368-1381. DOI:10.1080/00032710902954482.
[18] AMELIN V G, VOLKOVA N M, REPIN N A. Simultaneous determination of residual amounts of amphenicols in food by HPLC with UV-detection[J]. Journal of Analytical Chemistry, 2015, 70(10): 1114-1120. DOI:10.1134/S1061934815100020.
[19] LU Y B, ZHENG T L, HE X, et al. Rapid determination of chloramphenicol in soft-shelled turtle tissues using on-line MSPDHPLC-MS/MS[J]. Food Chemistry, 2012, 134(1): 533-539. DOI:10.1016/j.foodchem.2012.02.115.
[20] WU J B, CHEN L Y, MAO P P, et al. Determination of chloramphenicol in aquatic products by grapheme-based SPE coupled with HPLC-MS/MS[J]. Journal of Separation Science, 2012, 35(24): 3586-3592. DOI:10.1002/jssc.201200617.
[21] 杨黎, 廖夏云, 杨玮婷, 等. 高效液相色谱-串联质谱测定以蜂胶为主要原料的保健食品中氯霉素[J]. 食品科学, 2016, 37(16): 263-267. DOI:10.7506/spkx1002-6630-201616043.
[22] 郭丹, 陈娜娜, 晏媛, 等. 高效毛细管电泳法测定肤炎康霜中氯霉素的含量[J]. 广东药学院学报, 2003, 19(3): 232-233. DOI:10.3969/ j.issn.1006-8783.2003.03.015.
[23] PAJCHEL G, MICHALSKA K, GERMAN R, et al. Assay of the related compounds thiamphenicol, florphenicol, and chloramphenicol by CE[J]. Chromatographia, 2008, 68(7): 587-591. DOI:10.1365/ s10337-008-0771-7.
[24] WANG L, ZHANG Y, GAO X, et al. Determination of chloramphenicol residues in milk by enzyme-linked immunosorbent assay: improvement by biotin-streptavidin-amplified system[J]. Journal of Agricultural & Food Chemistry, 2010, 58(6): 3265-3270. DOI:10.1021/jf903940h.
[25] POSYNIAK A, ZMUDZKI J, NIEDZIELSKA J. Evaluation of sample preparation for control of chloramphenicol residues in porcine tissues by enzyme-linked immunosorbent assay and liquid chromatography[J]. Analytica Chimica Acta, 2003, 483(1): 307-311. DOI:10.1016/S0003-2670(02)01487-3.
[26] 陈霞, 杨晓霞, 骆朋辉, 等. 高灵敏度酶联免疫法快速检测动物源性产品中氯霉素残留的研究[J]. 中国畜牧兽医, 2013, 40(6): 233-236. DOI:10.3969/j.issn.1671-7236.2013.06.054.
[27] 管笛, 潘灿平, 王文, 等. 磁微粒酶联免疫吸附法测定玉米中的伏马毒素B1[J]. 食品科学, 2014, 35(8): 208-211. DOI:10.7506/spkx1002-6630-201408041.
[28] 何方洋, 冯月君, 吴鹏, 等. 氯霉素化学发光酶联免疫检测方法的建立[J]. 中国兽药杂志, 2012, 46(3): 25-29. DOI:10.3969/ j.issn.1002-1280.2012.03.009.
[29] XU C L, PENG C F, HAO K, et al. Chemiluminescence enzyme immunoassay (CLEIA) for the determination of chloramphenicol residues in aquatic tissues[J]. Luminescence the Journal of Biological & Chemical Luminescence, 2006, 21(2): 126-128. DOI:10.1002/bio.892. [30] TAO X Q, JIANG H Y, ZHU J H, et al. An ultrasensitive chemiluminescent ELISA for determination of chloramphenicol in milk, milk powder, honey, eggs and chicken muscle[J]. Food & Agricultural Immunology, 2013, 25(1): 137-148. DOI:10.1080/095401 05.2012.753513.
[31] BAI Z H, LUO Y B, XU W T, et al. Development of a new fluorescence immunochromatography strip for detection of chloramphenicol residues in chicken muscles[J]. Journal of the Science of Food & Agriculture, 2013, 93(15): 3743-3747.
[32] XU N F, XU L G, MA W, et al. An ultrasensitive immunochromatographic assay for non-pretreatment monitoring of chloramphenicol in raw milk[J]. Food & Agricultural Immunology, 2015, 26(5): 1-10. DOI:10.1080/09540105.2014.998640.
[33] BYZOVA N A, ZVEREVA E A, ZHERDEV A V, et al. Rapid pretreatment-free immunochromatographic assay of chloramphenicol in milk[J]. Talanta, 2010, 81(3): 843-848. DOI:10.1016/ j.talanta.2010.01.025.
[34] ZHOU C N, ZHANG X Y, HUANG X X, et al. Rapid detection of chloramphenicol residues in aquatic products using colloidal gold immunochromatographic assay[J]. Sensors, 2014, 14(11): 21872-21888. DOI:10.3390/s141121872.
[35] HSIEH K H, LIN C P, CHENG C C, et al. Screening procedures for chloramphenicol residue determination in serum, milk, and feedstuff using immunochromatographic assay[J]. Food Biotechnology, 2013, 27(4): 328-341. DOI:10.1080/08905436.2013.838784.
Development of Magnetic Bead-Based Chemiluminescent Enzyme Immunoassay for Chloramphenicol Detection in Swine Muscle
WANG Ling1, GUAN Di2, ZHOU Xin1, GAO Shutao1, ZANG Xiaohuan1, WEI Ying2
(1. College of Science, Hebei Agricultural University, Baoding 071001, China; 2. Beijing Center for Physical and Chemical Analysis, Beijing 100089, China)
Abstract:A chemiluminescent enzyme immunoassay based on magnetic beads was developed for quantitative determination of chloramphenicol (CAP) residues in pork samples. Sample, anti-chloramphenicol antibody, and magnetic beads coated with goat anti-mouse antibody were mixed on the microwell plate. After reacting for a certain period of time, CAP-horseradish peroxidase (HRP) was added and incubated. Then chemiluminescence substrate solution was added after washing the magnetic beads three times. Ten minutes later, the results were recorded by a microplate reader. Besides, the amount of magnetic beads coated with goat anti-mouse antibody, CAP-HRP, antibody concentration and reaction pattern were optimized. A sensitive and accurate magnetic bead-based chemiluminescent enzyme immunoassay for CAP was successfully developed. The limit of detection was 0.013 μg/kg, and good linear relationship was observed in the concentration range between 0.060 and 2.421 μg/kg. The recoveries of spiked pork samples varied from 85.24% to 93.57%, with relative standard deviation of less than 11.5%.
Key words:chemiluminescent enzyme immunoassay; chloramphenicol; magnetic beads; swine muscle
DOI:10.7506/spkx1002-6630-201710049
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)10-0305-05
引文格式:
王玲, 管笛, 周欣, 等. 磁性化学发光酶免疫法检测猪肉中的氯霉素[J]. 食品科学, 2017, 38(10): 305-309. DOI:10.7506/ spkx1002-6630-201710049. http://www.spkx.net.cn
WANG Ling, GUAN Di, ZHOU Xin, et al. Development of magnetic bead-based chemiluminescent enzyme immunoassay for chloramphenicol detection in swine muscle[J]. Food Science, 2017, 38(10): 305-309. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710049. http://www.spkx.net.cn
收稿日期:2016-10-21
基金项目:河北省科技厅科技支撑重点项目(肉类及豆制品中有害物质的残留检测)(14227115D)
作者简介:王玲(1963—),女,教授,本科,研究方向为分析化学。E-mail:wanglinghbnd@163.com